UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE …Figura 16. Clasificación de las Formas...
Transcript of UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE …Figura 16. Clasificación de las Formas...

UNIVERSIDAD CENTRAL DEL ECUADOR
FACULTAD DE CIENCIAS QUÍMICAS
CARRERA DE QUÍMICA FARMACÉUTICA
DISEÑO Y FORMULACIÓN DE UNA CREMA CON FILTROS DE PROTECCIÓN
SOLAR PARA SER UTILIZADA EN PERSONAS CON PSORIASIS
Autora: Soraya Nataly Altamirano Salazar
Tesis para optar por el Título Profesional de
QUÍMICA FARMACÉUTICA
Tutora: Dra. Liliana Naranjo
Quito, Diciembre, 2015

ii
Altamirano Salazar Soraya Nataly (2015). Diseño
y Formulación de una Crema con filtros
de Protección Solar para ser utilizada en
Personas con Psoriasis. Trabajo de tesis
para optar por el grado de Química
Farmacéutica. Carrera de Química
Farmacéutica. Quito: UCE. 114 p.

iii
DEDICATORIA
Dedico esta tesis a Dios por la oportunidad de la vida, a la vida por poner en mi camino a mis padres y hermanos
a mis padres y hermanos por todo el apoyo y amor brindados.
Se lo dedico también a mi esposo y mi hijo quienes han llenado mi vida de alegrías y nuevas experiencias.
Por último se lo dedico a todas aquellas personas que me dieron parte de su vida y me llenaron de buenos recuerdos.
“He tenido muchas cosas en mis manos y las he perdido todas; pero todas lo que he puesto en manos de Dios, aún las poseo”.
Martin Lutero

iv
AGRADECIMIENTO
A la Universidad Central del Ecuador y de manera especial a la Facultad de Ciencias Químicas por los conocimientos
brindados para mi profesionalización.
A la Dra. Liliana Naranjo por su valiosa colaboración y asesoramiento.
Finalmente, a todas aquellas personas que de una u otra forman han intervenido en la realización de este
trabajo de tesis.

v
AUTORIZACIÓN DE LA AUTORÍA INTELECTUAL
UNIVERSIDAD CENTRAL DEL ECUADOR
FACULTAD DE CIENCIAS QUÍMICAS
CARRERA DE QUÍMICA
Yo Soraya Nataly Altamirano Salazar en calidad de autor del trabajo de investigación o tesis
realizada sobre “DISEÑO Y FORMULACIÓN DE UNA CREMA CON FILTROS DE
PROTECCIÓN SOLAR PARA SER UTILIZADA EN PERSONAS CON PSORIASIS”, por la
presente autorizo a la UNIVERSIDAD CENTRAL DEL ECUADOR, hacer uso de todos los
contenidos que me pertenecen o de parte de los que contiene esta obra, con fines estrictamente
académicos o de investigación.
Los derechos que como autor me corresponden, con excepción de la presente autorización,
seguirán vigentes a mi favor, de conformidad con lo establecido en los artículos 5, 6, 8, 19 y demás
pertinentes de la Ley de Propiedad Intelectual y su Reglamento.
Quito, a los 1 días del mes de Diciembre de 2015
________________________
Soraya Altamirano
C.C. 1715236558

vi
CONSTANCIA DE APROBACIÓN DEL TUTOR
UNIVERSIDAD CENTRAL DEL ECUADOR
FACULTAD DE CIENCIAS QUÍMICAS
CARRERA DE QUÍMICA FARMACÉUTICA
Por la presente, dejo constancia que he leído la Tesis presentada por la Señora Soraya Nataly
Altamirano Salazar para optar por el título profesional de Química Farmacéutica cuyo tema es
DISEÑO Y FORMULACIÓN DE UNA CREMA CON FILTROS DE PROTECCIÓN SOLAR PARA
SER UTILIZADA EN PERSONAS CON PSORIASIS, la misma que reúne los requerimientos, y los
méritos suficientes para ser sometida a evaluación por el Tribunal Calificador.
En la ciudad de Quito, a los 1 días del mes de Diciembre de 2015.

vii
UNIVERSIDAD CENTRAL DEL ECUADOR
FACULTAD DE CIENCIAS QUÍMICAS
INFORME DEL TRIBUNAL CALIFICADOR
Quito, Diciembre de 2015
Señora
Dra. Isabel Fierro
DECANA DE LA FACULTAD DE CIENCIAS QUÍMICAS
UNIVERSIDAD CENTRAL DE L ECUADOR
Presente,
Señora Decana:
El Tribunal encargado de calificar la Tesis: DISEÑO Y FORMULACIÓN DE UNA CREMA
CON FILTROS DE PROTECCIÓN SOLAR PARA SER UTILIZADA EN PERSONAS
CON PSORIASIS, presentado por: Soraya Nataly Altamirano Salazar, estudiante de la Carreara
de Química Farmacéutica, luego del estudio y revisión correspondiente, resolvió:
APROBAR la Tesis con la NOTA de: __ / __
REPROBAR la Tesis.
Es cuanto podemos informar.
Atentamente,
FIRMA PROFESOR FIRMA PROFESOR FIRMA PROFESOR
Dra. Liliana Naranjo
CI. 0601545213
Wilmer Narváez
CI. 110232505-5
Jorge Moncayo
CI. 170433031-3

viii
CONTENIDO
pág.
1. INTRODUCCIÓN ....................................................................................................................... 1
Planteamiento del Problema .......................................................................................................... 1
Formulación del Problema ............................................................................................................ 1
Hipótesis ....................................................................................................................................... 1
Objetivo General ........................................................................................................................... 1
Objetivos Específicos .................................................................................................................... 2
Importancia y Justificación de la Investigación ............................................................................. 2
ANTECEDENTES ............................................................................................................................ 3
2. FUNDAMENTO TEÓRICO ........................................................................................................ 4
2.1 LA PIEL: GENERALIDADES ............................................................................................ 4
2.1.1 Estructura de la piel. La piel humana se subdivide en tres capas mutuamente
dependientes (Ver Figura 2) .......................................................................................... 5
2.1.2. Composición química de la Piel. ................................................................................... 7 2.1.3. Funciones de la piel ...................................................................................................... 7 2.1.4. Tipos de Piel ................................................................................................................. 8
2.2. PATOLOGÍAS DE LA PIEL: PSORIASIS ....................................................................... 15
2.2.1 Etiología...................................................................................................................... 16 2.2.2 Epidemiología ............................................................................................................. 16 2.2.3 Tipos de Psoriasis ....................................................................................................... 16 2.2.4 Causas de la Psoriasis ................................................................................................. 21
2.2.5 Tratamiento para la Psoriasis ...................................................................................... 22 2.2.6 Efectos de la Radiación UV: Psoriasis Fotoinducida .................................................. 24
2.3 FOTOPROTECCIÓN ......................................................................................................... 24
2.3.1 Radiaciones solares ..................................................................................................... 25 2.3.2 Tipos de Fotoprotector ................................................................................................ 26
2.3.3 Mecanismo de acción de protectores solares ............................................................... 29 2.3.4 Factor de Protección Solar .......................................................................................... 29 2.3.5 Parámetros de evaluación en fotoprotección. .............................................................. 30 2.3.6 Criterios para utilizar un filtro solar ............................................................................ 31
2.4 FORMAS FARMACÉUTICAS DE APLICACIÓN TÓPICA ........................................... 31
2.4.1 Formas Farmacéuticas Semisólidas............................................................................. 31 2.4.2 Formas Farmacéuticas Semisólidas de Aplicación Tópica .......................................... 32
2.5 PRE-FORMULACIÓN ...................................................................................................... 35
2.5.1 Urea ............................................................................................................................ 35 2.5.2 Filtros Solares Físicos ................................................................................................. 36 2.5.3 Filtros Solares Químicos ............................................................................................. 36 2.5.4 Emolientes .................................................................................................................. 38
2.5.5 Emulsificantes ............................................................................................................. 39 2.5.6 Estabilizador de emulsión ........................................................................................... 39

ix
2.5.7 Acondicionador/Humectantes ..................................................................................... 40
2.5.8 Extractos Naturales ..................................................................................................... 41 2.5.9 Antioxidantes .............................................................................................................. 41 2.5.10 Agentes Quelantes ...................................................................................................... 42 2.5.11 Conservantes ............................................................................................................... 43
2.5.12 Regulador de pH ......................................................................................................... 43
2.6 CONTROL DE CALIDAD DEL PRODUCTO TERMINADO ......................................... 43
2.6.1 Controles organolépticos ............................................................................................. 43 2.6.2 Control Físico ............................................................................................................. 44
2.6.3 Control Microbiológico............................................................................................... 45 2.6.4 Estabilidad de medicamentos ...................................................................................... 45
2.7 FUNDAMENTO LEGAL .................................................................................................. 46
2.7.1 CONSTITUCIÓN DE LA REPÚBLICA DEL ECUADOR ............................................... 46
2.7.2 LEY ORGÁNICA DE SALUD 2006 ................................................................................. 46
2.7.3 POLÍTICA NACIONAL DE MEDICAMENTOS 2007 .................................................... 47
2.7.4 BUENAS PRÁCTICAS DE MANUFACTURA 1994 ....................................................... 47
3. METODOLOGÍA ...................................................................................................................... 49
3.1. TIPO DE INVESTIGACIÓN ............................................................................................. 49
3.2. POBLACION Y MUESTRA ............................................................................................. 49
3.2.1. POBLACION ............................................................................................................. 49
3.2.2. MUESTRA ................................................................................................................. 49
3.3. DISEÑO EXPERIMENTAL .............................................................................................. 49
3.3.1. VARIABLES .............................................................................................................. 49
3.3.2. DISEÑO ESTADÍSTICO ........................................................................................... 50
3.3.3. Estructuración de fórmulas. ........................................................................................ 50
3.3.4. Evaluación de propiedades organolépticas y fisicoquímicas ....................................... 52 3.3.5. Evaluación de propiedades microbiológicas. .............................................................. 52 3.3.6. Evaluación de estabilidad acelerada. ........................................................................... 53
3.4. MATERIALES ................................................................................................................... 54
3.4.1. Materiales ................................................................................................................... 54
3.4.2. Equipos ....................................................................................................................... 55
3.4.3. Reactivos .................................................................................................................... 55
3.5. MÉTODOS E INSTRUMENTOS ANALÍTICOS ............................................................. 55
3.5.1. Método para evaluación de Color, Olor y Aspecto. .................................................... 55 3.5.2. Método para evaluación de pH.................................................................................... 55 3.5.3. Método para evaluación de Viscosidad. ...................................................................... 56 3.5.4. Método para evaluación de Peso Específico. .............................................................. 56
3.5.5. Método para evaluación de Extensibilidad. ................................................................. 57 3.5.6. Métodos para evaluación Microbiológica. .................................................................. 58 3.5.7. Método para evaluación de Estabilidad Acelerada. ..................................................... 60
3.6. PROCEDIMIENTO DE MANUFACTURA DE LA CREMA........................................... 60

x
4. ANÁLISIS E INTERPRETACIÓN DE RESULTADOS .......................................................... 63
4.1. RESULTADOS DE LAS PROPIEDADES ORGANOLÉPTICAS Y FISICOQUÍMICAS DE
LOS FORMULADOS ............................................................................................................. 63
4.1.1. Color, Olor y Aspecto ................................................................................................. 63
4.1.2 pH. .............................................................................................................................. 63
4.1.3 Viscosidad................................................................................................................... 64 4.1.4 Peso Específico. .......................................................................................................... 65 4.1.5 Extensibilidad. ............................................................................................................ 66
4.2 RESULTADOS DE LAS PROPIEDADES MICROBIOLÓGICAS DE LOS
FORMULADOS ......................................................................................................................... 68
4.2.1 Recuento de Bacterias. ................................................................................................ 68 4.2.2 Recuento de Hongos. .................................................................................................. 69 4.2.3 Presencia de Objetable 1: Staphyloccocus aureus. ...................................................... 69
4.2.4 Presencia de Objetable 2: Pseudomona aeruginosa. ................................................... 69
4.3 RESULTADOS DE LA ESTABILIDAD ACELERADA DE LOS FORMULADOS ....... 70
4.3.1 Estabilidad del Color, Olor y Aspecto. ........................................................................ 70 4.3.2 Estabilidad del pH. ...................................................................................................... 71
4.3.3 Estabilidad de la Viscosidad. ...................................................................................... 72 4.3.4 Estabilidad del Peso Específico................................................................................... 74 4.3.5 Estabilidad de la Extensibilidad. ................................................................................. 76 4.3.6 Estabilidad de las Propiedades Microbiológicas. ........................................................ 80
4.4 COMPENDIO DE RESULTADOS ................................................................................... 81
5. CONCLUSIONES ..................................................................................................................... 82
RECOMENDACIONES ................................................................................................................. 84
BIBLIOGRAFÍA ............................................................................................................................ 85
Referencias de Libros ...................................................................................................................... 85
Referencias de Revistas ................................................................................................................... 85
Referencias de Leyes y Reglamentos .............................................................................................. 85
Referencias de Sitios Web ............................................................................................................... 86

xi
LISTA DE TABLAS pág.
Tabla 1. Tipos de piel según la secreción .......................................................................................... 9 Tabla 2. Descripción de la piel grasa ............................................................................................... 10 Tabla 3. Pieles secas ocasionales o temporales ............................................................................... 12 Tabla 4. Principales Filtros Físicos.................................................................................................. 26 Tabla 5. Principales Filtros Biológicos ............................................................................................ 27 Tabla 6. Principales Filtros Organominerales .................................................................................. 27 Tabla 7. Principales Filtros Químicos ............................................................................................. 28 Tabla 8. Capacidad de Protección en base al FPS ........................................................................... 29 Tabla 9. Niveles de Radiación según el Fototipo de Piel ................................................................. 30 Tabla 10. Fórmulas Cuantitativas (F) a ser ensayadas ..................................................................... 51 Tabla 11. Diseño Experimental para la Evaluación de Propiedades Fisicoquímicas ....................... 52 Tabla 12. Diseño Experimental para la Evaluación de Propiedades Microbiológicas ..................... 53 Tabla 13. Especificaciones establecidas para cada parámetro a evaluar .......................................... 53 Tabla 14. Diseño Experimental para la Evaluación de Estabilidad Acelerada ................................. 54 Tabla 15. Características de identificación del Staphylococcus áureas............................................ 59 Tabla 16. Características de identificación del Pseudomona aeruginosa. ........................................ 59 Tabla 17. Color, Olor y Aspecto de los Formulados ....................................................................... 63 Tabla 18. pH de los Formulados...................................................................................................... 63 Tabla 19. Análisis estadístico (ANOVA+Tukey) para pH de los formulados ................................. 63 Tabla 20. Viscosidad de los Formulados ......................................................................................... 64 Tabla 21. Análisis estadístico (ANOVA+Tukey) para Viscosidad de los formulados ..................... 64 Tabla 22. Peso Específico de los Formulados ................................................................................. 65 Tabla 23. Análisis estadístico (ANOVA+Tukey) para Peso Específico de los formulados ............. 65 Tabla 24. Extensibilidad de los Formulados .................................................................................... 66 Tabla 25. Análisis estadístico (ANOVA+Tukey) para Extensibilidad de los formulados ............... 67 Tabla 26. Recuento de Bacterias de los Formulados ....................................................................... 68 Tabla 27. Recuento de Hongos de los Formulados .......................................................................... 69 Tabla 28. Recuento de Staphyloccocus aureus de los Formulados .................................................. 69 Tabla 29. Recuento de Pseudomona aeruginosa de los Formulados ................................................ 69 Tabla 30. Color, Olor y Aspecto de los Formulados versus Tiempo ............................................... 70 Tabla 31. pH promedio de los Formulados Versus Tiempo ............................................................ 71 Tabla 32. Análisis estadístico (ANOVA) para Estabilidad de pH de los Formulados ..................... 71 Tabla 33. Viscosidad promedio de los Formulados Versus Tiempo ................................................ 73 Tabla 34. Análisis estadístico (ANOVA) para Estabilidad de Viscosidad de los Formulados ......... 73 Tabla 35. Peso Específico promedio de los Formulados Versus Tiempo ........................................ 74 Tabla 36. Análisis estadístico (ANOVA) para Estabilidad de Peso Específico de los Formulados . 75 Tabla 37. Extensibilidad promedio de los Formulados Versus Tiempo........................................... 76 Tabla 38. Análisis estadístico (ANOVA) para Estabilidad de Extensibilidad de los Formulados ... 78 Tabla 39. Propiedades Microbiológicas de los Formulados versus Tiempo .................................... 80 Tabla 40. Resumen y Ponderación de Resultados ........................................................................... 81 Tabla 41. Propiedades Organolépticas, Fisicoquímicas y Microbiológicas de F2 ........................... 82

xii
LISTA DE FIGURAS
pág.
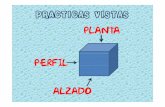
Figura 1. La Piel ................................................................................................................................ 4 Figura 2. Capas de la Piel .................................................................................................................. 5 Figura 3. Diagrama de Piel Grasa ...................................................................................................... 9 Figura 4. Diagrama de la piel seca .................................................................................................. 10 Figura 5. Diagrama de piel mixta o normal ..................................................................................... 13 Figura 6. Comparación entre la piel atópica y sana ......................................................................... 14 Figura 7. Diagrama de piel atópica .................................................................................................. 14 Figura 8. Psoriasis en Placas ........................................................................................................... 17 Figura 9. Psoriasis en Gotas ............................................................................................................ 18 Figura 10. Psoriasis Invertida .......................................................................................................... 18 Figura 11. Psoriasis Pustulosa ......................................................................................................... 19 Figura 12. Psoriasis Eritrodérmica .................................................................................................. 20 Figura 13. Psoriasis del Cuero Cabelludo ........................................................................................ 20 Figura 14. Psoriasis Ungueal ........................................................................................................... 21 Figura 15. Psoriasis Fotoinducida ................................................................................................... 24 Figura 16. Clasificación de las Formas Farmacéuticas Semisólidas ................................................ 32 Figura 17. Función Lineal Extensibilidad Vs Masa de los Formulados ........................................... 68 Figura 18. pH promedio de los Formulados Versus Temperatura/Humedad ................................... 72 Figura 19. Viscosidad promedio de los Formulados Versus Temperatura/Humedad ...................... 74 Figura 20. Peso Específico promedio de los Formulados Versus Tiempo ....................................... 76 Figura 21. Funciones lineales promedio de Extensibilidad de los Formulados a varios Tiempos y
Temperatura/Humedad .................................................................................................................... 79

xiii
LISTA DE ANEXOS
pág.
ANEXO 1. Registro de fotografías.................................................................................................. 87
ANEXO 2. Registro de mediciones …………………………………………………………….….89

xiv
RESUMEN DOCUMENTAL
Este trabajo de tesis tiene como objetivo diseñar y formular una crema de filtro solar con urea
como agente queratolítico para tratamiento de Psoriasis fotosensible. Se evalúan tres fórmulas con
diferente cantidad de urea (3%, 5%, 7%) y con materias primas hidratantes, emolientes, filtros
solares y otros excipientes. Se determinan las propiedades organolépticas (color, olor, aspecto),
fisicoquímicas (pH, viscosidad, peso específico, extensibilidad), microbiológicas (bacterias,
hongos, objetables), y de estabilidad (organoléptica, fisicoquímica, microbiológica) de las tres
fórmulas. Los resultados determinan a la fórmula F2 como la de mejores propiedades, apariencia
blanca homogénea de olor floral, pH de 5,17, viscosidad de 44361 cP, extensibilidad entre 80,7 a
136,73 mm2, con recuento de hongos y bacterias menor a 10
2 UFC/g, ausencia total Staphylococcus
aureus y Pseusomona aeruginosa, y muy buena estabilidad a la temperatura y tiempo de
almacenamiento.
PALABRAS CLAVES
PSORIASIS FOTOSENSIBLE, FILTRO SOLAR CON UREA, FORMULACIÓN DE CREMA
TERAPÉUTICA

xv
ABSTRACT
This research work has the goal designing and formulating a sunscreen cream, with urea as its
keratolytic agent, for treating photosensitive psoriasis. It assessed three formulas with different urea
concentrations (3%, 5% and 7%) and different hydrating, emollient and sun-protecting agents,
along with other excipients. Further, this work determined the three formulas’ organoleptic (color,
smell, appearance), physicochemical (pH, viscosity, specific weight, expandability),
microbiological (bacteria, fungi, objectionable microbes) and stability (organoleptic,
physicochemical, microbiological) properties. The results determined that formula F2 was the one
with the best overall properties: homogenous white color with a floral smell, 5.17 pH, 44361 cP
viscosity, expandability between 80.7 and 136.73 mm2, bacterial and fungal counts below 102
CFUs/g, with a total absence of Staphylococcus aureus and Pseusomona aeruginosa, and very good
stability against temperature and storage times.
KEYWORDS:
PHOTOSENSITIVE PSORIASIS, SUNSCREEN WITH UREA, THERAPEUTIC CREAM
FORMULATION.

CAPITULO I: INTRODUCCION
1
1. INTRODUCCIÓN
Planteamiento del Problema
La psoriasis es una dermatosis inflamatoria de etiología desconocida, habitualmente de curso
crónico que muestra una gran variabilidad clínica y evolutiva. Es una enfermedad frecuente en la
raza blanca, afecta a un 1,5%-3% de la población.
La psoriasis afecta en un alto porcentaje en las áreas expuestas al sol como la cara, cuello, manos y
antebrazos, esto se conoce como psoriasis fotosensible, este tipo de psoriasis requiere de protección
solar estricta combinada con otras formas de tratamiento de acuerdo a la gravedad de la
enfermedad.
La llamada psoriasis fotosensible es una enfermedad frecuente clínicamente bien reconocida.
Existen descritos diferentes mecanismos para explicar este fenómeno y se estima que entre el 5 y
20% de los pacientes con psoriasis empeoran luego de la exposición a radiación UV.
Formulación del Problema
En la actualidad no existe un tratamiento curativo específico para la Psoriasis fotosensible, los
productos que se comercializan para psoriasis no son específicos para cada tipo, es por ello que se
identifica la necesidad de diseñar un producto de aplicación tópica con Urea para el tratamiento
específico de este tipo de afección de la piel.
Hipótesis
Se puede diseñar una crema con Urea para tratamiento de Psoriasis fotosensible, con buenas
propiedades organolépticas, fisicoquímicas microbiológicas y de estabilidad.
Objetivo General
Diseñar y elaborar una crema de protección solar con Urea que ayuden a proteger e hidratar la piel
de personas que padecen Psoriasis

CAPITULO I: INTRODUCCION
2
Objetivos Específicos
- Formular cremas con filtros solares químicos y físicos, emolientes, extractos naturales y urea a
diferentes concentraciones como agente queratolítico para obtener una crema hidratante
recomendada para personas que padezcan Psoriasis.
- Realizar controles organolépticos, físicos, y microbiológicos para las formulaciones.
- Realizar un estudio de estabilidad organoléptica, fisicoquímica y microbiológica de las
formulaciones.
Importancia y Justificación de la Investigación
Los tratamientos tópicos de la psoriasis consisten principalmente en emolientes, hidratantes,
agentes queratolíticos y corticoides. Los productos hidratantes y emolientes son beneficiosos sobre
todo en las fases intermedias o de remisión de la psoriasis. Durante la fase queratósica inicial, los
agentes queratolíticos son los más beneficiosos y pueden utilizarse junto a hidratantes y emolientes.
Aunque los corticoides tópicos son eficaces en todas las etapas, no deben utilizarse
continuadamente durante periodos prolongados y a menudo es conveniente reservarlos para los
brotes (exacerbaciones).
Es por ello que este trabajo de tesis tiene como finalidad diseñar y elaborar una crema con filtros de
protección solar, que adicional a su propiedad protectora de la radiación solar en su formulación
contemple todo lo antes mencionado.
La formulación propuesta contiene:
• Filtros solares químicos y físicos idóneos para disminuir el efecto de los rayos ultravioleta
sobre la piel o sobre el ADN de las células cutáneas y con ello evitar que se agrave las lesiones que
padecen las personas con psoriasis.
• Una mezcla de emolientes ya que estos entre los periodos de exacerbación de las lesiones
psoriáticas son los más recomendados para el cuidado de la piel porque actúan creando una capa
oleosa oclusiva que hidrata la capa córnea e impide la evaporación del agua previniendo la
formación de fisuras y reduciendo la cohesión de los corneocitos facilitando su descamación y la
recurrencia temprana de la enfermedad,
• Agente queratolítico (úrea) muy eficaz en la reducción de las escamas de la placas psoriásicas,
dado que desintegran el material queratósico.
• Extractos naturales que son útiles para mejorar la hidratación y eliminar escamas de las
lesiones iniciales

CAPITULO I: INTRODUCCION
3
ANTECEDENTES
La República de Venezuela en la Parroquia San Fernando, en el período Mayo - Diciembre 2013 se
realiza un estudio de intervención terapéutica en 20 pacientes con psoriasis vulgar, los cuales son
seleccionados de manera aleatoria y divididos en 2 grupos con igual cantidad de personas; el
primer grupo fue el de control que recibe tratamiento convencional con triamcinolona, y segundo
grupo que recibe tratamiento tópico con crema de Aloe vera (sábila) de base inerte; a fin de
determinar la efectividad de esta última.
Para establecer la comparación entre ambos grupos, se emplearon técnicas no paramétricas debido
al número reducido de pacientes, y siempre se consideró un nivel de significación de 0,05. Se
obtuvo que la modalidad terapéutica con crema de sábila es tan efectiva como la aplicación de la
triamcinolona, pero a diferencia de esta última, no presentó reacciones adversas. Concluyéndose
que la terapia con Aloe vera es efectiva para tratar pacientes con psoriasis vulgar. (Yoisel, 2014)
El Dr. Alexander Filbry, Director del Desarrollo de Productos para el Cuidado Corporal de
Eucerin, realiza una investigación que ha demostrado que las formulaciones de Eucerin Hyal-Urea
hidratan intensamente la piel seca con el resultado de un aspecto radiante y más juvenil.
"Cuando examinamos las fórmulas de Hyal-Urea en ensayos dermatológicos realizados en
voluntarios con una edad media de 50 años y piel facial seca y con arrugas, observamos que no
sólo reducían la sequedad y el aspecto de las arrugas sino también significativamente la
descamación, la tirantez y el picor. La tolerabilidad fue confirmada adicionalmente en estudios
clínicos en pacientes con dermatitis atópica y psoriasis". (BEIERSDORF AG.)

CAPITULO II: FUNDAMENTO TEORICO
4
2. FUNDAMENTO TEÓRICO
2.1 LA PIEL: GENERALIDADES
La piel es una membrana externa, resistente que forma la parte superficial del organismo, y sirve de
frontera activa con el medio externo, además controla la pérdida de fluidos valiosos, actúa como un
cojín frente a golpes mecánicos y evita la penetración de sustancias extrañas, al igual que regula la
pérdida de calor y transmisión de estímulos (Ver Figura 1)
La estructura de la piel y los procesos fisiológicos que en ella se producen facilitan diferentes
funciones integrales:
- Protege frente a la invasión de microorganismos y cuerpos extraños, así como a pequeños
traumatismos físicos.
- Limita la pérdida de líquidos del organismo, proporcionando una barrera mecánica.
- Contribuye a regular la temperatura mediante radiación, conducción y evaporación.
- Proporciona la percepción sensorial mediante las terminaciones nerviosas libres y los receptores
especializados.
- Produce vitamina D a partir de precursores cutáneos.
- Contribuye a regular la presión sanguínea mediante la constricción de los vasos sanguíneos
cutáneos.
- Repara las heridas superficiales, acelerando el proceso normal de renovación celular.
Excreta sudor, urea, y ácido láctico. (MULLARES, 2001)
Figura 1. La Piel
Se describe la importancia y la función de la piel.
Nota: Tomado de “Enciclopedia Médica en Línea” por FERATO. (30 de Abril de 2015 ). Recuperado el 01
de Julio de 2011 (17h00), de http://www.ferato.com/wiki/index.php/Piel.

CAPITULO II: FUNDAMENTO TEORICO
5
2.1.1 Estructura de la piel. La piel humana se subdivide en tres capas mutuamente dependientes
(Ver Figura 2)
- La epidermis la capa más externa de la piel, vascularizada y formada por estratos celulares.
- La dermis formada por tejido conectivo.
- La hipodermis formada por grasa subcutánea.
Además, la piel posee una serie de órganos anexos, como folículos pilosos, glándulas sudoríparas,
terminaciones sensitivas nerviosas, entre otros, que hacen de la piel un órgano sensitivo, de la
protección y de secreción.
Figura 2. Capas de la Piel
Se observa las 3 capas que conforman la piel y se muestra en cuál de estas capas ejercen acción los productos
farmacéuticos, cosméticos y cosmecéuticos.
Tomado de “BIOCLINIC — Cosmecéutica para reactivar tu Juventud” por RIOS, Paty. (s.f.). Recuperado el
11 de Septiembre de 2012 (14h00). de http://www.haasler.com.mx/m_homeopaticos.asp
2.1.1.1. Epidermis. Es la capa más superficial de la piel y tiene un espesor variable, máximo en las
regiones palmo plantares (1mm) y mínimo en los párpados (50um).
Esta capa posee una triple función de protección: 1. es una barrera impermeable frente a la
penetración de sustancias químicas y de líquidos gracias a la capa córnea constituida como
consecuencia de la maduración de los queratinocitos, 2. es una protección frente al sol gracias a la
presencia de melanocitos, y 3. es una barrera inmunológica debido a la presencia de las células de
Langerhans. (GARCIA & et al, 2012)
Estructuralmente está formado por las siguientes capas:
- Extracto basal: Formado de una capa de queratinocitos cilíndricos o cúbicos, además se
encuentran dispersos melanocitos, células de Langerhans y células de Merkel. Está capa es la
más profunda de la epidermis, siendo la función de la misma la formación de nuevas células.

CAPITULO II: FUNDAMENTO TEORICO
6
- Extracto espinoso: Situado en la parte superior del extracto basal, el cual está formado de 8-10
capas de queratinocitos cuya forma es poliédrica, algunos de los cuales conservan su capacidad
de división celular.
- Extracto granuloso: Se le denomina de esta manera, debido a que en este se encuentran
presentes gránulos de color oscuro, color que se debe a la proteína denominada queratohialina.
Está formada de 3-5 capas de queratinocitos aplanados, estando sus núcleos en proceso de
degeneración constante. Su función es la de producir una capa impermeable que retrasa la
salida de líquidos corporales e impide la entrada de materiales extraños al cuerpo humano.
- Extracto lucido: Está presente únicamente en las yemas de los dedos, palmas de las manos, y
planta de los pies, formado de 3-5 capas de queratinocitos planos, los cuales no tienen
coloración y están muertas.
- Extracto corneo: Conformado de 25-30 capas de queratinocitos, cuya forma es aplanada y se
encuentran muertos. Estas células muertas contienen la proteína queratohialina y filamentos
intermedios, entre estas células se encuentran lípidos que le confieren permeabilidad al
extracto. Este extracto tiene la función de protección contra microorganismos y lesiones.
(AVRIL, 2004).
2.1.1.2. Dermis. La dermis es la capa de la piel situada bajo la epidermis y firmemente conectada a
ella, con un grosor entre 20 y 30 veces mayor que el de la epidermis. Desempeña una función
protectora, representa la segunda línea de defensa contra los traumatismos.
Estructuralmente está formado por dos capas:
- Capa capilar o papilar o dermis superior.- Es una zona superficial de tejido conectivo laxo, que
contacta con la membrana basal, cuyas fibras colágenas y elásticas se disponen en forma
perpendicular al epitelio, determinando la formación de papilas que contactan con la parte
basal de la epidermis. En este nivel encontramos receptores de presión superficial o tacto
(corpúsculos de Meissner).
- Capa reticular o dermis profunda.- Contiene la mayoría de los anexos de la piel. Está
constituida por tejido conectivo con fibras elásticas que se disponen en todas las direcciones y
se ordenan en forma compacta, dando resistencia y elasticidad a la piel. Posee fibras
musculares lisas que corresponden a los músculos erectores de los pelos. (GARCIA & et al,
2012)
2.1.1.3. Hipodermis. Es una capa de tejido subcutáneo formada por panículos adiposos de espesor
variable, esta capa de tejido adiposo permite el aislamiento térmico proporciona protección
mecánica y reserva de energía, además contiene órganos sensoriales de presión. A través de la

CAPITULO II: FUNDAMENTO TEORICO
7
hipodermis llegan a la piel los vasos sanguíneos y los nervios y esta capa de grasa es un aislante de
frío y calor.
Estructuralmente está formado por lo siguiente:
- Una estructura de células llamadas lipocitos cuya misión principal es la creación y
almacenamiento de la grasa cutánea, más conocida como tejido adiposo.
- Posee una zona muy vascularizada para permitirle una buena irrigación sanguínea.
- Además posee una multitud de terminaciones nerviosas con folículos pilosos muy profundos.
Funciones de la hipodermis.
- Proteger el organismo de agresiones exteriores.
- Proteger el organismo de posibles traumatismos moderados.
- Proteger el organismo contra la pérdida de calor.
- Es la encargada de dar textura a la piel. Cuando la hipodermis está en mal estado la piel forma
pliegues y se afloja.
2.1.2. Composición química de la Piel. La piel está constituida principalmente por cuatro
componentes químicos:
- Agua: constituye el 70 - 80% de la piel y el 10 - 15% pertenece a la capa córnea. El agua se
encuentra en la piel bajo el estado intercelular en el extracto córneo e intracelular bien fijada en
las grandes moléculas de la dermis (colágeno y elastina), impregnando como una esponja a las
sustancias hidrófilas de la dermis. Para que la capa córnea permanezca bien hidratada, es
necesario que exista un equilibrio entre la difusión (que es el paso de agua desde la dermis
hasta la epidermis) y la evaporación en la superficie y al mismo tiempo que la capacidad de la
capa córnea para fijar el agua, sea óptima.
- Carbohidratos: glucosa y ciertos glúcidos llamados mucopolisacaridos.
- Lípidos: colesterol, fosfolípidos, entre otros, estos aseguran el mantenimiento de la acidez de la
piel y su protección contra los microbios.
- Proteínas: son largas cadenas de aminoácidos, estas moléculas sirven para formar los tejidos y
componentes que le dan características propias a la piel como la elastina, el colágeno, entre
otros.
2.1.3. Funciones de la piel. Entre las principales funciones tenemos:
- Protección: Tiene una función de cobertura o aislamiento del organismo. Actúa como barrera
física protegiendo al mismo de las abrasiones físicas, de las invasiones bacterianas y de las
radiaciones.

CAPITULO II: FUNDAMENTO TEORICO
8
- Regulación de la temperatura corporal: a través de la vascularización y las pérdidas de agua.
- Control de las sensaciones: a través de las terminaciones nerviosas y de los receptores.
- Inmunológica: La piel confiere un alto grado de protección frente a organismos patógenos y
sustancias tóxicas. Determinadas sustancias de la epidermis son capaces de inactivar
microorganismos y de alterar la membrana de algunas bacterias.
- Homeostática: Previene la pérdida excesiva del agua corporal (el 70% de nuestro organismo) y
participa en la regulación de la excreción de líquidos, electrólitos y proteínas.
- Facilita la síntesis de vitamina D: ya que a través de numerosos precursores, por acción de la
luz ultravioleta sobre la piel, se convierte la vitamina D en una sustancia activa.
2.1.4. Tipos de Piel. Se pueden utilizar diferentes criterios para clasificar la piel, una de las más
aceptadas se basa en la naturaleza de la emulsión que se forma sobre la superficie corporal entre las
moléculas lípidicas y acuosas cutáneas o externas, denominada Manto hidrolipídico o emulsión
epicutánea. (FERATO, 2015).
Se puede clasificar:
a) Según la epidermis
- Piel gruesa: aquella que posee un estrato córneo bien desarrollado. La suelen presentar
personas expuestas de forma crónica al sol, ya que uno de sus efectos es la hiperqueratosis
(engrosamiento del estrato córneo).
- Su aspecto es tosco, con los poros dilatados, de color opaco amarillento. También posee una
epidermis gruesa y queratinizada, con un aspecto amarillento debido a la queratina.
- Piel delgada: posee una capa córnea fina. Propia en las mujeres y de zonas corporales cubiertas.
Presenta una superficie uniforme, con poros poco visibles y de color son rosado traslúcido.
b) Según la dermis
La firmeza, elasticidad y capacidad de recuperación de la piel, dependen básicamente de las
características de la dermis. Se puede dividir:
- Piel tónica: es aquella que presenta tensión y elasticidad.
- Piel flácida: aquella que ha perdido la elasticidad y la capacidad de recuperación después de
someterse a una deformación.
Presenta estas características pieles envejecidas e incluso pieles jóvenes que han sufrido un
adelgazamiento brusco o ciertas enfermedades.
c) Según las secreciones
La emulsión epicutánea o manto hidrolipídico es la emulsión formada por el agua procedente de las
glándulas sudoríparas y el ambiente, junto con los lípidos de las glándulas sebáceas y de la capa
córnea. Es una película que recubre el estrato córneo, ayudando al mantenimiento de la función de
barrera.

CAPITULO II: FUNDAMENTO TEORICO
9
Según la fase continúa de la emulsión resultante, se forman emulsiones de fase externa acuosa
(O/W) u oleosa (W/O), en función de los cuales clasificaremos los distintos tipos de piel (Ver
Tabla 1).
Tabla 1. Tipos de piel según la secreción
PIEL SECA PIEL NORMAL PIEL GRASA
Tipo de emulsión O/W O/W W/O
Epidermis Fina Normal Gruesa
Secreción sebácea Escasa Media Alta
Tamaño de poro Pequeño Normal Grande
Tomado de “Enciclopedia Médica en Línea” por FERATO. (30 de Abril de 2015 ). Recuperado el 01 de
Julio de 2011 (17h00), de http://www.ferato.com/wiki/index.php/Piel.
2.1.4.1. Piel Grasa. La piel grasa posee una emulsión tipo W/O, debido a que las secreciones
sebáceas y sudoral son abundantes. Son pieles muy protegidas y resistentes. Se caracteriza por el
brillo en la piel, la presencia constante de puntos negros y los poros dilatados (Ver Figura 3).
Figura 3. Diagrama de Piel Grasa
En un piel grasa debido a la secreciones sebáceas van apareciendo protuberancias en la piel similares al acné
(granos).
Tomado de “Formulación de una Nanoemulsión Dermocosmetica, Nutritiva y Regeneradora de la piel”
(Tesis de Posgrado ) por CARVAJAL, A (2004). Universidad de los Andes. Venezuela.
Se distinguen varios tipos de piel grasa con distintas características:
- Piel grasa seborreica: Este tipo de piel se presenta, principalmente, en individuos de raza latina.
- Piel grasa deshidratada: Se desarrolla cuando la secreción sebácea modifica su composición
cualitativa, disminuyendo la proporción de lípidos hidrófilos. En estas condiciones la emulsión
epicutánea no se forma o es insuficiente para proporcionar una adecuada protección, ya que
disminuye el agua retenida al evaporarse ésta con más facilidad y por tanto, la piel se
deshidrata.

CAPITULO II: FUNDAMENTO TEORICO
10
- Piel grasa asfíctica. Es una piel que ha alcanzado este estado por la utilización errónea de
productos cosméticos. Por ejemplo, el empleo de productos demasiado astringentes que cierran
los poros provoca una alteración en la composición de la secreción sebácea, originando la
producción de grasa solidificada que, por la hipertrofía de la capa córnea, tiene dificultades en
salir al exterior. Ello origina la aparición de quistes sebáceos o quistes de millium.
Características de los distintos tipos de pieles grasas (Ver Tabla 2):
Tabla 2. Descripción de la piel grasa
Piel Seborreica Piel Deshidratada Piel Asfíctica
Aspecto Brillante Brillante pero
opaca
Brillante en zonas
seborreicas. Mate y marchito
en zonas no seborreicas
Textura Untuosa Áspera
Ligeramente áspero en zonas
no seborreicas. Algo untuoso
en zonas seborreicas.
Superficie Cérea (sin escamas) Escamosa Descama según zonas
Poros Perceptibles,
abiertos (espinillas)
Perceptibles,
abiertos (zona
central de la cara)
Cerrados, con quistes
sebáceos y comedones.
Resiste el jabón Si No No, especialmente los
astringentes.
Resiste a los
cambios climáticos Si No Si / No
Tomado de “Enciclopedia Médica en Línea” por FERATO. (30 de Abril de 2015 ). Recuperado el 01 de
Julio de 2011 (17h00), de http://www.ferato.com/wiki/index.php/Piel.
2.1.4.2. Piel Seca. La piel seca presenta una emulsión del manto epidérmico de fase externa acuosa
(O/W). Una correcta función de barrera presupone una superficie cutánea lisa, flexible, sin fisuras,
sin grietas y con una descamación imperceptible. Las pieles secas se desarrollan como
consecuencia de una disminución en el contenido de agua del estrato córneo, dificultando dicha
función de barrera. (Ver Figura 4)
PIEL SECA
Este tipo de piel presenta un aspecto
tirante, casi transparente, con cierta
tendencia a resquebrajarse, es sensible
a los cambios de temperatura y en él se
aprecian los pequeños vasos capilares.
Es una piel deshidratada, que presenta
frecuentes arrugas, se pela y se
descama con facilidad.
Figura 4. Diagrama de la piel seca
La piel seca presenta un aspecto quebradizo. Tomado de “Formulación de una Nanoemulsión Dermocosmetica, Nutritiva y Regeneradora de la piel”
(Tesis de Posgrado ) por CARVAJAL, A (2004). Universidad de los Andes. Venezuela.

CAPITULO II: FUNDAMENTO TEORICO
11
La pérdida de agua puede deberse a:
- Disfunciones fisiológicas:
Disminución de la secreción sebácea. Es la deshidratación de las capas córneas superficiales y
propicia una alteración de la función barrera por parte de los agentes externos.
La falta de precursores de las moléculas higroscópicas que constituyen el factor de hidratación
natural. Como consecuencia aparecen sequedad y aspereza cutánea que dificultan la función
barrera.
La escasez y alteración de los lípidos que forman las membranas córneas y la sustancia
cementante intercorneal, puede incrementar la pérdida de agua, causar aspereza y sequedad.
- Agentes externos:
El calor seco intenso y persistente, provoca una pérdida de agua que modifica la fase acuosa de
la emulsión epicutánea.
El frío puede afectar las actividades enzimáticas que transforman los aminoácidos.
El exceso de radiación UV puede dañar las proteínas córneas y los lípidos lábiles.
La utilización continuada de jabones y detergentes puede provocar una pérdida de los lípidos
superficiales.
Los productos alcalinos pueden provocar la pérdida de la acidez fisiológica característica de la
capa córnea.
La sequedad cutánea puede ser ocasional o crónica. La piel seca se caracteriza por ser gruesa,
áspera y rugosa al tacto, con una descamación anormal. Presenta poca tolerancia a los agentes
externos.
Dentro de las pieles secas ocasionales o temporales se encuentran principalmente (Ver Tabla 3):

CAPITULO II: FUNDAMENTO TEORICO
12
Tabla 3. Pieles secas ocasionales o temporales
Tipo Descripción Características
LAS PIELES
LIPÍDICAS
Se caracterizan por una
disminución del nivel lipídico en
la secreción sebácea, ocasionando
la deshidratación de la capa
córnea por una menor protección
de la emulsión epicutánea.
Estas pieles suelen presentar:
Color blanco rosado.
Espesor fino.
Aspecto mate y marchito.
Poros cerrados e imperceptibles a simple vista.
Tacto áspero.
Fácil descamación.
Tendencia a presentar arrugas.
Resiste muy mal los cambios climáticos.
Toleran mal los jabones.
Se broncea con dificultad.
No suele tener comedones.
Pérdida de elasticidad.
La sensibilidad a los agentes externos favorece la
aparición de rojeces y descamaciones.
LAS PIELES
DESHIDRA-
TADAS
Deben su sequedad a un déficit de
agua en el estrato córneo.
Los agentes externos favorecen la
eliminación del agua superficial
conduciendo a un resecamiento y
mayor descamación córnea.
Sus características son:
Tacto áspero.
Piel con espesor fino.
Aspecto mate, sin brillo.
Gran tendencia a las arrugas y a que se infecten los
poros (granos).
Tolera muy mal los jabones.
Broncea difícilmente.
Fácil descamación.
Mala adaptabilidad a los cambios climáticos.
Piel muy sensible, que se irrita con facilidad
Sensación de tirantez.
No suele presentar comedones.
Nota: Tomado de “Enciclopedia Médica en Línea” por FERATO. (30 de Abril de 2015 ). Recuperado el 01
de Julio de 2011 (17h00), de http://www.ferato.com/wiki/index.php/Piel.
2.1.4.3. Piel Mixta o Normal. Es aquella cuyo manto hidrolipídico se halla correctamente
formado, con una cantidad de lípidos idónea y constituyendo una emulsión de fase externa acuosa
(O/W) o de fase externa oleosa (W/O), bien constituida. La función barrera no presenta ninguna
alteración y la hidratación cutánea presenta una normalidad absoluta (Ver Figura 5) (KOVACS &
PREUK, 2007).
Sus características son:
- Color rosado uniforme.
- Tacto muy suave, aterciopelado. Propio de pieles jóvenes.
- Espesor fino.
- Lisa, sin arrugas y elástica.
- Flexible, tónica.
- Bien irrigado.
- Poros cerrados y pequeños.

CAPITULO II: FUNDAMENTO TEORICO
13
- No hay presencia de aspectos poco estéticos como manchas, poros abiertos o líneas tirantes.
- No hay brillo grasiento.
- Tiene una superficie lubricada y humedecida.
- Presenta una buena tolerancia a los jabones.
- Broncea al sol en exposiciones normales y controladas.
- Resiste bien los cambios de temperatura.
PIEL NORMAL
Es la piel similar a la de un niño, es una
piel fina, flexible, tersa y muy suave.
Presenta un aspecto natural, sano y
agradable con poros diminutos muy
cerrados que impiden la formación de
espinillas
Figura 5. Diagrama de piel mixta o normal
La piel normal tiene un aspecto agradable y sano.
Tomado de “Formulación de una Nanoemulsión Dermocosmetica, Nutritiva y Regeneradora de la piel”
(Tesis de Posgrado ) por CARVAJAL, A (2004). Universidad de los Andes. Venezuela.
2.1.4.4. Piel Atópica. La piel seca constituye un denominador común en las personas atópicas,
estando considerada como una de las características más significativas y habituales del paciente
atópico, la cual se pone de manifiesto como una piel apagada, áspera al tacto, descamativa y que
suda poco.
Parece ser que la xerosis* aparece como consecuencia a una alteración epidérmica por la cual
existe una mayor permeabilidad del estracto córneo y, consecuentemente, una mayor pérdida de
agua transepidérmica. Este hecho, consecuencia de una disminución en la efectividad de la función
barrera frente a la pérdida de agua, ha sido atribuido a un defecto en el metabolismo de ácidos
grasos esenciales (ácido linoleico, gammalinolenico y araquidonico). (Ver Figura 6 )
*Xerosis. Es una resequedad anormal de la piel o las membranas mucosas.

CAPITULO II: FUNDAMENTO TEORICO
14
Figura 6. Comparación entre la piel atópica y sana
Las pieles atópica ante factores físicos o químicos responden frente a estos con reacciones de intolerancia
como el rush cutáneo.
Tomado de “Folleto de la piel atópica” por EBOOKBROWSE. (05 de Mayo de 2011 ). Recuperado el 04 de
Julio de 2015 (08h07), de http://ebookbrowse.com/folleto-cuidados-piel-atopica-pdf-d93599290.
La falta de efectividad que presenta la barrera epidérmica permite también una mayor
permeabilidad a otras sustancias, distintos tipos de alérgenos, agentes irritantes directos, perfumes,
tensioactivos y todo tipo de productos que, aunque anteriormente eran bien tolerados, tras está
alteración se han convertido en potenciales irritantes.
Este hecho explica la escasa tolerancia que presentan las pieles atópicas tanto a factores externos de
naturaleza química como física (exceso de frío o calor) y que como respuesta dan una reacción de
intolerancia (Ver Figura 7)
Figura 7. Diagrama de piel atópica
Las pieles atópica ante factores físicos o químicos responden frente a estos con reacciones de intolerancia
como el rush cutáneo.
Tomado de “Folleto de la piel atópica” por EBOOKBROWSE. (05 de Mayo de 2011 ). Recuperado el 04 de
Julio de 2015 (08h07), de http://ebookbrowse.com/folleto-cuidados-piel-atopica-pdf-d93599290.

CAPITULO II: FUNDAMENTO TEORICO
15
2.1.4.5. Piel Negra. En una piel negra no hay más melanocitos, células epidérmicas situadas en la
capa basal, que en la piel blanca. Son los melanosomas, productores de melanina, responsables del
color de la piel, los que son más numerosos, mayores y están dispersos por toda la capa de la
epidermis. Por eso la tonalidad de la piel es más intensa.
El pH cutáneo es un poco más ácido (4,8 – 5,2) que las pieles blancas. En los blancos los
melanocitos son pequeños (400nm) reunidos en el interior de los queratinocitos y en los negros los
melanosomas son dos veces más gruesas (800nm) y están dispersos en el citoplasma de los
queratinocitos.
2.2. PATOLOGÍAS DE LA PIEL: PSORIASIS
La psoriasis pertenece al grupo de enfermedades que tienen que ver con alteraciones de la
pigmentación. El color de la piel normal depende de la cantidad y tipo de melanina presente en los
melanocitos y en los queratinocitos. Las enfermedades que cursan con cambios del color natural de
la piel se denominan discromías. Hay distintas clasificaciones de las discromías, pero la más
sencilla y útil es dividirlas en hiper e hipocromías. (SERNA, VITALES, & LÓPEZ, 2001)
- Hipercromías: En las hipercromías hay aumento de tonalidad, circunscrita o generalizada, de la
piel. La gran mayoría son debidas a un aumento del número de melanocitos o a alteraciones de
la localización o distribución de la melanina, son las denominadas hipercromías melánicas.
Ocasionalmente, la presencia de pigmentos exógenos o endógenos puede aumentar la tonalidad
de la piel. (SERNA, VITALES, & LÓPEZ, 2001)
- Hipocromías: Las hipocromías son disminuciones del tono de color de la piel, que
habitualmente son debidas a una disminución de la pigmentación melánica. Ocasionalmente
pueden verse disminuciones circunscritas del color de la piel, debidas exclusivamente a
alteraciones localizadas de la vascularización cutánea conocidas como “nevus anémico”.Las
hipocromías melánicas son debidas a la disminución del número de melanocitos, melanina o de
la dispersión de ésta en los queratinocitos. (SERNA, VITALES, & LÓPEZ, 2001)
La psoriasis es una dermatosis inflamatoria de etiología desconocida, habitualmente de curso
crónico, que muestra una gran variabilidad clínica y evolutiva. Su diagnóstico es clínico y se basa
en la morfología de las lesiones caracterizadas por placas eritematosas, bien delimitadas y cubiertas
por escamas nacaradas. Las características histológicas de la psoriasis son hiperqueratosis de la
epidermis con acúmulos de leucocitos polimorfonucleares. (SERNA, VITALES, & LÓPEZ, 2001)

CAPITULO II: FUNDAMENTO TEORICO
16
2.2.1 Etiología. La psoriasis se provoca por el funcionamiento defectuoso del sistema
inmunitario que provoca un exceso de producción de células cutáneas, las encargadas de reponer
las capas de piel en renovación.
Este exceso de creación de nuevas capas puede causarse hasta siete veces superior al normal, dando
lugar a las características placas de la enfermedad, que adoptan la forma de manchas rojas
resaltadas cubiertas de descamaciones. El curso es impredecible, en algunos casos desaparece para
siempre y en otros casos persiste o vuelve con frecuencia, es importante saber que la psoriasis
aumenta con la edad, pero mientras más temprano se presente será más crónica y más grave.
2.2.2 Epidemiología. La psoriasis es una enfermedad frecuente en la raza blanca, que afecta a un
1,5%-3% de la población. Su prevalencia es similar en hombres y en mujeres, aunque en éstas
suele aparecer algo más precozmente. La enfermedad puede comenzar a cualquier edad, desde la
infancia hasta la vejez. La psoriasis es una enfermedad de causa desconocida en la que convergen
multitud de factores predisponentes y desencadenantes. (SERNA, VITALES, & LÓPEZ, 2001)
2.2.2.1 Predisposición genética. Se detectan antecedentes familiares en aproximadamente la
tercera parte de los enfermos, y el riesgo de presentar la enfermedad es de un 10%-15% si uno de
los progenitores la padece y de un 50% si son los dos padres los afectados. (SERNA, VITALES, &
LÓPEZ, 2001)
2.2.2.2 Factores desencadenantes. Los sujetos con psoriasis pueden sufrir la aparición de lesiones
o empeoramiento y/o extensión de las previas al incidir sobre ellos factores como traumatismos
(fenómeno de Koebner), infecciones, hormonales, metabólicos, fármacos (betabloqueantes, litio,
antimaláricos, AINE), psicológicos (estrés), alcohol. La exposición solar suele mejorar las lesiones
psoriásicas, pero en un reducido porcentaje de pacientes las puede desencadenar. (SERNA,
VITALES, & LÓPEZ, 2001)
2.2.3 Tipos de Psoriasis. A continuación se describen los diferentes tipos de psoriasis:
2.2.3.1 Psoriasis crónica estacionaria o psoriasis en placas (Psoriasis vulgaris). Es el tipo de
Psoriasis más común y afecta al cuero cabelludo, zonas de extensión (codos, rodillas), genitales,
región del ombligo, lumbosacra y retroauricular, con placas simétricas, eritematosas con bordes
bien definidos y descamación perlada, que van desde 1 cm hasta los 10 cm de tamaño. Al raspar las
placas se observan signos de inflamación en la piel que está bajo la lesión. La inspección en las
uñas puede mostrar pitting. En la mayoría de los casos son asintomáticas, aunque los pacientes
suelen quejarse de prurito (Ver Figura 8).

CAPITULO II: FUNDAMENTO TEORICO
17
Figura 8. Psoriasis en Placas
Fotos de psoriasis en placas crónica localizada en sitios característicos. Obsérvese la marcada simetría de las
lesiones.
Tomado de “Dermatología en Medicina General” por FITZPATRICK., (2008). (Séptima ed.). Buenos
Aires, Argentina: Editorial Médica Panamericana S.A.
2.2.3.2 Psoriasis en gotas. Se presenta como pequeñas pápulas de 1-10 mm de diámetro de color
salmón de predominio en el tronco. Pueden descamar. Suelen aparecer 1-2 semanas tras una
infección respiratoria de vías altas secundaria a estreptococo beta-hemolítico del grupo A, en niños
y adultos jóvenes, desapareciendo a los 2-3 meses de manera espontánea. Generalmente tiene buen
pronóstico, en algunos casos con brotes recurrentes, aunque puede ser la forma de inicio de una
psoriasis que posteriormente curse en forma de pequeñas placas de evolución crónica. En principio
solo precisa de tratamiento local, aunque habría que valorar otros tratamientos de tipo antibiótico si
se diera el caso de varios procesos infecciosos en un mismo paciente (Ver Figura 9).

CAPITULO II: FUNDAMENTO TEORICO
18
Figura 9. Psoriasis en Gotas
Fotos de psoriasis en gotas, (A) muslo, (B) manos, (C y D) dorso. El paciente en el panel (D) desarrolló
psoriasis en placas crónica.
Tomado de “Dermatología en Medicina General” por FITZPATRICK., (2008). (Séptima ed.). Buenos
Aires, Argentina: Editorial Médica Panamericana S.A.
2.2.3.3 Psoriasis invertida. Afecta a las zonas de flexión, regiones inframamarias y la piel de los
pliegues (axilar, inguinal, perineal, genital). Se caracteriza por lesiones de color rojo vivo,
brillantes, no descamativas y la ocasional fisuración. La transpiración está deteriorada en las áreas
afectadas. (Ver Figura 10).
Figura 10. Psoriasis Invertida
Tomado de “Dermatología en Medicina General” por FITZPATRICK., (2008). (Séptima ed.). Buenos
Aires, Argentina: Editorial Médica Panamericana S.A.

CAPITULO II: FUNDAMENTO TEORICO
19
2.2.3.4 Psoriasis pustulosa. La psoriasis pustulosa generalizada (Von Zumbusch) es una
característica variante aguda de la psoriasis. Habitualmente está precedida por otras formas de la
enfermedad. Los ataques de la enfermedad se caracterizan por fiebre que dura varios días y una
erupción súbita generalizada de pústulas estériles de 2 a 3mm de diámetro. Las pústulas están
diseminadas por el tronco y extremidades, incluyendo los lechos ungueales, las palmas y las
plantas de los pies. Las pústulas habitualmente surgen en regiones de la piel muy eritematosas, al
comienzo como parches y luego se hacen confluentes, a medida que la enfermedad se torna más
grave. Esta forma de psoriasis en general se asocia con signos sistémicos importantes y puede
producir complicaciones potencialmente mortales como la sobreinfección bacteriana, la sepsis y la
deshidratación. Puede ser difícil de controlar y requiere un régimen de tratamiento potente con
rápido comienzo de acción para evitar las complicaciones mortales. Los medicamentos
habitualmente utilizados son el metotrexato (MTX), la ciclosporina y los corticosteroides por vía
oral. (Ver Figura 11).
Figura 11. Psoriasis Pustulosa
Fotos de psoriasis pustulosa sobre la piel eritematosa. Tomado de “Dermatología en Medicina General” por FITZPATRICK., (2008). (Séptima ed.). Buenos
Aires, Argentina: Editorial Médica Panamericana S.A.
2.2.3.5 Psoriasis eritrodérmica. Es un tipo de Psoriasis poco frecuente. Se presenta como un
eritema generalizado, descamativo que afecta desde la cabeza del paciente hasta los dedos de los
pies. Suele acompañarse de infecciones (incluso sepsis), hipotermia y deshidratación secundaria, en
las zonas afectas debido a la pérdida de una adecuada barrera de protección. En los pacientes
mayores puede producirse inestabilidad cardiaca e hipotensión por la masiva vasodilatación en la
piel. Tanto esta forma de psoriasis como la pustulosa requieren en ocasiones ingreso hospitalario
para manejo metabólico y del dolor (Ver Figura 12).

CAPITULO II: FUNDAMENTO TEORICO
20
Figura 12. Psoriasis Eritrodérmica
Fotos de psoriasis eritrodérmica, en ambos paneles obsérvese islas de piel no afectada.
Tomado de “Dermatología en Medicina General” por FITZPATRICK., (2008). (Séptima ed.). Buenos
Aires, Argentina: Editorial Médica Panamericana S.A.
2.2.3.6 Psoriasis del cuero cabelludo. El tipo de Psoriasis en el cuello cabelludo es quizás la más
común afecta al 50% de los pacientes. Se presenta como placas eritematosas con escamas
nacaradas/perladas en el cuero cabelludo. Los pacientes suelen quejarse de prurito (Ver Figura 13).
Figura 13. Psoriasis del Cuero Cabelludo
Foto de psoriasis del cuero cabelludo.
Tomado de “Dermatología en Medicina General” por FITZPATRICK., (2008). (Séptima ed.). Buenos
Aires, Argentina: Editorial Médica Panamericana S.A.

CAPITULO II: FUNDAMENTO TEORICO
21
2.2.3.7 Psoriasis ungueal. En este tipo de Psoriasis la prevalencia exacta se desconoce, pero se
estima que más de la mitad de los pacientes con psoriasis van a presentar afectación ungueal. Es
más común en pacientes con artritis psoriasica. La alteración típica sobre las uñas es el denominado
pitting, un punteado fino disperso a lo largo de la superficie ungueal. Otra forma de afectación son
las denominadas manchas de aceite y la hiperqueratosis subungueal, que ocurre en los casos más
severos de afectación ungueal. Suele ser refractaria a la mayoría de los tratamientos tópicos,
requiriendo terapia sistémica o subungueal mediante infiltración de corticoides (Ver Figura 14).
(CAÑARTE, CABRERA, & PALACIOS, 2004)
Figura 14. Psoriasis Ungueal
Fotos de psoriasis ungueal (A-D)
Tomado de “Dermatología en Medicina General” por FITZPATRICK., (2008). (Séptima ed.). Buenos
Aires, Argentina: Editorial Médica Panamericana S.A.
2.2.4 Causas de la Psoriasis. Aún se desconoce el origen concreto de la enfermedad, sí se sabe
que es una enfermedad genética. De hecho, se ha localizado el gen cuya alteración influye en la
aparición de la patología. Se conoce que es una enfermedad hereditaria. Si uno de los dos padres es
psoriásico, uno de cada ocho hijos puede sufrirla. Si son los dos progenitores los afectados, la
probabilidad asciende a uno de cada cuatro. Sin embargo, no por el hecho de ser psoriásico, los
hijos van a serlo. Además puede ocurrir que se herede la alteración genética, pero no se desarrolle
la enfermedad, porque también intervienen factores exógenos (externos) en su aparición. Dentro de
los factores exógenos, destacan:

CAPITULO II: FUNDAMENTO TEORICO
22
- Infecciones crónicas
- Estrés nervioso
- Obesidad
- Alcohol
- Enfermedades como la artritis reumatoide
- Cambios hormonales
- Traumatismos (heridas, golpes, quemaduras solares...)
2.2.5 Tratamiento para la Psoriasis. A continuación se describen los tratamientos más
comunes:
2.2.5.1 Tópico: indicado en la psoriasis leve y como tratamiento de base. Los emolientes hidratan
el estrato córneo evitando la aparición de fisuras y los queratolíticos eliminan el exceso de escamas.
Suele usarse vaselina como emoliente asociada a ácido salicílico al 3-6% como queratolítico
(vaselina salicílica). El ditranol es un potente reductor que se utiliza principalmente en la psoriasis
vulgar con afectación de menos del 25% de la superficie corporal. Las resinas poseen efecto
antimitótico, antiinflamatorio y antipruriginoso. En la actualidad, las resinas y el ditranol se
consideran de segunda elección por la irritación que producen, su fuerte olor y color desagradables.
Los corticoides tópicos (de baja potencia) deben limitarse a pacientes con psoriasis leve que no
responde a otros tratamientos y en ciertas localizaciones como la cara, cuero cabelludo, pliegues y
genitales, donde no se toleran otros fármacos tópicos como el ditranol y el calcipotriol. En general
se usa hidrocortisona al 1%. Los corticoides tópicos de elevada potencia se deben evitar ya que,
aunque son muy efectivos, tras discontinuar la terapia se producen recidivas y exacerbaciones de
las lesiones. El calcipotriol es un análogo de la vitamina D. Se emplea tópicamente a una
concentración del 0,005%, aplicado 2 veces diarias. No debe utilizarse en la cara ni pliegues por su
efecto irritante primario en esta zona, es algo menos eficaz que los corticoides tópicos de potencia
media. El tacalcitol es otro derivado de la vitamina D de eficacia similar al calcipotriol, se aplica
una vez al día a una concentración del 0,0004%. Ninguno de estos análogos de la vitamina D posee
efecto apreciable sobre el metabolismo fosfo-cálcico. El tazaroteno al 0,05% es un retinoide de uso
tópico empleado en la psoriasis en placas leve-moderada que afecte a menos del 10% de la
superfície corporal, es algo menos efectivo que los corticoides tópicos.
En el cuadro de medicamentos ecuatoriano señala como tratamiento Antipsoriásico de uso
tópico los siguientes medicamentos:
D05A ANTIPSORIÁSICOS PARA USO TÓPICO
D05AA Alquitranes
D05AA01 Alquitrán de Hulla: Líquido cutáneo (Concentración: 5%)

CAPITULO II: FUNDAMENTO TEORICO
23
D05AX Otros antipsoriásicos para uso tópico
D05AX52 Calcipotriol + Betametasona Dipropionato: Semisólido cutáneo
(Concentración: (50mcg / 0,5mg /1g)).
2.2.5.2 Fototerapia. Se basa en la administración de dosis crecientes de UVB sin asociarlo a
ningún fármaco. Está indicado en las placas crónicas de psoriasis que no responden al tratamiento
tópico y en la psoriasis en gotas.
2.2.5.3 Fotoquimioterapia. La forma más utilizada es el PUVA, que combina la administración
de psoralenos y UVA, a dosis de 0,4 a 0,6 mg/kg de 8-metoxipsoralen, seguido dos horas después
de fototerapia con UVA. Los efectos secundarios a largo plazo (fotoenvejecimiento,
carcinogénesis, cataratas) aconsejan reservar esta modalidad para aquellos pacientes con más del
30% de la superficie corporal afectada y que no hayan respondido a otros tratamientos.
2.2.5.4 Tratamiento sistémico. Debe reservarse para las formas graves de psoriasis en placas que
no responden a los tratamientos anteriores, formas eritrodérmicas y pustulosas.
Metotrexato: antimetabolito del ácido fólico, está indicado en psoriasis severa resistente a
otros tratamientos. Se emplea en un régimen de 3 dosis semanales de 2,5 a 5 mg separadas
por intervalos de 12 horas. Esta pauta tiene pocos efectos secundarios, de los cuales el más
frecuente son las náuseas y el más importante la hepatotoxicidad. Durante el tratamiento se
requieren severos controles de la función hepática, pulmonar y recuentos hemáticos.
Acitretina: Es un análogo de la vitamina A de administración oral, indicado en psoriasis
severa resistente o complicada. Se inicia a dosis de 25-30 mg/día durante 2-4 semanas y luego
se ajusta la dosis según respuesta (entre 25-50 mg/día), el máximo beneficio se obtiene a las
4-6 semanas de tratamiento. Su inconveniente más importante es la teratogenicidad, que
obliga a una anticoncepción efectiva durante el tratamiento (un mes antes del inicio), que se
mantendrá hasta dos años después de abandonar la medicación. Otros efectos secundarios
frecuentes son queilitis, xerosis y elevación de los niveles sanguíneos de colesterol y
triglicéridos.
Ciclosporina A: se utiliza por su capacidad de inhibir a los linfocitos CD4 activados, que
juegan un papel fundamental en la patogenia de la enfermedad. Indicado en psoriasis severa
resistente a otros tratamientos. Se inicia a dosis oral de 2,5 mg/kg/día, dividida en dos tomas.
Si no hay respuesta clínica puede aumentarse la dosis de forma progresiva hasta un máximo
de 5 mg/kg/día (dividida en 2 tomas). Su administración exige un estricto control de la
función renal, de la tensión arterial y se recomienda monitorizar niveles en sangre. El uso de
corticoides sistémicos debe evitarse ya que al retirar el tratamiento se producen

CAPITULO II: FUNDAMENTO TEORICO
24
exacerbaciones que pueden ser severas e incluso formas pustulosas generalizadas (Von
Zumbusch). (SERNA, VITALES, & LÓPEZ, 2001)
2.2.6 Efectos de la Radiación UV: Psoriasis Fotoinducida. La radiación ultravioleta (UV) es
una de las medidas terapéuticas más utilizadas para el tratamiento de la psoriasis. Sin embargo, en
algunos casos las radiaciones UV, tanto solares como artificiales, pueden agravar la psoriasis o,
muy raramente, desencadenar la enfermedad. La llamada psoriasis fotosensible o fotoinducida es
una entidad poco frecuente pero clínicamente bien reconocida (Ver Figura 15).
Existen descritos diferentes mecanismos para explicar este fenómeno y se estima que entre el 5 y
20% de los pacientes con psoriasis empeoran luego de la exposición a radiación UV.
La psoriasis fotosensible es una entidad infrecuente, que fue descrita por primera vez por Bielicky
en 1963 y que se caracteriza por agravarse luego de la exposición a radiación UV natural o
artificial. Afecta entre el 5 al 14% de los pacientes con psoriasis (llegando hasta el 20-24% en
algunos estudios). A diferencia del inicio inmediato que se observa tras la exposición a radiación
UV en otras enfermedades fotosensibles, esta dermatosis comienza varios días posteriores a la
misma.
Figura 15. Psoriasis Fotoinducida
Foto de psoriasis fotoinducida.
Tomado de “Dermatología en Medicina General” por FITZPATRICK., (2008). (Séptima ed.). Buenos
Aires, Argentina: Editorial Médica Panamericana S.A
2.3 FOTOPROTECCIÓN
Fotoprotección es la protección frente a los posibles efectos adversos de la luz ultravioleta.
- Fotoprotección intrínseca de la piel. Para protegerse de las radiaciones externas, la piel posee
mecanismos intrínsecos de defensa, entre los que se encuentran el engrosamiento de sus capas
más superficiales (epidermis y dermis) y la síntesis de melanina (pigmento que origina el
bronceado). Estos mecanismos van a variar según el fototipo, resultando insuficientes para
prevenir el fotoenvejecimiento y la fotocarcinogénesis.

CAPITULO II: FUNDAMENTO TEORICO
25
- Fotoprotección exógena. La fotoprotección exógena la constituyen todas aquellas estrategias
encaminadas a disminuir los efectos adversos de las radiaciones solares sobre la piel. (ropa,
sombrillas, gafas de sol, evitar la exposición, filtros solares, etc.)
Antes de describir los fotoprotectores, es necesario dar una introducción a los tipos de radiaciones
solares a los que la piel está expuesta.
2.3.1 Radiaciones solares. La energía solar llega a la tierra en forma de radiaciones
electromagnéticas. Su distribución espectral en función de las longitudes de onda es:
- Infrarrojos (>760 nm)
- Visible (400-760nm)
- Ultravioleta A o UVA (320-400 nm)
- Ultravioleta B o UVB (290-320 nm)
Las radiaciones solares terrestres, están constituidas por un 5% de las ultravioletas, frente a un 95%
por el visible e infrarrojos.
Las radiaciones UVA representan el 98% de las radiaciones ultravioletas. La cantidad de UVB de
la radiación solar, disminuye sustancialmente de verano a invierno, mientras que la cantidad de
UVA disminuye en mucha menor proporción. También hay que tener en cuenta que los UVA no
son retenidos por el cristal de las ventanas, coches etc. No ocurriendo lo mismo con los UVB que
son retenidos en más del 90%. Incluso con el cielo cubierto, recibimos radiación UVA. Las UVA
presentan también mayor capacidad de penetrar en el agua que las UVB. Así aunque las UVB
poseen mayor energía, penetran poco en la piel, mientras que las UVA poseen mayor longitud de
onda y menor energía, inciden de forma constante sobre la dermis. Ésta es la radiación que penetra
más profundamente en la piel y además está presente en cantidades importantes a lo largo de todo
el día y de todo el año. (CABRERA & et al., 2005)
2.3.1.1 Radiación UVB.
- Desencadena el proceso de bronceado.
- Produce el engrosamiento del estrato córneo.
- Necesaria para la síntesis de vitamina D.
- Es responsable del enrojecimiento de la piel y del eritema actínico.
- Produce alteraciones del sistema inmunitario.
- Responsable de la fotocarcinogénesis.
2.3.1.2 Radiación IR.
- Posee acción calorífica.
- Es responsable del enrojecimiento de la piel.

CAPITULO II: FUNDAMENTO TEORICO
26
- Produce aumento de temperatura.
- Potencia los efectos negativos de la radiación UV.
- Es responsable de la pérdida de agua cutánea.
2.3.2 Tipos de Fotoprotector. Se denomina protectores solares o fotoprotectores a todos
aquellos productos (cremas, lociones, leches, etc.) que se aplican sobre la piel con el fin de
protegerla de los efectos perjudiciales de las radiaciones solares ultravioleta A (UVA) y/o
ultravioleta B (UVB). Esto es posible porque en su composición llevan unas sustancias
denominadas filtros, capaces de frenar la acción de uno y/u otro tipo de radiación (RIBERA & et
al., 2003).
Los fotoprotectores se clasifican según su modo de actuar:
2.3.2.1 Fotoprotectores Físicos. Son impermeables a la radiación solar y actúan sobre ella por
reflexión. Son de amplio espectro controlan el UV, visible e IR. Son los más utilizados en niños.
Debido a que el tamaño original es grande, los filtros son opacos y pueden alcanzar a brindar
protección hasta contra la luz visible, por lo cual son muy útiles en fotodermatosis como el lupus
eritematoso sistémico y otras. No obstante, debido a la sensación de máscara que pueden dejar
(efecto mínimo) y a su capacidad de producir comedones, se ha buscado mejorarlo
cosméticamente, disminuyendo el tamaño de la partículas a formas ultra finas, o micronizadas, lo
que los hace visiblemente aceptables y químicamente estables, y más efectivos contra longitudes de
onda más cortas. Hay dos filtros inorgánicos aprobados en el momento (Ver Tabla 4): el óxido de
cinc (ZnO) y el dióxido de titanio (TiO2). Estos son moléculas estables a la luz, sin capacidad de
causar alergias ni sensibilización, ambos pueden alcanzar a brindar protección contra longitudes de
onda de hasta 380 nm (UVA). Actualmente, varios de los protectores solares que hay en el mercado
tienen filtros inorgánicos con formas micronizadas o nano partículas que pueden llegar hasta a ser
de un tamaño de 100 nm.
Tabla 4. Principales Filtros Físicos
Filtros Físicos Radiación a la que actúan
Dioxido de Titanio UVA, UVB, Visible e IR
Oxido de Zinc UVA, UVB, Visible e IR
Mica UVA, UVB, Visible e IR
Tomado de “El sol y la piel” por RIBERA, M., & et al. (2003). (Tercera ed.). Madrid, España: Editorial
Medifam.

CAPITULO II: FUNDAMENTO TEORICO
27
2.3.2.2 Fotoprotectores Biológicos. Son antioxidantes que evitan la formación de radicales libres
por lo que aumentan el sistema inmunológico (Ver Tabla 5).
Llamados también inmunoprotectores solares, son sustancias que estimulan el sistema inmunitario
cutáneo para hacer frente a las radiaciones ultravioleta (UV). Activan los mecanismos internos de
la propia piel, lo que supone un nuevo enfoque de la protección, por lo que en la actualidad son
motivo de numerosos trabajos científicos. Los protectores solares biológicos contribuyen a proteger
la piel sin ser filtros solares, es decir, carecen de capacidad para reflejar o absorber las radiaciones
solares. Por tanto, sirven como complemento, pero no sustituyen los filtros solares físicos y
químicos de las formulaciones cosméticas. Un ejemplo de este tipo de sustancias lo constituye un
activo comercial obtenido de la semilla de soja, que ha demostrado in vitro una alta capacidad de
activación de las proteínas implicadas en la supresión de tumores p53 y p14ARF, así como una
activación de la eficacia reparadora del ADN y menor actividad de la enzima elastasa. Así pues,
estos activos también contribuyen a frenar el proceso de fotoenvejecimiento cutáneo. (JATIVA,
2000)
Tabla 5. Principales Filtros Biológicos
Filtros Biológicos Acción
Tocofenil Acetato Antioxidante
Retinil Palmitato Antioxidante
Pantenol Antioxidante
Acido Ascórbico Antioxidante
Zinc Antioxidante
Magnesio Antioxidante
Tomado de “El sol y la piel” por RIBERA, M., & et al. (2003). (Tercera ed.). Madrid, España: Editorial
Medifam.
2.3.2.3 Fotoprotectores Organominerales. Son un hallazgo reciente y consisten en filtros
químicos insolubles. “Combinan el efecto cosmético de los filtros químicos con la seguridad de los
filtros físicos, ya que no penetran en la piel. Además, actúan por un triple sistema de filtro: por
absorción, por reflexión y por dispersión, poseen gran capacidad filtrante de UVA. (Ver Tabla 6)
Tabla 6. Principales Filtros Organominerales
Filtros Organominerales Radiación a la que actúan
Metileno UVA, UVB
Bis-benzotriazolil UVA, UVB
Tetrametilbutil UVA, UVB
Butilfenol UVA, UVB
Tomado de “El sol y la piel” por RIBERA, M., & et al. (2003). (Tercera ed.). Madrid, España: Editorial
Medifam

CAPITULO II: FUNDAMENTO TEORICO
28
2.3.2.4 Fotoprotectores Químicos. Son sustancias químicas que absorben longitudes de onda del
espectro UV (UVB o UVA) y las transforman impidiendo que las radiaciones afecten a las
estructuras cutáneas (Ver Tabla 7). Actualmente se investigan nuevas moléculas inocuas con
capacidad de filtración del UVA-lejano, causante de las reacciones de fototoxia y fotoalergia. El
uso de fotoprotectores con filtros UVB aumenta la exposición a radiación UVA, ya que al evitar el
eritema alargan la exposición al sol sin filtrar el UVA. Es preciso recordar que esta radiación es la
causante de los daños seniles más significativos de la dermis.
Tabla 7. Principales Filtros Químicos
Filtros Químicos Radiación sobre la que actúan
PABA UVB
Cinamatos UVB
Salicilatos UVB
Benzofenonas UVA, UVB
Antralinatos UVA
Dibenzoilmetanos UVA
Tomado de “El sol y la piel” por RIBERA, M., & et al. (2003). (Tercera ed.). Madrid, España:
Editorial Medifam
De la tabla anterior, el ácido para-amino-benzoico, más comúnmente conocido como PABA, es un
agente usado en las pantallas solares, funciona reflejando los rayos ultravioletas del sol y
convirtiendo la energía de la luz solar en calor. El PABA ha sido también usado por vía oral para el
tratamiento de la constipación, otros desórdenes gastrointestinales y para ayudar a reducir los
síntomas del vitiligo, una enfermedad que se caracteriza por la pérdida del pigmento en zonas
aleatorias de la piel (EHOWENESPAÑOL.COM, 2015).
Las reacciones leves más comunes consisten en erupciones, sudoración, picazón y enrojecimiento.
El PABA usado directamente sobre la piel contribuye a la liberación de radicales libres del oxígeno
los cuales se ha demostrado que favorecen el desarrollo de cáncer. De acuerdo con el centro de
información sobre salud natural, las pantallas a base de PABA dañan el ADN, aumentando el
riesgo de cáncer relacionados con la piel.
Finalmente, las pantallas a base de PABA solo protegen contra el carcinoma, dejando a los usuarios
desprevenidos expuestos al melanoma, otra forma de cáncer de piel que puede ser fatal. Se ha
demostrado recientemente que podría provocar cáncer en las personas que lo usan
(EHOWENESPAÑOL.COM, 2015) .

CAPITULO II: FUNDAMENTO TEORICO
29
2.3.3 Mecanismo de acción de protectores solares. En su mecanismo de acción se utilizan dos
procesos: dispersión y absorción. Los protectores solares tienen sustancias que actúan mediante
ambos mecanismos.
- Dispersión. Ocurre cuando los rayos ultravioleta chocan contra una película o pantalla que
desvía su trayectoria, lo cual permite que se disipe en el entorno, por ejemplo, las pantallas
solares.
- Absorción. En este caso, las moléculas del protector solar absorben la radiación ultravioleta.
Implica la incorporación de energía en la estructura del protector. Los fotones son absorbidos
hasta alcanzar la piel y conducidos en forma de calor (MORENO & MORENO, 2010) .
2.3.4 Factor de Protección Solar. El factor de protección solar (FPS) o índice de protección
solar indica cuánto tiempo más un fotoprotector aumenta la capacidad de defensa natural de la piel
antes de llegar a quemarse una persona, usando un producto de protección frente a un eritema o
enrojecimiento de la piel previo a la quemadura. Por ejemplo, una persona de piel clara que
normalmente empieza a quemarse después de 10 minutos al sol, tardaría 15 veces ese tiempo con
un SPF 15 (150 minutos o 2.5 horas). El FPS indica el tiempo que puede exponerse la piel
protegida sin quemarse frente a la radiación ultravioleta (Ver Tabla 8).
Tabla 8. Capacidad de Protección en base al FPS
Capacidad de proteccipon del Fotoprotector FPS
Bajo
Medio
Alto
Muy alto
Ultra
2-4-6
8-10-12
15-20-25
30-40-50
50+
Tomado de “El sol y la piel” por RIBERA, M., & et al. (2003). (Tercera ed.). Madrid, España:
Editorial Medifam
En la práctica, la protección de un protector solar en particular depende de factores tales como:
- Tipos de bloqueador solar
- El tipo de piel de la persona
- La cantidad aplicada de protector solar y la frecuencia de aplicación.
- Actividades realizadas durante la exposición al sol (por ejemplo, nadar lleva a la pérdida del
protector solar de la piel en menor tiempo).
- Cantidad de protector solar que la piel ha absorbido.
Las pieles claras son mucho más sensibles al sol que las oscuras. Se definen principalmente estos
dos fototipos de piel (Ver Tabla 9):

CAPITULO II: FUNDAMENTO TEORICO
30
Tabla 9. Niveles de Radiación según el Fototipo de Piel
Nivel de radiación
(UVI)
Piel Clara Piel Oscura
Exposición máx.
sin protección
Índice
protección
indicado
Exposición máx.
sin protección
Índice
protección
indicado
0-2 (bajo) 80 minutos 15 110 minutos 8
3-5 (moderado) 40 minutos 25 60 minutos 15
6-7 (alto) 25 minutos 30 35 minutos 25
8-10 (muy alto) Verano 20 minutos 50+ 30 minutos 30
11+ (extremo) Verano 15 minutos 50+ 25 minutos 50+
Tomado de “Recomendaciones orientativas del departamento de sanidad y seguridad social según el UVI
(nivel de radiación)” por DERMA. (29 de Mayo de 2015 ). Recuperado el 14 de Junio de 2015 (11h23), de
http://www.centroderma.com/consejos-para-tomar-el-sol/
2.3.5 Parámetros de evaluación en fotoprotección. Son los siguientes:
2.3.5.1 Eficacia. La eficacia se mide con el factor de protección solar, especialmente en dosis
eritematógenas de rayos UVB y UVA II, hasta 340 nm. Una medida que complementa el factor de
protección solar, es la de espectrofotometría in vitro. Con ésta se establece como parámetro la
longitud de onda, entre 290 nm y 400 nm, a la cual el protector solar absorbe 90% de la radiación
UV.
Un consenso de la American Academy of Dermatolog y establece que el protector solar de amplio
espectro debe cubrir una longitud de onda de más de 370 nm y un factor de protección contra UVA
mayor de 4.
Para evaluar la eficacia de los protectores contra la UVA, se valoran la pigmentación inmediata
producida por la UVA y el espectro visible formado por la melanina existente. Estos parámetros
tienen el inconveniente de que son difíciles de medir en pacientes con piel de fototipo I y II. Es
diferente a la respuesta pigmentaria tardía, evaluada después de dos horas de exposición, ya que
esta última es más fácil de reproducir.
2.3.5.2 Seguridad. La seguridad se evalúa según los efectos después de la aplicación del producto
en la piel, como irritación, sensibilidad, penetración dérmica y déficit de vitamina D, que podría
llevar a poca absorción de calcio.
El uso de protectores solares puede hacer que las personas se confíen y aumenten el tiempo de
exposición solar, lo cual, a su vez, aumenta el riesgo de carcinoma de piel.

CAPITULO II: FUNDAMENTO TEORICO
31
2.3.5.3 Sustantividad. Es la característica de los protectores solares de reflejar su efectividad ante
eventos o situaciones adversas, como la exposición al agua y al sudor.
Un protector solar se considera resistente al agua sólo si puede mantener su factor de protección
solar original después de dos inmersiones de 20 minutos y, muy resistente al agua, si mantiene su
efectividad después de cuatro inmersiones de 20 minutos cada una.
2.3.6 Criterios para utilizar un filtro solar. El filtro solar debe ser seguro, eficaz, y
cosméticamente aceptable. A la hora de recomendar un filtro solar deberemos tener en cuenta tres
consideraciones:
- El fototipo frente al sol.
- El factor de protección solar (FPS) del filtro recomendado
- El tipo de piel (VERSCHOOTEN, 2006).
La cantidad de protector aplicada es el factor más importante, porque las personas se aplican
cantidades menores a las utilizadas en la prueba (2 mg/cm2), y se olvidan de aplicarlo en sitios
como la espalda, el cuello y las orejas. Los protectores inorgánicos se aplican en menor cantidad
que los orgánicos, debido a la apariencia de mimo que puede dejar, la cual generalmente disgusta al
usuario (VERSCHOOTEN, 2006).
2.4 FORMAS FARMACÉUTICAS DE APLICACIÓN TÓPICA
Las afecciones dermatológicas se caracterizan por presentar alteraciones en la estructura y
funcionalidad de la piel, que actúa como un órgano de reacción ya que es rápida en la expresión de
sus trastornos.
Con este tipo de preparados se persiguen exclusivamente efectos localizados en la piel (epidermis o
dermis) o mucosa; debe evitarse o reducir al máximo la absorción transcutánea de componentes, o
de producto activo presentes en el mismo que puedan provocar efectos secundarios o no deseados.
2.4.1 Formas Farmacéuticas Semisólidas.
Las afecciones dermatológicas se caracterizan por presentar alteraciones en la estructura y
funcionalidad de la piel, que actúa como un órgano de reacción ya que es rápida en la expresión de
sus trastornos.
Con este tipo de preparados se persiguen exclusivamente efectos localizados en la piel (epidermis o
dermis) o mucosa; debe evitarse o reducir al máximo la absorción transcutánea de componentes, o
de producto activo presentes en el mismo que puedan provocar efectos secundarios o no deseados.
2.4.1.1 Características de las Formas Farmacéuticas Semisólidas.
- La consistencia debe permitir una fácil aplicación.

CAPITULO II: FUNDAMENTO TEORICO
32
- El producto terminado debe tener buenas características organolépticas y no debe manchar la
piel.
- No debe causar reacción alérgica en la piel después de su aplicación.
- Buena estabilidad, físico, químico y microbiológico.
2.4.1.2 Clasificación de las Formas Farmacéuticas Semisólidas.
En la figura (Ver Figura 16) se detalla la clasificación de las formas de aplicación tópica
(SALAZAR, 2001).
Figura 16. Clasificación de las Formas Farmacéuticas Semisólidas
Tomado de “Dermatite atopique” por FONDATION POUR LA DERMATITE ATOPIQUE -
RECHERCHE. (16 de Mayo de 2014 ). Recuperado el 02 de Mayo de 2015 (14h33), http://www.fondation-
dermatite-atopique.org/es/espacio-profesionales-de-la-salud/scorad-y-po-scorad#arrivee_scorad
2.4.2 Formas Farmacéuticas Semisólidas de Aplicación Tópica. Las formas farmacéuticas
semisólidas poseen una buena adherencia y grado de absorción, lo que permiten el mantenimiento
de una fina película sobre la superficie de aplicación hasta que se eliminan por factores externos
como el lavado.

CAPITULO II: FUNDAMENTO TEORICO
33
2.4.2.1 Cremas: Descripción y Tipos. Son la forma de producto cosmético más comunes hasta
ahora representa el 90% de las preparaciones, que se encuentran en el mercado y que tienen más
aceptación por parte del consumidor.
Las cremas son emulsiones, formados por dos líquidos no miscibles, en el que uno de ellos está
disperso en el otro en forma de pequeñas gotas.
La clasificación más exacta son las características fisicoquímicas:
- Cremas Medicamentosas.- son las que se encuentran destinadas al tratamiento y curación de
la piel enferma o lesionada.
- Cremas cutáneas.- son las que están destinadas al cuidado y embellecimiento de la piel. Estas
se clasifican según el tipo de emulsiones que forman:
Cremas hidrófilas (Ac/Ag).- la fase externa es de naturaleza acuosa debido a la presencia
en su composición de tensioactivos tipo Ac/Ag.
Cremas lipófilas (Ag/Ac).- la fase continua o externa es la fase lipófila debido a la
presencia en su composición de tensioactivos tipo Ag/Ac.
Las cremas poseen las siguientes características:
- Buena tolerancia no deben producir irritación.
- Inertes en relación al principio activo compatibilidad físico-química, material empaque-envase.
- Estabilidad frente a factores ambientales (temperatura, humedad).
- Consistencia apropiada debido a su extensión sobre la piel.
- Capacidad para la incorporación de sustancias solubles tanto en agua como en aceite.
- Capacidad para actuar en cualquier tipo de piel.
- Facilidad y rapidez de transferencia del principio activo o sustancias activas a la piel.
- No producir deshidratación de la piel. (MARTIN, 2005)
2.4.2.2 Componentes generales de una crema. Las cremas por lo general están compuestas por:
Principio activo, Vehículos, Hidrofilicos (agua destilada), Lipofilicos (hidrocarburos oleosos y
ceras), Aceites vegetales, Ésteres, Alcoholes superiores, Ácidos grasos, Hidratantes / Humectantes,
Emulsificantes / Tensioactivos, Conservadores (Antimicrobianos, Antioxidantes), Colorantes, y
Perfumes.
- Principio activo. Los principios activos empleados por vía tópica deben tener las siguientes
características: (DE LA CADENA, 2010)
Presentar una alta especificidad.

CAPITULO II: FUNDAMENTO TEORICO
34
Que al absorberse sobre la piel no incremente los efectos sistémicos no deseados.
Cuando se desea que el principio activo sea absorbido, debe ser liberado fácilmente del
vehículo.
La efectividad del principio activo depende de la absorción percutánea que se la conoce como
la penetración de una sustancia en la piel, incluyendo su llegada al torrente circulatorio.
La absorción percutánea de un principio activo no depende solamente de las cualidades físicas
y químicas de la droga, sino del comportamiento del vehículo y de las condiciones de la piel.
- Vehículos. Para seleccionar a los vehículos se debe realizar un estudio sobre su utilización
concreta. Entre sus características generales se mencionan:
Deben poseer su pH próximo al de la piel (5 – 5,5).
Los vehículos deben tener buenas propiedades reológicas.
Facilidad de eliminación
No deben manchar ni la piel, ni los tejidos.
No deben presentar efectos de irritación primaria, ni secundaria, ni sensibilizaciones.
Buena estabilidad física, química y microbiológica.
Entre sus características específicas, se consideran las siguientes:
La miscibilidad del vehículo con la capa epicutánea de la piel.
Deben tener un buen poder absorbente de exudados, especialmente para tratamiento de
lesiones sobre la piel.
Debe tener un buen poder protector.
La posibilidad de resistir la esterilización.
Tener una buena capacidad de ceder el principio activo.
El vehículo debe elegirse cuidadosamente de acuerdo con su inocuidad, compatibilidad,
estabilidad y tolerancia, de ahí la importancia de formular una excelente emulsión base, que
permita asegurar un producto final óptimo.
- Conservadores. Los conservadores tienen como misión evitar el deterioro de la crema. Los
conservadores antimicrobianos son los encargados de mantener al producto sin contaminación
microbiana. (VALDIZAN, 1983).
Los conservadores antimicrobianos son los que se encargan de evitar:
La oxidación de las grasas
La fermentación de los hidratos de carbono
La putrefacción de las proteínas.
Por tanto, la sustancia conservadora a utilizar estará en función de los componentes que
predominen en la crema.

CAPITULO II: FUNDAMENTO TEORICO
35
- Colorantes. Componentes destinados a producir sensaciones visuales, van incorporados en
algunas cremas como agentes de su acción específicamente decorativa. La adición de
colorantes tiene como única finalidad exaltar el atractivo de su presentación. (VALDIZAN,
1983).
- Perfumes. Destinados a producir sensaciones olfativas, suelen ir asociados con los colorantes
(aroma de fresa – color fresa). Su finalidad es la de exaltar el atractivo de la crema para
aumentar las ventas. (VALDIZAN, 1983).
2.5 PRE-FORMULACIÓN
Un estudio de pre-formulación abarca desde la recopilación de información bibliográfica de todos
los componentes que contendrá la formulación final con el fin de evaluar las características físicas,
incompatibilidad y estabilidad frente a agentes externos como propios de la formulación, hasta el
desarrollo de pequeños lotes pilotos para evaluar las características que presenta ya en la práctica.
A continuación se describe cada una de las materias primas de la pre-formulación:
2.5.1 Urea. La urea, presente naturalmente en el cuerpo humano, es la principal forma de
eliminación de los compuestos nitrogenados (procedentes del metabolismo de los ácidos aminados
en el ser humano). El hígado degrada los ácidos aminados en urea.
Presente en la epidermis, procede esencialmente de las glándulas sudoríparas y forma parte de los
compuestos higroscópicos del stratum corneum que constituyen el factor natural de hidratación
(Natural Moisturizing Factor). Se utiliza en productos dermatológicos y cosméticos, como las
cremas, las leches corporales y en los geles.
La urea está presente en todos los productos indicados para tratar la xerosis, la ictiosis y estados
hiperqueratósicos localizados. La urea se utiliza a menudo en el tratamiento de las dermatitis
atópicas, psoriasis, en las que la sequedad cutánea constituye uno de los factores predominantes de
su aparición.
Además, la urea resulta tener una actividad antibacteriana, un efecto autorregulador (un exceso de
urea no provoca un exceso de hidratación) y tiende a favorecer la penetración de los activos.
Perfectamente tolerada, penetra muy fácilmente en la epidermis. La urea empleada en los
cosméticos se obtiene exclusivamente mediante síntesis, según un procedimiento no contaminante,
y su uso está autorizado en los cosméticos.
2.5.1.1 Mecanismo de Acción. La urea facilita la eliminación de la descamación, la renovación de
los corneocitos y constituye un agente hidratante privilegiado para la epidermis.

CAPITULO II: FUNDAMENTO TEORICO
36
La urea se emplea tradicionalmente en dermatología para el tratamiento de las pieles secas,
principalmente porque es capaz de romper los enlaces hidrógeno de las cadenas proteicas y de
alterar su configuración y agregación. Por consiguiente, en concentraciones fuertes (por encima del
3%), ejerce un efecto queratolítico y aumenta la permeabilidad cutánea. En concentración igual o
inferior al 3%, favorece el enlace del agua en las cadenas proteicas.
Es higroscópica y hace más hidrófilas a las células epidérmicas
Tópicamente, la urea facilita la hidratación de la piel al fijarse al estrato córneo, lo que origina una
mayor afinidad de este tejido hacia el agua. Además, la urea tiene una actividad queratolítica en la
piel hiperqueratósica.
2.5.1.2 Farmacocinética. Esta molécula químicamente muy simple, por su extrema afinidad con
el agua, su naturaleza no iónica y su capacidad para generar enlaces hidrógeno, es capaz de
interactuar con las proteínas y las estructuras complejas biológicas. Puede facilitar la retención de
agua y en concentraciones fuertes, disociar y solubilizar las estructuras biológicas. Sus propiedades
osmóticas celulares son bien conocidas en farmacia y difieren de las sales minerales.
A nivel cutáneo, su poder humectante se aprecia en concentraciones de rango porcentual (1% a
5%). Posee propiedades queratolíticas en fuertes dosis (en torno al 5%) provocarían un efecto
queratolítico suficiente para acelerar la renovación epidérmica y una estimulación global de la piel.
Esto ha permitido proponer este activo para el fotoenvejecimiento como alternativa.
En concentraciones “extremas” (20% y más), los productos se vuelven muy “disolventes”, hasta el
punto de permitir, bajo oclusión, por ejemplo, la avulsión ungueal para tratar onicomicosis.
Las concentraciones altas permiten también la “limpieza” de las placas de psoriasis y otras
queratosis (palmar, plantar). Muchas preparaciones magistrales dermatológicas acreditan su uso.
La actividad de la molécula es muy dependiente de la fórmula galénica, no hay que buscar una
penetración profunda, ya que las acciones conocidas son epidérmicas, pero el uso concomitante de
un cuerpo graso “pantalla protectora” influirá en gran medida en el resultado obtenido y en los
efectos asociados a las concentraciones.
2.5.2 Filtros Solares Físicos.
- Nombre INCI(s): Dicapril Carbonato (y) Dióxido de titanio (y) Ácido polihidroxiesteárico
(y) Alúmina (y) Ácido esteárico (y) Dimeticona.
Descripción Química: Dispersión de dióxido de titanio microfino en una mezcla de emolientes.
Ejemplo de uso: Es una dispersión líquida fácil de manejar (procesable en frío). Se utiliza para
elaborar formulaciones cosméticas con propiedades de protección UV (UVB / UVA).
2.5.3 Filtros Solares Químicos.

CAPITULO II: FUNDAMENTO TEORICO
37
- Nombre INCI: Metilen-bis-benzotriazolil tetrametilbutilfenol (MBBT)
Descripcion: Es el primer filtro solar que utiliza la tecnología de partículas microfinas con
doble acción, tanto como un micropigmento como un absorbente UV.
Deriva de un sólido orgánico absorbente UV, sin color, que ha sido micronizado a partículas
inferiores a los 200 nm de diámetro, siendo inherentemente foto estable.
Es un protector altamente eficiente debido a su triple acción: Absorción UV a través de una
molécula orgánica foto-estable, esparcimiento de la luz y reflexión de la misma por su
estructura microfina.
Aplicaciones: No solo puede ser incorporado en los protectores solares, sino también en
productos de cuidado diario de la piel, así como productos para aclarar la piel.
Características / beneficios:
Amplia cobertura de la radiación UV-B y UV-A
Facilidad de formulación
Excelente compatibilidad con los ingredientes cosméticos y otros filtros UV
Capacidad de fotoestabilizar otros filtros UV
Efecto sinérgico con filtros UV-B (Incrementa el Factor de Protección Solar SPF)
- Nombre INCI: Etilhexil Metoxicinamato
Descripción: Es un absorbente de radiación UV-B altamente eficaz y tiene absorción adicional
en el espectro de UVA de onda corta. Es soluble en aceite y prácticamente sin olor adecuado
para una amplia variedad de aplicaciones cosméticas. A temperaturas tan bajas como -10°C
sigue siendo un líquido y puede aumentar el factor de protección solar (SPF) cuando se utiliza
en combinación con otros filtros UV.
Es ideal para la formulación de productos de protección solar resistentes al agua. También es
un excelente solubilizante para filtros UV cristalinos. La máxima concentración varía de
acuerdo con la legislación local, pero es un absorbente UVB seguro y eficaz.
- Nombre INCI: 2- (2-hidroxibenzoil-4-dietilamino) - hexiléster de ácido benzoico
Propiedades y aplicaciones: Es un filtro UVA orgánico fotoestable que cubre largas longitudes
de onda del espectro UVA. El producto tiene una buena solubilidad en aceites y es compatible
con otros ingredientes, por ejemplo, óxido de titanio micronizado (TiO2) y óxido de Zinc
(ZnO). Debido a su alto punto de fusión (54 ° C) el producto es en forma de cristales de color
amarillo. Su fotoestabilidad proporciona una fiable y eficiente protección solar para todo el día.
- Nombre INCI: 2,4,6-trianilino-p- (carbo-2'-etil-hexil-1'-oxi) -1,3,5-triazin

CAPITULO II: FUNDAMENTO TEORICO
38
Propiedades y aplicaciones: Es un filtro muy eficaz UVB con una capacidad de absorción
excepcionalmente alta. Debido a su alto valor de absorción, se utiliza en pequeñas
concentraciones en preparaciones cosméticas de protección solar y logra obtener un alto factor
de protección solar (SPF). Se recomiendan concentraciones de hasta 3%.
Su naturaleza polar le proporciona buena afinidad a la queratina de la piel, por lo que las
formulaciones en las que se utiliza son particularmente resistentes al agua. Esta propiedad se ve
reforzada aún más por su insolubilidad completa en agua.
- Nombre INCI: Bis - etilhexiloxifenol metoxifenil triazina
Características: Ofrece protección altamente eficaz de UVA y UVB de amplio espectro,
presenta alta foto-estabilidad, es compatible con filtros orgánicos e inorgánicos, y cumple con
los requisitos de alta seguridad. Es soluble en aceite, propiedad que le genera alta resistencia al
agua. Este producto cumple con los requisitos de protección UV más exigentes de todo el
mundo para las cremas de protección solar.
2.5.4 Emolientes.
- Nombre INCI: Carbonato de Dicaprililo
Características y aplicaciones: es un emoliente de extensión rápida, se utiliza en aplicaciones
cosméticas para pieles secas en donde genera un efecto de terciopelo y es particularmente
adecuado para formulaciones de protección solar debido a sus capacidades de solubilización,
además de ser adecuado para la dispersión de pigmentos. Se trata de un aceite transparente,
incoloro, casi inodoro de baja polaridad con bajo peso molecular y un alto valor de difusión.
- Nombre INCI: C12-15 alquil benzoato
Características y aplicaciones: Es un éster emoliente producido a partir de ácido benzoico y
alcoholes C12-15. Proporciona una sensación lubricante, sin embargo, tiene la elegancia y el
atractivo deseable de un emoliente ultrafino. Aunque sus usos principales son como emoliente,
disolvente y solubilizante, además ofrece a los formuladores los beneficios de un ingrediente
realmente multifuncional y es adecuado para una variedad de aplicaciones en la protección
solar, cuidado del cabello, maquillaje y artículos de aseo, así como en el cuidado de la piel.
- Nombre INCI: PPG-15 estearil éter
Características: Es un emoliente que aporta una sensación aterciopelada, además de excelente
hidratación y elasticidad de la piel, a las formulaciones para el cuidado de la piel. Ofrece

CAPITULO II: FUNDAMENTO TEORICO
39
excelentes propiedades de solvencia y se puede utilizar para formar emulsiones oleosas.
Permite que los formuladores adapten la sensación en la piel a través de una amplia gama de
productos de consumo. Es notablemente no oclusivo y permite la facilidad de la aplicación del
producto. Los productos que contienen este componente han reducido la fricción, en particular
sobre la piel húmeda.
2.5.5 Emulsificantes.
- Nombre INCI: Estearato de glicerina y sodio estearoil lactilato y alcohol cetearílico
Características: Es un sistema de bases autoemulsionantes se construyen con ingredientes de
origen natural para imitar una barrera lipídica natural de la piel. Es un producto
extremadamente suave y no irritante que posee una afinidad única para la piel, confiere
beneficios tales como la hidratación, sensación de suavidad y resistencia al desgaste.
Aplicaciones: Es un sistema básico auto-emulsionante, si es lo suficientemente flexible como
para ser incorporado en una amplia gama de formulaciones cosméticas y de cuidado personal.
- Nombre INCI: Potasio cetil fosfato
Características: es un polvo inodoro color blanco a beige. Se dispersa en agua caliente,
logrando aclarar soluciones opacas. En general, es dispersa en la fase oleosa de las
formulaciones.
Aplicaciones: Es un emulsionante para fabricar productos de cuidado de la piel, homogéneos y
muy estables en un amplio rango de pH. Excelente candidato para formulaciones de protección
solar resistentes al agua.
2.5.6 Estabilizador de emulsión.
- Nombre INCI: Cetyl alcohol
Descripción: Se trata de una mezcla de alcoholes alifáticos sólidos, cuyo componente principal
es el alcohol cetílico.
Normalmente se obtiene por saponificación del espermaceti o esperma de ballena (grasa de las
cavidades del cráneo de las ballenas), o por hidrogenación catalítica de los triglicéridos del
aceite de coco o de grasas animales.
Propiedades y usos: Base anhidra que aunque es insoluble en agua es capaz de fijar agua
(hidrófila) formando emulsiones W/O, por lo que puede incorporar sustancias solubles en agua.
Habitualmente estas emulsiones no son lavables.

CAPITULO II: FUNDAMENTO TEORICO
40
No es irritante y tiene acción emoliente por impedir la desecación de la epidermis en su capa
córnea al retardar la evaporación del agua de la superficie cutánea, quedando la piel más blanda
y flexible.
Se usa como constituyente de cremas y pomadas, especialmente en aquellas en las que se desea
incorporar agua, teniendo la ventaja sobre la lanolina de no poseer olor desagradable.
También se usa para aumentar la viscosidad de las cremas.
- Nombre INCI: Xanthan gum.
Descripción: Goma producida normalmente por fermentación y purificación de un carbohidrato
en cultivo puro de Xanthomonas campestris y posterior purificación, que es la sal sódica,
potásica, o cálcica de un polisacárido de alto peso molecular que contiene D-glucosa, D-
manosa, ácido D-glucurónico, y ácido pirúvico.
Propiedades y usos: Es de naturaleza aniónica, con un pH de estabilidad de entre 4 y 11. Forma
geles no transparentes, de color blanquecino y traslúcido, de consistencia media, mayor o
menor según la concentración de goma utilizada. La gelificación es instantánea y el aspecto del
gel mejora al cabo de 24 horas. Los geles que forma son muy refrescantes y no adhesivos,
soportan bastante bien los electrolitos y admiten la incorporación de alcohol hasta un 30 %.
Se emplea en la industria farmacéutica como agente suspensor, estabilizante, espesante y
emulsionante, así como para preparar la matriz de comprimidos de liberación sostenida y para
retrasar la absorción de los principios activos.
2.5.7 Acondicionador/Humectantes.
- Nombre INCI: Hidrogenado Brassica Campestris / Aleurites Fordi Petróleo copolímero
(y) hidrogenada hidrogenado Brassica Campestris / Aleurites Fordi Petróleo copolímero /
Aleurites Fordi Petróleo Copolímero
Características: es un polímero natural para aplicaciones de la piel, el sol y el cuidado del
cabello. En base a sus excelentes propiedades de formación de película, puede mejorar la
hidratación, fijar principios activos en la piel y aumentar lustre y brillo. También es eficaz
como acondicionador, hidratante y genera resistencia al agua.
- Nombre INCI: Glycerin.
Descripción: Se obtiene principalmente de aceites y grasas como producto intermedio en la
fabricación de jabones y ácidos grasos. Puede ser obtenida de fuentes naturales por
fermentación, o por ejemplo melaza de remolacha azucarera en la presencia de grandes
cantidades de sulfito de sodio. Sintéticamente, la glicerina se puede preparar mediante la
cloración y saponificación de propileno.

CAPITULO II: FUNDAMENTO TEORICO
41
Propiedades: Es un agente deshidratante osmótico con propiedades higroscópicas y lubricantes.
Tiene también acción antiflogística local y tópica. Es emoliente, protege y ablanda la piel. Es
un buen disolvente de sustancias orgánicas y minerales.
Aplicaciones:
En todo tipo de formas tópicas para casos de piel seca, asperezas cutáneas, ictiosis, eczemas no
rezumantes.
2.5.8 Extractos Naturales.
- Nombre INCI: Aloe Barbadensis Leaf Juice
Descripción: Es un gel concentrado y estabilizado a partir del parénquima fresco de las hojas
del Aloe barbadensis (Aloe vera), cuidadosamente procesado al vacío a bajas temperaturas y
conservado. La relación de principios activos con respecto a la planta es 1:1.
Propiedades: Tiene efecto tópico principalmente como emoliente, calmante, refrescante,
hidratante y antiinflamatorio.
Por su capacidad de retención de agua, el gel se usa cuando se requiere hidratación y suavidad
y produce efectos sinérgicos en combinación con otros hidratantes y humectantes cutáneos
como la glicerina y el propilenglicol.
Es antiinflamatorio, pero a diferencia de los corticoides además actúa a nivel celular
provocando la reparación del tejido.
Aplicaciones: Se utiliza para proteger pieles con eccemas secos, escoceduras e irritaciones
cutáneas, eritemas, quemaduras, acné, heridas y úlceras tróficas, psoriasis, gastritis, úlceras
gastroduodenales, síndrome del intestino irritable, blefaritis, y conjuntivitis.
Así mismo también puede usarse en productos cosméticos y capilares: preparados solares,
hidratantes, after-sun, aftershave, líneas de baño, higiene infantil, geles y lociones.
2.5.9 Antioxidantes.
- Nombre INCI: Tocopheryl acetate
Descripción: Con el nombre de Vitamina E existen varios compuestos, denominados
Tocoferoles, que los podemos encontrar como α-tocoferol, β-tocoferol, γ-tocoferol, y delta-
tocoferol, siendo el primero el más activo como vitamina y el usado en terapéutica (así como
sus ésteres con acetato y succinato), y el último el más activo como antioxidante.
Normalmente se aísla del aceite de gérmen de trigo por saponificación, por encontrarse en altas
proporciones en éste aceite así como en el aceite de arroz, en verduras como la lechuga, etc.
Propiedades y usos: Es una vitamina liposoluble, cuyo papel principal es prevenir la oxidación
de los ácidos grasos poliinsaturados. Reacciona con los radicales libres de oxígeno, que son los

CAPITULO II: FUNDAMENTO TEORICO
42
causantes del daño oxidativo de las grasas de las membranas celulares, evitando la formación
de otros radicales libres en el proceso .Tiene capacidad de prevenir eritemas solares
(reduciendo el proceso inflamatorio y el incremento de la permeabilidad vascular), así como la
formación de manchas cutáneas de lipofucsina.
Es un buen antioxidante. Esta capacidad se potencia cuando se asocia a la vitamina C
(palmitato de ascorbilo) en la proporción de 1:5, protegiendo a fórmulas ricas en lípidos
insaturados y para realizar una actividad secuestradora de radicales libres.
Tiene acción hidratante de la piel.
Estas actividades antioxidantes e hidratantes explican que se pueda mejorar el aspecto de la
piel senil, sus arrugas y su sequedad, estando indicada para el envejecimiento cutáneo.
Tiene un efecto protector sobre los daños degenerativos que sufre el tejido conjuntivo (elastosis
y pérdida de funcionalidad de las fibras de colágeno).
- Nombre INCI: Pentaeritritilo hidroxihidrocinamato tetra-di-t-butilo
Descripción: Antioxidante soluble en aceite.
Características: Es un antioxidante fenólico que es un estabilizador de decoloración muy eficaz.
Se utiliza para prevenir la degradación de productos sensibles a la oxidación. Los buenos
perfiles toxicológicos y eco-toxicológicos proporcionan soluciones a las actuales discusiones
controversiales relacionadas con la toxicología. Es ideal para los aceites, grasas y fragancias
en el entorno lipófilo.
Aplicaciones: En jabón en barra, labiales, desmaquillantes, aceites, cremas, emulsiones y otras
formulaciones basadas en aceites y grasas.
Es compatible con la mayoría de formulaciones basadas en aceites. Puede usarse también en
formulaciones basadas en alcohol y emulsiones. En las emulsiones, puede agregarse
directamente a la fase oleosa. La incorporación a través de la fragancia también es posible.
2.5.10 Agentes Quelantes.
- Nombre INCI: Etilendiaminotetraacetato disódico
Propiedades y usos: Se utiliza principalmente como agente quelante de iones divalentes o
trivalentes en la industria farmacéutica, cosmética y alimentaria.
También se utilizan como antioxidantes, solos o como sinérgicos de otros antioxidantes, por
secuestrar trazas de iones metálicos (como cobre, hierro, manganeso…), que pueden catalizar
reacciones de oxidación.
- Nombre INCI: Polydimethlysiloxane

CAPITULO II: FUNDAMENTO TEORICO
43
Características: Agua clara fluido de silicona disponible en viscosidades que van desde 0,65 a
60.000 cst (mm /s).
Aplicaciones: Es un ingrediente importante en cremas para las manos, protectores solares de la
piel, lociones bronceadoras, y el cuidado del cabello, ya que forma una película no grasa
protectora que resiste irritaciones de la piel por el agua y el sol, sin embargo, permite que la
piel respire.
2.5.11 Conservantes.
- Nombre INCI: Fenoxietanol (y) Metilparabeno (y) Etilparabeno (y) Butilparabeno (y)
Propilparabeno (y) isobutilparaben
Características: Es un conservante líquido totalmente activo adecuado para la protección de las
aplicaciones cosméticas y farmacéuticas. Posee gran actividad anti-microbiana y rápida
actividad microbiocida frente a bacterias Gram negativas, así como bacterias Gram positivas,
levaduras y mohos.
2.5.12 Regulador de pH.
- Nombre INCI: Ácido 2-hidroxi-1,2,3-propanotricarboxílico.
Propiedades y usos:
Como regulador del pH. La forma monohidrato potencia esta acción acidificante.
Como sinérgico para aumentar la efectividad de los antioxidantes. Su mecanismo de acción se
basa en formar complejo con los metales que catalizan las reacciones de oxidación.
2.6 CONTROL DE CALIDAD DEL PRODUCTO TERMINADO
Son pruebas que se realizan para determinar la integridad del producto y advertir al analista si
existe contaminación o alteración del mismo, son pruebas subjetivas debido a que dependen del
analista.
Las propiedades importantes que deben controlarse en cada lote de fabricación son: las propiedades
organolépticas, la viscosidad, el pH, la densidad y la homogeneidad de la emulsión.
2.6.1 Controles organolépticos. Las propiedades organolépticas son muy importantes, puesto
que son las que el cliente percibe al abrir el empaque. Estas se refieren al color, el olor y el aspecto
de la emulsión.

CAPITULO II: FUNDAMENTO TEORICO
44
2.6.1.1 Color. Característica de cada producto, no debe cambiar durante el transcurso de
almacenamiento del producto, un cambio en el color puede indicar contaminación o degradación
del principio activo o excipientes.
2.6.1.2 Olor. Característica de cada producto, no debe cambiar durante el transcurso de
almacenamiento del producto, un cambio en el olor puede indicar contaminación o degradación del
principio activo o excipientes.
2.6.1.3 Aspecto. Debe ser homogéneo, sin la presencia de cristales o grumos, este debe
permanecer constante debido a que un cambio en el aspecto puede significar la separación de las
fases u otro tipo de proceso degradativos.
2.6.2 Control Físico. Se evalúan las siguientes propiedades fisicoquímicas:
2.6.2.1 pH. El pH de las emulsiones debe ser estable bajo cualquier condición, porque la mayoría
de los iones reactivos están neutralizados. Los iones hidrónio del ácido esteárico son los principales
causantes de los valores de pH de las emulsiones cosméticas. Este valor es propio de cada
producto elaborado debido a que depende de las características del principio activo y del lugar de
aplicación del mismo.
2.6.2.2 Viscosidad. Es la medida de la fluidez de la emulsión preparada, el valor de este parámetro
depende del tipo de emulsión y de las características del producto terminado. La viscosidad
también se ve influida por la cantidad de grasas que contiene la fase oleosa, así como del tipo y
cantidad de emulsificante, en este caso la estandarización del ácido esteárico influye en la
viscosidad final de la emulsión.
2.6.2.3 Extensibilidad. Se puede definir como el incremento de superficie que experimenta una
cierta cantidad de semisólido cuando se la somete a la acción de pesos crecientes, en intervalos
fijos de tiempo.
2.6.2.4 Peso Específico. Se realiza esta prueba para obtener lotes homogéneos en peso después del
proceso de llenado en el envase, se acepta una variante en el peso declarado de más 2%. Un
cambio en el peso significa que existe una modificación o alteración en la fórmula original de la
emulsión.

CAPITULO II: FUNDAMENTO TEORICO
45
2.6.3 Control Microbiológico. Las pruebas microbiológicas (Recuento de Mesófilos, hongos,
levaduras y determinación de Objetables) se realizará una vez obtenidos los productos terminados
y una vez culminado el estudio de estabilidad, en donde se determina la cantidad de
microorganismos que se encuentran presentes en el producto terminado.
2.6.4 Estabilidad de medicamentos. La estabilidad “es la capacidad que tiene un producto o un
principio activo de mantener determinado tiempo sus propiedades originales dentro de las
especificaciones de calidad establecidas, o las propiedades iníciales”
Son pruebas que se efectúan a un medicamento para determinar el periodo de caducidad y las
condiciones de almacenamiento en que sus características físicas, químicas, microbiológicas y
biológicas permanecen dentro de límites especificados, bajo la influencia de diversos factores
ambientales como temperatura, humedad y luz.
- Periodo de Vida Útil. Es el intervalo de tiempo desde la elaboración del medicamento hasta
que ya no cumple con las especificaciones físicas, químicas y microbiológicas establecidas en
farmacopeas oficiales.
- Fecha de caducidad. Es la fecha límite que al ser pasada ya no cumple con las especificaciones
establecidas en farmacopeas oficiales.
Los factores que pueden tener influencia en la estabilidad de los productos cosméticos se dividen
en variables intrínsecas a la formulación y variables extrínsecas a ésta, todas referentes a las
influencias del medio ambiente a que el producto estará expuesto.
2.6.4.1 Estudio de Estabilidad Preliminar o Stress Térmico. El estudio de estabilidad preliminar
consiste en la realización de la prueba en la fase inicial del desarrollo del producto, utilizándose
diferentes formulaciones de laboratorio y con duración reducida.
Emplea condiciones extremas de temperatura con el objetivo de acelerar posibles reacciones entre
sus componentes y el surgimiento de señales que deben ser observadas y analizadas conforme las
características específicas de cada tipo de producto. (Fernandez, 2001-2002)
Se trata de un estudio predictivo que puede ser empleado para estimar el plazo de validez del
producto. Además, puede ser realizado cuando existan cambios significativos en ingredientes del
producto y/o del proceso de fabricación, en material de acondicionamiento que entra en contacto
con el producto, o para validar nuevos equipamientos o fabricación por terceros.
La estabilidad de las emulsiones depende del tamaño de partícula, la diferencia de densidad de
ambas fases, la viscosidad, las cargas de las partículas, la cantidad del emulsificante y otras

CAPITULO II: FUNDAMENTO TEORICO
46
propiedades. También de las circunstancias de almacenamiento, temperaturas altas y bajas, la
agitación y vibración, la dilución o evaporación durante el almacenamiento o el uso.
2.7 FUNDAMENTO LEGAL
2.7.1 CONSTITUCIÓN DE LA REPÚBLICA DEL ECUADOR
“Art. 32.- La salud es un derecho que garantiza el Estado, cuya realización se vincula al ejercicio
de otros derechos, entre ellos el derecho al agua, la alimentación, la educación, la cultura física, el
trabajo, la seguridad social, los ambientes sanos y otros que sustentan el buen vivir. El Estado
garantizará este derecho mediante políticas económicas, sociales, culturales, educativas y
ambientales; y el acceso permanente, oportuno y sin exclusión a programas, acciones y servicios de
promoción y atención integral de salud, salud sexual y salud reproductiva. La prestación de los
servicios de salud se regirá por los principios de equidad, universalidad, solidaridad,
interculturalidad, calidad, eficiencia, eficacia, precaución y bioética, con enfoque de género y
generacional. ”
“Art. 363.- El Estado será responsable de:
Numeral 7: Garantizar la disponibilidad y acceso a medicamentos de calidad, seguros y eficaces,
regular su comercialización y promover la producción nacional y la utilización de medicamentos
genéricos que respondan a las necesidades epidemiológicas de la población. En el acceso a
medicamentos, los intereses de la salud pública prevalecerán sobre los económicos y comerciales.”
2.7.2 LEY ORGÁNICA DE SALUD 2006
“Art. 6.- Es responsabilidad del Ministerio de Salud Pública:
Numeral 18. Regular y realizar el control sanitario de la producción, importación, distribución,
almacenamiento, transporte, comercialización, dispensación y expendio de alimentos procesados,
medicamentos y otros productos para uso y consumo humano; así como los sistemas y
procedimientos que garanticen su inocuidad, seguridad y calidad, a través del Instituto Nacional de
Higiene y Medicina Tropical Dr. Leopoldo Izquieta Pérez y otras dependencias del Ministerio de
Salud Pública.
Numeral 20: Formular políticas y desarrollar estrategias y programas para garantizar el acceso y la
disponibilidad de medicamentos de calidad, al menor costo para la población, con énfasis en
programas de medicamentos genéricos.”
“Art. 131.- El cumplimiento de las normas de Buenas Prácticas de Manufactura, almacenamiento,
distribución, dispensación y farmacia será controlado y certificado por la autoridad sanitaria
nacional.”

CAPITULO II: FUNDAMENTO TEORICO
47
“Art. 154.- El Estado garantizará el acceso y disponibilidad de medicamentos de calidad y su uso
racional, priorizando los intereses de la salud pública sobre los económicos y comerciales.
Promoverá la producción, importación, comercialización, dispensación y expendio de
medicamentos genéricos con énfasis en los esenciales, de conformidad con la normativa vigente en
la materia. Su uso, prescripción, dispensación y expendio es obligatorio en las instituciones de
salud pública.”
“Art. 157.- La autoridad sanitaria nacional garantizará la calidad de los medicamentos en general y
desarrollará programas de farmacovigilancia y estudios de utilización de medicamentos, entre
otros, para precautelar la seguridad de su uso y consumo.
Además realizará periódicamente controles posregistro y estudios de utilización de medicamentos
para evaluar y controlar los estándares de calidad, seguridad y eficacia y sancionar a quienes
comercialicen productos que no cumplan dichos estándares, falsifiquen o adulteren los productos
farmacéuticos.”
2.7.3 POLÍTICA NACIONAL DE MEDICAMENTOS 2007
“La política pública es el conjunto de principios, objetivos y estrategias, que definen la orientación
de una gestión gubernamental; al permitir que las instituciones estatales, la sociedad civil, el sector
privado, la cooperación internacional y otros sectores; conozcan, analicen y se organicen alrededor
de las propuestas del gobierno.”
Objetivo:
"Garantizar que las especialidades farmacéuticas disponibles en el mercado respondan a las
exigencias internacionales en cuanto a eficiencia terapéutica, seguridad fármacoclínica, contenido
cuantitativo, costo beneficio derivado de su utilización, eficacia y seguridad en la dispensación;
para lo cual, el país deberá disponer de la tecnología necesaria que permita aplicar adecuados
controles de calidad.
2.7.4 BUENAS PRÁCTICAS DE MANUFACTURA 1994
PRIMERA PARTE
Administración de la calidad en la Industria Farmacéutica
Garantía de la calidad
Las GMP especifican que se emprenderá un programa documentado de pruebas encaminadas a
establecer las características de estabilidad de los productos de drogas. Los resultados de tales
pruebas de estabilidad se usaran para determinar las condiciones adecuadas de almacenamiento y
las fechas de vencimiento. Esto último tiene la finalidad de asegurar que el producto farmacéutico
satisface normas aplicables de identidad, potencia y pureza en el momento de la administración.

CAPITULO II: FUNDAMENTO TEORICO
48

CAPITULO III: METODOLOGÍA
49
3. METODOLOGÍA
3.1. TIPO DE INVESTIGACIÓN
La Investigación a desarrollarse en este trabajo se acopla a los siguientes tipos:
Investigación Bibliográfica. Para realizar la pre-formulación del producto a ser diseñado, ya que se
requiere establecer una base de las materias primas (ingrediente activo y excipientes) que se van a
utilizar, estableciendo previamente los porcentajes adecuados de cada una de ellas en base a las
dosis recomendadas en su información técnica.
Investigación Experimental. Se realizan ensayos experimentales para evaluar las propiedades
organolépticas, fisicoquímicas, microbiológicas y estabilidad de las fórmulas, y así determinar la
mejor opción de fórmula para el producto.
Investigación Descriptiva. Ya que la investigación se basa en la observación y descripción de las
propiedades de las diferentes formulaciones, todo en pos de encontrar la mejor de ellas.
3.2. POBLACION Y MUESTRA
3.2.1. POBLACION
La población está constituida por pequeños lotes piloto de crema en donde se varía la dosificación
del agente queratolítico a usar (úrea).
De la siguiente forma:
Formulación 1: Úrea 7%
Formulación 2: Úrea 5%
Formulación 3: Úrea 3%
3.2.2. MUESTRA
La muestra corresponde a 5 frascos de 100ml de cada una de las tres diferentes formulaciones.
3.3. DISEÑO EXPERIMENTAL
3.3.1. VARIABLES
Variables Independientes
Formulación de Crema 1: concentración de úrea 7%, simbología (F1)
Formulación de Crema 2: concentración de úrea 5%, simbología (F2)
Formulación de Crema 3: concentración de úrea 3%, simbología (F3)

CAPITULO III: METODOLOGÍA
50
Variables Dependientes
pH
Viscosidad
Extensibilidad
Peso Específico
3.3.2. DISEÑO ESTADÍSTICO
Este trabajo de tesis se elabora según los siguientes puntos:
- Estructuración de fórmulas
- Evaluación de propiedades organolépticas y fisicoquímicas
- Evaluación de propiedades microbiológicas
- Evaluación de estabilidad acelerada
Para cada uno de estos puntos, se establecen sus respectivos diseños experimentales:
3.3.3. Estructuración de fórmulas.
Para llegar a obtener una formulación que tenga las mejores características organolépticas, físicas y
microbiológicas se debe realizar una primera etapa de pre-formulación del producto, estableciendo
las materias primas a utilizar, y los porcentajes en los que son usados, variando los porcentajes del
agente queratólitico (úrea) de la siguiente forma:
- Formulación 1: Úrea 7%
- Formulación 2: Úrea 5%
- Formulación 3: Úrea 3%
A continuación se describen las fórmulas ensayadas y su procedimiento de formulación (Ver Tabla
10):

CAPITULO III: METODOLOGÍA
51
Tabla 10. Fórmulas Cuantitativas (F) a ser ensayadas
N°
ING INCI NAME F1 F2 F3 FUNCIÓN
% % %
1 Agua 42,99 44,99 46,99 Vehículo
2 Methylene Bis-Benzotriazolyl
Tetramethylbutylphenol 5,00 5,00 5,00 Filtro solar
3 Ethylhexyl Methoxycinnamate 5,00 5,00 5,00 Filtro solar
4
Dicaprylyl Carbonate /
Titanium Dioxide /
Polyhydroxystearic Acid /
Stearic Acid / Alumina /
Dimethicone
5,00 5,00 5,00 Filtro solar físico
5 Urea 7,00 5,00 3,00 Agente queratolítico
6 Diethylamino Hydroxybenzoyl
Hexyl Benzoate 4,00 4,00 4,00 Filtro solar
7 Dicaprylyl Carbonate 4,00 4,00 4,00 Acondiciondor de piel. Emoliente
8
Glyceryl Stearate/Cetearyl
Alcohol/Sodium Stearoyl
Lactylate
4,00 4,00 4,00 Emulsionante primario
9 C12-15 Alkyl Benzoate 4,00 4,00 4,00 Acondicionador de la piel,
emoliente
10 Ethylhexyl Triazone 3,50 3,50 3,50 Filtro solar
11 Brassica Campestris/Aleurites
Fordi Oil Copolymer 3,00 3,00 3,00
Formador de film, agente
acondicionador de la piel,
humectante,
12 PPG-15 Stearyl ether 3,00 3,00 3,00 Acondicionador de la piel,
emoliente
13 Potasium Cetyl Phosphate 2,00 2,00 2,00 Surfactante. Agente emulsionante
14 Glycerin 2,00 2,00 2,00 Acondicinador de la piel.
Humectante
15
Bis-Ethylhexyloxyphenol
Methoxyphenyl Triazine
(BEMT)
1,50 1,50 1,50 Filtro solar
16 Cetyl Alcohol 1,00 1,00 1,00 Estabilizador de emulsiones.
Agente opacificante
17 Fragancia 0,75 0,75 0,75 Prefume
18 Dimethicone 0,50 0,50 0,50 Silicona
19 Aloe Barbadensis Leaf Juice 0,50 0,50 0,50 Extracto acondicionador de la
piel
20
Phenoxyethanol /
Methylparaben / Ethylparaben /
Propylene Glycol
0,50 0,50 0,50 Preservante
21 Xanthan Gum 0,20 0,20 0,20 Estabilizador de emulsiones.
Agente espesante
22
Disodium
Lauriminodipropionate
Tocopheryl Acetate
0,20 0,20 0,20 Agente acondicionador de la piel.
Antiinflamatorio
23 Tocopheryl Acetate 0,20 0,20 0,20 Agente acondicionador de la piel.
Antioxidante
24 0,10 0,10 0,10 Agente quelante
25 Pentaerythrityl Tetra-di-t-Butyl
Hydroxyhydrocinnamate 0,05 0,05 0,05 Antioxidante
26 Citric Acid 0,01 0,01 0,01 Regulador de pH
TOTAL 100 100 100

CAPITULO III: METODOLOGÍA
52
3.3.4. Evaluación de propiedades organolépticas y fisicoquímicas. Se evalúan las siguientes
características fisicoquímicas:
- Color, Olor y Aspecto. La crema debe ser totalmente homogénea con un color
preferiblemente blanco y un olor agradable. (Ver Tabla 13)
- pH. Ya que la aplicación es vía dérmica, el pH debe cumplir las especificaciones establecidas
en las farmacopeas vigentes. (Ver Tabla 13)
- Viscosidad. La viscosidad del formulado debe ser la adecuada para tener una textura de gel
agradable al usuario, acoplándose a las especificaciones de las farmacopeas vigentes. (Ver
Tabla 13)
- Peso específico. Medido con el objetivo posterior de dar seguimiento a esta propiedad durante
la etapa del estudio de la estabilidad de las formulaciones. Ya que se trata de una propiedad
intrínseca, no se requiere su comparación frente a alguna especificación.
- Extensibilidad. La última propiedad a cumplir, es poseer una correcta extensibilidad, de forma
que la crema pueda ser aplicada vía dérmica sin ningún inconveniente para el usuario. Para esto
se requiere que el formulado se extienda según especificaciones descritas en farmacopeas
vigentes. (Ver Tabla 13)
Para estos parámetros (excepto color, olor y aspecto), se realizan 3 repeticiones por cada fórmula,
acoplando el experimento a un Diseño Completamente Aleatorizado (DCA) complementado con
Prueba de Tukey, como se muestra a continuación (Ver Tabla 11):
Tabla 11. Diseño Experimental para la Evaluación de Propiedades Fisicoquímicas
CARACTERÍSTICAS
DEL DISEÑO DESCRIPCIÓN
Hipótesis Nula Todas las fórmulas cumplen con la especificación
Hipótesis Alternativa Todas las fórmulas no cumple con la especificación
Diseño Experimental Diseño Completamente Aleatorizado (DCA) + Prueba de Tukey
Tratamientos Fórmulas
No. Tratamientos 3
Variable dependiente pH / viscosidad / peso específico / extensibilidad
Variable independiente Porcentaje de Urea en fórmula
Repeticiones 3
Tratamiento de resultados Mediante ANOVA de DCA se determina significancia de las diferencias entre
tratamientos, luego se desglosa dichas diferencias con prueba funcional de Tukey.
Con respecto a la extensibilidad, este parámetro requiere un tratamiento previo de los datos para
poder acoplarlos al diseño DCA, el cual se describirá en la metodología del mismo.
3.3.5. Evaluación de propiedades microbiológicas. Se evalúan los siguientes parámetros:
- Recuento de bacterias. Las formulaciones no pueden tener una cantidad excesiva de bacterias,
se debe cumplir las especificaciones descritas en las farmacopeas vigentes (Ver Tabla 13)

CAPITULO III: METODOLOGÍA
53
- Recuento de hongos. Los formulaciones no pueden tener una cantidad excesiva de hongos, se
debe cumplir las especificaciones descritas en las farmacopeas vigentes (Ver Tabla 13)
- Objetables. Los formulados no pueden mostrar presencia de microorganismos objetables
Staphylococcus aureus, y Pseusomona aeruginosa (Ver Tabla 13)
Para cada una de estos parámetros, se realizan 3 repeticiones por fórmula, usando un Diseño
Completamente Aleatorizado (DCA) más Prueba de Tukey, como se muestra a continuación (Ver
Tabla 12)
Tabla 12. Diseño Experimental para la Evaluación de Propiedades Microbiológicas
CARACTERÍSTICAS
DEL DISEÑO DESCRIPCIÓN
Hipótesis Nula Todas las fórmulas cumplen con la especificación
Hipótesis Alternativa Todas las fórmulas no cumple con la especificación
Diseño Experimental Diseño Completamente Aleatorizado (DCA) + Prueba de Tukey
Tratamientos Fórmulas
No. tratamientos 3
Variable dependiente Recuento de bacterias / Recuento de hongos / Objetable 1:
Staphylococcus aureus / Objetable 2: Pseusomona aeruginosa
Variable independiente Porcentaje de Urea en fórmula
Repeticiones 3
Tratamiento de resultados Mediante ANOVA de DCA se determina significancia de las
diferencias entre tratamientos, luego se desglosa dichas diferencias
con prueba funcional de Tukey.
Tabla 13. Especificaciones establecidas para cada parámetro a evaluar
ENSAYOS ESPECIFICACIONES
ORGANOLÉPTICOS
Color Blanco
Olor Floral
Aspecto Homogénea
FÍSICOS
pH 5,0 – 6,5
Peso especifico 1,05 – 1,15 g/mL
Viscosidad 35000 – 70000 cps
Extensibilidad 60 – 270 mm
MICROBIOLÓGICOS
Recuento bacterias < 102 UFC/g
Recuento hongos < 102 UFC/g
Objetable 1: Staphylococcus aureus Ausencia
Objetable 2: Pseusomona aeruginosa Ausencia
3.3.6. Evaluación de estabilidad acelerada. La estabilidad acelerada de los formulados se
realiza mediante seguimiento de sus propiedades organolépticas, fisicoquímicas y microbiológicas
respecto del tiempo transcurrido a 3 diferentes temperaturas de almacenamiento. Para esta

CAPITULO III: METODOLOGÍA
54
evaluación se diseña el experimento mediante un Diseño Factorial AxB, usando este diseño para
cada parámetro evaluado (excepto color, olor y aspecto), y para cada una de las fórmulas evaluadas
por separado. (Ver Tabla 14)
Tabla 14. Diseño Experimental para la Evaluación de Estabilidad Acelerada
CARACTERÍSTICAS
DEL DISEÑO DESCRIPCIÓN
Hipótesis Nula Todas las fórmulas mantienen sus propiedades con el tiempo a
cualquier temperatura de almacenamiento
Hipótesis Alternativa Todas las fórmulas no mantiene sus propiedades en el tiempo o a
cualquier temperatura de almacenamiento
Diseño Experimental Factorial AxB
Factor A Variación de Tiempo (t)
Niveles Factor A Tres niveles: 1, 2 y 3 meses
Factor B Condición: Temperatura/Humedad relativa (T/%HR)
Niveles Factor B Tres niveles: 25°C/70%HR, 30°C/70%HR, y 40°C/70%HR
Variable dependiente pH / viscosidad / peso específico / extensibilidad / Recuento de
bacterias / Recuento de hongos / Objetable 1: Staphylococcus aureus /
Objetable 2: Pseusomona aeruginosa
Variable independiente Variación de tiempo (t) / Condición (T/%HR)
Repeticiones 3
Tratamiento de resultados Mediante ANOVA de Factorial AxB se determina significancia de las
diferencias entre tratamientos e interacciones entre factores.
3.4. MATERIALES
3.4.1. Materiales
Mortero
Paleta
Vaso de precipitación
Portaobjetos
Papel milimetrado
Pesas
Regla
Calculadora
Balón aforado
Agitador
Cocineta
Tubos de centrifugación
Refrigeradora
Espátula
Probetas

CAPITULO III: METODOLOGÍA
55
Cajas petri de vidrio
Asa de platino
Erlenmeyer
3.4.2. Equipos
Balanza Analítica
Medidor de pH
Viscosímetro
Pesas estandarizadas
Estufa
3.4.3. Reactivos
Agua destilada
Agar cetrimida
Caldo tetrationato
Agar Mac conkey
Agar Sabouraud Dextrosa
Base de caldo TAT
Agar de soya-tripticaseina
Agar Vogel Johson
3.5. MÉTODOS E INSTRUMENTOS ANALÍTICOS
Para los ensayos mencionados en el diseño experimental, se describe su metodología a
continuación:
3.5.1. Método para evaluación de Color, Olor y Aspecto. Para cada uno de estas propiedades,
el método se describe a continuación:
- Color. Observación de la crema sobre una superficie blanca.
- Olor. Se realiza una inspección directa a la crema acercándola directamente a la nariz y percibir
el aroma.
- Aspecto. Se observa una capa delgada de crema extendida sobre una superficie plana y
examinar la uniformidad del producto tanto en el tamaño, en la distribución y la forma de
cristales, polvos u otras partículas que no estén bien dispersas.
3.5.2. Método para evaluación de pH. Ya que el formulado es una mezcla de fase oleosa con
fase acuosa, la determinación del pH requiere un paso previo dependiendo de si la crema resultante
es una emulsión aceite/agua (O/W), o una emulsión agua/aceite (W/O). Este procedimiento es el
siguiente:

CAPITULO III: METODOLOGÍA
56
- Emulsión O/W: se sitúan 2 g de emulsión aproximadamente en un mortero, se tritura de forma
enérgica con 20 ml de agua purificada y se procede a realizar la medición.
- Emulsión W/O: Se pesan 2 g de emulsión aproximadamente, se dispersan mediante suave
agitación en 30 ml de agua purificada y se procede a realizar la medición.
Hecho esto, se mide el pH según el método descrito a continuación:
- Encender el equipo y esperar que en la pantalla digital se muestre el dato de temperatura.
- Quitar del electrodo la tapa de protección e introducirlo en la solución buffer de pH 4.
- Esperar que el equipo mida el pH de la solución, el valor es indicado en la pantalla.
- Retirar el electrodo de la solución, lavar con agua destilada y secar cuidadosamente.
- Repetir el procedimiento para una solución buffer de pH 10, lavar y secar el electrodo.
- Cuando las lecturas de las soluciones buffer corresponden a los valores de pH indicados en la
etiqueta, el equipo se encuentra listo para medir el valor de pH de cualquier sustancia.
- Introducir el electrodo en la sustancia que se desea medir el pH, esperar a que en la pantalla se
muestre el valor del pH.
- Retirar el electrodo, lavar con agua destilada y secar cuidadosamente.
- Realizar tres lecturas para obtener un valor consistente.
3.5.3. Método para evaluación de Viscosidad. El método se describe a continuación
- Introducir la aguja (spin) en la muestra en forma inclinada para evitar que queden burbujas en
la parte inferior, una vez dentro centrarla de tal modo que el oleaje que produzca al girar sea el
mismo en todos los puntos alrededor del spin.
- Encender el viscosímetro y dejar que funcione libremente de un mínimo de 30 segundos a un
máximo de un minuto, en caso de que el dial pase de 100, apagar el viscosímetro, colocar el
spin inmediato superior y proceder como en el comienzo de este punto.
- Al cabo de este tiempo, oprimir la palanca para determinar la escala y anotar la lectura señalada
en esta.
3.5.4. Método para evaluación de Peso Específico. El método se describe a continuación:
- Pesar el balón limpio y completamente seco.
- Llenar el balón con agua hasta el aforo y pesar.
- Llenar el balón con la crema hasta la línea de aforo y pesar (evitar que se formen burbujas).
- Realizar el cálculo mediante la siguiente fórmula:
𝐷25 =𝑏𝑎𝑙ó𝑛𝑐𝑟𝑒𝑚𝑎 − 𝑏𝑎𝑙ó𝑛𝑣𝑎𝑐𝑖𝑜
𝑏𝑎𝑙ó𝑛 𝑎𝑔𝑢𝑎 − 𝑏𝑎𝑙ó𝑛𝑣𝑎𝑐𝑖𝑜
Las mediciones se deben hacer manteniendo las muestras a 25 ºC +- 0,2 ºC

CAPITULO III: METODOLOGÍA
57
3.5.5. Método para evaluación de Extensibilidad. El método se describe a continuación:
- Se rotulan los lados de un portaobjeto sobre un papel milimetrado y se trazan dos diagonales.
- Se sitúa un portaobjetos, conteniendo 25 mg de semisólido, encima de un papel milimetrado.
- Sobre dicho portaobjetos se coloca otro suavemente y de peso conocido (4g), se espera 1
minuto y se anota el diámetro del círculo formado.
- Se sigue el mismo procedimiento, siempre a intervalos de 1 minuto, utilizando una pesa de 3 g,
dos pesas de 3 g y finalmente tres pesas de 3 g (masa máxima usada=13g).
- Con los diámetros obtenidos se calculan los radios, y con éstos, las superficies
correspondientes.
- Las determinaciones se realizan por triplicado para cada muestra, calculándose el valor medio
en función del peso situado en el portaobjetos
- Una vez obtenidos los datos de superficie extendida con respecto a la masa de las pesas, se
hace una regresión lineal de los datos y se determina la ecuación de la función lineal
extensibilidad=ƒ(masa) de cada repetición.
El siguiente es el procedimiento a seguir para dar un tratamiento previo a los datos de
extensibilidad para acoplar el arreglo estadístico a un Diseño Completamente Aleatorizado (DCA):
- Con la ecuación de la recta de cada repetición, determinar la extensibilidad en un punto medio
(Pm) de masa mediante la siguiente ecuación:
𝑃𝑚 = 𝐴 × 𝑚𝑀𝐴𝑋
2 + 𝐵
Donde, A: pendiente de la recta
B: ordenada al origen de la recta
mMAX: masa máxima utilizada en el ensayo
- Se calcula también la ecuación de la recta y punto medio que correspondería a la especificación
de 60 a 270 mm2 de superficie extendida, asignándoles masa cero y masa máxima (13g)
respectivamente a cada uno de esos puntos, como sigue:
𝐴 =270𝑚𝑚 2−60𝑚𝑚 2
13𝑔−0𝑔= 16,15 𝑚𝑚2/𝑔 ; 𝐵 = 60𝑚𝑚2
𝑃𝑚 = 16,15𝑚𝑚2
𝑔×
13𝑔
2 + 60𝑚𝑚2 = 165 𝑚𝑚2
- Finalmente, calcular un factor de comparación (X) entre la recta de cada repetición versus la
recta de la especificación mediante la siguiente fórmula:
𝑋 = 𝐴𝑒𝑠𝑝𝑒𝑐𝑖𝑓𝑖𝑐𝑎𝑐𝑖 ó𝑛 − 𝐴 × 𝑃𝑚𝑒𝑠𝑝𝑒𝑐𝑖𝑓𝑖𝑐𝑎𝑐𝑖 ó𝑛 − 𝑃𝑚
O utilizando los datos de la especificación ya calculados:
𝑋 = 16,15 𝑚𝑚2/𝑔 − 𝐴 × 165 𝑚𝑚2 − 𝑃𝑚
Este factor es el que debe utilizarse para hacer el análisis estadístico correspondiente.

CAPITULO III: METODOLOGÍA
58
3.5.6. Métodos para evaluación Microbiológica. El análisis microbiológico de los formulados
requiere procedimientos de preparación, conteo y/o identificación.
La preparación de Medios de Cultivo y de la muestra se realiza como sigue:
- Preparar los medios de cultivo a utilizarse siguiendo las instrucciones especificadas por el
fabricante para cada medio.
- Esterilizar los medios en autoclave con calor húmedo, dejar enfriar hasta una temperatura de
45ºC, observando que los medios se encuentren totalmente fluidos y mantenerlos en esta
condición con la ayuda de un baño María a esta temperatura.
- Debido a que la muestra a analizarse es semisólida y ligeramente soluble en agua se
recomienda que en el medio TAT (Base de Caldo Tetrationato) se añada una cantidad mínima
de un solvente emulsificante como el polisorbato 20, mezclar y si es necesario calentar a una
Temperatura menor de 45ºC.
- Suspender 10g de crema en 90 ml del medio TAT (Base de Caldo Tetrationato) con el
propósito de revitalizar a los microorganismos existentes en la muestra, agitar mecánicamente
durante 15 min. en condiciones estériles, y dejar por 24 horas.
Para el Contaje de Microorganismos Aeróbicos Totales, Hongos y Levaduras, se utiliza el método
de Cuenta placa:
- Sembrar por vertido 1 ml de la muestra preparada anteriormente en cajas Petri que contenga
TSA (Agar de Soya Tripticaseina) y SAB (Agar Sabouraud Dextrosa), mezclar con
movimientos rotatorios y dejar solidificar a temperatura ambiente, incubar durante un periodo
de 48 a 72 horas.
- Preparar un testigo con el producto no disuelto en el medio TAT (Base de Caldo Tetrationato)
siguiendo el procedimiento anterior; la prueba es válida si no se observa desarrollo de
microorganismo en las cajas Petri.
Para la identificación de Microorganismo Objetable Staphylococcus aureus, se hace lo siguiente:
- Tomar un inóculo de la solución preparada de la muestra en el medio TAT (Base de Caldo
Tetrationato) después de 24 horas de incubación y aislar por estría cruzada en el medio Vogel
Jonhson; incubar por 24 horas y observar.
- Si existe crecimiento comparar la morfología de las colonias con la bibliografía
correspondiente (tabla de morfología) (Ver Tabla 17).
- Si las características son similares se procede a realizar una prueba de coagulasa y para
confirmar se pueden realizar pruebas bioquímicas adicionales.

CAPITULO III: METODOLOGÍA
59
Tabla 15. Características de identificación del Staphylococcus áureas
MICROORGANISMO MEDIO GRAM MORFOLOGIA
Staphylococcus aureus
Vogel Johnson
Cocos + con
racimos
Ufc Negras rodeadas de
halo amarillo
Agar sal manitol
Cocos + en
racimos
Ufc colonias amarillas
rodeadas de una zona
amarilla
Agar Baird parker Cocos + en
racimos
Ufc colonias negras
lustrosas rodeadas de zonas
claras 2-5 mm de diámetro.
Tomados de: Fernandez, E. A. (2001-2002). Tecnicas de Procedimientos en Formulcion Magistral
Dermatologica. Mexico.
Y para la identificación de Microorganismo Objetable Pseudomona aeruginosa:
- Tomar un inóculo de la solución preparada de la muestra en el medio TAT (Base de Caldo
Tetrationato) después de 24 horas de incubación y aislar por estría cruzada en el medio Agar
Cetrimida; incubar por 24 horas y observar.
- Si existe crecimiento comparar la morfología de las colonias con la bibliografía
correspondiente (tabla de morfología) (Ver Tabla 17):
Tabla 16. Características de identificación del Pseudomona aeruginosa.
MICROORGANISMO MEDIO GRAM MORFOLOGIA
Pseudomona aeruginosa
Cetrimide
Bacilo
Gran –
Oxidasa +
Ufc verdosas
fluorescentes
Agar
Pseudomona para
obtención por
fluoresceína
Bacilo
Gran –
Oxidasa +
Ufc colonias incoloras o
amarillentas, con luz
ultravioleta se observan
bacilos negativos de color
amarillento.
Agar
Pseudomona para
detección de
piocina.
Bacilo
Gran –
Oxidasa +
Ufc colonias verde-
azulosas con luz
ultravioleta se observan de
color azul.
Tomado de: Fernandez, E. A. (2001-2002). Tecnicas de Procedimientos en Formulcion Magistral
Dermatologica. Mexico.

CAPITULO III: METODOLOGÍA
60
3.5.7. Método para evaluación de Estabilidad Acelerada. La estabilidad de los formulados se
evalúa en base al seguimiento de las propiedades organolépticas, fisicoquímicas y microbiológicas
(cuyos métodos ya se describieron) con respecto al tiempo almacenados en condiciones de estrés
térmico y humedad relativa.
Para esta evaluación se establecen las siguientes recomendaciones:
- Se recomienda que las muestras sean acondicionadas en frascos de vidrio neutro, transparente,
con tapa que garantice un buen cierre evitando pérdida de gases o vapor para el medio. Si
existiera incompatibilidad conocida entre los componentes de la formulación y el vidrio, el
formulador debe seleccionar otro material de acondicionamiento.
- La cantidad de producto debe ser suficiente para todas las evaluaciones a realizar.
- Se debe evitar la incorporación de aire en el producto, durante el envasado en el recipiente de
prueba.
- Es importante no completar el volumen total del recipiente permitiendo un espacio vacío de
aproximadamente un tercio de la capacidad del frasco para posibles intercambios gaseosos.
- Se debe tomar una muestra de referencia, también denominada patrón, que en general puede
ser mantenida en nevera o a temperatura ambiente, al abrigo de la luz.
3.6. PROCEDIMIENTO DE MANUFACTURA DE LA CREMA
Para cualquiera de las tres fórmulas descritas, el procedimiento de elaboración es el siguiente:
- I. FASE OLEOSA. En un recipiente añadir
Etilhexil Metoxicinamato
2- (2-hidroxibenzoil-4-dietilamino) - hexiléster de ácido benzoico
2,4,6-trianilino-p- (carbo-2'-etil-hexil-1'-oxi) -1,3,5-triazin
etilhexiloxifenol metoxifenil triazina
Estearato de glicerina y sodio estearoil lactilato y alcohol cetearílico
Carbonato de Dicaprililo
C12-15 alquil benzoato
PPG-15 estearil éter
Hidrogenado Brassica Campestris / Aleurites Fordi Petróleo copolímero (y) hidrogenada
hidrogenado Brassica Campestris / Aleurites Fordi Petróleo copolímero / Aleurites Fordi
Petróleo Copolímero
Cetyl alcohol
Pentaeritritilo hidroxihidrocinamato tetra-di-t-butilo
Dicapril Carbonato (y) Dióxido de titanio (y) Ácido polihidroxiesteárico (y) Alúmina (y)
Ácido esteárico (y) dimeticona
Urea,

CAPITULO III: METODOLOGÍA
61
Fundir a una temperatura entre 70 - 80 °C; mezclando cada 15 minutos para evitar
sobrecalentamiento del fundido. Cuando se alcance fundir por completo todas las materias
primas adicionar
Potasio cetil fosfato
- II. PRE-MEZCLA 1. Adicionar primero el Etilendiaminotetraacetato disódico al 90% de la
cantidad de agua desmineralizada, agitar hasta completa disolución, luego adicionar lentamente
la Xanthan gum y la Glycerin. Agitar hasta completa disolución.
- III PRE-MEZCLA 2. Adicionar el Ácido 2-hidroxi-1,2,3-propanotricarboxílico al 10%
restante del agua desmineralizada, agitar hasta completa disolución. Luego adicionar el
Metilen-bis-benzotriazolil tetrametilbutilfenol (MBBT) y agitar hasta obtener una mezcla
homogénea.
- Mezclar la FASE OLEOSA y la PRE-MEZCLA 1 con turbo-agitador a 70 – 80 °C hasta
completa homogenización. Luego iniciar enfriamiento a una temperatura de 50 °C. Finalmente,
adicionar uno a uno la PRE-MEZCLA 2, Aloe Barbadensis Leaf Juice, Tocopheryl acetate,
Polydimethlysiloxane, Fenoxietanol (y) Metilparabeno (y) Etilparabeno (y) Butilparabeno (y)
Propilparabeno (y) isobutilparabén y fragancia, agitar hasta completa homogenización entre
cada adición.
- Enfriar el producto y envasar.


CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
63
4. ANÁLISIS E INTERPRETACIÓN DE RESULTADOS
4.1. RESULTADOS DE LAS PROPIEDADES ORGANOLÉPTICAS Y FISICOQUÍMICAS
DE LOS FORMULADOS
4.1.1. Color, Olor y Aspecto. Bajo las especificaciones de color blanco, olor floral y aspecto
homogéneo, los resultados de las fórmulas F1, F2 y F3 son los siguientes (Ver Tabla 17):
Tabla 17. Color, Olor y Aspecto de los Formulados
F1 F2 F3
Color Blanco Blanco Blanco
Olor Floral Floral Floral
Aspecto Homogénea Homogénea Homogénea
INTERPRETACIÓN:
Todas las fórmulas tienen el mismo color, olor y aspecto. F1=F2=F3
4.1.2 pH. Bajo la especificación de un pH óptimo entre 5,0 a 6,5, los resultados de las fórmulas
F1, F2 y F3 son los siguientes (Ver Tabla 18):
Tabla 18. pH de los Formulados
F1 F2 F3
Repetición 1 5,44 5,09 6,00
Repetición 2 5,41 5,33 6,00
Repetición 3 5,40 5,08 5,88
Promedio 5,42 5,17 5,96
Realizando el Análisis de Varianza y Prueba de Tukey de estos datos en DCA, se obtiene los
siguientes resultados (Ver Tabla 19):
Tabla 19. Análisis estadístico (ANOVA+Tukey) para pH de los formulados
Análisis de Varianza para un factor
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Entre grupos 0,99 2 0,49 58,7a 5,143
Dentro de los grupos 0,05 6 0,01
Total 1,04 8
Prueba de Tukey
Promedios ordenados
de mayor a menor
Diferencias
entre promedios
Valor crítico
de Tukey
F3: 5,96 (F3 – F1): 0,54a 0,23
F1: 5,42 (F3 – F2): 0,79a
F2: 5,17 (F1 – F2): 0,25a
a. Mayor al valor crítico, significativamente diferente
b. Menor o igual a valor crítico, significativamente igual

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
64
INTERPRETACIÓN:
Los resultados obtenidos son:
El análisis de varianza determina que existe una diferencia significativa entre el pH de las
formulaciones (F1-F2-F3), debido a que la FCAL> FCRÍTICO, lo cual indica que las muestras
analizadas son diferentes estadísticamente.
El análisis estadístico y comparativo (Prueba de Tukey) indica que todas las diferencias >
VTCRÍTICO, lo cual determina que existe una diferencia significativa estadísticamente en
cuanto al pH de la crema en todas las formulaciones:
F3 vs F1: Formulación con Urea al 3% vs Formulación con Urea al 7%.
F3 vs F2: Formulación con Urea al 3% vs Formulación con Urea al 5%.
F1 vs F2: Formulación con Urea al 7% vs Formulación con Urea al 5%.
Comparando frente a la especificación, cuyo promedio es un pH de 5,75, se establece el siguiente
orden de la mejor (más cercana a promedio de especificación) a la peor (más lejana) fórmula:
Mejor > F3- Urea al 3% > F1- Urea al 7% > F2- Urea al 5% > Peor
4.1.3 Viscosidad. Bajo la especificación de una viscosidad óptima entre 35000 a 70000 cPs, los
resultados de las fórmulas F1, F2 y F3 son los siguientes (Ver Tabla 20):
Tabla 20. Viscosidad de los Formulados
F1 F2 F3
Repetición 1 48997 cPs 44679 cPs 42334 cPs
Repetición 2 49320 cPs 44529 cPs 41568 cPs
Repetición 3 51485 cPs 43875 cPs 45213 cPs
Promedio 49934 cPs 44361 cPs 43038 cPs
Realizando el Análisis de Varianza y Prueba de Tukey de estos datos en DCA, se obtiene los
siguientes resultados (Ver Tabla 21):
Tabla 21. Análisis estadístico (ANOVA+Tukey) para Viscosidad de los formulados
Análisis de Varianza para un factor
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Entre grupos 8x107 2 4 x10
7 21,12
a 5,143
Dentro de los grupos 1 x107 6 2 x10
6
Total 9 x107 8
Prueba de Tukey
Promedios ordenados
de mayor a menor
Diferencias
entre promedios
Valor crítico
de Tukey
F1: 49934 (F1 – F2): 5573a 3456
F2: 44361 (F1 – F3): 6896a
F3: 43038 (F2 – F3): 1323b a. Mayor al valor crítico, significativamente diferente
b. Menor o igual a valor crítico, significativamente igual

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
65
INTERPRETACIÓN:
Los resultados obtenidos son:
El análisis de varianza determina que existe una diferencia significativa entre la viscosidad
de las formulaciones (F1-F2-F3), debido a que la FCAL> FCRÍTICO, lo cual indica que las
muestras analizadas son diferentes estadísticamente.
El análisis estadístico y comparativo (Prueba de Tukey) en cuanto a la viscosidad de la
crema indica que: F1 es significativamente diferente a F2 y F3, debido a que
(Diferencias>VTcritico), mientras que F2 y F3 son significativamente iguales entre sí
estadísticamente, debido a que (Diferencias>VTcritico).
F1 vs F2: Formulación con Urea al 7% vs Formulación con Urea al 5%.
F1 vs F3: Formulación con Urea al 7% vs Formulación con Urea al 3%.
Comparando frente a la especificación, cuyo promedio es 52500 cPs, se establece el siguiente
orden de la mejor (más cercana a promedio de especificación) a la peor (más lejana) fórmula:
Mejor > F1- Urea al 7% > F2- Urea al 5% = F3- Urea al 3% > Peor
4.1.4 Peso Específico. Bajo la especificación de un peso específico óptimo entre 1,05 a 1,15
g/ml, los resultados de las fórmulas F1, F2 y F3 son los siguientes (Ver Tabla 22):
Tabla 22. Peso Específico de los Formulados
F1 F2 F3
Repetición 1 1,12 g/mL 1,12 g/mL 1,08 g/mL
Repetición 2 1,13 g/mL 1,12 g/mL 1,09 g/mL
Repetición 3 1,10 g/mL 1,15 g/mL 1,11 g/mL
Promedio 1,12 g/mL 1,13 g/mL 1,09 g/mL
Realizando el Análisis de Varianza y Prueba de Tukey de estos datos en DCA, se obtiene los
siguientes resultados (Ver Tabla 23):
Tabla 23. Análisis estadístico (ANOVA+Tukey) para Peso Específico de los formulados
Análisis de Varianza para un factor
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Entre grupos 0,002 2 0,001 4,043b 5,143
Dentro de los grupos 0,002 6 3x10-4
Total 0,004 8
Prueba de Tukey
Promedios ordenados
de mayor a menor
Diferencias
entre promedios
Valor crítico
de Tukey
F2: 1,13 (F2 – F1): 0,013b 0,04
F1: 1,12 (F2 – F3): 0,037b
F3: 1,09 (F1 – F3): 0,023b
a. Mayor al valor crítico, significativamente diferente
b. Menor o igual a valor crítico, significativamente igual

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
66
INTERPRETACIÓN:
Los resultados obtenidos son:
El análisis de varianza determina que no existe una diferencia significativa entre el peso
específico de las formulaciones (F1-F2-F3), debido a que la FCAL< FCRÍTICO, lo cual indica
que las muestras analizadas no son diferentes estadísticamente.
El análisis estadístico y comparativo (Prueba de Tukey) indica que todas las diferencias <
VTCRÍTICO, lo cual determina que no existe una diferencia significativa estadísticamente en
cuanto al peso específico de la crema en todas las formulaciones, por lo tanto todas las
formulaciones se consideran iguales entre sí.
Comparando frente a la especificación, que es un peso específico de 1,1 g/mL, se establece el
siguiente orden de la mejor (más cercana a promedio de especificación) a la peor (más lejana)
fórmula:
Mejor > F1- Urea al 7% = F2- Urea al 5% = F3- Urea al 3% > Peor
4.1.5 Extensibilidad. Bajo la especificación de una extensibilidad óptima entre 270 a 60 mm, los
resultados de las fórmulas F1, F2 y F3 son los siguientes (Ver Tabla 24):
Tabla 24. Extensibilidad de los Formulados
Fórmulas
Pesas F1 F2 F3
Repetición 1 4 g 151,60 mm2 101,76 mm
2 105,21 mm
2
7 g 177,88 mm2 101,88 mm
2 102,82 mm
2
10 g 202,96 mm2 112,66 mm
2 125,76 mm
2
13 g 224,70 mm2 154,16 mm
2 143,17 mm
2
Función lineal y=8,15x+120,04 y=5,60x+70,02 y=4,56x+80,47
A 8,15 mm2/g 5,60 mm
2/g 4,56 mm
2/g
Pm 172,99 mm2 106,42 mm2 110,12 mm2
X 64,01 mm4/g 618,32 mm
4/g 636,25 mm
4/g
Repetición 2 4 g 122,64 mm2 90,76 mm
2 115,44 mm
2
7 g 145,97 mm2 102,46 mm
2 112,55 mm
2
10 g 164,06 mm2 123,56 mm
2 144,99 mm
2
13 g 198,60 mm2 132,17 mm
2 173,63 mm
2
Función lineal y=8,20x+88,13 y=4,84x+71,06 y=6,90x+78,00
A 8,20 mm2/g 4,84 mm2/g 6,90 mm2/g
Pm 141,42 mm2 102,55 mm
2 122,85 mm
2
X 187,58 mm4/g 706,29 mm
4/g 390,02 mm
4/g
Repetición 3 4 g 141,87 mm2 103,53 mm
2 111,40 mm
2
7 g 153,66 mm2 123,56 mm
2 132,67 mm
2
10 g 211,79 mm2 133,70 mm
2 152,65 mm
2
13 g 220,51 mm2 123,86 mm
2 187,60 mm
2
Función lineal y=9,80x+98,64 y=2,37x+101,01 y=8,29x+75,65
A 9,80 mm2/g 2,37 mm2/g 8,29 mm2/g
Pm 162,35 mm2 116,42 mm2 129,51 mm2
X 16,81 mm4/g 669,56 mm
4/g 279,25 mm
4/g

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
67
Para el análisis estadístico, se utilizan los datos del Factor de comparación (X), obteniendo los
siguientes resultados para el Análisis de Varianza y Prueba de Tukey correspondientes (Ver Tabla
25):
Tabla 25. Análisis estadístico (ANOVA+Tukey) para Extensibilidad de los formulados
Análisis de Varianza para un factor
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Entre grupos 503134,8 2 251567,4 17,502a 5,143
Dentro de los grupos 86242,1 6 14373,7
Total 589376,9 8
Prueba de Tukey
Promedios ordenados
de mayor a menor
Diferencias
entre promedios
Valor crítico
de Tukey
F2: 664,73 (F2 – F3): 229,55b 300,41
F3: 435,17 (F2 – F1): 575,26a
F1: 89,46 (F3 – F1): 345,71a
a. Mayor al valor crítico, significativamente diferente
b. Menor o igual a valor crítico, significativamente igual
INTERPRETACIÓN:
Los resultados obtenidos son:
El análisis de varianza determina que existe una diferencia significativa entre los factores
de comparación de las funciones lineales de la extensibilidad de las formulaciones (F1-F2-
F3), debido a que la FCAL> FCRÍTICO, lo cual indica que las muestras analizadas son
diferentes estadísticamente.
El análisis estadístico y comparativo (Prueba de Tukey) en cuanto a la extensibilidad de la
crema indica que: F1 es significativamente diferente a F2 y F3, debido a que
(Diferencias>VTcritico), mientras que F2 y F3 son significativamente iguales entre sí
estadísticamente, debido a que (Diferencias>VTcritico).
F2 vs F1: Formulación con Urea al 5% vs Formulación con Urea al 7%.
F3 vs F1: Formulación con Urea al 3% vs Formulación con Urea al 7%.
Para comparar frente a la especificación, se debe considerar que el factor de comparación (X)
representa que tan diferentes son las funciones lineales de las formulaciones (F1-F2-F3) frente a la
función lineal de la especificación, por lo tanto, mientras menor sea el factor de comparación, más
cercana serán dichas funciones lineales. Así, se establece el siguiente orden de la mejor (menor X) a
la peor (mayor X) fórmula:
Mejor > F1- Urea al 7% > F2- Urea al 5% = F3- Urea al 3% > Peor
Este orden se puede también notar observando las gráficas de las funciones lineales promedio de
cada fórmula (Ver Figura 17):

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
68
Figura 17. Función Lineal Extensibilidad Vs Masa de los Formulados
Se comparan las funciones lineales de los tres formulados F1, F2 y F3 frente a la función lineal que
dibujaría la especificación (spec) establecida. Se puede notar que la gráfica de F1 se encuentra más
cercana a la especificación, tal como ya se demostró con el análisis estadístico.
4.2 RESULTADOS DE LAS PROPIEDADES MICROBIOLÓGICAS DE LOS
FORMULADOS
4.2.1 Recuento de Bacterias. Bajo las especificaciones de menor a 102 UFC/g, los resultados de
las fórmulas F1, F2 y F3 son los siguientes (Ver Tabla 26):
Tabla 26. Recuento de Bacterias de los Formulados
F1 F2 F3
Repetición 1 < 10² UFC/g < 10² UFC/g < 10² UFC/g
Repetición 2 < 10² UFC/g < 10² UFC/g < 10² UFC/g
Repetición 3 < 10² UFC/g < 10² UFC/g < 10² UFC/g
Promedio < 10² UFC/g < 10² UFC/g < 10² UFC/g
INTERPRETACIÓN:
Todas las fórmulas cumplen con la especificación. Como no hay variación de datos (varianza=0),
no se requiere hacer análisis estadístico. Por lo tanto, todas las formulaciones son iguales entre sí:
F1- Urea al 7% = F2- Urea al 5% = F3- Urea al 3%.
y = -9,3978x + 121,01R² = 0,0745
y = -13,991x + 147,25R² = 0,1153
y = -15,824x + 158,21R² = 0,1268
y = -9,0275x + 118,91
0,00
20,00
40,00
60,00
80,00
100,00
120,00
140,00
160,00
180,00
200,00
0,0 1,0 2,0 3,0 4,0 5,0 6,0
Exte
nsi
bili
dad
(m
m2)
Masa de la pesa (g)
102,82 112,55 132,67
103,82 Lineal (102,82) Lineal (112,55)
Lineal (132,67) Lineal (103,82)

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
69
4.2.2 Recuento de Hongos. Bajo las especificaciones de menor a 102
UFC/g, los resultados de
las fórmulas F1, F2 y F3 son los siguientes (Ver Tabla 27):
Tabla 27. Recuento de Hongos de los Formulados
F1 F2 F3
Repetición 1 < 10² UFC/g < 10² UFC/g < 10² UFC/g
Repetición 2 < 10² UFC/g < 10² UFC/g < 10² UFC/g
Repetición 3 < 10² UFC/g < 10² UFC/g < 10² UFC/g
Promedio < 10² UFC/g < 10² UFC/g < 10² UFC/g
INTERPRETACIÓN:
Todas las fórmulas cumplen con la especificación. Como no hay variación de datos (varianza=0),
no se requiere hacer análisis estadístico. Por lo tanto, todas las formulaciones son iguales entre sí:
F1- Urea al 7% = F2- Urea al 5% = F3- Urea al 3%.
4.2.3 Presencia de Objetable 1: Staphyloccocus aureus. Bajo las especificaciones de ausencia
total, los resultados de las fórmulas F1, F2 y F3 son los siguientes (Ver Tabla 28):
Tabla 28. Recuento de Staphyloccocus aureus de los Formulados
F1 F2 F3
Repetición 1 Ausencia Ausencia Ausencia
Repetición 2 Ausencia Ausencia Ausencia
Repetición 3 Ausencia Ausencia Ausencia
Moda Ausencia Ausencia Ausencia
INTERPRETACIÓN:
Todas las fórmulas cumplen con la especificación. Como no hay variación de datos (varianza=0),
no se requiere hacer análisis estadístico. Por lo tanto, todas las formulaciones son iguales entre sí:
F1- Urea al 7% = F2- Urea al 5% = F3- Urea al 3%.
4.2.4 Presencia de Objetable 2: Pseudomona aeruginosa. Bajo las especificaciones de
ausencia total, los resultados de las fórmulas F1, F2 y F3 son los siguientes (Ver Tabla 29):
Tabla 29. Recuento de Pseudomona aeruginosa de los Formulados
F1 F2 F3
Repetición 1 Ausencia Ausencia Ausencia
Repetición 2 Ausencia Ausencia Ausencia
Repetición 3 Ausencia Ausencia Ausencia
Moda Ausencia Ausencia Ausencia

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
70
INTERPRETACIÓN:
Todas las fórmulas cumplen con la especificación. Como no hay variación de datos (varianza=0),
no se requiere hacer análisis estadístico. Por lo tanto, todas las formulaciones son iguales entre sí:
F1- Urea al 7% = F2- Urea al 5% = F3- Urea al 3%.
4.3 RESULTADOS DE LA ESTABILIDAD ACELERADA DE LOS FORMULADOS
4.3.1 Estabilidad del Color, Olor y Aspecto. En condiciones de almacenamiento de alta
temperatura y humedad, el color, olor y aspecto de las fórmulas F1, F2 y F3 en el transcurso del
tiempo, se muestra a continuación (Ver Tabla 30):
Tabla 30. Color, Olor y Aspecto de los Formulados versus Tiempo
CONDICIÓN
INICIAL MES 1 MES 2 MES 3
F1 25°C / 70%HR Color Olor Aspecto
Blanco Floral Homogéneo
Blanco Floral Homogéneo
Blanco Floral Homogéneo
Blanco Ligero floral Homogéneo
30°C / 70%HR Color Olor Aspecto
- - -
Blanco Floral Homogéneo
Blanco Floral Homogéneo
Blanco Ligero floral Homogéneo
40°C / 70%HR Color Olor Aspecto
- - -
Blanco Floral 2 Fases
Blanco Floral 2 Fases
Blanco Ligero floral 2 Fases
F2 25°C / 70%HR Color Olor Aspecto
Blanco Floral Homogéneo
Blanco Floral Homogéneo
Blanco Floral Homogéneo
Blanco Ligero floral Homogéneo
30°C / 70%HR Color Olor Aspecto
- - -
Blanco Floral Homogéneo
Blanco Floral Homogéneo
Blanco Ligero floral Homogéneo
40°C / 70%HR Color Olor Aspecto
- - -
Blanco Floral Homogéneo
Blanco Floral Homogéneo
Blanco Ligero floral Homogéneo
F3 25°C / 70%HR Color Olor Aspecto
Blanco Floral Homogéneo
Blanco Floral Homogéneo
Blanco Floral Homogéneo
Blanco Ligero floral Homogéneo
30°C / 70%HR Color Olor Aspecto
- - -
Blanco Floral Homogéneo
Blanco Floral Homogéneo
Blanco Ligero floral Homogéneo
40°C / 70%HR Color Olor Aspecto
- - -
Blanco Floral Homogéneo
Blanco Floral Homogéneo
Blanco Ligero floral Homogéneo
INTERPRETACIÓN:
El olor de todas las fórmulas disminuye a ligero floral a los 3 meses de almacenamiento, a
cualquiera de las temperaturas lo cual supone que el olor disminuye en el tiempo
independientemente de la temperatura.
La fórmula F1 es la única que se desestabiliza a temperatura de 40°C, mostrando dos fases desde el
primer mes de almacenamiento. Ya que esta fórmula no se desestabiliza a otras temperaturas en los
3 meses transcurridos, se puede suponer que la temperatura es el factor que influye en esta
separación de fases independientemente del tiempo que transcurra.

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
71
El color y aspecto de las fórmulas F1 y F2 no se ven afectados ni por el tiempo ni por la
temperatura. Se establece el siguiente orden de mejor a peor:
Mejor > F2- Urea al 5% = F3- Urea al 5% > F1- Urea al 3% > Peor
4.3.2 Estabilidad del pH. En condiciones de almacenamiento de alta temperatura y humedad, el
pH de las fórmulas F1, F2 y F3 en el transcurso del tiempo, se muestra a continuación (Ver Tabla
31):
Tabla 31. pH promedio de los Formulados Versus Tiempo
CONDICIÓN INICIAL MES 1 MES 2 MES 3
F1 25°C / 70%HR 5,42 5,43 5,41 5,49
30°C / 70%HR - 5,57 5,68 5,64
40°C / 70%HR - - - -
F2 25°C / 70%HR 5,17 5,13 5,17 5,28
30°C / 70%HR - 5,56 5,73 5,73
40°C / 70%HR - 5,58 5,61 5,58
F3 25°C / 70%HR 5,96 5,96 5,96 5,98
30°C / 70%HR - 5,71 5,70 5,72
40°C / 70%HR - 5,82 5,78 5,85
Se muestra el promedio de 3 repeticiones, para ver los datos completos, ver ANEXO 1
No se realiza la evaluación de la F1 a 40°C/70%HR debido a que presentó separación de fases
Realizando el Análisis de Varianza para diseño factorial AxB, se obtiene los siguientes resultados
(Ver Tabla 32):
Tabla 32. Análisis estadístico (ANOVA) para Estabilidad de pH de los Formulados
Fórmula F1: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) 0,139 1 0,139 13,98a 4,747
Factor B (tiempo) 0,014 2 0,007 0,687b 3,885
Interacción AB 0,012 2 0,006 0,608b 3,885
Dentro del grupo 0,119 12 0,01
Total 0,283 17
Tabla 32. Análisis estadístico (ANOVA) para Estabilidad de pH de los Formulados (Continuación)
Fórmula F2: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) 0,685 2 0,343 10,38a 3,555
Factor B (tiempo) 0,02 2 0,01 0,308b 3,555
Interacción AB 0,022 4 0,006 0,17b 2,928
Dentro del grupo 0,594 18 0,033
Total 1,322 26

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
72
Fórmula F3: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) 0,161 2 0,08 5,912a 3,555
Factor B (tiempo) 0,002 2 0,001 0,085b 3,555
Interacción AB 0,002 4 6x10-4
0,046b 2,928
Dentro del grupo 0,244 18 0,014
Total 0,41 26
a. Mayor al valor crítico, significativamente diferente
b. Menor o igual a valor crítico, significativamente igual
INTERPRETACIÓN:
Los resultados obtenidos son:
El análisis de varianza determina que para todas las formulaciones (F1-F2-F3) existe una
diferencia significativa en el factor Temperatura, debido a que la FCAL> FCRÍTICO, en tanto
que, no existe diferencia significativa en el factor Tiempo y en la interacción entre factores,
debido a que la FCAL< FCRÍTICO. Lo mencionado indica que el pH de las formulaciones se
ve influenciado por la Temperatura independientemente del Tiempo que transcurra.
A pesar de que el pH efectivamente varía con la temperatura, nunca se sale del rango permitido
(Ver Figura 18). Por lo tanto, todas las formulaciones son iguales entre sí:
F1- Urea al 7% = F2- Urea al 5% = F3- Urea al 3%.
Figura 18. pH promedio de los Formulados Versus Temperatura/Humedad
Se muestra la variación de pH de las fórmulas respecto a la temperatura y humedad de
almacenamiento. Los valores mostrados son promedios de todos los datos tomados de cada
temperatura/humedad, independientemente del tiempo transcurrido.
4.3.3 Estabilidad de la Viscosidad. En condiciones de almacenamiento de alta temperatura y
humedad, la viscosidad de las fórmulas F1, F2 y F3 en el transcurso del tiempo, se muestra a
continuación (Ver Tabla 33):
4,50
5,00
5,50
6,00
6,50
7,00
25°C / 70%HR 30°C / 70%HR 40°C / 70%HR
pH
F1 F2 F3 lim.inf lim.sup

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
73
Tabla 33. Viscosidad promedio de los Formulados Versus Tiempo
CONDICIÓN INICIAL MES 1 MES 2 MES 3
F1 25°C / 70%HR 49934 cPs 49806 cPs 49768 cPs 49611 cPs
30°C / 70%HR - 49311 cPs 48856 cPs 48581 cPs
40°C / 70%HR - - - -
F2 25°C / 70%HR 44361 cPs 44470 cPs 43456 cPs 43788 cPs
30°C / 70%HR - 43474 cPs 43822 cPs 43497 cPs
40°C / 70%HR - 38466 cPs 37741 cPs 37282 cPs
F3 25°C / 70%HR 43038 cPs 44750 cPs 44526 cPs 44361 cPs
30°C / 70%HR - 44322 cPs 44181 cPs 44042 cPs
40°C / 70%HR - 36989 cPs 36736 cPs 36962 cPs
Se muestra el promedio de 3 repeticiones, para ver los datos completos, ver ANEXO 1
No se realiza la evaluación de la F1 a 40°C/70%HR debido a que presentó separación de fases
Realizando el Análisis de Varianza para diseño factorial AxB, se obtiene los siguientes resultados
(Ver Tabla 32):
Tabla 34. Análisis estadístico (ANOVA) para Estabilidad de Viscosidad de los Formulados
Fórmula F1: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) 3020882 1 3020882 5,569a 4,747
Factor B (tiempo) 483744 2 241872 0,446b 3,885
Interacción AB 339283 2 169642 0,313b 3,885
Dentro del grupo 6509299 12 542442
Total 10353208 17
Fórmula F2: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) 191022080 2 95511040 125,89ª 3,555
Factor B (tiempo) 1566259 2 783129 1,032b 3,555
Interacción AB 1259335 4 314834 0,415b 2,928
Dentro del grupo 13656042 18 758669
Total 207503716 26
Fórmula F3: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) 139839282 2 69919641 48,12a 3,555
Factor B (tiempo) 235315 2 117657 0,081b 3,555
Interacción AB 227527 4 56882 0,039b 2,928
Dentro del grupo 26152282 18 1452905
Total 166454406,1 26
a. Mayor al valor crítico, significativamente diferente
b. Menor o igual a valor crítico, significativamente igual
INTERPRETACIÓN:
Los resultados obtenidos son:
El análisis de varianza determina que para todas las formulaciones (F1-F2-F3) existe una
diferencia significativa en el factor Temperatura, debido a que la FCAL> FCRÍTICO, en tanto

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
74
que, no existe diferencia significativa en el factor Tiempo y en la interacción entre factores,
debido a que la FCAL< FCRÍTICO. Lo mencionado indica que la viscosidad de las
formulaciones se ve influenciada por la Temperatura independientemente del Tiempo que
transcurra.
A pesar de que la viscosidad efectivamente varía con la temperatura, nunca se sale del rango
permitido (Ver Figura 19). Por lo tanto, todas las formulaciones son iguales entre sí:
F1- Urea al 7% = F2- Urea al 5% = F3- Urea al 3%.
Figura 19. Viscosidad promedio de los Formulados Versus Temperatura/Humedad
Se muestra la variación de viscosidad de las fórmulas respecto a la temperatura y humedad de
almacenamiento. Los valores mostrados son promedios de todos los datos tomados de cada
temperatura/humedad, independientemente del tiempo transcurrido.
4.3.4 Estabilidad del Peso Específico. En condiciones de almacenamiento de alta temperatura y
humedad, el Peso Específico de las fórmulas F1, F2 y F3 en el transcurso del tiempo, se muestra a
continuación (Ver Tabla 33):
Tabla 35. Peso Específico promedio de los Formulados Versus Tiempo
CONDICIÓN INICIAL MES 1 MES 2 MES 3
F1 25°C / 70%HR 1,12 g/mL 1,12 g/mL 1,10 g/mL 1,10 g/mL
30°C / 70%HR - 1,12 g/mL 1,10 g/mL 1,10 g/mL
40°C / 70%HR - - - -
F2 25°C / 70%HR 1,13 g/mL 1,13 g/mL 1,12 g/mL 1,12 g/mL
30°C / 70%HR - 1,13 g/mL 1,12 g/mL 1,12 g/mL
40°C / 70%HR - 1,13 g/mL 1,12 g/mL 1,12 g/mL
F3 25°C / 70%HR 1,09 g/mL 1,09 g/mL 1,09 g/mL 1,04 g/mL
30°C / 70%HR - 1,09 g/mL 1,09 g/mL 1,04 g/mL
40°C / 70%HR - 1,09 g/mL 1,09 g/mL 1,04 g/mL
Se muestra el promedio de 3 repeticiones, para ver los datos completos, ver ANEXO 1
No se realiza la evaluación de la F1 a 40°C/70%HR debido a que presentó separación de fases
Realizando el Análisis de Varianza para diseño factorial AxB, se obtiene los siguientes resultados
(Ver Tabla 36):
30000
35000
40000
45000
50000
55000
60000
65000
70000
75000
25°C / 70%HR 30°C / 70%HR 40°C / 70%HR
Vis
cosi
dad
F1 F2 F3 lim.inf lim.sup

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
75
Tabla 36. Análisis estadístico (ANOVA) para Estabilidad de Peso Específico de los Formulados
Fórmula F1: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) -8,67x10-19
1 -8,67x10-19
-3,5x10-15 b
4,747
Factor B (tiempo) 4,15x10-4
2 2,07x10-4
0,84 b 3,885
Interacción AB 1,30x10-18
2 6,51x10-19
2,6x10-15 b
3,885
Dentro del grupo 2,96x10-3
12 2,47x10-4
Total 3,38x10
-3 17
Fórmula F2: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) 0 2 0 0 b 3,555
Factor B (tiempo) 4,67x10-4
2 2,33x10-4
3 b 3,555
Interacción AB -2,17x10-19
4 -5,42x10-20
-7x10-16 b
2,928
Dentro del grupo 1,40x10-3
18 7,78x10-5
Total 1,87x10
-3 26
Fórmula F3: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) 0 2 0 0 b 3,555
Factor B (tiempo) 9,07x10-3
2 4,54x10-3
5,176 a 3,555
Interacción AB 0 4 0 0 b 2,928
Dentro del grupo 0,016 18 8,77x10-4
Total 0,025 26
a. Mayor al valor crítico, significativamente diferente
b. Menor o igual a valor crítico, significativamente igual
INTERPRETACIÓN:
Los resultados obtenidos son:
El análisis de varianza determina que para todas las formulaciones (F1-F2-F3) no existe
una diferencia significativa en el factor Temperatura, en la interacción entre factores y en
el factor Tiempo en las formulaciones F1 y F2, debido a que la FCAL< FCRÍTICO, mientras
que para el factor Tiempo en la formulación F3 existe una diferencia significativa debido a
que la FCAL>FCRÍTICO. Lo mencionado indica que para las formulaciones F1 yF2 el peso
específico no se ve influenciado por ninguna de las variable, en cambio la formulación F3
el peso específico se ve influenciado por el tiempo independientemente de la temperatura.
La forma cómo el peso específico de la formulación F3 varía con el tiempo, mientras que las otras
2 formulaciones F1 y F2 no lo hacen, se muestra e continuación (Ver Figura 20). El orden de mejor
a peor se establece de la siguiente manera:
Mejor >F1- Urea al 7% = F2- Urea al 5% > F3- Urea al 3% >Peor

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
76
Figura 20. Peso Específico promedio de los Formulados Versus Tiempo
Se muestra la variación de Peso Específico de las fórmulas respecto al tiempo transcurrido. Los
valores mostrados son promedios de todos los datos tomados de cada tiempo, independientemente
de la temperatura/humedad de almacenamiento. Nótese que la diferencia significativa determinada
para la fórmula F3 se da por la brusca disminución del peso específico en el mes 3.
4.3.5 Estabilidad de la Extensibilidad. En condiciones de almacenamiento de alta temperatura
y humedad, la extensibilidad de las fórmulas F1, F2 y F3 en el transcurso del tiempo, se muestra a
continuación (Ver Tabla 37):
Tabla 37. Extensibilidad promedio de los Formulados Versus Tiempo
CONDICIÓN PESAS INICIAL MES 1 MES 2 MES 3
F1 25°C /
70%HR
4 g
7 g
10 g
13 g
138,70 mm2
159,17 mm2
192,94 mm2
214,60 mm2
139,86 mm2
157,85 mm2
193,24 mm2
217,59 mm2
103,95 mm2
136,14 mm2
165,05 mm2
188,60 mm2
134,24 mm2
155,43 mm2
173,81 mm2
189,52 mm2
Función lineal
A
Pm
X
y=8,7x+102
8,72 mm2/g
158,92 mm2
89,46 mm4/g
y=8,9x+101
8,95 mm2/g
159,23 mm2
96,85 mm4/g
y=9,4x+68
9,43 mm2/g
129,58 mm2
235,55 mm4/g
y=6,1x+111
6,14 mm2/g
150,97 mm2
330,29 mm4/g
30°C /
70%HR
4 g
7 g
10 g
13 g
-
-
-
-
109,97 mm2
129,63 mm2
156,82 mm2
185,24 mm2
95,38 mm2
119,45 mm2
136,14 mm2
172,77 mm2
109,97 mm2
129,33 mm2
157,59 mm2
188,73 mm2
Función lineal
A
Pm
X
-
-
-
-
y=8,4x+73
8,43 mm2/g
128,55 mm2
281,41 mm4/g
y=8,3x+60
8,30 mm2/g
114,34 mm2
386,97 mm4/g
y=8,8x+71
8,82 mm2/g
128,77 mm2
266,16 mm4/g
40°C /
70%HR
4 g
7 g
10 g
13 g
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
1,00
1,10
1,20
INICIAL MES 1 MES 2 MES 3
Pes
o E
spec
ífic
o
F1 F2 F3 lim.inf lim.sup

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
77
Tabla 37. Extensibilidad promedio de los Formulados Versus Tiempo (Continuación)
CONDICIÓN PESAS INICIAL MES 1 MES 2 MES 3
F2 25°C /
70%HR
4 g
7 g
10 g
13 g
98,68 mm2
109,30 mm2
123,31 mm2
136,73 mm2
92,31 mm2
110,89 mm2
122,56 mm2
146,80 mm2
100,88 mm2
106,89 mm2
119,45 mm2
146,67 mm2
83,87 mm2
92,18 mm2
103,82 mm2
132,67 mm2
Función lineal
A
Pm
X
y=4,3x+81
4,27 mm2/g
108,46 mm2
664,73 mm4/g
y=5,8x+69
5,84 mm2/g
106,46 mm2
601,05 mm4/g
y=5,0x+76
5,00 mm2/g
108,48 mm2
629,14 mm4/g
y=5,3x+58
5,27 mm2/g
92,60 mm2
787,68 mm4/g
30°C /
70%HR
4 g
7 g
10 g
13 g
-
-
-
-
144,13 mm2
165,44 mm2
177,02 mm2
208,19 mm2
97,93 mm2
109,97 mm2
129,33 mm2
161,45 mm2
95,38 mm2
113,04 mm2
132,80 mm2
161,32 mm2
Función lineal
A
Pm
X
-
-
-
-
y=6,8x+116
6,79 mm2/g
160,11 mm2
133,45 mm4/g
y=7,0x+65
7,00 mm2/g
110,68 mm2
498,47 mm4/g
y=7,3x+64
7,25 mm2/g
111,13 mm2
473,45 mm4/g
40°C /
70%HR
4 g
7 g
10 g
13 g
-
-
-
-
137,56 mm2
163,94 mm2
148,65 mm2
224,97 mm2
125,38 mm2
112,53 mm2
138,95 mm2
156,56 mm2
106,13 mm2
124,14 mm2
119,44 mm2
157,83 mm2
Función lineal
A
Pm
X
-
-
-
-
y=8,2+99
8,23 mm2/g
152,32 mm2
118,50 mm4/g
y=4,0x+99
4,00 mm2/g
125,36 mm2
472,55 mm4/g
y=5,0x+84
5,01 mm2/g
116,86 mm2
528,65 mm4/g
F3 25°C /
70%HR
4 g
7 g
10 g
13 g
110,68 mm2
116,01 mm2
141,13 mm2
168,13 mm2
109,97 mm2
119,72 mm2
139,86 mm2
169,43 mm2
97,75 mm2
100,01 mm2
127,30 mm2
163,15 mm2
103,24 mm2
108,31 mm2
113,17 mm2
146,93 mm2
Función lineal
A
Pm
X
y=6,6x+78
6,58 mm2/g
120,83
435,17 mm4/g
y=6,6x+79
6,62 mm2/g
121,51 mm2
428,56 mm4/g
y=7,5x+59
7,45 mm2/g
107,16 mm2
519,80 mm4/g
y=4,5x+79
4,53 mm2/g
108,85 mm2
655,29 mm4/g
30°C /
70%HR
4 g
7 g
10 g
13 g
-
-
-
-
113,49 mm2
133,06 mm2
150,79 mm2
189,12 mm2
109,52 mm2
98,06 mm2
116,25 mm2
139,60 mm2
113,44 mm2
132,80 mm2
146,67 mm2
176,63 mm2
Función lineal
A
Pm
X
-
-
-
-
y=8,2x+77
8,15 mm2/g
130,31 mm2
286,41 mm4/g
y=3,6x+85
3,61 mm2/g
108,63 mm2
706,09 mm4/g
y=6,8x+85
6,78 mm2/g
128,82 mm2
326,55 mm4/g
40°C /
70%HR
4 g
7 g
10 g
13 g
-
-
-
-
126,24 mm2
138,06 mm2
152,43 mm2
175,32 mm2
104,52 mm2
107,99 mm2
123,16 mm2
135,19 mm2
129,94 mm2
134,61 mm2
134,36 mm2
159,73 mm2
Función lineal
A
Pm
X
-
-
-
-
y=5,4x+102
5,39 mm2/g
137,24 mm2
317,00 mm4/g
y=3,6x+87
3,57 mm2/g
110,57 mm2
685,21 mm4/g
y=3,0x+114
2,97 mm2/g
133,72 mm2
410,55 mm4/g
Se muestra el promedio de 3 repeticiones, para ver los datos completos, ver ANEXO 1
No se realiza la evaluación de la F1 a 40°C/70%HR debido a que presentó separación de fases
Los datos de función lineal, pendiente (A), punto medio (Pm) y factor de comparación (X) son promedios de las
repeticiones, y no guardan relación matemática entre sí, o sea: 𝑋 ≠ 16,15 − 𝐴 165 − 𝑃𝑚

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
78
Para el análisis estadístico, se utilizan los datos del Factor de comparación (X), obteniendo los
siguientes resultados para el Análisis de Varianza para diseño factorial AxB (Ver Tabla 38):
Tabla 38. Análisis estadístico (ANOVA) para Estabilidad de Extensibilidad de los Formulados
Fórmula F1: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) 20056,7 1 20056,7 12,883 a 4,747
Factor B (tiempo) 25996,6 2 12998,3 8,349 a 3,885
Interacción AB 39652,8 2 19826,4 12,735 a 3,885
Dentro del grupo 18682,0 12 1556,8
Total 104388,1 17
Fórmula F2: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) 270207,0 2 135103,5 17,907 a 3,555
Factor B (tiempo) 368553,6 2 184276,8 24,424 a 3,555
Interacción AB 189190,0 4 47297,5 6,269 a 2,928
Dentro del grupo 135806,7 18 7544,8
Total 963757,3 26
Fórmula F3: Análisis de Varianza para dos factores AxB
Origen de las
variaciones
Suma de
cuadrados
Grados de
libertad
Promedio de
los cuadrados F
Valor crítico
para F
Factor A (Temperatura) 24289,5 2 12144,7 1,104 b 3,555
Factor B (tiempo) 112882,6 2 56441,3 5,132 a 3,555
Interacción AB 13388,0 4 3347,0 0,304 b 2,928
Dentro del grupo 197958,3 18 10997,7
Total 348518,4 26
a. Mayor al valor crítico, significativamente diferente
b. Menor o igual a valor crítico, significativamente igual
INTERPRETACIÓN:
Los resultados obtenidos son:
El análisis de varianza determina que existe una diferencia significativa para todas las
formulaciones (F1-F2-F3) en el factor Tiempo y para las formulaciones F1 y F2 en el
factor Temperatura y en la interacción entre factores, debido a que la FCAL> FCRÍTICO, en
tanto que, no existe una diferencia significativa en la formulación F3 en el factor
Temperatura y en la interacción entre factores, debido a que la FCAL< FCRÍTICO. Lo
mencionado indica que en las formulaciones F1 y F2, los factores Tiempo y Temperatura
influyen sobre la extensibilidad e incluso hay interacción entre factores, mientras que en la
formulación F3, el único factor que influencia sobre la extensibilidad es el tiempo,
independientemente de la temperatura de almacenamiento. El orden de mejor a peor se
establece de la siguiente manera:
Mejor >F1- Urea al 7% > F2- Urea al 5% = F3- Urea al 3% >Peor

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
79
La forma cómo las funciones lineales de las formulaciones (F1-F2-F3) varían a las diferentes
temperaturas y tiempos de almacenamiento, se muestra a continuación (Ver Figura 21):
Figura 21. Funciones lineales promedio de Extensibilidad de los Formulados a varios
Tiempos y Temperatura/Humedad
Se muestra la variación de la extensibilidad de las fórmulas respecto al tiempo y la temperatura
/humedad de almacenamiento. Nótese cómo las funciones lineales de los diferentes tiempos son
diferentes entre sí en todas las gráficas. Nótese también que sólo en las fórmulas F1 y F2 las
funciones se mueven arriba o abajo a diferentes temperaturas, mientras que en la F3 las líneas se
mantienen a una misma altura en las tres gráficas de temperatura.
0
50
100
150
200
250
300
0 2 4 6 8 10 12 14
Exte
nsi
bili
dad
(m
m2)
Masa (g)
F125°C / 70%HR
0
50
100
150
200
250
300
0 2 4 6 8 10 12 14
Exte
nsi
bili
dad
(m
m2)
Masa (g)
F130°C / 70%HR
INICIAL
MES 1
MES 2
MES 3
Lineal (ESPECIFICACION)
0
50
100
150
200
250
300
0 2 4 6 8 10 12 14
Exte
nsi
bili
dad
(m
m2)
Masa (g)
F225°C / 70%HR
0
50
100
150
200
250
300
0 2 4 6 8 10 12 14
Exte
nsi
bili
dad
(m
m2)
Masa (g)
F230°C / 70%HR
0
50
100
150
200
250
300
0 2 4 6 8 10 12 14
Exte
nsi
bili
dad
(m
m2)
Masa (g)
F240°C / 70%HR
0
50
100
150
200
250
300
0 2 4 6 8 10 12 14
Exte
nsi
bili
dad
(m
m2)
Masa (g)
F325°C / 70%HR
0
50
100
150
200
250
300
0 2 4 6 8 10 12 14
Exte
nsi
bili
dad
(m
m2)
Masa (g)
F330°C / 70%HR
0
50
100
150
200
250
300
0 2 4 6 8 10 12 14
Exte
nsi
bili
dad
(m
m2)
Masa (g)
F340°C / 70%HR

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
80
4.3.6 Estabilidad de las Propiedades Microbiológicas. En condiciones de almacenamiento de
alta temperatura y humedad, el conteo de bacterias y hongos, y presencia de microrganismos
objetables en las fórmulas F1, F2 y F3 en el transcurso del tiempo, se muestra a continuación (Ver
Tabla 39):
Tabla 39. Propiedades Microbiológicas de los Formulados versus Tiempo
CONDICIÓN PARÁMETRO INICIAL MES 1 MES 2 MES 3
F1 25°C /
70%HR
Bacterias Hongos S. aureus P. aeruginosa
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
30°C /
70%HR
Bacterias Hongos S. aureus P. aeruginosa
- - - -
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
40°C /
70%HR
Bacterias Hongos S. aureus P. aeruginosa
- - - -
- - - -
- - - -
- - - -
F2 25°C /
70%HR
Bacterias Hongos S. aureus P. aeruginosa
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
30°C /
70%HR
Bacterias Hongos S. aureus P. aeruginosa
- - - -
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
40°C /
70%HR
Bacterias Hongos S. aureus P. aeruginosa
- - - -
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
F3 25°C /
70%HR
Bacterias Hongos S. aureus P. aeruginosa
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
30°C /
70%HR
Bacterias Hongos S. aureus P. aeruginosa
- - - -
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
40°C /
70%HR
Bacterias Hongos S. aureus P. aeruginosa
- - - -
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
< 10² UFC/g <10² UFC/g Ausencia Ausencia
INTERPRETACIÓN:
Todas las fórmulas cumplen con el requerimiento establecido, sin ninguna variación ni por el
tiempo, ni por la temperatura/humedad de almacenamiento. Por lo tanto, todas las formulaciones
son iguales entre sí:
F1- Urea al 7% = F2- Urea al 5% = F3- Urea al 3%.

CAPITULO IV: ANALISIS E INTERPRETACIÓN DE RESULTADOS
81
4.4 COMPENDIO DE RESULTADOS
A continuación se muestra un resumen de todos los resultados y la correspondiente interpretación
respecto de las tres fórmulas evaluadas (Ver Tabla 40):
Tabla 40. Resumen y Ponderación de Resultados
PARÁMETRO RESULTADO
CUMPLE
ESPECIFICACIÓN
PONDERACIÓN*
F1 F2 F3
FISICOQUIMICO
Apariencia F1=F2=F3 Todos 6 6 6
pH F3 > F1 > F2 Todos 5 4 6
Viscosidad F1 > F2=F3 Todos 6 5 5
Peso Específico F1=F2=F3 Todos 6 6 6
Extensibilidad F1 > F2=F3 Todos 6 5 5
MICROBIOLÓGICO
Conteo de Bacterias F1=F2=F3 Todos 6 6 6
Conteo de Hongos F1=F2=F3 Todos 6 6 6 S. aureus F1=F2=F3 Todos 6 6 6
P. aeruginosa F1=F2=F3 Todos 6 6 6
ESTABILIDAD
Estabilidad Apariencia F2=F3 > F1 F2, F3 1 6 6
Estabilidad pH F1=F2=F3 Todos 6 6 6
Estabilidad Viscosidad F1=F2=F3 Todos 6 6 6
Estabilidad Peso Específico F1=F2 > F3 F1, F2 6 6 1
Estabilidad Extensibilidad F1 > F2=F3 Todos 6 5 5
Estabilidad Microbiológico F1=F2=F3 Todos 6 6 6
PONDERACIÓN PROMEDIO 5,60 5,67 5,47 * Se pondera el resultado según lo siguiente: 6 mejor resultado dentro de especificación
5 resultado intermedio dentro de especificación 4 peor resultado dentro de especificación
3 mejor resultado fuera de especificación
2 resultado intermedio fuera de especificación
1 peor resultado fuera de especificación
INTERPRETACIÓN:
En conjunto, la formulación F2 tiene la mayor ponderación promedio, seguido de la formulación
F1 y al final la formulación F3. En el análisis organoléptico y fisicoquímico inicial, la F2 no es la
de mejores propiedades aunque todas ellas entran en las especificaciones, pero ya que F2 no
muestra problemas de estabilidad como ocurre en F1 (en apariencia) y F3 (en peso específico), ésta
termina como la mejor formulación del estudio.

CAPITULO V: CONCLUSIONES Y RECOMENDACIONES
82
5. CONCLUSIONES
Se realizó el Diseño, Formulación y Elaboración de una crema de protección solar, utilizando
diferentes concentraciones de UREA como agente queratolítico, para determinar que
formulación es idónea y constituya una alternativa Dermocosmética que ayude a proteger e
hidratar la piel de personas que padecen Psoriasis.
Referente al Diseño y Formulación de la Crema con protección solar los componentes
utilizados en la misma son estables con el principio activo (urea) y cumplen con las
especificaciones Organolépticas, Físicas y Microbiológicas en Condiciones Normales y en
Condiciones Extremas.
El análisis estadístico determina que la formulación F2 que contiene UREA al 5% es la mejor
de las tres formulaciones evaluadas (Ver tabla 10). Sus propiedades se muestran a
continuación ( Tabla 41):
Tabla 41. Propiedades Organolépticas, Fisicoquímicas y Microbiológicas de F2
ENSAYOS ESPECIFICACIONES RESULTADO
ORGANOLÉPTICOS
Color Blanco Cumple
Olor Floral Cumple
Aspecto Homogénea Cumple
FÍSICOS
pH 5,0 – 6,5 5,17
Peso especifico 1,05 – 1,15 g/mL 1,13 g/mL
Viscosidad 35000 – 70000 cP 44361 cps
Extensibilidad 60 – 270 mm2 80,7 – 136,73 mm
2
MICROBIOLÓGICOS
Recuento bacterias < 102 UFC/g Cumple
Recuento hongos < 102 UFC/g Cumple
Objetable 1: Staphylococcus aureus Ausencia Cumple
Objetable 2: Pseusomona aeruginosa Ausencia Cumple
La fórmula F2 posee una excelente estabilidad:
o La apariencia del producto no sufre variaciones considerables en el tiempo a ninguna
temperatura, excepto por una ligera disminución del aroma de poca importancia.
o El pH aumenta ligeramente con el tiempo y en mayor medida con la temperatura,
siendo esto último un comportamiento normal (a mayor temperatura, mayor potencia
eléctrica y por lo tanto mayor pH). A pesar de esto, los valores siempre se encuentran
dentro del rango de pH óptimo especificado (5 – 6,5).
o La viscosidad prácticamente no cambia en el transcurso del tiempo, y sólo disminuye
por la temperatura, lo cual nuevamente es un comportamiento normal. La viscosidad
también se mantienen siempre dentro del rango óptimo (35000 – 70000 cP)

CAPITULO V: CONCLUSIONES Y RECOMENDACIONES
83
o El peso específico se mantiene invariable a cualquier temperatura o tiempo de
almacenamiento, lo cual demuestra que no sufre ningún cambio estructural o molecular
por ninguna de estas dos variables. La fórmula es químicamente estable.
o La extensibilidad siempre mantiene una curva creciente dentro del rango especificado
(60 – 270 mm2), con una pendiente menor a la óptima, lo cual significa que requiere
mayor fuerza para extenderse sobre la piel, aunque dicha cantidad de fuerza entra en la
especificación.
o La cantidad de microorganismos (bacterias, hongos y objetables) nunca sobrepasa los
límites permisibles durante todo el tiempo transcurrido y a todas las temperaturas, con
lo cual se asegura que la fórmula no permite el crecimiento de microorganismos
siempre y cuando se la fabrique respetando las Buenas Prácticas de Manufactura.

CAPITULO V: CONCLUSIONES Y RECOMENDACIONES
84
RECOMENDACIONES
Se recomienda complementar los estudios realizados en este trabajo de tesis, con los estudios
pre-clínicos y clínicos necesarios para demostrar la efectividad terapéutica de la fórmula F2
desarrollada.
Se recomienda que antes de realizar los diferentes controles físicos y químicos se verifique que
los equipos para dichos controles se encuentran en buenas condiciones y de ser el caso
debidamente calibrados.
En la elaboración de cremas con filtros solares se recomienda trabajar a temperaturas elevadas
dentro de las tolerancias de cada componente para lograr fundir por completo los filtros solares
y también se debe mantener una constante agitación para evitar la separación de fases en el
producto final.
Se recomienda realizar un estudio de estabilidad acelerada y estabilidad a largo plazo, para
determinar el periodo de caducidad de la crema, en condiciones aptas para el consumo en su
envase original y en condiciones de almacenamiento del producto.

BIBLIOGRAFÍA
85
BIBLIOGRAFÍA
Referencias de Libros
AVRIL, M. (2004). Sol y piel: beneficios , riesgos y prevención. Barcelona, España: Masson.
CABRERA, & et al. (2005). Radiacion ultravioleta y Salud. Santiago de Chile, Chile:
Universitaria.
CAÑARTE, C., CABRERA, F., & PALACIOS, S. (2004). “Epidemiologia de psoriasis en el
Distrito metropolitano de Quito”. Sociedad ecuatoriana de dermatología. Quito, Ecuador:
Autor.
CARVAJAL, A. (2004). Formulación de una Nanoemulsión Dermocosmetica, Nutritiva y
Regeneradora de la piel (Tesis de Posgrado ). Universidad de los Andes. Venezuela.
DE LA CADENA, M. (05 de 2010). "Folleto de Tecnologia Farmacéutica". Quito, Ecuador:
Universidad Central del Ecuador.
FERNANDEZ, E. (2002). Técnicas de Procedimientos en Formulción Magistral Dermatologica.
Mexico, México: El Ateneo.
GARCIA, A., & et al. (2012). La piel (Vol. Tomo II). Madrid, España: Dias de Santos.
JATIVA, C. (2000). Texto Básico Fitoquímica de la ESPOCH. Riebamba, Ecuador: Autor.
KOVACS, H., & PREUK, M. (2007). The care of your skin. Barcelona, España: Robin Book.
MARTIN, M. (2005). “Introducción a la dermofarmacia y a la cosmetología”. Zaragoza, España:
Acribiana.
RIBERA, M., & et al. (2003). El sol y la piel (Tercera ed.). Madrid, España: Medifam.
SALAZAR, M. (2001). “Gestión de la calidad en el desarrollo y fabricación industrial de
medicamentos”. Barcelona, España: Autor.
SERNA, J., VITALES, M., & LÓPEZ, M. (2001). Dermatología. Barcelona, España: Médica
Panamericana
VERSCHOOTEN, L. (2006). Nuevas estrategias de fotoprotección. Guadalajara, México:
Photochem.
Referencias de Revistas
VALDIZAN, H. (1983). “Nociones sobre cosméticos: elaboración de cosméticos”. Nueva revista
de enseñanzas medias, 10(3), 103-109.
Referencias de Leyes y Reglamentos
CONSTITUCIÓN DE LA REPUBLICA DEL ECUADOR. (20 de Octubre de 2008). En
Registro Oficial No.449. República del Ecuador.
Ley No.2006-67 Ley Orgánica de la Salud. (22 de Diciembre de 2006). En Registro Oficial
No.423. República del Ecuador.
CONSEJO NACINAL DE MEDICAMENTOS [CONASA]. (2007). Política nacional de
medicamentos. Ecuador: Autor
Acuerdo Ministerial No.4640 sobre Reglamento de Buenas Prácticas de Manufactura [BPM]. (19
de Julio de 1994). En Registro Oficial No.486 . República del Ecuador.

BIBLIOGRAFÍA
86
Referencias de Sitios Web
BEIERSDORF AG. (s.f.). Tras la ciencia de Eucerin Hyal Urea. Recuperado el 25 de Enero de
2015 (20h04), de http://www.eucerin.es/nuestras-investigaciones/la-base-cientifica/hyal-
urea
BELEN, Y., HERNÁNDEZ, N., & et al. (Octubre de 2014). Efectividad de la crema de Aloe vera
en pacientes con psoriasis vulgar de la Parroquia San Fernando. MEDISAN, 18(10), 1357-
1365. Recuperado el 20 de 01 de 2015, de
http://bvs.sld.cu/revistas/san/SAN%2018(10)/HTML/san041810.htm
DERMA. (29 de Mayo de 2015). “Recomendaciones orientativas del departamento de sanidad y
seguridad social según el UVI (nivel de radiación)” . Recuperado el 14 de Junio de 2015
(11h23), de http://www.centroderma.com/consejos-para-tomar-el-sol
EHOWENESPAÑOL.COM. (08 de Agosto de 2015). Todo sobre PABA. Recuperado el 29 de Julio
de 2015 (10h15), de http://www.ehowenespanol.com/peligros-del-paba-sobre_74253/
24/03/2015
FERATO. (30 de Abril de 2015). Enciclopedia Médica en Línea. Recuperado el 01 de Julio de
2011 (17h00), de http://www.ferato.com/wiki/index.php/Piel.
FONDATION POUR LA DERMATITE ATOPIQUE - RECHERCHE. (16 de Mayo de 2014).
“Dermatite atopique” . Recuperado el 02 de Mayo de 2015 (14h33), de
http://www.fondation-dermatite-atopique.org/es/espacio-profesionales-de-la-salud/scorad-
y-po-scorad#arrivee_scorad
MORENO, M., & MORENO, L. (2010). Mecanismo de acción de fotoproctetores. Asoc Colomb
Dermatol., 20(18), 31-39. Recuperado el 24 de Marzo de 2015 (18h00)
MULLARES, M. (2001). Monografias.com. Recuperado el 30 de 06 de 2011, de
http://www.monografias.com/trabajos10/protoco/protoco.shtml#CINCO.
RIOS, P. (s.f.). BIOCLINIC- Cosmecéutica para reactivar tu Juventud . Recuperado el 22 de Mayo
de 2015 (20:00), de https://oriescuelacorrecaminos.wordpress.com/tag/flacidez/
UNIVERSIDAD DE SEVILLA. (s.f.). Autoevaluación práctica Planificación, programación y
control de proyectos. Recuperado el 21 de Noviembre de 2014, de
http://rodas.us.es/file/e7208ea6-0bac-c0b2-25b6-481fbb8eaab0/1/solucion_
detallada_planificacion.zip/pagina_01.htm

ANEXOS
87
ANEXO 1. Registro de fotografías
PRODUCTO:

ANEXOS
88
EQUIPOS:
VISCOSIMETRO PHMETRO
BALANZA AGITADOR MAGNÉTICO

ANEXOS
89
ANEXO 2. Registro de todas las Mediciones realizadas:
REGISTRO COMPLETO DE DATOS DE PROPIEDADES ORGANOLÉPTICAS
ORGANOLÉPTICOS
MES 1 MES 2 MES 3
25ºC 30ºC 40ºC 25ºC 30ºC 40ºC 25ºC 30ºC 40ºC
70% HR 70% HR 70% HR 70% HR 70% HR 70% HR 70% HR 70% HR 70% HR
PRUEBAS DE ESTABILIDAD F1
COLOR Blanco Blanco Blanco Blanco Blanco Blanco Blanco Blanco Blanco
OLOR Floral Floral Floral Floral Floral Floral Ligeramente
Floral
Ligeramente
Floral Ligeramente Floral
ASPECTO Homogénea Homogénea Separación
de fases Homogénea Homogénea
Separación
de fases Homogénea Homogénea Separación de fases
PRUEBAS DE ESTABILIDAD F2
COLOR Blanco Blanco Blanco Blanco Blanco Blanco Blanco Blanco Blanco
OLOR Floral Floral Floral Floral Floral Floral Ligeramente
Floral
Ligeramente
Floral Ligeramente Floral
ASPECTO Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea
PRUEBAS DE ESTABILIDAD F3
COLOR Blanco Blanco Blanco Blanco Blanco Blanco Blanco Blanco Blanco
OLOR Floral Floral Floral Floral Floral Floral Ligeramente
Floral
Ligeramente
Floral Ligeramente Floral
ASPECTO Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea
PRUEBAS DE ESTABILIDAD EUCERIN UREA
COLOR Blanco Blanco Blanco Blanco Blanco Blanco Blanco Blanco Blanco
OLOR Ligeramente
cítrico
Ligeramente
cítrico
Ligeramente
cítrico
Ligeramente
cítrico
Ligeramente
cítrico
Ligeramente
cítrico
Ligeramente
cítrico
Ligeramente
cítrico Ligeramente cítrico
ASPECTO Homogénea Homogénea
Ligera
separación
de fases
Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea
PRUEBAS DE ESTABILIDAD SUNCARE
COLOR Blanco Blanco Blanco Blanco Blanco Blanco Blanco Blanco Blanco
OLOR Frutal (coco) Frutal
(coco) Frutal (coco)
Frutal
(coco) Frutal (coco)
Frutal
(coco)
LigeramenteFrutal
(coco)
LigeramenteFrutal
(coco)
LigeramenteFrutal
(coco)
ASPECTO Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea Homogénea

ANEXOS
90
REGISTRO COMPLETO DE DATOS DE pH
PH INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
F1 UREA 7%
25°C / 70%HR 5,44 5,41 5,40 5,46 5,41 5,43 5,44 5,40 5,40 5,56 5,42 5,48
30°C / 70%HR 5,61 5,43 5,66 5,89 5,55 5,61 5,60 5,73 5,58
40°C / 70%HR - - - - - - - - -
F2 UREA 5%
25°C / 70%HR 5,09 5,33 5,08 5,00 5,30 5,08 5,05 5,36 5,10 5,07 5,36 5,40
30°C / 70%HR 5,12 5,56 6,01 5,67 5,53 5,98 5,51 5,71 5,98
40°C / 70%HR 5,65 5,58 5,51 5,71 5,58 5,54 5,65 5,60 5,50
F3 UREA 3%
25°C / 70%HR 6,00 6,00 5,88 6,02 6,00 5,87 6,00 6,00 5,88 6,00 6,04 5,90
30°C / 70%HR 5,87 5,76 5,50 5,80 5,76 5,55 5,81 5,77 5,59
40°C / 70%HR 5,99 5,80 5,66 5,89 5,83 5,63 5,99 5,88 5,69
EUCERIN UREA
25°C / 70%HR 6,44 6,41 6,24 6,20
30°C / 70%HR 6,44 6,13 6,05 6,05
40°C / 70%HR 6,44 6,32 6,28 6,12
SUNCARE
25°C / 70%HR 5,09 5,33 5,09 5,07
30°C / 70%HR 5,09 5,21 5,21 5,51
40°C / 70%HR 5,09 5,16 5,20 5,19

ANEXOS
91
REGISTRO COMPLETO DE DATOS DE VISCOSIDAD
VISCOSIDAD INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
F1 UREA 7%
25°C / 70%HR 48997 49320 51485 48900 49275 51244 48887 49273 51144 48540 49204 51090
30°C / 70%HR 48003 48780 51150 46561 48759 51249 46567 48066 51110
40°C / 70%HR - - - - - - - - -
F2 UREA 5%
25°C / 70%HR 44679 44529 43875 44600 44789 44022 42370 43998 44001 43453 43877 44033
30°C / 70%HR 41567 44701 44155 41765 43999 45701 41850 43885 44755
40°C / 70%HR 38650 38769 37980 38004 38230 36989 37650 37654 36542
F3 UREA 3%
25°C / 70%HR 42334 41568 45213 45579 45001 43670 45509 44870 43200 45000 44803 43279
30°C / 70%HR 44908 44780 43278 44500 44886 43158 44321 44561 43244
40°C / 70%HR 35660 38765 36543 35055 38562 36590 35790 38544 36551
EUCERIN UREA
25°C / 70%HR 58791 58673 58505 58321
30°C / 70%HR 58791 57743 57641 57770
40°C / 70%HR 58791 54610 53200 54439
SUNCARE
25°C / 70%HR 44345 44609 44521 44567
30°C / 70%HR 44345 44561 44112 44502
40°C / 70%HR 44345 44508 44100 44021

ANEXOS
92
REGISTRO COMPLETO DE DATOS DE PESO ESPECÍFICO
PESO ESPECÍFICO INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
F1 UREA 7%
25°C / 70%HR 1,12 1,13 1,10 1,12 1,13 1,10 1,11 1,13 1,07 1,11 1,10 1,08
30°C / 70%HR 1,12 1,13 1,10 1,11 1,13 1,07 1,11 1,10 1,08
40°C / 70%HR - - - - - - - - -
F2 UREA 5%
25°C / 70%HR 1,12 1,12 1,15 1,12 1,12 1,15 1,12 1,10 1,15 1,11 1,12 1,13
30°C / 70%HR 1,12 1,12 1,15 1,12 1,10 1,15 1,11 1,12 1,13
40°C / 70%HR 1,12 1,12 1,15 1,12 1,10 1,15 1,11 1,12 1,13
F3 UREA 3%
25°C / 70%HR 1,08 1,09 1,11 1,08 1,09 1,11 1,08 1,09 1,11 1,05 1,09 0,99
30°C / 70%HR 1,08 1,09 1,11 1,08 1,09 1,11 1,05 1,09 0,99
40°C / 70%HR 1,08 1,09 1,11 1,08 1,09 1,11 1,05 1,09 0,99
EUCERIN UREA
25°C / 70%HR 1,01 1,01 1,02 1,01
30°C / 70%HR 1,01 1,01 1,01 1,01
40°C / 70%HR 1,01 1,02 1,01 1,01
SUNCARE
25°C / 70%HR 0,99 1,00 1,00 0,98
30°C / 70%HR 0,99 1,00 0,99 1,00
40°C / 70%HR 0,99 0,99 0,98 1,00

ANEXOS
93
REGISTRO COMPLETO DE DATOS DE EXTENSIBILIDAD
EXTENSIBILIDAD INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN PESO (g) REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
F1 UREA 7%
25°C / 70%HR
4,0 151,60 122,64 141,87 153,86 122,66 143,07 103,82 113,04 94,99 113,04 176,63 113,04
7,0 177,88 145,97 153,66 176,63 143,07 153,86 143,07 132,67 132,67 132,67 200,96 132,67
10,0 202,96 164,06 211,79 200,96 165,05 213,72 165,05 165,05 165,05 153,86 213,72 153,86
13,0 224,70 198,60 220,51 223,76 188,60 240,41 188,60 188,60 188,60 165,05 226,87 176,63
A 8,15 8,20 9,80 7,80 7,33 11,73 9,21 8,64 10,44 5,91 5,45 7,07
B 120,04 88,13 98,64 122,49 92,57 88,07 71,84 76,44 56,58 90,94 158,23 83,99
Pm 172,99 141,42 162,35 173,20 140,19 164,31 131,71 132,57 124,45 129,34 193,65 129,92
X 64,01 187,58 16,81 68,50 218,99 3,07 231,11 243,83 231,70 365,39 306,65 318,83
30°C / 70%HR
4,0 113,04 113,04 103,82 78,50 103,82 103,82 113,04 113,04 103,82
7,0 133,55 132,67 122,66 113,04 122,66 122,66 132,67 132,67 122,66
10,0 151,56 153,86 165,05 132,67 143,07 132,67 153,86 153,86 165,05
13,0 178,14 200,96 176,63 176,63 165,05 176,63 188,60 200,96 176,63
A 7,11 9,50 8,69 10,47 6,80 7,61 8,26 9,50 8,69
B 83,63 69,40 68,14 36,24 75,82 69,22 76,81 69,40 68,14
Pm 129,85 131,14 124,65 104,28 120,04 118,72 130,52 131,14 124,65
X 317,86 225,38 300,99 345,31 420,37 395,23 272,12 225,38 300,99
40°C / 70%HR
4,0 - - - - - - - - -
7,0 - - - - - - - - -
10,0 - - - - - - - - -
13,0 - - - - - - - - -

ANEXOS
94
REGISTRO COMPLETO DE DATOS DE EXTENSIBILIDAD (CONTINUACIÓN) EXTENSIBILIDAD INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN PESO (g) REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
F2 UREA 5%
25°C / 70%HR
4,0 101,76 90,76 103,53 86,55 86,55 103,82 94,99 103,82 103,82 78,50 86,55 86,55
7,0 101,88 102,46 123,56 106,20 103,82 122,66 103,82 103,82 113,04 94,99 86,55 94,99
10,0 112,66 123,56 133,70 112,36 122,66 132,67 122,66 113,04 122,66 103,82 103,82 103,82
13,0 154,16 132,17 123,86 153,86 132,67 153,86 143,07 153,86 143,07 132,67 132,67 132,67
A 5,60 4,84 2,37 6,94 5,24 5,34 5,44 5,31 4,25 5,71 5,19 4,91
B 70,02 71,06 101,01 55,78 66,89 82,88 69,93 73,49 84,56 53,95 58,30 62,80
Pm 106,42 102,55 116,42 100,87 100,95 117,58 105,26 108,01 112,16 91,07 92,02 94,69
X 618,32 706,29 669,56 591,12 699,09 512,93 640,25 617,89 629,27 771,99 800,29 790,76
30°C / 70%HR
4,0 155,86 153,86 122,66 103,82 94,99 94,99 78,50 103,82 103,82
7,0 176,63 176,63 143,07 103,82 113,04 113,04 113,04 113,04 113,04
10,0 188,60 188,60 153,86 122,66 132,67 132,67 143,07 132,67 122,66
13,0 226,87 221,70 176,00 153,86 176,63 153,86 165,05 165,05 153,86
A 7,50 7,18 5,69 5,63 8,82 6,54 9,66 6,78 5,32
B 123,24 124,14 100,50 73,17 54,38 68,04 42,84 71,04 78,09
Pm 171,99 170,83 137,51 109,78 111,70 110,56 105,60 115,09 112,70
X 60,49 52,31 287,55 581,06 391,01 523,33 385,95 467,98 566,41
40°C / 70%HR
4,0 135,16 131,86 145,66 132,20 141,99 101,95 101,56 113,82 103,00
7,0 166,60 176,53 148,70 104,12 117,04 116,42 111,04 143,40 117,99
10,0 183,40 148,60 113,96 152,36 132,47 132,01 123,07 122,88 112,38
13,0 216,75 261,87 196,30 133,60 176,53 159,56 165,85 155,75 151,89
A 8,72 12,07 3,91 1,75 3,97 6,28 6,83 3,51 4,70
B 101,37 77,12 117,95 115,71 108,28 74,10 67,33 104,14 81,35
Pm 158,04 155,58 143,34 127,07 134,07 114,92 111,72 126,94 111,91
X 51,75 38,49 265,25 546,36 376,89 494,41 496,77 481,21 607,97

ANEXOS
95
REGISTRO COMPLETO DE DATOS DE EXTENSIBILIDAD (CONTINUACIÓN) EXTENSIBILIDAD INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN PESO (g) REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
F3 UREA 3%
25°C / 70%HR
4,0 105,21 115,44 111,40 103,82 113,04 113,04 101,85 90,55 100,85 103,59 99,59 106,55
7,0 102,82 112,55 132,67 103,82 122,66 132,67 96,55 94,99 108,50 104,56 116,55 103,82
10,0 125,76 144,99 152,65 122,66 143,07 153,86 113,04 165,05 103,82 113,04 103,82 122,66
13,0 143,17 173,63 187,60 143,07 176,63 188,60 143,07 213,72 132,67 143,07 132,67 165,05
A 4,56 6,90 8,29 4,55 7,04 8,26 4,67 14,65 3,03 4,23 2,88 6,48
B 80,47 78,00 75,65 79,64 79,02 76,81 73,92 16,53 85,74 80,10 88,65 69,46
Pm 110,12 122,85 129,51 109,24 124,77 130,52 104,28 111,77 105,41 107,60 107,39 111,56
X 636,25 390,02 279,25 646,90 366,66 272,12 697,15 79,92 782,31 684,35 764,49 517,04
30°C / 70%HR
4,0 103,97 132,67 103,82 111,55 98,50 118,50 94,99 122,66 122,66
7,0 122,66 153,86 122,66 103,82 103,82 86,55 122,66 143,07 132,67
10,0 132,67 176,63 143,07 113,04 122,66 113,04 143,07 153,86 143,07
13,0 165,05 213,72 188,60 143,07 143,07 132,67 176,63 176,63 176,63
A 6,44 8,86 9,16 3,46 5,09 2,30 8,84 5,76 5,74
B 76,33 93,88 61,69 88,47 73,79 93,14 59,16 100,12 94,94
Pm 118,20 151,49 121,22 110,95 106,84 108,09 116,65 137,54 132,27
X 454,49 98,47 306,26 686,12 643,74 788,42 353,42 285,49 340,72
40°C / 70%HR
4,0 103,82 131,70 143,20 106,55 108,50 98,50 114,99 122,66 152,16
7,0 142,01 159,60 112,56 105,72 101,90 116,35 128,55 142,57 132,70
10,0 137,67 171,61 148,02 115,40 141,04 113,04 143,77 113,60 145,70
13,0 155,50 211,79 158,67 141,17 133,07 131,33 156,63 146,43 176,13
A 5,02 8,41 2,73 3,78 3,76 3,17 4,67 1,41 2,83
B 92,05 97,20 117,42 85,04 89,15 87,84 96,28 119,32 127,61
Pm 124,70 151,86 135,15 109,64 113,60 108,46 126,64 128,49 146,01
X 448,52 101,79 400,67 684,75 636,91 733,96 440,44 538,21 252,99

ANEXOS
96
REGISTRO COMPLETO DE DATOS DE EXTENSIBILIDAD (CONTINUACIÓN) EXTENSIBILIDAD INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN PESO (g) REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
EUCERIN UREA
25°C / 70%HR
4,0 103,82 103,42 105,07 101,00
7,0 101,12 111,20 104,55 106,65
10,0 122,66 129,66 153,86 122,66
13,0 165,05 145,51 176,63 143,07
A 6,84 4,82 8,80 4,74
B 65,01 81,44 60,23 78,05
Pm 109,48 112,80 117,43 108,86
30°C / 70%HR
4,0 113,04 106,64 113,04
7,0 122,66 122,33 132,21
10,0 153,86 151,65 155,60
13,0 176,63 176,04 177,69
A 7,40 7,92 7,24
B 78,66 71,87 83,06
Pm 126,75 123,33 130,15
40°C / 70%HR
4,0 116,04 114,14 118,00
7,0 131,17 137,78 111,17
10,0 143,60 139,60 137,60
13,0 168,54 188,40 185,59
A 5,66 7,49 7,64
B 91,69 81,34 73,15
Pm 128,51 130,01 122,81

ANEXOS
97
REGISTRO COMPLETO DE DATOS DE EXTENSIBILIDAD (CONTINUACIÓN) EXTENSIBILIDAD INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN PESO (g) REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
SUNCARE
25°C / 70%HR
4,0 101,76 143,07 122,66 145,07
7,0 101,88 176,63 176,63 188,60
10,0 112,66 200,96 158,60 199,50
13,0 154,16 226,87 213,72 216,70
A 5,60 9,19 8,51 7,53
B 70,02 108,76 95,61 123,49
Pm 106,42 168,50 150,89 172,41
30°C / 70%HR
4,0 137,97 201,55 151,37
7,0 156,05 146,63 108,60
10,0 188,16 151,65 191,76
13,0 206,74 203,20 196,70
A 7,95 0,33 7,31
B 104,68 172,93 100,02
Pm 156,34 175,09 147,50
40°C / 70%HR
4,0 111,04 142,16 115,74
7,0 156,88 116,13 118,60
10,0 199,00 118,02 119,44
13,0 198,50 113,26 116,17
A 10,15 -2,83 0,07
B 80,08 146,42 116,88
Pm 146,06 128,05 117,35

ANEXOS
98
REGISTRO COMPLETO DE DATOS DE ENSAYO MICROBIOLÓGICO
OBJETABLES: Staphylococcus aureus INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
F1 UREA 7%
25°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
30°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
40°C / 70%HR - - - - - - - - -
F2 UREA 5%
25°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
30°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
40°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
F3 UREA 3%
25°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
30°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
40°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
EUCERIN UREA
25°C / 70%HR Ausencia Ausencia Ausencia Ausencia
30°C / 70%HR Ausencia Ausencia Ausencia
40°C / 70%HR Ausencia Ausencia Ausencia
SUNCARE
25°C / 70%HR Ausencia Ausencia Ausencia Ausencia
30°C / 70%HR Ausencia Ausencia Ausencia
40°C / 70%HR Ausencia Ausencia Ausencia

ANEXOS
99
REGISTRO COMPLETO DE DATOS DE ENSAYO MICROBIOLÓGICO (CONTINUACIÓN)
OBJETABLES: Pseudomona aeruginosa INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
F1 UREA 7%
25°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
30°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
40°C / 70%HR - - - - - - - - -
F2 UREA 5%
25°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
30°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
40°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
F3 UREA 3%
25°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
30°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
40°C / 70%HR Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia
EUCERIN UREA
25°C / 70%HR Ausencia Ausencia Ausencia Ausencia
30°C / 70%HR Ausencia Ausencia Ausencia
40°C / 70%HR Ausencia Ausencia Ausencia
SUNCARE
25°C / 70%HR Ausencia Ausencia Ausencia Ausencia
30°C / 70%HR Ausencia Ausencia Ausencia
40°C / 70%HR Ausencia Ausencia Ausencia

ANEXOS
100
REGISTRO COMPLETO DE DATOS DE ENSAYO MICROBIOLÓGICO (CONTINUACIÓN)
RECUENTO DE BACTERIAS INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
F1 UREA 7%
25°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
30°C / 70%HR
< 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
40°C / 70%HR
- - - - - - - - -
F2 UREA 5%
25°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
30°C / 70%HR
< 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
40°C / 70%HR
< 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
F3 UREA 3%
25°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
30°C / 70%HR
< 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
40°C / 70%HR
< 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
EUCERIN UREA
25°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
30°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g
40°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g
SUNCARE
25°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
30°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g
40°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g

ANEXOS
101
REGISTRO COMPLETO DE DATOS DE ENSAYO MICROBIOLÓGICO (CONTINUACIÓN)
RECUENTO DE HONGOS INICIAL MES 1 MES 2 MES 3
FORMULACIÓN CONDICIÓN REPETICIÓN REPETICIÓN REPETICIÓN REPETICIÓN
R1 R2 R3 R1 R2 R3 R1 R2 R3 R1 R2 R3
F1 UREA 7%
25°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
30°C / 70%HR
< 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
40°C / 70%HR
- - - - - - - - -
F2 UREA 5%
25°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
30°C / 70%HR
< 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
40°C / 70%HR
< 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
F3 UREA 3%
25°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
30°C / 70%HR
< 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
40°C / 70%HR
< 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
EUCERIN UREA
25°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
30°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g
40°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g
SUNCARE
25°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g < 10² UFC/g
30°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g
40°C / 70%HR < 10² UFC/g < 10² UFC/g < 10² UFC/g