Unidades químicas de concentración
-
Upload
cambridge-technical-foundation -
Category
Documents
-
view
198.134 -
download
5
Transcript of Unidades químicas de concentración
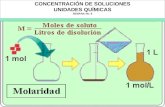
- 1. Unidades Qumicas de Concentracina) Molaridad ( M ): Es el nmero de moles de soluto contenido en un litro desolucin. Una solucin 3 molar ( 3 M ) es aquella que contiene tres moles desoluto por litro de solucin.Ejemplo 1:* Cuntos gramos de AgNO3 , se necesitan para preparar 100 cm3 de solucin1M?Previamente sabemos que:El peso molecularmasa de 1 y170 g=de AgNO3 es: mol AgNO3 que100 de H2O cm3equivalen a 100 ml. H2OUsando la definicin de molalidad , se tiene que en una solucin 1M hay 1 mol deAgNO3 por cada Litro (1000 ml ) de H2O (solvente) es decir:Utilizando este factor de conversin y los datos anteriores tenemos que:Se necesitan 17 g de AgNO3 para preparar una solucin 1 MEjemplo 2:Si se tienen 20 g de NaOH en 250 mL de solucin, calcule su molaridad.Solucion:
2. Puesto que la cantidad de soluto est dada en gramos, se requiere convertirlos amoles, con ayuda del peso molecular.n NaOH = W NaOH= 20 g = 0.5 moles ; 250 mL x1L = 0.25 LPM NaOH 40 g 1000 mLA partir de la expresion para M, se tiene M = 0.5 moles = 0.2 moles = 2 M 0.25 litros litrosEjemplo 3:Calcule la molaridad de una solucin de HCl que tiene una concentracin de11.2% por masa y una densidad de 1.1 g /mL.Solucion:A diferencia de los ejercicios anteriores, en ste hay que calcular el nmero degramos de soluto a partir de las concentracin peso a peso. Ntese tambinque no se da ningn volumen de solucin. En realidad, no se requiere parasolucionar el ejercicio, ya que en la definicin se establece el volumen de 1 L.El ejercicio se puede resolver siguiendo el procedimiento que se describe acontinuacin:1.Como la molaridad est definida en trminos de 1 litro de solucin, con la densidad y este volumen se calcula la masa de 1 litro de solucin:m = v x d; 1,000 mL x 1.1g = 1,100 g de solucin mL2. Dado que la masa del soluto es de 11.2 % por peso, entonces, utilizando la expresin de porcentaje por peso, se tiene:11.2 =g solutox 100 = 11.2 = g de soluto x 100masa solucion1.100 gEntonces, 11.2 x 1.100 = 123.2 g de soluto o HCl puro en 1 L de solucin100 3. 3. Conociendo el nmero de gramos de soluto puro en 1 L de solucin, se calcula el nmero de moles de soluto. n= W= 123.2 g HCI = 3.37moles de soluto por litro dePM 36.5 g HClsolucin o, sencillamente, 3.37 MEJERCITACION DE CONCEPTOSACTIVIDAD DE MOLARIDAD1. Se disuelven 18 gr. de sulfato cprico, CuSO 4 en agua, hasta 120 c.c. de una solucn cul es la molaridad de la misma?2.Cual es el volumen de una solucin 3.5 M que contiene 0,42 moles de Na 2S04 en solucin?3. Se prepar una solucin de etanol, C 2H50H, depositando 23,2 g de etanol en un recipiente y luego adicionando agua hasta obtener 75,6 c.c. de solucin. Cul es la moralidad de la solucin?4. Calcular la molaridad de una solucin de cido sulfrico de densidad 1.198 g/ml que contiene 27% de H 2SO4 en peso.5. Cuntos gramos de cloruro de sodio se necesitan para preparar 3.5 lt de solucin 1.5 M?6. Cuantos gramos de cloruro de Aluminio, AlCl 3, son necesarias para preparar 720 ml. de solucin 0.875 M?7. Se tienen preparados 420 ml. De solucin 2.7 M de Ba(OH) 2 . Determinar la cantidad de soluto contenida en la solucin expresndola: a. En moles de Ba (OH)2 b. En gramos de Ba (OH)28. Cuntos gramos de sacarosa C 12H22O11 son necesarios para preparar 500 ml de solucin 0,15 M? 4. 9. Cuntos gramos de HCI hay en 1,5 litros de solucin 2,5 M?10.Cul es la concentracin molar de una solucin que contiene 18 gr de clorato de potasio en 300 ml. de solucin?11. Cuntos gramos de soluto hay en cada unas de las siguientes soluciones:a. 100 mI, de NaCI 0.1 molar?b. 2000 mL de solucin de glucosa C6H12O6 0.2 M?c. 400 mL de KOH 0.25 M?d. 700 mL de KNO3 1M?12. Calcule la molaridad de una solucin de HCl de densidad 1.16 g/mL y cuya concentracin es 32 % por peso.13. Calcule la molaridad de H3PO4 , cuya densidad es 1.75 g/mL y concentracin por peso de 89%.14. Cul es la molaridad de una solucin de H2SO4 cuya densidad es 1.11 g/mL y concentracin por peso 16%?15. Calcule la molaridad de una solucin de NH3 cuya densidad es 0.92 g/mL y concentracin 19 % por peso.16. Cul es la molaridad de una solucin de NaOH cuya densidad es 1.11 g/mL y concentracin 12.1%? 5. MOLALIDAD (m):Es el nmero de moles de soluto contenidos en un kilogramo de solvente. Unasolucin formada por 36.5 g de cido clorhdrico, HCl , y 1000 g de agua es unasolucin 1 molal (1 m)Ejemplo 1 :* Cuntos gramos de AgNO3 , se necesitan para preparar 100 cm3 de solucin1m?Previamente sabemos que: El peso molecular masa de 1 y 170 g = de AgNO3 es:mol AgNO3 que 100 de H20 cm3equivalen a 100 gr. H20Usando la definicin de molalidad , se tiene que en una solucin 1m hay 1 mol deAgNO3 por cada kg (1000 g ) de H2O (solvente) es decir:Utilizando este factor de conversin y los datos anteriores tenemos que:Se necesitan 17 g de AgNO3 para preparar una solucin 1 m, observe que debidoa que la densidad del agua es 1.0 g/ml la molaridad y la molalidad del AgNO3 es lamisma 6. Ejemplo 2:Calcule la molalidad de una solucin que tiene 0.1 moles de NaCI en 0.2 kg deagua.Solucion:Puesto que la cantidad de soluto est dada en moles y el solvente en kg, lamolalidad se halla reemplazando directamente en la expresin de molalidad. m = Nmero de moles de soluto = 0.1 moles = 0.5 m kg solvente 0.2 kgEjemplo 3:Calcule la molalidad de la solucin resultante al disolver 4.0 gramos de NaOH en250 mL de H2O.Solucion :Para calcular la molalidad, se requiere expresar 4.0 gramos de NaOH en moles ylos 250 mL de agua en kg. n = 4 g NaOH x 1 mol NaOH = 0,1 moles de NaOH 40.0 g NaOHPuesto que la densidad del agua es 1 g/mL, los 250 mL son iguales a 250 g.Estos 250 g, expresados en kg, son iguales a 0.25 kg. As, la molalidad es iguala:m = 0.1 moles = 0.4 m0.25 kg 7. EJERCITACION DE CONCEPTOSACTIVIDAD MOLALIDAD1. Calcule la molalidad para las siguietes soluciones: a. 0.1 H2S en 2 Kg de agua b. 2 moles de HNO3 en 5 Kg de agua c. 1 mol de NaNO3 en 1 Kg de agua d. 0.1 mol de cido acetico en 3 Kg de agua2. Calcule la molalidad de las siguientes soluciones: a. 10 gramos de KCl en 2 Kg de agua b. 0.2 gramos de NaBr en 1 Kg de agua c. 100 gramos de KMnO4 en 6 Kg de agua d. 0.1 mol de H3PO4 en 2.0 gramos de agua a. 0.2 gramos de MgCl2 en 800 gramos de agua3. Cuntos gramos de CaCl2 debern aadirse a 300 mL de agua para preparar una solucin 2.46 molal?4. Una solucion contiene 57.5 gr de alcohol etlico ( C2H5OH ) y 600 gr de benceno ( C6H6 ). Cul es la molalidad de la solucion?5. Una solucion azucarada se prepar disolviendo 13.5 g de C 12H22O11 en agua para obtener exactamente 100 mL de solucion, vindose que tenia una densidad de 105 g/ cc. Calcular la molalidad y la molaridad de la solucion?6. Determinar la molalidad de una solucion que contiene 5 g de NaHCO 3 disueltos en 25 gr de agua.7. Calcular la molalidad de una solucion que contiene 3 moles de KNO 3 disueltos en 1800 ml de agua. 8. Normalidad (N):Es el nmero de equivalentes gramo de soluto contenidos en un litro de solucin.Ejemplo1:* Cuntos gramos de AgNO3 , se necesitan para preparar 100 cm3 de solucin1N?Previamente sabemos que:El peso molecularmasa de 1170 g=y quede AgNO3 es: mol AgNO3100 de H20 cm3equivalen a 100 gr. H2OUsando la definicin de molalidad , se tiene que en una solucin 1N hay 1 mol deAgNO3 por cada kg (1000 g ) de H2O (solvente) es decir:Utilizando este factor de conversin y los datos anteriores tenemos que:El peso equivalente de un compuesto se calcula dividiendo el peso molecular delcompuesto por su carga total positiva o negativa.Ejemplo 2:Cul es la normalidad de una solucin de HCl que tiene 0.2 equivalentes delcido en 2 litros de solucin?Solucion:El enunciado presenta directamente el nmero de equivalentes de soluto y elvolumen de solucin en litros. Por tanto, la normalidad se calcula directamentede la expresinN = 0.2 equivalentes = 0.1 equivalente por litro 0.1 N 2 litros 9. Ejemplo 3:Calcule la normalidad de una solucin de HCI que tiene 20 gr de HCl en 500 mLde solucin.Como el soluto est dado en gramos, se requiere pasar los gramos aequivalentes:20 g de HCl x 1 eq HCl = 0.55 eq36.5 gTambin se requiere convertir mililitros de solucin a litros500 m Lx 1L = 0.5 L 1,000 mLLa normalidad ahora es N = 0.55 eq = 1.1 N 0.5 LEjemplo 4:El HCl concentrado de laboratorio es una solucin que tiene una concentracinde 37 % por masa y una densidad de 1.19 g/mL. Calcule la normalidad de estasolucin. La cantidad de soluto presente en la solucin no est explicita y serequiere calcularla a partir del porcentaje por peso. Tampoco est especificadala cantidad de solucin, pero la definicin de normalidad est dada con base enun litro de solucin.Este tipo de ejercicios, al igual que los de molaridad, pueden resolverse por elprocedimiento que se describe a continuacin.1. A partir de la densidad, se calcula la masa de un litro de solucin.m = v x d = 1,000 mL x 1,19 = 1.190 g de solucin2. Se calculan, a partir de la concentracin de la solucin del cido dada, los gramos de cido puro que hay en un litro de solucin.% soluto = g soluto X 100; 37 = g soluto x 100 g solucion 1.190 g 10. g soluto = 37 x 1,190g = 440.3 g HCl puro 1003. En un litro de esa solucion hay 440.3 g de HCl puro. A partir de este cidopuro, se calcula el numero de equivalentes por litro de solucin. El numero deequivalentes coincide, en este caso, con el numero de moles. n = W = 440.3 = 12.06 equivalentes en un litro. Asi, la solucion es 12.06 N M 36.5Fraccin molar (X):se define como la relacin entre las moles de un componente y las moles totalespresentes en la solucin.Xsto + Xste = 1Ejemplo1:Una solucion contiene 5 moles de NaCl y 15 moles de agua. Cul es la fraccinmolar del soluto y del solvente?Solucin:Soluto NaCl ( A )= 5 molesSolvente H2O ( B ) = 15 molesXA = 5 moles=5 moles= 0.25 5 moles + 15 moles20 molesXB = 15 moles = 15 moles= 0.75 5 moles + 15 moles 20 molesXA + XB = 0.25 + 0.75 = 1Ejemplo 2:Una solucin contiene 30 gramos de NaCl y 40 gramos de H2O. Cules son lasfracciones molares del H2O y NaCl?Solucin: 11. Tanto el soluto como el solvente estan dados en gramos. Se quiere convertirlos amoles.moles de NaCl = 30 gr NaCl X 1 mol NaCl = 0.51 moles58.5 g NaClmoles de H2O = 40 g H2O X 1 mol H2O = 2.2 moles18 g H2Ola fraccin molar del soluto NaCl es:XNaCl = 0.5 moles = 0.5 = 0.190.5 moles + 2.2 moles 2.7XH2O =2.2 moles = 2.2 = 0.810.5 moles + 2.2 moles 2.7Ntese que XNaCl + XH2O = 1 . Por tanto, conociendo la fraccin molar del solutoo del solvente, la otra se puede obtener restando de la unidad. 12. EJERCITACION DE CONCEPTOSACTIVIDAD Pesos equivalentes1. Calcule el peso de 1 equivalente para las siguientes sustancias: CaCl 2, HNO3, Al(OH)3, Ca(OH)2, H3PO4, NaCl, LiOH, Fe(PO 4)2.2. Calcule el nmero de equivalentes para cada uno de los siguientes casos: a. 60 g de CaCl 2 b. 120 g de HNO3 c. 200 g de Al(OH) 3 d. 50 g de Ca(OH) 2 e. 90 g de H 3PO4 f. 100 g de NaCl g. 20 g de LiOH3.Cuntos equivalentes gramo de HCl hay en 100 mL de solucin 3 molar ?4. Cuntos equivalentes gramo de KCl hay en 1 L de solucin 0.5 M?ACTIVIDAD DE NORMALIDAD1. Cul es la normalidad de las siguientes soluciones: a. 90 g de H3PO4 en 500 mL de ecuaciones? b. 100 g de NaCl en 2.0 L de solucin? c. 20 g de LiOH en 250 mL de solucin? . d. 50 g de Ca(OH) 2 en 900 mL de solucin?2. Cul es la normalidad de las siguientes soluciones? a. 0.5 equivalentes de CaCI 2 en 100 mL de solucin? b. 0.1 equivalentes de NaOH en 1 L de solucin? c. 0.1 equivalentes de NaOH en 50 mL de solucin? d. 1 equivalente de H 2O en 2,010 mL de solucin?3. Cuntos gramos de soluto hay en cada una de las siguientes soluciones: 13. a. 200 mL de NaOH 0.6 M? b. 800 mL de H 2SO4 3M? c. 500 mL de NaCI 0.5 M? d. 250 mI, de Al(OH) 3 1 M?4. Calcule la normalidad en los ejercicios de la seccin Molaridad.5. Calcule la normalidad para una solucin de NH 3 de densidad 0.902 g/mL yconcentracin de 26.6%6. Cul es la normalidad de una solucin de KOH cuya densidad es de 1.41 g/mL si su concentracin es 41.2% por peso?7. Se disuelven 35,89 de CaSO 4 en agua hasta obtener 940 c.c. de solucin. Cul es la normalidad de la solucin?8. Cuntos gramos de H3PO4, son necesarios para preparar 3,2 It de una solucin 2,7 N?9. Cundo puede ser una mol igual a un equivalente-gramo?10. Cuntos equivalente-gramos de H2SO4 se encuentran en 620 c.c. de una solucin 2.8 N de H2SO4? Cuntos gramos de soluto hay en ese volumen de solucin?11. Que volumen de una solucin 3N de CaCl 2 se puede preparar al disolver 38 g de CaCl2 en agua?12.Que peso de Al(OH)3 se necesita para preparar 500 c.c. de una solucin 0.2 N?13. Una solucin contiene 116 g de acetona (CH 3COCH3), 138 g. de alcohol etlico (C2H5OH) y 126 gramos de agua. Determinar las fracciones malares de los componentes de esta solucin.14. Una solucin contiene 10 g de cido actico, CH 3COOH, en 125 g de agua. Cul es la concentracin de la solucin expresada en: 14. a. Fracciones molares de CH 3COOH y de H2O. b. Molalidad15. Cuntos gramos de cido fosfrico, H3PO4 , son necesarios para preparar 1.7 litros de solucion 1.5 N? Cuntos para preparar 3.4 litros de solucion 0.75 N?16. Se disuelven 2.5 g de sulfato de cobre ( II ), CuSO 4 , en agua hasta obtener 670 cc de solucion. Cul sera la normalidad de la solucion?



![Velocidad de las reacciones químicas · v unidades: cociente entre concentración y tiempo [(cantidad de materia)(volumen)-1] [tiempo]-1 unidades: SI mol m-3 s-1 mol dm-3 s-1 ...](https://static.fdocuments.ec/doc/165x107/5ed6415e0c1f140c715b571e/velocidad-de-las-reacciones-qumicas-v-unidades-cociente-entre-concentracin.jpg)