Unidad 1 materia, energía y cambios
-
Upload
universidad-autonoma-de-zacatecas -
Category
Education
-
view
99 -
download
1
Transcript of Unidad 1 materia, energía y cambios

I
2012
Manuel Acevedo Díaz
Universidad Autónoma de Zacatecas
Unidad Académica Preparatoria Plantel V
21/12/2012
Materia, Energía y Cambios

II
Contenido
1.1 INTRODUCCIÓN ............................................................................................................. - 1 -
1.2 OBJETO DE ESTUDIO DE LA QUÍMICA ........................................................................ - 3 -
1.3 PROPIEDADES DE LA MATERIA ................................................................................... - 4 -
1.3.1 PROPIEDADES GENERALES: ................................................................................ - 4 -
1.3.2 PROPIEDADES ESPECÍFICAS O INTRÍNSECAS ................................................... - 5 -
1.3.3 PROPIEDADES CUALITATIVAS (NO MEDIBLES): ................................................. - 6 -
1.3.4 PROPIEDADES CUANTITATIVAS (MEDIBLES): ..................................................... - 6 -
1.3.5 PROPIEDADES INTENSIVAS: ................................................................................. - 6 -
1.3.6 PROPIEDADES EXTENSIVAS: ................................................................................ - 6 -
1.4 MEDICIONES Y SUS UNIDADES ................................................................................... - 7 -
1.4.1 PRESIÓN ................................................................................................................ - 10 -
1.4.2 TEMPERATURA ..................................................................................................... - 11 -
1.4.3 VOLUMEN .............................................................................................................. - 13 -
1.4.4 CANTIDAD DE SUSTANCIA .................................................................................. - 14 -
1.5 CLASIFICACIÓN DE LA MATERIA ............................................................................... - 20 -
1.5.1 SUSTANCIAS ......................................................................................................... - 20 -
1.5.2 ELEMENTOS .......................................................................................................... - 20 -
1.5.3 COMPUESTOS ....................................................................................................... - 22 -
1.5.4 MEZCLAS ............................................................................................................... - 23 -
1.5.4.1 MÉTODOS DE SEPARACIÓN DE MEZCLAS ................................................. - 25 -
1.6 ESTADOS DE AGREGACIÓN ...................................................................................... - 33 -
BIBLIOGRAFÍA .................................................................................................................... - 35 -

- 1
-
UNIDAD 1: MATERIA, ENERGÍA Y CAMBIOS
1.1 INTRODUCCIÓN
El Sistema Escolarizado del Plantel V de la Unidad Académica Preparatoria de la
Universidad Autónoma de Zacatecas les da la más cordial de las bienvenidas a la Asignatura
de Química I, felicitándolos por haber tomado la decisión de continuar su preparación
académica.
Como parte complementaria de los materiales, herramientas y actividades necesarios
para cursar la materia, es que en cada tema o apartado se presenta un documento, el cual
deberán de leer a completitud y tratar de entender los conceptos y las ideas ahí vertidos, ya
que –en la mayoría de los casos- ahí se encuentran contenidos que es, si no obligatorio sí
conveniente, memorizar.
V.S.
Hoy las cosas no son como antes. En la época de su descubrimiento, el plástico
enloqueció a la humanidad por sus propiedades, por la novedad y por su gran utilidad. Parece
que el bienestar material, la computadora de plástico, la carrocería de los automóviles y los
aviones ya no nos sorprenden. Al contrario, los plásticos son ahora una fuente de
contaminación, tanto que en algunos países se ha llegado a prohibir su uso en los
supermercados como bolsas para transportar las compras. ¿Qué ocurre? Es como si todo
descubrimiento y diseño derivado de la Química se volvieran contra nosotros...

- 2 -
Pedimos que viertas tu opinión en el Debate: "La Química ¿Héroe o Villano?" Ésta
será tu primer actividad objeto de avaluación.
Ante cualquier duda o problema de aprendizaje, favor de comunicarse con un servidor
vía Skype (usuario: mamamia017), o bien, a través de mi cuenta de correo personal
Deseándoles éxito en todas las actividades que emprendan, incluyendo ésta, su
superación académica, no me despido… ¡Me pongo a sus órdenes para cualquier asesoría,
duda o aclaración!
¡¡FELICIDADES!!
A t e n t a m e n t e
M. en E. Manuel Acevedo Díaz Instructor de la Asignatura

- 3 -
1.2 OBJETO DE ESTUDIO DE LA QUÍMICA
La Química es la ciencia que estudia la materia, sus propiedades físicas y químicas, los
cambios que experimenta y las variaciones de energía que acompañan a dichos
procesos (Chang, 2007 Química, pág. 11).
Como sabemos que la materia es todo lo que ocupa un lugar en el espacio y tiene
masa y que la energía se define como la capacidad de realizar un trabajo y/o de transferir
calor, de esta definición “aparentemente” sencilla podemos deducir que el campo de
aplicación de la química es enorme.
La materia la encontramos desde las partes internas de los diminutos e invisibles átomos, los
pequeños microbios, virus y bacterias (que tampoco vemos, pero sí sentimos sus efectos al
enfermarnos); en nuestra vida diaria, todo lo que tocamos, comemos, vestimos, calzamos, el
vehículo en el que nos transportamos, las pinturas, las lacas, los barnices, los
impermeabilizantes, los cosméticos, las bebidas procesadas, etc. Si volteamos al cielo
podremos observar, de día, una enorme lumbrera que nos proporciona luz y calor -ambas,
formas de energía- y de noche, un sinnúmero de cuerpos celestes: estrellas, planetas,
satélites naturales, cometas; y muchos otros cuerpos que, a simple vista no podemos
observar, pero que con el uso de lentes muy poderosas, los telescopios, sí se pueden admirar.
Se conocen diversas formas de la energía como lo son: cinética, potencial, mecánica,
eléctrica, química, luminosa, entre otras, pero una de ellas tiene un significado especial para la
vida humana, la calorífica. El calor es la transferencia de energía entre dos cuerpos que
se encuentran a diferente temperatura.
La temperatura ambiente es diferente por la mañana que al mediodía; de igual forma,
hace más calor en un día soleado que en un día nublado; pero aún más visible es el cambio
de temperaturas con el cambio de las estaciones, ¡Hace mucho más calor en verano que en
invierno! Esto es… ¡En todo el universo, en todo momento, hay materia y hay energía!
Es preciso observar que todo a nuestro alrededor está en movimiento, y que esto provoca
cambios. Necesitamos distinguir entre los cambios que no alteran la naturaleza de las
sustancias implicadas (Jiménez Prieto & Torres Verdugo, 2012) (cambios físicos: cambios de

- 4 -
temperatura, forma o posición) y aquellos que sí conducen a un cambio en la composición
química (cambios químicos).
Actividad 1: Complete con lo que se le solicita.
Mencione 2 cambios físicos y 2 cambios químicos
1.3 PROPIEDADES DE LA MATERIA
Para distinguir una muestra de materia de otra se hace uso de sus propiedades. Las cuales
pueden clasificarse de diferentes maneras:
1.3.1 PROPIEDADES GENERALES: Son propiedades que tienen en común
todos los cuerpos, por tanto, no permiten diferenciar entre un cuerpo y otro. Ellas
son:
Masa (m): Es una medida de la cantidad de materia contenida en una
muestra de cualquier material. En el Sistema Internacional de Unidades
(S.I.) su unidad de medida es el kilogramo (kg).
Peso (): Es una medida de la fuerza con que cualquier objeto es atraído
hacia el centro de gravedad del cuerpo celeste más cercano (hacia el
centro del planeta Tierra, en nuestro caso). En el Sistema S.I. su unidad de
medida es el Newton (N).
El común de la gente toma masa y peso como sinónimos, pero en realidad
sólo son propiedades cuyos valores varían proporcionalmente. Se dice que
dos variables son directamente proporcionales cuando al aumentar la primera

- 5 -
en una cierta proporción, la segunda también se incrementa en la misma
razón, es decir, si la primera se duplica, la segunda también. Por el contrario,
se dice que dos variables son inversamente proporcionales cuando al
incrementarse una de ellas en cierta proporción, la otra se ve disminuida en la
misma razón, esto es, si la primera se duplica, la otra se reduce a la mitad.
Volumen: Cantidad de espacio que ocupa un cuerpo. Su unidad de
medida en el S.I. es el metro cúbico (m3).
Inercia: Propiedad por la cual un cuerpo tiende a permanecer en su
estado de reposo o movimiento rectilíneo uniforme.
Impenetrabilidad: Propiedad de la materia por la cual dos cuerpos no
pueden ocupar, a la vez, el mismo espacio.
1.3.2 PROPIEDADES ESPECÍFICAS O INTRÍNSECAS: Se llaman así
porque no son comunes a todos los cuerpos y sí permiten identificar una muestra
de materia o diferenciarla de otra.
Organolépticas: Son las propiedades de la materia que se pueden
percibir con cualquiera de los órganos sensoriales (sentidos) del cuerpo
humano, p. Ej. el color (mencione, al menos, otras cinco):
______________________________________________________________
______________________________________________________________
Físicas: Son las propiedades de la materia que, al determinarse, no
provocan un cambio en su composición, p. Ej. Densidad (mencione, al
menos, cinco más):
______________________________________________________________
______________________________________________________________
Químicas: Son las propiedades de la materia que, al determinarse, sí
provocan un cambio en su composición, p. Ej. La combustión (mencione,
cuando menos, dos más):
______________________________________________________________
______________________________________________________________
______________________________________________________________

- 6 -
O bien, pueden dividirse en:
1.3.3 PROPIEDADES CUALITATIVAS (NO MEDIBLES):
Son propiedades a las que no se les puede asignar un valor cuantificable, por
ejemplo, el color, el olor, el sabor o el estado físico de una sustancia, o bien, el estado civil, el
lugar de nacimiento o el género de una persona.
1.3.4 PROPIEDADES CUANTITATIVAS (MEDIBLES):
Son propiedades a las que sí se les puede asignar un valor cuantificable o
numérico y una unidad de medida; por ejemplo, la temperatura (36°C), la presión (1 atm),
el volumen (22.414 L), la masa (50.0 kg), el calor específico (0.21J/mol·K-1), etcétera.
Otro tipo de propiedades que es conveniente que aprendamos a distinguir son:
1.3.5 PROPIEDADES INTENSIVAS:
Son las propiedades de la materia que no dependen de la cantidad de material
examinado, p. Ej. Punto de fusión, punto de ebullición, densidad, viscosidad, conductividad
térmica, conductividad eléctrica, solubilidad, etcétera.
NOTA: ¡Todas las propiedades químicas son propiedades intensivas!
1.3.6 PROPIEDADES EXTENSIVAS:
Son las propiedades de la materia que sí dependen de la cantidad de material
examinado, p. Ej. Masa, peso, volumen y capacidad calorífica.

- 7 -
1.4 MEDICIONES Y SUS UNIDADES
Actividad 2: Investigue, de las 7 unidades fundamentales del S. I.:
Entidad: (qué mide) Definición más actual: Unidad: Símbolo:
Cantidad de
Sustancia
Intensidad de
Corriente Eléctrica
Intensidad Luminosa
Longitud (distancia)
Masa
Temperatura
Tiempo
Actividad 3: Investigue las definiciones matemáticas -y su correspondiente unidad de medida-
de las siguientes unidades derivadas del S. I. No olvide indicar qué significa cada una de las

- 8 -
literales (letras o símbolos) utilizadas en cada fórmula y su correspondiente unidad de medida
en el S. I.
Entidad: Fórmula Matemática: Unidad: Nombre
especial:
Velocidad
Aceleración
Fuerza
Energía
cinética
Energía
Potencial
Gravitatoria
Trabajo

- 9 -
Presión
Sin embargo, aunque estas sean las unidades oficiales, por decirlo de algún modo, existen
otras unidades empleadas para medir las mismas dimensiones. Por ejemplo:
La unidad oficial para medir el volumen es el metro cúbico (m3), sin embargo existe otra
unidad usada con mucha mayor frecuencia: el litro (L)1; la unidad oficial para medir presión es
el Pascal (Pa), pero existen otras unidades de mayor uso, como son la atmósfera (atm), el
Torricelli (Torr) o el milímetro de mercurio (mmHg).
Actividad 4: Investigue diferentes unidades empleadas para medir las entidades
mencionadas en las actividades 2 y 3 y sus correspondientes equivalencias con la respectiva
Unidad S.I.
Entidad: (qué
mide) Unidad 1 Unidad 2 Unidad 3 Unidad 4
Cantidad de
Sustancia
Intensidad de
Corriente
Eléctrica
Intensidad
Luminosa
Longitud
(distancia)
1 La abreviatura de Litro (o Litros) es “L”, no “l”, “lt” ni “lts”.

- 10 -
Masa
Temperatura
Tiempo
Velocidad
Aceleración
Fuerza
Energía cinética
Energía
Potencial
Gravitatoria
Trabajo
Presión
1.4.1 PRESIÓN
La presión se define, desde el punto de vista físico, como la aplicación de una fuerza en un
área determinada. Se mide con Manómetros o con Barómetros. Matemáticamente se expresa
como
A
FP
Donde: P es la Presión, y su unidad de medida en el S. I. es el Pascal (Pa);
F es la Fuerza y su unidad de medida en el S. I. es el Newton (N);

- 11 -
A es el Área y su unidad de medida en el S. I. es el metro cuadrado (m2).
Es decir:
2
F NP Pa
A m
Algunas unidades utilizadas para medir Presión son:
Atmósferas (atm)
Torricellis (Torr)
Milímetros de Mercurio (mmHg)
Kilogramos fuerza sobre centímetro cuadrado (kgf/cm2)
Pascales (Pa)
kilo pascales (kPa)
Libras fuerza sobre pulgada cuadrada (lbf/in2), también llamadas P. S. I. por sus siglas en
inglés «Pound per Square Inches», etc.
Y las equivalencias respectivas son:
2
2
1 760
760
1.033 /
101325
101.325
14.68 /
14.68 . . .
f
f
atm Torr
mmHg
kg cm
Pa
kPa
lb in
P S I
1.4.2 TEMPERATURA
La temperatura es una forma de medir la Intensidad del Calor. Se mide con Termómetros.
Existen varias Escalas Termométricas entre las que se encuentran la Kelvin (K), la
Centígrada o Celsius (°C), la Fahrenheit (°F) y la Rankine (°R). Las primera es la unidad
oficial en el Sistema Internacional de Unidades; la segunda es la reconocida por el Sistema

- 12 -
Decimal, y las dos últimas son del Sistema Ingles. Hay dos escalas llamadas Relativas por
contener valores tanto positivos como negativos (Celsius y Fahrenheit) y dos escalas
denominadas Absolutas por sólo contener valores positivos (Kelvin y Rankine).
Para ínter transformar valores de temperatura de una escala a otra se utilizan las siguientes
fórmulas:
Para Obtener: A partir de: Utilice la Fórmula:
Grados Celsius Kelvin 1) 1
273.151
CC xK C
K
Grados Fahrenheit Grados Celsius 2) FC
FCxF
32
0.1
8.1
Grados Rankine Grados Fahrenheit 3) 1
459.671
RR x F R
F
Grados Fahrenheit Grados Rankine 4)
R
FRRxF
1
167.459
Grados Celsius Grados Fahrenheit 5)
F
CFFxC
8.1
0.132
Kelvin Grados Celsius 6) 1
273.151
KK x C C
C
Grados Rankine Kelvin 7)
K
RxKR
0.1
8.1
Kelvin Grados Rankine 8)
R
KRxK
8.1
0.1

- 13 -
1.4.3 VOLUMEN
El Volumen es la cantidad de espacio ocupado por un cuerpo. La unidad derivada de
volumen en el Sistema Internacional de Unidades (S. I.) es el metro cúbico (m3), sin
embargo existen otras unidades que tienen gran uso en la vida cotidiana, como el litro o el
mililitro, por ejemplo. Algunas equivalencias que pueden ser útiles son las siguientes:
1L=1 000mL=1 000 000L (Recuerde que 1 000=1X103=103 y que 1 000 000=1X106=106)
1 m3 = 103 L = 106 mL
1 m3 = 103 dm3 = 106 cm3
Por lo cual se deduce que:
1L = 1 dm3 y 1 mL = 1 cm3
1 in3 = 16.387 cm3
1 ft3 = 28.32 L
1 yd3 = 764.55 L
1gal = 3.785 L

- 14 -
1.4.4 CANTIDAD DE SUSTANCIA

- 15 -

- 16 -

- 17 -

- 18 -
Si los materiales siempre tienen una masa fija, podemos contarlos y pesarlos. Como los
átomos de una sustancia tienen masas fijas, podemos pesar la sustancia para contar los
átomos. Por tanto, el mol constituye una forma práctica para determinar el Número de átomos,
moléculas o unidades fórmula de una muestra al pesarla. Por ejemplo:
Por lo anterior el mol es la unidad de cantidad de sustancia que se mide de forma indirecta, a
través de una propiedad que sea proporcional al número de entidades elementales.
La MASA ATÓMICA de un átomo de un cierto elemento está determinada
experimentalmente y su valor está registrado en la Tabla Periódica de los Elementos.
Se define como el peso atómico promedio de las masas de sus isótopos naturales; se
considera que todos los átomos de un elemento tienen la misma masa atómica, la cual
es expresada en Unidades de Masa Atómica (uma).
La masa atómica de un elemento, expresada en uma, es numéricamente igual a la masa
de 1 mol de átomos del mismo elemento, expresado en gramos.
Para aclarar lo anterior, es conveniente que observe lo siguiente:
La masa de 1 átomo de Hierro es de 55.847 uma
La masa de 1 mol de átomos de Hierro es de 55.847 g.
La masa de 1 átomo de Azufre es de 32.064 uma
La masa de 1 mol de átomos de Azufre es de 32.064 g.
La masa de 1 átomo de Oxígeno es de 15.9994 uma
La masa de 1 mol de átomos de Oxígeno es de 15.9994 g.
El valor de la masa atómica en la Tabla Periódica no tiene unidades porque es una masa
atómica relativa, dada por la masa atómica, en una, dividida entre la masa atómica del átomo
de Hidrógeno (1 uma, que equivale a 1/12 de la masa de un átomo de C-12).
=uma
Masa Atómica del elemento
Masa Atómica RelativaMasa Atómica del Hidrógeno uma

- 19 -
Por lo tanto se usa el mismo número para la Masa Atómica (expresada en uma) que para la
Masa Molar (denotada en g/mol). El mol es muy útil porque relaciona el número de especies
químicas a la masa de una muestra de estas especies.
Por ejemplo: un vendedor no puede obtener una docena de huevos pesándolos y un
impresor no puede obtener una resma (500 hojas) pesándolas, porque los huevos y las hojas
no tienen siempre la misma masa, la masa de hoja a hoja es similar, pero no es la misma. Sin
embargo el químico sí puede obtener un mol de átomos de cobre (6.022X1023 átomos)
simplemente pesando 63.54 g de cobre. El concepto de mol permite encontrar la masa en
gramos de una unidad de masa atómica. A partir de la definición de mol, sabes que un mol de
átomos de C-12 tiene una masa exacta de 12.0 g. Esto quiere decir que 1/12 de mol de
átomos de C-12 tiene una masa de 1.0 g.
Haciendo este mismo planteamiento de una manera alternativa:
1mol (6.022X1023) de unidades de masa atómica, es igual a 1 gramo.
Es decir:
6.022X1023 uma = 1 g.
O bien,
1uma23
1
6.022 10
g
X uma
241.661 10X g
1uma = 1.661X10-24 g
Estas equivalencias nos servirán para convertir uma’s en gramos y viceversa.

- 20 -
RESUMEN DE TÉRMINOS RELACIONADOS CON LA MASA
TÉRMINO DEFINICIÓN UNIDAD
Masa Isotópica Masa del isótopo de un elemento uma
Masa Atómica (Confundida, por
ser proporcional, con el Peso
Atómico)
Promedio de las masas de los isótopos naturales de un
elemento, multiplicadas por sus correspondientes
abundancias relativas.
uma
Masa Molecular (o masa
formular)
Suma de las masas atómicas de los átomos o iones en
una molécula o unidad fórmula.
una
Masa Molar Masa de 1 mol de entidades elementales (átomos, iones
o moléculas)
g/mol
1.5 CLASIFICACIÓN DE LA MATERIA
La materia se puede clasificar, con base en su composición y propiedades, en dos grandes
categorías: sustancias y mezclas.
1.5.1 SUSTANCIAS
Una sustancia es una muestra de materia que tiene composición idéntica y, en
condiciones iguales, idénticas propiedades. Una sustancia puede ser un elemento o un
compuesto.
1.5.2 ELEMENTOS
Un elemento es una sustancia pura que no se puede separar en otras más sencillas por
medios químicos (Definición propuesta por Antoine Laurent Lavoisier). Para representar a
los elementos químicos se utilizan una serie de símbolos que constan de una o dos letras; en
el primer caso la letra debe ser mayúscula y en el segundo de los casos, la primera es
mayúscula y la segunda será, obligatoriamente, minúscula.
Los símbolos son empleados por conveniencia, para reducir tiempo, dinero y esfuerzo.
Es más fácil escribir: Que:
H Hidrógeno
B Boro

- 21 -
C Carbono
N Nitrógeno
O Oxígeno
F Flúor
Hay elementos cuyos símbolos son tomados de la letra inicial del nombre y otra letra
cualquiera, por ejemplo:
Elemento: Símbolo:
Helio He
Litio Li
Berilio Be
Magnesio Mg
Aluminio Al
Radón Rn
Sin embargo también hay elementos cuyo nombre no coincide con su símbolo. En ese caso,
con toda seguridad, el símbolo fue tomado de la raíz del nombre, generalmente latina o
griega, aunque hay raíces provenientes de otros idiomas.
Actividad 5: Detecte, en la tabla periódica de los elementos químicos, cuáles son los
elementos en los que no hay coincidencia entre el símbolo y el nombre e indague cuál es la
raíz de la que fue tomado el símbolo. Guíese en los ejemplos:
Elemento: Símbolo Raíz: Significado
Sodio Na Del latín Natrum
Se asienta el origen
de la palabra, pero
no su significado.
Fósforo P Phosphorus Portador de luz

- 22 -
Nota: Agregue las filas que considere necesarias.
1.5.3 COMPUESTOS
Los átomos de muchos elementos pueden interactuar entre sí para formar compuestos. Un
compuesto es una sustancia pura que se puede descomponer en otras más sencillas o
en los elementos que lo forman empleando métodos químicos (Definición propuesta por
Antoine Laurent Lavoisier).
2 3 2 2
2 2 2
1
2
H CO CO H O
H O H O
Así pues, el agua es un compuesto formado por Oxígeno (O) e Hidrógeno (H) en una
proporción fija de 2 átomos de H por 1 de O, que equivalen al 11.19% en masa de H y al
88.81% en masa de O, sin importar que el agua provenga del Río Bravo, del Mar Negro o de
la capa más profunda de hielo de la Antártida.
Si otro compuesto está formado por los mismos elementos que el agua, pero la proporción en
masa no es la misma, las propiedades del segundo compuesto, con toda seguridad serán
distintas, tal como lo demuestra la tabla 1.
Tabla 1. Propiedades del Agua y del Agua Oxigenada

- 23 -
Compuesto: Agua Agua Oxigenada
Fórmula Química: H2O H2O2
Estado de
agregación: Líquido Líquido
% en masa de H: 11.19% 5.93%
% en masa de O: 88.81% 94.07%
Olor: Inodora Inodora
Color: Incolora, en pequeñas cantidades Incolora
Sabor: Insípida Amargo
Masa Molar: 18.01534 g/mol 34.01474 g/mol
Punto de Fusión: 0°C -0.4°C
Punto de Ebullición: 100°C 150.2°C
Densidad: 1.00 g/cm3 1.40 g/cm3
Usos comunes: Solvente, agente de limpieza Blanqueador de vestimentas,
cabello y piezas dentales
Riesgos:
Ingestión: Necesaria para la vida; su
consumo excesivo puede producir
dolores de cabeza, confusión y
calambres. Puede ser fatal en atletas.
Inhalación: No es tóxica. Puede
disolver el surfactante de los
pulmones. La sofocación en el agua
se denomina ahogo.
Piel: La inmersión prolongada puede
causar descamación.
Ojos: No es peligrosa para los ojos, a
no ser que tenga cloro, con el cual los
ojos se irritan.
Ingestión: Serios daños,
posiblemente fatal.
Inhalación: Irritación severa,
posiblemente fatal.
Piel: Agente aclarante y
desinfectante. Causa ardor casi
inmediatamente.
Ojos: Peligroso.
1.5.4 MEZCLAS
Una mezcla es una combinación de dos o más sustancias en las que éstas conservan
sus propiedades distintivas. Las mezclas no poseen composición constante. Por tanto, las

- 24 -
muestras de aire obtenidas en diferentes ciudades probablemente diferirán en su composición
a causa de diferencias de altitud y contaminación atmosférica.
Las mezclas pueden ser homogéneas o heterogéneas. En las mezclas homogéneas (también
llamadas soluciones) la composición es uniforme, mientras que en las mezclas
heterogéneas no.
Algunos ejemplos familiares de las primeras son el aire, los refrescos, la gasolina, la
mayonesa o las amalgamas. Podemos observar ejemplos de las segundas en la sopa de
verduras, el pozole, el pan, una tela estampada, algunas medicinas, etcétera.
Dependiendo del tamaño de las partículas, las mezclas heterogéneas se dividen en
Suspensiones y Coloides. Los coloides son mezclas intermedias entre las soluciones y las
suspensiones. Para clasificar una sustancia como coloidal, las dimensiones de las partículas
del soluto están comprendidas entre 10 y 100 nm (1 nanómetro (nm) = 1x10-9 m) mientras que
las moléculas en solución miden entre 0.1 y 10 nm. Si las dimensiones de las partículas del
soluto sobrepasan los 100 nm, entonces se trata de una suspensión.
En la Tabla 2 se mencionan las principales diferencias entre soluciones, coloides y
suspensiones.
Tabla 2. Diferencias entre soluciones, coloides y suspensiones
Propiedad: Solución Coloide Suspensión
Tamaño de las partículas (nm): 0.1 - 10 10 - 100 Mayores de 100
Número de fases: Una Dos Dos
Tipo de mezcla: Homogénea En el límite Heterogénea
Hay separación al reposar: No No Sí
Transparencia: Transparente Intermedia No transparente
Fuente: (Facultad de Ciencias Médicas)

- 25 -
1.5.4.1 MÉTODOS DE SEPARACIÓN DE MEZCLAS
En la naturaleza, las sustancias se encuentran formando mezclas y compuestos que es
necesario separar y purificar, para estudiar sus propiedades tanto físicas como químicas. Los
procedimientos físicos por los cuales se separan las mezclas se denominan Métodos De
Separación.
A continuación presentaremos algunos:
1. Decantación
2. Filtración
3. Evaporación
4. Destilación
5. Centrifugación
6. Cristalización
7. Cromatografía
1. DECANTACIÓN:
Es la separación mecánica de un sólido de grano grueso, insoluble, en un líquido; consiste en
verter cuidadosamente el líquido, después de que se ha sedimentado el sólido. Por este
proceso se separan dos líquidos miscibles, de diferente densidad, por ejemplo, agua y aceite.
Figura 1 Separación por decantación

- 26 -
Figura 2 Embudos de decantación
2. FILTRACIÓN:
Es un tipo de separación mecánica, que sirve para separar sólidos insolubles de grano fino de
un líquido en el cual se encuentran mezclados; este método consiste en verter la mezcla a
través de un medio poroso que deje pasar el líquido y retenga el sólido. Los aparatos usados
se llaman filtros; el más común es el de porcelana porosa, usado en los hogares para purificar
el agua. Los medios más porosos más usados son: el papel filtro, la fibra de vidrio o asbesto,
telas etc.
En el laboratorio se usa el papel filtro, que se coloca en forma de cono en un embudo de
vidrio, a través del cual se hace pasar la mezcla, reteniendo el filtro la parte sólida y dejando
pasar el líquido.

- 27 -
Figura 5 Cribas para gránulos gruesos
Figura 3 Embudo Bushner
Figura 4 Filtración

- 28 -
Figura 6 Filtración al vacío
3. EVAPORACIÓN:
Es la separación de un sólido disuelto en un líquido, por calentamiento, hasta que el líquido
hierve y se transforma en vapor. Como no todas las sustancias se evaporan con la misma
rapidez, el sólido disuelto se obtiene en forma pura.
Figura 7 Evaporación natural

- 29 -
4. DESTILACIÓN:
Es el proceso mediante el cual se efectúa la separación de dos o más líquidos miscibles y
consiste en una evaporación y condensación sucesivas, aprovechando los diferentes puntos
de ebullición de cada uno de los líquidos, también se emplea para purificar un líquido
eliminando sus impurezas.
En la industria, la destilación se efectúa por medio de alambiques, que constan de una
caldera, una retorta, el refrigerante en forma de serpentín y el recolector; mediante este
procedimiento se obtiene el agua destilada o bidestilada, usada en las ámpulas o ampolletas
que se usan para preparar las suspensiones de los antibióticos, así como el agua destilada
para las planchas de vapor; también de esta manera se obtiene la purificación del alcohol, la
destilación del petróleo, etc.
Figura 8 Aparato para destilación

- 30 -
5. CENTRIFUGACIÓN:
Proceso mecánico que permite, por medio de un movimiento acelerado de rotación, provocar
la sedimentación de los componentes de una mezcla con diferente densidad. Para ello se usa
una máquina especial llamada centrífuga. Ejemplo: se pueden separar las grasas mezcladas
en los líquidos, como la leche, o bien los paquetes celulares de la sangre, separándolos del
suero sanguíneo.
6. CRISTALIZACIÓN:
Separación de un sólido soluble y la solución que lo contiene, en forma de cristales. Los
cristales pueden formarse de tres maneras:
Por fusión: para cristalizar una sustancia como el azufre por este procedimiento, se
coloca el azufre en un crisol y se funde por calentamiento, se enfría y cuando se ha
Figura 9 Centrífuga de alta velocidad
Figura 10 Centrifugación diferencial

- 31 -
formado una costra en la superficie, se hace un agujero en ella y se invierte
bruscamente el crisol, vertiendo el líquido que queda dentro. Se observará una
hermosa malla de cristales en el interior del crisol.
Figura 11 Cristales de azufre
Por disolución: Consiste en saturar un líquido o disolvente, por medio de un sólido o
soluto y dejar que se vaya evaporando lentamente, hasta que se han formado los
cristales. También puede hacerse una disolución concentrada en caliente y dejarla
enfriar. Si el enfriamiento es rápido, se obtendrán cristales pequeños, y si es lento,
cristales grandes.
Figura 12 Formación de estalactitas
Sublimación: Es el paso directo de un sólido gas, como sucede con el yodo y la
naftalina al ser calentados, ya que al enfriarse, los gases originan la cristalización por
enfriamiento rápido.

- 32 -
Figura 13 Sublimación de Yodo
7. CROMATOGRAFÍA:
Es un procedimiento para separar, identificar y determinar con exactitud la cantidad de cada
uno de los componentes de una mezcla líquida colorida. Consiste en poner en contacto
directo una fase móvil y una fase estacionaria. Existen dos variantes: la Cromatografía en
Papel y la Cromatografía en Columna.
Figura 14 Cromatografía en papel

- 33 -
Figura 15 Cromatografía en columna
1.6 ESTADOS DE AGREGACIÓN
La materia existe en 5 estados de agregación: Condensado de Bose-Einstein, Sólido, Líquido,
Gas y Plasma. Aunque más del 90% de la materia en el universo es Plasma, los tres estados
más comunes son sólido, líquido y gas.
En un sólido, las moléculas se mantienen juntas de manera ordenada, con escasa libertad de
movimiento. Las moléculas en un líquido están cerca unas de otras, sin que se mantengan en
una posición rígida, por lo que pueden moverse. En un gas, las moléculas están tan
separadas entre sí por grandes distancias en comparación con el tamaño de las moléculas
mismas. Ver Figura 16.
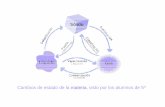
Las conversiones entre los tres principales estados de la materia son posibles sin que exista
un cambio en la composición de la sustancia. El paso del estado sólido al estado líquido se
llama Fusión, en tanto que la Vaporización o Evaporación nos indica que una sustancia se
transforma de líquido en gas. Hay también un paso directo del estado sólido al estado
gaseoso, se llama Sublimación. Los tres procesos anteriores tienen en común que todos ellos
consumen energía y por ello son denominados Procesos Endotérmicos.

- 34 -
Existen también los pasos inversos, pero cada uno recibe un nombre específico:
De gas a líquido: Condensación; de líquido a sólido: Congelación o Cristalización (este último
sólo en el caso de que el sólido formado sea un cristal) y de gas a sólido: Deposición (o
Sublimación inversa) Ver Figura 17.
Figura 16 Representación microscópica de un sólido, un líquido y un gas.
Figura 17 Conversiones de Estado Físico

- 35 -
BIBLIOGRAFÍA
WIKIPEDIA. (2012). Recuperado el 12 de 08 de 2012, de WIKIPEDIA.
Chang, R. (2007 Química). Química (9a ed.). México: Mc Graw Hil.
Facultad de Ciencias Médicas. (s.f.). Tutorial de coloides. Recuperado el 30 de Julio de 2012,
de http://medicina.usac.edu.gt/quimica/coloides/Coloides_1.htm
Jiménez Prieto, R., & Torres Verdugo, P. (2012). Recuperado el 20 de diciembre de 2012, de
http://concurso.cnice.mec.es/cnice2005/35_las_reacciones_quimicas/curso/lrq_cfq.html