Un compuesto posee la siguiente composición en masa: C = 55,81 %; H = 6, 98 %; O = 37,2 %.
description
Transcript of Un compuesto posee la siguiente composición en masa: C = 55,81 %; H = 6, 98 %; O = 37,2 %.

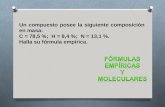
Un compuesto posee la siguiente composición en masa: C = 55,81 %; H = 6, 98 %; O = 37,2 %.Su masa molecular es de 172 g/mol.Halla su fórmula empírica y molecular.

Un compuesto posee la siguiente composición en masa:
C = 55,81 %; H = 6, 98 %; O = 37,2 %.
Su masa molecular es de 172 g/mol.
Halla su fórmula empírica y molecular.
Vamos a determinar la fórmula empírica.Para ello hallamos primero los moles de átomos de cada elemento en 100 g del compuesto.

Un compuesto posee la siguiente composición en masa:
C = 55,81 %; H = 6, 98 %; O = 37,2 %.
Su masa molecular es de 172 g/mol.
Halla su fórmula empírica y molecular.
n(C) = 55,81:12 = 4,65
n(H) = 6,98:1 = 6,98
n(O) = 37,2:16 = 2,325

Un compuesto posee la siguiente composición en masa:
C = 55,81 %; H = 6, 98 %; O = 37,2 %.
Su masa molecular es de 172 g/mol.
Halla su fórmula empírica y molecular.
Estos tres números (4,65, 6,98; 2,325) tienen que guardar una relación según números naturales sencillos.
Para hallar dicha relación dividimos por el menor.

Un compuesto posee la siguiente composición en masa:
C = 55,81 %; H = 6, 98 %; O = 37,2 %.
Su masa molecular es de 172 g/mol.
Halla su fórmula empírica y molecular.
n(C)
n(O)=
4,65
2,325= 2 =
2
1
n(H)
n(O)=
2,325= 3,002 ≈
6,98 3
1

Un compuesto posee la siguiente composición en masa:
C = 55,81 %; H = 6, 98 %; O = 37,2 %.
Su masa molecular es de 172 g/mol.
Halla su fórmula empírica y molecular.
n(C)
n(O)=
2
1
n(H)
n(O)≈
3
1
Luego la fórmula empírica del compuesto es:

Un compuesto posee la siguiente composición en masa:
C = 55,81 %; H = 6, 98 %; O = 37,2 %.
Su masa molecular es de 172 g/mol.
Halla su fórmula empírica y molecular.
Si ésta fuese la fórmula molecular, su masa molecular sería:
2·12+3·1+16 = 43 g/molPero como es 172 g/mol, la fórmula molecular será de la forma:
Siendo n un número natural

Un compuesto posee la siguiente composición en masa:
C = 55,81 %; H = 6, 98 %; O = 37,2 %.
Su masa molecular es de 172 g/mol.
Halla su fórmula empírica y molecular.
Como conocemos la masa molecular:172 = 43·n
Luego n será 172:43 = 4Por tanto la fórmula molecular será: