TESIS Determinacion de Cu Pb Por Espectofotometria de Absorcion Atomica
-
Upload
prueba11283 -
Category
Documents
-
view
257 -
download
4
Transcript of TESIS Determinacion de Cu Pb Por Espectofotometria de Absorcion Atomica

UNIVERSIDAD NACIONAL DEL CENTRO DEL PERÚ
FACULTAD DE INGENIERÍA QUÍMICA
MONOGRAFÍA
PARA OPTAR EL TITULO PROFESIONAL DE
INGENIERO QUÍMICO
PRESENTADO POR:
Bach. JORGE ERIMÓN AVELLANEDA
MARTÍNEZ.
HUANCAYO - PERÚ
2 009
“APLICACIÓN DE UN NUEVO MÉTODO DE ENSAYO PARA LA DETERMINACIÓN DE Cu, Pb, Zn, Ag, Fe, As, Bi, Sb EN
MUESTRAS GEOQUIMICAS POR ESPECTROFOTOMETRIA DE ABSORCIÓN ATÓMICA, EN LA COMPAÑÍA MINERA
AUSTRIA DUVAZ S.A.C.”

ii
“APLICACIÓN DE UN NUEVO MÉTODO DE ENSAYO PARA LA DETERMINACIÓN DE Cu, Pb, Zn, Ag, Fe, As, Bi, Sb EN
MUESTRAS GEOQUIMICAS POR ESPECTROFOTOMETRIA DE ABSORCIÓN ATÓMICA, EN LA COMPAÑÍA MINERA
AUSTRIA DUVAZ S.A.C.”

ASESOR:
ING. ENRIQUE BELTRAN LÁZARO
iii

DEDICATORIA
A mis tres amores Maribel, Jorge
Luís y Zamyra por darme el impulso de
crecer y ser mejor cada día.
iv

AGRADECIMIENTO
Primeramente a Dios por haberme guiado e iluminado en los momentos difíciles
y felices de mi vida que hicieron que hoy en día se cumpla unas de mis metas más
importantes.
A mi Padre Jorge y Raúl que desde arriba se deben sentir orgulloso de cada
paso que doy en mi vida. A mi Madre Viviana y Elvira por darme apoyo, comprensión a
lo largo de mi vida. A mis hermanos Carolina, Ruth y Salomón por su confianza. A mi
esposa Maribel por su amor, comprensión y apoyo incondicional. A mis hijos Jorge
Luís y Zamyra por esa alegría que brindan siempre en cada momento de mi vida.
A mi tutor Enrique Beltrán, por esa excelencia profesional y calidad de persona,
por su dedicación y ayuda prestada para la realización de esta monografía.
A la Facultad de Ingeniería Química y a todos los profesionales que laboran en
ella por impartir sus conocimientos y consejos, para mi formación profesional y apoyo
en la elaboración de esta monografía.
A la Compañía Minera Austria Duvaz S.A.C, a la Gerencia y todo el personal
que labora ahí, por haber confiado en el desarrollo, planificación y puesta en marcha
este proyecto.
A todas aquellas personas, que no he nombrado pero que de alguna manera
contribuyeron en el desarrollo de este proyecto.
v

CONTENIDO
Páginas.
ASESOR. iii
DEDICATORIA. iv
AGRADECIMIENTO. v
CONTENIDO. vi
INTRODUCCIÓN. xii
RESUMEN. xiv
OBJETIVOS. xv
SIMBOLOGÍA. xvi
CAPITULO I
GENERALIDADES
1.1 PLANTEAMIENTODEL PROBLEMA………….................................... 1
1.2 JUSTIFICACIÓN DEL PROBLEMA…………………………………... 1
1.2.1 JUSTIFICACIÓN TEÓRICA…………………………………… 1
1.2.2 JUSTIFICACIÓN LEGAL……………………………………… 2
1.2.3 JUSTIFICACIÓN TÉCNICA…………………………………… 2
CAPITULO II
MARCO TEORICO
2.1 LOCALIZACION DE LA EMPRESA MINERA
AUSTRIA DUVAZ SAC……………………………………………….. 3
2.2 ANTECEDENTES……………………………………………………… 3
2.2.1 RECURSOS MATERIALES, EQUIPOS E
INFRAESTRUCTURA…………………………………………. 4
2.2.2 PARTE TÉCNICA……………………………………………… 5
2.2.3 SISTEMA DE CALIDAD……………………………………… 5
2.3 REVISIÓN BIBLIOGRÁFICA………………………………………… 8
vi

2.3.1 ANALISIS QUIMICO…………………………………………... 8
2.3.2 ESPECTROSCOPIA DE ABSORCIÓN ATOMICA
ATÓMICA (EAA)………………………………………………. 10
2.3.3 PRINCIPIOS BASICOS DE EAA……………………………… 11
2.3.4 FUNDAMENTO DE EAA……………………………………… 14
2.3.5 DESCRIPCION DE LA TECNICA DE EAA…………………... 14
2.3.6 FUENTES DE LUZ (LAMPARA DE CATODO HUECO)………….. 15
2.3.7 NEBULIZADOR………………………………………………… 16
2.3.8 TIPOS DE FLAMAS………………………………………………….. 17
2.3.9 UNIDAD DE ATOMIZACION………………………………… 17
2.3.10 UNIDAD PROCESADORA DE SEÑALES……………………. 20
2.3.11 SISTEMAS OPTICOS…………………………………………… 23
2.3.12 INTERFERENCIAS EN ABSORCION ATOMICA……………. 24
2.3.13 FACTORES QUE INFLUYEN EN LA SENSIBILIDAD
DE UN EQUIPO DE AA………………………………………………. 28
2.3.14 CURVA DE CALIBRACION…………………………………… 29
2.3.15 PARAMETROS DE VALIDACION……………………………. 31
CAPITULO III
PARTE EXPERIMENTAL
3.1 PLANTEAMIENTO……………………………………………………………. 33
3.2 PRINCIPIO DEL METODO…………………………………………………… 34
3.3 DESCRIPCION DEL METODO ANTERIOR…………………………. 34
3.4 CONDICIONES DE TRABAJO PARA METODO ANTERIOR……… 34
3.4.1 ANALISIS VOLUMETRICO DEL COBRE…………………… 34
3.4.2 ANALISIS VOLUMETRICO DEL PLOMO…………………… 36
3.4.3 ANALISIS VOLUMETRICO DEL ZINC……………………… 38
3.5 DESCRIPCION DEL METODO PROPUESTO……………………….. 41
vii

3.5.1 PREPARACIÓN DE ESTÁNDARES PARA EL MÉTODO
PROPUESTO…………………………………………………… 43
3.5.2 CALCULOS…………………………………………………….. 43
3.5.3 CONDICIONES DE TRABAJO EN EQUIPO DE AA
PARA EL NUEVO METODO (EQUIPO MODELO
THERMO S SERIES)…………………………………………… 44
CAPITULO IV
TRATAMIENTOS DE DATOS Y DISCUSION
DE RESULTADOS
4.1 RECOPILACION DE DATOS………………………………………….. 45
4.1.1 ANALISIS QUIMICO DE LOS ELEMENTOS
EN EVALUACION……………………………………………… 45
4.1.2 NUMERO DE DETERMINACIONES…………………………. 54
4.1.3 HORAS – HOMBRE EMPLEADO PARA EL ANALISIS……. 58
4.1.4 CONSUMO DE REACTIVOS QUIMICOS……………………. 59
4.1.5 DIFERENCIA DE COSTOS ENTRE LOS DOS METODOS…. 60
4.2 RESULTADOS Y DISCUSION…………………………………………. 61
4.2.1 DETERMINACION DE LA DESVIACION ESTANDAR
RELATIVA……………………………………………………… 61
4.2.2 DETERMINACION EN EL CONTROL DE CALIDAD
INTERNO………………………………………………………… 65
CONCLUSIONES
RECOMENDACIONES
BIBLIOGRAFIA
ANEXOS
viii

INDICE DE FIGURAS
FIGURA Nº 1 PRINCIPIOS BASICOS DE EAA………………..…………….. 11
FIGURA Nº 2 PRINCIPIOS BASICOS DE EAA………………..…………….. 12
FIGURA Nº 3 PRINCIPIOS BASICOS DE EAA………………..…………….. 12
FIGURA Nº 4 PRINCIPIOS BASICOS DE EAA…………………..………….. 14
FIGURA Nº 5 TECNICA DE EAA…………………………………..………… 15
FIGURA Nº 6 LAMPARA DE CATODO HUECO…………………………..… 16
FIGURA Nº 7 NEBULIZADOR…………………………………………..……. 16
FIGURA Nº 8 UNIDAD DE ATOMIZACION……………………………....… 17
FIGURA Nº 9 CAMARA DE ATOMIZACION……………………………….. 18
FIGURA Nº 10 PROCESOS FISICOS DE LA ATOMIZACION…………..…. 19
FIGURA Nº 11 ESTRUCTURA DE LLAMA…………………………………. 19
FIGURA Nº 12 ATOMIZADORES DE LLAMA…………………………….... 20
FIGURA Nº 13 UNIDAD PROCESADORA DE SEÑALES………………..… 20
FIGURA Nº 14 FUENTES DE RADIACIÓN………………………………..… 21
FIGURA Nº 15 MONOCROMADORES………………………………….…… 22
FIGURA Nº 16 DETECTORES………………………………………………... 22
FIGURA Nº 17 SISTEMAS OPTICOS………………………………………… 23
FIGURA Nº 18 INTERFERENCIAS FISICAS………………………………... 24
FIGURA Nº 19 INTERFERENCIAS QUÍMICAS…………………………..… 25
FIGURA Nº 20 INTERFERENCIAS ESPECTRALES………………………... 26
FIGURA Nº 21 INTERFERENCIAS POR IONIZACION…………………..… 27
FIGURA Nº 22 INTERFERENCIAS POR BACKGROUND………………..… 28
FIGURA Nº 23 CURVA DE CALIBRACION……………………………….... 29
INDICE DE TABLAS
TABLA Nº 1 TIPOS DE FLAMAS…………………………..……………….… 17
TABLA Nº 2 CONDICIONES DE TRABAJO EN EQUIPO DE AA (THERMO
S SERIES)……………………………………………………………………..... 44
TABLA Nº 3 RESULTADOS DE LOS ANÁLISIS PARA EL Cu……....……. 46
ix

TABLA Nº 4 RESULTADOS DE LOS ANÁLISIS PARA EL Pb……..……… 48
TABLA Nº 5RESULTADOS DE LOS ANÁLISIS PARA EL Zn ……..…….... 50
TABLA Nº 6 RESULTADOS DE LOS ANÁLISIS PARA EL Ag ……..….…. 52
TABLA Nº 7 NUMERO DE DETERMINACIONES POR EL METODO
ANTERIOR………………………………………………………………..……. 54
TABLA Nº 8 NUMERO DE DETERMINACIONES POR EL
METODO PROPUESTO…………………………………………………..…… 56
TABLA Nº 9 HORAS HOMBRE EMPLEADO POR EL METODO
ANTERIOR…………………………………………………………………..…. 58
TABLA Nº 10 HORAS HOMBRE EMPLEADO POR EL METODO
PROPUESTO…………………………………………………………………..... 58
TABLA Nº 11 CONSUMO DE REACTIVOS QUIMICOS PARA EL
METODO ANTERIOR………………………………………………………….. 59
TABLA Nº 12 CONSUMO DE REACTIVOS QUIMICOS PARA
EL METODO PROPUESTO………………………………………………….… 59
TABLA Nº 13 COSTOS DE REACTIVOS POR EL METODO ANTERIOR… 60
TABLA Nº 14 COSTOS DE REACTIVOS POR EL METODO PROPUESTO.. 60
TABLA Nº 15 ANÁLISIS REALIZADOS POR EL ELEMENTO Cu PARA
DETERMINAR LA REPRODUCIBILIDAD…………………………………… 61
TABLA Nº 16 ANÁLISIS REALIZADOS POR EL ELEMENTO Pb PARA
DETERMINAR LA REPRODUCIBILIDAD …………………………………... 62
TABLA Nº 17 ANÁLISIS REALIZADOS POR EL ELEMENTO Zn PARA
DETERMINAR LA REPRODUCIBILIDAD…………………………………… 63
TABLA Nº 18 ANÁLISIS REALIZADOS POR EL ELEMENTO Ag PARA
DETERMINAR LA REPRODUCIBILIDAD…………………………….…….. 64
INDICE DE GRAFICAS
GRAFICA Nº 1RESULTADOS DE LOS ANÁLISIS PARA EL Cu……..…….. 47
GRAFICA Nº 2 RESULTADOS DE LOS ANÁLISIS PARA EL Pb…...…..…. 49
GRAFICA Nº 3 RESULTADOS DE LOS ANÁLISIS PARA EL Zn…...…..… 51
GRAFICA Nº 4 RESULTADOS DE LOS ANÁLISIS PARA EL Ag…..…….. 54
x

INTRODUCCIÓN
La producción Minero-Metalúrgica a través de las exportaciones de metales en
sus diferentes formas representa un importante ingreso de divisas al país.
La explotación de los minerales se fijan de acuerdo a las leyes determinadas en
los análisis, por ello surge la necesidad de obtener resultados seguros y confiables que
se logran con una alta y eficiente capacitación técnica y profesional.
Esto significa que la calidad dentro del servicio de un laboratorio dedicado a
analizar muestras de minerales que conllevan a tomar la mejor decisión para futuras
explotaciones así como para optimizar el proceso en la Planta Procesadora; es una
responsabilidad individual y de conjunto de todas las personas que lo componen;
significa que conozcamos y entendamos las exigencias de toda tarea encomendada, que
hagamos un trabajo con responsabilidad y que tomemos medidas para mejorar día a día.
Actualmente la gran mayoría de los Laboratorios se encuentran a la par con la
tecnología y respectivamente con la optimización de nuevos controles para la
determinación de nuevos métodos y una calidad en los ensayes
El Laboratorio Químico de la Compañía Minera Austria Duvaz S.A.C. desde los
inicios de sus operaciones fue trabajando con métodos clásicos.
Desde inicios del 2006 en el Laboratorio Químico empezó a enfrentar un
problema por el incremento de la cantidad de muestras geoquímicas generando así un
cuello de botella en el área de pesaje, tiempo en los resultados, aumento de consumo de
reactivos de una manera considerable y costo hacia a la empresa.
El presente trabajo monográfico fue desarrollado en las instalaciones del
Laboratorio Químico de la Compañía Minera Austria Duvaz S.A.C. que tiene por
objetivo demostrar la validez de un nuevo método de ensayo para la determinación de
Cu, Pb. Zn, Ag, Fe, As, Bi, Sb y otros elementos de muestras geoquímicas por
Espectrofotometría de Absorción Atómica. Y así eliminar las restricciones generadas el
área de pesaje y disminuir en un 70% el consumo de reactivos para el flujo actual de
muestras y aumentar en un 47% su captación.
El proyecto se formula como investigación y diseño; se estructura de la
siguiente manera:
xi

En la primera parte de la monografía se presentan los objetivos de las
investigaciones, tanto generales como específicas, la justificación de la investigación y
el planteamiento del problema.
En la segunda parte se describe el marco referencial en donde se presentan los
antecedentes y las bases conceptuales, las cuales deben conocerse para el entendimiento
de la investigación.
En la tercera parte se desarrolla el tratamiento de datos y discusión de resultados.
En la cuarta parte se refiere al análisis de resultados.
Finalmente se formulan las conclusiones y recomendaciones desarrolladas por el
autor.
xii

RESUMEN
La Compañía Minera Austria Duvaz S.A.C. es una empresa dedicada a las
actividades mineros metalúrgico de explotación, beneficio y comercialización de
concentrados de minerales polimetálicos.
La Compañía viene desarrollando nuevos proyectos de exploración, como son.
Proyecto Victoria, La Paz, Piritosa, Yolanda y otros en su afán de expandirse y
aumentar la cantidad de mineral tratado para el aprovechamiento de la coyuntura
mundial del precio de los metales. Por lo tanto, esto hace que el flujo de muestras
geoquímicas aumente de una manera considerable, pasando en los últimos meses del
año 2006 de 2276 ensayes a 3367 ensayes. Y esto hace que se genere una restricción en
el área de pesaje, aumentado también el consumo de reactivos.
El presente trabajo monográfico tiene la finalidad implementar un nuevo
método para la determinación de los elementos de Cu, Pb, Zn, Ag, Fe, As, Bi, Sb en
muestras geoquímicas para ello se harán análisis para demostrar el parámetro de
repetibiliad en nuestro laboratorio y la reproducibilidad con otros laboratorios del medio
como son. AHL, Ramón y SGS.
Así mismo se demuestra que con el método de análisis propuesto se está
logrando, disminuir en 70% el consumo de reactivos y aumentar en 47% la capacidad
de captación de muestras para el análisis.
De igual forma optimizando el tiempo de pesado, y disminuyendo el consumo de
reactivos.
xiii

OBJETIVOS
OBJETIVO GENERAL
Aplicar un nuevo método de ensayo para la determinación de Cu, Pb, Zn, Ag,
Fe, As, Bi, Sb en muestras geoquímicas por Espectrofotometría de Absorción
Atómica en la Compañía Minera Austria Duvaz S.A.C.
OBJETIVOS ESPECÍFICOS
Disminuir el consumo de los insumos químicos generadas en el proceso operativo
de Laboratorio Químico de Compañía Minera Austria Duvaz S.A.C.
Incrementar la capacidad de determinaciones de muestras en Laboratorio Químico
de Compañía Minera Austria Duvaz S.A.C.
Reducir el tiempo de resultados y costos operativos del Laboratorio Químico de
Compañía Minera Austria Duvaz S.A.C.
xiv

SIMBOLOGÍA UTILIZADA
A.A : Absorción Atómica.
Bk : Muestra Blanco.
Ag : Plata.
Cu : Cobre.
Zn : Zinc.
Pb : Plomo.
HCl : Acido clorhídrico.
HNO3 : Acido nítrico.
HClO4 : Acido Perclórico.
AgNO3 : Nitrato de Plata.
H2O2 : Peróxido de Hidrógeno.
NH4Cl : Cloruro de Amonio.
NH4OH : Hidróxido de Amonio.
Na2S2O3 : Tiosulfato de Sodio.
CH3CO2NH4 : Acetato de amonio.
NH4F : Fluoruro de Amonio.
KCLO3 : Clorato de Potasio.
KI : Ioduro de potasio.
EDTA : (Ethylenedinitrilotetraacetic acid, disodium
salt dihydrate)
X : Promedio.
RSD : Desv. Estándar relativa.
SD : Desv. Estándar.
S : Sensibilidad.
Oz/Tm : Onzas / tonelada métrica.
mg/l : Miligramos / litros
mm : Milímetros.
g : Gramos
ml : Mililitros.
ppm : Partes por millón.
min : Minutos.
xv

CAPITULO I
GENERALIDADES
1.1 PLANTEAMIENTODEL PROBLEMA
La Compañía viene desarrollando nuevos proyectos de exploración,
como son. Proyecto Victoria, La Paz, Piritosa, Yolanda y otros en su afán de
expandirse y aumentar la cantidad de mineral tratado para el aprovechamiento
de la coyuntura mundial del precio de los metales. Por lo tanto, esto hace que el
flujo de muestras geoquímicas aumente de una manera considerable, pasando en
los últimos meses del año 2006 de 2276 ensayes a 3367 ensayes. Y esto hace que
se genere una restricción en el área de pesaje, aumentado también el consumo
de reactivos.
1.2 JUSTIFICACIÓN DEL PROBLEMA
1.2.1 JUSTIFICACIÓN TEÓRICA
Es importante tener un conocimiento teórico acerca del método
que se va ha desarrollar e implementar para los respectivos ensayes.
1

1.2.2 JUSTIFICACIÓN LEGAL
La minería tiene una gran problemática principalmente con el
tiempo de resultados y costo de sus operaciones y a consecuencia de esta
surge la preocupación por parte de nuestro Laboratorio de implementar
un nuevo método.
Nuestro trabajo es importante en la medida en que se preocupa
por la calidad de nuestros resultados, que nos servirán en la exploración
de nuevos proyectos y optimización en el proceso de planta
concentradora.
1.2.3 JUSTIFICACIÓN TÉCNICA
Técnicamente la propuesta se justifica ya que para la empresa la
mayor preocupación es el tiempo en los resultados y costos operativos
que demandan estos análisis, además hoy en día tenemos resultados
confiables gracias a la implementación de equipos en nuestro laboratorio.
2

CAPITULO II
MARCO TEORICO
2.1 LOCALIZACION DE LA EMPRESA MINERA AUSTRIA DUVAZ
SAC.
La Compañía Minera Austria Duvaz S.A.C. Se encuentra ubicada en la
ciudad de Morococha, Provincia de Yauly y Departamento de Junín, a 175 Km.
En línea recta al NE de Lima, con latitud este 10º42’ latitud Sur y de longitud
76º45’ longitud Oeste, su altura es de 4330 m. Sobre el nivel del mar, de un
clima frígido. La humedad máxima es de 92% y la mínima de 32%, su
temperatura máxima es de 16ºC y la mínima de -9ºC.
2.1 ANTECEDENTES
El Laboratorio Químico es una de las áreas más importantes de la
Compañía Minera Austria Duvaz SAC, tiene a su cargo realizar los análisis de
reactivos, los análisis de minerales, puntos intermedios (cabeza), productos
finales (concentrados), así también como los relaves emitidos en Planta
Concentradora.
3

Los resultados que son reportados desde el Laboratorio definen
importantes aspectos en la decisión sobre lo estimado y la programación y
planeamiento de las posibles exploraciones y explotaciones que se puedan
llevar a cabo a mediano y largo plazo.
El muestreo, preparación y ensayes de muestras de exploraciones
(geoquímicas), son de suma importancia, pues sus resultados están relacionados
con las probables reservas que existen para la explotación y ayudaran a
determinar la ubicación de las diferentes vetas.
También son analizados los despachos nacionales e internacionales
(lotes comerciales de los concentrados), para seguir un control de las
operaciones de Planta, pues de la ley reportada se establecen los valores de los
productos comercializados.
2.1.1 RECURSOS MATERIALES, EQUIPOS E INFRAESTRUCTURA.
Anteriormente nuestro Laboratorio tenía una deficiencia en
equipos lo cual gracias al proyecto elaborado contamos con lo siguiente:
En el Área de Preparación de Muestra actualmente se cuenta
con una Chancadora Rhino, Pulverizador de Anillos, Filtros de Presión
de Aire para la preparación de pulpas de cabeza, relave y concentrados
de Pb, Zn y Cu y una Estufa para secado de muestras.
En el Área de Instrumentación actualmente contamos con
equipo de Absorción Atómica de última generación, equipo THERMO S
SERIES (6 lámparas) equipo sofisticado para el análisis Multi-elemento
secuencial y rápido por absorción atómica.
Se tiene implementado un área específica para los análisis de
Oro y Plata (FIRE ASSAY ) . El área cuenta con un horno eléctrico.
Con respecto a los Sistemas de extracción de polvos se viene
trabajando en un proyecto para instalar un sistema de aspiración al vacío
para disminuir la emisión de polvos y por lo tanto la contaminación, y
para los gases, se está trabajando en un proyecto para la instalación de
un Lavador de Gases.
4

2.1.2 PARTE TÉCNICA
Se cuenta con personal de amplia experiencia en análisis tanto
en vía clásica, vía seca e instrumental en Laboratorio Químico de
nuestra unidad, por lo tanto todas las operaciones analíticas se vienen
desarrollando con normalidad . Se evidencia esto con los resultados
comparativos obtenidos mensualmente al analizar los Lotes de
concentrados en los Laboratorio Externos de SGS, AHL y J. RAMON.
Para la evaluación de resultados se realiza un promedio de los tres
laboratorios de control y el resultado del laboratorio emisor, y se
determinó la variabilidad de los resultados mediante el cálculo del
%RSD (Desviación Estándar Relativa), en este parámetro ha sido
incluido como parte de la aplicación de criterios normalizados y en
adecuación de nuestras actividades a la norma ISO/IEC 17025 para el
control de calidad de nuestros resultados de laboratorio.
2.1.3 SISTEMA DE CALIDAD
a) Controles en la etapa de Muestreo:
Para asegurarnos de captar una muestra representativa y
proporcional en las plantas concentradoras, mensualmente se efectúa
una revisión a todos los parámetros de operación de los muestreadores
automáticos: Abertura de la cuchilla, tiempo de corte y número de
incrementos.
Para el respectivo control de los productos finales (Concentrado
de Cu, Pb y Zn) diariamente se realiza el respectivo muestreo en los
Filtros y sus muestreadores.
Actualmente para poder obtener resultados fiables sobre Cabeza
y Relave se esta realizando un muestreo manual lo que nos da mayor
seguridad en nuestros resultados.
El traslado de muestras desde Planta Concentradora a
Laboratorio se hace en baldes de acero Inoxidable herméticamente
cerrado con tapa y descripción de muestra.
De igual manera las muestras geoquímicas llegan al Laboratorio
en sus respectivas bolsas selladas y codificadas.
5

b) Control en la etapa de Preparación de Muestras
Se ha implementado los siguientes controles:
Inserción de muestras blancas: para monitorear la
contaminación y así esterilizar los equipos de operación tanto de la
chancadora como de la pulverizadora; lo cual se hará uso de sílice
granulado y fino para chancadora y pulverizadora respectivamente.
Granulometría de malla 10: este control se realiza en el
Chancado cada 15 muestras. El resultado obtenido debe ser mínimo
85%, lo cual garantiza la liberación del mineral.
Granulometría de malla 140: Este control se realiza para
chequear la eficiencia en el pulverizado. Obteniendo >90 % según
especifica las normas técnicas, lo cual asegurará la total liberación de los
metálicos contenidos en el mineral.
Duplicado de preparación: se realiza cuarteando cada 10
muestras y con ello se podrá monitorear la varianza de preparación a
partir de los resultados analíticos.
Determinación de humedad: se verifican las balanzas con pesas
certificadas para la preparación de muestras de concentrados en los
despachos.
Para evitar confusiones y errores se viene implementado una
serie de formatos individuales para anotar las diferentes etapas de las
operaciones desde la preparación de muestras hasta los resultados.
Para evitar errores por contaminación se tiene designado equipos
y materiales para cada tipo de muestra (cabeza, relave, concentrados de
Zn, Cu y Pb). Los filtros prensa son individuales para cada tipo de
muestra y todas las bandejas para el secado son de acero inoxidable y
codificadas y enumeradas.
c) Control en la etapa de análisis:
Todas las muestras son analizadas paralelamente con blancos.
Todas las muestras son analizadas paralelamente con estándares
de cabeza; concentrados y relaves; dependiendo de la matriz de la
muestra.
6

Se ha implementado formatos para anotar diariamente los
resultados analíticos de las muestras, blancos y estándares de referencia
de concentración conocida.
Las muestras de referencia han sido preparadas en nuestro
Laboratorio Químico, con los compòsitos mensuales, para tener la misma
matriz y evitar las interferencias químicas durante el análisis químico.
Para controlar la correcta obtención de resultados analíticos,
mensualmente se envían muestras de los compòsitos de las plantas
concentradoras a 3 laboratorios externos para verificar la calidad de
ensayos, mediante una evaluación y comparación de resultados.
Las soluciones de titulación para análisis por vía clásica, se
preparan con 20 días de anticipación a su uso para garantizar la
estabilidad de las soluciones y evitar variaciones en los factores de
cálculo
d) Control de lectura mediante el instrumento analítico
de AA
Antes de tomar la lectura de la concentración de las diferentes
muestras, nos aseguramos que el equipo esté perfectamente calibrado
(revisión de los parámetros de operación del Instrumento Analítico de
Absorción Atómica). Verificación de complemento de absorbancia entre
420 y 500. Los estándares de trabajo diario se preparan empleando la
misma matriz de las muestras, para evitar Interferencias químicas,
espectrales y de Ionización.
Mensualmente determinamos la curva de calibración del equipo
para verificar la linealidad del Instrumento Analítico y determinar a partir
de qué concentración deben analizarse por vía clásica.
Mensualmente se determina el límite de detección para describir
la capacidad analítica del Instrumento.
e) Control de eficiencia de los analistas y preparadores
Debemos tener en cuenta que los resultados deben ser
confiables y que el analista y/o preparador sea lo suficientemente
competente como para reproducir datos, es por ello que se evalúa
7

constantemente al personal ya se ha teóricamente empleando bien el
método a trabajar y/o empleando muestras ciegas (de concentración
conocida y anteriores), para verificar la precisión, exactitud y veracidad
de los resultados.
2.3 REVISIÓN BIBLIOGRÁFICA
2.3.1 ANALISIS QUIMICO
En el análisis químico es fundamental que la muestra represente
exactamente el material objeto del ensayo, y si una muestra no es
representativa, es por demás todo cuidado que se ponga en el análisis,
porque el resultado será negativo.
a) Análisis
Se refiere a todas las operaciones que pueden requerirse para usar
el método de determinación.
b) Ensaye:
Prueba de calidad de los metales que se trata o el análisis de un
producto químico.
Cada análisis cuantitativo es una breve investigación química que
requiere un planteamiento adecuado, anulación de las fuentes de error,
cuidado en la manipulación, etc. El éxito del trabajo depende de las
formas, condiciones y control con que se realizan.
En el laboratorio se pesan las muestras para el ensaye, se atacan
con ácidos diferentes según el mineral, se realizan precipitaciones por
medio de reactivos en determinadas condiciones, se separa la solución
del precipitado por medio del filtrado, se lavan los precipitados, se
preparan soluciones standard para las valoraciones y se titulan las
muestras, etc.
Todos estos procesos constituyen las condiciones de operación.
c) Operaciones en Análisis Cuantitativo:
8

Las principales operaciones que se realizan en análisis
cuantitativo son: pesada, ataque de muestras, precipitación, filtración,
lavado de precipitados, titulaciones, cálculo de porcentajes.
Pesadas de Muestra: La pesa de muestras que se realizan en el
laboratorio se hacen en la balanza analítica.
La balanza analítica es uno de los instrumentos de mayor
importancia para los trabajos de laboratorio y para el químico analista, es
el punto de partida para el análisis cuantitativo después de preparar la
muestra y por eso es necesario conocer el manejo y cuidado de la
balanza.
La pesada de muestras para el análisis, es el primer punto de
partida en laboratorio, para la exactitud de un resultado, si se comete un
error en la pesada, este error se suma a los demás posibles en las
preparaciones sucesivas que se realizan, por consiguiente va a tener una
alteración mayor.
Las muestras que llegan al laboratorio se seleccionan según su
numeración y tipo. Al efectuar la pesada se debe chequear el orden de los
vasos o fiolas, que deben coincidir con la numeración de los sobres, esto
evita confusiones y errores de trabajo.
Los ensayadores deben tener presente que un error causado por
negligencia en el trabajo o descuido en su operación, puede causar
errores y problemas en la operación de la Mina o Concentradora, con
graves consecuencias para la producción.
Ataque Químico: Las muestras de minerales, concentrados
finamente pulverizados y secos que se pesan en el laboratorio, se colocan
en vasos o fiolas. Para su ataque y disolución se usan ácidos u otros
reactivos, se vierte cuidadosamente el ácido con un dosificador
apropiado, se agita moviendo el vaso o fiola, y se coloca en la plancha
caliente sobre asbesto. Se debe reducir el volumen del ácido y a veces
evaporarlo totalmente hasta la sequedad, para agregar el siguiente
reactivo. Se debe hacer una evaporación lenta y no por ebullición fuerte,
porque se puede producir pérdida por mucha precaución que se tenga, ya
sea por salpicadura o por volatilización.
9

Precipitación: En los procesos volumétricos se separan los
elementos que interfieren por precipitación como en el caso del análisis
del Zinc; o precipitando el elemento que se desea y desea y después
disolviendo como en el caso del análisis del Plomo. La precipitación se
efectúa en soluciones calientes, la solución a precipitar se debe calentar a
temperaturas convenientes.
Filtración: Mediante esta operación se separa el precipitado de la
solución madre, tiene por objeto obtener el precipitado o el filtrado. El
papel de filtro a usar se debe adaptar perfectamente al embudo con el
objeto de que durante el proceso de la filtración el tubo del embudo se
halle siempre lleno de líquido y la filtración sea rápida. La pulpa de papel
se emplea como coadyuvante en la filtración de partículas pequeñas, que
pueden obstruir el poro del papel de filtro. La pulpa de papel se prepara
con hojas de papel bond desmenuzados, se coloca en un vaso y se agrega
agua destilada caliente, se agita bien, debe guardarse en un frasco tapado
para evitar contaminación del polvo.
Titulación: La volumetría consiste en determinar el volumen de
una solución de concentración conocida que se necesita para la reacción
cuantitativa, con un volumen dado. La solución de concentración
conocida es equivalente gramo por litro, se denomina solución valorada.
La solución valorada se agrega mediante una bureta. La operación de
agregar la solución valorada hasta que la reacción sea cuantitativa (hasta
el punto final) y medir la cantidad de solución gastada, se denomina
titulación o valoración.
2.3.2 ESPECTROSCOPIA DE ABSORCIÓN ATOMICA ATÓMICA
(EAA)
La espectroscopia de Absorción Atómica es una técnica de
análisis instrumental, capaz de detectar y determinar cuantitativamente la
mayoría de los elementos comprendidos en el sistema periódico.
10

En 1955 se obtuvieron las primeras aplicaciones reales de la
EAA, realizadas por Walsh en Australia y Alkemade en Holanda.
Alan Walsh, empezó sus trabajos en Absorción Atómica en 1952,
tardando nada más que una semana en cristalizar la idea de esta nueva
técnica.
En 1954, el Instituto de Física de la Universidad de Melbourne, en
Australia, realizó una demostración del EAA diseñado por Alan Walsh.
El espectrofotómetro presentaba todos los componentes esenciales que
hoy pueda tener un equipo moderno de AA.
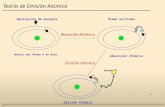
2.3.16 PRINCIPIOS BASICOS DE EAA
Cuando suministramos una cantidad de energía E a un átomo cualquiera
que se encuentre en su estado fundamental E0 esta energía es absorbida
por el átomo , entonces se incrementará el radio de giro de sus electrones
de la capa externa llevando al átomo a un nuevo estado energético E1,
llamado estado excitado.
Átomo en estado excitado Átomo en estado Fundamental
Nivel Energético =E1 Nivel Energético =E0
Átomo en estado excitado Átomo en estado Fundamental
Nivel Energético =E1 Nivel Energético =E0
+
E0 + E E1 E0
248.3
E = E1 - E0 = hò
11

Figura Nº 1
Todo este fenómeno lo representó perfectamente Plank en una ecuación
que dice: Un átomo en estado excitado se encuentra en equilibrio con
átomos en estado fundamental emitiendo una serie de radiaciones, a
diferentes longitudes de onda, características para cada uno de los
diferentes elementos.
Me* Me°+ h 1ע + h 2ע + h 3ע + ........
La representación gráfica de la intensidad de emisión de esas radiaciones,
en función de la longitud de onda, se llama espectro de emisión.
a) Absorción:
Es la diferencia que existe entre la luz incidente (Io) y la luz
emergente (I).
Absorción = Io - I
Figura Nº 2
b) Absorción Atómica:
Io I
b
12

Figura Nº 3
Es el proceso mediante el cual un átomo libre en estado fundamental
(o de baja energía), absorbe energía y pasa a un estado de alta energía,
llamado “Estado Excitado”.
c) Espectroscopia de Absorción:
Consistente en la absorción de radiaciones a determinadas longitudes
de onda por cualquier medio absorbente.
d) Transmitancia:
Es la relación matemática entre el cociente de la intensidad
transmitida y la incidente.
e) Absorbancia:
Al ser la transmitancia respecto al espesor del medio absorbente, una
función logarítmica, para una mayor comodidad se utiliza el concepto
Absorbancia, que se define como el logaritmo con signo cambiado de la
transmitancia: ( Ley de Lambert)
f) Ley de Lambert y Beer
Estado fundamental
E
0.0 eV
Estado Excitado
13

Relación existente entre la Absorbancia y la concentración de una
disolución, contenida en un recipiente de dimensiones fijas.
Abs = a b c
a = absortividad
b = longitud del camino óptico
c = concentración de la solución (g / L ó mol /L)
Figura Nº 4
2.3.17 FUNDAMENTO DE EAA
Tiene como fundamento la absorción de radiación de una longitud
de onda determinada. Esta radiación es absorbida selectivamente por
átomos que tengan niveles energéticos cuya diferencia en energía
corresponde en valor a la energía de los fotones incidentes.
También podemos decir que esta basado en la atomización del
analito en matriz acuosa y que utiliza comúnmente un nebulizador pre-
quemador (o cámara de nebulización) para crear una niebla de la muestra
y un quemador con forma de ranura que da una llama con una longitud
de trayecto más larga. La niebla atómica es desolvatada y expuesta a una
energía a una determinada longitud de onda emitida ya sea por una
Lámpara de Cátodo hueco construida con el mismo analito a determinar
o una Lámpara de Descarga de Electrones (EDL).
Log I 0
I
ppm
0.5
1.0
5 10 15abc
14

2.3.18 DESCRIPCION DE LA TECNICA DE EAA
Consta de lo siguiente: la muestra en forma líquida es aspirada a
través de un tubo capilar y conducido a un nebulizador dónde ésta se
desintegra y forma un rocío o pequeñas gotas de líquido.
Las gotas formadas son conducidas a una flama, donde se produce
una serie de eventos que originan la formación de átomos. Estos átomos
absorben cualitativamente la radiación emitida por la lámpara y la
cantidad de radiación absorbida está en función de su concentración.
La señal de la lámpara una vez que pasa por la flama llega a un
monocromador, que tiene como finalidad el discriminar todas las señales
que acompañan la línea de interés. Esta señal de radiación
electromagnética llega a un detector o transductor y pasa a un
amplificador y por último a un sistema de lectura.
Figura Nº 5
2.3.19 FUENTES DE LUZ (LAMPARA DE CATODO HUECO)
La fuente más utilizada en la Espectroscopia de Absorción
Atómica es la Lámpara de Cátodo Hueco.
Consiste en un ánodo de níquel o tungsteno y un cátodo
cilíndrico, encerrados en un tubo de vidrio, que contiene un gas inerte,
como el gas argón, a una presión de 1 a 5 torr. El cátodo esta constituido
con el metal cuyo espectro se desea obtener, o bien, sirve de soporte para
Detector sensible a la luzSistema electrónico de salida
monocromador
Fuente de luz - lámpara cátodo
hueco
atomizador(flama, horno,
ó hidrurossolución
(blanco, estándareso muestra)
0.723
15

una capa de dicho metal. Una parte de estos átomos se excitan con la luz
que pasa a través de ellos y, de este modo, al volver al estado
fundamental emiten su radiación característica, los átomos metálicos se
vuelven a depositar difundiendo de nuevo hacia la superficie del cátodo o
hacia las paredes del vidrio. La configuración cilíndrica del cátodo tiende
a concentrar la radiación en una región limitada del tubo metálico, este
diseño aumenta la probabilidad de que la redepositación sea en el cátodo
y no sobre la pared del vidrio.
14Figura Nº 6
2.3.20 NEBULIZADOR
Cuando una solución acuosa de sales inorgánicas disueltas es
aspirada y dirigida hacia una flama. En esta ocurre una serie de eventos
que conducen a la formación de átomos en la misma.
El quemador de premezclado o de flujo laminar tiene la siguiente
secuencia de pasos en su operación: inicialmente la muestra líquida debe
ser conducido al quemador. Para esto se hace el afecto Venturi .Este
efecto se crea cuando el oxidante (por ejemplo aire) se introduce a través
de un tu tubo diseñado de manera tal que se genera un vacío lo cual
produce la succión de la muestra líquida a través del tubo capilar. Este
mismo efecto Venturi favorece la formación de pequeñas gotas en forma
de rocío.
Figura Nº 7
16

2.3.21 TIPOS DE FLAMAS
Aunque a lo largo del desarrollo de la EAA se han utilizado
diferentes combinaciones de gases para producir la reacción de
combustión en el quemador, las únicas combinaciones que hoy en día se
emplean con fines prácticos son las flamas: aire-propano, aire-acetileno,
oxido nitroso-acetileno. Se utiliza una flama química para llevar a cabo la
atomización de los elementos a medir.
Entre las flamas más frecuentemente usadas se encuentran las
flamas de Aire-Acetileno y la Flama Oxido Nitroso-Acetileno, etc.
Como se puede observar en el cuadro:
Tabla Nº 1 Tabla de Flamas.
Combustible Oxidante Temperatura Vel. de Combustión
Gas LP Aire 1700-1900 39-43
Gas LP Oxígeno 2700-2800 370-390
Hidrógeno Aire 2000-2100 300-440
Hidrógeno Oxígeno 2550-2700 900-1400
Acetileno Aire 2100-2400 158-266
Acetileno Oxígeno 3050-3150 1100-2480
Acetileno Oxido Nitroso 2600 - 2800 285
2.3.22 UNIDAD DE ATOMIZACION
Figura Nº 8
17

a) Atomización
Proceso físico que consiste en llevar el analito (elemento objetivo)
a estado atómico.
b) Cámara de Atomización
La cámara de Atomización es de material inerte Fluoroplástico
estándar. El diseño incluye el Baffle y el Impact Bead permanentemente
colocados. Posee un Disco de Alumina y diseñado con inclinación
posterior para evitar efectos de Memoria.
Posee un sistema de protección seguro contra explosiones, además del
clásico drenaje, arrestadores y una válvula de seguridad.
Figura Nº 9
c) Atomización por flama
Son procesos físicos que se produce durante la atomización. En
un atomizador con llama la disolución de la muestra es nebulizada
mediante un flujo de gas oxidante mezclado con el gas combustible y se
transforma en una llama donde se produce la atomización. El primer paso
es la desolvatación en el que se evapora el disolvente hasta producir un
aerosol molecular sólido finamente dividido. Luego, la disociación de la
mayoría de estas moléculas produce un gas atómico.
18

Figura Nº 10
d) Estructura de llama
Las regiones más importantes de la llama son la zona de
combustión primaria secundaria y zona interzonal, esta última es la zona
más rica en átomos libres y es la más ampliamente utilizada.
Figura Nº 11
e) Perfiles de temperatura
La temperatura máxima se localiza aproximadamente 1 cm por
encima de la zona de combustión primaria
f) Atomizadores de llama
El aerosol formado por el flujo del gas oxidante, se mezcla con el
combustible y se pasa a través de una zona de flectores que eliminan las
gotitas que no sean muy finas. Como consecuencia de la acción de estas,
Iones Atómicos Iones Excitados (hv Atómica)
Disolución del Analito
Nebulizaciòn
Aerosol (Sólido/Gas)
Volatilizaciòn
Moléculas gaseosas Moléculas Excitadas (hv Molecular)
Disociación (Reversible) Atomos Atomos Excitados (hv Atómica)
Ionización (Reversible)
Aerosol
Desolvatacion
Estructura de la Flama:
Zona de Combustión PrimariaConocida como “Zona Fría”, es la zona de menor temperatura de la flama y es donde se encuentran Partículas sólidas, radicales libres y otras especies orgánicas.
Zona Media o Región InterconalConocida como “Zona Analítica”, es la zona en la cual la temperatura no es ni alta ni baja
Zona Externa o Cono ExternoConocida como “Zona Caliente” o “Zona de Deshechos”, es la parte en la cual se encuentran productos de oxidación.
19

la mayor parte de la muestra se recoge en el fondo de una cámara y se
drena hacia un contenedor de desechos. El aerosol, el oxidante y el
combustible se queman en un mechero provisto de una ranura de 1 mm o
2 de ancho por 5 ó 10 mm de longitud. Estos mecheros proporcionan una
llama relativamente estable y larga, estas propiedades aumentan la
sensibilidad y la reproducibilidad.
Figura Nº 12
2.3.23 UNIDAD PROCESADORA DE SEÑALES
Debido a que en los métodos de Atomización por Flama y
Electrotérmico se produce el fenómeno de “Absorción de Fondo” (o
“Background”), es necesario procesar la información y separar esta de la
Absorción Atómica Neta.
Esa es la función del sistema Procesador de señales, función que
se realiza a alta velocidad y elevadas frecuencias, de tal forma que la
corrección se lleve a cabo en tiempo real y casi en simultaneo.
Figura Nº 13
20

a) Fuentes de radiación
Los métodos analíticos basados en la absorción atómica son
potencialmente muy específicos, ya que las líneas de absorción atómica
son considerablemente estrechas (de 0,002 a 0,0005 nm)y las energías de
transición electrónica son específicas de cada elemento
Figura Nº 14
b) Monocromadores
Existen diversas combinaciones y distribuciones de los
componentes ópticos dentro de un monocromador que buscan optimizar
la calidad del espectro generado. Las más comunes son las denominadas,
prisma de Nicoll o el de Litrow y Zcerny-Turner para sistemas
convencionales con redes de difracción holográficas. También se están
comenzando a utilizar monocromadores con redes Echelle.
Un monocromador es un mecanismo de alta precisión compuesto
principalmente de:
Lentes planos y convexos, para dirigir y enfocar la radiación a otros
componentes del sistema.
Una Rejilla de difracción, para separar una longitud de onda específica.
Un Mecanismo Conductor para el movimiento angular de la rejilla de
difracción.
Ventanas de Cuchilla (Slit), para la entrada y una para la Salida de la
radiación.
1. Desalojo:Ar*
M°
2. Excitación:
Ar*M°
M*
3. Emisión:
M°
M*
21

Figura Nº 15
c) Detectores
El detector es el dispositivo encargado de captar la señal óptica
proveniente del monocromador y transformarlo en una señal electrónica
capaz de ser convertida en un valor legible. El más común es el
fotomultiplicador, tubo de vacío provisto de placas fotosensibles que
recibe los fotones, los convierte en impulsos electrónicos y multiplica
hasta obtener la suficiente intensidad eléctrica. En años reciente se están
utilizando también los detectores de estado sólido CCD, de alta
sensibilidad asociados a los monocromadores Echelle.
Figura Nº 16
22

2.3.24 SISTEMAS OPTICOS
Los lentes y espejos se encuentran dispuestos en forma ordenada según el
diseño del fabricante del equipo. Existen diferentes sistemas ópticos que
cumplen perfectamente las funciones de enfoque y redirección de la
radiación.
Figura Nº 17
Sistema de Haz Simple
Fuente de LuzQuemador
Espejo Rotatorio
Monocromador
DetectorLámpara de
Deuterio
Sistema de Doble Haz Optico
Fuente de LuzQuemador
Espejo Rotatorio
Monocromador
DetectorLámpara de
Deuterio
23

2.3.25 INTERFERENCIAS EN ABSORCION ATOMICA
a) Interferencias Físicas
Causas: Naturaleza de la muestra (viscosidad, tensión
superficial, densidad). Si la muestra sujeta a nebulización presenta
características diferentes a la de los patrones, la velocidad de aspiración o
la eficiencia de nebulización será diferente y por consiguiente el número
de átomos en el rayo de luz también.
Efectos: La absorbancia de la muestra puede aumentar o
disminuir (errores positivos o negativos).
Ejemplos: Concentración de ácidos, concentración de sólidos
disueltos, solventes Orgánicos.
Solución: Tratar de llevar las muestras y patrones a iguales
condiciones.
Figura Nº 18
b) Interferencias Químicas
Generación de Compuestos no separables por coexistencia de
matriz. Ejemplo: Influencia de Ion fosfato con respecto al ion Calcio en
análisis por flama (generación de Fosfato de calcio).
Recu
pera
ción
(%)
0.01 0.1 1.0
100
80
60
40
20
Interferencia de la Matriz por efecto de Viscosidad
Mg (2 x 10-5 M)Cu (8 x 10-5 M)
H3PO4 (M)
24

Causas: Flama de baja energía como para lograr la disociación de
algunas moléculas térmicamente estables.
Efectos: Bajos valores da absorbancia debidos a la baja
disociación de las moléculas en átomos libres.
Ejemplo: La presencia de fosfatos en la determinación de Calcio,
utilizando flama Aire-Acetileno.
Solución: Remoción de los materiales interferentes por
intercambio iónico y/o extracción por solventes. Extracción
selectiva del elemento objetivo. Adición de supresores de
interferencias (Modificadores de Matriz). Cambio del tipo de
Flama (uso de flamas de mayor energía). Medición por adición de
patrón.
Figura Nº 19
c) Interferencia Espectrales
Causas: Superposición de la línea de emisión de un elemento
diferente sobre la línea de emisión del analito. Esta interferencia
Calcio + Fosfato + 1000 ug/mL de Lantano
Calcio + Fosfato
ug/mL de Fósforo (como Fosfato)
Ug/m
L de
Cal
cio
0.5 1.0 1.5 2.0
1.0
0.9
0.8
0.7
0
Interferencia de Fosfato sobre Calcio
25

no es muy frecuente, pero las posibilidades de que esto ocurra
aumentan cuando se utilizan lámparas multielementos.
Efecto: Valores desproporcionados en absorbancia para las
muestras.
Ejemplo: Interferencia mutua entre Hierro y Níquel.
Solución: Estrechamiento del ancho de apertura
espectral del monocromador. Utilizar longitud de onda
alternativas.
Figura Nº 20
d) Interferencia Por Ionización
Ocurre por desestabilización del equilibrio entre el par Átomo/Ion
en la flama, debido principalmente a flamas muy enérgicas o a la
coexistencia de elementos con potenciales iónicos muy bajos. Ejemplo:
Influencia de Potasio (K) durante la medición de Sodio (Na) o La
influencia de Sodio en la medición de Potasio.
Causas: Alta energía de la flama. Si la flama de trabajo es muy
energética, puede originar que los átomos pasen al estado
excitado o a la remoción total del electrón, originando un ion.
Espectros de Absorción de Ni, Ca y Mg
285.2 nm
Magnesio
422.6 nm
Calcio
231.6 nm
232.2 nm
Níquel
26

Efectos: Disminución de átomos disponibles en estado
fundamental en el paso del haz de luz.
Ejemplo: Determinación de Bario en flama Aire-Acetileno.
Solución: Modificadores de Matriz (generalmente soluciones de
Sodio o Potasio). Esta soluciones contienen elementos fácilmente
ionizables, lo que generan flamas ricas en electrones.
Figura Nº 21
e) Interferencia Por Absorción De Fondo (Background)
Causa: No todos los materiales de la matriz se atomizan en un
100%. Formas moleculares no disociadas presentan espectros de
absorción de bandas anchas.
Efectos: Dispersión de luz que aumenta la señal de absorbancia.
Ejemplo: Partículas sólidas menudas dispersan la luz en una
amplia región de longitud de onda.
Solución: Sistemas de corrección automática del background en
el equipo (corrección continua, Auto corrección (Self-Reverse) o
Efecto Zeeman).
553.5 nm
455.4 nm
553.5 nm (Resonancia)
455.4 nm (Línea del ion)Bario
500 1000 1500 2000 2500 3000ug/mL de Potasio añadido
Abso
rban
cia
0.1
0.2
0.3
0.4
0.5
Interferencia por Ionización(Efecto de la adición de ion Potasio)
27

1
Figura Nº 22
2.3.26 FACTORES QUE INFLUYEN EN LA SENSIBILIDAD DE UN
EQUIPO DE AA
a) Elección de la línea de absorción
La elección correcta de la línea de absorción depende de la
sensibilidad requerida
C. St x 0,0044
Sensibilidad (S): = ---------------------------------------
Absorbancia medida
C.St: Concentración de solución estándar de un elemento, que se sugiere
sea de 0,050 mg/l
La sensibilidad es la concentración que hay que introducir en un
aparato de Absorción Atómica para que éste produzca una señal con una
intensidad del 1% de absorción. La sensibilidad mejora si sólo la línea de
resonancia alcanza el detector
b) Temperatura de la llama (factores que afectan la atomización)
El tamaño de la gota, residuo, % de alimentación de la muestra,
temperatura del quemador, la formación de óxidos, % de combustible y
Abso
rban
cia Absorción de Fondo
(AF)
Absorción Atómica (AA)
AA + AF
Longitud de Onda
28

oxidante en la llama.
2.3.27 CURVA DE CALIBRACION
Una curva de calibración es el registro de los valores de
absorbancia vs valores de concentración de soluciones estándar en un eje
de coordenadas.
Se trata de una curva de referencia construida con cantidades
conocidas de una sustancia (estándar) que se utiliza para determinar la
cantidad de un elemento presente en una muestra incógnita.
El registro obtenido se une mediante una línea que debe de
acercarse lo más posible a todos los puntos.
Figura Nº 23
A menudo en nuestro laboratorio debemos realizar diversas
curvas de calibración para determinados métodos, y también curvas de
linealidad para verificar la linealidad de lectura de un espectrofotómetro.
a) Factores necesarios
Para realizar una curva de calibración o linealidad, matemáticamente
el número de mediciones mínimo debe ser por lo menos 3, ya que si
realizamos solamente 2 siempre será una recta. Pero en realidad la
cantidad de mediciones que debemos realizar para hacer una curva tiene
29

que ser en lo posible mayor o igual a 5. Éstas deben estar uniformemente
distribuidas a lo largo del intervalo de concentraciones de nuestro interés.
Controlar la respuesta lineal de nuestro espectrofotómetro, ya que si
no, podemos obtener curvas con desviaciones importantes.
Los cálculos para realizar las diluciones deben contemplar la menor
cantidad de pipetas y micropietas posibles para evitar introducir
demasiados errores.
Para cada concentración de muestra la medición debe realizarse por
duplicado en lo posible.
La curva debe prepararse a partir de una solución madre de alta
concentración para realizar las distintas mediciones por dilución directa y
no seriada, ya que éste último método produce la propagación de error
entre diluciones aumentando la dispersión de los puntos de la curva.
Hay que tener en cuenta que las curvas que tengan la mayoría de los
puntos en regiones de Absorbancia donde el error espectrofotométrico
sea grande, verán afectada su linealidad.
Con respecto al análisis del punto de vista estadístico, se supone que
si se realizan varias medidas de un patrón, los valores resultantes de por
ej. Abs. tienen una distribución de errores Gausiana. También
suponemos que la magnitud de los errores en los valores de Abs. son
independientes de la concentración del analito considerado. Esto supone
que todos los puntos del gráfico tienen igual importancia o peso en la
realización de los cálculos. Si esta suposición es cierta, el análisis de la
recta de regresión será no ponderada, ya que teóricamente todos los
puntos de la recta tienen igual peso (la varianza de los residuos es
independiente de x). Pero en la práctica el error por lo general varia en
función de la concentración haciendo necesario el uso del análisis de
regresión ponderado.
30

La recta de calibración seguirá a la ecuación: y = a + bx donde b es la
pendiente y a la ordenada al origen. Los puntos que caen sobre la recta
serán: (x1,y1)......(xn,yn).
Es importante señalar que estas curvas en realidad tienen que
acercarse lo más posible a una recta. Cuanto mayor se acerca la curva a
una recta, mejor es la linealidad, es decir, mejor es la calidad de la
medición de la curva. También es importante saber que existen métodos
cuyas curvas son más lineales que otras.
2.3.28 PARAMETROS DE VALIDACION
La estadística aplicada y los conceptos generales de Gestión de
Calidad, integran la base indispensable para la construcción del Sistema
de Calidad de Laboratorio. Puede decirse entonces que esta rama de las
matemáticas es el instrumento que “mide” la Calidad de los resultados
analíticos, siguiendo siempre los lineamientos generales de la norma
Internacional ISO/IEC 17025, máximo referente en cuanto a requisitos
generales para la competencia de los laboratorios de ensayo y de
calibración.
A continuación definimos los conceptos de los parámetros de
validación de ensayos.
Para el presente trabajo se estará desarrollando solo dos de ellos.
a) Veracidad
Grado de concordancia existente entre el valor medio obtenido de
una gran serie de resultados y un valor aceptado como referencia.
b) Precisión
Grado de concordancia existente entre los resultados
independientes de un ensayo, obtenidos en condiciones estipuladas.
c) Selectividad/especificidad
Es el grado por el cual un método puede determinar un analito
particular dentro de una mezcla compleja, sin ser interferido por otros
31

componentes de la mezcla.
d) Limite de detección
Es la menor cantidad de un analito en una muestra la cual puede
ser detectada pero no necesariamente cuantificada con un valor exacto.
e) Limite de cuantificación
Es la concentración mínima que puede determinarse con un nivel
aceptable de exactitud.
f) Linealidad.
Es la relación entre la concentración de un analito y respuesta del
método, denominada comúnmente curva patrón o curva de calibración.
g) Rango de trabajo
Es el intervalo entre la más alta y más baja concentración del
analito de la muestra, para la cual se ha demostrado que el método
analítico tiene un nivel apropiado de precisión, veracidad y linealidad.
h) Sensibilidad
Es el cambio en la respuesta de un instrumento de medida
dividido por el cambio correspondiente en el estímulo.
i) Robustez
Es la medida de la resistencia de un método al cambio de
respuesta cuando se introducen pequeñas variaciones en el
procedimiento.
j) Incertidumbre
Un parámetro asociado con el resultado de una medición, que
caracteriza la dispersión de los valores que podrían ser atribuidos
razonablemente al resultado.
32

CAPITULO III
PARTE EXPERIMENTAL
3.1 PLANTEAMIENTO
En el área de Laboratorio Químico, de la Compañía Minera Austria
Duvaz SAC, en los últimos meses se ha registrado un incremento de muestras
geoquímicas, todo esto debido al aumento de sus exploraciones y al desarrollo
de nuevos proyectos como: Victoria, Piritosa entre otros. Cuya preocupación de
la supervisión de Laboratorio ha sido aplicar una reingeniería a todo el proceso,
ya que se estaban presentando dos problemas en el proceso de análisis debido a
este incremento. El primero es que había generado un cuello de botella en la sala
de balanzas y el otro es que se incremento el consumo de reactivos en el ataque
químico, para tal efecto se realizaron pruebas en la aplicación de un nuevo
procedimiento, haciendo variaciones de pesos y volúmenes de dilución, los
resultados fueron comparados mediante un Round-Robin con Laboratorios
externos dando una buena performance.
33

3.2 PRINCIPIO DEL MÉTODO
La determinación de Cu, Pb, Zn, Ag, Fe, etc. se realiza mediante una
digestión con ácido clorhídrico y ácido nítrico. Este tipo de digestión es
aplicable a muestras tales como: sulfuros, sulfatos, óxidos, carbonatos y cuando
no hay presencia de silicatos los cuales no son atacados por esta mezcla ácida.
No se recomienda esta digestión para análisis de elementos difícilmente
solubles como Sn, W, Ta, V, Zr.
3.3 DESCRIPCION DEL METODO ANTERIOR
Para la determinación de los elementos Pb, Zn, Cu, Ag, en muestras
geoquímicas, se realizaban por el método volumétrico, lo cual tomaba
demasiado tiempo en los reportes y el consumo excesivo de reactivos.
3.4 CONDICIONES DE TRABAJO PARA METODO ANTERIOR
Las condiciones de trabajo en el método anterior a parte de que se
realizaba por el método volumétrico, no se contaba con equipos óptimos para los
análisis como chancadora, pulverizadora, etc.
3.5.1 ANALISIS VOLUMETRICO DEL COBRE
a) PRINCIPIO
Las soluciones neutras o débilmente ácidas de Cu (II) reaccionan
con el KI dando un precipitado de ioduro cuproso, y liberando el yodo. El
yodo formado se titula con solución valorada de Tiosulfato de sodio.
El CuI libera muy lentamente el yodo absorbido, provocando
puntos finales prematuros, para ello se añade Nitrato de Plata, en esta
forma el yodo absorbido vuelve a la solución siendo titulado por el
Tiosulfato de sodio.
2 Cu+2 + 4 I - 2 CUI + I2
I2 + 2S2O3 2 I- + S4 O6=
b) REACTIVOS
Acido Perclórico (HClO4).
34

Acido Acético glacial (1:1), Preparar 500ml de ácido acético
glacial y llevar a 1 litro con agua.
Hidróxido de Amonio.
Fluoruro de Sodio/Amonio.
Solución de Yoduro de Potasio (25%), Pesar yoduro de potasio,
25g y diluir a 100ml con agua.
Solución de Almidón (0.5%), Pesar 0.5 g de almidón y disolver
con una cantidad pequeña de agua fría y luego agregar lentamente
100ml de agua en ebullición y hervir por 2 minutos.
Solución de Nitrato de Plata (10%), Pesar 10g de AgNO3, y
llevar a 100ml con agua.
Solución de Tiosulfato de Sodio, 0.025N, Pesar 6.3g de
Tiosulfato de sodio, disolver en agua deshionizada, diluir en
1litro y homogeneizar.
Cobre metálico, Pureza mínima 99.999%
c) PROCEDIMIENTO:
Pesar 0.25g de muestra y transferir a un matraz de 300,
500ml.
Adicionar 4ml de ácido Perclórico y digestar hasta que los
vapores blancos se encuentren en el pico del matraz, retirar de la plancha
y enfriar.
Retomar la muestra lavando las paredes del matraz, añadir
agua hasta 50ml y hervir aproximadamente por 10 minutos.
Enfriar, adicionar hidróxido de amonio gota a gota, hasta
formar un precipitado ligero de hidróxido de hierro (III). Luego adicionar
10ml de ácido acético.
Adicionar fluoruro de amonio, para acomplejar el Fe.
Antes de titular adicionar 10ml de solución de yoduro de
potasio, homogenizar en el agitador magnético luego titular el yodo
liberado con el tiosulfato de sodio hasta que la solución se torne amarillo
pálido, luego agregar 10ml de solución de almidón y continuar titulando
hasta que el color azul comience a desaparecer, adicionar 10 gotas de
AgNO3, continuar titulando gota a gota. En el punto final desaparece el
35

color azul de la solución y aparece el precipitado blanco lechoso o
amarillo cuando se deja sedimentar.(Ver Diagrama de Flujo Anexo 1)
d) ESTANDARIZACIÓN DE LA SOLUCIÓN DE TIOSULFATO
DE SODIO:
Pesar por triplicado aproximadamente 0.0500g de cobre metálico
en matraz de 300, 500ml. Digestar con 3ml de ácido Perclórico, luego
retomar la muestra con 50ml de agua deshionizada y hervir. Enfriar y
regular el pH usando el hidróxido de amonio y la solución de ácido
acético. Proseguir como la muestra.
e) EXPRESIÓN DE RESULTADOS
Cálculo del factor:
3.5.2 ANALISIS VOLUMETRICO DEL PLOMO
a) PRINCIPIO
Se basa en tratar los concentrados con ácidos comunes, luego se
adiciona el ácido sulfúrico para precipitar el plomo como sulfato de
plomo, el cual posteriormente es disuelto con solución de Acetato de
Amonio formándose acetato de plomo, que luego es titulado
complexométricamente con solución valorada de EDTA
(Ethylenedinitrilotetraacetic acid, disodium salt dihydrate) usando
Anaranjado de Xilenol como indicador.
La reacción química de disolución es como sigue:
PbSO4 + 2NH4 .C2 H3 O2 Pb(C2 H3 O2 )2 + (NH4 )2 SO4
b) REACTIVOS
Acido Nítrico (concentrado).
Acido Sulfúrico (concentrado).
Acido Acético glacial.
36

Acetato de amonio.
Solución de EDTA (0.05M), Disolver 18.63g de EDTA en 1 litro
de agua y homogeneizar.
Indicador Anaranjado de Xilenol (0.5%), Disolver 0.5 g de
anaranjado de xilenol en 50ml de alcohol, y diluir a 100ml con agua.
Solución de Extractiva de Plomo, Disolver 400 g de acetato de
amonio, luego adicionar 30ml de ácido acético, y diluir a 1 litro con
agua.
Plomo metálico, Pureza mínima 99.999%
c) PROCEDIMIENTO:
Pesar 0.50g de muestra y transferir a un vaso de 400ml.
Colocar la luna de reloj y añadir 10ml de ácido nítrico concentrado
llevar a la plancha caliente aproximadamente 3 minutos (Hasta el
desprendimiento de gases nitrosos), retirar de la plancha y enfriar.
Añadir 10 ml ácido sulfúrico cubrir con luna de reloj y digestar en
la plancha hasta humos blancos, retirar de la plancha y enfriar.
Agregar 2 gotas de ácido nítrico, colocar nuevamente en la
plancha, hasta pastoso, retirar de la plancha y enfriar.
Retomar la muestra lavando la luna y paredes del vaso, añadir
agua hasta 50ml y hervir aproximadamente por 10 minutos.
Retirar de la plancha y dejar reposar la muestra hasta que este frío.
Filtrar en papel de filtro N°42 o su equivalente en fiolas de 200ml,
lavar el precipitado 3 veces con agua deshionizada fría, luego el papel de
filtro 8 veces aproximadamente con agua deshionizada fría.
El precipitado regresar al vaso original que previamente contiene
30ml de solución extractiva de plomo, con la ayuda de una piceta;
haciendo pedacitos el papel de filtro ponerlo al vaso original.
Llevar a la plancha y hervir por 8 minutos aproximadamente,
retirar de la plancha y adicionar agua caliente hasta un volumen
aproximado de 150ml y 50ml de agua fría.
Agregar de 3 a 5 gotas del indicador anaranjado de xilenol
proceder a titular con la solución de EDTA (0.05M) hasta que el color
vire de grosella a amarillo champán. (Ver Diagrama de Flujo Anexo 2)
37

d) ESTANDARIZACIÓN DE LA SOLUCIÓN DE EDTA:
Pesar por triplicado; aproximadamente 0.3000g de Plomo
metálico en vaso de 400 ml, adicionar 15 ml de ácido nítrico (1:3), cubrir
con luna de reloj y calentar hasta la aparición de un precipitado blanco,
llevar a plancha baja hasta sequedad completa, retirar de la plancha,
retomar con agua deshionizada, lavando la luna de reloj y las paredes del
vaso, hervir aproximadamente 5 minutos, adicionar 30ml de solución
extractiva de plomo y proseguir a la titulación.
e) EXPRESIÓN DE RESULTADOS
Cálculo del factor:
3.5.3 ANALISIS VOLUMETRICO DEL ZINC
a) PRINCIPIO
Este método es usado para determinar Zinc en concentrados o
mineral de Zinc, etc. Está basado en la titulación de Zinc con una
solución valorada de EDTA (Ácido Etilendiamino Tetra Acético) en una
solución ligeramente ácida (pH =5.4 y 5.6).
Este análisis donde el Zinc forma un complejo (1:1) estable y
soluble con EDTA en la titulación complexométrica de éste metal con
EDTA y Xilenol orange como indicador, es así como produce un punto
final de excelente definición.
b) REACTIVOS
38

Acido Clorhídrico cc.
Acido Nítrico cc.
Clorato de Potasio.
Peróxido de Hidrógeno.
Acido Acético glacial (1:1).
Cloruro de Amonio.
Hidróxido de Amonio.
Acetato de amonio.
Fluoruro de Amonio.
Tiosulfato de Sodio.
Solución de Acido Clorhídrico diluido (1:1).
Solución de EDTA (0.05M), Disolver 18.63g de EDTA en 1litro de
agua y homogeneizar.
Solución de Anaranjado de Xilenol (0,5%); se disuelve 0,5g de
Anaranjado de Xilenol en 50ml de alcohol etílico y aforar con agua
destilada a 100 ml.
Solución de Azul Bromothymol (0,5%); se disuelve 0,5g de Azul
Bromothymol en 50ml de alcohol etílico y aforar con agua destilada a
100ml.
Solución Buffer, pesar 250g de acetato de amonio, 30g de fluoruro
de amonio y 100g de tíosulfato de sodio disolver en agua y llevar a 2
litros.
Solución Extractiva, Pesar 143g de cloruro de amonio, disolver en
715ml de hidróxido de amonio y diluir a 1litro con agua.
Solución de lavado, Mezclar 100 ml de solución extractiva con 400
ml de agua caliente.
Zinc metálico (Patrón Primario), 99.99% de pureza.
c) PROCEDIMIENTO:
Pesar 0,250g de muestra y transferir a un vaso de 250ml.
Colocar la luna de reloj y añadir 10ml de ácido nítrico concentrado
llevar a la plancha caliente aproximadamente 3 minutos (Hasta el
desprendimiento de gases nitrosos), añadir una pizca de clorato de
potasio y llevar a sequedad, a temperatura moderada.
39

Retirar la muestra de la plancha; para enfriar, adicionar 5ml de
ácido clorhídrico concentrado, retomar la muestra lavando con agua
destilada la luna de reloj y las paredes del vaso, llevar hasta un volumen
aproximado de 75ml, hervir hasta reducir aproximadamente a 50ml,
luego enfriar.
A la solución agregar 1ml de peróxido de hidrógeno y 40ml de
solución extractiva de Zinc, hervir a temperatura moderada de 10 a 15
minutos aproximadamente. Retirar de la plancha y enfriar.
Filtrar en papel Nº 41 o su equivalente, recibiendo el filtrado en un
vaso de 600 ml. Lavar el vaso y el precipitado con solución de lavado
caliente, hasta un volumen de 200ml, luego con agua caliente hasta un
volumen de 250mL. Retirar la solución filtrada.
Enfriar la solución, añadir de 3 a 5 gotas del Indicador Azul
Bromothynol y neutralizar agregando Acido clorhídrico (1:1) gota a gota
hasta cambiar el viraje de azul intenso amarillo brillante y añadir 5 gotas
en exceso, enfriar.
Añadir 40ml de solución Buffer.
Agregar de 3 a 5 gotas del indicador anaranjado de xilenol proceder
a titular con la solución de EDTA (0.05M) hasta que el color vire de
grosella a amarillo champán. (Ver Diagrama de Flujo Anexo 3)
d) ESTANDARIZACIÓN DE LA SOLUCIÓN DE EDTA:
Pesar por triplicado aproximadamente 0.15 g de zinc metálico en
un vaso de 400ml, adicionar 20ml de ácido clorhídrico (1:1), cubrir con
la luna de reloj. Digestar a temperatura moderada hasta que reduzca de
volumen a aproximadamente 5ml. Retirar de la plancha y retomar
adicionando 150ml de agua y 20ml de solución extractiva, hervir por 5
minutos. Retirar y enfriar.
e) EXPRESIÓN DE RESULTADOS
Cálculo del factor:
40

Cálculo del contenido de Zinc en la muestra:
3.6 DESCRIPCION DEL METODO PROPUESTO
El nuevo método que se implemento es del análisis por Espectroscopia de
Absorción Atómica (EAA) que se realiza de la siguiente manera:
Hacer un solo peso para determinar los 4 elementos solicitados para su
análisis, disminuyendo de este modo el 50% de horas hombre destinada para el
pesaje, así mismo se disminuye en 70% los reactivos para el ataque químico
(HCl, HNO3 ) y trasvasar a un solo volumen disminuyendo también las horas-
hombre para las diluciones.
a) EQUIPOS
Balanza Analítica de 0.1 mg de precisión.
Equipo de Espectrofotometría de Absorción Atómica
b) MATERIALES
Espátula.
Fiolas de 100 ml
Fiolas de 50 ml
Lunas de reloj
Pipetas de 2 ml
Bombilla
Pizetas
Plancha eléctrica
c) REACTIVOS
Ácido Clorhídrico. (HCl)
Ácido Nítrico (HNO3)
Agua desionizada
Clorato de Potasio (KCLO3)
41

d) PROCEDIMIENTO
La determinación de Plomo, Zinc, Plata, Cobre Fierro, se realiza
mediante una digestión con ácido clorhídrico y ácido nítrico. Este tipo de
digestión es aplicable a muestras tales como: Sulfuros, sulfatos, óxidos,
carbonatos y cuando no hay presencia de silicatos los cuales no son
atacados por esta mezcla ácida:
Pesar 0.5 g de muestra en fiolas de 100 ml
Adicionar 10 ml de HNO3 y llevar a la plancha de calentamiento
de 275 ºC +/- 5ºC hasta la eliminación de los vapores nitrosos, agregar
una pizca de clorato de potasio, digestar y concentrar hasta 1ml
aproximadamente (consistencia pastosa).
Luego adicionar 5 ml de HCl y hervir hasta eliminar los vapores
nitrosos, llevando el contenido a un volumen de aproximadamente 5
mlPosteriormente añadir 20ml de HCl, se coloca a la plancha de
calentamiento de 275 ºC +/- 5ºC, digestar hasta el cambio de coloración a
amarillo y/o anaranjado de solución luego de lo cual se adiciona 5 ml
aproximadamente de agua destiladaza y se lleva a la plancha por un
periodo de 3 min.
Retirar la muestra de la plancha y lavar con agua destilada las
paredes de la fiola, llevar a enfriamiento.
Luego de la digestión, se dejan enfriar las muestras, para su
posterior aforo con agua destilada, se tapan las fiolas y se proceden a
agitarlas por dos ves cada bach de muestras.
Una vez agitadas las muestras se procede a realizar la dilución
correspondiente, alícuota de 2 ml en fiola de 50 ml, se acondiciona al
20% en volumen con Acido Clorhídrico, se afora y agita por dos veces
por cada bach de muestras.
Leer en el equipo de absorción atómica buscando la absorbancia
optima para cada elemento. (ver diagrama de Flujo Anexo 4)
3.5.1 PREPARACIÓN DE ESTÁNDARES PARA EL MÉTODO
PROPUESTO
Para la preparación de los estándares al 25% de HCl en ppm
se realiza mediante la siguiente formula:
42

C1*V1 = C2*V2
Despejando: V1 = V2*C2/C1
Donde:
C1: Concentración de la matriz (1000 ppm).
V1: Volumen a extraer de la matriz.
C2: Concentración requerida
V2: Volumen requerido.
a) Estándares para Cobre : (Cu)
5,10, 20 y 50ppm
b) Estándares para Plomo :(Pb)
5,10, 20 y 50ppm
c) Estándares para Zinc: (Zn)
5,10, 20 y 50ppm
d) Estándares para Plata: (Ag)
0.5, 1, 2 y 5 ppm
3.5.2 CALCULOS
g/Tm ó ppm =[ Peso de muestra ( Lectura AA – Lectura Bk)* Dilución]
Volumen final
43

3.5.3 CONDICIONES DE TRABAJO EN EQUIPO DE AA PARA EL NUEVO METODO (EQUIPO MODELO THERMO S
SERIES)
ELEMENTO
Long de
onda
Max.
corriente
Corriente
lampara
Flujo
combustible Slit Sensibilidad Estandar ABSORBANCIA
nm % L/min nm mg/L=absorb. mg/L <5% Normal >5%
Ag
0,5 0.055 0,058 .061
328,1 4 75 0.9 0,5 1.5 mg/L = 0.5 1 0.113 0,119 0.125
2 0.225 0,237 0.249
Cu
5 0.195 0,205 0.215
324,8 8 75 1.2 0,2 1.5 mg/L = 0.5 10 0.398 0,419 0.440
20 0.798 0.840 0.882
50 1.663 1.750 1.838
Pb
5 0.173 0,182 0.191
217.0 8 75 1.1 0,5 10.0 mg/L = 0.5 10 0.248 0.261 0.274
20 0.404 0.425 0.446
50 0.874 0920 0.966
Zn
5 0.267 0,281 0.295
213,9 10 75 1.2 1,0 0.3 mg/L = 0.5 10 0.431 0.454 0.477
20 0.860 0.905 0.950
50 1.815 1.910 2.006
Tabla Nº 2 Fuente LAD

CAPITULO IV
TRATAMIENTOS DE DATOS Y DISCUSION
DE RESULTADOS
4.1 RECOPILACION DE DATOS
4.1.1 ANALISIS QUIMICO DE LOS ELEMENTOS EN EVALUACION
Los análisis químicos se realizaron en 3 diferentes Laboratorios,
para determinar los elementos de Pb, Zn, Cu y Ag para las muestras
geoquímicas en evaluación, para luego realizar un tratamiento
estadístico.
Y determinar el parámetro de reproducibilidad del método
planteado arrojando resultados que a continuación se muestran en los
cuadros elaborados para cada elemento en estudio.
Los Laboratorios donde se realizaron los análisis de las muestras
en estudio Fueron: JR; AHL, SGS.

Tabla Nº 3 Resultados de los análisis para el elemento Cu fueron:
código Elementos item de Cu % Cu % Cu % Cu % Cu %
muestra LAD AHL JR SGS x%
error1 19013 1,29 1,31 1,30 1,29 1,30 0,782 19014 0,60 0,65 0,63 0,64 0,64 6,673 19015 0,63 0,62 0,63 0,65 0,63 0,534 19016 0,80 0,77 0,78 0,75 0,77 -4,175 19017 0,61 0,60 0,59 0,58 0,59 -3,286 18986 0,52 0,48 0,50 0,53 0,50 -3,217 18987 0,17 0,17 0,18 0,19 0,18 5,888 18988 4,15 4,12 4,11 4,19 4,14 -0,249 18989 3,71 3,70 3,65 3,80 3,72 0,1810 19001 0,07 0,07 0,07 0,06 0,07 -4,7611 19002 0,10 0,10 0,09 0,10 0,10 -3,3312 19003 0,12 0,12 0,11 0,13 0,12 0,0013 19004 0,05 0,05 0,05 0,05 0,05 0,0014 19005 0,14 0,13 0,12 0,14 0,13 -7,1415 18786 0,51 0,50 0,52 0,55 0,52 2,6116 18787 0,28 0,27 0,29 0,28 0,28 0,0017 18788 0,28 0,28 0,30 0,25 0,28 -1,1918 18789 0,67 0,69 0,68 0,66 0,68 1,0019 18790 0,76 0,78 0,77 0,75 0,77 0,8820 18791 0,35 0,33 0,33 0,34 0,33 -4,76Fuente LAD
Según los resultados obtenidos en el promedio de los tres laboratorios
comparados con nuestro resultados tenemos una diferencia en las muestras 2, 7 y
14, entre tanto las demás muestras están dentro del porcentaje de error aceptable
ya que para análisis de muestras de minerales se considera +/- 5%.

Grafica 1
En esta grafica podemos observar que hay una ligera diferencia en las muestras 4, 7 y 14.

Tabla Nº 4 Los resultados de los análisis para el elemento Pb fueron:
código Elementos item de Pb % Pb % Pb % Pb % Pb %
muestra LAD AHL JR SGS x%
error1 19013 1,60 1,65 1,63 1,61 1,63 1,882 19014 1,73 1,70 1,74 1,73 1,72 -0,393 19015 0,33 0,30 0,32 0,33 0,32 -4,044 19016 0,15 0,16 0,15 0,15 0,15 2,225 19017 0,11 0,12 0,11 0,11 0,11 3,036 18986 0,16 0,16 0,15 0,17 0,16 0,007 18987 0,52 0,50 0,53 0,52 0,52 -0,648 18988 0,19 0,19 0,18 0,20 0,19 0,009 18989 0,13 0,12 0,13 0,13 0,13 -2,5610 19001 0,91 0,90 0,93 0,89 0,91 -0,3711 19002 0,66 0,65 0,67 0,64 0,65 -1,0112 19003 0,85 0,84 0,86 0,85 0,85 0,0013 19004 0,47 0,43 0,45 0,49 0,46 -2,8414 19005 0,93 0,98 0,99 0,92 0,96 3,5815 18786 1,07 1,05 1,06 1,08 1,06 -0,6216 18787 0,28 0,28 0,27 0,26 0,27 -3,5717 18788 0,20 0,19 0,18 0,20 0,19 -5,0018 18789 0,96 0,95 0,97 0,99 0,97 1,0419 18790 1,09 1,08 1,08 1,09 1,08 -0,6120 18791 0,62 0,63 0,62 0,62 0,62 0,54Fuente LAD
Según los resultados obtenidos en el promedio de los tres laboratorios
comparados con nuestro resultados se puede observar un porcentaje de error
aceptable ya que para análisis de muestras de minerales se considera +/- 5%.

Grafica 2
En esta grafica podemos observar que nuestros resultados estan muy serca a los resultados de los otros tres laboratorios.

Tabla Nº 5 Los resultados de los análisis para el elemento Zn fueron:
código Elementos item de Zn % Zn % Zn % Zn % Zn %
muestra LAD AHL JR SGS x%
error1 19013 3,93 3,90 3,96 3,90 3,92 -0,252 19014 2,86 2,89 2,89 2,85 2,88 0,583 19015 3,14 3,15 3,17 3,16 3,16 0,644 19016 6,23 6,26 6,26 6,21 6,24 0,215 19017 2,39 2,40 2,42 2,46 2,43 1,536 18986 1,98 1,99 2,01 1,99 2,00 0,847 18987 2,33 2,35 2,37 2,33 2,35 0,868 18988 1,57 1,59 1,59 1,58 1,59 1,069 18989 1,46 1,49 1,48 1,47 1,48 1,3710 19001 3,56 3,60 3,58 3,53 3,57 0,2811 19002 2,78 2,80 2,80 2,77 2,79 0,3612 19003 4,64 4,60 4,66 4,65 4,64 -0,0713 19004 1,68 1,70 1,70 1,66 1,69 0,4014 19005 5,26 5,26 5,28 5,30 5,28 0,3815 18786 6,47 6,49 6,50 6,45 6,48 0,1516 18787 4,51 4,50 4,55 4,51 4,52 0,2217 18788 3,54 3,55 3,58 3,54 3,56 0,4718 18789 5,84 5,80 5,88 5,85 5,84 0,0619 18790 4,87 4,80 4,91 4,88 4,86 -0,1420 18791 9,93 9,90 9,96 9,93 9,93 0,00Fuente LAD
Según los resultados obtenidos en el promedio de los tres laboratorios
comparados con nuestro resultados se puede observar un porcentaje de error al
+/- 2% lo cual es aceptable, de igual forma evaluando con cada Laboratorio
externo.

Grafica 3
En esta grafica podemos observar que nuestros resultados estan al +/- 2% de error

Tabla Nº 6 Los resultados de los análisis para el elemento Ag fueron:
código Elementos
item de Ag
Oz/TmAg
Oz/TmAg
Oz/TmAg
Oz/TmAg
Oz/Tm
muestra LAD AHL JR SGS x%
error1 19013 6,56 6,52 6,60 6,56 6,56 0,002 19014 9,07 9,05 9,12 9,07 9,08 0,113 19015 0,64 0,65 0,71 0,65 0,67 4,694 19016 9,39 9,40 9,46 9,39 9,42 0,285 19017 1,80 1,82 1,77 1,80 1,80 -0,196 18986 1,74 1,75 1,78 1,74 1,76 0,967 18987 1,41 1,41 1,45 1,42 1,43 1,188 18988 14,72 14,72 14,76 14,73 14,74 0,119 18989 12,60 12,59 12,64 12,61 12,61 0,1110 19001 1,35 1,34 1,31 1,36 1,34 -0,9911 19002 1,93 1,94 1,90 1,94 1,93 -0,1712 19003 1,09 1,15 1,09 1,11 1,12 2,4513 19004 0,90 0,96 0,90 0,91 0,92 2,5914 19005 1,41 1,38 1,43 1,43 1,41 0,2415 18786 3,73 3,70 3,75 3,74 3,73 0,0016 18787 1,54 1,56 1,59 1,56 1,57 1,9517 18788 1,80 1,82 1,85 1,81 1,83 1,4818 18789 12,92 12,95 12,97 12,94 12,95 0,2619 18790 11,00 11,01 11,04 11,01 11,02 0,1820 18791 1,74 1,78 1,79 1,75 1,77 1,92Fuente LAD
Según los resultados obtenidos en el promedio de los tres laboratorios
comparados con nuestro resultados se puede observar un porcentaje de error al
+/- 3% lo cual es aceptable ya que para análisis de muestras de minerales se
considera +/- 5%.

Grafica 4
En esta grafica podemos observar que nuestros resultados tienen un porcentaje de error al +/- 3%.

4.1.2 NUMERO DE DETERMINACIONES
El número de determinaciones en el Laboratorio Analítico, para
muestras geoquímicas se mantuvo sin variaciones considerables hasta
Septiembre del año 2006, a partir la Empresa Minera Austria Duvaz
SAC en su afán de aumentar la producción de concentrados de Zn, Pb,
Cu, y Ag intensifica sus exploraciones y explotación en las unidades
antes mencionadas, variando el numero de determinaciones como se
muestra en el cuadro adjunto:
a) NUMERO DE DETERMINACIONES POR EL METODO
ANTERIOR
Tabla Nº 7
MES
TRATA
MIENTO NUMERO ENSAYES TOTAL
TMS MUESTRAS
%
Cu
%
Pb
%
Zn
Oz./Tm
Ag ENSAYE
ENERO 12718 464 464 464 464 464 1856
FEBRERO 14296 423 423 423 423 423 1692
MARZO 14022 469 469 469 469 469 1876
ABRIL 14746 473 473 473 473 473 1892
MAYO 14002 428 428 428 428 428 1712
JUNIO 14910 467 467 467 467 467 1868
JULIO 13525 424 424 424 424 424 1696
AGOSTO 15200 495 495 495 495 495 1980
SETIEMBRE 15100 718 718 718 718 718 2872
OCTUBRE 15351 698 698 698 698 698 2792
NOVIEMBRE 15300 700 700 700 700 700 2800
DICIEMBRE 15052 660 660 660 660 660 2640
TOTAL
GENERAL 128519 4361 4361 4361 4361 4361 17444
Fuente LAD

Grafica 5
Según el cuadro y la grafica se puede observar el resumen del número de determinaciones que se realizan mensualmente en el
área de Laboratorio químico, en donde se puede apreciar la tendencia al incremento. Cuyo promedio de los cuatro últimos meses del año
2006 es de 2276 determinaciones mensuales.

b) NUMERO DE DETERMINACIONES POR EL METODO
PROPUESTO
Actualmente para el año 2008 se determino un promedio de
3367 ensayes al mes. Habiendo un incremento del 47% en los
ensayes.
Tabla Nº 8
MES
TRATA
MIENTO NUMERO ENSAYES TOTAL
TMS MUESTRAS %Cu %Pb %Zn Oz./Tm Ag ENSAYE
ENERO 16530 753 753 753 753 753 3012
FEBRERO 15100 770 770 770 770 770 3080
MARZO 16437 770 770 770 770 770 3080
ABRIL 17422 651 651 651 651 651 2604
MAYO 16045 914 914 914 914 914 3656
JUNIO 16395 805 805 805 805 805 3220
JULIO 16806 917 917 917 917 917 3668
AGOSTO 17013 1024 1024 1024 1024 1024 4096
SETIEMBRE 15164 826 826 826 826 826 3304
OCTUBRE 17000 1128 1128 1128 1128 1128 4512
NOVIEMBRE 17217 837 837 837 837 837 3348
DICIEMBRE 16580 706 706 706 706 706 2824
TOTAL
GENERAL 197709 10101 7430 7430 7430 7430 29720
Fuente LAD

Grafica 6
Según la grafica se puede observar el incremento de muestras lo cual nos lleva a realizar mayor ensayos en cada mes.

4.1.3 HORAS – HOMBRE EMPLEADO PARA EL ANALISIS
Las horas hombre empleado para el análisis están especificadas
tanto para el método anterior como para el método propuesto
a) HORAS HOMBRE EMPLEADO POR EL METODO
ANTERIOR
Los cálculos están basados sólo en la etapa de análisis,
que corresponde al pesaje, ataque químico y resultado.
Tabla Nº 9
item min/muestra
min/4
ensayes
pesaje 1 min 4 min
ataque 30 min 90 min
resultado 30 min 100 min
Tiempo empleado 61 min 194 min
Fuente LAD
Donde se puede observar que el tiempo empleado para
esta etapa es de 1840 horas hombre por las 2276 ensayes.
b) HORAS HOMBRE EMPLEADO POR EL METODO
PROPUESTO
Para el análisis por el método propuesto corresponde
también todos los ítems contemplados en el método anterior,
además la misma cantidad de ensayes.
Tabla Nº 10
item min/muestra
min/4
ensayes
pesaje 1 min 1 min
ataque 10 min 10 min
resultado 20 min 35min
Tiempo empleado 31 min 46 min
Fuente LAD
58

Para la misma cantidad de ensayes se obtuvo un tiempo de
436 horas hombre, lo que significa un empleo de 1404 horas
hombre menos, esto nos permite incrementar en un 47% la
capacidad de ensayes.
4.1.4 CONSUMO DE REACTIVOS QUIMICOS
a) PARA EL METODO ANTERIOR
El consumo de reactivos químicos está basado estrictamente para
el HCl y el HNO3 en la etapa de análisis, llegando a consumirse en un
mes para la determinación de 2276 ensayes la cantidad de 23 litros de
HCl y 46 litros de HNO3 como se muestra en el cuadro respectivo.
Tabla Nº 11
ACIDOS ml/muestra ml/4 ensayes L/2276 ensayes
HNO3 20 80 46
HCL 10 40 23
H2SO4 10 40 23
HCLO4 3 12 7
Fuente LAD
c) PARA EL METODO PROPUESTO
Para el método propuesto se está considerando un solo ataque y
las diluciones respectivas dependiendo de la concentración de la muestra.
Donde se puede apreciar que se tiene un consumo de 17 Litros de
HCl y 6 Litros de HNO3 para la misma cantidad de 2276 ensayes.
Tabla Nº 12
ACIDOS ml/muestra ml/4 ensayes L/2276 ensayes
HNO3 10 10 6
HCL 30 30 17
H2SO4 ** ** **
HCLO4 ** ** **
Fuente LAD
59

Por lo tanto según los cuadros comparador se puede apreciar lo siguiente
que habido una disminución de 27% para el HCl y una disminución de 87% para
el HNO3.
4.1.6 DIFERENCIA DE COSTOS ENTRE LOS DOS METODOS
Si analizamos la diferencia entre los dos métodos vamos a
encontrar que el consumo de HCl para el método anterior es de 23 litros
y para el nuevo método es de 17 litro, y el consumo de HNO3 es de 46 L
para el método anterior y 6 L para el nuevo método. Como se muestra en
los cuadros adjuntos:
a)PARA EL METODO ANTERIOR
Tabla Nº 13
INSUMOS Litros empleados $/litro TOTAL ($)
HNO3 46 6.4 294.4
HCL 23 8.1 186.3
Fuente LAD
Haciendo un total de $480.7 en insumos
b) PARA EL METODO PROPUESTO
Tabla Nº 14
INSUMOS Litros empleados $/litro TOTAL ($)
HNO3 06 6.4 38.4
HCL 17 8.1 137.7
Fuente LAD
Haciendo un total de $176.1 en insumos.
Por lo tanto se puede apreciar que hay una disminución de 63% en términos
de costos en insumos químicos del HCl y HNO3.
60

4.2 RESULTADOS Y DISCUSION
4.2.1 DETERMINACION DE LA DESVIACION ESTANDAR RELATIVA
La desviación estándar relativa (RSD) de los resultados debe ser
menor o igual a 5%.
a) Análisis realizados por el elemento Cu en cuatro Laboratorios
diferentes para determinar la reproducibilidad
Tabla Nº 15
Código Elementos
de % Cu % Cu % Cu % Cu S X RSD
Muestra LAD AHL JR SGS
19013 1.29 1.31 1.3 1.29 0.009 1.30 0.72
19014 0.60 0.65 0.63 0.64 0.021 0.63 3.31
19015 0.63 0.62 0.63 0.65 0.012 0.63 1.97
19016 0.80 0.77 0.78 0.75 0.022 0.78 2.88
19017 0.61 0.6 0.59 0.58 0.014 0.60 2.31
18986 0.52 0.48 0.5 0.53 0.022 0.51 4.27
18987 0.17 0.17 0.18 0.19 0.010 0.18 5.90
18988 4.15 4.12 4.11 4.19 0.036 4.14 0.87
18989 3.71 3.7 3.65 3.8 0.062 3.72 1.68
19001 0.07 0.07 0.07 0.06 0.005 0.07 7.45
19002 0.10 0.1 0.09 0.1 0.005 0.10 4.89
19003 0.12 0.12 0.11 0.13 0.009 0.12 7.19
19004 0.05 0.05 0.05 0.05 0.001 0.05 2.84
19005 0.14 0.13 0.12 0.14 0.009 0.13 6.77
18786 0.51 0.5 0.52 0.55 0.021 0.52 4.12
18787 0.28 0.27 0.29 0.28 0.008 0.28 3.02
18788 0.28 0.28 0.3 0.25 0.021 0.28 7.42
18789 0.67 0.69 0.68 0.66 0.013 0.67 1.93
18790 0.76 0.78 0.77 0.75 0.013 0.76 1.70
18791 0.35 0.33 0.33 0.34 0.011 0.34 3.38
Fuente LAD
61

b) Análisis realizados por el elemento Pb en cuatro Laboratorios
diferentes para determinar la reproducibilidad
Tabla Nº 16
Código Elementos
de % Pb % Pb % Pb % Pb S X RSD
Muestra LAD AHL JR SGS
19013 1.60 1.65 1.63 1.61 0.022 1.62 1.37
19014 1.73 1.70 1.74 1.73 0.017 1.72 0.99
19015 0.33 0.30 0.32 0.33 0.014 0.32 4.48
19016 0.15 0.16 0.15 0.15 0.005 0.15 3.20
19017 0.11 0.12 0.11 0.11 0.005 0.11 4.41
18986 0.16 0.16 0.15 0.17 0.008 0.16 5.14
18987 0.52 0.50 0.53 0.52 0.013 0.52 2.43
18988 0.19 0.19 0.18 0.20 0.008 0.19 4.31
18989 0.13 0.12 0.13 0.13 0.006 0.13 4.60
19001 0.91 0.90 0.93 0.89 0.017 0.91 1.88
19002 0.66 0.65 0.67 0.64 0.013 0.65 1.92
19003 0.85 0.84 0.86 0.85 0.008 0.85 1.00
19004 0.47 0.43 0.45 0.49 0.026 0.46 5.62
19005 0.93 0.98 0.99 0.92 0.036 0.95 3.81
18786 1.07 1.05 1.06 1.08 0.013 1.07 1.23
18787 0.28 0.28 0.27 0.26 0.009 0.27 3.37
18788 0.20 0.19 0.18 0.20 0.011 0.19 5.56
18789 0.96 0.95 0.97 0.99 0.017 0.97 1.73
18790 1.09 1.08 1.08 1.09 0.007 1.09 0.66
18791 0.62 0.63 0.62 0.62 0.005 0.62 0.76
Fuente LAD
62

c) Análisis realizados por el elemento Zn en cuatro Laboratorios
diferentes para determinar la reproducibilidad
Tabla Nº 17
Código Elementos
de % Zn % Zn % Zn % Zn S X RSD
Muestra LAD AHL JR SGS
19013 3.93 3.90 3.96 3.90 0.028 3.92 0.72
19014 2.86 2.89 2.89 2.85 0.022 2.87 0.76
19015 3.14 3.15 3.17 3.16 0.015 3.15 0.47
19016 6.23 6.26 6.26 6.21 0.025 6.24 0.41
19017 2.39 2.40 2.42 2.46 0.033 2.42 1.35
18986 1.98 1.99 2.01 1.99 0.014 1.99 0.72
18987 2.33 2.35 2.37 2.33 0.017 2.34 0.73
18988 1.57 1.59 1.59 1.58 0.011 1.58 0.68
18989 1.46 1.49 1.48 1.47 0.013 1.48 0.88
19001 3.56 3.60 3.58 3.53 0.030 3.57 0.84
19002 2.78 2.80 2.80 2.77 0.015 2.79 0.54
19003 4.64 4.60 4.66 4.65 0.026 4.64 0.57
19004 1.68 1.70 1.70 1.66 0.019 1.69 1.14
19005 5.26 5.26 5.28 5.30 0.019 5.28 0.36
18786 6.47 6.49 6.50 6.45 0.023 6.48 0.35
18787 4.51 4.50 4.55 4.51 0.020 4.52 0.44
18788 3.54 3.55 3.58 3.54 0.017 3.55 0.47
18789 5.84 5.80 5.88 5.85 0.031 5.84 0.53
18790 4.87 4.80 4.91 4.88 0.045 4.86 0.92
18791 9.93 9.90 9.96 9.93 0.025 9.93 0.25
Fuente LAD
63

d) Análisis realizados por el elemento Ag en cuatro Laboratorios
diferentes para determinar la reproducibilidad
Tabla Nº 18
Código Elementos
de
Oz/Tm
Ag
Oz/Tm
Ag
Oz/Tm
Ag
Oz/Tm
Ag SD X RSD
Muestra LAD AHL JR SGS
19013 6.56 6.52 6.60 6.56 0.033 6.56 0.50
19014 9.07 9.05 9.12 9.07 0.030 9.08 0.33
19015 0.64 0.65 0.71 0.65 0.031 0.66 4.68
19016 9.39 9.40 9.46 9.39 0.032 9.41 0.34
19017 1.80 1.82 1.77 1.80 0.020 1.80 1.12
18986 1.74 1.75 1.78 1.74 0.022 1.75 1.27
18987 1.41 1.41 1.45 1.42 0.020 1.42 1.41
18988 14.72 14.72 14.76 14.73 0.020 14.73 0.14
18989 12.60 12.59 12.64 12.61 0.020 12.61 0.16
19001 1.35 1.34 1.31 1.36 0.022 1.34 1.64
19002 1.93 1.94 1.90 1.94 0.019 1.93 0.98
19003 1.09 1.15 1.09 1.11 0.028 1.11 2.54
19004 0.90 0.96 0.90 0.91 0.029 0.92 3.19
19005 1.41 1.38 1.43 1.43 0.024 1.41 1.70
18786 3.73 3.70 3.75 3.74 0.022 3.73 0.60
18787 1.54 1.56 1.59 1.56 0.019 1.56 1.21
18788 1.80 1.82 1.85 1.81 0.019 1.82 1.07
18789 12.92 12.95 12.97 12.94 0.021 12.95 0.16
18790 11.00 11.01 11.04 11.01 0.018 11.01 0.17
18791 1.74 1.78 1.79 1.75 0.027 1.76 1.53
Fuente LAD
Observando los cuadros 15, 16, 17 y 18 para la determinación de la
Desviación Estándar Relativa , para los 4 elementos en análisis entre los laboratorios
en examen tenemos en promedio valores que no superan el 5% (valor recomendado
para la Desviación Estándar Relativa en muestras geoquímicas), llegando a determinar
que el método propuesto es válido.
64

4.2.2 DETERMINACION EN EL CONTROL DE CALIDAD
INTERNO
Nos referimos a los controles que llevamos en la actualidad
dentro de nuestro laboratorio, como en la implementación de
formatos en las lecturas tanto en muestras de Geología, Planta
Concentradora, Despachos, Pruebas Metalúrgicas.
En estos formatos (ver Anexo 5) se pueden observar la
duplicidad que se realiza en las muestras como la precisión en los
resultados de los patrones certificados por otros laboratorios.
En este ejemplo se puede observar lo siguiente:
Que nuestros patrones están dentro del porcentajes de error
que es de +/- 5%.
De igual manera en nuestros duplicados que se realiza cada 10
muestras, dándonos datos confiables para posteriormente realizar una
evaluación y resultados de muy buena calidad.
65

CONCLUSIONES
1. Se implemento el nuevo método de ensayo para la determinación de Cu, Pb, Zn,
Ag, Fe, As, Bi, Sb en muestras geoquímicas por Espectrofotometría de
Absorción Atómica
2. Se logro disminuir el consumo de los insumos químicos de 23 litros de HCl a 17
litros y de 46 litros de HNO3 a 6 litros para los 2276 ensayes.
3. Actualmente se esta realizando 3367 ensayes al mes incrementándose en un 47%
la capacidad de determinaciones en el tiempo empleado, de 1840 horas
hombre por las 2276 ensayes a 436 horas hombre, lo que significa un empleo de
1404 horas hombre menos.
4. Se logro reducir el tiempo de resultados de 194 min. a 46 min. en la etapa de
análisis (pesaje, ataque, resultado) y costos en el consumo de reactivos de
$480.7 con el método anterior a $176.1 con el método propuesto, lo que
significa una disminución del 63 % en términos de costos en insumos químicos
del HCl y HNO3.
5. Los valores obtenidos después del tratamiento de datos cumplen con los
requisitos, dándonos valores menores de 5% RSD (valor máximo para muestras
geoquímicas) entre los Laboratorios en examen.

RECOMENDACIONES
1. Este Método es aplicable para muestras geoquímicas tales como: Sulfuros,
sulfatos, óxidos, carbonatos.
2. El método se ajusta para realizar un solo tipo de dilución para cualquier tipo de
muestra geoquímica.
3. El método planteado fue exclusivamente para Absorción Atómica y el Método
por Volumetría debe ser aplicable solamente para muestras de Concentrados.
4. Los valores de RDS no deben pasar de 5%, ya que este valor es el máximo
considerado para muestras geoquímicas.
5. Para realizar una curva de calibración o linealidad, matemáticamente el número
de mediciones mínimo debe ser por lo menos 3, ya que si realizamos solamente
2 siempre será una recta. Pero en realidad la cantidad de mediciones que
debemos realizar para hacer una curva tiene que ser en lo posible mayor o igual
a 5.
6. La curva debe prepararse a partir de una solución madre de alta concentración
para realizar las distintas mediciones por dilución directa.

BIBLIOGRAFIA
1. ARTUR L. VOGEL. QUIMICA ANALITICA CUANTITATIVA. Editorial
Kapelusz SA
2. J.C. VAN LOON, R.R. BAREVFOOT, Analytical Methods for Geochemical
Exploration, Academic Press, INC San Diego California, 1989.
3. KOLTHOFF SANDELL.- QYUMICA ANALITICA CUANTITATIVA.
Editorial MARIN S.A
4. LEICEBTER F. HAMILTON, S.B. “Cálculos De Química”
5. R.A UNDERWOOD . QUIMICA ANALITTICA CUANTITATIVA editorial
Prentice Hall México 1989.
6. STEPHEN G. SIMPSON, Ph Analítica”. Octava Edición. Editorial Mc Graw –
Hill. Mexico 1989.
7. TECSUP. Curso teórico practico de “Análisis de minerales por
Espectrofotometría de Absorción Atómica” Lima -2006.

ANEXO Nº 1 DIAGRAMA DE FLUJO DE VOLUMETRIA DE COBRE POR IODOMETRIA.
Muestra
Pesado: 0.2500 gr.. Introducir al matraz de 100 ml.
Adición de HCLO4 cc. 4ml Ataque en la plancha eléctrica hasta obtener pastoso
Retira de la Plancha: Agregar gotas de NH4OH cc. Para precipitar el Fe hasta color
marrón.
En Frió: Agregar agitando Acido Acetico: 10 ml al 50%, NH4F 0.25
gr., KI 10 ml al 25%
Titulación: Con Na2S2O3 al 0.025 N y como indicador 10 ml de
almidón y gotas de AgNO3 al 10%
Preparación de Reactivos:Acido Acético: 250 ml/250ml
Yoduro de Potasio: 250 gr./1000ml
Preparación del Titulante:Na2S2O3 6.3gr./1000ml.Preparación de Indicador:
Almidón 5 gr./1000 ml.AgNO3 10 gr./100 ml
¿Esta dentro del rango de
Ley?
NO
SI

ANEXO Nº 2 DIAGRAMA DE FLUJO DE VOLUMETRIA DE PLOMO POR COMPLEXOMETRIA
Muestra
1er Paso: Agregar 10 ml de HNO3 cc, luego llevar a la plancha eléctrica hasta desprendimiento de gases nitrosos,
retirar y enfriar
2do Paso: Agregar 10 ml de H2SO4 y someter a la plancha eléctrica hasta sequedad desprendimiento de vapores blanco
(SO2) por 35 a 40 min.
Retirar y Enfriar: Adicionarle Agua desionizada 50 ml. Y volver a calentar hasta hervir por 10min.
Retirar y Enfriar: Por espacio de 60 min. En reposo para que precipite el PbSO4 (ppdo. blanco).
Filtrar y Lavar: Filtrar el ppdo. Blanco en papel filtro nº 42 mínimo de 6 a 8 veces con agua desionizada.
Precipitado: Se trasvasa al vaso original y se adiciona 30 ml. de Solución Extractiva, luego se llevar a hervir.
¿Esta dentro del rango de
Ley?
Titulación: Con EDTA y como indicador el Xilenol, 3 a 4 gotas hasta el cambio (viraje de grosella a amarillo patito).
NO
SI

ANEXO Nº 3 DIAGRAMA DE FLUJO DE VOLUMETRIA DE ZINCMuestra
Pesado: 0.2500 gr. Recibir en vaso de 400 ml.
1er Paso: Agregar 10 ml de HNO3 cc. Poner a la plancha eléctrica hasta desprendimiento de vapores nitrosos; adicionar una pizca de Clorato de Potasio y llevar a sequedad.
2do Paso: Agregar 5 ml de HCl, retomar la muestra con agua desionizada hasta un volumen de 75 ml; llevar a la plancha para reducir hasta 50 ml.
A la soluc. resultante agregar 1 ml de Peroxido de Hidrogeno y 40 ml de Soluc. Extractiva para Zn.
Llevar la solución a ebullición de 10 min a 15 mi.
Filtrar: Separar el Fe (ppdo.) de la solución en vaso de 600 ml papel filtro nº 41 y lavar con agua caliente en medio amoniacal, hasta un volumen de 200 ml; luego con agua caliente hasta un
volumen de 250 ml
Solución: Adicionar 3 a 4 gotas de Azul de Bromotimol, luego dosificar HCl al 50% hasta cambio de color (de azul a amarillo brillante); añadir 5 gotas en exceso. Adicionar 40 ml de Solución Buffer.
Titilación; Con EDTA (.05M) y como indicador Xilenol de 3 a 4 gotas hasta viraje.
¿Esta dentro del rango de
Ley?
NO
SI

ANEXO Nº 4 DIAGRAMA DE FLUJO DE CALIBRACION DEL EAA
Limpiar y lavar el sistema de nebulizador y el quemador
Encendido de la comprensora de aire, Extractor de Gases y Acetileno
Colocar la lámpara de Cu y Amperaje
Optimizar el flujo del nebulizador hasta obtener la mayor absorbancia y regular la perilla
Equipo calibrado
IPER, CHECK List de equipos
Alinear cabezal y encender la llama (Aire - Acetileno)
Colocar el capilar en la soluc.
Estándar de 5 ppm Cu
Lectura
¿Encendido del EAA?
¿Se tiene absorbancia aceptable de 5 ppmncendido del EAA?
NO
NO
SI
SI

REPORTE GEOLOGIA (EVALUACION)
FECHA:
13/02/2009
Responsables:JAM / RMC
ITEM Codigo de muestra
Elementos
Cu %Pb % Zn %
Ag Oz/TM
1 21959 0,66 0,67 2,79 3,282 21960 0,53 0,75 3,15 2,96 SAMPLE Cu Pb Zn Ag
3 21961 0,84 2,03 15,99 6,82 10 0,14 0,63 4,07 1,29
4 21962 0,57 0,67 4,29 3,28 37 0,13 0,61 4,02 1,29
5 21963 0,52 0,66 3,28 2,38PROMEDI
O 0,14 0,62 4,04 1,296 21964 0,46 0,34 2,25 1,61
7 22069 0,06 3,31 11,03 1,16 SAMPLE Cu Pb Zn Ag
8 22070 0,07 1,77 4,64 1,03 20 1,54 0,2010,2
4 6,30
9 22071 0,18 1,18 7,98 1,80 38 1,50 0,1910,0
8 6,24
10 22072 0,14 0,63 4,07 1,29PROMEDI
O 1,52 0,1910,1
6 6,2711 22073 0,29 0,60 2,43 3,5412 22074 0,27 0,26 4,42 1,74 SAMPLE Cu Pb Zn Ag13 22075 0,33 0,42 5,41 2,12 30 0,77 0,13 1,73 1,6114 22076 0,32 0,23 3,43 1,93 39 0,78 0,13 1,89 1,61
15 22077 0,06 2,76 1,94 0,64PROMEDI
O 0,78 0,13 1,81 1,6116 22078 0,41 0,06 0,20 0,0617 22079 0,15 1,17 3,94 2,83 SAMPLE Cu Pb Zn Ag18 22080 0,21 0,18 1,40 0,71 40 0,00 0,00 0,00 0,00
19 22129 1,73 0,22 12,38 11,19 0
#N/A
#N/A #N/A
#N/A
20 22130 1,54 0,20 10,24 6,30
PROMEDIO
#N/A
#N/A #N/A
#N/A
21 22131 2,67 0,81 11,89 9,58
22 22132 2,57 0,72 10,09 9,00 SAMPLE Cu Pb Zn Ag
23 22133 7,02 1,89 4,62 43,15 50 0,00 0,00 0,00 0,00
24 22134 0,30 0,07 0,52 0,71 0#N/A
#N/A #N/A
#N/A
25 22135 1,71 0,43 6,17 5,08PROMEDI
O#N/A
#N/A #N/A
#N/A
26 22136 1,35 0,34 4,94 3,3427 22137 1,06 0,27 1,41 2,31 SAMPLE Cu Pb Zn Ag28 22138 1,16 0,31 1,55 2,89 60 0,00 0,00 0,00 0,00
29 22139 0,94 0,15 1,77 2,06 0#N/A
#N/A #N/A
#N/A
30 22140 0,77 0,13 1,73 1,61PROMEDI
O#N/A
#N/A #N/A
#N/A
31 22141 1,18 0,34 0,98 3,0232 22142 1,36 0,45 1,40 3,73 SAMPLE Cu Pb Zn Ag33 22143 6,13 1,61 4,24 41,73 70 0,00 0,00 0,00 0,00
34 22144 0,20 0,04 0,24 0,39 0#N/A
#N/A #N/A
#N/A
35 22145 1,09 0,25 2,42 2,64PROMEDI
O#N/A
#N/A #N/A
#N/A
36 22146 0,99 0,28 2,46 2,5137 D10 0,13 0,61 4,02 1,29

38 D20 1,50 0,19 10,08 6,24 SAMPLE Cu Pb Zn Ag
39 D30 0,78 0,13 1,89 1,61 # BK CH#N/A
#N/A #N/A
#N/A

ANEXO Nº 6 EQUIPO DE ESPECTROFOTOMETRIA DE ABSORCIÓN ATÓMICA MODELO TRHERMO S SERIES Y VARIAN
AA240

ANEXO Nº 7 CHANCADORAS
ANTES DE LA IMPLEMENTACION DESPUÉS DE LA IMPLEMENTACION (TIPO RHINO)

ANEXO Nº 8 PULVERIZADORAS
ANTES DE LA IMPLEMENTACION DESPUÉS DE LA IMPLEMENTACION

ANEXO Nº 9 IMPLEMENTACION DE EQUIPOS
FILTROS A PRESION PARA LA PREPARACION DE
MUESTRAS EN PULPA.
HORNO DE SECADO PARA MUESTRAS GEOQUIMICAS

ANEXO Nº 10 INSPECCION EN PLANTA CONCENTRADORA CIA AUTRIA DUVAZ SAC.

ANEXO Nº 11 CERTIFICACIONES DE ENSAYES Y CALIBRACIÓN DE EAA













![Determinacion de Pb en Sangre Usando Espectrofotometria de Absorcion Atomica[1]](https://static.fdocuments.ec/doc/165x107/55cf9c90550346d033aa4152/determinacion-de-pb-en-sangre-usando-espectrofotometria-de-absorcion-atomica1.jpg)