termo03 sustancia pura.pdf
-
Upload
michael-orihuela-barreto -
Category
Documents
-
view
71 -
download
1
description
Transcript of termo03 sustancia pura.pdf

Termodinámica
Sustancia pura
Profesor: Freddy J. Rojas, M.Sc.

Sustancia Pura
H2O
Freddy J. Rojas, M.Sc. 2

Freddy J. Rojas, M.Sc. 3
Caldera de vapor

Freddy J. Rojas, M.Sc. 4
Caldera de vaporVapor

Sustancia pura
Sustancia que tiene una composición
química fija.
Agua (H2O)
Nitrógeno (N2)
Helio (He)
Dióxido de carbono (CO2)
Aire (N2, O2, CO2, Ar, …)
Freddy J. Rojas, M.Sc. 7

Freddy J. Rojas, M.Sc. 8
Sustancia pura
Vapor
Líquido
Vapor
Líquido
H2OAire

Freddy J. Rojas, M.Sc. 9
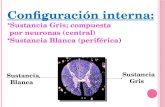
Fases de una sustancia pura
Sólido
Líquido
Gaseoso

Freddy J. Rojas, M.Sc. 10
H2O: (1-2): Calor sensible
P = 1 atm
T = 27 °C
Peso = 0 kg
P = 1 atm
Pistón
H2O
P = 1 atm
T = 100 °C
Peso = 0 kg
P = 1 atm
1 2Líquido
Saturado
Líquido
comprimido

Freddy J. Rojas, M.Sc. 11
H2O: (2-4): Calor latente
Líquido saturado
P = 1 atm
T = 100 °C
Peso = 0 kg
P = 1 atm
Mezcla saturada
Líquido – Vapor
(Vapor húmedo)
P = 1 atm
T = 100 °C
Peso = 0 kg
P = 1 atm
Vapor saturado
T = 100 °C
Vapor
Saturado3 4

Freddy J. Rojas, M.Sc. 12
H2O: (4-5): Calor sensible
P = 1 atm
T = 300 °C
Peso = 0 kg
P = 1 atm
5

Freddy J. Rojas, M.Sc. 13
Propiedades de saturación, H2O
27
100
300

Freddy J. Rojas, M.Sc. 14
Propiedades de saturación, H2O
27
100
300
Campana de Andrews
Vapor
sobrecalentado
Línea de vapor
saturado
Línea de
Líquido
saturado
Mezcla saturada
Líquido-vapor
(Vapor húmedo)

Freddy J. Rojas, M.Sc. 15
Temperatura de saturación y
presión de saturación
La temperatura a la cual comienza a hervir el
agua depende de la presión.
A una determinada presión, la temperatura a
la que una sustancia pura cambia de fase se
llama temperatura de saturación, Tsat
A una temperatura determinada, la presión a
la que una sustancia pura cambia de fase se
llama presión de saturación, Psat

Freddy J. Rojas, M.Sc. 16
Diagrama T-v, H2O (líquido-vapor)
T °C
170,41
100,00
237,33Vapor
sobrecalentado
Punto crítico
Línea de vapor
saturado
Línea de
Líquido
saturadoP = 22,09 MPa374,14
Mezcla saturada
Líquido-vapor
(Vapor húmedo)

Freddy J. Rojas, M.Sc. 17
Diagrama P-v, H2O (líquido-vapor)

Diagrama P-T o Diagrama de fases
Freddy J. Rojas, M.Sc. 18

Freddy J. Rojas, M.Sc. 19
Superficie P-v-T
sólido
Só
lid
o-l
íqu
ido
líq
uid
o
vapor
Sólido-vapor
Líquido-vapor

Freddy J. Rojas, M.Sc. 20
Superficie P-v-T (vistas)

Sustancia que se expande al congelarse: H2O
Freddy J. Rojas, M.Sc. 21
(a) (b)

Freddy J. Rojas, M.Sc. 22
(a) Diagrama P-T o Diagrama de fases: H2O
P
T
Sólido
Líquido
vaporPunto triple
Punto crítico

Freddy J. Rojas, M.Sc. 23
(b) Diagrama P-v, H2O (sólido-líquido-vapor)
VAPOR
LÍQUIDO+VAPOR
Línea triple
SÓLIDO+VAPOR
SÓ
LID
O
LÍQ
UID
O
Punto críticoP
v

Sustancia que se comprime al congelarse
Freddy J. Rojas, M.Sc. 24
(a) (b)

Freddy J. Rojas, M.Sc. 25
(a) Diagrama P-T o Diagrama de fases
P
T
SólidoLíquido
vaporPunto triple
Punto crítico

Freddy J. Rojas, M.Sc. 26
(b) Diagrama P-v (sólido-líquido-vapor)
VAPOR
LÍQUIDO+VAPOR
Línea triple
SÓLIDO+VAPOR
SÓ
LID
O
SÓ
LID
O+
LÍQ
UID
O
LÍQ
UID
O
Punto críticoP
v

Freddy J. Rojas, M.Sc. 28
Ejemplo
Decir en que fase se encuentra (H2O)?
P=?
T=150 °C
1 kg
28 kg
1 kg
28 kg
r = 10 cm

Freddy J. Rojas, M.Sc. 29
Equilibrio sólido-líquido-vapor
Es importante advertir que se necesita
dos propiedades intensivas
independientes para determinar el
estado de una sustancia pura.

Freddy J. Rojas, M.Sc. 30
Tablas de propiedades termodinámicas

Freddy J. Rojas, M.Sc. 31
Entalpía
En la generación de potencia y en
refrigeración:
u + Pv
h = u + Pv (kJ/kg)
H = U + PV (kJ)

Freddy J. Rojas, M.Sc. 32
Estados de líquido saturado y de
vapor saturado
Temp
°C
T
Pres.
Sat.
kPa
Psat
Volumen específico
m3/kg
Líquido
Sat.
vf
Vapor
Sat.
vg
85 57,83 0,001033 2,828
90 70,14 0,001036 2,361
95 84,55 0,001040 1,982
vf = volumen específico del líquido saturado
vg = volumen específico del vapor saturado
vfg = vg - vf

Freddy J. Rojas, M.Sc. 33
Vapor Saturado
Donde:
h = [kJ/kg]
v = [m3/kg]
u = [kJ/kg]
s = [kJ/kg.K]
fgfg
fgfg
fgfg
fgfg
sss
uuu
vvv
hhh

Freddy J. Rojas, M.Sc. 34
Mezcla saturada de líquido-vapor
gf
g
total
vapor
mm
mx
m
mx
Calidad, x
Su valor solo está entre 0 y 1

Freddy J. Rojas, M.Sc. 35
Calidad
Vg
Vapor saturado
Vf
Líquido saturado
Vprom
Mezcla saturada
líquido-vapor
Supongamos que tenemos un recipiente de H2O en
mezcla:

Freddy J. Rojas, M.Sc. 36
Calidad
AC
ABx
P o T
v
vfg
vprom-vf
A B C
fg
fprom
v
vvx
vf vprom vg

Freddy J. Rojas, M.Sc. 37
Mezcla saturada de líquido-vapor
xy 1
Humedad, y
Su valor solo está entre 0 y 1

Freddy J. Rojas, M.Sc. 38
Aproximación de líquido comprimido
como líquido saturado
Determine la energía
interna del agua líquida
comprimida a 80 °C y 5
MPa (abs).
%34,010072,333
72,33386,334
:
86,334
:
82,333
:
80@
Error
kg
kJuu
oAproximand
kg
kJu
Tablas
Cf
80
Real (tablas) Aproximado (líquido saturado)
T, [°C]
u, [kJ/kg]

Procesos en sustancia pura

Ejemplo:
Freddy J. Rojas, M.Sc. 40
1
2
3T, °C
v
4
1-2: isocórico
2-3: isobárico
3-4: PVn , (PV)
4-5: isotérmico
5

Freddy J. Rojas, M.Sc. 41
Problema 1 (Estado)
Un recipiente rígido
contiene 50 kg de
agua líquida
saturada a 90 °C.
Determinar:
La presión en el
recipiente, en kPa
Volumen del mismo,
en m3
3
90@
0518,0
183,70
mV
kPaPPsat

Freddy J. Rojas, M.Sc. 42
Problema 2 (Estado)
Calcular la entalpía y el volumen
específico de vapor que se encuentra a
200 kPa absolutos y 300 °C.
kg
mv
kg
kJh
VSC
3
3162,1
8,3071

Freddy J. Rojas, M.Sc. 43
Problema 3 (Estado)
Considerando el vapor a una presión de
200 kPa absolutos y con una energía
interna de 2966,7 kJ/kg. Determinar la
entalpía, la temperatura y el volumen
específico.
CT
kg
mv
kg
kJh
VSC
400
5493,1
6,3276
3

Freddy J. Rojas, M.Sc. 44
Problema 4 (Estado)
Considerando el agua a 10 MPa
absolutos y 60 °C, se desea calcular su
entalpía y su volumen específico en
estas condiciones.
kg
mv
kg
kJh
LC
3
001013,0
49,259

Freddy J. Rojas, M.Sc. 45
Problema 5 (Estado)
Un recipiente rígido contiene 10 kg de agua a
90 °C. Si 8 kg del agua están en forma
líquida y el resto como vapor, determine:
La presión en el recipiente, en kPa
El volumen del recipiente, en m3
3
90@
73,4
183,70
mV
kPaPPCsat

Freddy J. Rojas, M.Sc. 46
Problema 6 (Estado)
En un recipiente se tiene amoniaco a
una presión de 250 kPa absolutos y
una temperatura de 30 °C. ¿qué
cantidad de sustancia (kg) se encuentra
en el recipiente de 0,5 m3?
kgv
Vm
kg
mv
865,05780,0
5,0
5780,0
3

Freddy J. Rojas, M.Sc. 47
Problema 7 (Estado)
Se utiliza R12 en un sistema de refrigeración.
En una etapa del proceso sale gas caliente
del compresor a 1,0 MPa absolutos y 70 °C.
Determinar la velocidad en un tubo de 2,5 cm
de diámetro, si el flujo es de 3 kg/min.
s
mmc
A
mvc
v
Acm
kg
mv
o
o
07,2min
6,124
4
)025,0(
)020397,0)(0,3(
020397,0
2
3

Freddy J. Rojas, M.Sc. 48
Problema 8 (Estado)
Un recipiente de 80 L
contiene 4 kg de
refrigerante 134a a una
presión de 160 kPa.
Determine:
La temperatura, en °C
La calidad
La entalpía del
refrigerante, en kJ/kg
El volumen que ocupa la
fase vapor, en m3
30775,0
2,64
157,0
60,15160@
mV
kg
kJhh
x
CTT
g
prom
kPasat

Freddy J. Rojas, M.Sc. 49
Problema 9 (Estado)
Calcular la entalpía y el volumen
específico de vapor a 250 kPa
absolutos y con 50% de calidad en una
mezcla líquido-vapor.

Freddy J. Rojas, M.Sc. 50
Problema 10 (Proceso)
En un sistema cilindro-
pistón, una masa de
200 gr de agua líquida
saturada se evapora
por completo a una
presión constante de
100 kPa. Determine:
Cambio de volumen, en
m3
Cantidad de energía
transferida al agua, en kJ
kJH
mV
5,451
3386,03

Freddy J. Rojas, M.Sc. 51
Problema 11 (Procesos)
Si el vapor de agua está inicialmente a 3 MPa absolutos y 300°C en un dispositivo cilindro-pistón. Sigue los siguientes procesos:
El agua se enfría a volumen constante hasta que la temperatura alcanza 200°C,
Siendo comprimida a continuación isotérmicamente hasta un estado en el que la presión es 2,5 MPa absolutos.
a) Localizar los puntos en los diagramas T-v y P-v
b) Determinar los volúmenes específicos en los tres puntos y la calidad del estado 2.
kg
mv
kg
mvv
kg
mv
3
3
3
12
3
1
001157,0
0811,0
0811,0