TEMA 7: LA MORFOLOGÍA CELULAR(I) MEMBRANA PLASMÁTICA CITOSOL CITOESQUELETO.
Tema 6 El Citoesqueleto
Transcript of Tema 6 El Citoesqueleto
UNIVERSIDAD DE OVIEDO EL CITOESQUELETO Y ESTRUCTURAS RELACIONADAS
Tema 6. El citoesqueleto.
Se denomina citoesqueleto al conjunto de filamentos proteicos situados en el citoplasma, que constituyen estructuras reticulares o no, más o menos complejas y contribuyen a la morfología celular, organización interna de los orgánulos citoplásmicos y movimiento celular. Pese a la idea de estabilidad que conlleva el uso del término “esqueleto”, es necesario indicar que el citoesqueleto es una estructura inmersa en un equilibrio dinámico, cuyos componentes están sometidos a continuo recambio y a ciclos de polimerización.
1, Microfilamentos: la actina es su principal componente. Hay diferentes isoformas de actinas que se agrupan en tres clases: La clase I, incluye las actinas β y γ no musculares y la actina γ de músculo liso.La clase II, incluye las actinas α del músculo cardiaco, esquelético y del músculo liso vascular.La clase III, incluye tipos de actinas de levaduras, invertebrados, etc.
Formas estructurales de la actina: Actina F, filamento de 6-8 nm de diámetro, dos hebras globulares enrolladas en doble hélice, también se denomina actina polimerizada. Ocurre con aumento de Mg2+, Ca2+ y ATP. Polarización: extremo (-) y extremo (+)Actina G, actina globular o actina monomérica, pues es una proteína globular, piriforme, con un surco donde se une el ATP. Tiene polaridad.
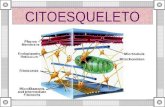
El citoesqueleto está constituido por: microfilamentos o filamentos de actina; filamentos intermedios; y microtúbulos
EL CITOESQUELETO Y ESTRUCTURAS RELACIONADAS
Polimerización de actina G en actina F. Crecimiento en el extremo +, disminución en el extremo -, gasto de ATP
EL CITOESQUELETO Y ESTRUCTURAS RELACIONADAS
Proteínas asociadas a la actina: Casi un centenar, con funciones muy diversas:
-Proteínas estructurales: formadoras de haces (α-actinina, fimbrina) y formadoras de redes (filamina)-Proteínas reguladoras: motoras y no motoras.
. Proteínas reguladoras motoras:
. La miosina: permite el deslizamiento de los microfilamentos de actina unos sobre otros. Hidrolizan ATP. Miosina II: Cada molécula esta constituía por 6 cadenas polipeptídicas, dos pesadas idénticas y cuatro ligeras. Cada cadena pesada tiene una zona globular en su extremo. Miosina I: sólo una cabeza, cola más corta y variable, puede tener una o mas cadenas ligeras asociadas.La miosina II está implicada en la contracción muscular y en la citocinesis. La miosina I, en locomoción celular, fagocitosis y movimientos de orgánulos. Aunque no son motoras pero si asociadas al movimiento celular se deben incluir aquí las proteínas: tropomiosina que se une a actina y junto a la troponina que median el control del calcio sobre la contracción muscular.
Proteínas reguladoras no motoras: es el grupo mas variado y abundante. Se pueden dividir en:-Proteínas que secuestran monómeros: destacan la profilina y las timosinas, que al unirse a monómeros de actina impiden su polimerización-Proteínas de encapuchamiento (capping). Bloquean extremos de actina F, impidiendo su despolimerización-Proteínas de fragmentación. Al unirse a actina F lo cortan y lo encapuchan, reduciendo su longitud, p.e. gelsolina.
miosina I
miosina II
Proteínas asociadas a los microfilamentosEl citoesqueleto
Acción de la gelsolina en el corte de filamentos de actina
Acción de la filamina en la formación de redes de actina
EL CITOESQUELETO Y ESTRUCTURAS RELACIONADAS
Microvellosidades:Son repliegues digitiformes de la membrana que se
localizan en la superficie apical de algunos epitelios, para el incremento de superficie y función de absorción.
El extremo + de los filamentos de actina en las microvellosidades, se encuentran recubiertos por
una proteína (proteína de capuchón o de casquete)
Están organizadas en haces de microfilamentos (MF) de actina, no de MT.
Los MF están empaquetados por efecto de villina y fimbrina y se unen a la membrana a través de miosina I.
El extremo (+) de los MF se introduce en la estructura proteica que ocupa el extremo de la microvellosidad
Imagen a MO de estereocilios en el epitelio del epidídimo. Van Gieson
¿Qué diferencias hay entre el cinocilio y el estereocilio?
EL CITOESQUELETO Y ESTRUCTURAS RELACIONADAS
Imagen superior:
inmuno para filamentos de actina (rojo).
En la inferior: inmuno para
miosina II (verde).
Interacción miosina II-actina en el
anillo contráctil durante la división celular
Imagen a MEB y MET de una célula al final de telofase. Se aprecia en el centro el anillo contráctilAnillo contráctil de la citocinesis:
UNIVERSIDAD DE OVIEDO EL CITOESQUELETO Y ESTRUCTURAS RELACIONADAS
2, Filamentos intermedios (FI): Son filamentos proteícos de 10 nm aproximado de diámetro, intermedio entre los microfilamentos y los microtúbulos. Son muy heterogéneos, estables e insolubles, no necesitan ATP ni GTP para polimerizar.
Tipos de filamentos intermedios:
Tipo I. Queratinas acidas (10 subtipos). Tipo II. Queratinas básicas y neutras (10 subtipos). El filamento intermedio de queratina es un heteropolímero en el que participan del tipo I y del tipo II. Tipo III. Con 4 subtipos: vimentina, desmina, GFAP y periferina. El último se encuentra en neuronas del sistema nervioso periférico. Tipo IV. Incluye a los neurofilamentos, son heteropolímeros.Tipo V. De la lámina nuclear heteropolímeros de lámina A, B y C. Se encuentran en la parte interna de la membrana nuclear.
Otros tipos de filamentos intermedios. Por sus peculiaridades estructurales no se incluyen en los tipos anteriores, p.e. la nestina, se presenta en algunos tejidos durante el desarrollo embrionario
Funciones: Proporcionan estabilidad mecánica a las células. Estabilizan los complejos de ADN en la membrana nuclear. Mantienen algunos sistemas de anclaje (desmosomas y hemidesmosomas)
Filamentos intermediosEl citoesqueleto
Imagen de M.E.T. de una pequeña gota lipídica rodeada de filamentos de vimentina.
Extraído de Alberts y cols. Biología Molecular de la Célula. 4ª edición (2004).
El citoesqueleto Filamentos intermedios
Estructura y polimerizaciónMonómero-dímero-tetrámero- protofilamento (2 tetrámeros )- filamento intermedio (8 tetrámeros o 16 dímeros)
El citoesqueleto Filamentos intermedios
Extraídos de Alberts y cols. Biología Molecular de la Célula. 3ª edición (1996).
UNIVERSIDAD DE OVIEDO EL CITOESQUELETO Y ESTRUCTURAS RELACIONADAS
3, Microtúbulos (MT): Pueden aparecer dispersos por la célula o formando estructuras como centriolos, cilios y flagelos. Dinámicos, participan en la forma celular, locomoción, transporte de orgánulos y separación de cromosomas en la mitosis
Estructura:Son cilindros huecos de diámetro de 25 nm y longitud variable. En sección transversal aparece formado por 13 subunidades, la asociación longitudinal de estas subunidades genera los protofilamentos. El MT es una estructura polarizada, posee un extremo (+) y otro (-) en función de su capacidad de crecimiento.Tubulinas: esta proteína globular se asocia en el MT como heterodímeros (α – tubulina y β- tubulina). Hay un tercer tipo la γ- tubulina, específicamente localizada en el centrosoma y que no forma parte del MT. Tanto la α – tubulina y β- tubulina son capaces de unirse a GTP en los dímeros que se asocian al extremo (+).Hay varios genes que codifican para cada una de las tubulinas.
Proteínas asociadas a los MT( las MAPs). Se pueden clasificar en estructurales y dinámicas o motoras
MAPs estructurales: Dos tipos: las de alto peso molecular (HMW) como las MAP1A, MAP1B, MAP2, MAP3 y MAP4 y las proteínas Tau. Estabilizan la estructura del MT y ayudan a su polimerización.
MAPs dinámicas o motoras: Dos tipos: quinesinas y dineínas, ambas son ATPasas. La quinesina es reponsable del transporte anterógrado, hacia el extremo (+) en el axón y la dineína del retrogrado, hacia el extremo (-), transportando vesículas u orgánulos con gasto de ATP.
MicrotúbulosEl citoesqueleto
1-protofilamento2-lámina
3-alargamiento
Polimerización y organización del MT