Separación de Sólidos de Líquidos
-
Upload
k-rito-cuenca -
Category
Documents
-
view
22 -
download
7
description
Transcript of Separación de Sólidos de Líquidos
Integrantes: Gianella Cuenca Fabian CarrionKarol Hernandez Viviana Barriga
Fecha: 24/10/14
SEPARACIN DE SLIDOS DE LQUIDOS
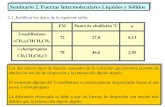
RESUMENEsta prctica en el laboratorio de qumica se la realiz con la finalidad de observar las diferentes caractersticas fsicas de los compuestos que usamos, ya que al tener las mezclas de slidos con lquidos se puede utilizar diferentes mtodos para la separacin, pero en nuestro caso lo que se emple fue la filtracin.Los objetivos de la prctica realizada son los siguientes: Establecer la metodologa para separar slidos de lquidos Cuantificar la concentracin de precipitado obtenido en el desarrollo de la prcticaLa prctica se bas en utilizar una disolucin, utilizando Nitrato de Plata (AgNO3) y Cloruro de Sodio disueltos en agua destilada, como indicador utilizamos el Cromato de Potasio (K2CrO4). En nuestro caso utilizamos 2 muestras, la primera con exceso de AgNO3 y por ende el color de nuestra mezcla fue ms roja, y la otra con un valor normal de los mismos, que se torn el rojo ladrillo esperado.Para el procedimiento colocamos las mezclas en la bureta hasta que se forme un precipitado. Esperamos un momento y procedemos a filtrar la mezcla con un embudo de filtracin y papel filtro. Lo que se filtra, el lquido (NaNO3) lo dejamos en un vaso de precipitacin, el slido (AgCl) lo dejamos reposar por aproximadamente 5 horas y al estar seco lo pesamos. Los clculos del peso se los realiza de la siguiente manera:PESO TOTAL DEL SLIDO: PESO DEL SLIDO CON PAPEL FILTRO PESO DEL PAPEL FILTRO1. OBSERVACIN: 1.745 g - 0.09g = 1.085g AgCl2. OBSERVACIN: 1.106 g - 0.09g = 1.016g AgClLa reaccin que utilizamos es:AgNO3+NaCl -> NaNO3 + AgCl
INTRODUCCINLa mayora de las sustancias que encontramos en la naturaleza son mezclas y de ellas se obtienen las sustancias puras mediante diferentes mtodos de separacin. Una mezcla es un conjunto de dos o ms componentes diferentes que conservan sus propiedades. Los diferentes mtodos de separacin de mezclas se clasifican en mtodos fsicos y qumicos.En una mezcla se aprovechan las propiedades fsicas de las sustancias que la integran. En el laboratorio es necesario la mayora de las veces trabajar con sustancias puras, para que alguna impureza no interfiera en el experimento planeado, en nuestro caso la separacin de un slido con un lquido. Para lograr una separacin se aprovecha el hecho de que los diversos componentes de una mezcla tienen diferentes propiedades fsicas y qumicas. En la prctica realizada el mtodo que utilizamos fue la filtracin, ya que es el proceso ms fcil para separar las mezclas slido-lquido.Utilizando un indicador como lo es el cromato de potasio, se puede diferenciar los colores que tornan las disoluciones.La prctica fue realizada con mucho cuidado, tomando la precauciones debidas para as no alterar ningn valor de los resultados obtenidos.
METODOLOGA EXPERIMENTALPara separar un slido (AgCl) que ha sido formado a partir de una reaccin entre AgNO3 y NaCl, nos valemos de la filtracin mediante un papel filtro que se encontrara dispuesto en un embudo de vidrio.
Para obtener las solucin de AgNO3 en un vaso de 150 ml pesar 2 gramos de AgNO3 y disolver con agua destilada hasta obtener un volumen de 100ml.
Para la solucin de Nacl pesar 1 gramo del mismo en otro vaso y disolver con agua destilada hasta completar 100ml, luego se toma un volumen de 20 ml se lo coloca en un vaso de 250ml.
Procedemos de la misma manera con 10g de K2CrO4. Tomamos 2 ml de esta solucin y lo agregamos a los 20ml de NaCl. El K2CrO4 servir nicamente como indicador de la reaccin.
Para proceder a titular (previamente colocada la solucin de AgNO3 en una bureta) dejamos caer la solucin de AgNO3 sobre el NaCl con K2CO4. Al agitar esta mezcla se formara un slido (AgCl) y observaremos un color rojo ladrillo.
Filtramos usando un embudo de filtracin con papel filtro y colocando el embudo sobre el matraz donde el lquido atraviesa el papel filtro y el slido queda retenido en el filtro que se puede secar y luego cuantificar.
RESULTADOS Y DISCUSIN
Con ayuda del K2CO4 se pueden observar los cambios que sufre la solucin al cambiar su color. En primera instancia se pudieron observar alrededor de 3 colores en la etapa de formacin del solido (AgCl) debido a la enrgica adicin del AgNO3.En la primera experiencia de titulacin se obtuvo un color rojo ms intenso que el planeado. Esto se dio por el exceso de AgNO3. Lgicamente con esto deducamos que el NaCl tuvo el papel de reactivo limitante.Figura 1. Adicin de K2CO4 a la sol. de NaCl
Luego, haciendo una segunda experiencia de titulacin con las mismas soluciones claramente observamos la diferencia en comparacin con la primera.La segunda titulacin obtena un color rojo-ladrillo deseado inicialmente. Al tener este color era evidente una cantidad menor de solido formado.Filtrando con papel filtro y luego depositando el slido retenido en papel comn observamos una gran diferencia en el lquido que paso por el filtro. El lquido de la primera titulacin resultaba an bastante rojo a diferencia del lquido de la segunda titulacin el cual presentaba solo la coloracin del indicador. Figura 2. Adicin de AgNO3
Comparacin del lquido separado del solido entre la primera y segunda titulacin
Figura 3. Filtracin muestra 1 1Figura 4. Filtracin muestra 2
Luego de haber depositado el slido retenido sobre un papel por cada titulacin y este haberse secado, se procedi a la cuantificacin del mismo. En este instante es preciso conocer la masa del papel para luego restar esta masa del pesaje del solido con el papel.El papel de la primera muestra no presento mayor coloracin mientras que el correspondiente a la segunda muestra se ti de un rojo oscuro.Peso del papel = 0.09g1. Peso del slido muestra 1 = 1.743g 0.09g = 1.653 g1. Peso del slido muestra 2 = 1.105g 0.09g = 1.015 g Figura 5. Pesaje del solido muestra 1Figura 6. Pesaje del slido muestra 2
CONCLUSIONES General:Llegamos a reconocer los tipos de mezclas entre los componentes incluidos en la prctica y saber separarlos.
Especficos:-Identificamos los mtodos de separacin segn las propiedades de los componentes de la mezcla.-Cuantificar la concentracin de precipitado obtenido en el desarrollo de la prctica.
En el primer proces que realizamos con 2 g de Nitrato de Plata disuelto en aguan destilada hasta 100 ml lo dejamos gotear sobre 1 g de cloruro de sodio disuelto en agua destilada hasta el volumen de 20 ml (que contiene un indicador) en este proceso pudimos observar que al gotear el nitrato de plata sobre el cloruro de sodio cambia el color de la mezcla a un rojo ladrillo y se ha formado un precipitado dejamos reposar unos 10 minutos y luego precedimos a filtrar usando un embudo de filtracin con papel filtro y colocamos el embudo sobre el matraz Erlenmeyer hasta terminar de filtrar, en donde en el papel filtro queda el slido retenido en el cual tuvimos el resultado que tuvimos una prdida de las sustancias iniciales.
RECOMENDACIONES Se recomienda tener gran cuidado y precaucin con el manejo de los materiales delaboratorio, con ello estaremos colaborando con nuestra propia seguridad y a la vez estaramos evitando que se produzca algn accidente. Se debe utilizar siempre el utensilio en lafuncinpara la que fue diseado. No se debe jugar con los utensilios, especialmente con los devidriopor el riesgo de quebrarse y producirse heridas u otro accidente. Empleemos los materiales correctos de acuerdo a la prctica. Es bueno elegir el indicador ms adecuado para cada experimento, de manera que haya la menor diferencia posible entre el punto de equivalencia y el punto final. Al momento de realizar la titilacin abrir cuidadosamente la llave de la bureta para que la titilacin se d correctamente.
BIBLIOGRAFA:http://www.monografias.com/trabajos37/acido-base/acido-base2.shtml#ixzz3H1m3oDUk (Consultado Octubre 20, 2014)
http://www.monografias.com/trabajos81/practica-1-laboratorio-quimica/practica-1-laboratorio-quimica3.shtml#ixzz3H1g5YiB4 (Consultado Octubre 20, 2014)
ANEXOS
Materiales y Reactivos
Evidencias de los Procesos