Tema 5. Aminas. Estructura de las aminas. Nomenclatura. Basicidad ...
Reactividad de Grupos Funcionales Alcoholes y Aminas
-
Upload
makhiiss-vega -
Category
Documents
-
view
243 -
download
20
description
Transcript of Reactividad de Grupos Funcionales Alcoholes y Aminas

Reactividad de grupos funcionales alcoholes y aminas: síntesis de ciclohexeno
Introducción: en esta actividad experimental determinaremos la presencia de aminas mediante los ensayos de Dragendorff y Mayer, los cuales nos ayudan a detectar la presencia de XXX mediante la formación de un precipitado de color blanco en caso de Mayer y un precipitado naranja rojizo con el de Dragendorff. Estudiaremos el carácter básico de las aminas comparándolas con la basicidad de amoníaco.
También veremos a los alcoholes, que pueden actuar como bases y aceptar un protón para dar un alcohol protonado RCH2 + ; y también puede actuar como ácido y perder un protón para dar un anión alcóxido RO - . Los alcoholes se clasifican en primarios secundarios y terciarios según la naturaleza del carbono donde se une el grupo funcional OH.
Vamos a analizar los reactivos de deshidratación de alquenos, síntesis de alquenos, la deshidratación de alcoholes catalizada por ácidos minerales fuertes, tales como ácido sulfúrico y fosfórico.
Objetivos: analizar las propiedades generales ácido-base, redox y reactividad de alcoholes y aminas. Estudiar reactivos para su caracterización.
Comparar las propiedades de estos grupos funcionales con los de especies inorgánicas agua amoníaco y otras especies.
PARTE I: Aminas
I-1) Comparación de las propiedades básicas de las aminas y amoníaco
Compuesto
Kb
NH3 1,80E-05
CH3NH2 4,30E-04 Los grupos alquilos son donores de e- (estabilizan la carga del catión)(CH3)2NH 5,30E-04
(CH3)3N 5,50E-05Kb aumenta a medida que se incorporan grupos a la molécula.
NH3 + H2O = NH4+ + OH-
CH3NH2 + H2O = CH3NH3 + OH-
(CH3)2NH + H2O = (CH3)2NH2+ + OH-
Se desplaza el equilibrio hacia la formación de OH-. Las aminas terciarias, tiene distinto comportamiento por la presencia de tres grupos
alquílicos. Poseen impedimento estérico por lo cual la Kb es menor. I-2) Determinación de la presencia de aminas, empleando los ensayos de
Dragendorff y Mayer, reactivos empleados para la identificación de alcaloides
Página 1Alumnos: Liendo María Evangelina, Vega Emilse Macarena, Vergara Silvana Soledad. Comisión 17

El procedimiento para estos reactivos generales comienza con la disolución de la amina en 1L de agua. Se le agrega luego de dos a tres gotas de HCl 1M hasta la disolución si la droga es sólida. A esta solución se le agrega una gota del reactivo correspondiente.
Realizar los ensayos de Dragendorff y Mayer comparando butilamina, butanol, acetona y quinina.
Butilamina Butanol AcetonaQuinina+H20
(disolver)
MAYER precipitado BLANCO (+)formación de dos fases
(AMARILLO/BLANCO) (-) solución INCOLORA (-)precipitado AMARILLO
(+)
DRAGENDORFF leve turbidez BLANCA (+) solución AMARILLA (-) solución NARANJA (-) precipitado NARANJA (+)
PARTE II: Alcoholes
II-1) comparación de las propiedades de los alcoholes con respecto al agua, ácidos inorgánicos y orgánicos
a) Agregar un trocito de sodio del tamaño de una lenteja en 5mL de alcohol etílico absoluto puesto en un tubo de ensayo. A continuación verter al mezcla en un vaso de precipitados y dejar evaporar el exceso de alcohol i evaporar sobre una plancha e calentamiento. Demostrar el carácter básico del residuo. Añadir 3mL de agua y ensaye la solución de fenolftaleína.
b) Colocar una porción del sodio metálico similar al del experimento anterior en un vaso de precipitados con 200mL de agua destilada y tres gotas de fenolftaleína. (ensayo desarrollado por el jede de TP)
Conclusión:
CH3CH2OH + Na = Na+ + CH3CH2O- + ½ H2
CH3CH2O- + H2O = CH3CH2OH + OH-
Ante la disolución de la sal de etóxido de sodio en la solución de agua-fenolftaleína, la misma se torna ROSADA de manera prácticamente instantánea, indicando un pH menor o igual a 10.
2Na + 2H2O = 2Na+ + 2OH- + H2
Ante la adición de trocitos de sodio en la solución de agua-fenolftaleína la misma se torna ROSADA a los pocos segundos de que el mismo hace contacto con la fase líquida y comienza a reaccionar (indicando la formación de OH).
Asimismo se observa que inicialmente el trocito se calienta al rojo vivo con la posterior generación de una llama (por la gran exotermicidad de proceso) que se extingue a los pocos segundos. Se observa también que el trozo amorfo se torna esférico, dado que el mismo se funde y en todo momento flota sobre la superficie del líquido (el H2 gaseoso que se desprende
Página 2Alumnos: Liendo María Evangelina, Vega Emilse Macarena, Vergara Silvana Soledad. Comisión 17

forma una especie de “colchón de burbujas” que mantiene la esferita a flote, si bien la densidad de la misma es mayor a la del agua).
En el caso del etanol estos fenómenos no ocurren dado que la reacción es lenta; sólo cuando la porción de sodio es lo suficientemente pequeña como para que el empuje de las burbujas compense la fuerza peso, el mismo se eleva hacia la superficie.
c) Colocar 3mL de alcohol etílico en un tubo de ensayo cortado. Medir el pH con un phímetro. Repetir este experimento con ácidos y comparar los resultados obtenidos.
Compuesto KbCH3COOH 3,37
Al(NO3)3 3,27
n-butilamina 11,52NH3 10,83HCl 2,12H20 4,77
II-2) Propiedades redox de alcoholes
Oxidación del glicerol con permanganato de potasio
Colocar 1g de permanganato de potasio en una cápsula de porcelana. Con la ayuda de una espátula, hacer espacio en el centro, agregar dos o tres gotas de ácido sulfúrico concentrado y luego 1mL de glicerol anhidro (1,2,3-propanotriol) (secarlo con cloruro de calcio).
Esperar 20 segundos y observar. (experimento desarrollado por jefe de TP)
Conclusión:
Se observa un residuo color PÚRPURA carbonizado, correspondiente al permanganato de potasio sólido sin reaccionar y una pequeña porción de residuo verde correspondiente al permanganato de potasio (MnO4
- se reduce a MnO42- para oxidar el glicerol).
II-3) Clasificación de alcoholes 1°, 2° y 3°. Test de Lucas
Los alcoholes se clasifican en primarios, secundarios y terciarios, según la naturaleza del carbono donde se une el grupo funcional OH. Los alcoholes primarios y secundarios son fácilmente oxidados, mientras que los terciarios no lo son. Una combinación del test de Lucas y del test de oxidación con dicromato de potasio permite diferenciar entre alcoholes primarios, secundarios y terciarios.
El test de Lucas consiste en la aparición de un cloruro de alquilo como un líquido insoluble, cuando un alcohol se trata con una mezcla de ácido clorhídrico y cloruro de zinc (Reactivo de Lucas).
Página 3Alumnos: Liendo María Evangelina, Vega Emilse Macarena, Vergara Silvana Soledad. Comisión 17

ROH + HCl R-Cl + H2O
Experimentalmente, se puso en un tubo de ensayo 20 gotas del reactivo de Lucas y se agregó 3 o 4 gotas del alcohol. Se tapó el tubo y se lo agitó vigorosamente. Los compuestos a analizar son: 1-butanol (n-butanol), 2-butanol (s-butanol) y 2-metil-2-propanol (t-butanol).
n-butanol 2-butanol tert-butanolTest de Lucas
No se observan cambios. No hay reacción.
(Tiempo + Calor) = Precipitado blanco
Precipitado blanco (Inmediato)
Conclusión:
A través de esta experiencia se pudo observar que el alcohol terciario (tert-butanol) reacciona inmediatamente (precipitado blanco), debido a que esta reacción ocurre por mecanismo SN1 por medio de la formación de un ión carbonio intermediario. Los iones carbonios terciarios son especies muy estables, con lo cual se forman inmediatamente en condiciones de reacción del test.
Por otro lado, el alcohol secundario (2-butanol) reacciona lentamente y requiere de tiempo y calor para reaccionar con el reactivo (precipitado blanco), ya que el ión carbonio secundario formado como un intermediario es menos estable que el ión carbonio terciario.
En contraposición, el alcohol primario (n-butanol) no reacciona a temperatura ambiente, ya que se observa que el alcohol simplemente se solubiliza, debido a que el ión carbonio primario es una especie inestable y por lo tanto no se forma en condiciones de reacción de test.
II-4) Síntesis de ciclohexeno.
Se coloca 20ml de ciclohexanol y 10ml de ácido fosfórico en el balón de destilación y se mezcla la solución completamente. Se agrega una barra magnética al balón de destilación, hacer circular el agua fría por el refrigerante y calentar la mezcla hasta que el producto comience a destilar. Se detiene la destilación cuando queden unos pocos mililitros de residuo en el balón de destilación. Se agrega cloruro de sodio para saturar el destilado y después se le agrega carbonato de calcio para sacar el agua.
Reacciones de caracterización. Test de instauración.
Se coloca en dos tubos de ensayos 8-10 gotas de ciclohexanol. En otros dos tubos de ensayos coloque 8-10 gotas de ciclohexeno sintetizado. Se toma un tubo de cada grupo y se agrega al contenido una solución de bromo en tetracloruro de carbono. De igual forma se realiza el ensayo con permanganato de potasio con los dos tubos restantes.
ZnCl2
Página 4Alumnos: Liendo María Evangelina, Vega Emilse Macarena, Vergara Silvana Soledad. Comisión 17

Las reacciones se dieron de la siguiente forma:
1)
2)
3)
4)
Conclusión:
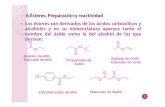
A partir de esta experiencia se puede concluir que los compuestos que contienen dobles enlaces (ciclohexeno) reaccionan decolorando una solución de bromo que presenta color rojo (reacción 3). También se oxidan con una solución de permanganato de potasio que presenta un color violeta; este color desaparece (2-3-ciclohexanol) al producirse un precipitado marrón de MnO2 (reacción 4).
En cambio en un ciclohexanol, si reacciona con bromo (halogenuro) no se producen cambios, es decir que no se produce una reacción ya que el ciclohexanol es una alcohol primario, que al pasar por un mecanismo SN1, forma un ión carbonio primario, una especie muy inestable (reacción 1). Si el ciclohexanol reacciona con permanganto de potasio se producen dos fases, un alcohol y un precipitado marrón de MnO2, debido a que al producirse por mecanismo SN1 y reaccionar con un nucleófilo débil, se produce la reacción ya descripta anteriormente (reacción 2).
Página 5Alumnos: Liendo María Evangelina, Vega Emilse Macarena, Vergara Silvana Soledad. Comisión 17
No hay reacciónCCl4
+ Br2OH
+ MnO2 O+ KMnO4
(Incoloro)
BrBrCCl4
+ Br2
+ MnO2
OHOH
+ KMnO4