Potenciales analgésicos obtenidos a partir de toxinas de moluscos gasterópodos
-
Upload
nelson-giovanny-rincon-silva -
Category
Health & Medicine
-
view
167 -
download
0
Transcript of Potenciales analgésicos obtenidos a partir de toxinas de moluscos gasterópodos

https://www.flickr.com/photos/animaliaproject/12847680065
Hipotesis19.indd 48 28/01/16 15:59

Potenciales analgésicos obtenidos a partir de toxinas de moluscos gasterópodos
Nelson Giovanny Rincón-Silva, Juan David Rincón Silva
Hipotesis19.indd 49 28/01/16 15:59

50 Hipótesis, Apuntes científicos uniandinos, núm. 19, 2015
Nelson Giovanny Rincón SilvaQuímico, estudiante de maestría en Química en la Universidad de los [email protected]
Juan David Rincón SilvaBiólogo, estudiante de Ingeniería Eléctrica en la Universidad Nacional [email protected]
El dolor es una experiencia sensorial y emocional desagradable que pueden experimentar todos los seres vivos que disponen de un sistema nervioso central. Se puede asociar a una lesión tisular o expresada como si esta existiera; puede ser agudo o sordo, y puede ser intermitente o constante [1]. En los seres vivos, el dolor se pue-de sentir en algún lugar del cuerpo, como la espalda, el abdomen, el pecho, si bien puede sentirse un dolor generalizado, como los dolores musculares (mialgia) [2]. La sensación de dolor articular o muscular se puede producir por diversas enfermedades, como artritis, fibromialgia, algunos tipos de cáncer u otras enfermedades crónicas [3]. Además, cuando se produce una lesión o traumatismo directo sobre un tejido por estímulos mecánicos, térmicos o quími-cos, se produce daño celular, que desencadena una serie de suce-sos que producen liberación de potasio, síntesis de bradiquinina del plasma y síntesis de prostaglandinas en la región del tejido dañado, que a su vez aumentan la sensibilidad del terminal a la bradiquinina y otras sustancias productoras del dolor [2].
El dolor en los pacientes se trata con medicamentos denominados analgésicos, que pueden ser de diversos tipos. Entre los principales se encuentran antinflamatorios no esteroideos, como la aspirina, el ibuprofeno (figura 1a) o naproxeno, el paracetamol (más conocido como acetaminofén, carente de
Potenciales analgésicos obtenidos a partir de toxinas de moluscos gasterópodos
Figura 1. Estructura química de los analgésicos comúnmente utilizados para tratar el dolor en diversas enfermedades: a) ácido (RS)-2-(4-isobutilfenil), propanoico conocido como ibuprofeno; b) N-(4-hidroxifenil), acetamida conocida como paracetamol o acetaminofén; c) (5α,6α)-7,8-didehidro-4,5-epoxi-17-metilmorfinan-3,6-diol, alcaloide fenantreno del opio conocido como morfina, nombrado así por el farmacéutico alemán Friedrich Sertürner en honor a Morfeo, el dios griego de los sueños [4-6].Fuente: imágenes editadas por los autores.
CH3
O
OH
CH3
CH3CH3
O
NH CH3
A B C
CH3
O
OH
CH3
CH3
Hipotesis19.indd 50 28/01/16 15:59

Universidad de los Andes, Facultad de Ciencias 51
efectos antinflamatorios [figura 1b]), que actúan inhibiendo las postraglandinas [4, 5]. Otros tipos de analgésicos son los opiá-ceos menores, como el tramadol, y los opiáceos mayores; estos son un grupo de fármacos naturales (opiáceos) como la morfina, y artificiales (opioide) como el fentanilo. Entre estos el más po-pular es la morfina, que se utiliza para tratar dolores crónicos en pacientes oncológicos, dolores en los huesos o en pacien-tes posquirúrgicos (figura 1c) [6]. El problema de la mayoría de estos analgésicos es que presentan efectos secundarios como daño hepático, gástrico o renal y, en el caso de los opiáceos, pueden causar adicción debido a la combinación de factores psicológicos y fisiológicos [4, 5].
Recientemente se ha demostrado la importancia de algunos compuestos químicos presentes en numerosos venenos de organismos marinos para el tratamiento de diferentes tipos de dolores crónicos [7]. En 1987 ya se habían reportado cerca de 2.500 metabolitos provenientes de estos organismos; en 1998 se tenían cerca de 850 nuevas estructuras de compuestos químicos con actividad medicinal provenientes de organismos marinos, y en el 2012 se presentaron más de dos mil nuevos
compuestos provenientes de esta fuente [8]. Estos potenciales analgésicos pueden llegar a tener un efecto mil veces más efec-tivo que poderosos analgésicos como la morfina, con la ventaja de que no causan dependencia ni depresión respiratoria. De ahí que actualmente sean estudiados por cientos de grupos de in-vestigación a escala mundial [9].
Entre los organismos marinos que pueden aportar las menciona-das sustancias están el fitoplancton; las algas verdes, pardas y rojas, y los siguientes filos del reino animal: esponjas o poríferos, cordados, equinodermos y moluscos, entre otros [9]. Estos últi-mos, y específicamente los caracoles, son muy interesantes, ya que su veneno contiene toxinas de gran poder analgésico [8-10].
LOS MOLUSCOS
Los moluscos pertenecen al amplio filo animal Mollusca. Re-cientes revisiones demuestran que se han descrito alrededor de 100.000 especies de moluscos vivientes, y más de 35.000 especies extintas [11, 12]. Los moluscos han colonizado la ma-yoría de ambientes terrestres, desde grandes alturas a más de
Figura 2. Diferentes representantes del filo de moluscos (Mollusca, del latín molluscum: blando) [20].Fuente: editado por los autores.
Bivalvos Cefadópodos Gasterópodos
Con valvas Con tentáculos Con "pies"
Almejas Calamares Caracoles
Ostras Nautilus Caracolas
Mejillones Pulpos Babosas
Hipotesis19.indd 51 28/01/16 15:59

52 Hipótesis, Apuntes científicos uniandinos, núm. 19, 2015
3.000 m hasta profundidades de más de 5.000 m, y se dis-tribuyen tanto en aguas polares como tropicales [11, 12]. Los moluscos son considerados el segundo grupo más abundan-te de invertebrados después de los artrópodos; presentan una morfología muy heterogénea, desde típicas formas de almejas, ostras, caracoles, babosas, quitones y lapas, hasta organismos con tamaños y formas considerables, como los pulpos y cala-mares (figura 2) [12]. De esta enorme diversidad ha resultado una amplia clasificación taxonómica que incluye siete clases: Aplacophora, Monoplacophora, Poliplacophora, Escaphopoda, Bivalvia, Cephalopoda y Gastropoda [11, 12]. Además, los gas-terópodos se dividen sistemáticamente en prosobranquios (prin-cipalmente marinos), opistobranquios (exclusivamente marinos) y pulmonados (en su mayoría, terrestres).
CARACTERÍSTICAS BIOLÓGICAS DE LOS GASTERÓPODOS
Una de las principales características de los gasterópodos es su concha, que se compone de varias capas. En el caso más sim-ple, la concha está dispuesta como un tubo enrollado en espiral que se ensancha continuamente. El agujero terminal de la con-cha, por donde asoma el blando cuerpo del molusco, se deno-mina estoma, y puede ser redondo, ovalado o hendido [11, 12]. La cabeza contiene a los ojos, y uno o dos pares de tentáculos. En muchos prosobranquios se prolonga en forma de hocico. La estoma es ventral, y la faringe presenta una rádula multi-den-ticulada, precedida de unas placas afiladas que trabajan como mandíbulas. Unas glándulas esofágicas segregan un mucus que envuelve las partículas alimenticias; algunos géneros producen también una secreción tóxica que paraliza a la presa [12].
En la mayoría de los casos, junto a la base de los tentáculos se encuentran unos ojos primarios, ocelos, o incluso ojos con
lente, que les proporcionan una visión primitiva. Los gaste-rópodos se desplazan normalmente reptando, por medio de ondas que recorren la suela del pie y empujan al animal hacia delante. Los prosobranquios son, por lo regular, unisexuados. Los opistobranquios y los pulmonados son hermafroditas y generalmente practican una cópula cruzada; muy rara vez se autofecundan [12]. Los gasterópodos se reproducen por hue-vos, que ponen por lo común en forma de cápsulas o cordones gelatinosos, o también de capullos apergaminados que con-tienen muchos huevos. El desarrollo de las especies marinas pasa por un estado larvario, mientras que los gasterópodos de tierra y agua dulce se desarrollan directamente sin estadio larvario [12].
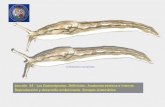
De los gasterópodos, el que recibe mayor atención por sus bio-compuestos de utilidad médica es el género Conus, que cuen-ta con cerca de setecientas especies. Pertenecen a la familia Conidae, y son mejor conocidos como conos (figuras 3a y 3b). Son caracoles marinos de aguas tropicales que se encuentran en los arrecifes de coral [11, 12]. Son carnívoros y poseen un órgano venenoso, que consiste en una glándula unida a un dien-te radular en forma de arpón. Con base en el tipo de presas consumidas, los caracoles cono se clasifican en vermívoros (co-medores de gusanos), moluscívoros (comedores de moluscos) y piscívoros (comedores de peces), aunque algunas especies de caracoles cono pueden consumir más de un tipo de presa. El veneno de ciertas especies, como el Conusgeographus, el Co-nusaulicus o el Conusleopardus, puede ser fatal para el hombre, ya que produce parálisis y puede causar la muerte. El veneno de los conos comprende numerosos péptidos ricos en cisteína llamados conotoxinas o conopéptidos. Estos péptidos se dirigen a los canales iónicos y receptores en el sistema nervioso de la presa con potencia y especificidad [13].
Figura 3. Caracoles marinos del género Conus, denominados así por la forma de su concha. Estas especies producen un veneno que puede causar la muerte en los humanos; de allí surgió el interés por estudiar las toxinas presentes en estos animales [12].Fuente:
A B
Hipotesis19.indd 52 28/01/16 15:59

Universidad de los Andes, Facultad de Ciencias 53
COMPUESTOS QUÍMICOS CON ACTIVIDAD FARMACOLÓGICA EXTRAÍDOS DE CARACOLES
La mayoría de conopéptidos oscilan entre 10 y 30 aminoácidos de longitud, y cada especie de caracoles cono produce un ve-neno que comprende más de mil péptidos únicos. Su pequeño tamaño, la relativa facilidad de síntesis química y la diversidad de canal iónico, así como los receptores objetivo, hacen que los conopeptidos sean valiosos fármacos [14]. Muchos de los conopéptidos farmacológicamente caracterizados se dirigen a los receptores de canal iónico —proteínas transmembrana con poros acuosos que cuando se abren permiten el paso selectivo de iones específicos a través de las membranas celulares— de los mamíferos. Estos receptores participan en las vías del dolor, y entre ellos se incluyen los receptores nicotínicos de acetilco-lina (α-conotoxinas), los canales de sodio (μ-conotoxinas y μO-conotoxinas), los canales de calcio (ω-conotoxins), transporta-dores de noradrenalina (χ-conopéptidos), el receptor de NMDA (conantoquinas) y el receptor de neurotensional (contulakins). La alta selectividad de los conopeptidos hace de ellos fármacos muy útiles [15].
Por ejemplo, el conopéptido Ziconotida tipo ω-MVIIA se encuentra disponible en el mercado bajo el nombre comercial de Prialt (figu-ra 4), y fue aprobado en 2004 por la agencia de alimentos y medi-camentos de los Estados Unidos como analgésico intratecal. Este es un analgésico que bloquea los canales de calcio tipo N (CCN), no es narcótico y es aislado del veneno que emplea la especie Conus Magus para aturdir las presas que captura. Los canales CCN regulan la liberación de neurotransmisores en poblaciones neuronales específicas, responsables del procesamiento medular del dolor. Al unirse a estos CCN neuronales, la ziconotida inhibe la corriente de calcio sensible al voltaje en las vías aferentes noci-ceptivas principales que terminan en las capas superficiales del asta dorsal de la médula espinal. A su vez, esto inhibe la liberación de neurotransmisores (incluida la sustancia P, un neuropéptido que actúa como neuromodulador y neurotransmisor) y, por tanto, la señalización medular del dolor [16].
Actualmente se estima que hay más de cincuenta mil conopép-tidos diferentes, de los cuales menos del 0,1% se han caracteri-zado hasta la fecha. Esta cantidad está aumentando rápidamente con la llegada de nuevas técnicas analíticas, más rápidas, y que
Figura 4. Conopéptido Ziconotida tipo ω-MVIIA. Comercialmente denominado Prialt, este fue el primer derivado marino que recibió la aprobación como medicamento [12-16]. Imagen editada por autores.
Hipotesis19.indd 53 28/01/16 15:59

54 Hipótesis, Apuntes científicos uniandinos, núm. 19, 2015
requieren, además, menos cantidad de muestra de veneno. Es-pecíficamente, se usa la técnica instrumental de espectrometría de masas MS, que cada vez es más sensible. La combinación de los datos de espectrometría con información de secuencias de ADN obtenida a partir de bibliotecas de ADNc y EST (expressed sequence tag) es muy práctica [16, 17].
NUEVAS HERRAMIENTAS EN EL DESCUBRIMIENTO Y OBTENCIÓN DE CONOPÉPTIDOS
La obtención de conopéptidos tradicionalmente se ha realizado-mediante métodos clásicos de actividad guiada por fracciona-miento, en los que el veneno es detectado por su bioactividad, luego se purifica y se caracterizan las fracciones que exhiben actividad biológica; pero este método requiere bastante tiempo para llevarse a cabo y exige grandes cantidades de veneno cru-do, lo que dificulta el trabajo [17, 18]. Con el fin de acelerar el proceso de obtención y de limitar la cantidad de veneno necesa-ria para adelantar los estudios han sido implementados nuevos métodos con ayuda del avance tecnológico en la instrumenta-ción y el desarrollo de nuevas técnicas; además, se ha recurrido a la combinación de estas. Por ejemplo, con la proteómica se es-tudia el conjunto de proteínas presentes en una unidad biológica bajo condiciones específicas de interés, al tiempo que se utiliza un espectrómetro de masas MS de alta sensibilidad, debido a la extremadamente pequeña cantidad de muestra del veneno [18].
Desarrollos paralelos en el campo de la proteómica y las me-joras en la instrumentación de MS han hecho de los estudios proteómicos uno de los pilares en el campo de los estudios de venenos [16-18]. Los venenos se componen principalmente de péptidos, y por tanto son susceptibles de estudiarse mediante análisis de masas. El acoplamiento con técnicas como la croma-tografía líquida con espectrometría de masas (LC-MS), así como el aumento de la sensibilidad de la instrumentación ha ayuda-do a desentrañar la verdadera complejidad de los venenos. En particular, técnicas como la desorción/ionización láser asistida por matriz (MALDI) con detector de iones de tiempo de vuelo TOF permiten el análisis de biomoléculas (biopolímeros como las proteínas, los péptidos, los azúcares y los lípidos) y molé-culas orgánicas grandes (como los polímeros, los dendrímeros,
etc.), que tienden a hacerse frágiles y fragmentarse cuando son ionizadas por métodos convencionales. También se emplea es-pectrometría de masas de ionización por electroespray (ESI) que contribuye a elucidar la complejidad del veneno. Adicionalmente, estas técnicas han aumentado en diez veces las estimaciones del número de conopéptidos presentes en cada especie [14-20].
En cuanto a la transcriptómica (Ómica encargada de identificar la porción del genoma de un organismo transcrito a mRNA, rRNA, tR-NAs, etc., presentes en una célula, tejido u órgano, o la cuantifica-ción de los niveles de transcripción de los genes), varios grupos han utilizado métodos para estudiar los genes que codifican los compo-nentes del veneno que se encuentran en los caracoles cono. Estos estudios se basan en la construcción de bibliotecas de cDNA segui-da por el método de secuenciación Sanger, con el cual se determina el orden de los nucleótidos en un oligonucleótido de ADN [19]. La secuenciación de un marcador de secuencia expresada EST (se-cuencia nucleotídica transcrita codificante de una proteína) ha per-mitido la identificación de un número de genes que codifican toxinas particulares. Adicionalmente, ha conducido al descubrimiento de nuevas α-conotoxinas. El uso de perfiles de expresión génica tam-bién se ha utilizado para explicar los mecanismos de la variación y la evolución de los conopéptidos. Sin embargo, la cantidad de infor-mación obtenida mediante la secuenciación de partes específicas del transcriptoma es evidentemente restringida, y tales métodos son propensos a sufrir los efectos que impiden la identificación de los transcritos complejos de muestreo. Algunos grupos de investigación también descubrieron varias enzimas nuevas en la modificación postraduccional (cambio químico ocurrido después de la síntesis de una proteína), y han podido presentar la caracterización completa de la glándula del veneno [18-19]. Así, los nuevos avances en MS están siendo integrados con la trascriptómica, genómica, proteó-mica y bioinformática en un enfoque multidisciplinario que algunos investigadores han denominado venómica [18, 20].
Otra aplicación médica de las conotoxinas provenientes de cara-coles ha sido estudiada en los últimos años por algunos grupos de investigación, que han empleado estas toxinas en tratamien-tos contra desórdenes neurodegenerativos, específicamente en patologías como el Alzheimer, la enfermedad de Parkinson y la esclerosis múltiple [20, 21]. Estas enfermedades conducen con
Hipotesis19.indd 54 28/01/16 15:59

Universidad de los Andes, Facultad de Ciencias 55
REFERENCIAS
[1] Grimmer-Somers K, Vipond N, Kumar S, Hall G. A review and
critique of assessment instruments for patients with persistent
pain. Journal of Pain Research 2009; 2: 21-47.
[2] Frey-Law LA, Lee JE, Wittry AM, Melyon M. Pain rating sche-
ma: three distinct subgroups of individuals emerge when ra-
ting mild, moderate, and severe pain. Journal of Pain Research
2014; 7:13-23.
[3] Eustice C. Fibromyalgia vs. rheumatoid arthritis pain – what
factors determine treatment? Some patients have both condi-
tions. Arthritis & Joint Conditions Expert; 2014, http://arthritis.
about.com/od/fibromyalgia/f/pain.htm.
[4] Malm H, Borisch C. Analgesics, non-steroidal anti-inflamma-
tory drugs (NSAIDs), muscle relaxants, and antigout medi-
cations. En: Drugs during pregnancy and lactation. London:
Elsevier; 2015.
[5] Piazueloa E, Lanas A. NSAIDs and gastrointestinal cancer.
Prostaglandins & Other Lipid Mediators 2015; 120: 91-96.
[6] Lu Y, Hu J, Dong C. Morphine may enhance the cardioprotec-
tion induced by remote ischemic preconditioning. International
Journal of Cardiology 2015; 187(6): 443-444.
[7] Prashanth JR, Lewis RJ, Dutertre S. Towards an integrated
venomics approach for accelerated conopeptide discovery.
Toxicon 2012; 60(4): 470-477.
[8] Hu Y, Chen J, Hu G, Yu J, Zh X, Lin Y et al. Statistical research
on the bioactivity of new marine natural products discovered
during the 28 years from 1985 to 2012. Marine Drugs 2015;
13(1): 202-221.
[9] Cragg GM, Newman DJ. Natural products: a continuing sou-
rce of novel drug leads. Biochimica et Biophysica Acta 2013;
1830(6): 3670-3695
[10] Costantini M. An overview on genome organization of marine
organisms. Marine Genomics; 2015, in press.
[11] Dutertre S, Lewis RJ. Cone snail biology, bioprospecting and
conservation. En Snails: Biology, ecology and conservation.
New York: Nova Science Publishers; 2012: 85-105.
[12] Gofas S, Moreno D, Salas C. Moluscos marinos de Andalucía,
vols. I y II. Andalucia: Universidad de Málaga; 2011.
[13] Hannon H, Atchison W. Omega-conotoxins as experimental
tools and therapeutics in pain management. Marine Drugs
2013; 11(3): 680-699.
[14] Favreau P, Stöcklin R. Marine snail venoms: use and trends in
receptor and channel neuropharmacology. Current Opinion in
Pharmacology 2009; 9(5): 594-601.
[15] Jakubowski JA, Kelley WP, Sweedler JV, Gilly WF, Schulz JR.
Intraspecific variation of venom injected by fish-hunting Conus
snails. Journal of Experimental Biology 2005; 208(15): 2873-
2883.
[16] Jones A, Bingham JP, Gehrmann J, Bond T, Loughnan M, At-
kins A et al. Isolation and characterization of conopeptides by
high performance liquid chromatography combined with mass
spectrometry and tandem mass spectrometry. Rapid Commu-
nications in Mass Spectrometry 1996; 10(1): 138-143.
[17] Lewis RJ, Dutertre S, Vetter I, McDonald CJ. Conus venom
peptide pharmacology. Pharmacological Reviews 2012; 64(2):
259-298.
[18] Rincón-Silva NG, Carazzone C, Rincón-Silva JD. Envenena-
miento por mordeduras de serpientes: impacto general en
Colombia y en el mundo. Química e Industria 2015; 27(5):
32-37.
[19] Terrat Y, Biass D, Dutertre S, Favreau P, Remm M, Stöcklin R
et al. High-resolution picture of a venom gland transcripto-
me: case study with the marine snail Conus consors. Toxicon
2012; 59(1): 34-46.
[20] Alonso D, Khalil Z, Satkunanthan N, Livett BG. Drugs from the
sea: conotoxins as drug leads for neuropathic pain and other
neurological conditions. Mini-Reviews in Medicinal Chemistry
2003; 3(7): 785-787.
[21] Brand-Schieber E, Werner P. Calcium channel blockers ame-
liorate disease in a mouse model of multiple sclerosis. Experi-
mental Neurology 2004; 189(1): 5-9.
el tiempo a una incapacidad progresiva que afecta a millones de seres humanos. Se ha observado que diferentes canales iónicos en las neuronas, como algunos de sodio y potasio, tienen efectos directos en los padecimientos neurodegenerativos, dependiendo de las expresiones y anormalidades en sus funciones [20, 21]. Por otro lado, las toxinas aisladas de los caracoles presentan afinidad por diferentes canales iónicos, de los cuales algunos se relacionan directamente con el desarrollo de las mencionadas enfermedades. Las conotoxinas que pueden presentar dicha in-teracción son principalmente las rXIA, αD-cap, αD-mus, CalTx, entre otras. De ahí que la investigación de estas interacciones pueda conducir a impedir la destrucción de los canales iónicos y, así, a la disminución del proceso neurodegenerativo [19-21].
Finalmente, a pesar de los potenciales efectos analgésicos de los conopéptidos aislados de moluscos gasterópodos que ya han sido comprobados en pruebas farmacológicas, hasta el presente solo un pequeño número de conopéptidos ha sido caracterizado detalladamente. No obstante, las mejoras en los campos de estudio —proteómica y trascriptómica— y el de-sarrollo en técnicas instrumentales de MS/MS han acelerado los estudios de descubrimiento y caracterización de conopép-tidos, lo que favorece la esperanza de tratar a pacientes que no pueden llevar una vida tranquila por los fuertes dolores que padecen. Por lo tanto, es importante auspiciar las investigacio-nes en esta área, así como asegurar la protección de diferentes especies marinas. •
Hipotesis19.indd 55 28/01/16 15:59