Oxicloración de metano · ro y de oxicloraciôn de metano respectivamente. Asi mis mo se optimô...
Transcript of Oxicloración de metano · ro y de oxicloraciôn de metano respectivamente. Asi mis mo se optimô...

UNIVERSIDAD COMPLUTENSE DE MADRIDFACULTAD DE CIENCIAS QUÍMICAS
TESIS DOCTORAL
MEMORIA PARA OPTAR AL GRADO DE DOCTOR
PRESENTADA POR
Carlos Renta Huertas
DIRECTOR:
Enrique Costa Novella
Madrid, 2015
© Carlos Renta Huertas, 1976
Oxicloración de metano

UNIVERSiDAD COMPLU TENSE DE MADRID ^
FACULTAD DE CIENCIAS QUIMICAS G
V ■ '■ '
BIBLIOTECA UCM
5300125868
OXICLORACION DE METANO
UNIVERSiDAD COMPLUTENSE - MADRID Facultad de Ciencias Q u i m i c a s B I B L I O T E C A
N- Registre ........
MEMORIA
QUE PARA OPTAR AL GRADO DE DOCTOR EN CIENCIAS QUIMICAS
PRESENTA
CARLOS RENTA HUERTAS
MADRID 1976

A MIS PADRES


La presente investigaciôn ha do realizada en la catedra de Ingenieria Quim^ ca de la Facultad de Quimica de la Universidad Complutense de Madrid, bajo la direcciôn del catedratico Dr. D. Enrique Costa Novella y del profesor agregado Dr* D. José Luis Sotelo San- cho, en quienes siempre encontre el estimulo y la ayuda necesaria para realizar mi labor, por lo que deseo expresarles mi mas sincero agrad^ cimiento.
Vaya también mi gratitud para todas las personas que han colaborado en la realizacion de este trabajo, para todos mis companeros de catedra y en especial para mi mu jer, por su valiosa ayuda.
Asi mismo, he de mencionar al Ministerio de Educaciôn y Ciencia por las ayu- das econômicas que han posibilitado la reali - zaciôn de mi trabajo.


INDICE
1,- RESUMEN 12.- INTRODUCCION 5
2*1.- Situaciôn actual de los clorometanos* 132,2.- Materias primas* 222*3*- Objeto y alcance de la présente investi
gaciôn* 263*- INSTALACION 29
3*1#- Reactor* 293*2*- Sistema de alimentaciôn de reaccionantes 31
3*2*1*- Alimentaciôn de metano* 313*2*2*- Alimentaciôn de aire* 323*2*3*- Alimentaciôn de cloruro de hidr^
geno* 323*3*- Tratamiento de productos* 35
3*3*1*- Productos de oxidaciôn de cloruro de hidrôgeno* 35
3*3*2*- Productos de oxicloraciôn de me-tano* 36
3#3*5*- Eliminaciôn de productos residua,les* 37
3*4*- Instalaciôn elêctrica* 39

4.- PROCEDIMIENTO 434#!#- Planteamiento de un experimento* 43
4*1*1#- Oxidaciôn de cloruro de hidrôg^no a cloro* 43
4*1*2*- Oxicloraciôn de metano* 444*2*- Desarrollo de un experimento* 45
4.2*1*- Oxidaciôn de cloruro de hidrôgeno a cloro* 45
4*2*2*- Oxicloraciôn de metano* 4?5*- RESULTADOS EXPERIMENTALES 51
5*1*- Selecciôn y optimaciôn del catalizadorde oxicloraciôn* 53
5#2*- Estudio cinético del proceso Deacon* 575*2*1*- Expérimentes previos* 575*2*2*- Influencia de las etapas de
transferencia de materia* 575#2*3»- Expérimentas cinéticos* 59
5*3#- Estudio cinético de la oxicloraciôn demetano* 595.3*1#- Expérimentas previos* 595*3*2*- Variaciôn de la actividad del
catalizador* 635*3*3*- Influencia de las etapas de
transferencia de materia* 675*3*4*- Expérimentas cinéticos* 67
5*4*- Método de optimaciôn de Box-Wilson* 695*4*1*- Diseno empirico-experimental 69

6.- DISCUSION DE RESULTADOS 8l6*1,- Selecciôn y optimaciôn del catalizador
de oxicloraciôn, ôl6.2,- Estudio cinético del proceso Deacon. 92
6.2.1.- Expérimentas previos. 92a.- Variaciôn de la actividad
del catalizador. 92b.- Selecciôn del intervalo de
variables a utilizar en el estudio cinético. 93
6.2.2,- Estudio cinético# 95a.- Consideraciones previas s^
micuantitativas. 95b,- Tratamiento cuantitativo de
las reacciones entre gases catalizadas por sôlidos. 103
c#- Etapas de transferencia demateria. 104
d.- Etapas quimicas. • 1076.3*- Estudio cinético de la oxicloraciôn de
metano* 1206*3*1*- Experimentos previos* 120
a*- Variaciôn de la actividaddel catalizador* 120
b*- Selecciôn del intervalo de variables a utilizar en el estudio cinético* 122

6*3.2.- Estudio cinético. 124a.- Consideraciones previas se-
micuantitativas. 124b.- Etapas de transferencia de
materia. l4lc.- Etapas quimicas. l43
6.4*- Método de optimaciôn de Box-Wilson* 1626*4*1*- Ajuste de una superficie de
respuesta a la regiôn estudiada 1626*4*2*- Interpretaciôn de la superficie
de respuesta* l647*- CONCLUSIONES 1718*- RECOMENDACIÔNES 1779*- APENDICES 179
9*1*- Instalaciôn : Detalles y Accesoràos* 1799*1*1*- Detalles del aparato. 179
• 9*1*2*- Vâlvulas* 1799*1*3*- Diapositives de medida* l8l
a#- Medidores de caudal utilizados. l8l
b*- Sistemas de regulaciôn ycontrol de la temperatura* I85
9*2*- Detalles de procedimiento* I889*2*1*- Preparaciôn de catalizadores* I889*2*2*. Métodos de anâlisis* 190
a*- Cloro producido* 191b*- Cloruro de hidrôgeno libre 193c*- Metano y clorometanos* 194

9*3*- Métodos de câlculo* 20Ô9*3*1*- Câlculo de un experimento de
oxicloraciôn. 208a.- Anâlisis de los productos
de reacciôn. 209b.- Câlculos finales* 214
9*3*2*- Câlculo de las presiones par-ciales en el reactor. 21?
9*3*3*- Câlculo de las velocidades ne tas de apariciôn y desapari - ciôn de productos y reaccionan tes* 219
9*4*- Estudio cinético del proceso Deacon* 2209*4*1*- Deducciôn de las ecuaciones
de velocidad* 2209*4*2*- Integraciôn de las ecuaciones
* de velocidad* 2439*3*- Estudio cinético de la oxicloraciôn
de metano* 2489*5*1*- Deducciôn de las ecuaciones
de velocidad* 2489*6*- Investigaciôn operativa* 270
9*6*1*- Introducciôn* 2709*6*2*- El objetivo* 2739*6*3*- El sistema* 2759*6*4*- El modelo* 2799*6*5*- Método de optimaciôn de Box-
Wilson* 296

a,- Diseno emplrico-experimen tal alrededor de un punto inicial.(Planteamiento de la exp^ rimentaciôn)•
b#- Ajuste de la superficie de respuesta.
c.- Desplazamiento de las con diciones operatives en dd recçiôn al ôptimo.
d.- Diseno empirico-experimen tal en la subregiôn ôptima#
e.- Interpretaciôn de la super ficie de espuesta.
297
302
NOMENCLATURABIBLIOGRAFIA
306
310
310
313317

1,- RESUMEN
En esta memoria se informa sobre los resuJL tados obtenidos en la preparaciôn y optimaciôn de un cata lizador de oxicloraciôn, asi como del estudio cinético de los procesos de oxidaciôn de cloruro de hidrôgeno a cloro (proceso Deacon) y de oxicloraciôn de metano en fase de vapor y en presencia del catalizador desarrollado.
El creciente interés por los clorometanos, unido al abaratamiento de las materias primas utilizadas, motivado por la introducciôn de métodos petroleoquimicos para la obtenciôn de metano de diversa procedencia y los grandes excedentes de cloruro de hidrôgeno de las numero- sas industrias de cloraciôn existantes, ha permitido su producciôn a escala industrial, siendo su crecimiento uno de los mâs destacados de toda la industria quimica de de- rivados organoclorados.
El precio del metano, la elevada conver - siôn de clorometanos que se obtiene en su reacciôn con el cloruro de hidrôgeno, siempre que se dispong* de un buen catalizador, determinan que este proceso resuite competitive con los actualmente existantes para la obtenciôn de

dichos derivados*Las ventajas que presentan los procesos
de oxicloraciôn sobre los de cloraciôn clâsica (têrmi- COS o cataliticos) son, por otro lado, évidentes. Los innumerables estudios y publicaciones aparecidas ultima mente sobre los procesos de oxicloraciôn, son quizâs, el mejor exponente de esta afirmaciôn.
Pese a los numerosos trabajos cientifi- COS de los ôltimos anos sobre el proceso de oxiclora — ciôn de metano, no se dispone de todos los datos que fuera de desear para su realizaciôn prâctica, ya que las elevadas temperaturas de trabajo hasta ahora pro- puestas, influyen seriamente sobre la actividad del ca talizador y la selectividad del proceso# Por otro lado, gran parte de la informaciôn existante esté protegida por patentes, por lo que lôgicamente no résulta muy ex pllcita#
Por estas razones se considerô intere - santé iniciar una investigaciôn sobre el mencionado pro ceso para tratar de encontrar un buen catalizador para el mismo, esclarecer su mecanismo y poder obtener datos cinéticos utiles para la evaluaciôn tecnolôgicd del mis mo.
A tal fin se montô la instalaciôn necesa ria, consistante en un reactor integral de lecho catal^ tico fluidizado que habia de permitir un estrecho con - trol de la temperatura, variable fundamental en el pro-

ceso, que no variô nunca mâs de 1—2 OC alrededor del valor deseado.
Una vez puestos a punto los métodos anal^ ticos que permitan determinar cuantitativamente reaccionantes y productos,. se seleccionaron los componentes bâ- sicos del catalizador y se optimô su composiciôn, tenien do en cuente ademâs sus condiciones mecânicas y de flui- dizaciôn*
Estudiada la variaciôn de actividad con el tiempo de utilization, se procediô a la realizaciôn de 36 y 60 experimentos ôtiles para el estudio cinético de los procesos de oxidaciôn de cloruro de hidrôgeno a cloro y de oxicloraciôn de metano respectivamente. Asi mismo se optimô el proceso de oxicloraciôn de metano por el método de Box-Wilson, respecto al rendimiento global de clorometanos, obteniéndose datos suficientes para esta- blecer las condiciones ôptimas para la obtenciôn preferential de cualquiera de ellos#
Se llegô a mécanismes plausibles para am bos procesos. La integraciôn de las ecuaciones diferen- ciales respectivas ha proporcionado valores de los ren- dimientos en cloro y cloruro de hidrôgeno no reacciona- do, que se apartan de los resultados expérimentales en menos del 396*
El diseno experimental elaborado para la optimaciôn del proceso de oxicloraciôn de metano, condu jo a una ecuaciôn representative de la respuesta del s^

tema, que permite predecir el comportamlento del mismo, en la region estudiada, con un grado dé fiabilidad no inferior al 95 por ciento.

2.- INTRODUCCION
Desde que Hass y McBee en 1935 demostraron con sus estudios, la importancia de la cloraciôn de hidroi carburos, la industria del cloro sufriô un empuje tan con siderable que aûn en la actualidad destaca su acentuado crecimiento.
A pesar de ello, el método mâs importante para la producciôn en gran escala de cloro sigue siendo la via electrolitica• Sin embargo, la producciôn de cada tonelada de cloro por este procedimiento, impiica la producciôn simultanea de otra de sosa caûstica (l), lo que représenta uno de los principales problemas de esta indu^ tria, pues el crecimiento anual de la demanda de cloro es un 7-10% mayor que el de la demanda de hidrôxido sôdico. Técnicamente, la inevitable producciôn simultânea de hi - drôxido sôdico détermina un gran excedente de este produc, to en la industria quimica mundial, y que el precio del cloro siga subiendo anormalmente para soportar cada vez una mayor proporciôn del coste global de producciôn.
Aunque este hecho constituye un incentive para tratar de lograr un uso eficiente del cloro produci- do, se puede afirmar que por razones técnicas, résulta muy

dificil de conseguir en la prâctica# En efecto, actual - mente, mâs del 70% de la producciôn mundial de cloro se destina a la fabricaciôn de derivados halogenados de corn puestos orgânicos, procesos en los que cas! s in excepciôn, solo el 50% del cloro utilizado aparece en el producto A nal# La otra mitad, se convierte en cloruro de hidrôgeno o cloruros salinos. Este constituye el mâs claro ejemplo de la pobre utilizaciôn del cloro, globalmente hablando, ya que estos subproductos no se encuentran al final del proceso en condiciones de una utilizaciôn inmediata.
Para evitar este exceso de producciôn de cloruro de hidrôgeno, que es el subproducto principal,se han desarrollado diferentes procesos que esencialmente se pueden agrupar en :
I - Recuperaciôn de cioro a partir del cloruro de hidrôgeno#
II — Utilizaciôn directa del cloruro de hidrôgeno en presencia de oxlgeno como mezcla dorante#
I#- En la ûltima década, han aparecido sûmenes con diversas posibilidades de recuperar cloro a partir de cloruro de hidrôgeno (2) (3)# Se pueden desta- car como mâs importantes las cuatro siguier^tes :
1#- Oxidaciôn directa del cloruro de hidrôgeno con agentes inorgânicos# Es sobradamente conocida por ejem - plo, la reacciôn del cloruro de hidrôgeno con piroluxita (MnOg) ya estudiada por Weldon en 1866#

MnOg * 4 CIH Cl^ I ClgMn 4> HgO
Su principal inconveniente radica en el bajo rendimiento en cloro (30-30%), la pêrdida de clori^ ro de hidrôgeno como Cl^Mn y el elevado precio de la p^ roluxita#
2.- Oxidaciôn en dos etapas, utilizando oxidos y cloruros metâlicos (de hierro y magnesio, fundamental - mente).
MeO 4. 2 CIH y:,.» Cl^Me 4 H^O
ClgMe 4 1/2 Og ^ Gig 4 MeO
En una primera etapa, reaccionan los ôxl dos con cloruro de hidrôgeno para formar el cloruro me- tâlico# A continuaciôn, el cloruro se oxida con aire pa ra obtener cloro y regenerar el ôxido inicial. Este método fué pronto abandonado, pues al bajo rendimiento del proceso quimico en si, habia que sumar las pérdidas por volatilizacion del cloruro metâlico a causa de las elevadas temperaturas utilizadas.
3.- Electrolisis del cloruro de hidrôgeno* Aun - que este proceso résulta atractivo desde el punto de v ^ ta tecnolôgico, su rentabiblidad esta condicionada a la disponibilidad de cnergia eléctpica de bajo coste.
4.- La oxidaciôn catalitica en fase gaseosa delcloruro de hidrôgeno, constituyô una de las soluciones

m
S(O
m
en
s
o g
HCi
2 8Hfb

mâs generalxzadas para resolver el problema del cloro en instalaciones industriales*
La oxidaciôn de cloruro de hidrôgeno es una reacciôn exotêrmica reversible, que puede represen - tarse por la siguiente ecuaciôn :
2 CIH 4. 1/2 Og Clg 4 HgO A H = -28 Kcal/mo
La reacciôn en fase homogenea es lenta,p^ ro Deacon (4) (5) (6) utilizando como catalizador cloruro de cobre en sus dos estados de oxidaciôn, sobre un so porte inerte, consiguiô que la velocidad de reacciôn fu^ ra suficientemente alta a temperaturas a las que la con- ersiôn de equilibrio era aceptable desde un punto de vû ta individual*
Habida cuenta de que la constante de equ^1ibrio viene dada por la ecuaciôn :
Ig K = - 0*93035 Ig T 4. 1*3704 *10"^ T -T
- 1*7581 * 10" ® - 4*1744
la conversiôn de equilibrio (7) en funciôn de la tempera tura para una relaciôn estequiométrica CIH/Og indica que la mâxima conversiôn de cloruro de hidrôgeno teoricamente alcanzàble, disminuye râpidamente al aumentar la tempera^ tura, como puede apreciarse en la figura 2*1 (85% a 5OOQC, 66% a 45OQC, 5896 a 550ûC)*
A este efecto negative de la temperatura sobre la conversiôn de cloruro de hidrôgeno hay que su—

10
mar los inconvenientes derivados de la temperatura a la que Deacon se vi6 forzado a operar (450r550@C) para que la velocidad de reacciôn fuera adecuada. Entre ellos se pueden destacar :
a#- El componente active del catalizador, cloruro de cobre, muestra una marcada tendencia a la sublimaciôn a temperaturas superiores a 4000C* Por este motive, las pér didas de catalizador son Importantes y la vida del mismo se acorta notablemente.
Actualmente, se han propuesto soluciones ga ra disminuir la volatilidad de esta sal por adiciôn de c ^ ruros de metales alcalines (sodio y potasio fundamentalmen te) (8),
b.- La exotermicidad de la reacciôn de cloraciôn di— ficulta el control de la temperatura, dando lugar a puntos calientes en los que la volatilizaciôn adicional del catalizador y la formaciôn de productos indeseables empeoran las cenversiones alcan&adas.
En este sentido, la posterior utilizaciôn de lechos cataliticos fluidizados (1) (9)« ha mejorado nota - blemente el comportamiento del sistema#
c.- La corrosividad del sistema crece al hacerlo la temperatura, por lo que el équipé résulta mâs costoso y la técnica de trabajo mâs compleja.
Por otro lado y aunque la estequiometrla de la reacciôn indica que un aumento de prèsiôn debe despla — zarla hacia el segundo miembro, en la prâctica este efecto

es sumamente reducido (!)• Tampoco parece afectar sens! - blemente al comportamiento del sistema la sustituciôn del aire por el oxlgeno o aire enriquecido (l) (10).
El proceso Deacon fue utilizado comercialmente en el pasado, cuando la fabricaciôn de sosa por el método Le Blanc facilitaba grandes cantidades de cloruro de hi - drôgeno subproducto# S in embargo, el desarrollo del proce^ so electrolltico motivô su posterior abandono.
Diversos autores (l) (il) (12), han estu - diado las variables que afectan a la velocidad de reacciôn del proceso Deacon asi como el mecanismo a través'del cual el cloruro de cobre ejerce su acciôn catalitica (I3) (l4)(15) (16).
Las numerosas patentes y trabajos de inve^ tigaciôn aparecidos desde I9OO que tratan de mejorar el proceso propuesto por Deacon, son quizâs el mejor exponen te de los problemas y dificultades que entrana la aplica- ciôn industrial de este proceso.
Como se ve, el desarrollo industrial del proceso Deacon, tanto técnica como econômicamente, ha de supeditarse al descubrimiento de nuevos catalizadores que proporcionen elevadas velocidades de reacciôn a menores temperaturas que las utilizadas inicialmente.
II.- La utilizaciôn de cloruro de hidrôgeno y aire (oxlgeno) como mezcla dorante de un hidrocar)3uro, consti tuye la segunda posibilidad de recuperaciôn del exceso d cloruro de hidrôgeno, subproducto de las reacciones d

12
cloraciôn. La gran importancia adquirida por estos procesos y sus peculiares caracterlsticas, ha motivado la den£ minaciôn propia de procesos de oxicloraciôn.
En ellos, el hidrocarburo entra a formar parte de la alimentaciôn con los reaccionantes del proceso propuesto por Deacon. El sistema pues, puede represen- tarse por la siguiente ecuaciôn :
RH 4. CIH 4. 1/2 Og = * R-Cl 4- HgO
Las primeras comunicaciones sobre la utili zaciôn de este procedimiento de cloraciôn se remontan a los anos 1919-1926 (1?) (l8) (19), en los que se menciona la cloraciôn de benceno a clorobenceno, de etileno a di - cloroetano y de metano a clorometanos.
La cloraciôn oxidativa del benceno ha dado lugar al proceso Raschig, via fenol (20), mientras que la oxicloraciôn del etileno ha permitido la producciôn indu^ trial de dicloroetano (21).
La reacciôn de oxicloraciôn de metano, conocida ya en 1921 (22), ha sido objeto de numerosos estudios y publicaciones (23) (24) (2$). A pesar de todo, si- guen surgiendo problemas de tipo tecnolôgico a la hora de su realizaciôn prâctica. El motivo de estas dificultades reside fundamentaImente en el hecho de que 1^ temperatura de oxicloraciôn del hidrocarburo inferior (metano), resul^ ta mâs elevada que en el caso de benceno o etileno y en les circunstancias, las reacciones secundaria* de combus-

13
tion del hidrocarburo, implican un peor control del proce^ so y una tecnologia mas dificultosa.
Los catalizadores mâs comunmente empleados ejs tân formados por cloruros de metales en estados de oxidaciôn variables y ocasionalmente ôxidos. Figuran como mâs importantes los cloruros de cobre, metales alcalinos, hie rro, tierras raras, antimonio, vanadio, molibdeno, teluro y titanio (26) (2?) (28) (29) (30) (31).
Meissner y Tliode (23) y Topchiev y Krent - sel (32) operando con un catalizador constituldo por cloruro cûprico soportado sobre piedra pômez, indican haber conseguido una elevada conversiôn de metano, a costa de transformer un 40 - 30% del hidrocarburo total alimentado en monôxido y diôxido de carbono# Otros autores sugieren el uso de catalizadores a base de silicato cûprico lecho fluidizado (33), la diluciôn del catalizador con un sôlido inerte (34) u operar con catalizadores constitul - dos por mezclas de sales metâlicas en estado fundido (24). Un modo particular de efectuar la reacciôn de oxiclora - ciôn consiste en oxidar en una primera etapa un catalizador de cloruro cuproso a cûprico mediante oxlgeno y cloru ro de hidrôgeno y, posteriormente, hacerlo reaccionar con el hidrocarburo (35).
De lo anteriormente expuesto se deduce que la
oxicloraciôn de metano,que puede esquematizarse por el siguiente sistema de reacciones consecutivas (36) •

14
CH^ * CIH * 1/2 Og = r CHjCl * HgO /\H°gg=-37.4
CHjCl * CIH 4. 1/2 O g = CHgClg 4 HgO AH° g=-47.6 "
CHgClg 4 CIH 4 1/2 O g = CHCl^ 4 HgO ÛH® g=-25.7 "
CHCl 4 CIH 1 1/2 Og 3=^ CCl^ 4 HgO ^g^g=-39.8 "
se vera afectada por los mismos problemas surgidos para el proceso Deacon. De las numerosas publlcaciones que so bre este tema han aparecido en les ultimes anos, cabe de^ tacar las que estudian la velocidad de oxicloracion de me tano en funciôn de la velocidad de oxidaciôn del cloruro de hidrogeno a clore (37) (38) y las que tratan de ex - plicar la distribuciôn de clorometanos en funei6n del gra do de cloraciôn (39) (40) (4l) (42) (43).
Respecte a este ultime punto parece ser, segûn se desprende de la bibliografia existante, que la distribuci&n de clorometanos es fija para un grade de clo raciôn determinado, independientemente del sistema catall tico o de reacci&n utilizado para conseguirlo. Esta cir - cunstancia ha movido el interês de ciertos autores (43a) (43b) por establecer un modèle matemâtico capaz de repro- ducir esta particular caracteristica del proceso de oxi - cloraciôn de metano.
De todas formas el compromise, al igual que en el proceso Deacon, queda pues centrado en el descubri-

15
miento y desarrollo de nuevos catalizadores de oxiclora — cion que proporcionen elevadas conversibnes y eliminen la necesidad de utilizer las elevadas temperatures de trabajo actuales y sus indeseables efectos#
2.1.- SITUACIQN ACTUAL PE LOS CLOROMETANOS
El interés mostrado en los ûltimos anos por el desarrollo tecnolôgico de la oxicloraciôn de metano es- tk basado sin duda en el continue crecimiento de la produ£ ci6n de clorometanos y los innumerables uses y aplicacio - nés a que se destinan.
En la figura 2.2. se représenta la produc - ciôn de clorometanos en Estados Unidos (4?) a partir de 1940 y en la tabla 2.1 sus principales uses y aplicacionea derivados de las propiedades fisicas y quimicas que presen tan (44) (45).
- Cloruro de metilo (monoclorometano) (CH^Cl)
A temperatura y presiôn ordinarias es un gas de olor etéreo, no irritante y sabor dulce. Comercial- mente se maneja licuado. El liquide es miscible con los principales disolventes orgânicos y s6lo ligeramente soluble en agua. Cuando estâ seco el liquide es estable y no corrosive pero en presencia de impurezas se descompone len
tamente Uegando a ser corrosivo para los metales, partlcu

Tm / ano600
CliC
500
400
300Cl.CH
CICH200
Cl^CH
100
i9601950 1970
FIGURA 2.2

TABLA 2.1
CLOROMETANOS
USOS Y APLICACIONES
- CLORURO DE METILO %
Siliconas 40Tetrametil-plorao 36Fibras butilicas 4Metil Celulosa 4Herbicidas 4Aminas Cuaternarias 3Otros USOS 9
- CLORURO DE METILENO %
Quitaesmaltes 32Preparaciôn de aerosoloes 20Desengrasantes 10Plâsticos 10Otros USOS 28
- CLOROFORMO %
Réfrigérantes y propelentes 60Resinas 19Otros USOS 21
- TETRACLORURO DE CARBONO %
Réfrigérantes y aerosoles 80Otros USOS 20

18
larmente para e], aluminio, zinc y magnesio. En estado ga- seoso es moderadamente inflamable y puede producir series efectos tôxicos por prolongada exposiciôn a concentracio- nes elevadas.
En Espana (46) (4?) la produceion es esta- cionaria desde I963 (350 Tm/ano), pero el consume crecien te motiva que cada vez sean mâs elevadas las importacio - nes.
Los precios actuales para el cloruro de me tile (45) (46) (4?) (48) son en Estados Unidos y Espana de 240 d6lares/Tm. y 35*000 pts/Tm. respectivamente. Esta gran diferencia es debida sin duda a la menor capacidad de producci6n de la industria espanola y la tqcnologia em pleada.
Actualmente existen dos procesps fundamen- tales con algunas variantes cada uno para la fabricaciôn de clorubo de metilo (44) (48) ;
1.- Hidrocloraciôn de metanol.2.- Cloraciôn de metano.
El primero, mâs antiguo, proporciona como ûni- co producto cloruro de metilo, con rendimientos prôximos al 95%; mientras en el segundo se obtienen simultâneamen- te los cuatro clorometanos, con un reparto variable entre el 100% de cloruro de metilo y tetracloruro de carbono co mo ûnico producto final, en funciôn del grado medio de cloraciôn.
El hecho de que se utilicen simultôneamen-

iv
te ambos procedimientos puede deberse a que si bien el tano, como materia prima, résulta mucho mâs barato que el metanol, el cloro empleado en el segundo proceso résulta mâs caro que el cloruro de hidrogeno necesario para el primero. Por otro lado las instalaciones actuales basadas en la hidrocloraciôn de metanol son tan numerosas que la inercia a cambiar de procedimiento résulta considerable. Baste decir que en Estados Unidos el 92% se produce por el procedimiento mâs antiguo. En Espana actualmente, la obtenciôn de cloruro de metilo se realiza exclusivamente via metanol•
- Cloruro de metileno (diclorometano) (CH^Clg)
Es un liquide incolore, pesado y muy fluide, con un agradable olor a ôter. Es el menos tôxico de los clorometanos (49)# Sus excelentes propiedades como d^ solvents constituyen la base principal de sus aplicacio- nes industriales. El cloruro de metileno es prâcticamente ininflamable (pero es capaz de formar mezclas explosivas con aire u oxlgeno, en ciertas condiciones)• Es una de las cloroparafinas mâs astables, no mostrando sehales de descomposiciôn ni con la presencia del agua ni con los m^ taies, incluse por encima de su punto de ebulliciôn; el cloruro de metileno comercial, sin embargo, frecuentemen- te contiens pequenas cantidades de aditivos estabilizado- res.
La produceiôn de cloruro de metileno en Es

20
tados Unidos (48) comenzô en 1944 con 3,800 Tm, estando prevista para 1975 una producciôn de mâs de 270,000 Tm. La producciôn espanola se iniciô en 1973, situândose en la actualidad en unas 8.000 Tm/ ano.
Los precios del mercado interior (45) (46) (4?) (48) son para Estados Unidos y Espana de 330 dôlares la tonelada y 30.000 pts/Tm. respectivamente (Abril 1975)
Aunque existen otros procedimientos de fabricaciôn de menor entidad se puede decir que, prâctica - mente, todo el cloruro de metileno se obtiens por clora - ciôn directa de metano, produciéndose, como en el caso del cloruro de metilo, los cuatro clorometanos simultânea mente.
- Cloroformo (triclorometano) (CHCl^)
En condiciones ordinarias es un liquide de aspecto acuoso, pesado, volatil, no irritante y de olor agradable. No es inflamable, pero mezclado con alcohol y en estado de vapor arde con llama de color verdoso. Es me nos estable que los dos clorometanos inferiorps y se descompone a temperatura ordinaria con luz solar y en ausen- cia de aire o en la oscuridad en presencia del mismo. El fosgeno es uno de los productos de su descomposiciôn oxi- dativa.
Entre las aplicaciones ya indicadas para el cloroformo, se pueden citar ademâs, las que lo utili- %an como agente de extracciôn y purificaciôn de penicili^

na y otros antibiôticos, asi como el empleo como materia prima en la fabricaciôn de drogas y pesticidas.
En Espana la producciôn, recientemente ampli ada , ascenderâ a 4.000 Tm. en 1975 (46) (47).
El mercado interior en Estados Unidos y Ejs pana présenta para el cloroformo, unos precios de 330 dô- lares/Tm, y 28.000 pts/Tm. respectivamente.
Aunque la principal via de fabricaciôn es la cloraciôn del metano, es en el ûnico de los cuatro clorometanos en que la.oxicloraciôn tiene.alguna aplicaciôn ini cial (en Estados Unidos).
- Tetracloruro de carbono (Tetraclorometano) (CCl^)
Es un liquido incoloro, pesado y de un olor caracteristico, no irritante. Sus vapores en contacte con una llama o una superficie muy caliente se descomponen, dando productos como el fosgeno de toxicidad sobradamente conocida. El 92% de su peso molecular es debido al cloro. Es el mâs tôxico de los clorometanos y el mâs sensible a la oxidaciôn térmica, por lo que el producto comercial va casi siempre acompanado de estabilizadores• De entre sus propiedades (44) (45) se puede destacar la qu^ lo caracte^ riza como un poderoso disolvente de asfaltos, résinas, b^ tûmenes, fibras, gomas, etc. y otros productos similares.
El tetracloruro de carbono supera en cuan- to a producciôn a los otros très clorometanos en conjun - to, siendo prévisible en Estados Unidos una producciôn de

22
unas 600.000 Tm. (1975)# En Espana se producirân (46) (47) en 1975, unas 25.000 Tm.
El precio comercial es de 225 dôlares/Tm .en Estados Unidos y de 16.000 pts/Tm. en Espana (45) (46)(47) (48).
Aunque el 80% de la producciôn mundial se destina a la fabricaciôn de liquides réfrigérantes y aerosoles , encuentra también aplicaciones como extintor de fuegos, agente de limpieza, disolvente y agente fumigante.
La mayor parte se produce por cloraciôn directa de metano, junto con los otros très clorometanos. El reste se obtiene por cloraciôn de disulfuro de carbono y en menor proporciôn, como coproducto en la cloraciôn térm^ ca de hidrocarburos para la obtenciôn de percloroetileno.
2.2.- MATERIAS PRIMAS
- Metano
El metano es quizâs el hidrocarburo mâs abundan- te de la naturaleza. Se encuentra formando parte del gas natural, del que représenta aproximadamente el 80-90% en volumen.
A pesar de ser una importante n^ateria prima base de la producciôn de metanol y sus derivados, encuen - tra su principal aplicaciôn como combustible. Sus propie - dades fisicas hacen de esta sustancia fôsil, no tôxica y de

llama limpia no contaminante, un combustible muy ventajo- so en cualquier proceso industrial, pues permite una uti- lizacion mâs racional de la energla y , en las operaciones a fuego directo (procesos cerâmicos, metalûrgicos, etc.), una mejora en la calidad del producto final obtenido.
Su consumo ha experimentado tal creci - miento en los ûltimos anos, como puede apreciarse en la tabla 2.2 , que en la actualidad cubre aproximadamente el 30% de las necesidades energéticas mundiales.
TABLA 2.2
CONSUMO DE METANO EN MILLONES DE M^ POR ASO
AREAS DE CONSUMO 1968 1970 1975 1980Estados Unidos 563170 665050 817870 962200URRS y P. del Este 203081 236645 344637 449319Oeste de Europa 40978 77882 143764 203675Amêrica Latina 33620 53912 59911 107823Canadâ 21678 24310 33168 38431Asia del Pacifico 8971 10782 25753 44912Africa 7783 8971 12565 17971
TOTAL 879281 1077552 1437.668 1824331
Esta circunstancia ha motivado la bûs -. queda y descubrimiento de nuevas réservas de gas natural, asi como la producciôn industrial de metano. De entre los procesos de obtenciôn de metano por via qulmica se pueden

24
destacar el reformado con vapor, el craqueo, hidrocraqueo y la plrôlisis de hidrocarburos parafihicos de bajo peso molecular. No obstante su producciôn industrial va en fun ciôn de las réservas naturales de cada pais.
En Espana el gas natural se importa en sumayoria de Libia en condiciones ventajosas, existiendo unpequeno yacimiento en la provincia de Alava. A pesar detodo,su consumo es tan importante que ya existe producciônde metano sintético, siendo de destacar la llevada a caboen el complejo industrial de la zona franca del puerto deBarcelona que ocupa, como dato significativo, una exten -
2siôn aproximada de 200.000 m .Pese a no disponer de datos de precio de
mercado actualizados se puede afirmar que la utilizaciôn de un combustible clâsico como materia prima quimica, r<B sultarâ siempre ventajosa.
- Cloro
El cloro estâ considerado en la actuali - dad como uno de los productos inôrgânicos mâs importan - tes en cuanto al crecimiento de su producciôi%. Este hecho es sin duda debido al aumento de la demanda de pro - ductos organoclorados, ya que aproximadamente el 70% de la producciôn mundial de cloro se emplea para tal fin.
En la tabla 2.3 se indica la producciôn de cloro en diverses paises asi como la de Espana que estâ cifrada en unas 400.000 Tm. para 1975#

25
TABLA 2.3
PRODUCCION DE CLORO EN MILES DE TM/AfîO
i960 1965 1970 1975E.E.U.U. 4033 5876 8856 (10000)Alemania 658 1081 1726 (2600)Francia 331 588 1027 (1500)Italia 287 581 829 (1200)Espana 35 78 174 (400)
Este aumento de producciôn ha venido acompana-do de un crecimiento del precio de cloro liquido , como sepuede ver en la tabla 2.4
TABLA 2.4
PRECIO INTERIOR DEL CLORO (POR TM)' 1965 1970 1975
E.E.U.U. (*) 76 82 (137)Italia (Lir.) 4Ô000 50000 (75000)Espana (Pts.) 4750 5000 (5880)
De entre las principales empresas nacio- nales productoras de cloro se pueden destacar: Solvay y Cia., Electroquimica de Flix y Energla e Industrias Ara gonesas, con una capacidad de producciôn que supera el 60% de la total instalada en nuestro pais.

26
- Cloruro de hidrôgeno
En cuanto al cloruro de hidrôgeno se refiere, el hecho de que se obtenga como subproducto de las numerosas industrias de cloraciôn, hace que tanto su precio como su producciôn estên sujetos a variaciones no concor dantes con su utilizaciôn como materia prima#
Por otra parte y dado que su forma comercial mâs frecuente es la de âcido clorhidrico de distintas ca lidades, no se pueden indicar datos significativos de su valor como especie quimica cloruro de hidrôgeno. Unica - mente es de destacar que el cloruro de hidrôgeno, en estado gaseoso o como âcido clorhidrico, es un gran exce - dente de la industria quimica mundial, caracterizado como tal por su bajo precio.
2.3.- OBJETO Y ALCANCE DE LA PRESENTE INVESTIGACION
A la vista de lo que antecede cabe plantear las siguientes consideraciones :
- Laf propiedades fisicas y quimicas de los cloro metanos y sus innumerables aplicaciones como taies o co mo materias primas de derivados organocloradof mâs comple jos, los sitùan como compuestos de gran utilidad.
El acentuado crecimiento de s^ producciôn y las constantes ampliaciones industriales realizad^s tanto a

27
nivel nacional como mundial, son un claro exponente del in terés que los clorometanos han alcanzado en la actualidad. (Sirva como ejemplo que sobre una producciôn nacional de 25*000 Tm. de tetracloruro de carbono en 1975, estân ya previstas ampliaciones adicionales de unas 13*000 Tm/ano).
- El constante aumento del precio del cloro a pesar de su creciente producciôn y los grandes excedentes de cl^ ruro de hidrôgeno, estân provocando un desplazamiento pro- gresivo hacia la utilizaciôn de este ultimo como agente de cloraciôn (procesos de oxicloraciôn).
- Pese a las indudables ventajas de los procesos de oxicloraciôn sobre la cloraciôn directa y a los numerosos estudios que sobre ellos se han realizado, todavla no se dispone de todos los datos que fuera de desear a la hora de su realizaciôn prâctica. Por otra parte, de las investi^ gaciones realizadas hasta el momento, las que no estân pro tegidas por patentes muestran ùnicamente aspectos parcia - les del proceso global de oxicloraciôn.
- ^1 carâcter exotérmico de la reacciôn y las elevadas temperatures de trabajo en el proceso concreto de oxicloraciôn de metano, crean serios inconvenientes en cuan - to a la estabilidad de los catalizadores utilizados.
Con estas premisas de base se planteô la in vestigaciôn para cubrir las siguientes etapas :
1.- Diseno y montaje de un reactor integral de lecho catalltico fluidizado donde llevar a cabo la expérimenta -

20
ciôn.
2.- Establecimiento de métodos analiticos adecua - dos para los productos manejados.
3.- Preparaciôn y optimaciôn de un catalizador de oxicloraciôn.
4.- Estudio de la actividad del catalizador de oxi cloraciôn en funciôn del tiempo de utilizaciôn.
5.- ^elecciôn de los intervalos mâs adecuados para las distintas variables.
6.- Obtenciôn de datos cinéticos para el sistemacatalitico utilizado, con los que deducir ecuaciones de velocidad de la reacciôn de oxidaciôn de cloruro de hi - drôgeno a cloro.
7.- Selecciôn de un campo de valores adecuado pa - ra las distintas variables y estudio en el mismo del pro ceso de oxicloraciôn de metano por el método de optima - ciôn de Box-Wilson.
8.- Obtenciôn de datos cinéticos para el procesode oxicloraciôn de metano con miras a esclareçer el me - canismo de la reacciôn y tratar de deducir ecuaciones de velocidad utiles para el diseno de los reactores donde poder desarrollar el proceso.

3.- INSTALAClüN
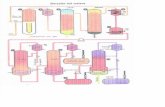
La Instalaciôn utllizada en la présente in vestigaciôn estâ esquematizada en el diagrama de flujo de la figura 3.1. Consta de las siguientes partes :
- Reactor.- Sistema de alimentaciôn de reaccionantes•
- Sistema de recogida y tratamiento de productos.
- Instalaciôn elôctrica.
3.1.- REACTOR
Los experimentos se han realizado en un reactor integral de lecho catalitico fluidizado, 1. Estâ consti - tuido por un tubo cilindrico de vidrio pyrex, en cuya par te inferior lleva soldada una plaça de vidrio sinterizado poroso, con la doble misiôn de servir de soporte al catalizador y homogeneizar la mezcla gaseosa de reaccionantes,
La parte superior del mismo se ensancha (separador, 6) para evitar el arrastre de las pequenas partîculas producidas por abrasiôn del catalizador al di^ minuir la velocidad de la corriente gaseosa efluente. La misma estâ provista de una uniôn esmerilada para la carga

! ! ®-l iHg»
.1A " CM
<
cH-u.
— 0
- 0
— 0 -0 — 0
H § )
Hi)H i )
u>

31
y descarga del reactor, que permite ademâs la introducei6n de una sonda termométrica, alojada en uïia vaina de vidrio que se prolonge axialmente hasta la parte superior de la plaça de vidrio poroso en el seno del lecho catalitico.
Los accesos al reactor, asi como los del pr^ mezclador de reaccionantes, 2 representado eh la parte inferior de la figura 3.1 van provistos de los mécanismes de uni6n necesarios para su adecuado ensamblaje con los demâs elementos de la instalaciôn.
En el apéndice 9*1 se indican otros data - lies de menor importancia.
3.2.- SISTEMA DE ALIMENTACION DE REACCIONANTES
3.2.1.- ALIMENTACION DE METANO
El metano procédé de un envase metâlico, 42en el que se encuentra como gas a 10.000 - 14.000 KN/ m
de presiôn. ^sta se reduce a la salida del mismo medianteun monoreductor de una etapa, manteniêndose ep un valor de 150 KN/m • Su caudal se régula mediante una v^lvula de agu ja y a continuaciôn se mide con un diafragma de acero ino- xidable de diseno propio, adecuadamente conectado a un ma- nômetro diferencial. Pinalmente el metano se lleva mediante una conducciôn hasta el premezclador de raaccionantes adaptable a la base del reactor.

32
3.2,2.- ALIMENTACION DE AIRE
El aire, contenido en un envase metâlico, 3 2a 15.000 - 20.000 KN/m , es alimentado por el procedimien-
tb descrito en el apartado anterior y sometido a las mis - mas operaciones de regulaciôn y medida de caudal antes de su llegada al premezclador.
3.2.3.- ALIMENTACION DE CLORURO DE HIDROGENO
El cloruro de hidrôgeno gaseoso se obtiene por desplazamiento con âcido sulfûrico concentrado de su disoluciôn acuosa saturada en el generador, 3 esquematiza do en la figura 3.2.
Los âcidos clorhidrico y sulfûrico estân almacenados en sendos matraces A y B de 2 y 3 litres de capacidad, descargando su contenido por acciôn de la gra vedad al matraz de desplazamiento C en una proporciôn aproximada de 3 gotas de âcido sulfûrico por cada dos de âcido clorhidrico. La dosificaciôn se consigne con la ayuda de las vâlvulas de teflôn 1 y 2 a la salida de los matraces almacén. La presiôn ejercida por el cloruro de hidrôgeno generado en el matraz C se transmite por el conducto D a la parte superior de los matraces A y B, con lo que se posibilita su descarga por acciôn de la grave- dad.
El cloruro de hidrôgeno gaseoso abandons

g< a:
Li
0-
0 -0
r i - 9 . _ _ H *—f ...
m TU- ■..... M ------- — :
dK\

3^
el matraz C por el conducto E y se seca en contracorriente con el âcido sulfûrico alimento. Para aumentar la eficacia de esta operaciôn, se dispone de un lecho F relleno de anillos Fenske de vidrio que proporcionan una elevada superficie de contacte* El resto de la humedad se élimina ha ciendo atravesar la corriente principal de cloruro de hi - drôgeno dos lechos G y H rellenos de silice impregnada con cloruro de cobaltô como indicador de hidrataciôn.
El caudal de la corriente gaseosa de cloruro de hidrôgeno seco se régula con una vâlvula de aguja, 3 y, después de conocer su presiôn y temperatura, se mide con un rotâmetro y un diafragma de vidrio instalados entre dos recipientes de gran volumen I, J que amortiguan las fluc - tuaciones de presiôn producidas por el burbujeo del exceso de cloruro de hidrôgeno en los recipientes K y L*
El cloruro de hidrôgeno sobrante, tras atravesar los burbujeadores K, L, de 1 m. de longitud cada uno, que contienen âcido sulfûrico concentrado, sé di- suelve en âcido clorhidrico diluido contenido en el reci- piente G# Con esto se consigne por un lado mantener la presiôn en un valor constante y suficientemente elevado como para que el cloruro de hidrôgeno pase al reactor y
por otro, recuperar el cloruro de hidrôgeno sobrante*
Tanto los gases rcsiduales proçedentes del reactor, como el cloruro de hidrôgeno no retenido en el recipiente G, se eliminan por diluciôn con agua en una trompa de vacio Ho, on su defecto y eventualmente, me-

35
diante un extractor eléctrico I, asegurândose asl, en todo momento, unas adecuadas condiciones ambientales de tra bajo.
3.5.- TRATAMIENTO PE PRODUCTOS
Se distinguirân dos tipos de tratamientos en funciôn del tipo de experimentos realizados*
3.3.!•- PRODUCTOS DE OXIDACION DE CLORURO DE HIDROGENO
En los experimentos realizados con motivo de la selecciôn y optimaciôn del catalizador de oxiclora ciôn y del estudio cinético del proceso Deacon, la mez - cla gaseosa efluente del reactor, constituida fundamen - talmente por cloro, cloruro de hidrôgeno, oicigeno y ni - trôgeno, se somete al siguiente tratamiento.
Una vez abandonado el sistema de reacciôn se hace atravesar très bubbujeadores en serie que conti^ nen unos 100 - I30 cm^ de disoluciôn de hidrôxido sôdico de una concentraciôn aproximada de 200 gr/lt. En ellos se retienen cuantitativamente el cloruro de hidrôgeno y cloro.

36
3.3.2.- PRODUCTOS DE OXICLORACION DE METANO
La corriente gaseosa obtenida en los experimentos de cloraciôn de metano, constituida por los cuatro clorometanos, metano no reaccionado, cloro, cloruro de hidrôgeno, oxigeno, nitrôgeno, vapor de agua y diôxido de carbono, se somete a su vez a las siguientes operaciones :
A la salida del reactor se hace atravesar un sistema de seis burbujeadores en serie, conteniendo agua los très primeros y una disoluciôn saturada de sulf^ to sôdico los restantes, ^n el agua se queda retenido cuan titativamente el cloruro de hidrôgeno asi como una parte del cloro producido y en el sulfito, todo el cloro no retenido anteriormente.
Los compuestos orgânicos, debido a su vola tilidad • y baja solubilidad en agua, permanecen en la C£ rriente gaseosa principal. Con motivo de que el anâlisis cromatogrâfico a que se someten, descrito ampliamente en el apéndice 9.2, implica la introducciôn al cromatôgrafo, 10 figura 3*1 de un volumen fijo de muestra por medio de una vâlvula de inyecciôn de gases, la masa de muestra in- yectada depende en gran manera de las condiciones de presiôn y temperatura de la corriente gaseosa principal. La presurizaciôn y termostalizaciôn a que se somete esta co rriente gaseosa asegura, no sôlo unos valores adecuados de presiôn y temperatura , sino también, la circulaciÔn de la

37
muestra gaseosa por el sistema de inyecciôn y el evitar la condensaclôn de los productos gaseosos de mâs alto pun to de ebulliciôn (agua y tetracloruro de carbono funda - mentalmente)#
Con este motivo y tal como se indica en la figura 3.5 sobre la conducciôn por la que circula se arro lia una resistencia elôctrica que los mantiene a una temperatura de la que importa no tanto su constancia sino , fundamentalmente, su conocimiento. Este se consigue m e diante la lectura del termômetro T instalado a la salida del sistema de inyecciôn.
La presurizaciôn por su parte, se efectûa haciendo pasar parte de la corriente gaseosa, efluente del tren de recogida de productos, por un burbujeador con mercurio B, de altura regulable, en el que se provoca la sobrepresiôn necesaria para la circulaciôn de la muestra por el'sistema de inyecciôn. Mediante el rotâmetro F de la figura se aprecia êsta cualitativa y cuantitativamente. La presiôn se mide con un manômetro de columna de agua M y después de reunir nuevamente las dos corrien - tes gaseosas, se détermina su caudal en un medidor de pompa de jabôn P.
3.3.3.- SISTEMA DE ELIMINACION DE EFLUENTES
La toxicidad de los productos manejados , debida fundamentalmente al cloro, cloruro de hidrôgeno y

K\
<aa

39
clorometanos« motivé la instalacién de un sistema adecua- do de eliminaciôn de efluentes (11, figura 3.1).
Como ya se ha indicado, consiste fundamen- talmente en el barrido con aire del exceso de cloruro de hidrôgeno producido en el generador y de los productos de reacciôn, provocado éste por la succiôn de una trompa de vacio de agua, en la que ademâs se consigue su disolucion y una diluciôn adicional, o por un sistema de extracciôn eléctrico, montado con tal fin*
3.4.^ INSTALACION ELECTRICA
Lq instalaciôn eléctrica utilizada (9« figura 3.1) se pue^e considérer dividida en dos partes fundament al es :
a.- Sistema de calefacciôn del reactor.b.- Sistemas auxiliares de calefacciôn y de medida
y control de la temperature.
a.- El sistema de calefacciôn del reactor copsta de cua- tro pares de resistencias de 40 cada uno, de hilo Kan- thal arrollado sobre ocho barras cerâmicas roscadas, si - tuadas alrededor del mismo y paralelamente a él. Todo el conjunto se encuentra rodeado por una camisa cilindrica de vidrio pyrex que évita en parte las pérdidas de calor por conduceiôn - convecciôn, a su vez protegida por dos pantallas curvadas longitudinalmente, de chape de alumi-

40
nio, concéntricas con ella para disminuir las pérdidas de calor por radiaciôn. Tanto el reactor cbmo las resisten - cias, camisa y pantallas se encuentran soportadas por sen dos cabezales de calorit, en forma de corona circular, con centrions y ensamblados unos con otros. Las resistencias pueden conectarse de diverses maneras, desde el panel de mando de la instalaciôn con objeto de variar su resisten- cia total y con ella, la potencia eléctrica aplicada al reactor.
b.- El control de temperature se efectûa ûnicamente so - bre el reactor por medio de un controlador electromecâni- co de acciôn todo-nada que ejerce su funeiôn a través de un contactor electromagnético, mas apto para soportar las chispas de ruptura en el cambio de circuito de calefacciôn de alta al de minima. Como elemento sensible utiliza una resistencia termométrica de Pt-W, situada en el lecho ca talltico.
La calefacciôn de ciertas partes de la in^ talaciôn como el premezclador de reaccionanteg, el sépara dor, los accesos al cromatôgrafo, etc., se efectûa por medio de resistencias arrolladas directamente sobre la zo na correspondiente y conectadas convenientemente a un au- totransformador de salidas multiples de 2.5 KW con sali- das escalonadas de 5 eu 5 voltios entre 0 y 220. No se ejerce regulaciôn de temperatura sobre estas zonas ya que ûnicamente se requiere una temperatura suficientementeelevada con fines de precalefacciôn o para ev$tar conden-

4l
saciones.Sobre ciertos puntos singulares de la ins
talaciôn como el reactor, el premezclador y el separador, se efectûa un registre de temperatura en un aparato Fisher and Porter, modelo N-PELEMTC-8.


4.- PROCEDIMIENTO
Puesto que en la realizaciôn de la pre - sente investigaciôn se han realizado dos tipos distin - tos de experimentos, el planteamlento y desarrollo de cada unô de ellos se considerarâ separadamente*
4.1.- PLANTEAMIENTO DE UN EXPERIMENTO
4.1.1.- OXIDACION DE CLORURO DE HIDROGENO A CLORO
En cada experimento de selecciôn del ca- talizador y estudio cinético del proceso Deacon se fija ron las 'siguientes variables :
- Temperatura (t)- Raz6n M/A (M/Al)- Relaciôn molar cloruro de hidrôgeno/aire
(Rml)Presiôn total (P)
Decidida la cantidad de catalifador M, a colocar en el reactor, se calcula a partir de la razôn M/Al seleccionada, el caudal molar de cloruro de hidrôgeno Ng, y con éste y la relaciôn Rml prefijada, el eau dal molar de aire a alimentar.

44
Conocidos los caudales molares del cloruro de hidrôgeno y aire y haciendo uso del calibrado de sus diafragmas medidores, se calculan las diferencias de altu ra manométrica correspoiidientes •
4.1.2.- OXICLOHACTON DE METANO
Tanto en los expérimentes cinéticos del e^ tudio cinético de oxicloraciôn de metano como en los de investigaciôn del proceso de oxicloraciôn por el método de optimaciôn de Box-Wilson, se establecieron como parâm^ tros bâsicos los siguientes :
- Temperatura (t)- Razôn M/A (M/A2)- Relaciôn molar cloruro de hidrôgeno/aire
( Rjnl )- Relaciôn molar cloruro de hidrôgeno/metano
(Rm2)- Presiôn total (P)
Como en el caso anterior, conocida la cantidad de catalizador M, se calcula a partir de la razôn M/A2, el caudal molar, en este caso de metano Conéste y con la relaciôn molar cloruro de hidrôgeno/metano, Rm2, el caudal molar de cloruro de hidrôgeno, y, apartir de él y la relaciôn molar Rml, el caudal molar de aire alimente.
Asl mismo, los calibrados de los diafrag —

45
mas correspondientes proporcionan los valores de las dif^ rencias de altura manométrica para cada uho de los tres reajc cionantes mencionados.
4.2.- DESARROLLO PE UN EXPERIMENTO
4.2.1.- OXIDACION DE CLORURO DE HIDROGENO A CLORO
Una vez pesada exactamente la cantidad de ca talizador se introduce en el reactor por su parte superior.A continuaciôn se aloja la sonda termométrica en el mismo , conectândola adecuadamente y se comienza a producir cloruro de hidrôgeno en el generador representado en la figura 5.2. Cuando el generador alcanza su mâximo valor de presiôn, se comienza su alimentaciôn al reactor, regulando el caudal con la vôlvula de aguja correspondiente. Agi mismo, se abre la vâlvula de*la botella de aire, regulando su presiôn median- te el monorreductor de que va provista, y su caudal median- te la vâlvula de aguja del aire. Acto seguido se conectan todos los circuitos eléctricos de calefacciôn, asl como los dispositivos de medida registre y control de la temperatura, con los valores de consigna correctamente establecidos.
Cuando el controlador de temperatura comienza a ejercër su acciôn de regulaciôn, se comprueba que los caudales de los reaccionantes permanecen constantes en los valores previamente seleccionados y, a partir de este mo - mento en que se ha conseguido el régimen estacionario de

46
funcionamiento, se puede comenzar el experimento.Con este motivo se conec'ta el tren de rec£
gida de productos de reacciôn y simultanéamente se dispara el cronômetro que indicarô al final la duraciôn del ex perimento. Durante el desarrollo del mismo ( 50 minutos aproximadamente), se comprueba la constancia de todas las variables, anotando o corrigiendo eventualmente su varia- ciôn y el momento en que se produjo.
Finalizado el experimento se para el cro - nômetro y se retira el tren de colectores, guardando sucontenido y el agua empleada para lavarlo interiormente ,
5en un matraz aforado a 500 cm •Por ultimo se analiza el cloro por iodome-
trîa y los cloruros por potenciometria de precipitaciôn con plata. Los detalles de ambas técnicas analiticas pu^ den verse en el apéndice 9.2.2.
* En cada experimento se miden y anotan losvalores de las siguientes variables :
M - masa de catalizador (gr). t - temperatura del lecho catalitico (oC).^ h - lectura del manômetro diferencial conec- mx
tado al diafragma medidor dereaccionante X (mm. de liquide manométrico)*
P - presiôn a la salida del diafragma medi- pdxdor del reaccionante x (mm. Hg)•
t^ - temperatura del reaccionante x a la salida de su diafragma medidor (oC).

47
Z^p - pérdida de presiôn a través del lecho catalitico (mm. Hg)•
- presiôn atmosférica (mm. Hg).t - temperatura ambiente (oC). a0 - duraciôn del experimento (S).
Los câlculos efectuados con estas magnitudes se especifican en el ejemplo que se incluye en el apén dice 9*3*
4.2.2.- OXICLORACION DE METANO
Considerando como base el planteamiento del apartado anterior, el desarrollo de un experimento de ox^ cloraciôn de metano incluye ademâs las siguientes opera - ciones :
. Una vez alcanzada la temperatura de reac -ciôn seleccionada, se comienza la alimentaciôn de metano regulando y midiendo su caudal de manera similar a la de 16s otros reaccionantes. â pesar de la momentânea eleva - ciôn de temperatura producida por la exotermicidad de la reacciôn de oxicloraciôn de metano, ésta se restablece ra pidamente para alcanzar definitivamente el régimen esta - cionario de funcionamiento del sistema de reaçciôn.
La realizaciôn y duraciôn de c*da experi - mento es similar a la descrita en el apartado anterior si bien el anâlisis de clorometanos por cromatografia en fa-

48
se gaseosa introduce una diferencia fundamental,El anâlisis de los clorometanos y del me -
tano no reaccionado se realiza durante cada experimento • Con este motivo y tal como se ha indicado en el apartado5.5.2, la mezcla gaseosa que los contiens se termostatiza y presuriza, realizando sucesivas inyecciones hasta con- seguir una constancia en la respuesta del cromatôgrafo. Acto seguido se procédé a finalizar el experimento de la manera ya indicada.
Unicamente es de destacar que el contenido de los dos trenes de recogida de productos se guarda sep^ radamente en dos matraces, aforados a 250 cm^ cada uno , (apartado 5*3*2.) y se analiza por el procedimiento des - crito en el apéndice 9.2.2.
En los experimentos de oxicloraciôn, ade - mâs de las variables indicadas en el apartado anterior,se anotan los valores de las siguientes :
Z\h Lectura del manômetro diferencial cone£GO
tado al diafragma medidor de metano (mm, de liquide manométrico).
- presiôn a la salida del diafragma de rajeCO tano (mm, Hg),
t - temperatura a la salida del diafragmaCOmedidor de metano (QC).
A p - presiôn de alimentaciôn de productos alcromatôgrafo (mm. Hg).
t^ - temperatura de los productos gaseosos

%
49
efluentes del cromatôgrafo (oC).- caudal volumétrico de la mezcla efluen-
te del reactor a P y t (cm^/S).R - rango de medida del pico cromatogrâfico
del producto x.At - atenuaciôn de medida del pico cromato -X
grafico del producto x#


5*- RESULTADOS EXPERIMENTALES
La presentaciôn de resultados se desarro - lia con los siguientes conceptos y nomenclature, mâs am - pliamente detallados en el apartado correspondiente a NO- MENCLATURA,
- Apartados 5*1 y 5«2
M : masa de catalizador empleada (gr)Al : caudal molar de cloruro,de hidrôgeno ali -
mentado (moles gr/hr) t : temperatura (o c )
Rendimiento : âtomos gramo de cloro producidos / 100 moles gramo de cloruro de hidrôgeno alimenta do*
Rml : relaciôn molar cloruro de hidrôgeno / aire: caudal molar total de reaccionantes (mmol/s): moles de cloruro de hidrôgeno transforma - dos en el producto x / mol de cloruro de hidrôgeno alimentado, pudiendo ser x :
H ; cloruro de hidrôgeno Clg : cloro
Ng : caudal molar de cloruro de hidrôgeno ali - mentado*

52
- Apartados 5«3 y 5*4
M : masa de catalizador (gr)A2 : caudal molar de metano alimentado (moles-
gr/hr ) t : temperatura (@C)
Rendimiento : moles gramo de clorometanos producidos / 100 moles gramo de metano alimentado.
Rml : relaciôn ' molar , cloruro dehidrôgeno / aire
Rm2 : relaciôn molar cloruro de hidrôgeno / me tano
C : conversiôn, moles gramo de metano reac - cionados / 100 moles gramo de metano al^ mentados
S ; selectividad, moles gramo de clorometa - nos obtenidos / 100 moles gramo de metano reaccionado
Q : moles gramo de metano quemados / 100 moles gramo de metano alimentado
O : duraciôn del experimento (hr)n : moles de metano transformados en el pro- X
ducto X / mol de metano de metano alimen tado, pudiendo ser x :
CO : metanoCl : cloruro de metilo C2 : cloruro de metileno C3 : cloroformo

53
C4 : tetracloruro de carbono CC : monôxido, diôxido de carbono
5.1.- SELECCION Y OPTIMACION DEL CATALIZADOR DE OXICLORA
CION
Rara la selecciôn de los componentes bâsicos, se ensayaron ocho catalizadores, todos ellos con so- porte de -alumina, de una granulometria de 80-100 mallas. Con los mismos, se realizaron 20 experimentos con la rela ciôn molar estequiométrica : 0.84 moles de cloruro de hidrôgeno por mol de aire, temperatura de 3ôO, 395 y 4300C y una presiôn media de reacciôn de 730 mm de Hg. En la ta bla 5#1 ee resumen los resultados obtenidos.
Para la determinaciôn de la composiciôn 6^ tima del catalizador con el soporte indicado y la serie de componentes seleccionada, se ensayaron 12 catalizadores con los que se realizaron 36 experimentos con relaciôn mo_ lar cloruro de hidrôgeno / aire estequiométrica (0*84) , razôn M/Al prôxima a I60 gr de càtalizador / mol gr de cio ruro de hidrôgeno/hora, a temperaturas de 36O, 395 y 43Q0C y una presiôn media en el reactor de 730 mm de Hg. En la tabla 5.2 se resumen los resultados obtenidos.

TABLA 5.1
SELECCION DEL CATALIZADOR DE OXICLORACION Relaciôn molar Rml : 0*84 Presiôn media de reacciôn : 730 mm. HgTamano de particula : 80-100 mallas
EXP.Nfi CATALIZADOR M M/Al t RENDIMIE
Al Cu-5 51.3 96.4 4oo 1A2 Co—5 53.3 93.1 400 1
A3 Ni-5 50.6 87.1 400 1A4 CuNiK 522 58.6 103.7 300 1.78
A5 II II 101.0 400 18.14a6 CuK 41 55.1 95.1 360 5.6A7 II II 93.3 395 11.32A8 II II 97.8 430 16.22
A9 CuLaK 522 52.0 91.0 360 11.80AlO II II 90.4 395 21.82Ail II II 89.6 430 32.47A12 CuCoLaK 5222 50.5 90.2 360 14.05A13 II II 90.8 395 24.10Al4 II II 89.4 430 35.03A15 tt 80.0 137.2 360 20.33Al6 II II 138.4 395 35.82
A17 II II 136.1 430 50.85A18 CuCeLaK 5222 80.1 133.0 360 45.38
A19 II II 137.8 395 57.38A20 II II 135.2 43a 64.07

TABLA 5,2
OPTIMACION DEL CATALIZAD*# DE OXICLORACION Relaciôn molar Rml : 0,84 Presiôn media de reacciôn : 730 mm# Hg Tamano de particula : 80-100 mallas
EXP.Nfi CATALIZADOR M M/Al t RENDIMIENTO
11 CuCeLaK 2222 100.6 201 360 56.8412 II Il * 214 395 62.6213 II II 209 430 64.2821 CuCeLaK 3222 100.0 176 360 54,1322 II II 173 395 62.6523 II II 176 430 66.2331 CuCeLaK 7222 98.1 l6l 360 60.5532 II II 151 395 68.9633 tt II 153 430 66.2241-1-1 CuCeLaK 8222 96.5 167 360 65.4542—1—1 II II 156 395 69.5043-1-1 II II 191 430 65.1651 CuCeLaK 11222 91.8 167 360 65.3152 II II 164 395 69.21
53 II II 163 430 65.7641-0 CuCeLaK 8212 94.6 157 360 59.0542-0 II II 153 395 65.8143-0 II II 157 430 66.2741-2 CuCeLaK 8232 96.3 157 360 65.1942-2 II II 157 395 69.0743-2 II II 158 430 65,05

TABLA 5.2 (continuaciôn)
EXP.Nfi CATALIZADOR M M/Al t RENDIMIEI
41-1-1 CuCeLaK 8222 96.5 167 360 65.4542—1—1 i t II 156 395 69.5043—1—1 t t II 191 430 65.1641-1-0 CuCeLaK 8122 93.0 158 360 62.6042-1-0 II II 158 395 66.2043-1-0 t t II 154 430 65.8041—1—2—1 CuCeLaK 8322 95.1 147 360 65.2042—1—2—1 ff II 145 395 71.5043—1—2—1 II II 147 430 70.7041-1-3 CuCeLaK 8422 96.0 154 360 65.6042-1-3 II II 161 395 70.02
43-1-3 II II 159 430 66.4541-1-2-2 CuCeLaK 8324 95.0 156 360 59.7042—1—2—6 II II 156 395 66.2043-1-2-2 II II 159 430 67.50

57
5.2.- ESTUDIO CINETICO DEL PROCESO DEACON
5.2.1.- EXPERIMENTOS PREVIOS
Como se explica en el apartado Discusiôn de Resultados (6.2), los experimentos previos realizados co^ ciden con los de la tabla 5.2.
5.2.2.- INFLUENCIA DE LAS ETAPAS DE TRANSFERENCIA DE MA
TERIA.
Se realizaron cuatro experimentos variando el caudal molar total de gases (n,p) a través del lecho ca talltico, manteniendo constantes la razôn M/Al, 70 gr / (mol gr/hr), la relaciôn molar Rml, 0.Ô3 y la temperatura, 4000C.
Con tal fin, se variô simultaneamente el caudal molar de cloruro de hidrôgeno y aire (para mante - ner constante la relaciôn molar Rml) y la cantidad M de catalizador (para mantener igualmente constante la razôn M/Al).
En la tabla 5.3 se indican los resultadosobtenidos.

CM K\ H O OH vd 00 ir\ HU • .# • •d CM CM CM CM
te\ 1T\ lA LA
bOK
ON O Okn H LA ON• • • •N A- VOcf
tr\
<àg
Ew§Ht/3PkHQ<PPQ<HU§3g
CMO 00 r- • o
CMCMKN00
=3iO5UO•o(dN•HH(8•P«ü
0)(8HH(8SOchHIOO1-4
(8H0Ov4■P<8A0)•do'§
LA ON v£> CM LALA CO 00 ON CMH H LA LA 00d CM .8* vd 00• • • •
O O o Oko■po<8<üUp ON vû A- oQ) iH CM CM CM CM
a 00 00 00 00d K • • •0) O O O O(8•H"do8S•H0}0)UÇU
o H CM CM• • • •LA O LA OCM LA A- OH
oo oo §
01%&tù
CM K\

59
5.2.5.- EXPERIMENTOS CINETICOS
Se realizaron 56 experimentos con el cata lizador seleccionado,en las siguientes condiciones :
Temperatura (t) : 370, 385 y 4000C Relaciôn molar (Rml) : 0.84 y 0.42 moles de cio ruro de hidrôgeno / mol de aire alimentado Razôn (M/Al) : I5, 35. 70, IO5, l40 y 175 gr de catalizador / (mol gr de cloruro de hidrôgeno / hr ).
La presiôn media de reacciôn fue de 735 mm de mercurio y el tamano de particula del catalizador de 100-140 mallas.
En la tabla 5.4 figuran los resultados obtenidos.
5.3.- ESTUDIO CINETICO DE LA OXICLORACION METANO
5.3.1.- EXPERIMENTOS PREVIOS
Para determinar la influencia de las di^ tintas variables y elegir el intervalo mâs adecuado pa-

HOLA LA N ch -8* VO LA CM CO CM VOco Os -8* LA LA O Ov H LA IN.• • • • • # # • « • • •VO CM H O LA H ' LA LA CM LA VO COH CM CM LA CM LA CM LA LA Ch LA ch
B+>(8fN.vOON
|N. LA LA VO VO .8" LA 00 CM CO Ch VOH O CM LA VO .8* Os o 00 VO CM CM• • • # • • • • # • • •LA IN. 00 OS ch 00 Ch VO VO LA HCO IN. N VO N VO N VO VO LA VO LA
bOS
lA<
g
WOoHËg0 (Oe
1AMAM
LA
09(8,PPLA 2I^ S«. oU
.8<P0 CM 1CM Oü LA O«8 00 pOU Ui irP (8P (80> d) Pü 0g 0 Oo u p(8 ,, +>k•H (8•0 u PU4) 0S "0 0(8 •0A NsO •H 0P P09 (8 2W +> SU « 3PU O H
H< o P CM P P ch LA O VO LA LA 00LA LA LA LA LA LA IN. VO IN. N VO VO• # • • • • • • # * • •VO VO VO VO VO VO CM CM CM CM CM CMH P P P P P LA LA LA LA LA LA
VO o .8< os LA p LA o LA os .8* oCM CM CM P CM CM CM CM CM p CM CM00 00 Ch 00 .8* 00 ch 00 ch 00 .8*» # • • • • • • # • # •o O O O o O O o o o O O
P os co os o VO LA p p LA 00 VOLA CM CM CM LA CM LA LA LA LA LAP P P P P P P p P P P PCM CM CM CM CM CM CM CM CM CM CM CM• • • • • • • • • • • •O O O O O O O O O O O O
o O LA LA O O O O LA LA O OIN. N 00 00 O o I^ 00 00 O oLA LA LA LA ch LA LA LA LA
01%5M
CM LA LA VO CO HH CM

CMHOCM lA Ov CM o LA LA LA Cv CM00 lA O IN. O H CM IN. LA 00• • # # • • • • # • # #Ch VO r* O 00 CM VO LA VO OV .8*•A LA lA VO LA ' LA VO LA [N.
00 VO LA VO H 00 O IV. LA |v- H 00H .8* LA OV CM ov LA 00 |v- CM #8» H• • # # • • # • • • • #LA LA LA CM OV H (N. LA VO LA O LAVO LA LA .8* LA LA .8* .8* LA .8* CM
<
SP0 (81gOChm
CM VO 00 ov vO LA CM OV CM 00 CM CMLA CM .8 CM H H OV LA OV EN. OV OV• • * • • • • • • • •00 00 00 00 00 00 LA LA LA LA LA LAVO VO VO VO VO VO O O O O O qH H H H H p
IIV. ov OV 00 vO ov VO o ov 00 ov ovCM P CM p CM P CM CM CM p CM P00 .8» . 00 .8* 00 #8* 00 .8* W #8* 00 .8*• • • • # # • • # • •O O O O O O O O P O o O
<
îLA IN. O VO O P ov O ov CM ov ovLA LA LA LA .8« .8* LA LA LA .8* LA LAP P P P P P P P P P P PCM CM CM CM CM CM CM CM CM CM CM CM• • • • • • • • • • • *O O O O O O O O O O O O
O O LA LA CD O O ON r. 00 00 q o IV. r.LA LA LA LA .Oh .8» LA LA ^ 8 § K\ ch
o%ftM
K\ chH IT\ VO H i4(NkH 00H OvH 8
HCM CMCM K\CM .S*CM

CMHO
LA 00 ON O r. H LA #8* H VO H 00H H VO ON 00 VO VO O VO LA OV co• • • • • • • * • • • #ON VO H LA VO LA CM 00 vO.8* VO VO r. VO N LA N VO |N. VO r-
N CM H O LA Ov LA VO OV <h OV CM00 00 LA H H LA LA ON LA VO O H• • • • • • • • • • •o LA 00 LA #8* LA .8* |N. LA H CM LALA LA LA CM LA CM .8* CM LA CM LA CM
<
Pü«I+>gOlA
N VO O OV OV LA H ov O CM P LA00 m8< VO LA LA LA OV LA .8 |N. LA 00• # • • • • • • • • • •LA LA LA LA LA LA LA LA .8* .8* ■ <h LA#8* .8« .8* .8* r. (V. EN. r. r-H H H H H H H H H H p p
LA o o ov ov CM p O ov VO qCM CM LA p CM P LA CM LA P CM CM00 .8* 00 <h 00 .8" 00 00 00 .8• # • # ■ • • • • • # # •O O O O o O O O O O O O
îCM 00 VO ov ov VO o O VO p [N..8 <h <h •8 LA VO LA 8 LA LAP p P P p P P P P P P PCM CM CM CM CM CM CM CM CM CM CM CM• • • 0 # • • • • • • #O O O O O O O O O O O O
O O LA LA O O O O LA LA4 IN. IN. 00 00 O O IN. IN. 00 00LA LA LA LA 8 8 LA LA LA LA §.8*
01%ftfà
LACM VOCM A.CM COCM ONCM OLA HLA CMLA LALA LA LALA VOLA

63
ra el estudio cinético, se han realizado 28 experimentos entre los siguientes mérgenes de variacién :
Temperatura (t) : 330-4000C Razén (M/A2) : l40-l600 gr/(mol gr/hr) Relaciôn molar (Rml) : 0,4-0.9 Relaciôn molar (Rm2) : 1-17
Los resultados obtenidos figuran en la tabla 3.3#
5.3.2#- VARIACION DE LA ACTIVIDAD DEL CATALIZADOR
Con este objeto se ha realizado un experimento de 40 horas de duraciôn total, en cinco periodos de ocho horas aproximadamente. Cada cuatro horas, se proce - diô a la toma de muestras y anâlisis de los productos de reacciôn#
Todo el ensayo se realizô con los siguientes valores aproximados delas variables :
Temperatura (t) : 385GCRazôn (M/A2) : 317 gr /(mol gr/hr)Relaciôn molar (Rml) : 0.82 Relaciôn molar (Rm2) : 10
En la tabla 5.6 se presentan los résulta - dos correspondientes a este experimento#

VO H d VO VO H o oa IfN CO in o0 • • • • • • • • •lA o . 00 H d VO as m VO Hd d H d K\ ‘ d H d d d tA
aV(0
0+>5•HITJgOS
d VO 00 KN Ov H K\ d ir\ O• • m • • • # • # •00 00 00 o o o d K\ ON
H VO Ov H VO 00 r- N VO
bO IN. VO .4* ON in H m 00 in HX • • • • * • • • • • • •
CO IfN VO H 00 ON in o ON K\ in ON• K\ IN. 00 ON KN VO 00 in IN. VO
m(0HO HVO (0|N- a
Ui oO .4*H u H> 0 d 1M +> d Oin X 0 tn O• X 0 00 Hin 0w k US • •< o C0«-3 E- H a (0oa % 0 V H
< u 0X A 0 OH 0 o nHX +>M (0 • • kPi •H (0T3 k A0) 0G V 0)
CS *0A NNO •H 0•H H *0(0 <0 (0o -P Gk (0 <0& U H
d
d<
ON 00 ON o ON O O o IN. d o o• • • • • • • • • # • •ON in VO o in tn o o r* 00 o om 00 ON o .4* ON o o vO ON o oH iH H H H
VO 00 |N. in in VO in .4* .4* in• • • • • • • • • • • #VO VO VO VO VO VO VO VO vO VO VO VOH H H H H H H iH H H H H
n- IN- IN- VO VO IN. VO N VO VO VO VO00 00 00 00 CO 00 00 00 00 00 00 00• • • • • • • • # • • •o o o o o o o o o o o o
|N- 00 00 IN. ON d r- VO d in VO VOo o o o o r4 o O o O O O-4* -4* -4* 00 00 00 00 VO
HVOH
VOr4 VOH
o o o o O O o o O O o oin |N- ON H in |N- Ov H in |N- O n Htn tn tn -4« tn tn tn •4* tn tn tn .4*
aZftw
o O o O o O o o o O O O• • • • • • # # • • • •in in in in o O o o o o o od d d d in in in in o o o oH H H H
H d tn in vo 1 00 ON O H d

tn in d ON tn ON r4 tn 00 VO H o 00 tn• • • • • • • # • • • • • * # #d d IN. ON tn tn vo vo VO -4« tn tn tn d votn tn -4» -4* tn tn tn tn -4* -4* -4* tn tn tn tn
0+>§•H
1 I
H VO o ON tn [N. H vo d O vo tn 00 r- tn# • • • • # • # # * • • • • • •VO •4* 00 tn ON H tn d 00 00 -4* ON H 00 OH d H H d d d d d d H . 01 H d H d
•HO«Sa.5+»§O
mlAi
vo 00 00 IN. ON O tn IN. tn 00 o d tn oo# • • • • # • • • # • # • # # •(A tn H d d tn VO H d 00 ON .4» vo 00 vo tn
d tn d d .4" tn -4* tn tn d tn tn tn tn tn
tn d in H tn H tn tn tn tn .4V ON ON N tn vo• • • • • • # # • • • • -• * •Ü 00 N H 00 ON tn N d 00 d tn ON .4* vo H vovo N VO vo tn vo tn vo vo IN. vo VO tn tn tn tn
H d ON ON tn H 00 00 tn tn O n 00 tn tn tn Hd vo vo O o vo VO O o vo vo O O vo vo H H8 • # • # # • • • # • • • # # • •(S H H iH H H H H H H H H H H H H H
00 H ON H ON H ON H O H ON O ON d H dH VO -4* vo -4< VO VO -4* 1^ .4* VO VO r- .4*S • • • • • # • • • • • # • # • •3 O O o O O O o O O O O o O o O O
d ON O o o H O O O ON N 00 00 H O O O< I^ 00 00 00 .4* .4V I^ IN. N IN. .4V .4V .4V 4v> d d d d H H H H d d d d H H H H
O o o o o o o o o o o o o o o oON ON ON ON ON ON ON ON [N. IN. rv IN. i^ i^ IN.tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn
ot%ft
o#§
•AH
O•OOH
O O tn tn tn tn O• • • • • • •
O O O o O O ooH s
tn tn tn tn oH
tn vo N 00 ON O HH H H H H d d
0 •.
1Cld
o O tn tn tn tn# • • • • •
o o o O o Oo o tn tn tn tnH H
tnCl •4»Cl IfN VO Cl Cl
|N.d «0d

OV H H 00 00 .4V tn H tn• • • • # • # • # • •
VO tn vo vo 00 VO vo 00 n-
voif\
I
bO« S
• 4 •o k H gê bO H4 aM tn s OH voH o o n-CM tnCM H dtn 1 vO00 o •H% o UO H ÜU 4 4Ü kQ k 4 0)Û O 0 0 H k< tn o V 0Û 00 d 4 0 Q)H tn Ü N vH ■d> •H +>H #* •• H k 4H 4 4 •HU (8 k +> A *d< k 0 4 0d *0 0 Q> 8< +> 4 t3a (8 N o dk •H •0 0 vOM 0 . H id •HQ A 4 4 4 toB 4» to 8 4)% Q) 4 4 4 kO H O X AHU<
I
Og•H•d§A
(A
d
tn n- <jv o\ tn OV VO H .4V CM vo• • • • • • • • • • #CM CM H CM CM O OV CM CM Ov HVO VO vO VO VO vo in VO VO tn VO
tn tn O 00 H vo CM vo in Ov• • • • • • • • • • •
o H o ov O 00 rv- o o OVov OV ov 00 Ov 00 00 ov ov 00 00
tn CM O CM tn O .4* ov• • • * • • • • # •
ov 00 00 o OV 00 00 00 OV N 00VO vo vo n- vo vo vo vo VO VO VO
.4 tn tn tn .4 .4< CM m00 00 00 00 00 00 00 CO 00 00 00• • • # # # • • #O o o o o o O o o o o
tn tn O H tn CO tn Hov 00 Ov CM o OV tn O vo 00• • • # • • • • • • •ov ov ov OV ov o
HOV ov oH
Ov Ov
CM< 00 vo tn Ov tn N o 00 IN. o 00
H H H H H H CM H H CM HX tn tn tn tn tn tn tn tn tn tn tn
IT\CM
00 CM VOH OCM$n#mCM 00CM CMm voK\ O.4V
01%ft CM m m vo 00 ov

67
5.3.3.- INFLUENCIA DE LAS ETAPAS DE TRANSFERENCIA DE MA
TERIA
Se realizaron cuatro experimentos variando el caudal total de gas a traves del lecho y la cantidad de catalizador para mantener invariables la raz6n M/A2 en 480 gr /(mol gr/hr), la relacion molar Rml en un valor de 0.82 y la relaci&n molar Rm2 en 10 mol gr de cloruro de hidr6- geno/mol gr de metano alimentado.
La tabla 5.7 resume los resultados obteni-dos.
5.3.4.-k EXPERIMENTOS CINETICOS
Se realizaron 60 experimentos ûtiles con el catalizador de oxicloraci6n seleccionado,en las siguien- tes condiciones :
Temperature (t) : 370, 385 y 400QÇRaz6n (M/A2) : I50, 3OO, 475, 65O, 950 gr de çatalizador/(moles gr de metano/hr)Relacion molar (Rml) : 0.42 y 0.84 moles gr de clorüro de hidr6geno/mol gr de metano aliment^ do.

lA<É5 <HI
S'
kO bOClO H5 840+>4k
I
b00
<
bOX
(Q g4 gHH O4 vo8 IN-O #»H kd 1 0d O +>tn O Ü00 H 4
< 4X • • k4tiS 4 HH 4 H 4X u 0tii 0 O do «H 4Xo • • k 4H 4 •H(A k A •d5 0 4k "d 4 8H 4 •d.Q N d•H 0 NO< H id •H4 4 n+> 8 44 4 kQ O H A
I I
dv vO vo oO O vO IN. 00o • • . • •d IN. IN. VO in
o d O voo vo 00 tno # • • •o tn d d dd H H H H
H tn N Hin d 00#4« • • • #O .4 vo in ind tn tn tn tn
O vo .4* tntn d d Otn # • • ' •o d O H tnd tn tn tn tn
d H o dd CO o H oo • • • •d ov o O oH H H
CO d tn 00H d d d tnU • • • •d tn tn tn tn
CM
o ov H -4*OV tntn .4* VO 00• • • •o o O o
H vo -4< r-O CO Ov ov• # • •
o OV OV Ov
vo O H oH d d dH 00 00 00 008 • i • • •(S O o o o
d o00 •• o
o H H in H in# # • •M X in o dd tn in vO
01X
ftMd K\ .4*

69
Relaci6n molar (Rm2) : 6, 10 moles gr de cloru ro de hidr6geno/mol gr de iftetano alimentado*
Todos los experimentos se realizaron con un caudal molar medio de metano de 0*0213 mmol/s*
En la tabla 3 #8 se expresan los resultadosobtenidos*
5.4.- METODO PE OPTIMACION PE BOX-WILSON
5.4.1.- DISERO EMPIRICO-EXPERIMENTAL
Se ban elaborado dos disenos empirico-ex- perimentales, uno sobre la regi6n en que se ha llevado a cabo el estudio cinético del proceso de oxicloraci6n de metano y el otro sobre una subregi6n de ëste, aceptada previamente como 6ptima.
- Diseno nQ 1 :
El diseno inicial elaborado ha sido un diseno 2^ factorial centrado, en el espacio dci cuatro dimen siones (t, N/A2, Rm2, Rml)* de las siguientes caracterls- ticas :
- . Coordenadas del punto base :
(Yi) t - 5850c(Y2) M/A2 - 600 gr de catalizador/Cmolgr de meta
no/hr)(Y^) Rm2 - 8.0 mol gr de cloruro de hidr6geno/

COin<
g
lAOUHH
8U(A0
1AMft
bOS
ovoIN.
uo+»u44k
• fl 44•H*04a
•HCQ«kA
CMCMm00
%•gu0u
k
4N•HH44O
0O«H+>k4A4•0O■§
HO
lAHCMO
m4HHso O
é IO 4H E• • Q)
•do•H*04ak4HOaH4•d4O
u o u tn 0 •#4*#
CM
O CMo tn 00u • •fl IN. 00vo
H vo.4* VO tno • •d CM in
otnu •IN.I^00H
H IN. CM tn VOÜ • •0 H voH H
H 00 .4<U OJ r:
CM<
CMI
Ov•HinH
cr\
vo•ovotn
vovo•ON
ON VO l'os VO ON• • fCM tn
vo ovo 00 • •CM
VOH•Ovtn
IN-00
CM
OVO•OV
Ov
VO
OvO•Ovtn
00 tn iov .4 ov• • •00 tn oH CM
.4* • •CM in
H tn 00 r- • #tn IN.CM CM
00IN.*tntn
H IN.tn CM# #CM HH CM
lA CMCM VO• • •00 00 VOH H H
OH#H
tnin•oCM
00 voIN- ovovo in
tn in O 00 • #Is. 00
OV CM H CM CO 00 • •o o
tn ov H• • •IN. o inIN. in .4*^ vo ov
00 tn CMI Ov o• • •ov Ov O
00 tn oH H CM00 00 00• • •o o o
CM•Hin
mov•ov
in#CMHtn
ovr-•ov
CM OCM ÇM.4# #o o
o o o o o o|v- r- IN. IN.tn tn tn tn tn tn
H Ov voin ov IN.• * •in tn VO
H o oin in 00• • •
00 in .4*CM CM H
in H tnH tn CM# * •Ov tn 00H H
CM .4< IN-CM OV o• •
iH voCM tn tn
OV in 00IN. ov• # •
H H 00CM CM H
CM H VOo 00 H• • •00 vO in
o O 00• • •vo o oIN. vo in.4* vO ov
VO O00 o o• • •ov o oH H
OV 1-4 00H CM 1-4.4* -4*• # •O O O
O o OIN. IN. IN.tn tn tn
01X
ft CM tn in vo oH

•H0 41 +)§O
00in
<mS
Vo
oo
0^
tnO
CMü
HO
CM<
CM
VO tn H tn -4* O 00 ON IN. tn 00 tn VO tn HOS vo O CM 00 O IN. IN. 00 tn ON CM 00 N H• • • • • • • • • • • • • * •
tn VO n - -4< |N- o O tn vo a tn |N- tn 4« iN.
in VO H CM r - CM ON #4« -4* ON ON H CM ON VOH ON H tn H O VO 00 tn 00 vo CM 00 tn vo
• • • • • • • • • # • • • # #00 ON H o ON N 00 vo 00 vo vo H H vo VOvo .4 CM VO .4» tn CM H tn tn CM H
as H tn 00 in N IN. O VO ON tn H H 00 tnH tn vo H tn [N. tn CM O tn 4 * H ON vo
• • # • • # • » • • • • • • •CM .4* vo ON CM
HCM 00 O
H Hvo tn
HHCM
00CM
tn4<
VO CM tn H tn CM 00 H CM IN. 00 O |N- ON tntn H tn N #4« O -4* tn 00 tn CM tn 00 00 N
• • • • • • • • # • • • • • •00 00 H VO o N CM tn 00 VO vo H tn O
H H CM CM H H CM CM CM H CM tn tn tn
tn ON VO 00 r» 00 IN- IN. .4* O ON vo tn r -O VO CM CM -4< ON .4* H ON CM vo tn tn 00 o
• • # • • • • • # • • • • • •H tn r - VO N CM ON O O ON CM vo 4 * CMH H H H H H H CM CM H H H H H
H 00 -4< 00 tn H CM ON VO H tn IN- 00 VO votn CM .4* CM tn CM CM VO tn r - o 4 * ON H r -
• • • • • • • • • • • • • • •vo ON ON 00 vo r - ON 00 r - tn •4* tn 4 * tn CM
tn .4* ON vo -4« ON N tn 00 tn tn tn tn tn• • • • # • • • • • • • • • •
CM tn 00 ON -4« CM tn #4« CM 00 H IN- tn tn 4 *in H IN. tn tn tn H r - tn tn H t>- tn tnH tn #4* vo ON H tn .4* vo ON H tn 4 * vo Ov
VO vo tn H o |N- .4» ON tn (N. N tn O ON 4 *ON 00 O O H ON OV 00 ON O ON ov ON 00 O# • • « .# • • # # • ' # # # • •
in tn vo VO VO tn tn tn tn vo ON ON ON Ov O
tn tn O H vo vo tn tn 00 Ov 00 H vo CM tntn 4< tn tn tn CM CM CM H CM CM tn CM H CM00 00 00 00 00 4 * 4v 4 * 4< 00 00 00 00 00
• • $ • # • • • • • • • • • #o o o o O O O O O O o o O O O
o o o O o O o o o o tn tn tn tn inr- r- N N IN. i^ r- |N- 00 00 00 00 00tn tn tn tn tn tn tn tn tn tn tn tn tn tn tn
01Xi HH CM tn
H tn vo 00H
ONH 8 HCM CMCM tnCM -4*CM in
CM

i•H0 41-PgÜ
00m<
S
oo
oo
4*0
mo
CMo
M0
CM<
CM
ON r- m ON VO lA ON tn VO 4« CM lA lA 0 tnO vo 00 o CM H ON 0 tn ON H H vo Ov 00• • • # • • • # • • • • • • •
4* [N. IN. IN. 0 tn lA 00 0 CM 4* 00 ON tnH H H
VO VO O vo 0 0 VO lA ON H ON CM VO 0 0O IN. tn CM N tn I^ 0 ON tn ON ON 4* IN. tn• • • • • • • • • # • • • • •
00 H CM IN H 4* H m 00 CM 4* 00 ON 4< lA4< CM H VO 4- tn CM CM lA CM H H
in m OV IN. H CM VO H H VO tn lA 0 4* CMH 00 H CM ON 00 H CM 0 r- H 0 r - H ON• • • • • • • • • # • • • • •
|N- m I 00 lA 4« ON tn VO 00 lA H IN. lA ONH CM tn lA H H H H H CM tn
ON ITS in 4V 00 lA 0 0 tn 0 tn 0 CM tn H00 H ON I CM VO ON CM tn 4< N 00 ON vo 00
• • • • • • • • • • # • • • •o CM m lA IN- H Ov tn 4* IN. VO lA ON CM 0CM m tn tn CM H H CM CM CM H CM CM tn tn
VO lA CM ON CM IN. 00 tn ON 00 VO H 4* H CM|N- m in vo tn 4* 4* lA CM tn ON 4* CM ON vo• • • • • # • • • • * m * • •ITN IN. tn ov 4* 0 lA lA 4* tn 4* ON 00 lA 00H H H H H H H H H f4 H H
m m H 4* tn H H 00 CM H IN- r - tn CM CMO O CM ov m VO IN. ON 0 CM 0 vo 0 IN. lA• • • • • • # * • • • • • • #
4* lA tn H 0 lA IN. VO VO lA 4* vO lA tn r4
N H 44 4 H 0 0 tn 00 CM H VO ON VO* • • # • • • # • • • # • • #
ON CM ON r- CM CM IN. 0 4v IN. H vO IN. lA ON4* H I tn lA lA iH 00 tn 4« lA H I^ tn 4»H K\ 4« vo ON H tn 4« vo ON H tn 4* vo Ov
m O H ON tn lA IN. CM 0 4« tn lA 4< tn 0ON ON O ON ON Ov ON 0 0 ON ON 0 0 H H• • • # # • # • • • • • • • •
ON OV O ON dv lA lA VO vo lA lA vo VO vO VO
VO 00 00 H 00 0 tn CM 4« vo ON CM CM VO 0H CM H H 0 CM lA m r4 4* H CM CM CM4* 4* 4v 4< 4v 00 00 00 00 00 4* 4* 4* 4*• • • * • • • • • • # '# # # •0 0 0 0 0 0 0 0 0 0 0 9 0 0 0
lA lA lA lA lA lA lA lA lA lA lA lA lA lA lA00 00 00 00 00 00 00 00 00 00 00 qo 00 00 00tn tn tn tn tn tn tn tn tn tn tn r tn tn tn
01X
ftH
VOCM
r-CM
00CM
ONCM
Om
Hm
CMm
mm 4*m if\ voK\ K\ r-K\ 00m ON•n o
4*

uü H lA NO H vo CM lA 4< H VO A- O 4* ON CMNO O N H CM H VO H lA ON 00 00 H CM 00# • o • o • • • o • • • # • •CM lA NO 00 ON tA vo A- HH
lA 00 Or4 Or4 mr4
•HÜ(0!+>§o
00lA
Oo
tAO
CMU
HO
CM<
CM
CM O O 4* 004 00 00 4* 4<# • • • •ON CM CM 00 H4« CM H
00 H N H H4 00 00 H r-• • • • •H 4" lA VO HH CM tA 4< A-
CM CM 4* tA tAVO VO CM 00 VO• # # # •H O H 00 lACM tA tA CM H
lA CM O CM HVO 00 H O A-• • • • •H CM O HiH H H
CM O tA 00 CMCM ON CM 4* CM• • • • •tA KN tA H O
lAH 4* CM H CM• • • • •CM O 00 H tAlA CM r. tA lAH tA 4* VO ON
H 00 VO 00 OON ON 00 00 ON• • • • ■ •ON ON ON ON OV
tA O lA OH CM CM O CM00 00 00 00 00• # • • •O O o O O
o o o o oo o o o o4* 4* 4< 4* 4<
HlA•4*H
CM
CMA.•ON
HlA•H
O•lAlA
CMO•oH
as
oo4*
VO vo ON 00 A- CM 4* H 4*lA H CM o 00 CM A- tA VO# • • • • • • • •CM LA H o H 4< VO tA ONH lA tA CM CM H
VO CM 00 lA CM H VO H VOOV CM O H H tA CM H A-• # • • • • # • •O 00 A- ON ON 4< 00 H HtA 4< VO r- H iH CM CM
00 ON 00 CM O CM CM tA tAlA VO 4« A- *4 tA A- H CM• • • • • • • • •lA o H 00 VO H 4« A- 00tA tA CM H CM CM CM CM
O H VO o tA 00 H Ov VOA- 00 tA H CM tA H A- 00* • • • • • • • •H VO CM O CM 4* 4* CM iHrH H H •H H H
lA 00 00 O H A* tA tA ONlA ON CM o 00 tA O H VO• • • • • • • • •CM H O o 4« VO VO tA 4«
00 O 00 4* O tA tA 00 CM• • • • # # • • •lA tA lA lA H 00 VO asH I tA lA lA H A- tA tAtA 4* VO ON H tA 4» vo ON
00 tA 00 H ON 00 O 4< tA00 ON ON O 00 ON O O O• • e • • # • • •ov as ON O tA tA VO VO VOH
ON o H H tA i4 r. VO 4<H CM H CM 4* 4* tA 4* 44* 4«. 4« 4< 00 00 00 00 00• • # • • • • • •O O O O O O o o O
O O O O o o o O oo o O o o o o o o4* 4* 4* 4< 4* 4» 4* 4< 4*
CIX
ftMH4* CM4* m4« 4<4v lA4* NO4* r.4* 004< ON4< OlA HlA CMlA lAlA 4<lA lAlA

oo 4< VO CM CM 4A- tA O VO O# # • • #tA H CM A-H H H
•H0 C81 +>§O
00lA<
î
Oo
tAU
CMO
CM<
CM
I
tA vo CM lA lA4 CM A- ON A-• • • • •A- H CM A- H4* CM H
VO VO CM O VOCM H O A- ON• • # • •ON H ON 00 voCM CM tA lA
O ON H tA lAlA H 4< VO 00• • • •CM O H ON OCM tA tA CM CM
A- O CM 00 O4« 4* A- H O• • • • •tA lA CM ON tAH H H
lA tA H CM OVO VO H ON 4*• • # • •tA 4« tA H O
4 00 4 tA tA• • # • •H A. lA ON ONlA H A- tA 4«H tA 4 VO ON
O ON 00 lA 4O ON ON O ON* • e - • •vo lA lA vo lA
O ON tA 00 OCM H CM H H4* 4* 4< 4 4«• • • • #O O O O O
OO4*Oo4»
OO4*OO4«
01X
ftMvolA A-lA 00
lAONlA
Ovo

do :
75
mol gr metano alimentado.(Y. ) Rml - 0.65 mol gr de cloruro de hidr6geno/
mol gr de aire alimentado.
Las unidades de escala seleccionadas han si
= 150c
^M/A2 " gr/(mol gr/hr)
®Rm2 " ^®Rml =
Segûn esto la matriz de diseno queda esta- blecida como se indica en la tabla 5•9*
Las condiciones ôptimas operatives, asi c^ mo el valor observado de la respuesta del sistema (rendi- miento), se indican en la tabla 5#10#
- Diseno nO 2 :
• Este diseno se ha elaborado sobre una sub-regi6n del diseno inicial. Constituye asi mismo un diseno42 factorial centrado, en el espacio de cuatro dimensio -
nes (t, M/A2, Rm2, Rml), de las siguientes caracteristi - cas :
- Coordenadas del punto base :
(Y^) t - 592.50c(Yg) M/A2 - 900 gr de catalizador/(mol gr de me
tano/hr).(Yg) Rm2 - 9 mol gr de cloruro de hidr6ge-
no/mol gr de metano alimentado.

TABLA 5.9
MATRIZ DEL DISERO Nfi 1
EXP.NQ PUNTO COORDENADAS
45
EXPERIMENTAL
1 1
^2
1 1
Y
50 2 1 1 1 - 1
55 3 1 1
60 4 1 1 -1
42 5 1 1
47 6 1 1 - 1
52 7 1
57 8 1 -1
5 9 1 1
10 10 1 1 - 1
IS - 11 1
20 12 1 -1
2 13 1
7 14 1 - 1
12 1517 16 - 1
6 l o r ig e n 0 0 0 0
62 o r ig e n 0 0 0 0
63 o r ig e n 0 0 0 0
64 o r ig e n 6 0 0 0

TABLA 5.10
CONDICIONES OPERATIVAS Y RESULTADOS DEL DISERO NQ 1
PUNTO t M /A2 Rm2 Rml R endim ii
EXPERIMENTAL
1 400 900 10 0.84 8 9 .2
2 400 900 10 0.42 8 7 .9
3 400 900 6 0.84 6 6 .6
4 400 900 6 0.42 8 1 .3
5 400 300 10 0.84 7 2 .2
6 400 300 10 0.42 8 0 .8
7 400 300 6 0.84 57.08 400 300 6 0.42 7 1 .3
9 370 900 10 0.84 7 5 .9
10 370 900 10 0.42 7 8 .4
11 370 900 6 0.84 6 3 .0
1 2 . 370 900 6 0.42 7 0 .6
13 370 300 10 0.84 48.814 370 300 10 0.42 5 6 .1
15 370 300 6 0.84 4 3 .4
16 370 300 6 0.42 5 0 .5
o r ig e n 385 600 8 0 .6 3 77.6o r ig e n 385 600 8 0 .6 3 77.5o r ig e n 385 600 8 0 .6 3 7 8 .0
o r ig e n 385 600 8 0 .6 3 77.9

78
(Y^) Rml - 0.735 mol gr de cloruro de hidrége- no/mol gr de aire alimentado.
- Unidades de escala seleccionadas :
= 7.50c
^M/A2 " gr/(mol gr/hr)Rm2 = 1Rml = 0.105
La matriz del diseno nQ 2 se indica en latabla 5.11 y las condiciones operatives junto con los valores observados de la respuesta del sistema en la tabla5.12.

TABLA 5.11
EXP.Nfi
MATRIZ DEL DISERO Nfi 2
PUNTOEXPERIMENTAL
COORDENADAS
BW-1BW-2BW-3BW-4BW-5BW-6BW-7BW-8BW-9BW-10BW-11BW-12BW-13BW-14BW-15BW-16BW-RlBW-R2BW-R3BW-R4
12345678 910111213141516
origen origen origen origen
00O0
0OO0
0O00
0O00

TABLA 5.12
CONDICIONES OPERATIVAS Y RESULTADOS DEL DISENO NQ 2
PUNTOEXPERIMENTAL
t M/A2 Rm2 Rml Rendimii
1 400 1000 10 0.84 78.02 400 1000 10 0.63 78.1
3 400 1000 8 0.84 68.54 400 1000 8 0.63 75.8
5 400 800 10 0.84 74.96 400 800 10 0.63 74.37 400 800 8 0.84 67.88 400 800 8 0.63 72.89 385 1000 10 0.84 77.3
10 385 1000 10 0.63 79.711 385 1000 8 0.84 71.712 • 385 1000 8 0.63 75.313 385 800 10 0.84 73.214 385 800 10 0.63 76.015 385 800 8 0.84 67.316 385 800 8 0.63 66.6
origen 392.5 900 9 0.735 77.8origen 392.5 900 9 0.735 76.6origen 392.5 900 9 0.735 77.1origen 392.5 900 9 0.735 75.8

6,- DISCUSION DE RESULTADOS
6.1.- SELECCION Y OPTIMACION DE UN CATALIZADOR DE OXICLO RACION
A la vista del estudio bibliogrâfico really zado con miras a la selecciôn y optimacion de un cataliza dor para el proceso de oxicloraciôn de metano, se tratô de encontrar el catalizador mâs adecuado para la oxidaci&n de cloruro de hidrôgeno a cloro, por ser éste,paso decisive en el proceso de oxicloraciôn indicado.
De entre los numerosos componentes actives propuestos por diveros autores (I3) (23) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34), se eligieron losdorures de cobre, cobalto, niquel, lantano, cerio y pota sio, por ser los que apuntaban unes resultados m&s espergi zadores.
Por otro lado, y aunque la naturaleza del soporte influye notablemente sobre la conversiôn de cloru ro de hidrôgeno a cloro,en el sentido de favorecerla cuan te mayor es la superficie especifica del mismo, pareciô sensato utilizar soportes de baja superficie especifica (25), ya que si bien el criteria de selecciôn se basaba en el desarrollo de la reacciôn de oxidaciôn de cloruro de hidrôgeno a cloro, el destine final del catalizador

82
habîa de ser la oxicloraciôn de metano, durante la que lap reacciones secundarias de combustiôn de hidrocarburo se ye rlan favorecidas por soportes de elevada superficie especjL fica, efecto que debia contrarrestarse#
En las figuras 6,1, 6.2 y 6.3, se han re— presentado los resultados obtenidos en los experimentos de selecciôn de los componentes bâsicos del catalizador cuyas condiciones se detallan en la tabla 3#1# Se ha omitido la representaciôn de los resultados obtenidos con los catali- zadores Cu-3, Co-3, Ni-5 y CuNiK 322, ya que la degenera- cion sufrida por éstos, impidiô la reproducibilidad de resultados y con ella su posible utilizaciôn prâctica.
Los catalizadores se representarân por los simbolos de los cationes de los respectives cloruros, se— guidos de cifras indicatives del tanto por ciento de cada uno de ellos; asi por ejemplo, el catalizador CuCoLaK 32 22 estarâ Cbnstituido por un 3% de cloruro cûprico, 2% de clo ruro de cobalto, 2% de cloruro de lantano, 2% de cloruro potôsico y el resto hasta 100 de soporte ({(-alumina).
En la figura 6,1 se han representado los re sultados obtenidos con los catalizadores CuK 4l, CuLaK 322 y CuCoLaK 3222 (curvas A, B y C respectivamente), con una razôn M/Al prôxima a 100 gramos de catalizador/mol gr de cloruro de hidrôgeno alimentado/hora, y una relacion molar Rml de 0.84 mol gr de cloruro de hidrôgeno/mol gr de aire. Puede observarse que la conversiôn crece continuamente entre 360 y 4300c para los très catalizadores, si bien los

OflQ
mü 3
H
I

o s «o.
<K5CMfib

s
K\\o
i%
%
u a 3 §

86
mejores resultados se obtienen con el catalizador CuCoLaK 5222. No obstante, la estabilidad de los tres catalizadores fue satisfactoria durante la realizaciôn de los experimentos correspondientes.
Con el fin de hacer menos significativa la influencia de la relaciôn M/Al sobre la conversi6n alcan- zada en los experimentos de selecciôn , se decidiô repe- tir los experimentos con el ûltimo catalizador (CuCoLaK 3222) para una razôn M/Al prôxima al doble de la utiliza da anteriormente. Los resultados obtenidos, se muestran en la figura 6.2, En ella puede observarse que al aumen- tar la razôn M/Al (curva D), la conversiôn crece ostens^ blemente. Por este motivo, se decidiô en io sucesivo rea lizar las pruebas de selecciôn con el nuevo valor de (M/Al) (û£l40) utilizado.
De los distintos catalizadores ensayados a partir db este momento, tan solo el CuCeLaK 3222 (curva E) superô las conversiones alcanzadas con el CuCoLaK 3222 (curva D) para las très temperatures y en la cuantla que se muestra grâficamente en la figura 6.3. Puesto que a 43OGC la conversiôn alcanzada con este ultimo coincide prâcticamente con el valor de la conversiôn df equilibrio termodinâmico, no pareciô aconsejable prosegu^r la selecciôn, pues la mejora adicional alcanzable, podia ya cons^ guirse modificando convenientemente la proporçiôn de los componentes actives seleccionados.
Decidida de esta manera la composiciôn del

87
catalizador de oxicloraciôn, a base de los cloruros de co, bre, cerio, lantano y potasio soportados sobre y-alûmina, la determinaciôn de la composiciôn mâs adecuada se efectuô por aplicaciôn del método de optimacion de variaciôn alea toria de un factor, manteniendo constantes todos los demâs*
Con motivo de la determinaciôn del porcenta je ôptimo de cloruro de cobre (cûprico) se prepararon cin- co catalizadores CuCeLaK 2222, CuCeLaK 3222, CuCeLaK 7222, CuCeLaK 8222 y CuCeLaK 11222 con los que se realizaron cin co series de experimentos (curvas A, B, C, D y E respectivamente) a temperaturas de 3Ô0, 395 y 4300C cada una y con una razôn M/Al prôxima a 130• Los resultados obtenidos (ta bla 3*2) se representan en la figura 6.4# Aunque los resul^ tados obtenidos con los catalizadores CuCeLaK 8222 (curva D) y CuCeLaK 11222 (curva E) fueron muy similares y supe- riores a los alcanzados con los demâs, se decidiô como corn posiciôxl ôptima de cloruro cûprico el 8% ya que la imprejo naciôn del soporte resultô tanto mâs dificultosa cuanto ma yor fue la cantidad de componentes actives a depositar#
Anâlogamente se procediô para la determinaciôn de la composiciôn ôptima de los cloruros de cerio, lantano y potasio, representândose los resultados obtenidos (tabla 3*2) en las figuras 6,3» 6,6 y 6,7 respectivamente, En las mencionadas figuras, las lineas (A, B, C, D, E, F, G, H, I, J y K) corresponden a los experimentos rea lizados con los catalizadores CuCeLaK 2222, 3222, 7222 , 8222, 11222, 8212, 8232, 8122, 6322, 8422 y 8324 respect!

w \ \
< mo w
8o o
v£)

U.OOO CD
P
o o
o or
tr\
2§Hb,

LOmU)18mo
vO\D

( > »■ '/ W ; ! ; >
mtnmo c( o

92
vamente*Con todo lo anteriorment>e expuesto, la com
posiciôn ôptima seleccionada correspondlô al catalizador CuCeLaK 8322 (8)6 de cloruro de cobre, 3% de cloruro de rio, 2% de cloruro de lantano, 2% de cloruro potasico y 83% de y-alûmina) con el que al menos a 395QC se consigui6 alcanzar ya la mâxima conversion correspondiente al equil^ brio termodinâmico*
6.2.- ESTUDIO CINETICO DEL PROCESO DEACON
6.2.1.- EXPERIMENTOS PREVIOS
a#- Variaci&n de la actividad del catalizador
A pesar de que la degradaciôn del catalizador tal como se indica en el apartado 2, cabe esperarla co mo consecuencia de la pérdida de los componentes actives del mismo por volatilizaciôn a causa de las elevadas temp^ raturas de trabajo, ésta puede ester acentuada por el bloquée de centres actives del mismo al depositarse sobre elles carbOn precedents de degradaciones de molécules de compues^ tes organises.
Por este motive y dado que el catalizador se seleccionô con miras a su utilizacién en el proceso de oxicloraciôn de metano, en el que las dos circunstancias indicadas se dan simultaneamente, los ensayos de actividad se han realizado en los experimentos de oxicloraci&n de

93
metano y se describen y analizan en el apartado 6,3.1,
b.- Selecciôn del intervalo de variables a utili- zar en el estudio cinético
A la vista de los experimentos realizados con motivo de la optimacion del catalizador de oxiclora— ciôn y dado que ésta se ha realizado sobre experimentos de oxidaciôn de cloruro de hidr6geno a cloro, se han el^ gido como mâs adecuados los siguientes intervalos para cada una de las variables estudiadas.
i.- Relaciôn molar cloruro de hidrogeno-aire (Rml)De la estequiometrla de la reacciOn de ox^
daciôn de cloruro de hidrôgeno a cloro y de la relaciôn molar de oxîgeno en el aire, se deduce que la cantidad mJL nima de aire a utilizar para oxidar completamente un mol gr de cloruro de hidrôgeno a cloro, es de 0.84 mol gr de aire aproximadamente.
Por otro lado, el empleo de cantidades cre cientes de aire solo estaria justificado en el caso de que a cualesquiera otros valores de las restantes variables (temperature, razôn M/Al) no se consiguiera alcanzar el equilibria termodinâmico correspondiente.
Pues bien, a pesar de que como se puede apreciar en la figura 6.7 (curva I) con una razôn M/Al prôxima a I30, una relaciôn molar Rml estequiométrica (0.84) y a una temperature de 3 9 5 se alcaqza practica mente el equilibria, se decidiô adopter un intervalo de

94
variaciôn para la relaciôn molar Rml comprendido entre 0,84 y 0,42 en base a que a menores temperatures y/o con valores mâs bajos de la razôn M/Al de los empleados, pu- diera no alcanzarse éste y el comportamiento del sistema quedarâ desconocido, circunstancia ésta plenamente con- firmada en los experimentos del estudio cinético realiza do posteriormente.
No pareciô aconsejable la utilizaciôn de cantidades menores de aire (relaciones molares Rml mayo- res de 0,84) ya que ni técnica ni econômicamente reporta rla un gran beneficio,
ii,- Temperature.Dado el efecto negative de la temperature
sobre la conversiôn de equilibria (figura 2,1) y la ten- dencia a la sublimaciôn de los componentes actives del catalizador (apartado 2), pareciô aconsejable utilizar un intervalo lo mâs bajo posible para esta variable y que en funciôn de los experimentos previos realizados se fijô tre 370 y 400QC, Téngàse en cuenta,que con una relaciôn molar estequiométrica se consigue el equilibrio a 395^0 y que con cantidades mayores de aire, como Iss empleadas, cabe esperar alcanzarlo a temperaturas inferiores.

¥5
6.2.2.- ESTUDIO CINETICO
a.- Consideraciones previas semiciiantitativas.
En las figuras 6.8 a 6.13 se presentan las curvas de distribueiôn de productos en funciôn de la razôn M/Al, masa de catalizador/caudal molar de cloruro de hidrôgeno alimentado (tabla 3.4)
En ordenadas se han representado los ren- dimientos de cada producto, n^^^ y n^^ (n^^, cociente en tre el numéro de moles de compuesto consumidas o produc^ das y el nûmero de moles de cloruro de hidrôgeno alimentado. Para mayof facilidad de trazado de las curvas, el rendimiento del cloro viene expresado como ôtomos gramo de cloro producidos/mol gramo de cloruro de hidrôgeno ali mentado.
. La velocidad neta de desapariciôn o apar iciôn de un compuesto, expresada como d n^/d (M/Al), es la pendiente de la curva de distribuciôn correspondiente.
De la observaciôn de las curvas de distr^ buciôn correspondientes cabe plantear las siguientes con sideraciones :
La cantidad de cloruro de hidrôgeno no reaccionado disminuye continuamente al aumentar la razôn M/Al para todas las temperaturas y relaciones molares. Anâlogamente, la cantidad de cloro producido aumenta con tinuamente al hacerlo dicha razôn.
Las pendientes de las curvas de desapari-

COO
uOIoKS
<&
8CM
oin
8COVO
Oin
IPd Po

CM
Hs
u01oNK\
2I(dI
8
X
s
8 so
S
s

CO
I
ualA00K\
<aI(à
8
<X
8 VO
8
tndQo

CM
I
U01lAGOtA
<ctiXIH
OCM
oin
8
O
v£>
§
s :

00
ua
§
3ICdI
S
CMH•
IHfib
:

ca
uot8-zf
2g<AuIH
I
<%
8
8 v£>
§
8
too :

102
ciôn de cloruro de hidrôgeno y de apariciôn de cloro son inicialmente elevadas disminuyendo paulatinamente al cr^ cer la razôn M/Al*
Para las temperaturas mâs bajas 370 y 3830c y a todas las relaciones molares, las pendientes continûan decreciendo (en valor absoluto) incluso para el valor mâximo de la relaciôn M/Al investigado. Esta circunstancia indica que en estas condiciones no llega a alcanzarse el equilibrio.
Para un mismo M/Al, la pendiente de la curva de desapariciôn de cloruro de hidrôgeno es tanto mâs elevada cuanto menor es la relaciôn Rml* Sin embar go, a valores elevados de la razôn M/Al sucede tbdo lo contrario* Este hecho indica, como era de esperar, que el sistema estâ tanto mâs cercano del equilibrio cuanto menor es la relaciôn Rml, es decir, cuanto mayor es la cantidad de aire utilizado*
A 4000C se alcanza el equilibrio para las dos relaciones molares consideradas; para la relaciôn Rml = 0*84 a M/Al 175 y para la relaciôn Rml = 0*42 a M/Al & 123.
En la interpretaciôn cuantitativa de ej[ tos resultados con el fin de deducir las ecuaciones c^ néticas correspondientes solo podrân utilizarse los da tos expérimentales que correspondan a las zonas anterio res al equilibrio* Por otro lado, y dado el error expe rimental de que vendrân afectadas las velocidades ini-

103
claies medldas como pendientes de las curvas de distribu ciôn para M/Al = 0,no se considerarân tampoco estas velocidades iniciales en los câlculos sucesivos*
En la bibliografia consultada (13) (25) se encontraron dos posibles mecanismos para explicar la acciôn catalitica del cloruro de cobre en el proceso de oxidaciôn del cloruro de hidrôgeno.
- Mecanismo X
ClgCUg 4. 1/2 Og * ClgCuOCuClgCuOCu * 2 CIH = ClgCuClgCu 4. H^O ClgCuClgCu = ClgCUg 4 Cl^
- Mecanismo II
ClCu 4. 1/2 Og = OCu 4. 1/2 Cl^OCu 4. 2 CIH -■ * ClgCu 4. H^O Cl_Cu = ClCu 4. 1/2 Cl.
Nuestro interés se centrarâ en decidir el me canismo por el que el catalizador seleccionado y preparado en nuestro laboratorio ejerce su acciôn catalitica, compro^ bando asi mismo si responds o no a alguno de ios mecanismos indicados.
b,- Tratamiento cuantitativo de las re^cciones entre gases catalizadas por sôlidos.
Segun la conocida teoria de Lan^uir-Hinsel- wood (79), una reacciôn catalitica gas-sôlido transcurre a

104
travês de las siguientes siete etapas consecutivas :1.- Transporte de reaccionantes hasta la superfi
cie exterior del catalizador.2.- Difusiôn de reaccionantes por los poros del
catalizador hacia el interior.3.- Adsorciôn quimica de uno o mâs reaccionantes
sobre centres actives del catalizador.4.- Reacciôn superficial.3.- Desorciôn de los productos.6.- Difusiôn de los productos por los poros del
catalizador hasta su superficie.7«- Transporte de productos desde la superficie
del catalizador a través de la masa gaseosa.
Las etapas 1, 2, 6 y 7 son etapas fisicas de transporte, mientras que las etapas 3# 4 y 3 consti- tuyen las etapas de reacciôn quimica bien entre los reac_ cionantes o entre estos y los productos con centros ac— tivos del catalizador.
c.- Etapas de transferencia de materia.
Para comprobar el posible control de las etapas 1 ô 7 (transporte de reaccionantes o productos a través de la fase gaseosa sobre todo de la pçllcula laminar gaseosa -zona de mâxima resistencia de esta fase- que rodea a las partlculas sôlidas del catalizador) se han representado en la figura 6.14 los resultados de los experimentos incluîdos en la tabla 3*3 an la forma ren-

##in
S
S<pi3Mu.

106
dimientos obtenidos frente al caudal total de reaccionan tes allmentados* De controlar las etapas 1 6 7« al aumen tar la velocidad de circulaci6n del gas sobre la superf^ cie del catalizador disminuiria el espesor de la pelicu- la gaseosa y por tanto su resistencia, con lo que para el mismo valor de la razôn M/Al, la velocidad del proceso global aumentar£a*
La serie de experimentos se realizô a la temperatura mâxima de 4000C pues en estas condiciones, ya que la difusividad mâsica varia con la potencia 3/2 de la temperatura en tanto que la constante de velocidad de reacciôn varia exponencialmente (Ley de Arrhenius) la influencia de dichas etapas serâ resaltada al mâximo#
De la observaciôn de la figura 6.14 puede comprobarse la no influencia de los caudales manejados sobre el rendimiento en cloro, lo que demuestra que el transpoprte de reaccionantes o productos no contrôla la velocidad global del proceso y las etapas 1 y 7 podrân tratarse como etapas de equilibrio, es decir, las pre- siones parciales de los distintos componentes sobre la superficie del catalizador coinciden prâcticamente con sus valores en el seno de la masa gaseosa#
Por otro lado, el tamano de particule uti lizado (100-l40 mallas) permite eliminar "a priori" la poaibilidad de que controlen las etapas de difusiôn 2 y 6, pocas veces significativas, incluso para mayores tamanos de particula que los empleados.

107
d.- Etapas qulmicas.
Como se ha expuesto en el apartado anterior, las etapas fisicas 1, 2, 6 y 7 pueden tratarse como etapas de equilibrio dada la rapidez con que transcurren# La velo cidad global del proceso vendrâ pues definida por alguna de las très etapas quimicas 3$ 4 6 5* No obstante, para deducir las ecuaciones de velocidad correspondientes a la hip£ tesis de que una de las très etapas mencionadas contrôle el proceso por su mayor lentitud, se ha de suponer en principle que se cumplen las siguientes condiciones :
1«- Las etapas de transf erencia de materia se consi derarân como etapas de equilibrio#
2#-> De las très etapas quimicas 3,4 y 3, una transcurre con mayor lentitud y contrôla la velocidad global del proceso#
3#- Las otras etapas quimicas se çonslderarân como etapas de equilibrio.
4#- Las constantes de adsorciôn y de velocidad serin independientes de la presiôn#
3#- Los "centros actives'* y los compuestos adsorb! dos reaccionarân siguiendo la ley de acciôn de masas#
6#- La concentraciôn total de centros actives, L, se mantendrâ constante#
7#- Los compuestos gaseosos se comportarân ideal- mente en las condiciones de trabajo empleadas#
De acuerdo con los mecanismos I y XI indicados en el apartado a.- se considerarân en principle dos

108
posibles mecanismos para la reacciôn de oxidaciôn de clo ruro de hidrôgeno a cloro suponiendo en primer lugar que se realiza sobre un "centro activo" en ambos casos,
- Mecanismo Ml
1/2 Og 1 1 --- 01 siendo :01 4. 2 H = = ^ Clgl 4- W H ; CIHClgl = Clg * 1 W : HgO
1/2 0 4. 2 H . ' I Cl 4 W
Suponiendo en este caso que el "centro ac, tivo", 1, représenta a la especie quimica Cl^Cu^ (cloruM ro cuproso bimolecular)•
- Mecanismo M2
1/2 Ou 4 Cl 1 = : 01 4: 1/2 Cl_ siendo :01 4 2 H 4 Cl^l 4 W H : CIHflgl = = Cl 1 4 1/2 Cl^ W : HgO
1/2 Og 4 2 H = C l^ 4 W
Suponiendo ahora que el "centro activo", 1, représenta a un âtomo de cobre en sus dos posibles estadosde oxidaciôn (Cu^ y Cu**).
En la deducciôn de las ecuaciones de velocidad correspondientes a cada mecanismo propuesto se ha se-guido el procedimiento habituai (ÔO) indicado en el apônd^ ce 9*4.1 ex? el que se deducen las ecuaciones 11, 11* y 11" correspondientes al mecanismo Ml y 11 a, 11 * a y 11" a correspondientes al mecanismo M2*

109
Para comprobar el ajuste de las sels ecuaciones planteadas a los datos expérimentales se procediô, debido a la dificultâd de tratamiento por el método general de mlnimos cuadrados, a efectuar las simplificaciones necesarias para poder expresarlas en forma fâcilmente representable grâficamente.
Ecuaciones simplificadas de este tipo pueden conseguirse considerando :
1#- Reacciôn reversible, que implicarla una ecuaciôn de velocidad con dos constantes en el numerador y un tôr- mino del denominador mayor que los demâs.
2.- Reacciôn irreversible,representada por una ecu^ ciôn de velocidad con dos tôrminos del denominador de igual orden de magnitud y mucho mayores que los restantes.
3«- Reacciôn irreversible,apareciendo en la ecuaciAi de velocidad un ûnico término en el denominador mayor que los restantes.
Las ecuaciones de velocidad se linealizaron tal como se indica y los resultados obtenidos se resumen en las tablas 9. 2 , 9. 3 . 9«. 4 » 9*5 , 9*6 y 9* 7 las que se indica la simplificaciôn considerada, las expresiones de la ordenada y abscisa, los resultados esperados y los con- seguidos.
Solo se obtuvieron resultados satisfacto- rios con la prueba nûmero 3 de la tabla 9* 2 que corresponde al mecanismo Ml suponiendo reacciôn reversible con trolada por la reacciôn elemental de adsorciôn de oxlge-

110
no y con la suposiciôn de que el término del denom^nador de la ecuaciôn de velocidad 11 correspondiente a la adsorciôn de cloro, es mucho mayor que los otros dos.
Por ser éste el mecanismo que se ajusta a los datos expérimentales, se detalla a continuaciôn la li. nearizaciôn indicada anteriormente a partir de la ecuaciôn de velocidad 11. Al ser b^P^ «ayor que 1 4queda :
opérande y transponiendo términos :
" W " ' ^
Teniendo ahora en cuenta que la velocidad con quq transcurre el proceso de oxidaciôn de cloruro dehidrôgeno a cloro coincide con la velocidad neta de apari
2 0 3 2ciôn de cloro, al representar r^P^/P^ frente a P^* Pjj/P^^
debe obtenerse una recta de pendiente k^L/b^ positiva y una ordenada en el.origen k^L/b^K negative. Ep las figuras 6.13, 6.16 y 6.17 se han representado los resultados obtenidos para las très temperaturas 370, 305 y 400ûC re^ pectivamente.
Los datos expérimentales se hap ajustado por mlnimos cuadrados, obteniéndose para la pendiente y ordenada en el origen respectives los siguientes valores:

xIO
370 - 0JB4
370 - 0A2
05
0.5
000
FIGURA 6,15

xIO
2D
as
OS
OD50
FIGURA 6,16

xIO400 — 0.84
0 5 10
FIGURA 6.17

.114
k L k LT QC K, = — r— K_ = —1 2 b^K
370 0.000849 0.0002967385 0.001410 0.0002884400 0.001864 0.0002809
Aimque y no son constantes individua les de velocidad, sino una combinacx6n de b^, k y K, cu- yo significado se indica en el apéndice 9*4, siguen nna riaci&n de tipo exponencial y por tanto se disponen en 1 nea recta al representar los valores de Ig frente a 1/T dados en la tabla 6.1 y representados en la figura 6.I8 de acuerdo con la ley de Arrhenius.
TABLA 6.1
t (QC)* 1/T (K'I) Ig K, Ig K2
370 1.335 « 10"5 - 3.071 - 3.528383 1.520 .io"5 -2.831 -3.540400 1.486.10"^ -2.730 -3.551
Oon el fin de comprobar la utilidad de la ecuaciôn de velocidad deducida y su bondad en cuanto a la reproduccién de los datos expérimentales, se procediô a la integraciôn de la misma por un método numérico de Runge - Kutta (de cuarto orden) (81). La transformaci6n efectuada con la ecuacion de velocidad se indica en el apéndice 9*4.2.

tgK. tgK
3.45
.-35
-360-31150 152 154
FIGURA 6.18

lib
Es preciso«antes indicar los resultados ob tenidos« tener en cuenta las siguientes consideraciones :
Dado que la ecuaciôn de velocidad deducid^
^ - *1 ^ 7 *2 „2
indica que en el momento inicial de la reacci&n en que por no haber comenzado ésta, la presiôn parcial de agua y d o ro son nulas, la velocidad es :
or = K^— ------K2--2- =
no pueden referirse los valores de rendimiento en cloro a uno, para un valor inicial de M/Al =0, en el procedimien to de integraciôn numérica empleado,
Por este motivo, el valor mka bajo de M/Al considerado fue 5» igual a la longitud del intervalo A(M/A1) elegido# El correspondiente valor de rendimiento en cloro se déterminé a partir de las curvas de distri- bucién respectives•
El hecho de que en los momentps iniciales la ecuaciôn de velocidad no responda coherentementealos resultados obtenidos« se ha interpretado posteriormente suponiendo que si bien en el momento inicial de la reac- ciôn, la producciôn de cloro por oxidaciôn dp cloruro de hidrôgeno es nula« la simple descomposiciôn térBica de la forma Cl^Cu del catalizador podrla' liberar cantidad

117
suficiente de cloro como para que la velocidad inicial de reaccion pasara de ser infinite a tomar un valor elevado, pero finito# Esta suposicion se ve por otra parte confir mada por algunos trabajos de cloraciôn y oxicloraciôn (82) realizados utilizando como ûnico agente dorante, catali- zadores con base cloruro de cobre como el desarrollado en nuestro laboratorio, hecho éste que reconoce la singular propiedad de estos catalizadores de liberar cloro en su descomposiciôn térmica#
Los resultados obtenidos en la integraciôn de la ecuaciôn de velocidad deducida, se incluyen en la ta bla 9#9 y como puede apreciarse en la figura 6.19, en la que se han representado los rendimientos en cloro calcula- dos frente a los expérimentales, reproducen los resultados expérimentales con una desviaciôn mâxima de i 5 por ciento, que razonablemente puede ser debida al error experimental.
* Tanto la comprobaciôn del mecanismo de rea<çciôn propuesto, como la integraciôn numérica de la ecuaciôn diferencial de velocidad de reacciôn, se han efectuado con sendos programas en lenguaje FORTRAN IV procesados por el ordenador IBM 36O/65 de que esta dotado el Centro de Câlcu lo de la Universidad Complutense de Madrid. No se incluyen aqui ni los listados correspondientes a los mencionados programas ni mayor detalle en los resultados obtenidos, que por otro lado se encuentran disponibles en Ta Câtedra de Ingenieria Quimica de la Universidad Complutense de Madrid para cualquier consulta posterior.

1.0
calc.
as
ae
0.4
012
OJO0.0 02 04 10OJB
O 370 - 084 o 385 - 0B4 • 4 0 0 -0 0 4
0 370-042 # 385 - 042 • 400-Q42
FTGTIRA G . i q

119
Finalmente es de destacar que la integraciôn numérica de la ecuaciôn de velocidad deducida para el proceso de oxidaciôn de cloruro de hidrôgeno a cloro ûnicamente resultô satisfacoria iras sucesivos ajustes de los valores de las constantes de velocidad, realizados por una selecciôn ponderada de los datos expérimentales utilizados para su evaluaciôn.

120
6.3.- ESTUDIO CINETICO DE LA OXICLORACION DE METANO
6.3.1.- EXPERIMENTOS PREVIOS
a.- Variaciôn de la actividad del catalizador.
La figura 6.20 représenta los resultados que resume la tabla 3.6. Los experimentos, por las razo- nes apuntadas en el apartado 6.2.1, se han realizado a la temperatura maxima de 400QC y con relaciones molares Rml y Rm2 de 0.84 y 10.0 respectivaipente.
Se han representado en ordenadas, la con versiôn (C), selectividad (S), rendimiento en clorometa nos (n_^ p) y cantidad de metano oxidado (Q), frente al
Xtiempo de duraeiôn del experimento en horas.
Puede observarse que dentro del error ex perimental, todas las variables investigadas se mantie- nen constantes. Por otro lado, el aspecto flsico externe del catalizador permaneciô invariable durante todo el experimento.
A pesar de la estabilidad mostrada por el catalizador, nunca se empleô en el estudio cinético realizado, un catalizador con mâs de las 40 horas de utilizaciôn investigadas. Por este motivo se préparé can tidad suficiente del mismo como para asegurar que en to- dos los experimentbs cinéticos se utilizase ux catalizador de la misma composiciôh y preparado de igual manera.

cc/) L) p ^\cC> () c c1 -
0 0 0 c
C <> 0 (>
c <> c (>
o0 1> 0 o
oXOc 1> <> (> c(/)•*o
. c <' 0 <►
Xc c o (1
c 1> c1 )
o i > o D
_____ 1__ c______c . .. .1................................. ........ — i L-.
2CD
- 8oCl«sD<OC§HCx.
X s s s

b.- Selecciôn del intervalo de variables a utili- zar en el estudio cinético#
A la vista de la bibliografia consultada (25) sobre estudios similares de oxicloraciôn y del estu dio cinético del proceso de oxidaciôn de cloruro de hidrô geno a cloro, se han decidido los siguientes intervalos de variaciôn para las variables estudiadas, aténdiendo a las limitaciones que afectan a esta selecciôn, ya discu- tidas en el apartado 6.2,1.
i.- Relaciones molares Rml y Rm2.Respecte a la relaciôn molar Rml (moles
de cloruro de hidrôgeno/mol gramo de aire alimentado) no se considéré interesante cambiar el intervalo empleado en el estudio cinético de la oxidaciôn de cloruro de hidrôgeno a cloro (Rml : 0.84 - 0.42), pues si bien la pre sencia de altas relaciones de oxigeno frente al metano alimentado se presumieron en un principio como desfavora bles en el sentido de faciliter la combustiôn del hidro- carburo, los experimentos previos realizados (nûmeros 13 a 28 de la tabla 3.3) mostraron que mientras el rendimien to en clorometanos crecla sistemâticamente al aumentar la cantidad de oxigeno utilizado (mener Rml), el porcentaje de metano oxidado no se afectaba de modo apreçiable.
Tampoco pareciô aconsejable trabajar con cantidades de oxigeno menores de la estequiom^trica (Rml mayor de 0.84) pues la combustiôn del hidrocayburo trans- curriô dentro de limites aceptados como normales en los

trabajos bibliogrâficos consultados.En cuanto a la relaciôn molar Rm2 (moles
gramo de cloruro de hidrôgeno/mol gramo de metano alimen tado) teniendo présente, como ya se indicé anteriormente, que el agente dorante del metano habria de ser el cloro producido simultâneamente a la reacciôn de oxicloraciôn.
4 Clg 4 CH^ Cl^C 4 4 CIH
se fijô inicialmente en ocho moles gramo de cloruro de d drôgeno por mol de metano alimentado. La revisiôn biblio^ grâfica efectuada (23) confirmé este valor como medio en tre los mas comunmente utilizados. (4-l4). Por otro lado se realizaron experimentos con relaciones molares Rm2 pr.^ ximas a la unidad y a l6. En el primer caso, como era de esperar (experimentos 13 a 28, tabla 3*5), la combustiôn del hidrocarburo era a veces superior al 309é del metano total alimentado y en los experimentos con relaciôn molar Rm2 = l6 se alcanzaron con suma facilidad conversiones to> taies de metano a tetracloruro de carbono, cop lo que el comportamiento del sistema desbordaba el campo de nuestra investigaciôn.
Por este motivo y en espera de que el estudio cinético posterior confirmase las predicciones efec tuadas, se eligiô un margen para Rm2 comprendido entre 6 y 10 moles gramo de cloruro de hidrôgeno por mol gramo de metano alimentado.

124
11•- Temperatura.En la figura 6.21 se presentan los resul^
tados obtenidos en los experimentos 1 a 12 de la tabla 5*5• En ella se puede observer que a partir de 370CC y sea cual sea la razôn M/A2 (gramos de catalizador emplea dos/caudal molar de metano alimentado), los rendimientos en clorometanos son elevados* Por otra parte, segûn se ha comprobado en el estudio cinético de oxidaciôn de cloruro de hidrôgeno a cloro, a temperatures de 4000C, el sistema alcanza prâcticamente el equilibria.
Los experimentos se han realizado con una relaciôn Rm2 suficientemente elevada como para apreciar en que momento la temperatura de reacciôn dejaba de ser significative.
De esta manera se eligiô como intervalo de temperatura el comprendido entre 370 y 400@C coïncidente con el del estudio cinético de la oxidaciôn de cljo ruro de hidrôgeno a cloro.
6.3.2.- ESTUDIO CINETICO
a.- Consideraciones previas semicuantjtativas.
En las figuras 6.22 a 6.33 sq presentan las curvas de distribueiôn de productos relatives a los experimentos que xncluye la tabla 3.8 en funeiôn de la razôn M/A2 con t, Rml y Rm2 como parômetros.

II f f
<o
cv
§

oo
C45
00
uaO
<cdg<ceaI
O)
00
«o
oo o.
oo
CMCM•VO

ooiH
CM
CM
O
uoto
<AiI
§m
K\
(O
• 4
XQ u>
K\CM#\0
K§Mk

o
C]
00
001or-K\
<XIXMI
CM<
8o>
§CMVP<X5OHEfc
OOm
S

o<0
CM
CM
U01or-K\
Xg<XuI
os
to
#0
om o
lACM
\0
X§

o»
o
CM
00
i
u01lA00KS
IMI
o>
XQ m
vDCM
2§MÙk

o#
o
CM
CM
UalAGO•A
2
iq :M
I
o>
(O
o *
+ **
Xs m
r-CMVO

g\o
Ci
IO
U01IfN00
2
IMI
'f
§Hh
S §

o\o
Cii
Ci
O
U01lA00K\
3g3tùI
o
cm
o o
CM<
o\CMvü
8H6t»
m

oH
Cl
00
Hê
Oaoo
3g2uI
m
+ O
Ou>
o
3ëHh.

o#
o
MsCM
Uooo•4*
siOù
I
*<o
Q
N<
VO
2§HGb

oVO
N
-S*00O
oa§
:Mi
3
i
04KN•VO
a§
i
X § §

oVO
d
CM
u01§
Eo:[à
I
o*<
X •
CM<
Os
§
K\ K\ ' #
s§Hk
lO§

158
En ordenadas se representan los rend! - mientos de cada producto, n^(moles gramo de producto x/ mol gramo de metano alimentado).
De la observaciôn de las curvas de dis- tribuciôn, se deduce la influencia ya esperada en cuanto a las relaciones molares Rml y Rm2 en el sentido de que la producciôn de clorometanos es mayor cuanto menor es la relaciôn Rml y mayor la Rm2,
En todos los casos la cantidad de metano no reaccionado disminuye continuamente al aumentar la ra zôn M/A2 y solo en la curva 6,31 parece llegarse a un equilibria para un valor de M/A2 prôximo a 950« indicado por la parte horizontal que muestra la curva de apariciôn de tetracloruro de carbono,
Por otro lado, la forma de las curvas de distribuciôn (figura 6,31) con los môximos que presentan las curvas correspondientes al cloroformo, cloruro de mje tileno y cloruro de metilo, atestiguan que se trata de reacciones que transcurren en serie (consécutives) y el hecho de que en ninigôn experimento se haya detectado cl^ ro libre entre los productos de reacciôn podrla interpr^ tarse en el sentido de que la cloraciôn del ^idrocarburo fuera mucho mâs râpida que la producciôn catalltica de cloro, paso éste ûltimo que controlarla la velocidad gl^ bal del proceso de oxicloraciôn de metano.
Se ha comprobado adem&s que en este proceso, la distribuciôn de clorometanos résulta fija para

139
cada grado de cloraciôn determinado (âtomos gramo de cljo ro que entran a formar parte de la composiciôn media de los clorometanos obtenidos, independientemente delas condiciones en que se haya llevado a cabo cada exp^ rimento* Este hecho ha sido ya resaltado por diverses autores (25) (45 a) (83) y se visualiza en la représenta ci6n de la figura 6.34. En ella se représenta la fracciôn molar n^, ^ de cada clorometano referida al total de los
Xobtenidos frente al grado de cloraciôn, x^^.
Podrla interpretarse este hecho por la con currencia simultânea de dos circunstancias :
1.- Que las constantes de velocidad de reacciôn ga ra las reacciones de formaciôn de los cuatro clorometanos sean del mismo orden de magnitud.
2.- Que la variaciôn de estas constantes de velocidad con la temperatura sea tal que se mantëngan inva - riables las relaciones entre ellas a todas las temperatu ras, ya que estas relaciones en definitive serân las que determinen el reparto constante de clorometanos.
A la vista de cuanto antecede parece l6g^ co suponer que el mecanismo por el que transcurr&n las cuatro reacciones elementales de oxicloraciôn :
X'CH. * 1/2 0„ 4. CIH = = = CICH, 4. H„0 (l)4 2 3 2
C1CH_ 4. 1/2 4. CIH Cl^CH. 4- H_0 (2)r
CI.CHL 4. 1/2 0_ 4. CIH 3= ^ Cl,CH 4- H.O (3>6 6 6 3 2
ClgCH 1 1/2 Og 4. CIH 3=à=£ Cl^C * H^O

CLC
Q9
08
OjO1 2 X 43
FIGURA 6 .3't

I4l
serâ el mismo, estando controladas todas las velocidades de reaccion (r^, r^, y r^) por la misma etapa flsica o quimica*
Para las cuatro reacciones elementales m dicadas se ha propuesto el mismo mecanismo (M)) que se de talla a continuaciôn para la primera de ellas :
1/2 Og l ClgCUg = 2 : ClgCuOCu ,
ClgCuOCu 4. 2 CIH = 2 : ClgCuClgCu
ClgCuClgCu * CH^ = ClgCuCuClCHg 4 CIH
Cl.CuCuClCH, = : CICHL 4 Cl Cu_2 3 ) 2 2
1/2 Og 4 CIH 4 CH^ = ClCHg 4 H^O
A continuaciôn se trata de comprobar la bondad del mecanismo propuesto para las cuatro reacciones elementales indicadas, deduciendo las ecuaciones y constantes de velocidad correspondientes#
b«- Etapas de transferencia de materia
Se han realizado cuatro experimentos de oxicloraciôn a la temperatura mâxima de 4000C y en las condiciones que se resumen en la tabla 5*7» Los resultados obtenidos se'presentan en la figura 6.35, en la que se ha representado el rendimiento de metano (n^^), cloruro de me tilo (n j ), cloruro de metileno (n^^) , cloroformo (n^^) , tetracloruro de carbono (n^^) y diôxïdo de carbono (n^^), frente al caudal total de gases (n_) que atraviesa el le-

ro c CM ü V—o (J c) u o CJ
( > O > i > o c
ouOm C D ( <> c i »mO 'CM _Ooo« o O (> <) o i >• • •X
-
O o c ) 0 <>
1 1X n Ci gc o o O o
s
s tr\tr\J
<X5C
S

143
cho catalîtico.Por las mismas razones expuestas en el apar
tado 6.2.2 c, de las curvas obtenidas se deduce que dentro del error experimental, las etapas de transferencia de materia (1,7) se pueden considerar como no contrôlantes de ninguna de las velocidades de las cuatro reacciones elemen tales.
Por otro lado, dado que el catalizador uti lizado ha sido el mismo que el empleado en el estudio cinjê tico de la obtencion de cloro a partir de cloruro de hidrjô geno, se pueden ya suponer como etapas no contrôlantes,las de difusi&n de reaccionantes y productos (2 y 6) por el in terior de los poros del catalizador#
c.- Etapas gulmicas.
Por las mismas consideraciones del aparta- do 6.2.2 d, el mecanismo M3 propuesto anteriormente puede expresarse concretamente para la reacciôn elemental l,por las cuatro etapas siguientes :
1/2 Og 4 1 — 01 siendo :
01 4 2 H Clgl 4 W II : CIH
CO 4 Clgl = = Cl 1 4 H W : H^O
Cl 1 5 = 2 : ' Cl 4 1 CO ; CH^
1/2 Og 4 H 4 CO = 2 : Cl 4 W ' CICH^

144
El "centro active”, 1, représentera pues a la especie quimica Cl^Cu^ (cloruro cuproso bimolecular).
La deducciôn de las ecuaciones de velocidad correspondientes, segûn cual de las etapas contrôle la reacciôn elemental, se detalla en el apéndice 9.5, por lo que no se insistirâ sobre ellas aqul* Con las mismas simplificaciones indicadas para el caso de la obtenciôn de cloro a partir de cloruro de hidrôgeno, se han linearizado como alll se indica, y los resultados se presentan en las figuras 6.36 a 6.47.
Se obtuvieron resultados satisfactorios con el caso nfi 1 de la tabla 9.12 que corresponde a la h^ pôtesis de reacciôn reversible controlada por la reacciôn elemental de adsorclôn de oxigeno, con la suposiciôn de que el mayor término del denominador de la ecuaciôn de vje locidad de reacciôn es la unidad.
Por ser éste el mecanismo que se ajusta alos datos expérimentales, se indica a continuaciôn la forma de la ecuaciôn de velocidad résultante y la forma de los grupos de variables G1 y G2 representados en las figuras 6.36 a 6.47 resultado de la linearizaciôn efectuada.
Ecuaciôn de velocidad para la reacciôn el mental 1 con el mecanismo propuesto, suponiendo a la adsor ciôn de oxigeno como etapa contrôlante :
r, =

G1
60
40
201 - 370 ®C
0*0
0.840.42
1010 O
0.840.42
66
FIGURA 6.36

G1
60
40
201 -385 •€
00 10 62
*o
0.840.42
10 10
FIGURA
• 0.84 6O 0.42 65.37

G1
60
40
20400 ®C
00 10 G2
O 0.84 100 0.42 10
# 0.84 6O 0.42 6
FIGURA 6.38

G1
370 ®C
3
2
00 05 G2
G 0.84 10O 0.42 10
• 0.84 6O 0.42 6
FIGURA 6.39

G1
385 ®C
IS
10
Û5
00 62
0 0.84 10 e 0.84 6O 0.42 10 o 0.42 6
FIGURA 6.40

01
2 - 400 ®C
15
ID
OS
00 G2
O 0.84 10O 0,42 10
FIGURA
e 0,84 6O 0,43 66,41

G1
370 ®C
4
3
2
0620 2 3
• 0.84 10 e 0.64 6o 0.42 10 O 0.42 6
FIGURA 6.42

G1
385 ®C
3
2
omD0OS G 2
• 0.840 0.42
10 10
FIGURA
#O6.43
0.84 60.42 6

61
400
1.5
0.5
06 6204020
@ 0 . 8 4 10 e 0 . 8 4 6
© 0 . 4 2 10 O o . i 2 6
FKil KA <>,Vf

61
370 ®C
3
2
02
O 0.84 10© 0.42 10
# 0.84 6O 0.42 6
FIGURA 6.45

G1
385 ®C
3
2
0G2
0 0.84 10o 0.42 10
e 0.84O 0.42
FIGT’RA ( . , ' i i

G1
400 ®C
3
2
#0
00 G 2
*o
0.840.42
10 10
FIGURAO6.47
0.840.42

157
Por ser la unidad el mayor término del denominador, la ecuaciôn queda :
^1^ ^ci^w
Transponiendo termines :
^Cl^W= K.
p^«5p p0^ ^CO^H ^Cl^W
- K.
Siendo •
G1 =^Cl^W
G2 =pO*5p p
- % ? 7 -(i)
= k,L Kg =kiL
, Puesto que se supone el mismo mecanismo -para las tres reacciones elementales restantes, los grupos G1 y G2 para las mismas resultan ser :
- Reaccion elemental 2 : oxicloraciôn de cloruro de metilo a cloruro de metileno :
G1 = ^2^C1^H^C2^W
G2 =pO*5p p Og Hp p^C2 W
(ii)
» Reacciôn elemental 3 • oxicloraciôn de clorurode metileno a cloroformo ;

158
pO*5p pG1 = — -— p y G2 = p-p--- (iii)
C3 W ^C3 W
- Reacciôn elemental 4 : oxicloraciôn de cloroformo a tetracloruro de carbono :
pO*5p Pr&PciPH Oo HG1 = H y G2 = | - p ---- (iv)
C4 W W
El grupo de variables G1 se ha représenta do siempre en ordenadas y el G2 en abscisas. Las figuras 6*36 a 6.38 corresponden a la reacciôn elemental 1, las 6.39 a 6,4l a la reacciôn elemental 2, las 6.42 a 6.44 a la reacciôn elemental 3 y las 6.45 a 6.4? a la reacciôn elemental 4*
Las velocidades netas de desapariciôn de metano y de formaciôn de los clorometanos tienen por ex- presiôn ;
^ ^CO " d M/A2 * ^1
= ri - rgd M/A2
— gg ■ = ^2 - r.d M/A2
d n

159
d nC4 d M/A2
s* r.
pudiendo evaluarse a partir de las pendientes de las rejs pectivas curvas de distrlbuciôn. Con ellas y sucesivamen te con la ecuaciôn anterior o posterior pueden calcular- se los valores de las velocidades de las reacciones ele- ipentales r^, r^, r^ y r^ para cada valor prefijado de M/A2.
Ajustadas por minimos cuadrados las ecua clones de las rectas de las figuras 6*36 a 6.47, ultima- mente citadas, se deducen las pendientes y ordenadas en el origen, es decir, los valores de las constantes que se indican en la tabla 6.2, para las tres temperaturas de ex perimentaciôn.
TABLA 6.2
t (PC) 370 385 400
Kll . (10^) 5.927 7.589 8.238K12 . (10^) 1.976 1.607 1.399K21 . (10^) 5.117 7.406 8.171K22 . (10^) 1.362 1.016 0.748K31 . (10 ) 2.935 4.952 6.225K32 . (10^) 1.027 0.742 0.491K41 , (10^) 0.931 2.004 3.178K42 . (10^) 0.231 0.203 0.172

l60
De acuerdo con lo previsto, el orden de magnitud de las constantes deducidas por este procedi - miento es similar. Por otro lado, el ajuste alcanzado en la linearizaciôn de las ecuaciones de velocidad correspondientes confirma la bondad de los mecanismos propues^ tos para las reacciones elementales consecutivas impli- cadas en el proceso global de oxicloraciôn de metano.
La comprobaciôn del mecanismo propuesto para las cuatro reacciones elementales, se ha efectuado con un prograba de câlculo en lenguaje FORTRAN IV, que ha permitido la linearizaciôn conjunta de las respecti- vas ecuaciones de velocidad. La concordancia lograda en los valores de las constantes correspondientes a las ecuaciones de velocidad r y r_, calculadas altemativa mente a partir de r^ y r^ demuestra cualitativamente la validez de las mismas.
Se hd preparado asi mismo un programs de câlculo para la integraciôn simultânea de las cuatro ecuaciones de velocidad por un método numérico de Runge— Kutta de cuarto orden.
Pese a los numerosos ajustes que sobre las constantes de velocidad se han efectuado por el pro cedimiento de evaluaciôn ponderada de los datos expérimentales utilizados para el câlculo de las mismas, empleado con éxito en el estudio cinético de oxidaciôn de cloruro de hidrôgeno a cloro, no se ha conseguido aôn la reproducciôn total de los resultados expérimentales

l6l
con la precislôn que séria de desear.Se atribuye tal circunstancia a los si -
guientes hechos :- La interacciôn simultânea de las ocho constan
tes de velocidad, en la integraciôn de las ecuaciones co rrespondientes a las cuatro reacciones elementales, im- pide la modificaciôn independiente de una de ellas sin terar el resultado de las restantes ecuaciones en las que no interviene.
- Pequenas modificaciones, incluso menores del 10por ciento, en el valor de una de las ocho constantes empleadas como parâmetros en el programa de integraciôn,se ha comprobado que tienen drâsticos efectos en el valorde los resultados obtenidos.
Se ha elaborado un nuevo programa basado en el procedimiento de integraciôn simultânea ya indica- do, que por un método variacional de generaciôn interna de las constantes de velocidad a partir de los valores calculados, evitarâ los problemas de ajuste planteados.
Habida cuenta de la dificultad, que en el momento de redactar esta memoria, se encontrpba en el Cen tro de Câlculo, para procesar este nuevo programa variacional, no se informa aqul de los valores definitives de las ochb constantes a que han de conducir las deducidas de las figuras 6.36 a 6.47 y que permitirân la reproducciôn de los dates expérimentales con una precisiôn que se espera sea de orden de magnitud similar al alcanzado

162
en el proceso de oxidaciôn de cloruro de hidrôgeno a cl£ ro.
Tanto los programas de câlculo utilizados como el detalle de los resultados obtenidos, se encuen - tran disponibles en la Câtedra de Ingenieria Quimica de la Universidad Complutense de Madrid para cualquier consulta posterior,
6.4.- METODO DE OPTIMACION DE BOX-WILSON
6.4.1.- AJUSTE DE UNA SUPERFICIE DE RESPUESTA A LA REGION ESTUDIADA.
Con objeto de compléter la informaciôn , con miras al desarrollo prâctico del proceso de oxicloraciôn del metano, se procediô a la optimaciôn del men- cionado proceso por el método de Box-Wilson, basado en el ajuste de la respuesta de un sistema en una regiôn del espacio n dimensional definido por las n variables contrôlantes del mismo a un desarrollo polinômico, y en el desplazamiento hacia el ôptimo por la linea de mâxima ganancia respecte a la funciôn objetivo a opti- mar, con un numéro minime de experimentos.
Por este motive se procediô a la elabo- raciôn de un diseno experimental, es decir, a la deli- mitaciôn de la regiôn en la que estudiar el comporta - miento del sistema, coincidente en este caso con la que

163
se utilizô para el estudio cinético, atendiendo a los condicionamientos necesarios para lograr las ventajo- sas condiciones a que se alude anteriormente y que se detallan en el apéndice 9.6#
La etapa numéro 3 (apartado 9.6.5) del método de optimaciôn de Box-Wilson ha sido eliminada en base a que del estudio cinético realizado se conocia "a priori" de la realizaciôn del método de optimaciôn, una regiôn aceptable de antemano como ôptima,por los eleva- dos valores de rendimiento en clorometanos obtenidos.
Con este diseno se pretendla ajustar la respuesta del sistema,eligiendo como funciôn objetivo el rendimiento global en clorometanos (moles gramo de clorometanos producidos/mol gramo de metano alimentado), a un desarrollo polinômico de primer grado con t, M/A2, Rml y Rm2 como variables contrôlables, esto es, en un espacio de cuatro dimensiones.
La matriz de diseno elegida, esté resu- mida en la tabla 5#9 Y corresponde a las condiciones operativas que indica la tabla 5*10 en la que asi mismo se incluyen los resultados obtenidos.
^1 ajuste de la superficie de respuesta efectuado como se indica en el apéndice 9.6 hft dado como resultado el siguiente desarrollo polinômico.
Superficie ajustada para el diseno n& 1 :
p = 70.20 4. 7.48 4. 8.30 é 5.35 Y^ - 3.80 Y;

164
Siendo :p * rendimiento de los clorometanos
- temperature adimensional
Y2 - raz6n M/A2 adimensional
Y - relacion molar Rm2 adimensional 3Y^ - relaci&n molar Rml adimensional
For las razones que se indican en el apar tado siguiente, hubo de recurrirse a la elaboracidn de un nuevo diseno (nO 2) sobre una subregi6n mâs restringida que la inicialmente considerada#
La matriz de diseno se présenta en la tabla 5,11 y las condiciones operativas asi como los resul- tados expérimentales obtenidos en la tabla 5#12,
El ajuste de la superficie de respuesta por el procedimiento antes aludido de minimes cuadrados ha proporcionado a su vez el siguiente desarrollo poliné- mico :
p * 74.23 4. 0.20 4. 1.96 Y^ 4. 2,84 Y^ - 1,25 Y^
teniendo las variables que en él intervienen el signifi- cado indicado anteriormente,
6,4,2,- INTERPRETACION DE LA SUPERFICIE DE RESPUESTA
El an&lisis de varianza (pruebas de fia- bilidad) realizado tal como se indica en el apéndice 9*6

165
sobre las ecuaciones de respuesta de los disenos nO 1 y nfi 2 se resume en las tablas 6.3 y 6.4 respectivamente#
Segûn se puede observer,el desarrollo poli nomico deducido para el diseno n& 1 résulté probabilisti- camente no significativo. Este hecho puede ser debido a très causas fondamentales :
i - La respuesta del sistema es independiente delos factores contrôlantes çonsiderados.
ii - La respuesta del sistema no se ajusta a un desarrollo polinomico de primer grado como el elegido.
iii - Las unidades de escala elegidas para las variables contrôlables resultan muy elevadas y en una regiôn tan amplia la respuesta del sistema puede ser muy comple- ja o incluso parecer de naturaleza estocâstica.
Respecte a la primera razÔn apuntada y de^ pués del estudio cinêtico efectuado ha de ser descartada pues en él se aprecia claramente la influencia de las variables consideradas sobre el rendimiento en clorometanos.
De cumplirse la segunda causa expuesta, ha bria de recurrirse al ajuste de la respuesta a una funeion polinômica de grado superior al primero, circunstancia que complicaria extraordinariamente el tratamientp de los da- tos expérimentales, y que "a priori" no garantizarla el éxito del ajuste pretendido,
Por este motivo, se prefiriô suponer en pr^ mer lugar que la no significacion del polinomio podria de-

r\#vo<P<
ANO•Ho00
•H(H•Hg
(dbo
•H03
in•
H n-ON01Z P(do -P!%Cd03HQ
&P Q>(d kCdm (dO 003 (d •H
•H +>< X3 N(dSI O k
% •0cdH P
u<> •Cd 0)Q •0 •0
(d03 OB ■pH 0 k03 *0 0)H (d pk •H<
r-H
>•H+>(0O•H(W•Ha•rlOBOA
K\H
00ONHCO
O 01 O H inO• . • , • • . • . • . •01 00 H r*. oON o in m m00 HH 01
O inH tn fM
n o0) 0 v£>T3 •0 H in o 01 o H ON H
(d • . • . • . • . • . • . • . • . •(d k VÛ 00 01 00 H o O oV ON ON o in m NO so
(d OI 00 H 01 in in03 go
m H
A0) NO •O ‘H O0 (8
(d-p O r 5•H0}0)A
kOkkM
0>OBg•o<0noQ

A'O•HO(Co
•H
•H
a• r403
(d
?•H-P(do
•H(H•Ha•H(/)
I-P(do
m lA ir \ •H• . • , • (H
[N- N r - m •HON ON ON ON d
m
vo<
Pg
OJ fN.ON 1 1 • • • •
01 fN.% p
(diH iH iH H
o -p(Z kpmH ir\ mQ k ce lA OJ lA
X 1 1 • • • •p o O 00 lA lAp k 0 0 00
HK \
IOm<N§HP<>PQWHWH
i.
<d•H•Od)
%
0)•o
QQO•d(d
è
•0(d
+>k0)p
•HP
OCd
KN
moON
+» H NO O o oN(d VP r - H 00 KNk 1 1 • • • • 1 • •"d O H ON O NO(d NO 01 01d H
ir \ m 01H
Q)•d(d
p
(Q0"d(d
(ddo
NO ON H NO O lA ON NOON \o H 00 NO O lA
• . • . • . • . • • . • . • . •K \ 00 O H ON fN. 01 lAON H NO 01 01 r - r -OI H
OHH
H
0) nO H d)•d •H H (d P
o «d d k 09(d (d •p O H 03 lA •d 0 d09 •H o P P P P P •H k • od k H 09 k (d(d <d 0) P 09o > P d)
O

168
berse a los motives indicados en iii, y se decidio elabo rar el diseno nQ 2 sobre una region del espacio de cua- tro dimensiones aludido,mâs pequena, como puede apreciar se en la comparaciôn de las condiciones operativas de ca da uno de ellos (tablas 5.10 y 5*12 respectivamente).
Realizadas las pruebas de fiabilidad (an lisis de varianza del diseno nQ 2, tabla 6.4) para la ecuacién de la superficie de respuesta ajustada por el mêtodo de minimes cuadrados al desarrollo polinomico :
p = 74.23 4. 0.20 4. 1.96 Yg 4. 2.84 Y^ 4- 1.25 Y^
se mostr6 éste significative a un nivel de probabilidad del 97*5 por ciento, siendo a su vez todos los coeficien tes significatives al mismo nivel probabilistico, excep te el de la temperatura adimensional (b^, tabla 6.4).
Teniendo en cuenta le anterior, el desa— rrollo polinômico résulté ser :
p = 74.23 4. 1.96 Y^ 4» 2.84 Y^ 4. 1.25 Y^
el cual, dentro del error experimental del sistema (-5 por ciento), reproduce los resultados obtenidos.
Cabe sin embargo plantear algunas consi- deraciones finales :
1.- La no significacién estadistica de la temperatura como variable independiente, puede ser debida , mâs que al hecho de que como tal no influya sobre el ren dimiento en clorometano, a que por ser muy pequeno el

169
margen de variaciôn para ella seleccionado (385-400QC) su influencia flsica, comprobada en el estudio cinético rea lizado, sea del mismo orden de magnitud que el error experimental cometido y matemàticamente no tenga validez por estar incluida en él.
2.- Si bien la funcién objetivo seleccionada ha do el rendimiento global en clorometanos, se han obteni- do datos expérimentales suficientes como para seleccionar cualquier otra respuesta del sistema, como el grado de cloracién, la cantidad de cada clorometano obtenida, la cantidad de metano oxidado, etc., todas ellas potenciales funciones objetivo susceptibles de ser maximizadas o min^ mizadas por el método de optimaci&n utilizado#
No se ha efectuado sin embargo su trata - miento explicita pues metodologicamente la optimaciôn ha sido superada con éxito y su conocimiento es més oportu- no cuando las exigencias derivadas de la realizaciôn préc tica del proceso de oxicloraciôn de metano, definan cua^ quiera de los extremos apuntados como una funcién objet^ vo de mayor interés que las dem&s, si se quiere desde un punto de vista econémico, después de un detallado estudio de prospeccién de mercado.


?•- CONCLUSIONES
De la presente Investlgacién pueden ex — traerse las siguientes conclusiones :
1.- Tras un sistemâtlco proceso de optimaci&n,se ha conseguido un catalizador para el proceso de oxicloraciôn del metano, denominado CuCeLaK 8322 con la si - guiente composiciôn :
Componentes % (en
ClgCu 8
ClgCe 3
ClgLa 2
CIK 2
y -alômina 85
que ha moptrado excelente estabilidad y con el que se han estudiado los procesos de oxidaciôn de cloruro de drôgeno a cloro y de oxicloraciôn del metano, lleg&ndo- se a las conclusiones siguientes :

172
- Oxidaciôn de cloruro de hidrôgeno
2o- A 3950c se ha alcanzado la maxima conversiôn de cloruro de hidrôgeno a cloro : 71»5 por ciento, que corresponde a la del equilibrio termodinômico a tal tem peratura*
3e- La oxidaciôn de cloruro de hidrôgeno a cloro, parece transcurrir por un mecanismo que implica una sola reacciôn elemental que transcurre por très etapas :
Adsorciôn ClgCUg * 1/2 Og ClgCuOCu
Reacciônsuperficial ClgCuOCu 4. 2 CIH ClgCuClgCu 4. HgO
Desorciôn ClgCuClgCu CI2CU2 * CI2
2 CIH 1 1/2 0, Cl2C"2 CI2 * HgO
siendo la primera de adsorciôn, la mâs lenta, controlan te.
4.- Al mecanismo indicado corresponde la ecuaciôn de velocidad neta de formaciôn de cloro ;
d nCl »0.5
d M/Al = K1 P - K WCl.

173
habiêndose deducido los valores de las constantes en fun ciôn de la temperatura.
5.- Integrada la ecuaciôn diferencial de veloci— dad, por el método numérico de Runge-Kutta, se reprodu- jeron los rendimientos expérimentales de cloro# con un error inferior al 5 por ciento*
- Oxicloraciôn del metano
6.- La oxicloraciôn del metano se consiguiô con selectividades en clorometanos superiores al 90 por ciento y conversiones de metano del 100 por cien.
7#- La oxicloraciôn del metano parece desarro- llarse por un mecanismo que implica cuatro reacciones elementales consecutivas :
CH^ 4 CIH 4 1/2 Og t CH^Cl 4 H^O
r^CH^Cl 4 CIH 4 1/2 CHgClg 4 H^O
r_CHgClg 4 CIH 4 1/2 Og CHCl^ 4 H^O
r,CHClg 4 CIH 4 1/2 Og - CCl^ 4 H^G
transcurriendo cada una de ellas por cuatro que# a mo

174
de de ejemplo para la primera, son :
Adsorciôn Cl^Cu^ 4 1/2 0^ - ' * Cl^CuOCu
Reacciônsuperficial
ClgCuOCu 4 2 CIH = ClgCuClgCu 4 H^O
ClgCuCl^Cu 4 CH^ = ClgCu(CICH^)Cu 4 CIH
Desorciôn ClgCuXClCHg)^^ 4 : CICH^ 4 Cl^Cu^
ClgCuCH^ 4 CIH 4 1/2 0^ ?TT- * CICH^ 4 H^O
controlando en las cuatro reacciones elementales la pri mera etapa de adsorciôn de oxlgeno, bastante mâs lenta*
8*- Al mecanismo indicado corresponden las si - guientes ecuaciones de velocidades netas de formaciôn de los buatro clorometanos :
■[
- [ - ^ ]
twat ■ >-2 - ■'5 ■ [ '2;’ -
- [ « 1 -S;’ - - %

175
d nC3d M/A2 “ ^3 “ ^4 “ K31 P0.5 - K32 ^C3^W
^C2^H
K4l P0.5 - K42 ^C4^wPc3fH
d nC4d M/A2 = ri K41 p 0.5 - k 42 ^C4^w
^C3^H
habiêndose deducido los valores de las ocho constantes en funcién de la temperatura.
9.- Integrado el sistema de ecuaciones diferen- ciales de velocidad por el método numérico de Runge — Kutta (de cuarto orden), no se ha conseguido aûn la r^ produccién de los rendimientos expérimentales de clorjo metanos con la suficiente precisién, circunstancia que positivamente se alcanzarâ con el nuevo programs varia cional preparado, aûn sin procesar.
10.- Aplicado formalmente el método de optimaciôn de Box-Wilson al proceso de oxicloraciôn del metano, el rendimiento global en clorometanos (p) puede expresarse en funciôn de las très variables : Razôn molar M/A2 y relaciones molares Rm2 y Rml (Y^, Y^ e Y^ respectivamen te, en su forma adimensional) mediante la ecuaciôn :
£ = 74.23 4 1.96 Yg 4 2.84 4 1.25 Y

176
siendo significatives las très variables adimensionales al 97*5 por ciento y concordando la ecuaciôn con la re£ puesta del sistema a un nivel probabilistico del 95 por ciento. En la regiôn explorada, la temperatura no resul^ to matemâticamente significative. La informaciôn acumu— lada permite establecer las ecuaciones, similares a la indicada, que corresponderian a otras funciones objetivo , como podrian ser el rendimiento de cualquiera de los clorometanos en particular.

8.- RECOMENDACIONES
Como consecuencia de esta Investigaciôn se recomienda :
1#- Estudlar el proceso de oxicloraciôn de metano en un reactor multitubular, con objeto de determinar las condiciones del cambio de escala y su viabilidad industrial.
2.- Compléter el estudio de la influencia de las condiciones fluidodinâmicas y geométricas del lecho sobre la fluidizaciôn y, como consecuencia, sobre la velo cidad de reacciôn. Têngase en cuenta que a peser de mane jar un caudal total de reaccionantes doble del minimo necesario para la fluidizaciôn del catalizador,en los œ perimentos de oxicloraciôn del metano, ésta solo se con siguiô por vibraciôn mecânica en continue del reactor* Estudiar el comportamiento de otros soportes desde el punto de vista de la fluidizaciôn del catalizador.
3«- Verificar las teorlas propuestas por Natta (83) y otros investigadores (84), sobre la deduceiôn teôrica del reparte de productos en una serie de rea£

178
clones consecutivas, aplicada a In cloracién térmica del metano y su validez para el proceso de oxicloraciôn estu diado#
4.- Continuar el estudio de otros procesos de oxicloraciôn de productos orgânicos de interés aplicado,con el catalizador desarrollado en ésta investigaciôn.

9.- APENDICES
9.1.- INSTALACION. DETALLES Y ACCESORIOS
9.1.1.- DETALLES DEL APARATO
En la figura 9.1 se muestra la forma del reactor utilizado en todos los experimentos realizados, asl como sus dimensiones mâs caracterlsticas•
La plaça soporte del catalizador es de 5 mm de espesor, de vidrio sinterizado poroso del nâmero 2.
En la parte superior de la figura puede apreciarse la forma y dimensiones del separador, consti- tuldo por el ensanchamiento del reactor mismo.
9.1.2.- VALVULAS
Las vâlvulas de regulaciôn de caudal son de diseno especial de nuestro laboratorio. Estân dotadas de una aguja de acero inoxidable, con un ângulo de term^ nacion de 9 grades. Su eje y contraeje van roscados en

Esmerilado B-29
650onRétula
3325A
<D
Plaça porosa n* 2 - ^
Rotula3328
FIGURA 9.1

l8l
sentidos contraries con pasos de 0.7 y 0.8 mm respectivamente. Con esto se consigne que en una vuelta compléta del volante de mando de la vàlvula, la aguja avance o retrocje da ûnicamente 0.1 mm. De esta forma se consigne regular caudales muy pequenos con gran precisién.
9.1.3.- DISPOSITIVOS DE MEDIDA
a.- Medidores de caudales de fluides utilizados.
Para la medida de caudales de metano, aire y cloruro de hidrégeno, se utilizaron diafragmas de dos tipos fundamentale8 :
i.- Diafragams tradicionales constituidos por estr^ chamientos capilares de vidrio intercalados en las conduc clones Vespectivas.
ii.- Diafragmas de acero inoxidable 316 con orifi - cios calibrados de cantos vivos. En las figuras 9.2 y 9.3 se pueden ver los pianos de detalle de estes dispositivos de medida.
La pérdida de carga provocada por los diafragmas se mide en un manomètre diferencial puyas tomas se conectan a ambos lados del orificio. Como liquide manomé- trico se utiliza agua, excepte para los manémetros medido res del caudal de cloruro de hidrégeno en que se sustitu- yé el agua a causa de la gran solubilidad del gas en este

oCM
OCM
ZZEZZZZZZZ>==GZZZZZ2I23t
CD
o
lO ! <>>1
oy////A ...
5
CD
T
m CM
U)
OCM
§
lO
O
[

LOa i
m
m tf>
o
co00
o\
iHk

184
disolvente, por un aceite de silicona tipo "Rhodorshil” previamente saturado de cloruro de hidrogeno,
A la salida del diafragma se coneeta un tu bo manométrico con mercurio, una de cuyas ramas estâ abler ta a la atm6sfera* Este nos indica la sobrepresi6nZ\Pp^ respecte a la presi6n atmosferica, que sumada a ésta per mite conocer la presion absoluta del gas a la salida del diafragma* Disponiendo asl mismo de un termometro ala salida del diafragma, se conoce la temperatura del gas, ^pd» lo abandona.
Las curvas caracterlsticas de los diafra^ mas utilizados, se obtuvieron por calibrado de los mis - mos. Para ello se midié el caudal de gas para distintos valores de altura manométrica, en condiciones de preSion y temperatura conocidas#
Para el aire y el metano se utilizaron caudallmetros de burbuja y para el cloruro de hidrégeno, porlos problemas ya mencionados de solubilizacion en los 1^quidos utilizados por. los medidores de desplazamiento yolumetrico, hubo de recurrirse al siguiente procedimiento de medida.
Se coloca una cantidad de disolucion acuosa de hidrôxido sôdico perfectamente conocida y valoradaen un pH-metro potenciométrico con agitacion. Seleccionado un valor de caudal de cloruro de hidrôgeno (Cih ) se ham —ce burbujear éste en el seno de la disoluci&n alcalina hasta que se produce un brusco cambio de pH acusado por
aparato medidor. Midiendo con un cronômetro el tiem»

185
po transcurrido entre el comienzo del burbujeo del gas y el instante en que se produce el viraje, se puede calculer el numéro de équivalentes de cloruro de hidrégeno que circulan por unidad de tiempo y con este valor y el peso equivalents del mismo, su correspondiente caudal molar*
Los resultados obtenidos en el calibrado de los diafragams medidores utilizados, estén représenta dos por las ecuaciones que incluye la tabla 9*1# obtenir das por ajuste de los datos expérimentales por un procedimiento de minimes cuadrados*
Las unidades empleadas en la tabla 9*4son :
N - Caudal molar (mmol/s)P - Presion absoluta (mm de Hg)M - Peso molecular (gr/mol gr)T - Temperatura (ûK)
Ah - Altura manométrica (mm de liquide) m
b*- Sistemas de regulacién y control de la temperatura *
La calefaccién del reactor se efectéa por medio de ocho varillas cerémicas roscadas, de 60 cm de longitud, sobre las que se arrolla hilo de rçsistencia de 4-A./in lineal, soportadas por ocho varillas de acero, co- locadas entre los cabezales de Calorit qùe spportan el reactor*
Con objeto de disponer de dos circuitos de calefaccién, en funcién de que la accién todo-nada del c<m

c/3MAOQHQM%C/3
i1
H XCuON -d:H
< a
CO Cf3< oH
uQ
OO<XXHk)<u
•HO(Q&
•H{QOfif
•HO«POM
•H-Ü4)S(0â(0kW
•HÛ
H<
Oa<
N<
bOH
\o
K%<
vÆON*01
bOH
4)
•5<
HIX
CMOCM
CM
X
HI
OO
ONoON
ONCM00•CM
i ibOr4 bO
bOHbOH
0 0A A4) 4)bO bO
NO nOU k
•0 •D•H •H 0
,0 g(0
4) 4) ■PT5 *0 4)
%0 0k kP ? .k k0 0
M HV U
CMI
OU
K \K\CM#
CM
1
bO
IfNCMNO
bOH
O§•P
%

187
trolador de temperatura utilizado no provocase bruscas fluctuaciones en el valor de esta variable, se procediéal montaje de un contactor electromagnético marca AGUT
»(modelo CK-02) que recibiendo directamente la instruc- ci6n del controlador de temperatura, introdujera en s^ rie con el circuito principal de calefaccién ("circui- to de alta") una resistencia de un valor igual a de la resistencia total de éste# De esta manera, parte de potencia aplicada al circuito principal se disipa en ella y la calefaccién del reactor disminuye sin llegar a anularse. Este constituye el "circuito de calefac - cién de baja".
En funcién de la temperatura de reac — cién utilizada en cada experimento, la tensién aplicada a los circuitos de calefaccién, se seleccioné por medio de un autotransformador Variac de 2 Kw de poten cia, c6n salida de tensién variable entre O y 220 voJL tios, de forma continua.
El elemento de medida de temperatura utilizado, esté constituido por un termémetro de re - sistencia de Pt-W-85 de doble arrollamiento y blinda- je cerémico. Este envia su senal al controlpdor de temperatura y al registrador simultaneamente. Ambos aparatos marca Pisher-Porter Ibérica, utilizan un si^ tema de medida galvanométrico, efectuando su accién, el primero a través de un sistema electromecéncico de célula de mercurio basculante, y el segundo teniendo

188
capacidad para efectuar un registre simulténeo sobre ocho puntos distintos de la instalacion.
Las escalas de estos aparatos, con un in - tervalo aproximado de lOOQC cada una, fueron desde 250 a 45OQC (2 X lOOac) para el controlador (modelo TTR-20) y dejs d e O a 5000c (8 X lOOQC) para el registrador (modelo N- PELEMTC-8).
Los detalles de los restantes circuitos de calefaccién utilizados son accesorios, dado que su misién es exclusivamente la calefaccién de ciertas partes de la instalacién (premezclador, separador, accesos al cromaté- grafo de gases, etc.) con fines de precalefaccién o en evi tacién de posibles condensaciones de productos de reaccién
9.2.- DETALLES DE PROCEDIMIENTO
9.2.1.- PREPARACION DE CATALIZADORES
La preparacién de catalizadores incluyé las etapas propias de acondicionamiento del soporte y deposi- cién de los componentes actives sobre el mismo.
- Soporte
El soporte utilizado fué Jf-alémina MERCK con un tamano de particule comprendido entrq 80 y més de

189
200 mallas. Por tal motivo, se procediô a seleccionar los tamanos ûtiles (80-100 y 100-140) por tamizado de la mez- cla.
Realizadas las pruebas correspondientes de precipitaciôn con nitrate de plata, no se detect6 la pre- sencia de cloruros por lo que se utiliz6 el soporte dire£ tamente en su forma comercial.
Antes de procéder a su impregnaciôn, se so metl6 a un proceso de sinterizacion en un horno de mufla a lOOOQC durante ocho horas. Con este tratamiento las me- didas de superficie especifica que sobre él se efectuaron, dieron valores comprendidos entre 10 y 20 m /gr.
- Impregnacion del soporte
Para depositar los componentes del catali- zador sobre el soporte activado, se procedi6 de la siguien te manera :
Una vez decidida la composicion del catal^ zador, se pesan cuidadosamente los componentes actives en forma de cloruros (ClgCu, Cl^Ce*7 H^O, Cl^La*? HgO, ClK)y se disuelven en la minima cantidad de agua posible, de tal modo que al anadir esta disoluciôn sobre el soporte pre - viamente pesado y colocado eiji un matraz, el liquide supe- re ligeramente la parte superior del solide. Con este se consigne que la deposici6n se realice paulatina y homoge- neamente en la posterior y graduai eliminacion del disol- vente y no en la forma arbitraria que provocarla el sopor

190
te con su elevada velocidad de hldrataciôn*La eliminacion del disolvente se efectua a
vaclo y con agitaci6n continua en un aparato rotavapor a una temperatura inicial de unos 6O-6OOC# Cuando las part^ culas de catalizador, por efecto del secado, se mueven 1 bremente unas sobre otras la temperatura se eleva a 100- 120QC con lo que se efectua un secado final mas riguroso,
Acto seguido se procédé al almacenamiento del catalizador en un recipiente de cierre hermético para evitar su hidratacién hasta el momento de ser utilizado.
9.2.2.- METODOS DE ANALISIS
Segun se indica en el apartado 3*3« el sis, tema de recogida de productos de reaccion, fue diferente para los experimentos de oxidaciôn de cloruro de hidrôge- no a cloro y los de oxicloraci6n de metano.
En los primeros, la recogida de productos dio lugar a una muestra de 300 cc (muestra l) en la que aparecen el cloruro de hidrôgeno no reaccionado y el cljo ro producido en forma de cloruros, hipocloritos y clora- tos, segun el siguiente esquema de reacciones :
CIH 4. NaOH — ► ClNa 4- H^O
Clg 4. 2NaOH ► ClONa 4- ClNa 4- H^O
Clg * ôNaOH ClOgNa 4» 5ClNa 4- H^O

191
Por otro lado, en los experimentos de oxi- cloracion de metano se obtuvieron dos muestras aforadas a 500 y 250 cc respectivamente, de las siguientes caracte - risticas :
Muestra 2 (500 cm ).Solucion acuosa de cloruro de drogeno no reaccionado.
Muestra 3 (25O cm^)•Solucion acuosa de sulfito s6di- co, conteniendo el cloro producido en la reaccion en for ma de cloruros, segun la ecuacion qulmica siguiente :
Clg 4. S0= =2:. T 2 Cl" 4. SO^
A continuaci6n, se describe el metodo ana^ tico seguido para la evaluaciôn del cloro y cloruro de drogeno, asi como el anAlisis cromatogrâfico del metano y clorometanos producidos*
a Cloro producido.
Experimentos de oxidaci6n de cloruro de hidrogenoa cloro•
Se colocan 5 cm^ de la muestra 1 en un matraz erlenmeyer provisto de tapon esmerilado. Se acidula con 5-10 cm^ de Acido clorhidrico concentrado, agregando a continuacion unos 3 gr de ioduro potasico golido, pro- cediendo rApidamente al lavado interior de las paredes del recipiente con agua destilada (exenta de oxidantes) hasta que el contenido total sea de unos 100 cm aproximadamen

192
te. La muestra perfectamente tapada, para evitar las pér- didas de iodo por volatilizacion, se somete a agitacionc^ rante unos minutos, hasta que el color rojo-violAceo per- manezca invariable. Acto seguido se procédé a la valora - cion con una solucion 0.1 N de tiosulfato s6dico, previa- mente valorada con iodato potAsico. Cuando el punto final de halla cercano (momento en que el color de la disolucion se torna amarillo-oro claro) se agregan 2 cm^ de soluciAn indicadora de engrudo de almidôn y se continua la adiciôn de tiosulfato sôdico hasta que el color azul-violeta oscu ro comunicado por el indicador desaparece y la disolucion se hace totalmente incolora.
- Experimentos de oxicloraciôn de metano
Sobre 10 cm^(perfectamente medidos) de lamuestra 3 se agregan 2 cm^ aproximadamente de Acido sulfurico concentrado, llevando el conjunto a un volumen final
%de 130 cm con agua destilada. De esta manera se consigne el medio Acido necesario para la valoraciôn correspondien te y la descomposiciôn de los iones sulfito que interfie- ren en la precipitaciôn de los cloruros con plata*
La muestra preparada, se coloca adecuada - mente en un valorador automAtico marca Metrohm modelo 3 D y se desarrolla un metodo potenciométrico de precipitaciôn con una solucion 0.1 N de nitrato de plata previamente va lorada. El par de electrodes utilizado estA constituldo por une de calomelanos de vidrio y otro de plata metAlica

193
pura, de diseno y construcciôn de nuestro laboratorio.
De la curva de valoraciôn obtenida, se d£ duce la cantidad de nitrato de plata consumida por el prjo cedimiento habituai ($0) y de esta, la cantidad de cio - ruros en la muestra analizada.
b.- Cloruro de hidrôgeno libre.
- Experimentos de oxidaciôn de cloruro de hidrôgeno a cloro.
La valoraciôn del cloruro de hidrôgeno libre se efectuô por diferencia entre los cloruros totales contenidos en la muestra 1 y el cloro analizado segun el apartado a.
La valoraciôn de los cloruros totales se efectuô procediendo de la siguiente manera :
Sobre 2 cm^ de la muestra 1 se agregan 15-•X
20 ml de una disoluciôn 1 M de nitrito sôdico, 2 cm de acido sulfûrico concentrado y el agua necesaria para con- seguir un volumen final de 150 cm^ aproximadamente. La mues tra se somete a ebulliciôn y agitaciôn en una plaça de ca lefacciôn con agitador durante 5 minutos y pasado este tiem po se deja enfriar y se valora por el metodo potenciomé - trico descrito en el apartado anterior,con Is disoluciôn0.1 N de nitrato de plata ya preparada.
El tratamiento de la muestra con la solu - cion 1 M de nitrito sôdico tiene como misiôn la reducciôn de los hipocloritos y cloratos a cloruros, pues ûnicamen-

194
te estos ûltimos (los cloruros) precipitan cuantitativa - mente con los iones plata.
- Experimientos de oxicloraciôn de metano.
Se acidulan 2 cm^ de la muestra 2 con 1 ml de acido sulfûrico concentrado diluyendo a 150 cm^ con agua destilada exenta de cloruros.
La muestra asl preparada se valora por el metodo potenciométrico de precipitaciôn con plata ya descrito.
El resultado de la valoraciôn proporciona directamente el cloruro de hidrôgeno no reaccionado en los experimentos de oxicloraciôn de metano, o bien éste y el cloro producido, que se analiza en su caso por el procedimiento iodométrico descrito en el apartado b. En este ûltimo caso el cloruro de hidrôgeno no reaccionado se obtiens por diferencia entre los cloruros totales ana- lizados y el cloro calculado a partir de la correspon - diente valoraciôn iodométrica.
c Metano y clorometanos.
Tanto el metano no reaccionado como los clorometanos producidos en los experimentos de oxiclo- ciôn se analizaron por cromatografia en fase gaseosa.
Ante la imposibilidad de introducir en la corriente gaseosa efluente del reactor en la que se en- contraban los mencionados hidrocarburos, un patron in -

195
terno en cantidad conocida y constante a causa de la va riaciôn del caudal de productos de reacciôn en funeion del desarrollo de la misma (conversiôn y selectividad cambiantes de unos experimentos a otros) hubo de proce - derse a la realizaciôn de un calibrado absolute e in - dependinnte para el metano y los cuatro clorometanos.
En estas condiciones (ausencia de patron
interne) la respuesta reflejada por el sistema de medi- da cromatogrAfico (Area del pico correspondiente) varia tanto por la masa de producto inyectado como por les cambios que se produzcan en la sensibilidad del sistema de detecci&n utilizado.
Dado que sobre la respuesta del detector de ionizaciôn de llama que se empleô influyen en gran manera (51) los caudales de gas portador de hidrôgeno y aire, hubo que asegurar su constancia en aquellos valores que fueran adecuados para la separaciôn y anAli- sis cromatogrAfico pretendidos.
Con tal motivo se efectuô una optima - ciôn experimental de la respuesta del detector para seleccionar los caudales de hidrôgeno (combustible) y aire (comburente) que asegurasen la sensibilidad maxima posible y al mismo tiempo, su constancia, Por otro lado una vez determinado el caudal de gas portadqr necesario para la separaciôn de los cinco hidrocarburos en las condiciones previamente establecidas de temperatura de las diferentes partes del cromatôgrafo de tipo y Ion -

196
gitud de columna a utilizar y demAs condiciones de tra- bajo, se procediô al montaje en la parte exterior del cromatôgrafo de un controlador de caudal de nitrôgeno de alta precisiôn (marca Brooks, modelo 8744 A) que asegu - rase en el future su invariabilidad.
A parte de todo lo anterior y pese a dis- poner de manorreductores, en el caso del nitrôgeno con - cretamente , de hasta 5 cascadas de reducciôn escalonada, ya de por si suficientes para asegurar una presiôn de sa- lida constante aunque la presiôn del envase del gas correspondiente disminuyese por efecto del consume del mismo, se montaron tubes manométricos con mercurio (de 3 0 m. de longitud para el nitrôgeno y de 1.5 m . de longitud para el hidrôgeno) una decuyas ramas permaneciô abierta a la at- môsfera. De esta manera se visualizô con gran precisiôn cualquier variaciôn en la presiôn de alimentaciôn de los correspondientes gases sobre los controladores de caudales respectives, hecho que permitia su inmediata ce - rreciôn.
Con todo este, las caracterlsticas del sistema cromatogrAfico elegido y las condiciones anall - ticas utilizadas, fueron las siguientes:
- Cromatôgrafo de gases marca Hewlett-Packard modelo 5700 A.
- Registrador Hewlett-Packard modelo 7123 B,- Controlador de caudal de nitrôgeno marca Brooks
modelo 8744 A,

197
- Columnas :Fase estacionarla : UCC W-982 (10#)Soporte : Chromosorb W-AW—DMCSLongitud : 3,66 metros#
- Temperatures :Columnas : 8OGCDetector : I300CBloque de inyecciôn : 13OOCVAlvula de gases : I300C
- Caudales aproximados /en condiciones de presiôn y temperatura ambiantes :
Nitrôgeno : 30 ml/min*Hidrôgeno : 30 ml/min#Aire : 240 ml/min.
- Presiones de alimentaciôn de gases :
p.
Nitrôgeno : 3*438 Kg/cm^ 2613 mm HgHidrôgeno : 1.064 " 8O9 ”Aire : 2.3 " ( aproximadamente )
- VAlvula de gases :Volumen aproximado : O.3 cm^Material : Acero inoxidable 316
-. Detector :Doble, de ionizaciôn de llama.
- Condiciones de trabajo :Temperatura : isoterma (800C)

198
Velocidad del papel en el registrador : 2*54cm/min*
Atenuaciones : variables en cada anAlisis#Escalas : variables en cada anAlisis.
El calibrado efectuado sobre los cinco drocarburos incluyô la preparaciôn de patrones gaseosos de cada uno de elles, utilizando aire como diluyente# En los hidrocarburos gaseosos (metano y cloruro de metilo) las cantidades de hidrocarburo y aire se determinaron a partir de los calibrados de los diafragmas medidores correspondientes, En el caso del cloruro de metileno, clo- roformo y tetracloruro de carbone, su incorporaciôn a la corriente gaseosa de aire se efectuô por saturaciôn de parte de ésta por burbujeo en los liquides correspondien tes, en condiciones isotermas. La isotermicidad se cens guiô por inmersion de los burbujeadores en un bano de hie lo fundente* Por diferencia de pesada de los mismos, se déterminé la cantidad de hidrocarburo vaporizado y con 6 ta y el peso molecular, el caudal molar del correspon - diente producto.
La respuesta cromatografica se obtuvo como producto del area de cada pico por los correspondientes valores de escala y atenuacion utilizados.
Ante la dificultad de conocer la cantidad absoluta de componente introducido en cada inyecciôn, en tre otros motivos por no disponer del volumen real de la vAlvula de inyecciôn de gases ni de las condiciones de

199
presiôn y temperatura a las que estos se encontraban en su interior, se decidiô la representaciôn de una funciôn proporcional a la masa de componente definida en los siguientes termines :
La masa de un determinado hidrocarburo X en la corriente gaseosa viene dada por la ecuaciôn :
M
donde
siendo x
m^ = masa del componente x.y^ = fracciôn molar del componente x en la
mezcla gaseosa. n^ = nûmero de moles totales de la mezcla g^
seosa.= peso molecular del componente x.
metanocloruro de metilo cloruro de metileno cloroformotetracloruro de carbono
suponiendo que en las condiciones de presiôn y temperatu ra de trabajo utilizadas éstos se comportan como gases perfectos, suposiciôn por otro lado aceptada para la ma- yoria de los gases reales en condiciones de presiôn y tem peraturas prôximas al ambiente. Representando ahora por n^ al numéro de moles totales incluidos en una inyecciôn de la vAlvula de gases, la ecuaciôn anterior se convier- te en :

200
P VV V ^“x = ^ x - R ^ ”x
donde :; volumen de la vAlvula de gases.
R : constante de los gases ideales.P^ : presiôn de los gases en el interior de
la vAlvula.‘ : temperatura de los gases en el inte -
rior de la vAlvula de gases.
En esta ecuacion, tanto como R son c,o nocidos y constantes. Por otro lado, aunque el volumen de la valvula de gases es desconocido, se puede afirmar que a temperatura constante la no existencia de dilataciones lo mantiene invariable (volumen fisico de la vAlvula de gases). Por tanto, y dado que la vAlvula de gases del crp matografo utilizado estA dotada de control electrônico de temperatura, M^, R y se pueden englobar en una cons - tante k, de modo que :
P"x = ^x -tJ-
Tanto P como T son desconocidas e impo-V V
sibles de medir de modo directo y preciso, pero si se con sigue que el caudal de gases que atraviesa la vAlvula de inyecciôn se mantenga constante, la temperatura de sali- de de los mismos serA una medida ficticia pero proporcio nal a la temperatura de los gases en el interior de la misma. Como por otra parte la geometria del circuito de

201
inyecciôn es invariables, el caudal de gases serâ directs mente proporcional a la presiôn de los mismos a la entra- da del sistema.
La presurizaciôn y termostatizaciôn a que se sometiô este circuito implican que para valores de pre siôn y temperatura prôximos a las condiciones en que se han realizado los correspondientes calibrados* se cumple lo anter&ormente expuesto y :
^l^v ™x “ ^ ^x k^t2 VEnglobando k, k^ y kg en una nueva cons -
tante K se tiene que :. ..yy «T
donde : p^ = presiôn de alimentaciôn delos gases alcircuito de inyecciôn.
• t^ = temperatura de salida de los gases delcircuito de inyecciôn.
Como se indica en el apartado 3.3.2 p^ se obtiene sumando a la presiôn atmosférica, la presiôn correspondiente a la altura de liquide apreciada en el ma- nômetro instalado adecuadamente y tal como alli se ind^ ca con este fin .
La precisiôn alcanzada en las détermina - ciones expérimentales realizadas con este procedimiento analitico confirman plenamente la validez del razonamien to planteado.

202
Los calibrados expérimentales del metano, cloruro de metilo, cloruro de metileno, cloroformo y te - tracloruro de carbono, se incluyen en las figuras 9.4 » 9.5 9.6, 9*7 y 9.8 respectivamente• En ellas se représenta el producto y (p, /t, ) frente a la respuesta cromatogrAfica ob tenida.
En el apéndice 9.3 se incluye un ejemplo en el que se verA con detalle la aplicacion del método analitico expuesto.
Finalmente, cabe mencionar que ante la difi cultad de analizar separadamente los productos de combus - tiôn de los hidrocarburos, monoxido y diôxido de carbono fundamentalmente, estos se determinaron por diferencia en tre el metano alimentado y la suma del metano no reaccionado con los clorometanos obtenidos en la reacciôn de oxicloraciôn. El cierre de balance global se comprobô sobre el cloruro de hidrôgeno alimentado,por cAlculo del no rea^ cionado y del que entra a formar parte de los clorometanos obtenidos.

Im
o» iO
oX O)
tr>
O) oen
o\<a5OMh

s§■
UDo> momm oo
CM§
O
m
o<a2c?
ent LO m

CMX
CMai I u>
o§
0»
unQ
§ inO) oCO
2§Hh

CMO*
LO
CO
Xm
0»
COo
oCO
(C\<a

C*loo
m
O)
COa<KDÜ

208
9.3.- METODOS DE CALCULO
9.3.1.- CALCULO DE UN EXPERIMENTO
Como ejemplo se describen los câlculos efec tuados en el experimento de oxicloraci6n de metano nfi 43 (tabla 3.6).
Las condiciones de trabajo preestablecidasson :
Temperatura t = kOOQCRml = 0,84 moles de cloruro de hidr6geno/mol de
aire ,Rni2 = 10,0 moles de cloruro de hidr6geno/mol de
metano,M/A2 = 950 gr/(mol gr/hr)
En el reactor se colocaron 73.0722 gramos de catalizador, por tanto el caudal de metano a alimen - tar debia ser :
A2 = — = 7.902 • 10“^ mol gr/hr = 2,195 • 10*^ mmol/s
y los caudales de cloruro de hidrégeno y aire a partir de Rm2 y Rml :
Njj = Rm2 . A2 = (10,0) (2,195 . 10~^) = 0,2195 mmol/s
N . =---— - _ (0*2195) = 0,2613 mmol/saire R il 0.84

209
Para una presiôn post-diafragma mediade 765 mm de Hg y una temperatura post-diafragma t^^ de 29GC, los calibrados de los diafragmas COI de metano, H1de cloruro de hidrôgeno y A2 de aire, indican unos valores para los A h respectivos de :m
A h = = l44 mm de agua“co
A h = 316 mm de Rhodorshil
A h = 122 mm de agua"aireLos resultados del experimento fueron :
Temperatura del lecho, t = 4000C Masa de catalizador, M = 75*0722 grPresiôn atmosférica, P^ = 705*9 mm de Hg
Metano Cloruro de Airehidrôgeno
Ah^ (nun de liquide) 145 314 124Pp^ (mm de Hg) 768 779 764tp^ (QC) 29 29 29
Presiôn media de reacciôn : 758 mm Hg.Temperatura ambiente t^ : 28&C
, j .. .
Duracion del experimento 0: 2441 s.
a.- Anélisis de los productos de reacciôn :
i.- Cloruro de hidrôgeno no reaccionado.2 cm^ de la muestra M2 (500 c:p ) consuj:: i je
ron 13*10 cm^ de soluciôn de nitrato de plata 0.1 N ■ l

210
0.9996), por tanto :cloruro de hidrôgeno libre = (13.10)(0,1)(0,9996)($00/2)=
= 327.37 mmoles, il.- Cloro no reaccionado.
10 cm^ de la muestra M3 (230 cm^) consu - mieron 7.10 cm^ de soluciôn de nitrato de plata 0.1 N (f* = 0.9996), por tanto :cloro libre = (7.10)(O.l)(O.9996)(25O/IO) = 17.74 atomos-
gramo.iii.- Metano y clorometanos.
En la siguiente figura se incluyen los re_ sultados del anôlisis cromatogrôfico efectuado durante el experimento ns 4$. El significado de las variables que se indican, es el siguiente :
t^ - temperatura ambiente (QC)- temperatura de la corriente gaseosa a la sali
da del sistema deinyecciôn (oC)- presiôn atmosférica (mm de Hg)
V - volumen del medidor de gases utilizado (cm^)0 - tiempo para desalojar un volumen de gases igual
al del medidor (s)AP - presiôn manométrica de alimentaciôn de muestra
al sistema de inyecciôn (mm de columna de agua)V - velocidad de avance del papel registrador B — escala de medida ùtilizadaA - atenuaciôn de la sehal de salida del amplifica
dor del cromatôgrafo

Jrt
v£>loo
SO
-4 *
CO00 IvD
"oO"m
O-
00
K>N Terris-
o\c\
3§Hk

lî - altura del pico cromatogrâfico (mm) (valor me - dio de cuatro inyecciones en régimen estaciona- rio)
e - espesor (en la altura media) del pico cromato - mgr&fico (mm) (valor medio de cuatro inyecciones en régimen estacionario).
— Tetracloruro de carbonoEl area media del pico résulta ser ;
s = H o_ = (i89.8)(2.84) = 539.03 nunmp m mEl area media, corregida con el factor de
escala utilizado (f) :
S = S • f = S (E-A) = (539.03)(100)(32) = 1.7249 10^ mmm mp mp
El area media, corregida con el factor de escala del calibrado résulta finalmente :
S . = S / { E x A ) = 1.7249*10^/(10 64) = 2695 nun mg m g g
La gréfica 9.8 da un valor para la funciônT d*
FC4 = f)c4 = 0*15Anélogamente, para los demés hidrocarburos
se tiene :- Cloroformo
= 770.1 (grâfica 9*7)
^C3 = T^C3 =

215
- Cloruro de metileno
S__ = 92.5 (gr£fica 9.6) mg
Pca =<^f>C2 = 0-00557
— Cloruro de metilo
S s 26.6 (gréfica 9*3) mg
Fci =(Y #)ci = 0.00045
- Metano
S»,» * 96.9 (gréfica 9*4) mg
Fco =<’^ ¥ > c o = 0 . 0 0 3 1 0
pEl cociente -=r ee obtiene como sigue :
P aT 273 V
Como es comûn para el metano y los cuatro clorometanos, la fracciôn molar de cada componente en la fase gaseosa (muestra) ser& ;
F^C4 " a.3063 " *-498 . 1 0 " * 3 8 .2 9 3 Bunol
^C3 - 2 .3S&3 = 1-417• 1 0 " * 8-548 "
Fro^C2 ° -2.3083 ° 1-547 . 10 3 0.911 "
FC l = 1 . 9 4 9 . 10“ 4 0 . 1 1 5 "C l “ 2 .3 0 8 3
00 “ 2.3083FCO = 1.343 . io"5 0.791 "

214
b.- Câlculos finales :
Cantidad de metano alimentado*Con los dates expérimentales : /\h , PmCO
t , , y la ecuaciôn de calibrado del diafragma de me-P*COtano c6l se tiene un caudal molar de metano alimentado de
Nçq = 0.02188 mmol/s.
Metano total alimentado = (N^Q)(0) = 0.02188 . 244l =
= 53*41 mmoles,
ii.- Cantidad de cloruro de hidr6geno alimentado.
Con los mismos dates indicados en el apar tado anterior referidos al cloruro de hidrogeno y la ecua cion de calibrado del correspondiente diafragma HI :
= 0,2167 mmol/s.
Cloruro de hidrogeno total alimentado - (\j|) ( ) .=
= (0,2167) (244l) = 528,86 mmoles,
iii,- Cantidad de aire alimentado,Analogamente y con la ecuacion de calibra
do del diafragma de aire A2 :
N . = 0.2641 mmol/s.a ire
Aire total alimentado = = (0*2641} (2441) =
= 644.61 mmoles.

215
iv«- Caudal total de gas alimentado.= N-„ + N„ * N . = 53.41 *. 528.86 * 644.61 =T LfV M aire
= 0.5027 mmol/s = 1.81 mol gr/hr.
V.-* Razôn M/A2 y relaciones molares Rml y Rm2. Siendo A2 = se tiene que :
A ^ = 'llhVâl ° 5431 sr/(mmol/s) == 953*2 gr/(mol gr/hr)
Bml = -y — — = 0*2641 “ 0.820 mol gr de clorurode hidr6geno/mol de aire
aire
O 2167Rm2 = — --- =' 0*02188 “ 9.90 mol gr de cloruro dehidr6geno/mol de metano alimentado
vi.- Hidrocarburos producidos en la reacciôn.- Caudal molar de muestra cromatogrâfica
-T - #
nJ, = Moles totales = (N^) (0) = 0.24l4 , 2441 == 589*29 mmoles,
n^g = Metano no reaccionado = (Ygg)(n^) =
= (1.343 * 10"3) (589.29) = 0.791 mmples.
n^^ = Cloruro de metilo = (Y^^)(n^) =
= (1.949 * 10"^)(589*29) = 0.115 mmoles.
n^2 = Cloruro de metileno = -
= (1.547 . 10“^)(589.29) = 0.911 mmoles.

216
= Cloroformo =(Yg^)(n^) = (1.417.lO"^) (589.29) =
8.350 mmoles.
= Tetracloruro de carbono = (Yg )(ïi;p) =
= (6.498.10“^)(589.29) = 38.293 mmoles.
n*gg = Productos de combùsti6n = (metano alimentado) -
" * C0 " *'ci " * C2 “ ” C3 " ^C4 “= (53.4i )-((0.791)-(0.115)-(0.911)-(8.350)-(38.293) =
= 4.95 mmoles.
vii.- Balance global.
Balance % - (ClHlClgilCl en clorometanoscloruro de hidrogeno total alimentado
Cl libre = 327.37 i 17.74 = 345.11 mmoles.Cl en clorometanos = (l)(ng^)4 (2)(n^^^+(3)(ngg)+(4)(ng^)== (1)(0.115) + (2)(0.911) 4 (3)(8.35) 4 (4)(38.293) =
. = 180.16 mmoles.
Balance % = /545.11) 4 (I8O.16) (^QO) = 99.32%528.86
viii.- Conversion, Selectividad y Rendimiento.
_ _ ., a/ metano alimentado-metano no reaccionadoC = conversion % ----- ; metano alimentado-----------(53.41)-(0.791)
.(100) = 53.iii (100) = 98.52 %
S = selectividad % = aoo) =
. ”c1*°C2*"C5*"ç4 (100) , ..(47.672. qq) . 90.6053.41-0.791 (52.62)

217
(C)(S) ( 9 8 . 5 2 X 9 0 .60) Rendimiento total en clorometanos = “ — * -----^66-----
= 8 9 . 2 6 %
Rendimiento de los productos de reacci6n = %^g m
nCOmetano alimentado
Analogamente :
= — - 0.0148
“ci 0.0022
“C2 0.0171
“C3 0.1563
“C4 0.7170
“cc 0.0927 Total * IkOOOl
ix.- Grado de cloraci6n. ( x )01
(n^.) 4 (2)(n_p) 4 (5)(n_ ) 4 (4)(n_r)^ 1 =-^------n- ^ nc2 ^ -C, * -----------
mos gr de cloro por mol gr de clorometanos obtenido.
9.3.2.- CALCULO DE LAS PRESTONES PARCTALES EN EL REACTOR
Ya que las presiones de reaccion oscilaron siempre entre 748 y 769 mm de Hg, se ha tomado, por faci- litar los càlculos posteriores, una presiôn media de reac ci6n para todos los experimentos de ?60 mm de Hg con un

218
error medio menor que el 2%.Por tratarse de un reactor integral se su-
pondra que la presiôn de un componente en el lecho, es igual a la presiôn existente a la salida.
Se tomarô como base de calcule, un mol de metano alimentado. Cuando se produce la reacciôn y tenien do en cuenta la estequiometria de la misma, se tendrô :
Componente
MetanoCloruro de metilo Cloruro de metileno CloroformoTetracloruro de carbono Diôxido de carbono Nitrôgeno Oxigeno
Cloruro de hidrôgeno Agua
NQ de moles
nCOnClnC2nnC3C4
*CC(0.79)(Rm2/Rml)
(0.21)(Rm2/Rml)-(0.5ng^4
"C2*^"^“C3*^“C4*^“CC^
Se tiene por tanto que el numéro de molestotales es :
= Hgg 4 0.5n^, - 0.5n^, - n , 4 (Rm2/Rml) 4 Rm2 4 n‘Cl C3 C4 CC
Las presiones parciales se han obtenido aplicando la ley de Dalton,con una presiôn total media de 760 mm de Hg équivalente a 1.0 atm. .

219
9.3.3.- CALCULO DE LAS VELOCIDADES NETAS DE APARICION Y DESAPARICION DE PRODUCTOS Y REACCIONANTES
La velocidad de aparicion o desapariciôn de un producto x, en funcion del rendimiento, viene dada por ;
^ 4 "xX " d (M/A2)
O en funcion de las presiones parciales. d P,
r = d (M/A2)
Las velocidades netas de aparicion y des_a pariciôn de productos y reaccionantes se obtuvieron sobre las curvas de distribuciôn, por medida de las correspon- dientes pendientes con un derivimetro de espejo, obte - niéndose, para el ejemplo propuesto, los siguientes re- sultados :
^CO = 0.0559 mol gr/(gr
^C1 = 0.0001 II
^C2 = 0.0822 II
^C3 = 0.2401 II
^C4 = 0.3640 II
^CC 0.0035 II

220
9.4.- ESTUD10 CINETICO DEL PROCESO DEACON
9.4.1.- DEDUCCION DE LA ECUACION DE VELOCIDAD
En lo que sigue, se utilizer* la siguientenomenclatura :
b - constante de equilibrio de una reacciôn elemental
— constante de equilibrio de una reacciôn superfj. cial (elemental)
K - constante de equilibrio de una reacciôn global C^ - concentraciôn de componente x absorbido C^ — concentraciôn de centres actives libres L ,- concentraciôn total de centres actives
A continuaciôn,se incluye la deducciôn de las ecuaciones de velocidad para los mécanismes Ml y M2, cuando contrôla cada una de las très etapas quimicas :
- Mecanismo Ml
Reacciônk.
1/2 Og 4 1 01
01 * 2HH
Clg * *
Constante de equilibrio
■=C1>H

221
Cl.lS
Cl^ * 1 ^ - 4
1/2 4 2H Cl^ 4 W K = V i
tci.
a) Control de la adsorciôn de oxigeno :
1/2 0_ 4 1 = 01
Velocidad de la etapa :
(1)
Etapas de equilibrio
— Reacciôn superficial
01 4 2H zrn Cl.l 4 WI ^ K . (2)
— Desorciôn de cloro
Cl^ * 1Cl.
(3)
Como por otra parte :
(4)
Despejando en (2) y (3 ) :

(5) :
222
Sustituyendo el valor C__ dado por (6) en^ 2
y llevando los valores (7) y (6) a la ecuaciôn (4)
^Clg^W^ClL . C, (1 * --- 5 — 4. b-, P_, ) (8)
despejando :
Clg W Cl(1 * ----- ■ 2 ■■ * b P ) (9)K P„ ^^2 ^^2B n
llevando finalmente los valores (7) y (9) a la ecuaciôn (1), se tiene :
o 5 ^W^ClL(k P:'5 _ k'b -----5S-)1 Og 1 Clg K_pg (10)4 l , V c i 2
^ * %,PH * ^Cls?Cl2
teniendo en cuenta ahora que :

223
K = V i
r =kiL(pO»^ -
^ * 4 l / c i g(11)
b) Control de la reacciôn superficial
01 4 2H*2
Clgl * W
Velocidad de la etapa :
*■ " *2^0^H * ^2^Cl/w (!')
Etapas de equilibrio
- Adsorciôn de oxigeno
k_1/2 0, 4 1 = v-t 01
°2 P°*5C^(2* )
— Desorciôn de cloro
Cl«l2- -^7 2Cl_ 4 1Cl.
^^2 ^Clg^l(3*)
Como por otra parte :
(4')
Despejando en (2*) y (3*) :

224
'ci, ■ ‘ci,'ci,'i “ •>
y llevando los valores (5*) y (&') a la ecuaciôn (4*) :
L = C ^ d * bo^P°*5 * (8.)
despejando :
c,--------^ --------- (9')
llevando finalmente los valores (5*) (6*) y (9*) a la ecua ciôn (1*) se tiene ;
r = 2 2 2 2 (10')^ * 4 / o ' ^ * ”ci/ci2
teniendo en cuenta ahora que :
K. -® kl y . K = — s—
:
4'*02^^*’02^*’h ■ (l/K^Pcig^W) (11')
* *tl2^Cl2)
c) Control de la desorciôn de cloro :

225
ClgCl 4CI2 4. 1
Velocidad de la etapa :
r = - k_P_, C3 Cl 3 Clg 1 (1")
Etapas de equilibrio :
- Adsorciôn de oxigeno
1/2 OU 4 1 01 b. (2")
— Reacciôn superficial
01 4 2Hï T ' V ‘ "
K = a'ci,'.v T
(3")
- Como pox* otra parte :
(4")
Despejando en (2") y (3”)
(5")
Cl. (6")
sustituyendo el valor Cg dado por (5”) en (6”) :
4 i 2 = 4 4 , — pj---- (7")

226
y llevando los valores (5") y (7”) a la ecuaciôn (4”) :
L = C^(X * b„^P°-5 * (8")
despejando :
4 “ p2 0.5 (9")
* V 4 ' *
llevando finalmente los valores (7”) y (9*0 a la ecuaciôn■ t(l'O se tiene :
p % " 5p ^ - V c x ,
r = --------- --- -------- p2p0.5--( 1 4 b.., 4. K b^ . J Pa., ) (1 0 » )
teniendo en cuenta ahora que :
2
p2p0.5k'K b L( 4 4 - (1/K)P ) (11")3 * "2 4 ‘' 2
r = p2p0.5(1 * b,^P,*5 * )

227
— Mecanismo M2
Reacciôn Constante de equilibrio
Cl 1 * 1/2 0 ^ = 01 4 1/2 Cl^ b o4 4 Og
^2 ^C1 401 4 2H .'g Cl„l 4 W K =
4 4 iCl„l 5 = Cl 1 4 1/2 Cl- b
1/2 0„ 4 2H 5=3t Cl„ 4 W 4 , 4
2
La deducciôn de las ecuaciones de velocidad es paralela a la descrita para el mecanismo Ml, por loque las ecuaciones finales resultan ser similares a las (il) (11*) y (il») segûn contrôle una u otra de las très reacciones elementales respectivamente»
a) Control de la adsorciôn de oxigeno :Ecuaciôn de velocidad :
r =k^L (P°»5 . (i/K)(P^P^^/p2))
“ 4 l / c i 2 )(1 1 a )

228
b) Control de la reacciôn superficial :
Ecuaciôn de velocidad :
(11* a)
c) Control de la desorciôn de cloro :
Ecuaciôn de velocidad :
4 4 4 ^ ^/ ° * 4 / o ; 4 p ° i 5 A
(11» a)

OJCN
Iu<Q
Q
§HUU<«
<
MQ
IH
U
S
wQ
c/)<m
g
CM
CM
o809
•HA(0ooX
\
>
H
>lA
-» • CM O O
H AU
M
4- *
CM X4
Ü
>«
. §•HO(00O
O
§bOv4XOO•o
•HOUOmT3«
0)73Ok
-P
§u
09O73a+>Hg0)0)
«
Ü09 A
09« bO
TJ •H(6 kA O
k 09ea *0 H
73 k 0)O
0)+>s
•H•d
§& -
(6+>
g09 O O -Pk A A Q) O k k 44
H<
v§•HOOdQ)
A
01X
09O09 Uts (6
H H
: =*0 CO (Q Q)
l l « <
H « U
I•P(SbO0)A
!+>•H09OA
CM X
%
Ü
S»
«■puok
5
O0
I■P(6bO4)g
I•P•HCOOA
O•HUO
-PUd
<H09
•H•PCS00
I■P«bO0A
I■p•H00OA
CM X CM X CM XA Ü A Ü A
• lA • CM 4
lA • CM %
lA• CM
o o A O O A O OA A A
Ü
CM X %
.§•H09U09A0)
•H73(0
X0
1
>•H-P•H09OA
ir\• CM
o o A
• • • U09 00 09 09U u k >09 09 09 09> > > u09 09 09 hu U U •H
H CM *A •4*

•H0 (01+>
gO
CM
ON<à5
CQO*0(0■pHd«V
«
g G(0 09bO73•H(0 kG 0k 09(0 tj H73 k 09O
Q)hO
QO■pg
•H*0
gA
k O
>» d% w
j•HOO«O
A
01%
non k (0 (0
H H Om E (0*0 w (0 0)b S(0 O A -H o O :m (0
HOk
(0
I•P•HnoA
k CM XC0 A-p • lAG G • CM09 O On 09 A09 +>k PfA 0909 kk <k •
H k<
\4
«U0)>Q)
lA
(0-PÜOu(0
•O
oc
(0H
§
I■P•H09OA
09k0)
bk
•H
NO
ÜO•HmkoA0)
•H•0
10XO
>•H•P•H090A
>•H■P•H09OA
0)5(0k60909
IO
I•P•H00OA
I-P•H09OA
S•H09kOA09
<0xt0
1
I•P•H09OA
I•P•H00OA
lA U• CM
O O « y \CM X A 0A A
lA lA lA• CM • CM • CMk O O k O O k O O
. A A A
CM
Ot
00
.o#»
H
00k09>095
00
00k09>09kk•H
ON

KNON<
I
AlA lA•O o 3 OA AÜX ,û\H -*
1 lA•lA O O A0 \O u lAA • CM\ O OCM X AA CMlA O• CM XO O A'x H
II
•HOGGOfà
(0•HU•H(H
gGSQ
•HUOG09k
09•OHOk■P§L9
CQO73GPHGCQ09A
GG 0 G GG > >G bO •H •H•d *H P PG k G GG 0 bO bOk G G GG 73 H G G73 k G OGXG G G GQ P > >G •H •HG P P•H •H •H73 G GG 0 0G A AA
(Sispg(0 09 09 Pk GA 09 09 k k (w
sg•HOUGGA01X
nom k G G H H O
: = 73 w G G k G G O A "H 0) ü CQ G H
O k
AlAO ü A
OH
(Q09m k G G H H OCQ 6 G73 « G G k G G O A 'H G O n G H G k
G>•HP•HmoAG73Gg•dko
IpGbOGG
>•HP•HmoA
lA • CM O O% o
k A
CMO
HH CM
GPOGkG
73
OG
G•HP•rlGOA
lA lA lA lA• CM «CM tï «CM > • CMO O A O O A o o A 0^0CM^ A^ CM% py cm\ A CM%A A A A
L9A
lAH

sp0 G1P§Ü
tAON<ffl<H
no"dGpiHg
A
GG d
GG bO
•d •HG kd 0
k GG 73 H
•d k GO
GhGQ G
P
g•H"dgp.
«
kp
gm G G pk GA G G k k «M
iH<
k O O A
n
j•HOÜGG
A
oX
nG
•dG
sAG«
GG
io
IppGOA
CM S A
CMO
GkG>G
GG
G k G G
H H O
G S G
•d G G Gk§A -H G O G G
H G k
G
Ip•HGCA
CM X AlA • CM O O A
G
k&kti
lA
PGkGAG
•H"d
GAO§
Ip•HGOA
IPPGOA
lA • CM O O A
CM X A lA • CM O O A
CMO
GkG
tk
•H
VAH
âPGkGAG
•H■d
GX01j ;P•HGOA
CM X AlA • CM
O o A
G
kk
H
NOPGkGAG
•H•d
GXü
i
IPPGOA
G G> >
•H PP P•H PG G0 0A A
lA • CM O O A
CM X A
ÜCMO
00

ON<ffl<
X GA 0\ 73
lA Go CM PU O O HA oftc dGX A GX. AH CMOX1 G
XXA d _\ -» G dlA G• CM lA G bOO o • CM 73 P
cfk O O A G k . d 0A CM k 0)O 73 H
M X ^ k G-X oH GX
H G Q Q
PoGdo
OkOHOG73.§POkoGG73
G73
OkP§U
sp•osA
k O d
S w
c\0•HUOGGA01%
IpPnOAG73Gg73kO
IpGbOGd5pppGOA
•k lAG • CMP • O Og « CM%G G AG Pk dA GG kk PH< • k
ON
>PPPGOAG•OGg73k0
>PPGbOGd
IPPGOA
lA • CM O Ot
ÜA
CMO
OCM
GGG k G G H H OG S G73 G
S SG 0 A P G O G G H G k
IaGd>pppGOA
lA • CM O O A CM Xk
CMO3G
CM
GPÜGkG•dOd
GH§
>PPPGOA
lA lA lAÜ • CM Ü • CM Ü • CM
>O OCM% >
O OcAc >
O oCM^A A A
A
CMCM

xg•HüGd•Spgü
-4*ON<
g
GO•dGPHdGGA
dG d G
G bO V -H G k
s i :73 k G OGXGQ G
Gk G
P
gG G G Pk d A O.G kk P
H<
.g•HOÜGGAoX
GG73GkGAGG
GIGH§
IPPGOA
CM X A
CMO
GkG
kk
lACM
GPdGXgO
GG
d
GPO
CMO
GkG>Gk
a
CM
>PPGbOGdêGg•dko
IppGOA
>PPPGOA
lA • CM O O A
lA • CM O OcAcA % "
CMO
lACM
xgpGkGAG
P"d
tIppG0A
IPPGOA
lA • CM O OCM%A
lA• CM O OcAcA
Ak
CMO
*Gk>G5
VXCM
xgpGkGAG
P73GX01Ip
GOA
IPPGOA
CM X A
CM X A Ak
CloA
G
CMO
GkG>G
:rwCM

ir\CA<ffl<H
IU<QE£)QIHUU<A<Xb3QiH§U
X(s9OC/3<mgA
-♦UCM
oCM
CM
HO
CMX
oSm•HdGÜGS
CM XA
uA<H
IlA • CM O O A
lAo o%X
CM X A
O Ü An
X
xg•HOdo
O§bOPXoG*0
xg•HVkOG73GGHG73
OkPgO
GO73GPHgGA
dG d GG bO 73 P k OG
G dk G G "d P 73 k OGXG G' IP*d
gA
kGPdGGGkA G G k k PP
k O
X w
xgpooGGAoX
GGG k G G P P Or"d G G G
A P G Ü G G P G k
IpGbOGd
IPPGOA
>PPPGOA
g73kO
I
îGd
>pppGOA
OPk0POGPGP*5 /G
IPGbOGd
>pppG0A
CM Xt
A U33-
GkG>Gk
CM KN
xgpGkGAGP73GX01
GP§
>PPPG0A
lA lA lA lA• CM • CM • CM > • CM
O O 3: O O A O O A O Ocft: A
U ACM X UA CM% UA AA A A A
>lA CM X AA • A lAO k O ü k • kA A O ÜA

xg•HÜGIPgÜlAON<g<H
GO•0GPHdGG«0
g d
GGbO
"d PG kd 0
k GG 70 H
"d k G
GO
GP
g•H•0gA
H<
xg•HÜOGGA01%
G
5Gk6 G
GH
§
IPPGOA
k lA XG • CM A
P • O O lAdG
GC M %
#O oG G A AG Pk dA GG kk P
• k
A
Gk
Ii
lA
GP0 Gk
1Od
GH
§
>PPPGOA
lA lA • CM •O ÔJP ü A I A
kG>G
A
NX
xgpG
k§•
p•oG■§i
>pppG0A
>PPPGOA
AlA•O ü A
CM s A
>PPGbOGd
Gg
•0kO
IPPGOA
IPPGOA
lA
Ô O A
C.XmH
GkG>G
:
o
00
xgG
GAG
P•0
GXO
tppGOA
IPPGOA
lA lA irv• CM k * CM k • CMO O o o O OA A A
G .£
CM X A
lA
O o %
o
A
GkG>G
5
ON

o
<g<H
>A UÜ AA OXXi\ •» .P
lA• CM1 O OACM X CMA O
lA X• CMO OA 'i PM
xgpoGdoM
HG
POPPkGg"GxgpoÜGGk
GPG73okPgO
GO73G
PHdGGA
G d G
G bO 73 P G k , C o
k G G 73 H
73 k G O
GXG G O P
gP73
gA
G
kp dGG G G Pk d A G G k k P
H<
k O O Ab ?X bO
xgpGGGGA01X
GG
:kp po73 G G G
k gAP G Ü G G
P G k
IpGbOGd
IppGOA
GG
G k G G
P P O
r73 G G G k d G O A PG Ü G G
P Gk
G>
PPGbOGd
IppGOA
CM X CM X CM XA X --.A- X AlA A lA A &A
• CM ü * CM O «CMO O A O O A O OA A A
if\• CM O O%
A
CMO
GkG>Gk
IPPG0AG
73G
g•O
k
IpGbOGd
IppG0A
OA
GkG>GkCM
GPUGk
G73
Od
GP
g
G>PPPGOA
CM XA lAlA • CM• CM O oO O AA
GkG>Gkk
P
KN

xg•H0 G1PgÜ
kGNO P• d GON GG G< G PX k dCQ A G< G kH k <H
P■ <
GO73GPHdGGA
G d GG W -O *H
GU G G 73 H 73 U OGXG G
“ IP73gA
k O>N dX bO
xgpüoGGA
oX
GG■OGkAGG
G>kü
>pp
oA
CM K A
CMO
GkG>GkkP
H
GGG k G G H H Or73 G G Gk gAP G ü G G P G
k
5PpPG0A
LA • CM
O oCM^A
GkGS:kp
lA
IPGbOGd
GPgP•0gA
>PPPG0A
IPPGOA
IPGbOGd
Gg73k
IppGOA
>PPPGOA
CMO
V0
XmP
GkG>Gk
NH
xgpGkGAGP•0GXüg
>pPG0A
IPPGOA
lA lA lA lAO • • CM # «CMA O U O C P O O OA A A A
lA lAk CM S • CM • CM
A k O O U O Oc A c % CM^A A
O
Ot
CMO
GkG>GkkP

ON<àS
lA#
O ü
Air\ \e CM S
O Ü AA lAe CM
US O o\ AH G
XCM1 OAir\•
O UA lA*A O o
\ ACM S \A lAlA • CM
• CM O oO o AA CM
OX .O
H
s•HO«So
0)*0
•HOUGmG"G
G•GHOU
•P
§O
no•Ges+>HtGA
g0) g GG bO -G ‘H(6 g k G «S "G "G k OG
G Q G+»g•H•Ggeu
es+> gm G G -Pk AA G G k U «HH<
k O O A% ?X bO
-g•HGOesGX
01
I+>•HnOA<d*0Gg•Gg
t•H•PesbOGA
!+*•HOïOA
»A• (M O OoftcA
ONH
es.5+*•HnoAes"Gesg•GUO
I-pesbOGG
I■P•Hm0A
U)GG U es GH H
•G « G G U G G O A "H G O G G H G
U
I-pGbOGG
I■p•HGOA
<MO MO
OCM
GUG>G
A
CM
G-POGUG•GOG
G>•H-P•HGOA
ülA• CM O
iA • CM Ü lA• Cl
>O O C M % >
O O C M % >
O O C M ^
lA
A
lA# CM ü
A
lA • CM O O Ü
A
_#P U O o A A c ^ s UA U % A
U
CMCl

•r iOGG•g+>
§O
ON<ffl<H
GG
+>r4GGGA
G _ G A GG bO
T3 -HG, Gk G
G TJ■Ü %4OG,oG G
“ g•H*0GGA
+>
gGGUAG.U
H<
G
GG
+>
i
b 2
î i
•HOOGG
A
o%
GG•0GUGAGGG
ro
I+ i•HGOA
CMO
#GUG>G
AK \CM
G■P
g"PGGOÜGGOG
G
CMO
•GUG>G
•G*CM
>•H•PGbOGGG
+»
g•H•O
gA
■P•HGOA
I■P•HGOA
CMO
•GU
>G
k•H
IACM
I•PGbOGGG
•OG
SX>kO
I-P•HGOA
I•P•HGOA
IA IAIA IA • • CM
1 • • CM O U O O• CM a G ouA A -p A % c ic1 o A A
II
u CM a Is• u A A H UU
AG
CMO
•GUG>G
AVOCM
•HGkGAG
•H•O
GX0
1
>'H•P•HGOA
>•H•P•HGOA
CM a A
CM aA
CMOCMO
•GUG>G
A -CM

TABLA 9.8
Oxidaciôn de cloruro de hidrôgeno a cloro
Comprobac±6n del mecanismo de la reacci6n
Câlculo de las constantes y kg
EXP.Nû
1 0,006976 0,025590 30,09007 0,003699 0 ,0 0 7 4 4 8 10,5200
13 0,002382 0,002650 3.867019 0,002107 0,001490 1.877025 0,001817 0,000886 1.059031 0 .0 0 1 5 4 8 0,000513 0,5857
2 0.009131 0,013740 16,17008 0,004964 0 ,0 0 3 7 4 8 5.2910
14 0,003000 0,001090 1,781020 0,002586 0,000529 0,801226 0,002235 0,000232 0 ,3 3 1 4
32 0,001890 0 ,0 0 0 1 2 4 0,18713 0,008662 0 ,0 2 1 8 4 0 15.51009 0,004770 0,006187 4 ,9 9 4 0
15 0 ,0 0 2 8 4 0 0,001820 1,600021 0,002126 0,000814 0,730427 0 ,0 0 1 4 4 1 0,000323 0,333033 0,000998 0,000183 0 ,2 4 9 7

TABLA 9*8 (continuaciôn)
EXP.NO
4 0.010650 0,009863 7 .3 4 8 0
10 0.005658 0 ,0 0 2 4 7 5 2.331016 0.003096 0,000596 0.741622 0 .0 0 2 4 2 9 0 ,0 0 0 2 4 1 0.315328 0 .0 0 1 4 6 8 0,000075 0.138534 0.000945 0,000034 0.0929
5 0.009590 0,018990 10.190011 0,005228 0,005182 3 .2 2 4 0
17 0 ,0 0 3 0 4 8 0,001349 0.912323 0 ,0 0 2 0 4 4 0,000527 0 .4 0 7 3
29 0,000945 0.000158 0.220535 0,000472 0,000068 0.17856 0.013590 0,011830 6.6020
12 0.008287 0,002652 1 .4 8 2 0
18 0.003307 0,000299 0.278924 0,000857 0 ,0 0 0 0 4 4 0.139530 0,000227 0,000010 0 .1 1 4 2
36 0 ,0 0 0 0 0 1 0 ,0 0 0 0 0 0 0 .1 1 0 4

245
9.4 .2 .- INTEGRACION DE LA ECUACION DE VELOCIDAD
Obtenida la ecuacl6n de velocidad, dada en forma diferencial por la expresiôn :
** “a _ = w 4 ^ - k„ - % - (1)" d (M/Al) " *"1 P__ ^2 p2
y teniendo en cuenta las relaciones estequiométricas que c onduc en a expresar el nûmero de moles de cada components en funei6n del nûmero de moles de cloruro de hidr6geno pr e sentes, segûn :
“CIH = “hl-ÜH
nClg 2
0,21 “ “h“ Og = - R = ï 4 "
"Ng °
1“HgO = 2
Se puede sustituir la presi&n parcial de cada components i, por el producto de su fracciôn molar, n^/n^ , por la presiôn total fl , con lo que la ecuaciôn de velocidad quedarâ en la forma :

244
d (M/Ai> = A ; , t ■ "
1 - n Tl 2— ^ * ^
^2 2 , H \2 (2)“H •< ’
o bien :1 — xj SAp
-..A> .,. = kg ----2 - ^ —d (M/Al) Oy
0 ^ 1 - 0-5 1 2 (fr_)- Rml 4 ^ ^
(3)

A.ONCMOoo•o
CM
•0ê■ ri§iHG ON>G
00O*0 o
G o•G oS0 H
ON •HO r4• G XON S
<VGG
< GH iHG•G . g
lA
nO II•HO iHG <kbO SG
•PG o
H
001 oA-K\II
CM.r"eOuGHOSN§•HOGHG
A
00
uG
I—IOs
•HUGHGA
eOHGÜ
&G
•OHGO
G
H<
IA •H r - iH H IA00 IA r - ON H
A - VO o CM A - vDN NO lA KN IA• # # # •O O O o O O
lA 00 NO r - CM VOO O 00 00 ONA - NO lA IA IAA . NO lA IA CM
• * o • • •O O O O O O
lA A- ON CM ONr4 iH lA IA O ONlA lA CM lA O VOco A. VO IA lA
• • • • • #O O O O O O
N lA 00 o l>- lA1—1 ON 1—1 IA 00 IAIA lA O00 A . NO lA IA
• • • #O O O O O O
IA OlA
OA -
IA IA lAO A -H rH iH

00COCMooo
Ü lA CM 00 lA <AH lA CM lA ON
CM G o 00 r4 Os 00O A. lA lA lA CM N
• « • . • • #o a o o o o O O
CM 'O•HÜGHG«
•0GTJ•HO O0 r4r4G H> OoG #•0 oG IIGÜ H0 M•H0G:s -ï*o o 00
rH G •• OON G
G< H • uiJ Gm G H< •0 IA 0GA II
NO A•H NOO H •HG < OU GhO a HG G-P «AM
001 lf\ CO lAII
S'G
OHGÜ
SG
•<a
vjO 00 VO A- olA VO ON CM H VOON VO CM IA IA HNO IA lA CM CM• • • • •O O O O O O
H <*4 A lA iH ACM <r ON IA
00 00 IA IA OV AA- VO IA IA IA• • • • • •O O O O O O
IA CM lA lA H ONCM 00 lA A IA IA00 A IA VO 00 IAA VO IA IA IA• • • • • •O O O O O O
IA O O IA IA IAH IA A O A
H H H

ON
1g
00CMOoo
CM
CM
gHOSs•HoGHGa
73GT3•HU0 VOH 00G H> OOG •73 O« IIGg H0 M•HüG0Ü 00G •oGGH uGG H73 • IA 0aA IINO G•H NOO H •HG < ÜU GfaO a HG G-P «A <M
u01oO
•O CM H VO CM HH IA CM H O O ONG A CM CM A VO IAO VO IA IA CM CM CM• • • • • •f O O O O O O
S'G
sG
î
VO 00 00 ON CMCM ON H lA H00 H H IA lA IAVO IA IA CM CM CM• • • . • • #O O O O O O
ON o 00 lA IA00 A IA lA IAIA A Ov CMA VO IA IA IA• • • • • •O O O O O O
VO H H IA ONVO CM CM H OIA ON O CMA VO lA lA• • • • # #O O O O O O
IAi-r
oIA OA IA IA IAO ^ AH H H

248
9 .5 .- ESTUDIO CINETICO DE LA OXICLORACION DE METANO
9,5 ,1 .- DEDÜCCION DE LAS ECUACIONES DE VELOCIDAD
Por anâlogo razonamiento al utillzado en el apartado 9*4 .1 y aceptando la nomenclatura alll indicada , la deducciôn de las ecuaciones de velocidad para el meca — nismo de oxicloraciôn de metano conduce segûn contrôle cada una de las cuatro etapas quimicas elementales, a lo si- guiente :
Reacciôn Constante de equilibrio
1 /2 0 _ 4. 1 5==r 01^ VI
01 4 2HH
Clgl 4. W K^Cl^W
co * Cl„l — .— J- Cl 1 4. HS
^Cl^V^cofci.
Cl 1 H Cl 1 1 ClCl Pci^l

249
\ w1/2 0 4. H 4 CO Jg=S Cl 4. W K » --— 2.2 *C1
a) Control de la adsorci&n de oxlgeno :
Ecuaciôn de velocidad :
*■ " >*’c i V ‘’co * <”o/ ‘‘>*’ciV P co*’h >3 “
b) Control de la reacciôn superficial 2 : .
Ecuaciôn de velocidad :
^2^0«^ " (1/K)PQ2^^P^P(,Q)r =
r =
* ^O^Op ^Cl^Cl ^^Cl^^s_^^Cl^l/^CO^2 d 3
c) Control de la reacciôn superficial 3 :
..Ecuaciôn de velocidad ;
d) Control de la desorciôn de cloruro de metilo :
Ecuaciôn de velocidad :
n^Og^Sg^^s,^ <^o; V cq/ ^ - __________
* *>Og**o;' * * ^ 3 ^ g V < > 2 ^ * ‘H*’c o / V

250
Slmllarmente las ecuaciones de velocidad de las restantes reacciones de oxicloraciôn, resultan ser :
Reacciôn Constante de equilibrio
w \1/2 0_ 4 H 4 Cl = C2 4 W K .— —2 bgg
a) Control de la adsorciôn de oxigeno :
Ecuaciôn de velocidad anôloga a la del apartado a) cambiando :
CO por Cl yCl por C2
b*) Control de la reacciôn superficial 2 ;
Ecuaciôn de velocidad anôloga a la del apartado b) cambiando :
CO por Cl yCl por C2
c) Control de la reacciôn superficial 3 •
Ecuaciôn de velocidad anâloga a la del apartado c) cambiando :
CO por Cl yCl por C2
d') Control de la desorciôn de cloruro de metileno :
Ecuaciôn de velocidad anâloga a la del apartado d) cambiando :

251
CO por Cl yCl por C2
De la mlsma manera :
Reacciôn Çonstante de eqilibrio
1/2 0. 4 H 4 C2 5 = C3 4 W K =^ ^C3
Ecuaciones de velocidad anâlogas a las de los apar tados a), b), c) y d), cambiando :
CO por C2 yCl por C3
Reacciôn Constante de equilibrio
1/2 0- 4 H 4 C3 — C4 4 W K ^^ C4
Ecuaciones de velocidad anâlogas a la de los apar tados a), b), c) y d), cambiando :
CO por C3 yCl por C4

CM
ON
g
0Î1MQ§HU§dHg2MQ
O
gH(JzQW3I&
0G •H0 U
•0 0G -P■P GH GgG G
& G •HO A ■Pa G
PU GÜ
> G G GPU T3 bO >
H G *H •HÜ ei u -P
12 PU G 0 Gu 73 bO
- f IA G k G GG 73 O G A
H XH CM G G GO X G Xi -P >
eu bd G S3 •Hu 0 o Q G •Pf l S3 Ü H •H •H
1 G & Ü "0 G♦ bO \ A 0T! ^ G Pi
o X PU Puü 0 H - *
u 53*♦ G eu O PU
•0 O Os bd PU (J
S3 V . \ U PU* f nO h 53 G • IA
•H w PU -P • CMH O H A G O oO k 1 ü G PU
0 PU G GG lA G -P
*0 # CM IA U AG O O G PU G
PU bd G kG w U <H 53
H ' H PUO H • OG .O < Ü
*0 Piu
H0U H
0 -P Üa S3 PUG 0 H
•H Ü OS3GO •4G ■ Sh 0X H 0 Pi
>N p H. G kII % bO
u
••
pNO•r(. A •G nO G5 •H UW O G
» ü >G GG UP3
01X H
G GG G G GA G A , G G G0 G "0 0 G "0 •0 >
•H G G •H G G G •HÜ k k Ü k k A -PG G G G G G G •H
H H A H H A 73GG 0 G G 0 G k 0U S G k G G 0 A
I+»GbOGti>•H■P•HGOA
G G> >
•H •H+» +>G GbO bOG GA AG G> >
•H •H-P + i•H •HG G0 0A A
s
ÇU oH Ph Ü lA & «CMo oOi
X"bu
t
> op4 U HÜ lAo S
Cu
XX
OhH p4 C lAo S
A
HU
^ CM s & AM
lAn
HU
lAn
UiCMG
MO
GÜÏu
CM
•GUG>GU
IA

•H0
1-P
§OCM
CN<
î
mo*0G-PHPGGA
AG G73 G *H
S g
Il gGXiGQ
G■P
g•H
IA
G%
■P
gG G G -Pk AA G G k . k <H
r4<
k g
II
i•HÜOGGAoA
G "H .A G
gg•H•0
G1i-P•HGOA
lA • CM
% ?
GkG>G
ilA
G
il•H -P "O G A bOG G A A
GH§
HO
G
gg5V0
G G G G "A
g|O A
G G
G
1
G•POGk•SOA
G1
tAGlAG
HO
MCMG
HU
GkG>G
GkG>G
i
G
A >G *H
•H -P TJ G A bO G GA A
>•H-P•HGOA
G G G G> > > >•H •H •ri •ri
V P ■ P•n •d •ri •riOC G G GG 0 G 0A A GU A
X XA AO X O XU A O A H
IA A H A H ü• CM H IA O lA U A
O O O • CM A • CM AA A O O O OA A
lA • CM O O A
GkG>Gkk
•H
ON

N§•H0 G1P§Ü
ClH•ON<àg
GO•OGPHPGG(XAG G'O G *H A k G O k TJ G k A 73 O G
GXiGQ
GPg•H•OgA
Gk G PAG G G G P k A A G G k k <H
k O ^ P % bO
«g•HGOGGAOA
G ‘H Xi Ggg= &P73
•HP•HGOA>•HP•HG0A
ITN • ClO oA .
K\G
GkG>G
G G •0 > G *H A P G G 73 bO k G0 A
>P•HGOA>•riP•riGOA
G G 73 > G Tl A P G G •0 bO k G0 A
IP•riG0 A
1P•riGOA
G G■S-g g1S*0 bO k G O A
IP•riG0A
IPPG0A
in IA H IA Hk «CM k • CM O «CM OO O O O A O O AA A k A k
IAG IAGbdCMGHO
bdHOrriÜ
GkG>GkkPCMH
IAGGbd .
''ho»P
mGkGggPIAH
G G 73 > G Tl A P G G »0 bO k GO A
•Ep•riG0 A
1PPGOA
> SO A A O O _U H O X O XA O O A A A A AA ACM 33 A
IA• CM S3O O AA HO ÜÜ AA k
IAGUtCMG
IAGHU
GkG>Gka
H

IAH•ON<d2
HG•HO•H
gPG
•HOÜGGUGHG•0OkP§O
i
uAx-sbd
ICM S
• CM O O A
OO
IAG
O
U.o
IA • CM O O A CM O Xi
S•riU
PÜfà
G P P P p0 NO NO NO NO73 G tI G •ri G •ri GG ■ A G 43 G A G Xi GP O k O k O k O kH P G p G P G P GP .8 A a A a A a AG G G G GG P P p •riA *0 •0 *0 73
G G *0 bOGgk X G k •0 O
G43GQGPg•ri73gA
Gk G PgG G G P k P A G G k k <HH<
k 0 ÎA P X k
J•riÜÜGGA01X
G G G G> > > >•ri P •ri PP P P P•ri •ri P •riG G G G0 0 0 0A A A AG G . G G> > > >•ri P P •riP P P PG G G GbO bO bO bOG G G GP P P P
IA lA IA IA• CM • CM • CM • CMO O X O O X O O :%O O% \ %A O A U A U k
O A O A O A OO V O UA A A A
CM X A IA • CM O O Ak CM X A O
t
CM S AIA • CM
CMO HO
IAiri VO
#GkG>Gk
%
OU
\AIA • CM O O A
lAGbd
coiH

s•HÜGIP§OtAHON<
2
GO*0GPHPGGAPG G *0 bOG
gk 73 G k *0 OG45GQ
GPgP*0gA
Gk G PgG G G Pk P A G G k k <HH<
sgp0üGGA01 X
GGG *0 G G , > k k G P A O G G
G
IPPGOACM X AlA • CM O O A
ON
GGG 73 G G > kgü GAGG
GH§IPPGOA
CM X A
CMO
OCM
«gG PA
iGkGAGP*0
GHgIPPGOA
CM X AIA• CMO oA
HOA
PÜ45
PCM
GpoGk
GP§•EppGOA
• CMO oA
UA
tAG
PU
CMCM
•0 > G P P P G G *0 bO
>PPPGOA>PPPGOA
lA • CM O O A
CM X A
CMO
GkGggPIACM

s•HOGPP•HPPOO
tAON<àg
G■§GPHSGAPG G-0 G *H
g g* % g *0 O GG45GQ
GPg•H73gA
UG . PP GGG G G PU P A G G k k3-
b 2>N p
% k
Ng•Hu0 G G A01 X
GPgP P 73 G P W :G G ;A P
IppGOA>PPPGOA
HO
HO
GkGggP
CM
G G
gïX bO k G:o p
IppGOA>PPPGOA
G
s iP P 73 G P bO G G ;AP
>pppG0 A
1ppGOA
G G-g >G P P P G G 73 bO
>PPPGOA>PPPGOA
G G 7) > G P P P G G *0 faO k G O P
IPPGOA>PPPGOA
X XA O H IA AH O U • CM HO A A O O OA A A
O U A lA • CM O O AA O
U
CM X CM X CM XA A A PlA k IA k CM X k CM X k IA O• CM • CM A A • CM AO O O O O O kA A A
IAGlAG tAG
udHO
HOCMO
bd A
IACM
GkGgg
VOCM
HO
CM4?
Gk>G
CM
HO
HO
00CM

H
<mg
G•HO•HkGPGN§•HOOGGk
G•0HOkP§O
ACM X A m• CM O O"bOA
KM X AlA o CM O O ACMGACMO43
HO‘•ho
IA • CM O O"boA
J•HܧÜA
G73 G G G G _G GG 73 > 73 > 73 |>P G P G P G PH P P P P PP G P G p G PG *0 G X G •0 GG k 0 k 0 k 0A 0 A 0 A >0 A
73Gg
•0 O
pG G
G43GQGPg•H•0gA
GkG PgG G G P k p A G G k k <H
3-
k g % p% k
N§P0 ü G GA01 X
IîGP
IPPGOA
tPPGMGP>PPPGOA
IPGbOGPIPPGOA
X X X XA A A (kIA > lA X *A IA• CM A * CM A • CM A «CMO o H o o H O O H O OA O A U A O AO A O A O A OO O U OA A A A
X XA AH k H kU OA A
CMOHO
ONCM OIA
Gk>Gk
IA
G GG 73 G G Ü k k G G G H H 0 G O Gk E G
IPGbOGPG•SPPGOA
AA
XA XIA A• CM HO o ÜA Ak
CMG
OA
CMIA

i•H0
1P§Ü
ON<i
GO*0GPHPGOAP
G G-0 bOG PP kG 0
k *0G k P
*0 O G
G43GQ
GP
g•H*0gA
Gg
P
gG G G Pk P A G G k k <H
< '
k go An
s•HOÜGGAoX
GPOGk
■§
OP
GH
g
IPPG0A
GG
G "G G G
G G
gP Ü k k G G G
H H P G O Gk a G
GHSlppGOA
GPüGk
i0P
IPPG0A
G G GG *0Uo A
G G
G
GP
g
!ppGOA
P P *0 G P bO G G A P
•EppGOA>
PPPGOA
CM X AlA • CM O OOA
CM S
OA
CM XAIA X• CM A O lAO O H O H • CMA O A O oO A AOA
CM X%OA t
CMG
CMO
A
HO
WCMO
eGk>G
gP
IAIA
Gk>Gk
IA
GkG>G
A
lAIA
GkG>Gkk
P
VOIA
GkG>G
5
IA

G0 G73 P GG PP G pH P pP 73 GG P bOG G GA A PPG G G7) bO >G P PP k +G 0 Pk 73 GG k P 0"d O G A
G G GA P >G p PQ G +P T473 GP 0G AAPnQp CM Xü AG IA XP k • CM AP G . • O O HP P A OP P G O AP G ü0 G G A0 G Pk PA G CM XG k AH k ^ X lA• A • CMON H . • H O O< O A< A QO03 • A
<H
k 0 H0 A UlA p 4)G k »X bO H
eP GvO kP GU >ü GG kG kA PoiX cotA
sG *riA
i
mUoAG•H*0
ip•HG0 A
1PPGOA
CMGbdCMO
ONtA
GPgP P 73 G P bO G G A P
>PPPGOA>PPPGOA
HUCMO
#GUGgkkP
G P>§2 p G
p•0
IppG0 A
1PPGOA
CMGdCMOCMO
GkG>GkkP
N§G P-g GkGAGP•O
CM XA H IA AIA U • oj X CM P• CM A O O A X UO o A A AA
IppG0 A
1PPGOA
CM XA lA • CM
O oA
CM XA X O Ok O A ü k OU k A AA
CMGUtCMOHO
GkG>Gka
CM

IAH•ON
i
oHPPGSG•OO2O
G•d.§pouOGG"d
G*d
oup§o
AEH
• CMO o A
AOO
• CM O O AIAG“bGUtCMO
CM X AIA # CMO o ACMG
UtCMO
IA • CMO o“b
o43
POGPÜfà
G0 G G G G G G G G•d *d > •d > •d > •d >G G P G P G P G Pp P P P P P P P PH G P G P G P G PP *0 G "d G *0 G •d GG k 0 k 0 k 0 k 0GA 0 A 0 A 0 A 0 A
PG G 'd bOG P P U G O k *0 G k p •d O GGAGQ
GPgP"dgA
k O P
X k
püüGGA01X
G G G G> > > >P P P PP P P PG G G GbO bO bO bOG G G GP P P PG G G G> > > >P P P PP P P PP P P PG G G G0 0 0 0A A A A
O O Oo O U ük HO Ü
\AHO \
HO ■ \G •P « f %AIA %
AIAP G • CM A lACM A • CM A • CMG O o O O O O P OG G A A A ^AG Pk PA G OG k CM X Uk 44 IA A H\H • CM H IA OH . • k O O O O • CM
2 -A
< A % A O O %
IA • CM O O A
HO
CMO
CMn“c*o
IAGUtCMG
IAet* •4*•4*
eG
IkIA•4» VO-4*

ü'O•HÜGIPÜOumiHON<àg
GGP
G G G O G0 P G G G73 0 G 73 k 73G •H G G G GP O k k G G kH G G G 73 > GP H P A k AG G 0 G 0 ■PGGA
k S G P Ü G
PG G73 bOG •HP kG 0
k 73G k P73 O G
U oK gZ k
Po•H0 Ü G GA01X
GHg
G G GA P >G P •HQ G P
•H •H73 GP 0G AA
OU
Ak XG . • AP IAP G • CMG O OG G AG Pk PA GG kk <HH . • k<
A-4*
>•HP•HG0A
OU“bA
CMO
00
>•HP•HGOA
CMGdCMO
ONeh
GP§ G P
G GȤ P O
KNGbdCMG
bdCMoA
OlA
G G 73 > G *HP +1G G "d bO k G O P
IP•HG0AG
P•HGOA
OX u X HA A A
GP
IA• CM O O A
Ak
CMO
lA

•HUGIPgÜ
lAH*ON<i
GêGPHPGGA
PG G*0 G ’H P k G O k 73 G k P 73 O GG.0GQ
GPg•H"dgA
GgPgG G G Pk P A G G k k 44
k gK gX M
iPÜ0 G G A01 X
G G 73 > G *H P P G G •d bO k G O p
IP•HGOA>PPPG0A
%
CMn
O
k>GkkP
CMlA
Gs ip p *d G p bO G G A P
IPPGOA>PPPG0A
H k
IAGdCMG
O
G
iG:IAIA
G P A G0 k1 Gp•d
>pppGOA>PPPG0A
8A t
CMGbdCMOCMO
GggA-d»IA
âG P «! i »P•d
IppG0 A1ppGOA
H k
IAGdCMGbdCMOCMO
Gk>GAIAIA
G G -d > G P P P G G *d bO
IPPG0A•gPPGOA
OÜCM SA Oü ^IA X A X <M a » Pu•CM A IA A A A as AO O • CM AA
O
H k
IA
G‘I.O,o#CMGCMO
Gk>G
5
VDIA

Üu
rv. 00 N CO CO 00 CO COif\ ON H VO CM CM CM CM CM
CO CO CM K\ CM ON OV OV O' O'o o H H M O O O O o• ’ • • • • • • • # •o o O o O o o o o o
CM
VOH•O'<
<
o§+>0)S0)V
•HÜ«uoHUXo
•HÜO(80)kc8O73
Sm•H§0oG0)•0
•HÜ(80 U
1o
H
CMr\
HK\i4
CMCMui
CMU8CMHU6
HHui
DO«+>§■P<0§on<8
«•d
K\Ok
N H H CM lA ov VO lf\ H CMVO N CO CM CM o CO irvCO O CM H CO VO H Ov NCM CM H H o K\ CM H O O# • • • • • • • . • •o O O O o o O O o o
CMO
CM H ov CM OV lA ov CMH CO O CM CM o tAlA O' CM H lA CM H o •A lACM o o O O (A H o O O• • • • # • • • • •o o o 01 ? O O o 01 01
HÜ
CM lA CM CM CM H CM CO CMOV DA O tA VO CO lA ov tAH O tA CM CM o CM CM tAH O O O O H o o O O• • • . • • • • • • •O o o o O O o o o O1 1 1 1 1 1 1
OUCM o CO ov CT' lA CM COo CM tA lA O lA ov H CMtA O CM rv- tA lA Ov00 CM CM H ov CM H o# • • • • • • # •o o o o O o o o O o
doHV8O
0155
eCM K\ m VO CO ov oH

ON ON CM CM 00 CO lA o ONON ON H VO CM CM o VOVO VO VO lA VO ON ON CO CO f'-o o O O O o o o o o• • • , • # • # . • • •o o o o o o o o o o
K\OlA ON VO tA ON lA |N- olA CO VO ON o CM o COtA O ON VO On r- H CO tACM H H o o CM H . H o o• • • * • • • # #o O O o' o O O O o o
•H0 «1 +>go
CMou
VO CM lA lA H o ON NtA CO CM tA o H H H CMr- VO CM O H CO ON tA o lACM o O o O CM O O O o• • • • • ' • • • • •O o. o o 01 O o o o
VOH•ON
g
HUCO r- lA CM CM CO H CM NtA ON o VO lA tA O VO VOVO CM H CM VO O CM tA lAH o O o O H O o O O• . • • • • • • . • • •O o o o o O o o O o1 1 1 1 1 1
O H ON tA lA |N* VO H VO ON tACM H lA O 00 lA H N o VO|N- CO CN* H O tA CMCO tA H H o CO tA CM H• • ' # • • • • • . • . •o O O O o O O O O O
01%&M
CMH K\H H lA VO H H COH ONH

CMOU
CM lA lA lA 00 r- cM 00 tAcM (A CM N VO H tA 00 LA LAH CM tA LA IN. H CM HCM CM CM CM CM CM tA tA tA CM• • • • • • • ' • • •O O O O O O O O O O
K\O
tA o CM fN- LA tA CM CM IN. 00VO 00 ON Ov CM IN VO 00 00 tAH H 00 CM ON o H tA IN. VOCM o O O LA CM O O H# • • # • • • • • •O O o o O O O O o O1 1 1
S•HÜdI■pgü
CMOVO CM CM IN. cM CM IN. H CM IN-tA ON VO H LA CM 00 00 ONIN. H VO CM VO IN. CM H LACM O o O CM o H H o• • • • • • • • # •O O O o O O o O O o1 1 1 1 1 1 1 1
VOONc<H
HU
H CM IN. I LA IN- CM CM ONLA LA LA CM H O ON cM ONO O H CM tA 00 CM LA H tAH O O O O o O O O O• • « • • • • • • •O o O O O o o O O o1 1 1 1 1 1 1 1
VO O o ON LA CM VO CM 00 ON00 ON ON O IN. r* tA VO CM LAVO tA CM N 00 LA LA ON CM LAo cM CM H o CM CM H H O• e # • • • • • # •H O O O o H O O O O
a55ft CM CMCM lACM CM lACM VOCM CM 00CM
ONCM OlA

ou
|N- ON 00 ON o VO lA O VOrH ON ON ON VO ON CM O 00 lAtA CM ON VO tA 00 ON O HH H Q o O H H CM CM CM• • . • • , • . • • • • #O O o o o O O O O O
K\O|N. 00 r- .d* ON H r- CM CMCM ON VO H H N 00 CM [N.tA tA tA tA tA ON 00 HtA H O O O tA H o O O# • , # # • • • • • . #O O O o o O O o o 01
•H0
1•P§O
CMUHSCMO
ON o CM o VOlA H [N. CM lA H 00lA O o CM ON H LA ON OO O o O CM O O O H• • , • , • • • • . • •o o- o o O O o o O1. 1 1 1 1 1
VDH•ON<
î
HO00 o CM CM CM .1CM lA <M ON ON lA tA 00 ONCM ■ o H CM H H O CM tA CMH o O O O H O O O O;• • • • • • #' • • . #O o O o O O o O o o1 1 1 1 1 1
O lA ON VO .d* ON 00 00 HON tA H tA CM o 00 o 00H ON O tA VO N VO tA CMON tA CM H O H CM CM H . H• . • ' • • • • • •.. • •O O O . O O H O O O' - O
01%
i HtA CMK\ tAtA .ytA tA VOlA 00tA ONtA S

OU
Ov ov ov OV O tA [N. ov CMtA tA H tA CM OV H OV OV OIN. IN. N r- VO CM H [N. tA .d<tA tA tA tA tA tA tA tA .d« O• • • # • • • • • •O O O O O O O O O O
tAOtA tA md« o H H ov tA O .dVO VO OV IN. O OV IN. Ov tA tAVO CM tA tA .d< IN. CM .d* CM |N.
H O H CM CM O CM tA O# • • • * • • • •O O O O O O O O O o1 1 1 1 1 1 1
•HüdI§O
CMOCM CM ov CM VO ov IN. tA HH H Ov VO CM CM VO CM O00 VO 00 o 00 OV IN. ov OH O O H o H O H O o• • • • • • • • # #O o o O o O o O O o1 1 1 1 1 1 1 1
VOOv
g
AOCM I^ cM ov H cM o ov tA HCO 00 H 00 O 00 CM CM tA OVO O tA .d* O tA H tA O OO o O O O O O O O O• • • . • . • . • • • • •o o O O O O O O o O1 1 1 1 1 1 1
0 u k1
00 tA fN. O ov o tA ov ov HH H H H tA H tA OV OOV 00 CM CM tA CM tA CM VO OH CM CM H O tA .d* iH O O• # • . • • • • • •H O O O o H O O o O
a55ftCd
H CMCM tA CMCM tA.d* VO IN.CM
CO.d* O'md* OtA

VO o o lA H o CM tA tAH [N. 00 lA tA 00 o VOO tA ov CM O ov o OV OV OVCM H O O o CM tA CM CM CM• • • • • • • # #O O o o o o o O O o
tAO
N o lA CM -d< tA IV- tA ovH H tv- CM CM ov CM tA r - OVN CM 0 0 tA H .d« OV H CO NCM H O o O .d* O O o H# • • # • • • • • #O O o o o O o 01 01 O1
Ǥvl0
1+Ȥo
CMO
H tA OV N CM CM H H IN.CO O O Ov VO o o tA tA tAI H CM CM CM H -d* o o COH O O O O CM o H H o• • • • • • # • • •O O o o o o o O o o1 1 1 1 1 1 1
VOH•Cv<
t
tA IV. N CO IV. -d* N CM oo H CO CO H lA H O O .d*00 O o o o CO tA tA Ho o o o o o O o o O• « • • • • • • # •o o o o o o o o o o1 1 1 1 1 1 1
H SO H CO ov tA tA so CV -d<N I^ N CM o tA 00 H Cv VOlA o 00 OV CM CO H O CM VOCO tA H o O H -d* CM H o• # # # • # • # • •o o O o o H O O O o
«%ft lA CMlA •AlA lA lA VOlA &A lA 00lA OV OlA VO

270
9.6.- INVESTIGACION OPERATIVA
9.6.1.- INTRODUCCION
La continua mejora exigible a cualquier a£ tividad humana, puede concretarse en el campo de la tecno logia qulmica, a la de obtener, a partir de una détermina da cantidad de materia prima, la mAxima cantidad de pro- ducto, de la mayor pureza posible, al minimo costo y con el minimo esfuerzo. Pues bien, la optimaciôn es la repre- sentaciôn formai de estas ideas.
• Si bien las técnicas empleadas en la inve^tigaciôn fundamental, diseno y desarrollo a escalas pilote e industrial de procesos se suelen agrupar bajo la de- nomdLnaciôn comûn de investigaciSn operative, es en estas dos ûltimas etapas (diseno y desarrollo), donde estas té£ nicas encuentran su mayor campo de aplicaciôn.
En todo proceso existen un cierto numéro de factores contrôlables o entradas, taies como temperatures, presiones, caudales, concentraciones, etc., y un ciertoiiû mero de factores dependientes de éstas, denominados sali- des o respuestas taies como conversi6n, rendimiento, c&l±

271
dad, coste, etc* Se hace pues necesario el conocimiento de la influencia que las primeras tendrAn sobre las respues - tas, no s6lo para modificar estas ûltimas, sino para conse, guir su "valor Aptimo"#
La segunda de estas situaciones, en que se ve implicado el investigador, es en general una fase poste rior a la realizaci&n de la primera, y fAcilmente se comprends que se puede reducir en la prActica a la determina- ciôn del valor mAxdLmo o minimo de una funciûn de varias va riables, del tipo :
respuesta = f (entradas) jL
A pesar de que como ya se ha indicado, la m vestigaciAn operativa adquiere una especial importancia en las etapas de diseno y desarrollo de procesos, tambiAn pu£ de desempenar un importante papel en la etapa de investiga ciAn fundamental a escala de laboratorio, pues permitirA tener la informaciAn deseada en un minimo tiempo y esfuer— zo. Por otro lado, la sistematizaciAn empleada y la estra- tegia de bûsqueda de informaciAn, darAn un mayor rigor ci en tifico al trabajo realizado#
La mayoria de los problemas prActicos anal£ zados con las técnicas de la investigaciAn operativa, pue- den ser tratados con un mismo proceditniento general, ya que el objetivo comûn es determiner la influencia que una serie de variables independientes (entradas), sujetas a determi- nadas restricciones e influenciez compétitives, tendrAn S£ bre las respuestas, y en su caso, determiner las condicio-

272
nés en que estas ûltimas alcanzarûn su "valor ûptimo"#Las etapas de investigaciûn, se pueden re-
sumir como sigue :
1«- Définir un objetivo adecuado para el problème en estudio.
2«- Establecer con claridad las posibles restricciones externes sobre el problème que se estudia#
Proponer un sistema representative del problème, que posibilite su estudio.
4.- Analizar los elementos del sistema y sus posibles interacciones.
5.- Elaborer un modelo fIsico-matemAtico o emplrico— experimental, representative del sistema que permita définir "el objetivo" en funciûn de las variables del mismo.
6.-, Establecer con claridad las posibles restricciones internas sobre las variables del sistema.
?.- Desarrollar la experimentaciûn (o simulaciÛn) ba sAndose en el modelo elaborado, a fin de llegar a la expr£ siûn de la funciûn objetivo.
8.- Tratar de introducir las simplificaçiones necesa rias para q ue el problema, s in perder sus caracteristicas esencialês, pueda ser sometido al proceso de optimaciûn.
9.- Comprobar que el modelo elaborado représenta ad£ cuadamente al sistema propuesio.
10.- Mediante la têcnica de optimaciûn adecuada, de -

273
terminar la soluciûn ûptima del sistema y discutir la na turaleza de las condiciones del ûptimo#
11.- Utilizando la informaciûn obtenida, repetir t£ do el procedimiento hasta encontrar el resultado mAs sa- tisfactorio.
De las etapas indicadas, cabe establecer algunas consideraciones sobre las que de una manera mAs directa influyen sobre el estudio particular que nos ocu pa. De las restantes, se puede encontrar un detallado tra tamiento en la obra de Beveridge, G.S«G. y Schechter, R# S#, "Optimization : Theory and Practice", Me# Grav-Hill Co., N.Y. (1970).
9.6.2.- EL OBJETIVO
En cualquier proceso de optimaciôn es fun damental elegir, de entre las multiples soluciones posibles del problema de que se trate, aquella que sea mejor respecte a un criteria bien definido. Este criteria, el objetivo. es por tanto la etapa esencial de cualquier eia tudio de este tipo.
Los dos tipos de criterios mAg generalize dos son los econômicos y los técnicas. Si bien los crit£ rios econômicos, como los del bénéficia o los del inmov£ lizado (52) , suelen dar lugar a modelas mAs realistas,existen una gran cantidad de publicaciones partidarias de

274
los criterios puramente técnicos (53) (54) (55) • De to- das formas, si se decide utilizer estos ûltimos, los criterios econômicos se deben considerar como restricciones del sistema para evitar resultados impracticables y limiter el campo de aplicaciôn de los criterios técnicos a e£ tudios matemAticos tales como el ajuste de superficies con el minimo error posible etc.
La elecciôn del objetivo apropiado no es inmediata y mientras la expresiôn cuantitativa del mismo es normalmente una funciôn de las variables independien - tes, factible de ser maximizada o minimizada, en algunas ocasiones se pueden presenter complicaciones adicionales como las debidas a un comportamiento estocAstico del sis— tema en la regiôn estudiada, o a influencias de factores compétitives que habrAn de ser salvadas con la aplicaciôn de técnicas especiales de optimaciôn bajo incertidumbre#
• Por otro lado, el criterio adoptado depen-derA del tipo de trabajo e incluse de la etapa en que este se encuentre (investigaciôn, diseno o desarrollo) y a veces, en la prActica, habrAn de satisfacerse varies criterios a la vez que conducirAn a diferentes soluciones Ô£ timas. No obstante, une de elles serA siempre el princi - pal con el sacrificio parcial de los demAs y como se verA mAs adelante, la posibilidad de optimaciôn dependera de la precisiôn con que pueda definirse el sistema elegido#

275
9.6.5.- EL SISTEMA
La necesidad de que en ultimo término, el objetivo ha de ser expresado en funciôn de aquellas varia bles del sistema que pueden ser controladas extemamente, en forma de funciôn objetivo, hace que la proposiciôn del sistema esté supeditada a cualquier restricciôn impuesta desde el exterior. Asi, si se desea realizar una extrac — ciôn, la elecciôn del sistema estarA en cierto modo res - tringida por la disponibilidad de disolvente.
La selecciôn del sistema se puede ver fac£ litada preparando una adecuada representaciôn del mismo y conociendo la naturaleza de los elementos o subsistemas que lo componen. Estas representaciones van desde la mAs tradicional, pero no por ello menos efectiva, de diagrams s de flujo por bloques, hasta las representaciones ma- triciales (56) (57) o en forma de complejos listados (58) (59) (60), aptos para el tratamiento con ordenadores.
La optimaciôn no puede>realizarse hasta que el comportamiento de cada elemento del sistema o el del sistema globalmente considerado, representados p# ej. por un bloque, esté adecuadamente plasmado en un modelo. La existencia de un modelo tal, impl^ca que si se dan un ju£ go de valores para las corrientes de entrada, las de sal£ da queden determinadas, bien exactamente, o en términos de

:r;
una funciôn estocâstica. Esta definiciôn se puede conse— jGcuir especificando p, ej. las variables asociadas con ca da corriente del sistema que en un caso general podrân ser de uno de los tipos siguientes :
1 Corrientes que llegan al sistema desde el exterior o entradas (E),
2«- Corrientes que abandonan el sistema hacia el exterior o salidas (S)*
3#- Corrientes que[se generan y terminan en el pr£pio sistema o corrientes internas de entrada (1. ) o demsalida
Si se considéra un elemento n de los N totales que constituirân el sistema en la forma grAfica indicada :
In2n
ÿn
SISTEMA
ELEMENTO n
® l i i * ' ^ p n ^ n ï ' ^ n q
nin2L .nq*
N -
PfP -q»q -
elementosentradassalidas

277
la representaciôn cuantitativa del modelo (expresiôn de la fimciôn objetivo) puede ser hallada en forma de una ecuaciôn de transformaciôn, que para el caso considerado podrla adoptar una de las siguientes formas :
^nl “ ®2ii* •••’ ®pn* ^ln‘ ^2n* 'T'*
^n2 = ®2n* ®pn» ^In» ^2n*
Inq' = ®2n* •••• ®pn* ^in* l2n' •••• Ip'n)• /
®nl ° ®2n* •••♦ ®pn* "on* ^2n«
®n2 " *2^®ln’ »2*' •••• ®pn‘ I2.. ' Ip'n)
^nq “ «q^®ln* ®2n* ' ^pm' ^In* ^2n* "« ^p*n'
• En ocasiones puede ser interesante obte—ner un determinado valor para una de las salidas y en es, tos casos la ecuaciôn de transformaciôn deberia ser in - vertida en el sentido de obtener una entrada en funciôn de las demAs y la salida especificada. Desgraciadamente, tal inversiôn para la ecuaciôn de transformaciôn es a menudo imposible y cualquier anAlisis basado en la exi£ tencia de esta inversiôn es impracticable. Esta dificul- tad, puede ser debida a factores tan diverses como la ex presiôn en forma explicita de la entrada correspondiente a partir de una ecuaciôn matemAtica muy compleja o al h£

278
cho de que una serie de juegos de valores para las entra das. pueden dar lugar a una misma respuesta, y a partir de esta no podrân identificarse las entradas de forma ôni ca.
En cualquier caso, la optimabilidad de un sistema vendrâ definida por el nûmero de grades de liber-tad del mismo, definidos a su vez por el nûmero de variables de entrada que pueden ser alterados independientemen
/te y que producen cambios en la salida*
El nûmero de grades de libertad de un si£ tema vendrâ dado generalmente por una ecuaciôn del siguiw te tipo :
L = > D - VNC - R 3p ^
donde : L = Nûmero de grades de libertad,Dp="Dimensionalidad" de la p-ésima entra
da (nO de variables no consideradas que influyen sobre la corriente p-és^ ma) •
VNC = Nûmero de componentes de entrada fue- ra del control del investigador (varia bles no contrôlables),
R s Nûmero de grades de libertad perdidos por las restricciones a que estâ some— tide el sistema.
Se comprende fâcilmente que D represen-p ^
tarâ el nûmero total de variables de entrada que determi -

279
nan el comportamiento del sistema y que D - VNC pro-pal **
porcionarâ el numéro de variables contrôlables.En funciôn del valor de L cabe conside— r
rar très tipos diferentes de sistemas :
1«- Sistemas sobredefinidos (L<0), en ' los que existen mâs especificaciones para las entradas que el nu mero de éstas. En estos sistemas no existe posibilidad de obtener una soluciôn*
2.- Sistemas definidos (L=0). En estos sistemas existe una ûnica soluciôn que satisfaga las condiciones de entrada y restricciones impuestas.
3«- Sistemas indeterminados (L > 0). Estos en prin- cipio admiten un nûmero indefinido de soluciones y son los ûnicos que admitir&n un proceso de optimaciôn para elegir una de ellas respecte a un criterio bien definido (como ya se ha iqdicado),
9*6.4.- EL MODELO
Dependiendo del problema de que se trate y del tipo de sistema que pueda proponerse, el modelo ela borado puede ser de dos tipos fundamentales :
1.— Modelo flsico-matemâtico.
2.- Modelo emplrico-experimental (denominado en la literatura americana "black-box"),

280
El modelo flsico-matematico surge de la combinaciôn de ciertos mécanismes, postulados como aspec, tos contrôlantes del problema, con las leyes bâsicas de conservaciôn de materia, energia, cantidad de movimiento y carga eléctrica# Tal como se indica en el diagrama de la figura 9.10 un adecuado desarrollo analltico permiti- râ la obtenci&n de un sistema de ecuaciones independientes, en el sentido de que éstas proporcionarân unicamen- te las salidas o respuestas para una serie de entradas bien especificadas. Estas ecuaciones pueden ser utiliza- das de dos maneras. diferentes.
Primeramente, si es posible, se introdu cen una serie de simplificaciones flsicas o matemâticas, de manera que las ecuaciones transformadas sean aptas pa ra, por aplicaciôn de técnicas analiticas de optimaciôn ade cuadas, lograr los valores ôptimos buscados. Aqui,la ut£ lidad, hace referenda a las exigencies de continuidad y derivabilidad que la aplicaciôn de los métodos analiti - COS impondrân a las ecuaciones transformadas. Si éstas no cumplen con alguno de estos requisitos, cabe también la posibilidad de efectuar un tratamiento numérico de las mismas.
Dependiendo del tipo de sistema que estas ecuaciones representen, podrân ser algebraicas o di- ferenciales. En sistemas concentrados, denominando por taies aquelles en los que los valores de las variables re levantes del sistema no dependen de la posiciôn (un rea£

Plantearaiento de laExperimentaci6n
DesarrolloAnalltico
Técnicas Numéricas por Computadores
Expresiôn Analitica de los Resultados
Selecciôn de las Respuestas
Simplificaciones Fisicas o Mateméticas
Métodos Numéricos de Optimaciôn
Métodos Analiticos de Optimaciôn
Métodos Numéricos de Optimaciôn
SISTEMAREAL
EXISTENTE
MECANISMOSCONTROLANTES
LEYES DE CONSERVACION
VALORES o REGIONESOPTIMOS
ECUACIONESINDEPENDIENTES EXPERIMENTALES
RESULTADOS
MODELOEMPIRICO
EXPERIMENTAL
SOLUCIONESRELEVANTESFUNCIONOBJETIVO
ECUAClONES UTILES
SIMPLIFICADAS
MODELOFISICO
MATEMATICO
FIGURA 9.10

282
tor tipo tanque agitado en el que las concentraciones son iguales en todos sus puntos, pertenece al grupo de sistemas concentrados), las ecuaciones representatives ser&n de tipo algebraico# En sistemas distribuldos, por el contrario, como en el caso de un reactor tubular de flujo con tinuo, en el que la concentraciôn va variando con la posi ci6n, las ecuaciones vendrân expresadas en forma diferen- cial, considerando por supuesto, ambos tipos de sistemas en rêgimen estacionario*
Entre los numerosos métodos existantes de resolucién de ecuaciones algebraicas, se pueden citar como més representativos, el de interpolaciôn y el de Newton-Raphson, en los que dada una funciôn del tipo :
F(p,Ÿ) = 0 4
donde : p = salida o respuestaY = (Y^,Y2, ..., Y^) = entradas
el problema se reduce a calculer una raiz o raices p* de la ecuaciôn f(p) = 0# Si el célculo se repite, en el sen tido de calculer las raices p* * que minimizarân la fun - ciôn (f(p)) = 0, el problema se habrâ convertido en unotlpico de optimaciôn.
Analogamente, las ecuaciones diferen - ciales representativas de los sistemas distribuldos, pue den ser tratados por métodos numéricos como el de Euler, el método de Runge—Kutta y otros (6l) (62) (63) , sinolvidar los métodos analôgicos propuestos por Smith and

285
Wood (64) y Korn and Korn (65),En segundo lugar y en el caso de mode-
los fîsico-matemâticos muy complejos sin posibilidad de simplificaciôn, situaciôn frecuente en la mayoria de las aplicaciones prâcticas, el modelo puede ser utilizado pa ra generar un modelo emplrico—experimental por aplicaciôn de técnicas numéricas adecuadas en mâquinas computadoras de velocidad de câlculo elevada.
El modelo emplrico-experimental solo go drâ establecerse si se dispone de una instalaciôn real. Surge del planteamiento y desarrollo de una determinada experimentaciôn sobre el sistema. En este caso, a dife - rencia de los modelos fIsico-matemâticos, no se requiere el planteamiento de ecuaciones, sino que unicamente es necesario définir los campos de variacién de las entra — das para los que las respuestas del sistema puedan ser obtenidas por via experimental. La posterior selecciôn de las salidas conducirâ a la obtenciôn de las que, como mâs significatives definan la funciôn objetivo, que por aplicaciôn de las técnicas numéricas adecuadas proporci^ narâ la soluciôn ôptima del problema#
Con la utilizaciôn de un modelo emplrj. co-experimental, el conocimiento del sistema viene limi- tado a una serie de datos dispuestos mâs o menos acerta— damente en una tabla. Séria pues de gran utilidad, repre^ sentar estos datos y por consiguiente el propio sistema, por una aproximaciôn analitica de suficiente exactitud co

284
mo para ser usada en la optimaciôn del problema en vez de optimar con experimentos realizados sobre el sistema mismo . En la mayoria de los casos, la expresiôn matemâtica proporcionarâ aproximaciones a las respuestas observadas# pero la representaciôn sôlo serà vâlida para su empleo en la optimaciôn, si la aproximaciôn es de suficiente cali - dad como para conservar las caracteristicas esenciales de la respuesta del sistema#
En el ajuste de una cierta serie de datos expérimentales a una funciôn de aproximaciôn, cabe con siderar dos cuestiones de primordial importancia. ^Qué for ma matemâtica es la mâs adecuada para una determinada serie de datos? ^Qué problemas surgen cuando estos datos es tân afectados de error experimental?.
La ecuaciôn que liga las respuestas con las entradas se representarâ por una funciôn del tipo :
P “ p(Y) = P^Yj ,Y*j, • • • t Y^)
donde : p - respuestaY^- entrada i
En adelante se adoptarâ la siguiente nomenclatura :
p - valor real de la respuesta del sistema (deduci— ' do p. ej. como valor medio de un gran nûmero de observa - ciones)•
‘p - valor observado para la respuesta (experimental) 2 - valor de la respuesta obtenido de la funciôn de
aproximaciôn (incluirâ el error experimental y el error de la funciôn de aproximaciôn)•

2 8 5
Se han propuesto multitud de formas pa ra la funciôn de aproximaciôn, pero los desarrollos poli- nômicos, ademâs de proporcionar aproximaciones tan adecua das como las demâs, prèsentan grandes ventajas en cuanto a su simplicidad para el anâlisis por computadores y tratamiento estadlstico*
En su forma general, un desarrollo po- linômico # podrla representarse por :
p(Ÿ) = ♦ B^Yg * ... * B^Y^ +
«11^1 * »12V2 * • •• ^
* Bll2^î^2 * ••• * *• • • ’ # # • • • •
El problema reside en conocer el nûmero minimo de experimentos necesarios para calculer los cqe ficientes B del polinomio. Respecte a este punto y dependiendo de la experimentaciôn de que se pueda disponer, c^ be plantear las siguientes consideraciones :
- Si no existe error experimental y la funciôn de aproximaciôn elegida (p. ej. un desarrollo polinômico como el de la ecuaciôn es del mismo grado que la ecuaci&ide transformaciôn verdadera, por supuesto desconocida, con realizar el mismo nûmero de experimentos que parâmbtros tenga la funciôn de aproximaciôn, el problema queda re -
# Nota : En lo que sigue, el grado del polinomio se definirâ por el del mayor tôrmino.

286
suelto.Maternâtleamente se puede demostrar que en
estas condiciones, el nûmero minimo de experimentos a rea lizar para estimar todos los coeficientes B de un desarro^ llo polinômico, en funciôn del nûmero de variables (n) y del grado del mismo, son los indicados en la tabla.
nQ de variables Grado del desarrollo polinômico1 2 3 4
2 3 6 10 153 4 10 20 354 5 15 35 70
5 6 21 56 126
- Por el contrario, si existe error experimental, con este nûmero de experimentos se obtendrâ una aproximaciôn muy pobre.
- Por ûltimo, si existen mâs experimentos que parâ metros, baya o no error experimental, situaciôn que en principio siempre es alcanzable, surge el problema de de- cidir qué experimentos han de ser utilizados para determ^ nar los parâmetros. Sin embargo, esta circunstancia en vez de constituir un problema, puede ser aprovechpda ventajo- samente de la siguiente manera :
Elegido para la funciôn de aproximaciôn, un desarrollo polinômico representado de forma general por la ecuaciôn :

287
P - p(YjB) = p(Yj , Yg, Yj, ••• Y^, ••• B^) %
donde : s * 1 = nQ de coeficientes a determinarr = nQ de experimentos realizados
y siendo evidentemente r > s
Se puede définir un error residual, como diferencia entre el valor observado de la respuesta p* (valor experimental) y el valor deducido de la ecuaciôn de aproximaciôn p de la forma siguiente :
Error residual del éxperimento j-ôsimo:
Rj = Pj - p(Ÿj, B) 8
Este error residual (o simplemente residual) incluirâ tanto el error experimental, como las desviaciones de la funciôn de aproximaciôn.
Dado que estos residuales pueden ser po sitivos, negatives o cero, solo podrân considerarse si- multaneamente si se consigne que todos contribuyan de forma positiva al error residual total del sistema. En cualquier texto sobre teoria de errores, se incluye un gran nûmero de posibilidades de que esta condiciôn sea cumplida, por ejemplo sumando los valores absolûtes de todos los residuales, sus cuàdrados etc.
Procediendo de esta manera, el error r^ sidual total vendrîa dado por :
" ■ P ^ >

288
o bien E =) 10k l J -
Por motives estadisticos, es mâs util la segunda forma propuesta y en lo que sigue se harâ unicamente referencia a ella.
Es obvie, que los coeficientes B han de ser calculados de forma tal que hagan minimo el error r^ sidual total, condiciôn que matamâticamente se puede ex- presar por :
® ® = o k = O, 1 , 2, 3 , .... B 11a=k
Asi, para un desarrollo polinômico de pr^ mer orden en una dimensiôn, es decir, para una funciôn go linômica de una sola variable y de primer orden, re - presentada por :
p = Bo * 12
o bien, para obtener una mayor simetria en cuanto a la funciôn polinômica, por :
donde Y = 1 o
lerâ :El error residual del j-ôsimo expérimente

2S9
*j - p(Tij) 11
o slmplemente Rj = p - p a
Si se han realizado r experimentos :
= - Pij=l ^14
y de acuerdo con la ecuaciôn :
E = - B„Y„. - =
% n Vo, -
- il
Imponiendo ahora la condic±6n dada per laecuaciôn 11 :
a E „„■ “ « R " ! ■ ■ "
16
# = - ^ E V i j - = °® “l j=l j=l j=l
que simplificadamente podrla expresarse como :
<00*0 * <01*1 = »o
^10*0 * ‘=11®! = ®111

290
rdonde C.^ = ^ki
18
- ê V i i
Generalizando para un desarrollo polinômico de primer orden en n dimensiones (n variables)
p ÎS. a1=0
2 r n1 4 .
<00*0 * Col»l * ‘=o2®2 * •••• «=on®n = ®o
Clo®o * ‘=11®1 * *=12®2 * •••• ‘ In^n ° ®1
i Z a
‘=no®o * ‘ nl®! * ‘=n2®2 * --- ‘=im®n " ®n
O bien ; ) = 0 ^ i = 0, 1, ... , n 19
Todavîa se pueden presenter en la practice situaciones mâs ventajosas, en cuanto a la détermina - ciôn de los coeficientes por el procedimiento descri-to, que no es sino un ajuste de resultados expérimentales a une funciôn polinômica por un mêtodo de minimos cuadra-dos (-5-S. = 0 k = 0, 1, 2, ••• s) •
®®i

291
a.- Si en el tratamiento de un sistema,se conoce una respuesta para un juego determinado de entradas (séria el caso de un sistema que proporcionase una respuesta nula pa ra un juego de entrada, asi mismo nulas) o bien si por ex^ gencias de cierto nûmero de aplicaciones numéricas, el si^ tema se ve forzado a tener una respuesta determinada en un punto (juego de valores de las entradas), éste se puede e^ tablecer como base de c&lculo u origen de disefio de la si. guiente manera :
p “ ®o V i i i k <Yo =1=0 i=0
En el punto base se cumplirâ, segdn lo ant^rior que :
p = î con lo que = B B^Y. 20_o o o o i io —
'Po Si• i=l
Se ha perdido pues un grado de libertad y la ecuaciôn 1^ b se convierte en :
nP ='?o (Yi - Yio> ils.
con lo que solo hay que estimar n coeficientes en lugar de los n * 1 primitivos*
Si por otro lado se define :
A 3 = 'p - P* S2.

292
para el punto j se tendrâ ;
A p j = "Pj - p* 22
y por tanto, el error residual del sistema en el punto j quedarâ segûn la ecuaciôn 1^ :
= P j - P j = ^ P j - p j i l s
donde A P j = Pj - P* ^
y por la ecuaciôn 20 :
A p j = p j - "Po S2 a
Por an&logo tratamiento al realizado,entre las ecuaciones a y 1^, el sistema para determinar los coeficientes por minimos cuadrados quedarô en la forma:
. _IL__ __y ilc lc ~ ^i ^ — 1 # 2, ••• n 26
->■ - r c h . n ' i s " l urik =E*ij*kjdonde ^
J:r ^ 22
r::
Los t^es sistemps de eçpaciones 12$ i£ Y Sé. permiten pues evaluar los coeficientes B^ por minimos cuadrados , si bien el sistema de ecuaciones 2^ gracias a la

293
adopciôn de un punto base inicial, ha de estimar unicamen te n coeficientes en vez de los n * 1 de los otros dos s^ temas.
b#- A veces, es conveniente, con fines estadisti - COS, planificar de antemano la localizaciôn de los exper^ mentos# Pues bien, si la localizaciôn de los puntos expérimentales es tal que :
= 0 para i k
el sistema de ecuaciones 26 se convertir^ en :
k = 1,2,3$ ••• n ' " 26 a
y los coeficientes B^ podrôn ser evaluados inmediatamente segûn : _
Dk®k S2
kk
Un diseho.que tenga esta singular propie - dad, se denomina ORTOGONAL y sus ventajas en cuanto a la determinaciôn de los B^ por minimos cuadrados resultan evi dentes*
Puede resultar ilustrativo como ejemplo, el diseho ortogonal proporcionado por los vértices de un cua- drado regular en un especio de dos dimensiones#

2 94
Punto Coordenadasbase (?lo' ?2o)1 (Tll' ?2l)2 (Yl2. ^22*3 (?!,' ^23)4 (?14' ^24>
Experimento
3
Localizaciôn
■2j1 *11 = ^11 - ^10 = a *21 = ^21 - Y20 = ®2 *12 = ^12 " ^10 = a *22 = Y22 - Y203 " 13 = ^13 - ^10 =- a *23 = = 23 - ^2o4 *14 = ^14 - ^10 =- a *24 = Yg4 - Ygo = a
^12 - ""ij ^2j “ a2 . «2 4 «2 _ = 0 =
• Se comprende facilmente, que si el disenoexperimental no se ha planteado "a priori”, los coeficim tes habrân de ser calculados a partir de un sistema de ecuaciones como el 1^, pues en general no se cumplirân las condiciones indicadas en los apartados a o b.
Davies en su obra "The Design and Analysis of Industrial Experiments” (1956) efectûa una amplia dis cusiôn de distintos tipos ortogonales para sistemas con un gran numéro de variables.
Con objeto de simplificar la presentaciôn de un gran numéro de disenos basados en modelos empiri-

295
co-experimentales, el concepto de coordenada se cambia
por el de coordenada relative, de la forma :
apareciendo el concepto de nivel para la variable Y^, donde es la escala, referida al origen del diseno o punto base que tiene las mismas dimensiones que lavariable i a que se refiere. Hasta ahora, y en el conce^ to de coordenada relative empleado, la unidad de escala se ha aceptado impllcitamente como la unidad, es decir,
= 1. En lo que sigue, la ecuaciôn 22. permitirâ expr£ sar el diseno en terminos de localizaciones experiments les adimensionales, dando asi generalidad a las matrices o tablas de diseno que se empleen para describir la re- giôn experimental.
Como ejemplo del concepto de nivel, se puede hacer referenda a un sistema experimental que pro porcionarô datos vàlidos en un intervalo de temperatu - ras comprendido entre 100 y 3000C. El nivel de diseno em_ pleado podrla ser p.ej. :
V T - 200 X s 100
donde la unidad de escala es S = lOOOC y el nivel de va riaciôn de la regiôn experimental respecte a la temperature estarâ constituldo por los siguientes valores de X:
X^ = -1 Xg = 0 y Xg = 1

296
que corresponderân a unos valores respectives de temperature de :
= lOOûC Tg = 200QC y = 300QC
9.6.5. METODO DE OPTIMACION DE BOX-WILSON
De entre los métodos numéricos empleados en la investigaciôn operative para la determinaciôn de cond^ ciones ôptimas, cabe considérer dos grandes grupos :
1.- Métodos basados en la determinaciôn exclusive de las condiciones ôptimas.
2.- Métodos cuyo objetivo, adem&s de la determinaciôn de las condiciones ôptimas, es el estudio (anàlisis) de la influencia de las variables sobre la respuesta.
* De unos y otros cabe mencionar como més presentativos los siguientes :
1.- a. Método de variaciôn de un factor (6?)b. Método de disenos simplex (68)
i. Modificaciôn de Nelder-Nead (69) ii. Modificaciôn de Box (70) )?l)
c. Método de optimaciôn aleatoria (71)
2.- a. Anâlisis de variables cuando su nûmero eselevado.
b. Movimiento hacia el ôptimo por la linea de maxima pendiente (72)

297
El método de Box-Wilson para la détermina ciôn de las condiciones ôptimas se puede encuadrar en el apartado 2*b y présenta la ventaja de conseguir la méxi- ma informaciôn con el minimo nûmero de experimentos.
El método esté basado en la realizaciôn de las siguientes etapas :
1.- Planteamiento de la experimentaciôn o diseno experimental alrededor de un punto inicial.
2.- Ajuste de una superficie de respuesta a la sub regiôn estudiada.
3.- Desplazamiento de las condiciones operatives en direcciôn al ôptimo•
4.- Diseno experimental en esta subregiôn ôptima.
3.- Ajuste de una superficie de respuesta en estasubregiôn ôptima.
#6.- Interpretaciôn de la superficie de respuesta
en esta subregiôn ôptima.
a .- Planteamiento de la experimentaciôn o disenoexperimental alrededor de un punto inicial.
■
Las condiciones necesarias para que un d^ seno expérimental sea de interés prûctico pueden resumir se de la^forma siguiente :
1.- El diseno debe permitir una aproxiqmciôn pol^ nomial de grado d de suficiente calidad como para conser

298
var las caracteristicas esenciales de la respuesta del sistema en la regiôn de estudio.
2.- Debe permitir la realizaciôn de pruebas de s^ nificaciôn sobre el polinomio.
3.- No debe contener un nûmero excesivo de puntos expérimentales.
4.- Debe poder subdividirse en bloques mûs elementales.
3.- Debe contener un nûcleo, sobre el cual pueda construirse un diseno de orden d l l si el polinomio de orden d no résulta satisfactorio. De todas formas, en las aplicaciones prûcticas referentes a la optimaciôn, el diseno solo es viable si es de primero o segundo orden.
Por otra parte, el diseno elegido para terminar el polinomio de orden d puede cumplir con las siguientes condiciones :
i.- Diseno ortogonal (73) (?4) (73) (76) (77) #que como se ha visto, permite determinar directa y sepa radamente los coeficientes B del desarrollo polinômico y estadlsticamente con la minima varianza (75) (76).
ii.- Disenos rotatorios, en los que la informaciôn se estima con varianza constante en todos los puntos equi distantes del origen del diseno. De esta manera, los con toz*no8 de equivarianza son circunferencias, esferas o h^ peresferas centradas en el origen del diseno para 2, 3 6

299
n dimensiones rçspectivamente (75)*Matemâticamente, la ortogonalidad de un d^
seno solo es cierta en una orientaciôn particular y por tanto esta condici&n puede imponerse de antememo sobre la rotabilidad, de modo que un diseno rotatorio sea simulta- neamente ortogonal.
La importante generalizaci&n que compor - tan los disenos factoriales compuestos, propuestos por Box y Wilson (78) los cuales permiten operar en todos los e^ pacios n-dimensionales cumpliendo con las condiciones de car&cter pr&ctico, anteriormente expuestas, h$ce que estes sean la base usual para la determinaciôn de la superficie de respuesta en el método que lleva su nombre.
Los objetivos del estudio de optimaciôn que nos ocupa, hacen aconsejable referirse en lo que sigue , unicamente a los disenos de orden 1, pudiéndose encontrar ampliamente analizados todos los demés, en los trabajosya mencionados (73) (74) (75) (76) (77) (78).
'r —■ ■— Disenos de orden uno.
Los vértices de las siguientes figuras regular es en los espacios n-dimensionales, proporcionan las coordenadas de los disenos de orden uno ortogonales y rotatorios. Estas coordenadas se hallan a su ve* inscrites en la circunferencia, esfera o hiperesfera,de ecuaciôn :
i=lX? =/>^ = n 22

300
I - Espacio bidimensional (n = 2)- Triângulo con ires puntos expérimentales de
coordenadas (0, a) (4>b, -c)- Cuadrado con cuatro puntos expérimentales de
coordenadas (4*1, 4-1)- Pentâgono con cinco puntos expérimentales de
coordenadas (O, a) (Jd, e) (^f, -g)- Hexégono con seis puntos expérimentales de
coordenadas (O, *a) (4>b, 4c)- et c •
siendo : a = 1.4l4, b = 1,225, c = 0,707, d = 1#345e = 0.457, f = 0.831, g = 1.145
pudiéndose ademés anadir puntos centrales, de coordenadas (0, 0).
II - Espacio tridimensional (n = 3)- Tetraedro con cuatro puntos expérimentales de
coordenadas (-1, -1, l) (1, -1, -1,) (-1, 1, -1) (1, 1, 1)
- Octaedro con seis puntos expérimentales decoordenadas ( 4 O, 0,) (O, 4 *3*, 0) (0, O,tMT)
- Hexaedro con ocho puntos expérimentales decoordenadas (41, 41, 41)
- Icosaedro con doce puntos expérimentales de coordenadas (0, 4a, 4b) (4b, O, 4a) (4a, 4b, 0)

3°1
— Dodecaedro con veinte puntos expérimentales de coordenadas (0, 4c"^# 4c) (4c, 0, 4c"^) (4c"^, 4c, O) (41, 41, 41)
siendo : a = 1.473 ; b = 0.911 c = I.618
pudiéndose ademés anadir puntos centrales de coordenadas (0, 0, 0)
III - ,Espacios n-dimensionales (n 4)Solamente existen tres figuras regulares :
- Anélogo al tetraedro con n 4 1 puntos expérimentales.
- Anélogo al octaedro con 2n puntos experimen tales.
- Anélogo al hexahedro con 2^ puntos experi - mentales.
En el espacio de 4 dimensiones existen ad^ més, figuras con 24, 120 y 6OO puntos expérimentales.
Todos los disenos mencionados son rotato - rios y ortogonales de orden uno, si bien el triéngulo, el tetraedro y su anélogo en n-dimensiones, formados todos ellos por n 4 1 puntos expérimentales, contienen el nûmero minimo de puntos para estimar los n 4 1 coeficientes del desarrollo polinômico, por lo que no permiten reali - zar prueba alguna sobre la significaciôn del mismo. Estos disenos son la base del método Simplex de optimaciôn ya mèneionado.
De los restantes disenos indicados, cabe

302
mencionar que el cuadrado, el hexaedro y su anélogo en n dimensiones, son disenos factoriales de los indicados «m teriormente (78) .
b#- Ajuste de una superficie de respuesta a la sub regiôn estudiada.
Se exponen a continuaciôn los procedimien — tos de estimaciôn de coeficientes y el anélisis de varian za de la funciôn de aproximaciôn polinômica de primer or den considerada.
Sea la funciôn :
p G,h) = * BjXj + BgXg * --- ^
donde x = nivel de la i-ésima variable (Y)p ss respuesta proporcionada por la funciôn de aptp
ximaciôn.
Teniendo en cuenta que el desarrollo mate- mético del mêtodo de minimos cuadrados, en el que por sen cillez de expresiôn se emplearé b^ para indicar el coef^ ciente i-êsimo estimado por este procedimiento, conduce a la resoluciôn de un sistema de ecuaciones, como el ya in- dicado en la ecuaciôn 2ô :
* ®2‘=12 * •••• '*n‘=ln “® l ‘=21 ^ 2 ^ 2 2 * ' ®n‘ =2n ” ®2
* ®2fn2 * '
26 b

305
donde : Cik “ *ij*k,ij^Pj
por cnmplirse la condlciôn de ortogonalidad segûn :
^ik ® ^ki “ ® i / jr r_ ^
y Z-^*ij ® ' qtie implica que ^ ^ * ijPq * ®
la ecuaciôn 2Ô quedaré en la forma :
kk
Determinados los coeficientes, se procédé al anélisis de varianza, en el que la media cuadrética re sidual seré una estimaciôn de la media cuadrética del errorsolo en el caso de que la relaciôn polinomial supuesta sea
!
totalmente cierta. Si no fuera asi, la media cuadrética n sidual incluirla ademés del error experimental, la desvia ciôn del modelo propuesto respecto a la verdadera superfj^ de respuesta.
Respecte a la determinaciôn de la varianza del error experimental, pueden darse dos situaciones distintas :
1.- Que la varianza del error experimental (T del sistema se conozca a partir de un nûmero elevado de expe-

3 0 4
rimentos previos. En este caso, se reallza un test comparative de F ( 6 6 ) entre la media cuadrética residual con r - (n 4 1 ) grades de libertad y la varianza del error QT con infinités grades de libertad.
Si la varianza residual es significativa - mente mener que la varianza del error, a un nivel dado de probabilidad, puede aceptarse que las desviaciones del m_o delo propuesto respecte a la verdadera superficie de respuesta, son ûnicamente debidas a este errer experimental. En caso contrario, el modelo propuesto no represents la verdadera superficie de respuesta.
2 .— Que la varianza del error experimental sea des, conocida.
En este caso, la estimaciôn del error exp^ rimental se realiza en el propio diseno, por replicaciôn de p puntos del mismo n^ veces cada uno, en condiciones taies que la ortogonalidad no se pierda.
Se tendré pues, que la media cuadrética del error vendré dada por :
= ï z
evaluéndose con p(n^ - l) los grados de libertad.
Esta suma de cuadrados, debida al error, se desglosa de la residual con lo que se obtiene la me - dis cuadrética del desajuste con r - (n - 1 ) - p(n^ - l) grados de libertad, debido unicamente al error del poli-

305
nomlo (desajuste).Realizando un test de F en las mismas con
diciones anteriores,entre la media cuadrética del desa - juste y la media cuadrética del error, si se comprueba a un nivel dado de probabilidad, que la media cuadrética del desajuste es menor que la del error, el desarrollo go linômico se puede considerar representative de la verdadera superficie de respuesta.
En ambos casos s in embargo, si se comprue^ ba que el desarrollo polinômico de primer orden es carrée to, debe realizarse un test de F entre las médias cuadr^ ticas de cada coeficiente y la del error para comprobar si todos son o no significativos.
Resumiendo : si la ecuaciôn es globalmen- te no significative, debe ensayarse un modelo de orden m perior. Si la ecuaciôn es globalmente significative pero algûn coeficiente muestra ser no significative, hay que comprobar si el sistema es de hecho independiente del fa^ tor o por ser desproporcionadamente pequeha la unidad de cambio de este,no se muestra claramente su influencia. En tal caso, debe ampliarse su campo de variaciôn y compro- barse si el sistema sigue siendo independiente, en cuyo caso se élasifica el factor como no significative y se excluye del desarrollo polinômico.
Finalmente, si el desarrollo polinômico y los coeficientes son significativos, se continua el estu dio de optimaciôn por la siguiente etapa.

306
La tabla 9# 17 indica mateméticamente, la discusiôn que sobre el anélisis de varianza se ha reali— zado.
c Desplazamiento de las condiciones operativesen direcciôn al ôptimo.
Aceptando que dentro de la regiôn estudia da, las derivadas de la funciôn de respuesta obtenida son continuas, se pretende pasar del punto inicial de seno, o en el espacio n-dimensional al punto P, distante de 0 en una magnitud r, punto en el que la ganancia d respuesta es méxima. En P l a r^'^pnosta es (7 8) ;
F (P) = F ( , Xg, ... x^) 2 2
Puesto que DP es igual a r, se tiene laecuaciôp ;
a ^ 2r- = > xT 2Ï1 =
correspondiente a la ecuaciôn de una esfera o hiperesfe ra (segûn n),de radio r en el espacio n-dimensional siê^ do P un punto de la misma.
Puesto que se requiere que F(P) - F(0 ) sea méximo, cumpliêndose la condiciôn anterior, se cons truye la funciôn :
W = F (p) - F (0) - 1/2 y* E * î 11

o\
I
0§d0>< •dN u
5 0H Q)5 •d> 090)iHQ (8
dW 0H bOW 0H -P•J k< 0§ 09
0!dQ)(Q•HÛ
<8O•H+>
■è(8Po(8•H•OX
•d(8•ps•HH0)•o«
I
mo•o(8
§ow*0
CO
d»o•d •H
0(8 (809 •Hd k(8 <8O >
W
- A
(8+»H
n%(8
§0Q)•d
1
Q)•Ps•H•d§&Q)
§O
N•o
&
AwA
%I
H
d
Ih
dA
CM•o
,‘V- W i•o
CM *HH
-UI
•o CM *H" hk IIIu
is lS l
&
CM
ipT
" L E
uM
dAI
IAUQ
0)c8 • H •P• (8 (A(8 •H • d k d*d .0 CM "d 0 •n•H » •H k (8.0 09 H 09 k 098) 0 II 0 A oQ H •H A Q

308
usando el método de multiplicadores indeterminados de Lagrange, para la localizaciôn de mâximos condicionados• El mâximo requiere que todas las derivadas parciales de W respecte a x^ sean cero y por tanto se halla en el pun to en el que se satisfacen las n ecuaciones
yUX^ = F^(P) i = 1,2 ... n 2§
en donde F^ (P) représenta la derivada parcial de F respecte a la variable x^ en el punto P.
A partir de las ecuaciones 2^ y 2É*obtiene que :
/*
Estas ecuaciones establecen que el punto P situado a una distancia r de 0, tendré un aumento méx^ mo de rqspuesta y por consiguiente segûn la ecuaciôn 2É sus coordenadas son proporcionales a las primeras dériva das de F(P) en P, siempre, claro esté, que al menos una de ellas sea distinta de cero.
El sistema de ecuaciones 3ô détermina asi la linea de mayor pendiente que pasa por el punto O. El punto P es eiitonces la intersecciôn de esta linea con la esfera o hiperesfera de radio r segûn la longitud de avan ce deseada, tal como se représenta en la figura 9*19*
Cuando la superficie ajustada es de or -den uno segûn :

309p . * bi*! * bgXg * "... * 21
la ecuaciôn de la linea de ascenso es una recta en el es, pacio n-dimensional, cuyas ecuaciones en forma paramôtri ca son 8
is l , 2 , ... n 22
Entonces y dado que el radio del diseno es si se desea pasar desde el origen a un punto si.tuado a una distancia s VzT en donde s > 1, el valor deyu. seré segûn la ecuaciôn 2Z
permitiendo resolver el sistema de ecuaciones 22 Y ha -llar las coordenadas de P#
El signo deyu détermina el sentido delvector OP, mientras que las ecuaciones 22 su dir^cciôn. Este signo se détermina facilmente por observaciôn de las respuestas del diseno, de tal forma que el signo adecuado corresponde a los de las variables con respuejs ta més elevada. Aumentando s sucesivamente, se fijan nuje vos valores deyu y se hallan las coordenadas de puntos P més lejanos y con respuestas progresivamente majores.
Dado que el desarrollo polinômico ajust^ do es vûlido solamente en el çntomo del diseno, la apl^ caciôn de este método supone realizar extrapolaciones su cesivas, de tal modo que a una distancia s \/n, la ecua -

310
ciôn de ascenso 22. ûejarâ de ser vélida segûn la figura 9,11 pues se llegaré a un punto i en el que se cumpla que
Pi-i< p±> Pi*i 40
En este memento, es necesario realizar un nuevo diseno experimental, eligiendo este punto i de mejor respuesta como origen del mismo,
d Diseno experimental en la subregiôn ôptima#
Repitiendo el procedimiento descrito en los apartados ( b ) y ( c ) se puede llegar a determinar un punto 0* en el que la respuesta sea de la suficiente calidad como para esperar pequenas majoras adicionales por repeticiôn de las etapas indicadas.
Este punto 0* constituirû définitivamen te el origen del diseno en la subregiôn que ^e acepta como ôptima y sobre él se repetirû el procedimiento des, crito en el apartado ( a ) con lo que se obtendrû el diseno experimental sobre el que realizar la interpréta ciôn de la superficie de respuesta#
e •- Interpretaciôn de la superficie de respuesta en la subregiôn ôptima,
Aunque la interpretaciôn de las süperfi. cies de segundo orden es prûcticamente imposible por la

p,<p«< ■••<?. ,<p.>p.p. origan del nuevo diseRo
Y,FIGURA 9.11

312
sola inspecciôn de los coeficientes, si la ecuaciôn se duce a su forma can&nica, es decir, realizando una trans- laci&n y rotaciôn de ejes, de forma que el nuevo origen de coordenadas sea el centre del diseno, el anôlisis de la misma résulta sumamente sencillo (78)#
De todas formas y para superficies de pr^ mer orden, el anâlisis de fiabilidad del polinomio y la simple observaciôn del mismo, pueden resultar suficientes para la mayorla de los estudios de optimaciôn de interés préctico. Este anélisis de fiabilidad, ha sido ya indica- do en el apartado ( b ).

NOMENCLATURA
A^ Atenuaciôn de medlda del plco cromatogrAfIco delcompuesto %#
Ag^ Atenuaciôn del calibrado cromatogr&fico del com - puesto X.
At^ Atenuaciôn de medida del pico cromatogrAfico delcompuesto x.
b Constante de equilibrio de la reacciôn elementalXde adsorciôn del compuesto x*
C Conversiôn; Simbolo abreviado del cloroConcentraciôn de centres actives libres Concentraciôn de components x adsorbido
CC Diôxido de carboneCl Simbolo abreviado del dorure de metiloC2 Simbplo abreviado del dorure de metilenoC3 Simbplo abreviado del cloroformeC4 Simbolo abreviado del tetracloruro de carboneCO Simbolo abreviado del metanoCl C Representaciôn simbôlica de los dorometanosX/\hm^ Altura manométrica correspondiente al diafragmai m^
didor del gas x#

314
AP Presiôn de alimentaciôn de productos al cromat6gra- fo de gasesEscala de medida del pico cromatogrâfico del compue^ to X
Eg^ Escala del callbrado cromatogrâfico del compuesto xem^ Anchura del pico cromatogrâfico del compuesto x en
la semialtura (media de cuatro inyecciones)H Simbolo abreviado del cloruro de hidrôgenoHm^ Altura del pico cromatogfâfico del compuesto x (me
dia de cuatro inyecciones K Constante de equilibrio de una reacciôn global
Constante de equilibrio de una reacciôn superficial (elemental)
L Concentracion total de centres activesM Masa de catalizador
Masa molecular del compuesto x M/Al Masa de catalizador/(moles gramos de aire alimenta-
do/hora)M/A2 Masa de catalizador/(moles gramos de metano allmen-
tado/hora)Nûmero de moles del compuesto x Rendimiento del compuesto x Caudal molar del compuesto x Caudal molar total
02 Simbolo abreviado del oxlgenoPa Presiôn atmosféricaPx Presiôn pârcial del componente x

315
Ppd^ Presiôn a la salida del diafragma medidor del gas x Q Porcentaje de metano quemadoQv Caudal volumêtrico de la mezcal gaseosa efluente del
reactor en condiciones ambientalesEscala de medida del pico cromatogrâfico del compues^ to X
r^ Velocidad de la reacciôn i (rendimiento)r^^ Velocidad neta de apariciôn del componente Ci (ren
dimiento)r' Velocidad de reacciôn en funciôn de las presiones
parcialesRml Relaciôn molar cloruro de hidrôgeno/aireRm2 Relaciôn molar cloruro de hidrôgeno/metanoS SelectividadSm^ Area media del pico cromatogrâfico del compuesto xSmg^ Area media corregida a las condiciones del calibra-
d*ot Temperatura (oC)T Temperatura (QK)ta Temperatura ambientetpd^ Temperatura a la salida del diafragma medidor del
gas X
tv Temperatura de los productos efluentes del cromatfgrafo
0 Tiempo de reacciônW Simbolo abreviado del aguaXçj Grado de cloraciôn


BIBLIoèRAFIA( I
(1) Fleurke, K.H., Chem. Eng. March, CE 4l (I968)(2) Qusmt, J.T., van Dam, Engel, W.F. and Wattime -
na, F., Chem. Engr. Lo$d. (1963), No. I70, p.CE 224
(1963)(3) Sconce, J.S.,"Chlorine : Its Manufacture, Properties
and Uses" (19^2) Reinhold. Pub. Co. N.Y.(4 ) Deacon, H.W., Chea. NeVrs, 2 2 , 157 (I87O)(5) Deacon, H.W., British Patent l403 (1863)(6 ) Deacon, H.W., U.S. Pat| 8 5 .3 7 0 (I868)(7) Charles N, Arnold and Renneth A. Kobe., Chem. Eng.
Prog. No.6 , p.293 (1952)(8) U.*S. Pat. 2602021 (1952)
Ger. Pat. 8 5 7 6 3 3 (1952)
'* " 873688 (1953)" " 873689 (1953)
(9) U.S. Pat. 2577808 (1951)(1 0) Engel, W.F., Vaole, M.j. y Muller, S., Chem. and Ind,
Jan. 13,76 (1962)(11) Ruthven, D.M. y Kenney, C.N., Chem. Eng. Sci.2 3 ,981
(1968)(1 2) Beretta, G., La Chim. ^ L'Ind. 49 N.7,737 (I967)(13) Jellinek, K., Rudat, , T. anorg. all gem. Chem.1 5 5,

318
(14) Rideal, S.K., Taylor, H.S., "Catalysis in Theory and practice" Mac Millan, Londra (1926)
(15) Korvesee, A.K., Rec.Trav.Chim, ,505 (1931)(16) Choporov, P.Y., Chem. Ind. (USSR) 2,80 (1958)(17) Brev. Germ. 487596 (1919)(18) Brev. Germ. 486952 (1922)(19) Brev. Germ. 430539 (1926)(20) C.S.I.C. Madrid (1973)(21) U.S. Pat. 3010913 (1957)
U.S. Pat. 2752402 (1956)(22) Brit. Pat. I8627O (1921)
Ger. Pat. 486952 (1922)U.S. Pat. 2674633 (1954)
(23) Meissner, H.P. y Thode, E.E., Ind. Eng. Chem., 43,p.129 (1951)
(24) Everett Gorin, C.M. Fontana and Kidder, G.A., Ind. E^g. Chem. W No.11 p.2128 (1948)
(25) Caprara, G., Montorsi, G., Lo Vetere, G., La Chim. e L'Ind. ^ No.2 p.200 (I968)
(26) Kovacicf P. y Lange, R.M., J. Org. Chem. ^O, p.4251 (1965)
(27) Corriu, R. y Coste, C., Tetrahedron 2^, p.4949(1969)
(28) Chlpr, G.K. y Grossert\ J.S., Canad. J . of Chem. 50,No.8, p.1233 (1972)Kovacicf P* y Sparks, A.K., J. Am. Chem. Sq c»82,p. 5740 (1960)

319
Castro, C.E., Ganghan, E.J# y Owsley, D.G., J. Org Chem., 30, p.587 (1965)
(29) Koyano, T. y Vatanabe, 0 ., Bull. Chem. Soc. of J a
pon, p. 1378 (1971)(30) Koyano, T., Bull. Chem. Soc. of Japon, p.3501,
(1970)Kovacicff P» y Brace, N.O., J. Am. Chem. Soc, 76, p.3491 (1 9 5 4)
(31) Weisz, P.B., Am. Rev. of Phys. Chem. 2_1 ,1 7 5 (1 9 7 0)(32) Topchiev, A.V., Krentsel, B.A., Doklady Akad, Nan'.
S.S.S.R. 1 1 2, 1 , 73 (1957)(33) Reynolds, M.B., Snyder, N.Y., Brev. USA. 2783281
(1957)(34) Dunn, J.L. Jr., Jackson, L., Brev. USA . 2866830,
(1958)(3 5) Gorin, E., Brev. USA 2 408828 (1 9 4 6)
Socony Vacuum Oil Co, Brev. Brit. 587569 (1 9 4 7) Fontana, C.M., Gorin, E., Brev. USA 2375167 (1 9 5 1) Joseph, W.J., Brev. USA 27324 0 1/2 7 52 4 0* (1 9 5 6) Kilgren, E,W. e coll. Brev. USA 2498552 (1 9 5 0)
(36) Kobe, K.A., Long. E.G., Petroleum Refina 2 9 ,(3 )157 (1950)Perry, J.H. "Chemical Engineers Handbook"
(37) Pease, R.N., Walz, G.F., J. Am. Chem. Soc.5 3 ,3 8 2
(1931)(38) Nenitzescu, C.D., Rev. Chim. (Romania) 4 ,4l (195
(39) Boswell, M.C. and Me Laughlin, R.R.m Am. J.Rese

320
1,240 (1929)(40) Me Bee, E.T., Hass, H. B., Meher, C.M.. and Strick
land, H. Ibid. 34,296 (1942)(41) Mamedaliev, Yu.G., Dementyeva, V.V., Kuliev, A.M.
and Bakhshiev, A.A., J. Aplied Chem. (USSR) 12,1826 (1939)
(42) Mason, J., and Wheeler, T.S. J. Chem. Soc., 2282(1931)
(43) Tizard, H.T., Chapman, P.L. and Taylor, R., Brith. Pat. 214293 (1924)
(4>a) Scipioni, A., Rapisardi, E., La Chimica e L 'Industrie 43, 1 , 1286 (1961)
(43b) Natta, G., Mantica, E., J. Am. Chem. Soc•,?4,3152-3156 (1952)
(44) Kirk, R.E., Othmer, D.F., "Encyclopedia of Chemical Technology", 2» Ed.,N.Y. (1968)
(45) handbook of Chem.-Phys.,Chem.Rubb.Co.,4?Ed.,(1967)(46) La Industria quimica en Espana (1957-1974)(47) Boletin de la comisiôn asesora y de estudios tec -
nicos de la Industria Quimica Espanolq, sobre pre - visi&n de producei6n y consume de productos quimi- cos en Espana, Abril 1975*
(48) Chemical economica handbook, Stanford Research Ins titute, MENLOPARK, CALIFORNIA (1973)
(49) Ifvin-Sas, N . "Dangerous properties of industrial materials", 2ft Ed., Reinh. Pub. Co. N.Y. (I963)
(50) Combititrador 3D (Metroohm) "Manual de Instrccio - nes".

321
(51) Gasc6, S.L., "Teorîa y Prâctica de la Cromatogra - fia en Fase Gaseosa", Ed. J.E.N. (I969)
(52) Merrett, A.J. and A. Sykes, "Capital Budgeting and Company Finance", Longmans, Green and Co., Inc., N.Y. (1966)
(53) Van Krevelen, D.W. and Hoftyzer, P.J., "Process 0£timacion : Principles and Methods". Trans. " Inst. Chem. Eng. (London), 337-344 (I962)
(54) Horn, F.J. M., Uber die optimale Temperatur fUhrungbei kontinuierlichen chemischen Prozessen, Z. Elek trochem, 6^ ; 209 (19&1)
(55) Denbigh, K.G., Optimun Temperature Sequences in reactors, Chem. Eng. Sci., ^ : 025-032 (1958)
(56) Rudd, D.F. and D.F. and Stewart, D.V., "On informa tion Flow and Process Design Calculations" Paper Am. Inst. Chem. ^ng. Natl.
(57) Himmelblau, D.M., "Process Optimacion by Search Techniques", Ind. Eng. Chem. (Process Design Develop.) 2 ; 296-300 (1963)
(58) Sargent, R.W.H. and Westerberg, A.V., "Speed- upin Chemical Engineering Design", Trans. Inst.Chem.Eng. (London), 42 T19Q-T197 (1964)
(59) Lee, W., Christensen, J.H. and Rudd, D.F., "Design Variable Selection to Simplify Process Calcula - tions. Am. Inst.Chem. Eng. J# l^: 1104-1^10 (I966)
(60) Christensen, J.H. and Rudd, D.F., "Structuring Design Computations", Am. Inst. Chem, Eng. J. 15.94-

322
-100 (1969)(61) Lapidus, L., "Digital Computation for Chemical En
gineers". Me Graw-Hill Book Company, N.Y. (I962)(62) Schechter, R.S., "The Variational Method in ^ngi -
neering". Me Graw-Hill Book Company, N.Y. (I967)(63) Kantorovich, L.V. and Krylov, V.I., "Aproximate M^
thods of Higher Analysis". Noordhoff, Erven P., Gro ningen, N.V., Netherlands (1958)
(64) Smith, G.W. and Wood, R.C., "Principles of Analogue Computation". Me Graw-Hill Book Company, N.Y.(1959)
(65) Korn, G.A. and Korn, T.M., "Electronic Analog and Hybrid Computers", 2ft Ed. Me Graw-Hill Book Company, N.Y. (1964)
(66) Davies, O.L., "Métodos Estadisticos". Ed. Aguilar. Madrid (I96O)
(67) Friedman, M. y Savage, L.J., "Selected Techniques of Statistical Analisis", Ed. Me Graw-Hill, N.Y.(1947)
(68) Spendley, W., Hext, G.R. y Himsworth, F.R., Tech -nometrics, jt. No. 4, 44l-6l (1962)
(69) Nelder, J.A. y Nead, R., Computer J., ^ ,No.4, 30&(1963)
(70) Box, M.J., Computer J., No 1, 42 (I965)(71) Umeda, T. e Ichikawa, A., Ind. Eng. Chem. Process
Des. Develop., No, 2, 229 (1971)(72) Domingo Campos, F.J., Tesis Doctoral, Barcelona

323
(1974)(73) Hotelling, H., Ann. Math. Statist., 1^, 297 - 306
(1944)(74) Plackett, R.L, y Burman, J.P., Biometrika, 22,» 305-
325 (1946)(75) Box, G.E.P. y Hunter, J.S., Ann. Math. Statist., 28
No, 1, 195-24 (1957)(76) Box, G.E.P., Biometrika, 22 * 49!57 (1952)(77) Tocher, K.D., Biometrika, 22 » 109-117 (1952)(78) Box, G.E.P. y Wilson, K.B., J. Roy. Statist. Soc.,
Series B, IJ, 1-45 (1951)(79) Langmuir, I., J. Am. Chem# Soc# 2^, 2221 (I9I6)(80) Corrigan, T.E., Chem# Eng# Fundamentals, Me. Graw-
Hill, (1955 y sig.)(81) Puig Adam, P#, Ecuaciones diferenciales, 9^ Ed.,
p. 202, Madrid (I966)(82) Cuenca Sanchez de Castro, Cristina, C.S.I.C.,"Te
sis Doctoral", Madrid (1973)(83) Natta, G#, Mantica, E., Gazz. Chim. Ital# l64
(1951)(84) Natta, G., Mantica, E., J# Am. Chem. Soc. %4, 3152
(1952)