Puerto Ordaz. 1. NÚMEROS CUÁNTICOS 2. ORBITALES ATÓMICOS 3. DISTRIBUCIÓN ELECTRÓNICA.
Números Cuánticos 1
-
Upload
cristianleonarias -
Category
Documents
-
view
12 -
download
0
Transcript of Números Cuánticos 1
-
5/21/2018 N meros Cu nticos 1
1/5
NMEROS CUNTICOSNMEROS CUNTICOS
Qu son los Nmeros Cunticos?
Los nmeros cunticos determinan la regin del espacio-energa de mayor probabilidad para encontrar a un
electrn. El desarrollo de la teora cuntico fue realizado por Planck, a!"ell, #c$rodinger, Pauling, %eisenberg,
Einstein, &e 'roglie y 'oltzmann.
En la mecnica cuntica se re(uieren tres nmeros cunticos para describir la distribucin de los
electrones en el $idrgeno y otros tomos. Estos nmeros se deri)an de la solucin matemtica de la ecuacin de
#c$rodinger para el tomo de $idrogeno. #e denomina nmero cuntico principal, nmero cuntico del momento
angular y nmero cuntico magn*tico. Estos nmeros cunticos se utilizarn para describir orbtales atmicos ypara identificar los electrones (ue se ubican en ellos. +n cuarto nmero cuntico es el espn (ue describe el
comportamiento de un electrn especfico y completa la descripcin de los electrones en los tomos.
Nmeros Cunticos
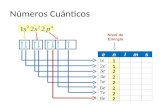
. Nmero Cuntico Principal (n) &etermina el ni)el de energa, la energa del electrn y el tamao
del subni)el matemticamente toma los )alores.
n / , 0 , 1 , 22222 22 34
56e imaginas una cebolla cortada por la mitad7
58u* obser)as7
#e obser)an las capas de la cebolla, cierto. 9 +na cebolla tiene capas. Esto e(ui)ale a los ni)eles de energa. 9 +n tomo tiene capas ni)eles-
0. Nmero Cuntico Secundario (
) &etermina el subni)el de energa, la geometra del mismo: se le
conoce tambi*n como nmero cuntico azimutal de momento magn*tico.
atemticamente toma los )alores
/ ; , , 0 , 2222 3n - 4 22 34
+tilicemos otro ecleo
?tmico @L
>
A
0
1B
C>i)eles
=apas
-
5/21/2018 N meros Cu nticos 1
2/5
?s como un $otel tiene pisos un tomo posee ni)eles.
Los pisos poseen $abitaciones los ni)eles poseen subni)eles.
Nmero Cuntico Subnivel Representacin
/ ; #$arp s/ Principal p
/ 0 &ifuso d
/ 1 Dundamental f
5=mo recordar el orden7
?s s o p a d e f i d e o s , p , d , f
; , , 0 , 1
1. Nmero Cuntico Magntico (m) ndica el orbital reempe
F Fegin
E Energ*tica
E Espacial
&onde se manifiesta
P Probablemente
E El electrn
atemticamente m -, 222 , ; , 222 , G 222 34
n / / ; m / ; 3 orbital4
3s4
/ ; m / ; 3 orbital4
n / 0 / ; ,
/ m / - , ; , G 31 orbitales4
B. Nmero Cuntico de Spin (s) ndica el sentido de giro del electrn en un orbital, a tra)*s del campo
magn*tico.
s
sp
pd s pd f
0
1B
#ubni)eles
>i)eles
G
9 En un orbital pueden
$aber $asta 0 electrones.
-
5/21/2018 N meros Cu nticos 1
3/5
#i imaginamos un orbital lleno con dos electrones.
=omo pueden con)i)ir dos partculas +no girar en un sentido y el otro en el sentido
de carga negati)a si se repelen el*ctricamente contrario generando campos magn*ticos
opuestos norte y sur : y estos se atraen
s / H0
EJEC!C!"S #E $P%!C$C!&N. 5=untos nmeros cunticos magn*ticos
puede $aber en el nmero cuntico secundario
17
a4 B b4 c4 I
d4 C e4 B
0. ar(ue )erdadero 3J4 o falso 3D4 en El nmero cuntico K toma los )alores
de ;, , 0, 1, 2.., n
El )alor de Km determina los subni)eles +n orbital Kd tiene como m!imo ; e-
a4 JJJ b4 DJJ c4 DDJ
d4 DDD e4 DJD
1. 58u* tipo de orbital describe los nmeroscunticos. n / B, / 07
a4 1s b4 1p c4 Bd
d4 1d e4 Bp
B. 5=ul de los siguientes subni)eles tiene ms
energa7
a4 Bf b4 1d c4 Bs
d4 Cs e4 Cp
C. 5Para los subni)eles Bs, 1d, Cp, Bf ordenados
de menor a mayor energa7
a4 1d, Bs, Bf, Cp d4 Bs, 1d, Cp, Bfb4 Bs, Cp, 1d, Bf e4 >.?.
c4 1d, Bs, Cp, Bf
M. 58u* significa la notacin BdC7
a4 =inco orbital Kd incompletos cuyos
nmeros cunticos n / B y / 0.
b4 =inco electrones (ue constituyen 1
orbtales Kd cuando n / Bc4 =uatro orbtales Kd completos
orientados segn cinco )alores de Km
d4 =uatro electrones en los orbtales Kd
cuando Kn es igual a B
e4 >.?.
I. #i n / 1 58u* )alores puede tomar K7
a4 ;, -, -0 b4 ;,, -0 c4 ;, , 0
e- e-
>
#
GH0
-H0
-
5/21/2018 N meros Cu nticos 1
4/5
d4 ,0,1 e4 -1, ; ,1
N. 58u* secuencia de nmeros cunticoscaracteriza a un electrn en orbital f7
a4 B, 1, G, G H0 d4 1, 0, , G H0
b4 B, ;, -, G H0 e4 C, , ;, - H0
c4 B, , -, - H0
O. 5=ul de las siguientes alternati)as es
correcta7
a4 0, 0, -, - H0 d4 0, 1, ;, G H0
b4 , ;, G , - H0 e4 >.?.
c4 1, 0, -1, - H0
;. 5=ul de las siguientes combinaciones no
representa un orbital permitido7. 1 ; H0 J. 0 0-0 - H0
. 0 0 ; G H0 J. C 0 0 G
1H0
. B 1 -B H0
a4 #lo b4 J y J c4 , J y J
d4 , J y J e4 todos
. #i n / 0 58u* )alores tomo el nmerocuntico azimutal7
a4 ,0 b4 ;, c4 ;, , 0
d4 -, -0 e4 -, ;
0. #i / 1 58u* )alores toma Km7
a4 , 0, 1, B d4 ;, , -, -0
b4 ;, , 0, - e4 -1, -0, -, ;, G , G 0, G
1
c4 -1, -0, -, ;, G
1. #i un electrn tiene como nmero cunticoazimutal 0 entonces dic$o electrn se
encuentra en el subni)el.
a4 s b4 p c4 d
d4 f e4 >.?.
B. #i n / C 58u* )alores toma K7
a4 , 0, 1, B d4 ;, , 0, 1, B, C, Mb4 ;, , 0, 1, B, C e4 -, -0, ;, G, G0
c4 ;, , 0, 1, B
C. 5=ul de las siguientes alternati)as es
correcta respecto a los nmeros cunticos7
a4 0, 0, -, -H0 d4 1, 0, B, GH0
b4 , ;, , G, -H0 e4 >.?.
c4 1, 0, -1, -H0
'$E$
. #i / 0 58u* )alores toma Km7
a4 , 0 b4 ;, , 0 c4 -, -0, ; G,
G0
d4 -,;,G e4 >.?.
0. #i n / 1 58u* )alores toma K7
a4 , 0, 1 b4 ;, , 0 c4 ;,, 0,1
d4 G, G0 e4 >.?.
1. 58u* combinaciones energ*ticas para el
electrn corresponde al orbital atmico
e!presado como Cf7
B. 58u* subni)el tiene la mayor energa
relati)a7
a4 Bf b4 Cd c4 Mp
d4 Is e4 iguales
C. =ompletar Kse denomina 22 a la regin del
espacio donde la 22. de encontrar 0
electrones es m!ima
a4 ni)el probabilidad
b4 subni)el probabilidad
c4 orbital probabilidad
d4 orbital certezae4 subni)el - certeza
M. 5=ul de las siguientes pare
-
5/21/2018 N meros Cu nticos 1
5/5
a4 1, 0, -1, GH0 d4 C, B, -0, -
b4 C, 1, -0, -H0 e4 B, 1, -B, GH0
c4 1, 0, ;, GH0