Los Estados de La Materia y Los Cambios Que Sufren
-
Upload
eduar-narvaez -
Category
Documents
-
view
130 -
download
0
Transcript of Los Estados de La Materia y Los Cambios Que Sufren
LOS ESTADOS DE LA MATERIA Y LOS CAMBIOS QUE SUFREN.
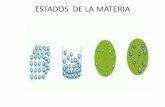
Como ya sabemos la materia se presenta en tres estados o formas de agregacin: slido, lquido y gaseoso. Dadas las condiciones existentes en la superficie terrestre, slo algunas sustancias pueden hallarse de modo natural en los tres estados, tal es el caso del agua. La mayora de sustancias se presentan en un estado concreto. As, los metales o las sustancias que constituyen los minerales se encuentran en estado slido y el oxgeno o el CO2 en estado gaseoso. As, cuando nos referimos a los elementos que se encuentran en estados slidos, destacamos que tienen forma y volumen constantes, se caracterizan por la rigidez y regularidad de sus estructuras. Por el lado de aquellos que permanecen en estados lquidos podemos destacar que no tienen forma fija pero s volumen, La variabilidad de forma y el presentar unas propiedades muy especficas son caractersticos de los lquidos, y por ltimo los gases no tienen forma ni volumen fijos, En ellos es muy caracterstica la gran variacin de volumen que experimentan al cambiar las condiciones de temperatura y presin. Si nos concentramos detalladamente en cada uno de los estados o formas de agregacin de la materia tendremos una visin ms amplia de cmo se comportan y de las caractersticas que presentan cada uno de ellos. Por tal motivo a continuacin detallare de manera ms especfica cada estado con el fin de obtener un mejor entendimiento. Primeramente encontramos el estado slido, el cual se caracterizan por tener forma y volumen constantes. Esto se debe a que las partculas que los forman estn unidas por unas fuerzas de atraccin grandes de modo que ocupan posiciones casi fijas. En el estado slido las partculas solamente pueden moverse vibrando u oscilando alrededor de posiciones fijas, pero no
pueden moverse trasladndose libremente a lo largo del slido. Las partculas en el estado slido propiamente dicho, se disponen de forma ordenada, con una regularidad espacial geomtrica, que da lugar a diversas estructuras cristalinas. (Al aumentar la temperatura aumenta la vibracin de las partculas). En segunda instancia nos encontramos al estado lquido, los cuales al igual que los slidos, tienen volumen constante. En los lquidos las partculas estn unidas por unas fuerzas de atraccin menores que en los slidos, por esta razn las partculas de un lquido pueden trasladarse con libertad. El nmero de partculas por unidad de volumen es muy alto, por ello son muy frecuentes las colisiones y fricciones entre ellas. As se explica que los lquidos no tengan forma fija y adopten la forma del recipiente que los contiene. Tambin se explican propiedades como la fluidez o la viscosidad. En los lquidos el movimiento es desordenado, pero existen asociaciones de varias partculas que, como si fueran una, se mueven al unsono. Al aumentar la temperatura aumenta la movilidad de las partculas (su energa). Y en ltima instancia se encuentra el estado gaseoso, en el que los gases, igual que los lquidos, no tienen forma fija pero, a diferencia de stos, su volumen tampoco es fijo. Tambin son fluidos, como los lquidos. En este estado las fuerzas que mantienen unidas las partculas son muy pequeas. En un gas el nmero de partculas por unidad de volumen es tambin muy pequeo. Las partculas se mueven de forma desordenada, con choques entre ellas y con las paredes del recipiente que los contiene. Esto explica las propiedades de expansibilidad y compresibilidad que presentan los gases: sus partculas se mueven libremente, de modo que ocupan todo el espacio disponible. La compresibilidad tiene un lmite, si se reduce mucho el volumen en que se encuentra confinado un gas ste pasar a estado lquido.
Al aumentar la temperatura las partculas se mueven ms deprisa y chocan con ms energa contra las paredes del recipiente, por lo que aumenta la presin Luego de haber estudiado de manera muy prctica los estados de la materia y todas sus caractersticas ya para finalizar sera muy conveniente tratar sobre los cambios que pueden sufrir estas, haciendo alusin a lo anteriormente dicho Cuando un cuerpo, por accin del calor o del fro pasa de un estado a otro, decimos que ha cambiado de estado. En el caso del agua: cuando hace calor, el hielo se derrite y si calentamos agua lquida vemos que se evapora. El resto de las sustancias tambin puede cambiar de estado si se modifican las condiciones en que se encuentran. Adems de la temperatura, tambin la presin influye en el estado en que se encuentran las sustancias. Si se calienta un slido, llega un momento en que se transforma en lquido. Este proceso recibe el nombre de fusin. El punto de fusin es la temperatura que debe alcanzar una sustancia slida presin para fundirse. Cada sustancia atmosfrica posee un punto de fusin normal. caracterstico. Por ejemplo, el punto de fusin del agua pura es 0 C a la Si calentamos un lquido, se transforma en gas. Este proceso recibe el nombre de vaporizacin. Cuando la vaporizacin tiene lugar en toda la masa de lquido, formndose burbujas de vapor en su interior, se denomina ebullicin. Tambin la temperatura de ebullicin es caracterstica de cada sustancia y se denomina punto de ebullicin. El punto de ebullicin del agua es 100 C a la presin atmosfrica normal. En el estado slido las partculas estn ordenadas y se mueven oscilando alrededor de sus posiciones. A medida que calentamos el agua, las partculas ganan energa y se mueven ms deprisa, pero conservan sus posiciones. Cuando la temperatura alcanza el punto de fusin (0C) la velocidad de las partculas es lo suficientemente alta para que algunas de
ellas puedan vencer las fuerzas de atraccin del estado slido y abandonan las posiciones fijas que ocupan. La estructura cristalina se va desmoronando poco a poco. Durante todo el proceso de fusin del hielo la temperatura se mantiene constante. En el estado lquido las partculas estn muy prximas, movindose con libertad y de forma desordenada. A medida que calentamos el lquido, las partculas se mueven ms rpido y la temperatura aumenta. En la superficie del lquido se da el proceso de vaporizacin, algunas partculas tienen la suficiente energa para escapar. Si la temperatura aumenta, el nmero de partculas que se escapan es mayor, es decir, el lquido se evapora ms rpidamente. Cuando la temperatura del lquido alcanza el punto de ebullicin, la velocidad con que se mueven las partculas es tan alta que el proceso de vaporizacin, adems de darse en la superficie, se produce en cualquier punto del interior, formndose las tpicas burbujas de vapor de agua, que suben a la superficie. En este punto la energa comunicada por la llama se invierte en lanzar a las partculas al estado gaseoso, y la temperatura del lquido no cambia (100C). En el estado de vapor, las partculas de agua se mueven libremente, ocupando mucho ms espacio que en estado lquido. Si calentamos el vapor de agua, la energa la absorben las partculas y ganan velocidad, por lo tanto la temperatura sube.