Influencia de las modificaciones químicas del enlace amida ... · especificidad frente a cepas...
Transcript of Influencia de las modificaciones químicas del enlace amida ... · especificidad frente a cepas...
Influencia de las modificaciones químicas
del enlace amida en la actividad
antimicrobiana de un péptido catiónico
derivado de la protamina
Jorge Antonio Rodríguez Guerra
Universidad Nacional de Colombia
Facultad de Ciencias
Posgrado Interfacultades en Microbiología
Bogotá D.C, Colombia
2013
II
Influencia de las modificaciones químicas
del enlace amida en la actividad
antimicrobiana de un péptido catiónico
derivado de la protamina
Jorge Antonio Rodríguez Guerra
Tesis o trabajo de investigación presentado como requisito parcial para optar al título de:
Magíster en Microbiología
Director:
José Manuel Lozano Moreno, Químico, Dr.Sc en Ciencias Químicas
Línea de Investigación:
Biología Molecular de agentes infecciosos
Grupo de Investigación:
Grupo Funcional de Biocatálisis, Fundación Instituto de inmunología de Colombia FIDIC
Universidad Nacional de Colombia
Facultad de Ciencias
Posgrado Interfacultades en Microbiología
Bogotá D.C, Colombia
2013
III
A Dios, a mis padres José (Q.E.P.D) y
Geomar que siempre han apoyado este proyecto de
vida, a mi inspiración diaria, mí linda esposa Gina y
hermoso hijo Juan David.
4
Agradecimientos
Mis agradecimientos al posgrado Interfacultades de Microbiología de la
Universidad Nacional de Colombia a su directora Martha Raquel Fontanilla y a
Socorrito Prieto por todo su apoyo. A los diferentes grupos funcionales de
investigación de la Fundación Instituto de Inmunología de Colombia-FIDIC en
cabeza del Profesor Manuel Elkin Patarroyo por la ayuda en los diferentes ensayos
realizados, en especial al Grupo Funcional Biocatálisis, al Doctor José Manuel
Lozano por su dirección, apoyo y dedicación para con este trabajo.
Al grupo de investigación Farmacogénetica del Cáncer, Departamento de Farmacia
Universidad Nacional de Colombia, por la donación de la línea celular HT29.
Al profesor Eduardo Groizman, del Departamento de Microbiología Molecular,
Washington University, St Luis, MD, USA, por la donación de las cepas bacterianas
Gram Negativas.
Al instituto de Biotecnología de la Universidad Nacional Colombia (IBUN) por la
donación de las cepas bacterianas Gram positivas.
5
RESUMEN
En los últimos años, la Organización Mundial de la Salud se ha preocupado por la
rápida aparición de microorganismos resistentes a los antimicrobianos; estos son el
resultado tanto de la presión selectiva por parte de los fármacos usados, como del
uso irracional de los mismos, por esta razón es importante buscar nuevas estrategias
para combatir las cepas resistentes.
Las investigaciones en el campo de los antimicrobianos están dirigidas al desarrollo
y búsqueda de nuevas moléculas. En este campo se destacan los péptidos, los cuales
se han perfilado como una familia de moléculas antimicrobianas denominadas
(PAMs). El estudio de los péptidos antimicrobianos tiene como finalidad mejorar la
actividad y entender su mecanismo de acción.
El objetivo de este trabajo fue sintetizar y determinar la actividad antimicrobiana de
pseudopéptidos (análogos peptídicos amida reducida) del fragmento C-terminal de
la protamina; estas moléculas mostraron características heterogéneas respecto a la
especificidad frente a cepas Gram positivas, Gram negativas y tiempos de vida
media, pero en general las modificaciones disminuyeron la actividad hemolítica sin
afectar la estructura nativa.
Esta estrategia permite modular la actividad antimicrobiana del péptido nativo; sin
embargo, es necesario complementar este tipo de estudio con pruebas específicas y
determinar si dos o más modificaciones simultáneas en una molécula podrían actuar
de forma sinérgica para mejorar la actividad contra un microorganismo
determinado.
Palabras clave: pseudopéptido, antimicrobianos, protamina.
6
ABSTRACT
In recent years, the World Health Organization has been concerned about the rapid
emergence of resistant organisms to antimicrobials, the resistant organisms are the
result of both selective pressure of the drugs used and the irrational use thereof, and
for this reason it is important to seek new strategies to combat resistant strains.
Research in the field of antimicrobials is directed to the development and research
of new molecules. In this field the peptides have emerged as a family of
antimicrobial molecules called (PAMs). The study of antimicrobial peptides
intended to improve the activity and understand its mechanism of action.
The aim of this work was to synthesize and establish the antimicrobial activity of
pseudopeptides (reduced amide peptide analogs) of the C-terminal fragment of
protamine, these molecules showed heterogeneous characteristics for specificity
against strains Gram positive, Gram negative and times half life, but in general the
modifications reduced the hemolytic activity without affecting the native structure.
This strategy works to modulate the antimicrobial activity of the native peptide, it
is necessary to complement this type of study with specific tests to determine if two
or more simultaneous changes in a molecule, could act synergistically to enhance
the activity against a determined microorganism.
Keywords: Pseudopeptide, Protamine, Antimicrobial.
7
Contenido
INTRODUCCIÓN ............................................................................................................................................ 12
PLANTEAMIENTO DEL PROBLEMA ......................................................................................................... 13
ESTADO DEL ARTE ...................................................................................................................................... 14
Resistencia antimicrobiana........................................................................................................................... 14
Características de algunos microorganismos ............................................................................................... 14
Péptidos antimicrobianos (PAMs) ............................................................................................................... 18
Mecanismos de acción de los PAMs ............................................................................................................ 18
Clasificación de los PAMs ........................................................................................................................... 21
Mecanismos de resistencia de los microorganismos a péptidos antimicrobianos ........................................ 23
Protamina de salmón .................................................................................................................................... 24
Síntesis de péptidos en fase sólida ............................................................................................................... 26
Síntesis de pseudopéptidos ........................................................................................................................... 28
Mecanismo de la reacción química en la obtención del enlace amida reducido. ......................................... 30
Métodos para el estudio de compuestos antimicrobianos ............................................................................ 31
Antibiograma ........................................................................................................................................... 31
Determinación de la concentración mínima inhibitoria ........................................................................... 32
OBJETIVOS ..................................................................................................................................................... 34
HIPÓTESIS DE TRABAJO ............................................................................................................................. 35
CAPÍTULO 1 ................................................................................................................................................... 36
DISEÑO, SÍNTESIS Y CARACTERIZACIÓN DE LOS PSEUDOPÉPTIDOS ............................................ 36
Diseño de los pseudopéptidos ...................................................................................................................... 36
Resultados ................................................................................................................................................ 36
Síntesis de aminoaldehídos partiendo de los respectivos aminoácidos t-Boc .............................................. 37
Resultados ................................................................................................................................................ 37
Síntesis y caracterización de los pseudopéptidos ......................................................................................... 39
Síntesis ..................................................................................................................................................... 39
Caracterización ........................................................................................................................................ 40
Resultados ............................................................................................................................................ 40
Primera síntesis estrategia t-Boc ........................................................................................................... 41
8
Segunda síntesis estrategia t-Boc ......................................................................................................... 44
Tercera síntesis estrategia F-moc ......................................................................................................... 45
CAPÍTULO 2 ................................................................................................................................................... 46
ENSAYOS DE ACTIVIDAD .......................................................................................................................... 46
Ensayos de estabilidad molecular frente a suero normal humano (SNH) .................................................... 46
Resultados ................................................................................................................................................ 46
Ensayos de actividad antimicrobiana .......................................................................................................... 50
Ensayo de sensibilidad bacteriana ........................................................................................................... 50
Resultados ............................................................................................................................................ 51
Determinación de la concentración inhibitoria 50 (CI50) ............................................................................ 56
Inhibición de la invasión a glóbulos rojos por P. falciparum ...................................................................... 57
Resultados ................................................................................................................................................ 57
Actividad hemolítica .................................................................................................................................... 59
Resultados .................................................................................................................................................... 59
Ensayo de citotoxicidad en células HT29 .................................................................................................... 60
Resultados ............................................................................................................................................ 61
Análisis de perfiles de estructura secundaria ............................................................................................... 62
Resultados ................................................................................................................................................ 62
DISCUSIÓN ..................................................................................................................................................... 64
CONCLUSIONES ............................................................................................................................................ 69
RECOMENDACIONES .................................................................................................................................. 70
ANEXO I. Espectros de masas y cromatografías primera síntesis ............................................................... 71
ANEXO II. Espectros de masas y cromatografías segunda síntesis ............................................................. 78
ANEXO III. Ensayos de sensibilidad bacteriana, bacterias Gram positivas. .............................................. 81
ANEXO IV. Ensayos de sensibilidad bacteriana, bacterias Gram negativas. ............................................ 83
ANEXO V. Espectros canónicos en dicroísmo circular ............................................................................... 85
ANEXO VI. Deconvolución de los pseudopéptidos sintetizados ................................................................ 86
ANEXO VII. Hemólisis de los pseudopéptidos y antibióticos a diferentes concentraciones ...................... 92
BIBLIOGRAFÍA .............................................................................................................................................. 94
9
Lista de figuras
Figura 1. Microscopía de Staphylococcus aureus, una bacteria Gram positiva. ............................................... 14 Figura 2. Microscopía de Streptococcus mutans, una bacteria Gram positiva. ................................................ 15 Figura 3. Microscopía de Enterococcus faecalis, una bacteria Gram positiva. ................................................ 15 Figura 4. Microscopía de Escherichia coli, una bacteria Gram negativa. ........................................................ 16 Figura 5. Microscopía de Pseudomonas aeruginos, una bacteria Gram negativa. ........................................... 16 Figura 6. Microscopía de Salmonella typhimurium, una bacteria Gram negativa. ........................................... 17 Figura 7. Microscopía de Plasmodium falciparum, un parásito humano. ........................................................ 17 Figura 8. Modelos de interacción inicial de PAMs con membranas lipídicas: ................................................. 19 Figura 9. Mecanismos de resistencia a los péptidos antimicrobianos en bacterias. .......................................... 24 Figura 10. Localizacion celular de la protamina. ............................................................................................. 25 Figura 11. Esquema general de síntesis en fase sólida. .................................................................................... 27 Figura 12. Diferencias entre enlace amida y enlace amida reducida en un pseudopéptido .............................. 28 Figura 13. Reacciones químicas para la obtención de aminoaldehído a partir de aminoácidos ....................... 29 Figura 14. Síntesis en fase sólida de pseudopéptidos amina reducida .............................................................. 29 Figura 15. Mecanismo de la reaccion química para la obtención de un enlace amida reducido partiendo de un
aldehído y una amina.73
................................................................................................................................... 30 Figura 16. Ensayo de difusión radial mostrando halos de inhibición. .............................................................. 31 Figura 17. Determinación de CMI, CMB. ........................................................................................................ 33 Figura 18. Espectros de infrarojo en la obtención del aminoaldehído Fmoc Gly y su analogo t-Boc. ............. 38 Figura 19. Espectro de masas y cromatografía del péptido 20.1 crudo (péptido nativo). ................................. 41 Figura 20. Espectro de masas y cromatografía del pseudopéptido 7 (pseudopéptido crudo) ........................... 42 Figura 21. Espectro de masas y cromatografía de los pseudopéptido 8, 9 y 10................................................ 43 Figura 22. Espectro de masas y cromatografía del pseudopéptido 12 .............................................................. 43 Figura 23. Espectro de masas y cromatografía de los pseudopéptidos 8.(1), 9.(1) y 10(1). ............................ 44 Figura 24. Proporcionalidad de las intensidades respecto a la concentración en los espectros de masas. ........ 47 Figura 25. Respuesta de las intensidades relativas mediante espectrometría de masas vs concentración. ....... 47 Figura 26. Confirmación de la tendencia con adición de SNH ......................................................................... 48 Figura 27. Estabilidad del pseudopéptido 1 incubado con SNH al 100%. ....................................................... 48 Figura 28. Estabilidad del pseudopéptido 1 frente a SNH al 50%, lecturas cada 5 min. .................................. 49 Figura 29. Resultados de los antibiogramas para bacterias Gram positivas. .................................................... 52 Figura 30. Resultados de los antibiogramas para bacterias Gram negativas a 20 µg ....................................... 54 Figura 31. Resultados de los antibiogramas para bacterias Gram negativas a 25µg. ....................................... 55 Figura 32. Porcentaje de hemólisis obtenido para los diferentes pseudopéptidos a 1, 0.5 y 0.25 mg/mL. ...... 59 Figura 33. Citotoxicidad de pseudopéptidos y antibióticos sobre la línea celular HT29. ................................. 61 Figura 34. Espectros de Dicroísmo circular de los pseudopéptidos, ................................................................ 62 Figura 35. Posible explicación a las deleciones de Gly en los pseudopeptidos 9 y 10. .................................... 64 Figura 36. Posible explicación a los mayores pesos encontrados en el pseudopeptido 8 ................................. 65 Figura 37. Halos de inhibición en Bacterias Gram positivas. ........................................................................... 81 Figura 38. Halos de inhibición en Bacterias Gram negativas ........................................................................... 83 ..............................................................................................................................................................................
10
Lista de tablas
Tabla 1. Números de identificación y números de equivalencia del péptido nativo y los diferentes
pseudopéptidos. ................................................................................................................................................ 36 Tabla 2. Comportamiento de los pseudopéptidos sintetizados por la estrategia t-Boc, cada color identifica
péptidos con características similares analizados mediante HPLC y espectrometría de masas. ....................... 40 Tabla 3. Tiempo de vida media de cada uno de los pseudopéptidos ensayados. ............................................. 49 Tabla 4. Valores de CI50 de los pseudopéptidos frente a diferentes cepas bacterianas Gram positivas y Gram
negativas.( rojo y verde respetivamente). ......................................................................................................... 56 Tabla 5. Resultados de los ensayos de invasión de P. falciparum a glóbulos rojos realizados en tres
concentraciones de péptido diferentes 50, 100 y 200 µMolar. ......................................................................... 58 Tabla 6. Resumen de resultados. ...................................................................................................................... 63 Tabla 7 . Valores de los halos de inhibición para Bacterias Gram positivas ................................................... 82 Tabla 8. Valores de los halos de inhibición para bacterias gram positivas ....................................................... 84
11
Lista de abreviaturas
SÍMBOLO
TÉRMINO
CD
Dicroísmo circular
TFE
Trifluoroetanol
(CMI)
Concentración mínima inhibitoria
(Ψ)
Carácter griego PSI que significa pseudo
CI50
Concentración inhibitoria 50
CMB
Concentración mínima bactericida
DCC
N,N'-diciclohexilcarbodiimida
DCM
Diclorometano
DIEA
Di isoproíl etil amina
DMF
Dimetil formamida
FIDIC
Fundación Instituto de Inmunología de Colombia
F-moc
9-Fluorenilmetoxicarbonil
G ó Gly
HF
Glicina
Fluoruro de hidrogeno
HOBt
1-hidroxibenzotriazol
HPLC
Cromatografía liquida de alta eficiencia
IPA
Alcohol isopropílico
LPS
Lipopolisacárido
MALDI
Desorción por ionización de matriz asistida por laser
NCCLS
National Committee for Clinical Laboratory Standards.
PAMs
Péptidos antimicrobianos
R ó Arg
S ó Ser
SBF
Arginina
Serina
Suero Fetal Bovino
SNH
Suero Normal Humano
SSF
Solución salina fisiológica
TA
Temperatura ambiente
t-Boc
Tert-butiloxicarbonil
TFA
Acido trifluoroacético
TIS
Triisopropílsilano
TOF
Tiempo de vuelo
Δ
V ó Val
Delta (variación)
Valina
12
INTRODUCCIÓN
Los antibióticos son muy utilizados para combatir infecciones bacterianas; sin embargo, el
fenómeno de resistencia a este tipo de moléculas ha limitado su uso y ha generado la
necesidad de hallar nuevos agentes antibacterianos.
Dentro de las moléculas estudiadas para combatir los microorganismos se ha encontrado
que los péptidos tienen un espectro de acción frente a diferentes tipos de microorganismos,
estos se pueden obtener de diversas fuentes naturales y algunos presentan actividad
citotóxica expresada como la capacidad para producir la hemólisis de los glóbulos rojos.
Los péptidos con actividad antimicrobiana tienen pesos moleculares entre 2 y 5 kDa, la
mayoría pueden formar poros en la membrana citoplasmática de bacterias tanto Gram
positivas como de Gram negativas, afectando la permeabilidad y promoviendo la lisis
celular.
Dentro de la familia de los péptidos antimicrobianos encontramos la protamina; un péptido
con un alto contenido de arginina aislado de células de esperma de salmón. Estudios
previos han mostrado que el fragmento C-terminal obtenido por la digestión con
termólisina tiene actividad antiplasmódica y antimicrobiana disminuyendo la actividad
hemolítica del péptido natural.
En este trabajo se estudió el efecto de modificaciones químicas del enlace peptídico sobre
la actividad antimicrobiana del fragmento C-terminal de la protamina, con lo cual se buscan
nuevas estrategias para el mejoramiento de la actividad antimicrobiana de péptidos
naturales con fines terapéuticos. Esta estrategia se ha aplicado en nuestro grupo de
investigación a antígenos provenientes de Plasmodium falciparum para mejorar la respuesta
inmune; sin embargo, no ha sido usada para estudiar los cambios en la actividad
antimicrobiana de este fragmento peptídico.
13
PLANTEAMIENTO DEL PROBLEMA
Este trabajo abordó el estudio sobre el efecto en la actividad antimicrobiana y
antiparasitaria derivada de las modificaciones químicas del enlace amida del fragmento C-
terminal de la protamina; con la finalidad de comparar la actividad de cada análogo frente a
diferentes patógenos, como estrategia para modificar la actividad antimicrobiana en dichas
moléculas.
.
14
ESTADO DEL ARTE
RESISTENCIA ANTIMICROBIANA
La práctica habitual de suplementar la dieta de animales de producción con antibióticos
como promotores de crecimiento1 y el uso extensivo de antibióticos para tratar infecciones
en seres humanos o animales pueden ser las causas principales del aumento en el número
de patógenos que presentan resistencia a los antibióticos,2,3
lo cual es un tema muy
controversial en la actualidad.4,5
También se ha reportado la resistencia de parásitos frente a medicamentos tradicionales, es
el caso de Plasmodium falciparum, un parásito intraeritrocitario del cual se han descrito en
los últimos años cepas multirresistentes incluso a la cloroquina,6,7
convirtiéndose en un
problema en la lucha antimalárica.
La resistencia microbiana a diferentes clases de antibióticos se está convirtiendo en un
problema de salud pública,8 por lo tanto hay una extensa y continúa búsqueda de nuevos
antibióticos que actúen in vivo, que sean de rápida acción, amplio espectro, que no
induzcan resistencia bacteriana y que tengan pocos o ningún efecto secundario.
CARACTERÍSTICAS DE ALGUNOS MICROORGANISMOS
Staphylococcus aureus: Es un agente patogénico que actúa
como un microorganismo saprófito, se encuentra en la piel
del individuos sanos sin embargo, cuando las defensas de la
piel disminuyen, puede causar enfermedades, donde el
principal grupo de riesgo son los pacientes hospitalizados e
inmunocomprometidos infectando la piel y los tejidos
blandos.
Los factores de virulencia más importantes que permiten
una identificación positiva, son la capacidad para fermentar
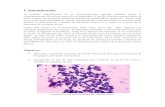
Figura 1. Microscopía de
Staphylococcus aureus, una
bacteria Gram positiva.
15
azúcares como manitol, la expresión de catalasa y coagulasa y la presencia del gen mecA de
localización cromosómica que codifica una proteína (lactamasa) que le confiere
resistencia a todos los antibióticos betalactámicos.9 Las cepas capaces de resistir
tratamientos con meticilina se denominan (MRSA), las cuales también puede presentar
resistencia a antibióticos de la familia de los macrólidos de manera inducible o constitutiva
gracias a la presencia de los genes erm(A).10
Streptococcus mutans: Es una bacteria Gram
positiva, anaerobia facultativa que se encuentra
normalmente en la cavidad bucal humana, formando parte
de la placa bacteriana o biopelícula dental relacionada al
inicio y desarrollo de la caries dental gracias a la
fermentación de azúcares.11
Los factores determinantes de virulencia están asociados
con la formación de biopelículas y la capacidad para
sobrevivir a pHs ácidos.12
Se ha reportado que este
microorganismo es resistente a bacitracina (péptido antibiótico) debido a los genes mbrA –
mbrD, involucrados en la síntesis de polisacáridos.
Enterococcus faecalis: Es una bacteria Gram-
positiva comensal, habita el tracto gastrointestinal de los
humanos y otros mamíferos, poseen poco potencial
patogénico en el hospedador normal, sin embargo son
patógenos oportunistas. E.faecalis y E. faecium representan
más del 95% de los aislamientos clínicos de
enterococos,13
como otras spp. del género Enterococcus, E.
faecalis puede causar infecciones en humanos,
especialmente en ambiente hospitalario. La existencia de
enterococos se potencia porque ha tenido la habilidad de adquirir resistencia a la mayoría
de los antibióticos en uso14
y cada vez son más comunes las cepas resistentes a la
vancomicina.15
Figura 2. Microscopía de
Streptococcus mutans, una
bacteria Gram positiva.
Figura 3. Microscopía de
Enterococcus faecalis, una
bacteria Gram positiva.
16
Escherichia coli: En su hábitat natural, vive en los
intestinos de la mayor parte de los mamíferos sanos, es el
principal organismo anaerobio facultativo del sistema
digestivo en individuos sanos, es decir, si la bacteria no
adquiere elementos genéticos que codifican factores de
virulencia, actúa como un comensal formando parte de
la flora intestinal ayudando a la absorción de nutrientes.16
En humanos coloniza el tracto gastrointestinal de un
neonato adhiriéndose a las mucosidades del intestino
grueso en el plazo de 48 horas después de la primera comida.17
En el caso de cepas
virulentas puede causar diarreas hemorrágicas.
Pseudomonas aeruginosa: Es una bacteria Gram-negativa,
aeróbica, con motilidad unipolar, es un patógeno
oportunista en humanos y también en plantas. Este
patógeno invade individuos inmunocomprometidos, infecta
el tracto respiratorio, urinario, tejidos, heridas y también
causa infecciones en sangre.. Una de las características más
preocupantes de este microorganismo es su
baja susceptibilidad a los antibióticos, debido a una acción
concertada de múltiples bombas de expulsión y genes de
resistencia como mexAB , mexXY, 18
algunas cepas producen infecciones crónicas por la
expresión de genes de resistencia encontrados en integrones, algunos estudios han mostrado
resistencia fenotípica asociada a la formación de biopelículas y a las variantes encontradas
en colonias muy pequeñas que pueden ser las responsables de la resistencia a tratamientos
con antibióticos.19
Figura 4. Microscopía de
Escherichia coli, una bacteria
Gram negativa.
Figura 5. Microscopía de
Pseudomonas aeruginos, una
bacteria Gram negativa.
17
Salmonella typhimurium: La salmonella es un bacilo Gram
negativo que pertenece a la familia Enterobacteriaceae.
Esta bacteria se encuentra a menudo en pollos, huevos y en
reptiles; se ha sabido recientemente que la causa más
común del envenenamiento de comida es debido a
Salmonella typhimurium, como su nombre sugiere, esta
bacteria causa enfermedades parecidas a la fiebre tifoidea,
la enfermedad se caracteriza por causar diarreas, dolores
abdominales, vómitos y náuseas, y generalmente dura
varios días.20
La variante phoP presenta un efecto regulador negativo en el componente
necesario para la virulencia responsable de la regulación en la expresión de los
lipopolisacáridos,21
la variante pcgl hace que esta cepa sea hipervirulenta gracias a la
acumulación de peptidoglicano..22
Plasmodium falciparum: Es un protozoo parásito que causa
malaria en humanos, transmitido por el mosquito
Anopheles.
Se pueden observar diferentes formas a través de su ciclo de
vida: 1. En el mosquito Anopheles (donde se reproduce el
parásito), 2. En el interior de los hepatocitos, 3. En el
interior de los glóbulos rojos del hospedador humano.
Este parasito transmite la forma más peligrosa de malaria y
se ha observado la aparición de cepas resistentes a la cloroquina en zonas endémicas,23
P.falciparum ha mostrado un índice de infección del 80% y una tasa de muertes por la
enfermedad de un 90%.24
Figura 6. Microscopía de
Salmonella typhimurium, una
bacteria Gram negativa.
Figura 7. Microscopía de
Plasmodium falciparum, un
parásito humano.
18
PÉPTIDOS ANTIMICROBIANOS (PAMS)
Hasta el momento los péptidos sintéticos con características antimicrobianas son los
mejores candidatos a reemplazar o coadyuvar en la lucha contra el aumento de la
resistencia a los antimicrobianos, este tipo de moléculas cumple con varios requisitos que
debe tener un medicamento antimicrobiano: Concentraciones mínimas inhibitorias (CMI)
bajas, un amplio espectro de actividad frente a diferentes tipos de microorganismos a bajas
y altas fuerzas iónicas,25
capacidad de neutralizar lipopolisacáridos y bajos efectos
secundarios.26
Algunos péptidos actúan sinérgicamente con los antibióticos
convencionales27
y es posible producirlos en cantidades apreciables y purezas aceptables
mediante síntesis química.
Los PAMs generalmente son muy diversos en cuanto a su estructura y mecanismos de
acción, por lo que se hacen atractivos en investigación como agentes terapéuticos contra
infecciones, son un componente importante de la defensa natural de la mayoría de los
organismos vivos contra los patógenos,28
son relativamente pequeños (<10 kDa), pueden
ser catiónicos, anfipáticos, de longitud, secuencia y estructura variable. Durante las últimas
dos décadas se han aislado una gran variedad de PAMs en plantas, animales, bacterias y
hongos.29,30
En general presentan un amplio espectro de actividades antivirales, anti
fúngicas, antibacterianas e incluso, en algunos casos, antitumorales.
MECANISMOS DE ACCIÓN DE LOS PAMS
Los mecanismos son variados31
y están relacionados con complejas interacciones
moleculares, lo que ha llevado a llamarlos “medicamentos sucios”32
en comparación con
los antibióticos convencionales beta-lactámicos que presentan un único mecanismo de
acción. Esto hace a los péptidos antimicrobianos difíciles de estudiar, pero al mismo tiempo
más interesantes.
Aunque por muchos años el dogma había sido que los péptidos antimicrobianos interactúan
con las membranas bacterianas aumentando la permeabilidad, actualmente se conocen otros
mecanismos de acción33,34
que interfieren en la síntesis de enzimas metabólicas, uniéndose
a organelos o actuando directamente sobre el DNA.35,36
19
La interacción inicial de los péptidos antimicrobianos con las bacterias es generalmente por
la atracción electrostática entre el péptido y las membranas negativas ricas en ácidos
teicoicos y lipopolisacáridos, una vez localizados en la membrana, pueden sufrir
modificaciones en su conformación y producir daños en la membrana o a nivel interno,
permitiendo la translocación de estos a través de la bicapa externa.
Figura 8. Modelos de interacción inicial de PAMs con membranas lipídicas:
barril, (B) carpeta, (C) poro toroidal, (E) balsa (D) electroporation.
Tomado de: Role of lipids in the interaction of antimicrobial
peptides with membranes.37
20
Se han descrito muchos modelos para la permeabilización de las membranas, sin embargo
existen tres modelos ampliamente aceptados: Barril, poro toroidal y carpeta.
En el modelo de barril (Figura 8A), los péptidos unidos a la membrana se agregan y se
insertan en la bicapa de modo que las regiones hidrofóbicas de los péptidos se alinean con
la región del core lipídico de la membrana, dejando las regiones hidrofílicas hacia el lumen
central. Se forma así un poro transmembrana muy similar a un barril cuyas paredes son los
péptidos helicoidales.
En el modelo de carpeta (Figura 8B) los péptidos se acumulan en la superficie de la bicapa
cubriendo la superficie de la membrana celular, en altas concentraciones interrumpen la
continuidad de la membrana insertándose en ella de forma paralela a la bicapa lipídica
mediante sus regiones hidrofóbicas, las regiones polares de los péptidos quedan expuestas
al exterior, de modo que actúan de manera similar a los detergentes para desintegrar
finalmente la membrana formando micelas.38
En el modelo de poro toroidal (Figura 8C), los péptidos unidos se agregan y se insertan en
la membrana e inducen a la mono capa de lípidos a curvarse a través del poro, de modo que
las regiones polares de ambas capas de la membrana llegan a unirse. Así, las paredes del
poro quedan formadas por las cabezas polares de los lípidos de membrana y por los
péptidos insertados en ella.39
Se ha sugerido que los canales iónicos, los poros transmembrana y la ruptura extensiva de
la membrana no representan tres mecanismos de acción completamente diferentes, sino que
existe una continuidad entre ellos. En relación a los modelos de muerte intracelular, existe
evidencia que los péptidos antimicrobianos después de cruzar la membrana citoplasmática
llegan a unirse e interactuar con blancos intracelulares como: histonas,40
ácidos nucleicos,41
intervienen en el plegamiento de las proteínas,42
inhiben la síntesis de membranas,43
y
estimulan la producción de especies reactivas de oxígeno.44
Una vez en el citoplasma, los PAMs pueden alterar la formación del septum citoplásmico,
inhibir la síntesis de pared celular, la síntesis de ácidos nucleicos, la síntesis de proteínas o
evitar la actividad enzimática.
21
CLASIFICACIÓN DE LOS PAMS
Aún no existe consenso respecto a los grupos de clasificación de los péptidos
antimicrobianos; estos pueden diferir dependiendo de los autores y experiencia
investigativa, sin embargo se están adelantando esfuerzos por consolidar dicha iniciativa de
clasificación.45
Una de las clasificaciones más relevantes de los PAMs puede encontrarse en la base de
datos de péptidos antimicrobianos (APD, por sus siglas en inglés, Antimicrobial Peptide
Database), realizada por Wang y colaboradores,46
en donde tenemos una clasificación en
base a seis grupos principales.
1. Maquinaria biosintética: Si la expresión de los péptidos puede inducirse o presentarse de
forma constitutiva, se les denomina péptidos antimicrobianos verdaderos, mientras que
aquellos que son producto de metabolitos secundarios o son obtenidos de proteínas cuya
función principal no es antimicrobiana se denominan péptidos antimicrobianos no
verdaderos.
2. Fuente biológica: Dependerá del tipo de organismo del que se obtenga.
3. Blanco biológico: Está relacionado al tipo de microorganismo contra el cual está dirigida
su actividad (péptidos antibióticos, péptidos antiparasitarios, péptidos antivirales y péptidos
antifúngicos).
4. Propiedades moleculares: Se relaciona con las propiedades intrínsecas de cada molécula
generalmente propiedades fisicoquímicas (carga, tamaño, hidrofobicidad y anfipaticidad).
5. Estructura tridimensional (3D): En este grupo se encuentran los péptidos con
características estructurales similares (hélice, hojas beta, giros, en conformación extendida
y péptidos cíclicos con puentes disulfuro).
6. Blancos moleculares: Es una de las clasificaciones más extensas ya que se basa en el tipo
de blanco o diana alcanzado por el péptido antimicrobiano una vez está en contacto con el
microorganismo (ácidos nucleicos, membrana citoplasmática, pared celular, proteínas y
organelos).
22
Según otros autores existe otra forma de clasificación basada en la composición de
aminoácidos, obteniéndose cinco grupos principales:47
1. Péptidos antimicrobianos aniónicos: Son ricos en ácido glutámico y ácido aspártico,
algunos se han aislado de extractos de fluido de lavado bronquio alveolar y células del
epitelio respiratorio, son producidos en concentraciones del rango milimolar, requieren
Zn++
como cofactor para su actividad antimicrobiana y son activos contra bacterias Gram
negativas y Gram positivas.
2. Péptidos catiónicos lineales y α-helicoidales: Carecen de residuos cisteína y a veces
tienen una zona flexible en la mitad de la molécula, en solución acuosa, muchos de estos
péptidos tienen una estructura desordenada pero en presencia de ciertas sustancias tales
como vesículas de fosfolípidos, una parte o toda la molécula es convertida en hélice α. Se
ha observado que un mayor contenido de hélice α se correlaciona con una actividad
antimicrobiana más fuerte. Como el grupo anterior, estos péptidos son activos contra
bacterias Gram positivas y Gram negativas debido a la carga negativa en la superficie de
ácidos teicoicos y lipopolisacáridos (LPS) respectivamente.
4. Péptidos aniónicos y catiónicos que contienen cisteína que forman enlaces disulfuro y
estructuras estables de láminas β: En este grupo se encuentra una familia muy diversa de
moléculas llamadas defensinas, hay α-defensinas que incluyen péptidos humanos
producidos por neutrófilos y criptidinas producidas por células del epitelio intestinal, tienen
alrededor de 29 a 35 aminoácidos, incluyen seis cisteínas unidas por tres enlaces disulfuro
intracatenarios. Este grupo también incluye a las β-defensinas humanas y de animales que
contienen de 36 a 42 aminoácidos que incluyen tres enlaces disulfuro.48
5. Péptidos aniónicos y catiónicos provenientes de proteínas de mayor tamaño: Son
similares en composición y estructura a los péptidos del subgrupo anterior, en humanos
tenemos los péptidos de lactoferricina y dominios antimicrobianos derivados de
hemoglobina y lisozima. También existe una familia de péptidos antimicrobianos con
estructura similar al colágeno que actúan como lectinas uniéndose a manosa, por lo cual se
han denominado colectinas, estos péptidos pueden activar el complemento vía lectinas y
actuar como opsoninas facilitando la fagocitosis.
23
MECANISMOS DE RESISTENCIA DE LOS MICROORGANISMOS A PÉPTIDOS
ANTIMICROBIANOS
Los péptidos antimicrobianos han sido utilizados por la naturaleza por billones de años y no
hay duda de que su uso eventualmente podría generar resistencia, aunque con una mayor
dificultad comparado con los antibióticos convencionales.
Se han descrito determinadas especies bacterianas que son resistentes a prácticamente todos
los péptidos antibióticos de origen eucariótico, como Proteus spp., Serratia spp. y
Burkholderia spp.
Cuando se intenta desarrollar in vitro resistencia en un microorganismo de una especie
generalmente sensible, esta se obtiene con muy poca frecuencia. Algunas cepas resistentes
a los péptidos antimicrobianos se han relacionado con enfermedades; por ejemplo:
Staphylococcus aureus resistente a estos péptidos tiende a causar endocarditis bacteriana, se
ha pensado que dicha resistencia es generada por enzimas proteolíticas secretadas que
pueden degradar a los PAMs.49,50
Se cree que algunos de los mecanismos desarrollados como resistencia contra los péptidos
antimicrobianos pueden ser los siguientes:
1. Mecanismos de captación-expulsión: Se han descrito sistemas de transporte a través de la
membrana de patógenos de plantas y de animales, estos captan el péptido al interior de la
célula para ser degradado. También pueden existir sistemas de expulsión similares a los
implicados en caso de multirresistencia. Este último mecanismo se ha descrito en N.
gonorrhoeae.51
2. Inactivación del péptido: El alto contenido en residuos básicos de los péptidos favorece
la degradación por proteasas, en algunas bacterias se han descrito enzimas capaces de
degradar los PAMs de forma específica, es el caso de las cepas de Bacillus spp,
P.aeruginosa y Salmonella spp que degradan cecropinas y magaininas. La inactivación de
péptidos con puentes disulfuro puede producirse por la acción de reductasas que se
encuentran en la membrana.
3. Incapacidad de llegar a la diana bacteriana: Antes de llegar a la membrana citoplásmica,
los PAMs deben atravesar la membrana externa y la capa de peptidoglicano.
La unión de los péptidos catiónicos se produce por interacción electrostática con los
lipopolisacáridos cargados negativamente, si existe una modificación o desaparición del
24
lipopolisacárido puede aparecer resistencia. Las cepas de Proteus spp. y Burkholderia spp.
presentan un lipopolisacárido con menor carga negativa y por esta razón son resistentes de
forma natural.39
Figura 9. Mecanismos de resistencia a los péptidos antimicrobianos en bacterias.
Las bacterias pueden resistir los efectos de péptidos antimicrobianos (PAMs) a través de: (1) La salida de
péptidos antimicrobianos a través de bombas de eflujo, (2) La producción de proteasas, (3) Alteraciones en la
composición de proteínas de membrana, (4) La unión de proteínas bacterianas para inactivar los PAMs, (5) El
cambio de la carga neta en la membrana. Tomado de: “Natural effectors of the innate immune system”.52
4. Modificación de la diana molecular: Se han descrito diferentes elementos de la
membrana plasmática que pueden sufrir alteraciones como posibles mecanismos de
resistencia. La composición en menor cantidad de fosfolípidos aniónicos se asocia con
resistencia natural en Serratia spp. El potencial de membrana está asociado con una mayor
permeabilización por los péptidos en bacterias o en modelos de membrana, una variación
en este potencial puede dar lugar a resistencia.39
PROTAMINA DE SALMÓN
Las protaminas son secuencias muy pequeñas de aminoácidos codificadas por un gen, por
tal razón se referencia como péptido o como proteína, tienen carácter básico, por lo tanto
son altamente catiónicas con un peso molecular de aproximadamente 5 kDa, y presentan un
nivel inusualmente alto de arginina (≈ 66% sobre una base molar) y un punto isoeléctrico
entre pHs 12 a 13,53
Son típicas en el núcleo espermático maduro que junto al ADN
constituyen la cromatina, haciendo que esta alcance un estado casi cristalino.54
25
Figura 10. Localizacion celular de la protamina.
Las histonas (parte superior) hacen parte de la cromatina en la célula germinal, a medida queocurre la
diferenciación a espermatozoides, las histonas son reemplazadas por las protaminas (parte inferior), en el
espermatozoide maduro alcanzan un 85% del total de proteinas totales que conforman la cromatina.
Tomado de : http://www.investigacionyciencia.es55
Desde hace más de cinco décadas la protamina de salmón se ha utilizado en aplicaciones
médicas como soporte o agente de liberación lenta de insulina inyectable,56
también se ha
usado como antagonista de la heparina para contrarrestar los efectos anticoagulantes
después de las intervenciones quirúrgicas y recomponer las características de
coagulación.57,58
Uno de los primeros reportes de la actividad antimicrobiana de la protamina de salmón
sobre bacterias tipo Gram positivas y Gram negativas se hizo en 1942,59
la documentación
respecto a la actividad microbicida y de su mecanismo de acción sobre el modelo
Salmonella typhimurium, involucra la disrupción de la membrana citoplasmática,60
considerándose un antimicrobiano no verdadero. La protamina de salmón se ha usado como
un ingrediente en algunos productos alimenticios para evitar el crecimiento de
microorganismos,61
incluso se han encontrado aplicaciones excepcionales como tratamiento
preventivo de la caries.62,63.
26
Las investigaciones en péptidos antimicrobianos está dirigida a modificar las características
fisicoquímicas y estructurales de péptidos aislados de fuentes naturales para obtener
información sobre las propiedades que hacen que sean específicos contra microorganismo
patógenos,64,65
conociendo dichas características que influyen en la actividad
antimicrobiana, se estaría en la capacidad de diseñar, modificar y sintetizar péptidos con
actividades moduladas o mejoradas.66,67
Nuestro grupo de investigación ha realizado trabajos con la protamina de salmón,
mapeando los sitios de corte con termolisina y sintetizando químicamente los tres
fragmentos resultantes, demostrando que el fragmento de la región C terminal presentaba
mayor estabilidad, actividad antimicrobiana y antiplasmódica respecto a los otros dos, al
analizar los componentes estructurales mediante dicroísmo circular se encontró que este
péptido tiene diferencias respecto a la protamina completa.68
SÍNTESIS DE PÉPTIDOS EN FASE SÓLIDA
El pionero de la síntesis de péptidos fue Emil Fisher, quien realizó la síntesis del dipéptido
glicil-glicina en 1901, su técnica evolucionó por varias etapas hasta que Bruce Merrifield
introdujo la síntesis en fase sólida (SPPS, por sus siglas en inglés: Solid Phase Peptide
Synthesis).69
El trabajo de Bruce Merrifield ha sido objeto de mejoras y modificaciones, la
más sobresaliente fue la realizada por Sheppard70
en donde se utilizan el grupo 9-
Fluorenilmetoxicarbonil (Fmoc) un compuesto base lábil, para proteger la función amina de
los aminoácidos, en lugar del grupo tert-butiloxicarbonil (t-Boc) un compuesto ácido lábil,
la técnica consiste en la adición secuencial de α aminoácidos protegidos en su cadena
lateral en un soporte polimérico como se muestra en la Figura 11.
Una vez unido el primer aminoácido usando activadores en dimetil formamida (DMF) o
diclorometamo (DCM) como solventes, se procede a remover el grupo protector de la
amina α el cual puede ser Fmoc ó t-Boc, una vez eliminado se adiciona el siguiente
aminoácido con ayuda de activadores para mejorar la reactividad del ácido carboxílico, este
proceso se repite las veces que sean necesarias para completar la cadena peptídica deseada,
el péptido resultante es desanclado de la resina al mismo tiempo que se retiran los grupos
protectores de las cadenas laterales de los aminoácidos en presencia de “scavengers” para
evitar reacciones colaterales.
27
Cuando se trabaja con el grupo protector α amino t-Boc, este se retira con ácido
trifuoroacético (TFA) en DCM y el desanclaje del péptido se lleva a cabo usando ácidos
fuertes como el fluoruro de hidrogeno (HF) en presencia de “scavengers”.
Adaptador+R
O
NHOH
Union al adaptador
Adaptador
R
O
NH.
Desprotección de la función amino
Adaptador
R
O
NH2.
AcopleR
1
O
NHOH
Adaptador
R
O
NH.
R1
O
NH
n-Ciclos de Desprotección y Acople
Adaptador
R
O
NH.
R
O
NH
R
O
NH
nn-1
x
x+1
Desanclaje de la resina
R
O
NHOH
R
O
NH
R
O
NH
nn-1
x
x+1
Grupo protector de cadenas laterales
Grupo protector N
Sporte polimerico
Figura 11. Esquema general de síntesis en fase sólida.
Adaptado de: Novabiochem catalog 2006/2007
Cuando se utiliza el grupo protector α amino Fmoc, este se retira con una solución de
piperidina en DMF. El desanclaje de la resina se lleva a cabo utilizando TFA y los
28
“scavengers” respectivos, sin embargo la estrategia Fmoc permite realizar rápidamente
controles de síntesis, por lo cual es preferida para monitoreo en secuencias difíciles.
SÍNTESIS DE PSEUDOPÉPTIDOS
El objetivo en el diseño de pseudopéptidos o péptidos miméticos es mejorar la estabilidad
respecto al péptido nativo, las modificaciones que se pueden realizar son amplias,71
sin
embargo el enfoque de este trabajo es específicamente la modificación del enlace peptídico.
Si se sustituye el átomo de oxígeno del carbono carboxílico del enlace peptídico por dos
átomos de hidrógeno (Figura 12), se obtiene un pseudopéptido amida reducida, el cual es de
interés para este proyecto.
..
H
O
NN
O
.H2C
O
NH.
R1
R2H
..
H
NN
O
.H2C
O
NH.
R1
R2H
Enlace amida (CO-NH)
Enlace amida reducido CH2-NH)
Figura 12. Diferencias entre enlace amida y enlace amida reducida en un pseudopéptido
El carácter griego Psi (Ψ) representa a la expresión pseudo, las moléculas
con esta modificación se denominan pseudopéptidos
Para realizar las modificaciones, es necesario contar con α amino aldehídos como se
muestra en la Figura 13, la síntesis se realiza mediante la protección con O,N-
dimetilhidroxilamina formando así el derivado N,O-dimetilcarboxamida como se muestra
en la Figura 13(2). Posteriormente, la N,O-dimetilcarboxamida se trata con LiAlH4 a 10 °C,
para producir la sal de litio Figura 13(3), esta se hidroliza en medio ácido a temperatura
ambiente (TA) para dar lugar a la formación del N-t-Boc-α-amino aldehído Figura 13(4).
29
Figura 13. Reacciones químicas para la obtención de aminoaldehído a partir de aminoácidos
Tomado de: Revista Colombiana de Química72
Las reacciones químicas necesarias para realizar la modificación del enlace peptídico amida
reducido Ψ[CH2-NH] se lleva a cabo mediante aminación reductiva in situ, luego de la
condensación del grupo aldehído (4) y el grupo amino libre Figura 14.5.
Figura 14. Síntesis en fase sólida de pseudopéptidos amina reducida
Tomado de: Revista Colombiana de Química63
30
MECANISMO DE LA REACCIÓN QUÍMICA EN LA OBTENCIÓN DEL ENLACE
AMIDA REDUCIDO.
La reacción de acople entre el aminoaldehído y el grupo amino del último residuo de la
cadena peptídica, se realiza en etapas que involucran diferentes pasos de reacción.73
En la
Figura 15 se esquematiza el mecanismo de reacción entre la función aldehído y la función
mina de las moléculas involucradas.
Figura 15. Mecanismo de la reaccion química para la obtención de un enlace amida reducido
partiendo de un aldehído y una amina.73
31
MÉTODOS PARA EL ESTUDIO DE COMPUESTOS ANTIMICROBIANOS
Determinar la sensibilidad de los microorganismos a los antimicrobianos es una de las
funciones más importantes de los laboratorios de microbiología. Su realización se basa en
pruebas de sensibilidad, cuyo principal objetivo es evaluar en el laboratorio la respuesta de
un microorganismo a uno o varios antimicrobianos, de esta forma se obtiene una primera
aproximación como factor predictivo de la eficacia clínica.
ANTIBIOGRAMA
El antibiograma disco-placa basado en el trabajo de Bauer, Kirby y colaboradores,74
es uno
de los métodos que el National Committee for Clinical Laboratory Standards (NCCLS)
recomienda para la determinación de la sensibilidad bacteriana a los antimicrobianos. El
antibiograma disco-placa consiste en depositar en la superficie de agar de una placa de petri
previamente inoculada con el microorganismo, discos de papel secante impregnados con
los diferentes antibióticos.
Figura 16. Ensayo de difusión radial mostrando halos de inhibición.
Tan pronto el disco impregnado de antibiótico se pone en contacto con la superficie
húmeda del agar, el filtro absorbe agua y el antibiótico se difunde formándose un gradiente
de concentración. Transcurridas 18-24 horas de incubación los discos aparecen rodeados
por una zona de inhibición. La concentración de antibiótico en la interface entre bacterias
en crecimiento y bacterias inhibidas se conoce como concentración crítica y se aproxima a
32
la concentración mínima inhibitoria (CMI o MIC por sus siglas en inglés, Minimum
Inhibitory Concentration) obtenida por métodos de dilución. Sin embargo, los métodos
disco-placa no permiten una lectura directa del valor de la CMI. La lectura de los halos de
inhibición para antibióticos ampliamente usados debe interpretarse según las categorías
establecidas por la NCCLS,75
una variante de la técnica consiste en abrir pozos en el agar
para colocar el antimicrobiano solubilizado (Figura 16).
DETERMINACIÓN DE LA CONCENTRACIÓN MÍNIMA INHIBITORIA
La cuantificación de la actividad in vitro de los antimicrobianos se evalúa habitualmente
mediante alguna de las variantes de los métodos de dilución. Estos métodos se basan en la
determinación del crecimiento del microorganismo en presencia de concentraciones
crecientes del antimicrobiano que se encuentra diluido en el medio de cultivo (caldo o
agar).
Las primeras determinaciones se realizaron empleando bacterias en tubos con caldo de
cultivo y un rango determinado de antimicrobiano (macro dilución). Esta metodología es
muy engorrosa por la manipulación y cantidad de material necesario para su realización. La
aparición de un sistema de inoculación múltiple para placas de agar popularizó el método
de dilución en agar, en el que cada placa, con una cierta concentración de antimicrobiano,
permite inocular simultáneamente un gran número de microorganismos. La utilización de
micro pipetas y de placas de micro titulación facilitó la utilización del método de micro
dilución con caldo. En la actualidad se han popularizado los métodos automatizados
comerciales de micro dilución en caldo, fácilmente integrables en sistemas
semiautomáticos de lectura e interpretación de resultados.
Tradicionalmente estos métodos se han venido usando para la determinación de la
concentración mínima inhibitoria (CMI), la concentración mínima bactericida (CMB) y la
concentración inhibitoria cincuenta (CI50) de los antimicrobianos. En la mayoría de los
casos se preparan diluciones de este en progresión geométrica en base dos, utilizando un
medio de cultivo adecuado. Posteriormente se inocula dicho medio y tras la incubación se
mide el crecimiento del microorganismo, de esta manera se puede determinar la
concentración que causa la inhibición del crecimiento del microorganismo como se muestra
33
en la Figura 17, también es posible determinar la CI50 del compuesto (concentración a la
que el número de células se ha reducido a la mitad respecto a un control sin tratamiento) y
si se realiza un subcultivo sin antimicrobiano de los medios sembrados previamente puede
determinarse la actividad bactericida.
Figura 17. Determinación de CMI, CMB.
Adaptado de: http://www.animalhealth.bayer.com/ 5236.0.html
CMB: Es la mínima concentración de un
fármaco que mata el microorganismo
CMI: Es la mínima concentración de un
fármaco que inhibe el crecimiento del
microorganismo
CMI, no hay
crecimiento
visible
No hay crecimiento
con un subcultivo.
CMB : 16µL
Tubos con incremento en el fármaco y cantidad de células
constante.
Cultivo del
microorganismo
Crecimiento del
microorganismo
34
OBJETIVOS
OBJETIVO GENERAL
Evaluar los posibles cambios en la actividad antimicrobiana, inducidos por
modificaciones químicas de los enlaces amida, de péptidos sintéticos derivados de
la región C-terminal de la protamina.
OBJETIVOS ESPECÍFICOS
Diseñar y sintetizar pseudopéptidos amida reducida, análogos del fragmento C-
terminal de la protamina.
Determinar la estabilidad de las moléculas obtenidas frente a suero normal humano.
Establecer el espectro de la actividad antimicrobiana in vitro de los pseudopéptidos
frente a Plasmodium falciparum, cepas de bacterias Gram positivas, Gram negativas
y determinar la posible actividad hemolítica.
Caracterizar estructuralmente los pseudopéptidos que presentan cambios
significativos de actividad antimicrobiana respecto al péptido nativo.
35
HIPÓTESIS DE TRABAJO
Las modificaciones del enlace amida en regiones discretas del péptido proveniente de la
región C-terminal de la protamina, pueden modular la actividad antimicrobiana y
antiplasmódica respecto al péptido nativo no modificado.
36
CAPÍTULO 1
DISEÑO, SÍNTESIS Y CARACTERIZACIÓN DE LOS
PSEUDOPÉPTIDOS
DISEÑO DE LOS PSEUDOPÉPTIDOS
Se diseñaron trece pseudopéptidos análogos utilizando como base la secuencia del péptido
2077 (VSRRRRRRGGRRRR) derivado de la región C terminal de la protamina,
modificando a lo largo de la secuencia cada uno de los enlaces peptídicos [CO-NH] por los
enlaces metilen-amina o amida reducido [CH2NH] como se muestra en la Tabla 1, donde
los residuos subrayados indican el sitio de modificación.
RESULTADOS
Tabla 1. Números de identificación y números de equivalencia del péptido nativo y los diferentes
pseudopéptidos.
N° de
Identificación
N° de
Equivalencia Secuencia
2077 20 VSRRRRRRGGRRRR
38807 13 VSRRRRRRGGRRR[CH2]R
38808 12 VSRRRRRRGGRR[CH2]RR
38809 11 VSRRRRRRGGR[CH2]RRR
38810 10 VSRRRRRRGG[CH2]RRRR
38811 9 VSRRRRRRG[CH2]GRRRR
38812 8 VSRRRRRR[CH2]GGRRRR
38813 7 VSRRRRR[CH2]RGGRRRR
38814 6 VSRRRR[CH2]RRGGRRRR
38815 5 VSRRR[CH2]RRRGGRRRR
38816 4 VSRR[CH2]RRRRGGRRRR
38817 3 VSR[CH2]RRRRRGGRRRR
38818 2 VS[CH2]RRRRRRGGRRRR
38819 1 V[CH2]SRRRRRRGGRRRR
37
A cada molécula se le asignó un número de identificación (ver Tabla 1 columna izquierda)
con el que se registró en la peptidoteca de la Fundación Instituto de Inmunología de
Colombia (FIDIC). Cada pseudopéptido tiene un número de equivalencia que coincide con
el número del aminoácido (contando de izquierda a derecha). en el cual se realizó la
modificación. Cuando los pseudopéptidos fueron sintetizados una segunda vez, se le
adicionó al número el sufijo (1), ejemplo: 20(1).
SÍNTESIS DE AMINOALDEHÍDOS PARTIENDO DE LOS RESPECTIVOS
AMINOÁCIDOS t-BOC
Se prepararon los α-N-t-Boc- aminoaldehídos derivados de los aminoácidos comerciales
protegidos α-N-t-Boc en dos etapas, empleando para ello estrategias de síntesis en fase
líquida. Inicialmente los α-N-t-Boc-aminoácidos se transformaron a sus correspondientes
O,N-dimetilcarboxamidas, las cuales se trataron posteriormente con hidruro de litio y
aluminio (LiAIH4) para producir su correspondiente aldehído.76
RESULTADOS
Los α-N-t-Boc amino aldehídos Valina (Val), Serina (Ser), Arginina (Arg) y Glicina (Gly),
fueron suministrados y sintetizados por el grupo funcional de Biocatálisis de la FIDIC.
El amino aldehído α-N-Fmoc-Gly, fue preparado y caracterizado mediante cromatografía
en capa delgada (TLC por sus sigla en inglés Thin Layer Chromatography) y
espectroscopía infrarroja, el producto de partida (aminoácido), intermediario (O,N-
dimetilcarboxamida) y producto final (amino aldehído) coincidieron en la mayoría de las
señales con las del grupo carboxilo del correspondiente derivado α-N-t-Boc-Gly, el cual
cuenta con caracterización mediante resonancia magnética nuclear protónica (RMN´H),
TLC y espectroscopía infrarroja. Los espectros infrarrojos muestran las señales
características para cada una de las especies formadas teniendo en cuenta el grupo
funcional (ácido carboxílico) sometido a modificaciones. En el caso de los aminoácidos
(Figura 18A) encontramos las señales características de estiramiento del oxígeno divalente
presente en los ácidos carboxílicos saturados, C=O entre 1700 y 1725 cm-1
. En la N,O-
dimetilcarboxamida (Figura 18B) la señal del carbono carbonílico presenta un
desplazamiento hacia 1650 cm-1
y finalmente para el aldehído (Figura 18C) tenemos un
38
desplazamiento de la señal entre 1720 y 1740 cm-1
corroborándose la función aldehído con
la aparición de la banda cercana a 2900 cm-1
que corresponde al alargamiento del enlace del
hidrógeno carbono carbonílico involucrado en la función aldehído.
A)
B)
C)
Figura 18. Espectros de infrarojo en la obtención del aminoaldehído Fmoc Gly y su analogo t-Boc.
A) Espectros IR de los aminoácidos t-Boc-Gly y Fmoc-Gly,
B) Espectros IR de las N, O-dimetilcarboxamidas t-Boc-Gly y Fmoc-Gly.
C) Espectros IR de los aminoaldehídos t-Boc-Gly y Fmoc-Gly.
t-BOC GLY 0
1710
Fmoc GLY 0
1650
1725
2900
1720
2850
900
1650
1715
39
SÍNTESIS Y CARACTERIZACIÓN DE LOS PSEUDOPÉPTIDOS
SÍNTESIS
Los pseudopéptidos se obtuvieron por síntesis química en fase sólida por el método descrito
por Merrifield,77
siguiendo la estrategia t-Boc en bolsas de polipropileno,78
cuando no fue
posible obtener las moléculas deseadas, se utilizó la estrategia Fmoc.79
Las reacciones de acople de los aminoácidos se realizaron a temperatura ambiente durante
una hora. Para esto se activó el grupo carboxilo del correspondiente aminoácido con N,N'-
diciclohexilcarbodiimida (DCC) y 1-hidroxibenzotriazol (HOBt) en una relación molar
1:1:1 usando DMF o DCM como solvente, esta mezcla se colocó en una proporción 5:1
respecto a la sustitución de la resina.
Los acoples se verificaron mediante la prueba cualitativa de Kaiser,80
el grupo t-Boc se
eliminó con TFA 37,5 % durante treinta minutos en DCM y se neutralizó la sal formada del
péptido con Dii sopropíl etil amina (DIEA) al 5 % en DCM.
Para realizar la modificación del enlace amida, el aminoaldehído se solubilizó en DMF que
contenía ácido acético al 1%, esta solución se adicionó en una proporción 5:1 sobre la
resina péptido, permitiendo la reacción durante una hora. Se continuó con la reducción del
enlace imina usando cianoborohidruro de sodio (NaBH3CN), el seguimiento de la reacción
se realizó mediante la prueba cualitativa de Kaiser. La eliminación de los grupos
protectores de las cadenas laterales y el desanclaje del pseudopéptido-resina se realizó
siguiendo procedimiento “Alto-Bajo” con HF en presencia de para-cresol usado como
“scavenger”.81,82
La extracción de los pseudopéptidos de la resina se realizó con TFA al 100%,
posteriormente con éter dietílico se precipitó, lavó y finalmente se secó al vacío.
En el caso de los pseudopéptidos Fmoc, se utilizaron reactores individuales y se
desprotegió el grupo Fmoc con piperidina al 50% en DMF, el acople del aminoaldehído se
realizó de la misma forma descrita en la estrategia t-Boc, el desanclaje de los controles de
los pseudopéptidos se realizó mediante TFA: Triisopropilsilano (TIS): H2O, en
proporciones 95:2,5:2,5 seguido de la precipitación y lavado con éter frio.
40
CARACTERIZACIÓN
El análisis de las moléculas se llevó a cabo mediante cromatografía líquida de alta
eficiencia en fase reversa (HPLC por sus siglas en inglés, High-Performance Liquid
Chromatography), utilizando una columna C18 marca VIDAC (250 x 4 mm, tamaño
partícula 5µm ) con un gradiente de acetonitrilo 0%-70% en 45min (flujo de 1mL/min, Δ
1.55) en un equipo Merck Hitachi L-6200 con detector UV-VIS L-4250.
Para identificar cada pseudopéptido se registraron espectros de masas empleando un equipo
de espectrometría de masas MALDI-TOF marca Bruker Daltonics Microflex. Los
experimentos MALDI (Matrix Assisted Laser Desorption Ionization.) se realizarán usando
la técnica TOF (Time of Flight.), con la matriz ácido alfa-ciano-4-hidroxi cinámico en una
relación a 18:2,5 respecto a la muestra.
RESULTADOS
Tabla 2. Comportamiento de los pseudopéptidos sintetizados por la estrategia t-Boc, cada color identifica
péptidos con características similares analizados mediante HPLC y espectrometría de masas.
N° de
Equivalencia Secuencia
Ciclos necesarios para
introducir la modificación
20 VSRRRRRRGGRRRR 0
13 VSRRRRRRGGRRR[CH2]R 6
12 VSRRRRRRGGRR[CH2]RR 6
11 VSRRRRRRGGR[CH2]RRR 8
10 VSRRRRRRGG[CH2]RRRR 14
9 VSRRRRRRG[CH2]GRRRR 14
8 VSRRRRRR[CH2]GGRRRR 15
7 VSRRRRR[CH2]RGGRRRR 6
6 VSRRRR[CH2]RRGGRRRR 8
5 VSRRR[CH2]RRRGGRRRR 6
4 VSRR[CH2]RRRRGGRRRR 6
3 VSR[CH2]RRRRRGGRRRR 6
2 VS[CH2]RRRRRRGGRRRR 8
1 V[CH2]SRRRRRRGGRRRR 6
En la Tabla 2, se puede observar el número de ciclos necesarios para introducir el amino
aldehído o modificación, los colores indican comportamientos similares en cuanto a la
41
caracterización tanto por HPLC como por espectrometría de masas MALDI-TOF (ver
Anexo I).
PRIMERA SÍNTESIS ESTRATEGIA t-BOC
Figura 19. Espectro de masas y cromatografía del péptido 20.1 crudo (péptido nativo).
En todos los ensayos se sintetizó el péptido nativo usado como control de síntesis (péptido
20). Como se puede observar en la Figura 19 (cromatograma) existe un pico principal con
un tiempo de retención de 14.32 min correspondiente a la especie esperada que presenta, en
el espectro de masas, una relación m/z de 1879,406 concordando con el cálculo teórico
obtenido de la suma de los residuos de aminoácidos correspondientes a la secuencia
peptídica VSRRRRRRGGRRRR (1879.18 umas), este cálculo se realizó con el programa
en línea “Peptide Mass Calculator”,83 la salida del programa se observa a continuación.
Secuencia de entrada (VSRRRRRRGGRRRR)
Salida del programa (expresado en unidades de masa atómica):
Mass 1879.18 (av.) 1878.17 (mono.)
Length 14 C-term amide
42
Síntesis de los Pseudopéptidos 1, 2, 3, 4, 5, 6, 7 (Color azul Tabla 2)
Todos los pseudopéptidos de este grupo presentaron un pico principal en su perfil
cromatográfico (ver Anexo I) con tiempos de retención ligeramente más altos respecto al
péptido nativo oscilando entre 14.5 y 15.5 min, cada uno fue analizado mediante
espectrometría de masas y se observó que corresponden a la especie esperada con una señal
promedio de 1865 m/z, (Figura 20) correspondiente a la diferencia de -14 m/z respecto al
péptido nativo, debido a la modificación. [Pérdida de un oxigeno (-16) y adición de dos
hidrógenos(+2) en el cambio del enlace amida a amida reducido].
Figura 20. Espectro de masas y cromatografía del pseudopéptido 7 (pseudopéptido crudo)
Representativo de los pseudopéptidos color azul, la señal esperada es de 1865 m/z, la experimental es de
1864.005 m/z, esta diferencia de aproximadamente 1 m/z es vista como una descalibración del equipo,
aceptado para moléculas de este tamaño sin superar el 0.002% de error.
Síntesis de los Pseudopéptidos 8, 9 y 10 (Color Rojo Tabla 2)
Mediante análisis cromatográfico estos pseudopéptidos mostraron dos picos con
intensidades similares, al dividirlos y ser analizados por espectrometría de masas se
comprobó para el pseudopéptido 8 que la especie esperada 1865 m/z era minoritaria, para
los pseudopéptidos 9 y 10 se observó que predominaban dos especies una para cada pico
correspondientes a la deleción de glicina modificada (Figura 21, color rojo) -42 m/z en el
43
primer pico y + 113 m/z (color amarillo) correspondiente a dos terbutilaciones (+56 m/z
c/u) en el segundo pico.
Figura 21. Espectro de masas y cromatografía de los pseudopéptido 8, 9 y 10
(pseudopéptidos color rojo).
Síntesis de los pseudopéptidos 11 ,12 y 13. (Color verde Tabla 2)
Estos pseudopéptidos presentaron un perfil cromatográfico similar con un hombro posterior
al pico principal (Figura 22), el espectro de masas mostró la existencia de una especie
predominante con una señal de 1965 m/z correspondiente a un valor de +100 m/z respecto a
la especie esperada.
Figura 22. Espectro de masas y cromatografía del pseudopéptido 12
(representativo de los pseudopéptidos color verde)
44
SEGUNDA SÍNTESIS ESTRATEGIA t-BOC
Síntesis de los pseudopéptidos con problemas (Verdes y rojos Tabla 2)
Se sintetizaron nuevamente los pseudopéptidos que presentaron inconvenientes mejorando
las condiciones de desanclaje de la resina, en esta oportunidad se agregó el doble de
cantidad de “scavenger” registrándose una mejora en los perfiles cromatográficos y
espectros de masas de moléculas.
Se observó mediante identificación por espectrometría de masas las especies esperadas en
más de un 90% según análisis cromatográfico, excepto para los pseudopéptidos 8.(1) 9.(1)
y 10.(1) (ver Anexo II).
Pseudopéptidos 8.(1), 9.(1) y 10.(1) segunda síntesis (Pseudopéptidos que presentaron
deleción)
Mediante el análisis cromatográfico y de espectrometría de masas se pudo comprobar que
el pseudopéptido 8.(1), presentó una proporción inferior al 20% de la especie esperada. Los
pseudopéptidos 9.(1) y 10.(1) en la segunda síntesis presentaron un perfil cromatográfico
similar entre sí, mostrando un pico principal correspondiente a la deleción de la glicina
modificada -42 m/z, y disminuyendo considerablemente el pico cromatográfico
correspondiente a +113 m/z como se puede ver en la Figura 23, concluyendo que la
modificación puede verse afectada por el tipo de estrategia usada (química ácida t-Boc), por
lo cual se sintetizaron nuevamente los pseudopéptidos mediante estrategia F-moc.
Figura 23. Espectro de masas y cromatografía de los pseudopéptidos 8.(1), 9.(1) y 10(1).
45
TERCERA SÍNTESIS ESTRATEGIA F-MOC
Síntesis de los Pseudopéptidos 8, 9 y 10 (Pseudopéptidos que presentaron
inconvenientes en las dos síntesis anteriores).
Se sintetizaron los pseudopéptidos mediante la estrategia Fmoc e inmediatamente después
de la introducción de la modificación, se realizó un control de síntesis donde se evidenció la
deleción de la glicina modificada, fenómeno similar al observado en la síntesis t-Boc, por lo
cual la síntesis no se llevó a término. Se determina que la introducción del amino aldehído
glicina y arginina acoplado después de una glicina, es un proceso complejo que necesita ser
analizado con mayor detalle; sin embargo, se decide trabajar con estas tres moléculas
provenientes de la segunda síntesis para observar su comportamiento en los ensayos de
actividad.
46
CAPÍTULO 2
ENSAYOS DE ACTIVIDAD
ENSAYOS DE ESTABILIDAD MOLECULAR FRENTE A SUERO NORMAL HUMANO
(SNH)
Este ensayo se realiza para evaluar la estabilidad relativa de los péptidos modificados frente
a la actividad de proteasas del suero humano. Para tal fin, se implementó el método para
determinar la estabilidad de los pseudopéptidos mediante espectrometría de masas MALDI-
TOF el cual hace uso de la técnica adición de patrón interno, para estos experimentos se
utilizaron los mismos equipos y técnicas descritas para la obtención de los espectros de
masas.
Correlación de la intensidad respecto a la concentración mediante el uso de patrón
interno.
Con el pseudopéptido 1, se realizaron diluciones seriadas con PBS a pH 7.3 partiendo de
una concentración de 1mg/mL, cada dilución se mezcló en proporción 1:1 con el péptido
20, el cual se encontraba disuelto en TFA al 0.1%. a una concentración de 1mg/mL, las
muestras fueron leídas por espectrometría de masas realizando 200 disparos por muestra, la
intensidad del láser se ajustó para poder observar la señal del pseudopéptido a la mayor
concentración. La intensidad de la señal del pseudopéptido leído por masas se dividió por la
intensidad de la señal del péptido 20 usado como patrón interno (Figura 24), dicha relación
se graficó vs la concentración del pseudopéptido (Figura 25). La misma relación se aplicó
usando las áreas de las señales obteniendo resultados similares.
RESULTADOS
Interferencias por el suero humano en la lectura del espectro de masas.
Comprobada la relación de la respuesta vs la concentración, se realizó un ensayo para
determinar el grado de interferencia ejercido por el suero humano en las lecturas, en este
caso se aumentó la cantidad de diluciones del pseudopéptido 1 y se utilizó una
concentración diez veces menor 0.1 mg/mL de péptido 20 (patrón interno).
47
Como se observa en la Figura 26, la tendencia se mantiene y la lectura en los espectros se
pudo realizar sin interferencias.
Figura 24. Proporcionalidad de las intensidades respecto a la concentración en los espectros de masas.
(a medida que disminuye la concentración del pseudopéptido 1, la relación de las señales disminuye aún
cuando los valores y la escala de intensidades no es la misma para los diferentes espectros)
Figura 25. Respuesta de las intensidades relativas mediante espectrometría de masas vs concentración.
Gráfica log-log de la relación de las intensidades (pseudopéptido/ patrón interno) vs concentración.
y = 0,5621x + 0,5118 R² = 0,9687
-1,8
-1,6
-1,4
-1,2
-1
-0,8
-0,6
-0,4
-0,2
0
0,2
-4 -3,5 -3 -2,5 -2 -1,5 -1 -0,5 0
Log-
Inte
nsi
dad
rel
ativ
a (U
.A)
Log-Concentración (mg/mL)
Relación entre intesidad relativa y concentración
48
Figura 26. Confirmación de la tendencia con adición de SNH
Una vez comprobado que el suero no afectaba la tendencia y no presentaba interferencia en
la lectura, se realizó el ensayo de estabilidad de pseudopéptido 1 frente al suero humano de
la siguiente manera: 100µL de pseudopéptido a una concentración de 1 mg/mL, se
incubaron con 100µL de suero humano a un pH 7,3 en tampón fosfato salino (PBS),
posteriormente a intervalos de tiempo se tomaba una alícuota de 10µL de la mezcla de
reacción a la que se adicionaba 10µL de solución de TFA a 0,1% donde se encontraba
disuelto el péptido 20 a una concentración de 1mg/mL, esta mezcla fue analizada por
espectrometría de masas y graficada vs el tiempo de toma de la muestra (Figura 27).
Figura 27. Estabilidad del pseudopéptido 1 incubado con SNH al 100%.
y = 0,9847x + 1,8571 R² = 0,9812
-2
-1
0
1
2
-3,5 -3 -2,5 -2 -1,5 -1 -0,5 0
Log-
Inte
nsi
dad
rel
ativ
a (U
.A)
Log-Concentración (mg/mL)
Relación entre intesidad relativa y concentración con adición SNH
0
0,1
0,2
0,3
0,4
0,5
0,6
0 50 100 150 200
señ
al p
seu
pé
pti
do
/se
ñal
p
atro
n in
tern
o
Tiempo min.
Ensayo estabilidad pseudopéptido 1
49
Figura 28. Estabilidad del pseudopéptido 1 frente a SNH al 50%, lecturas cada 5 min.
Tabla 3. Tiempo de vida media de cada uno de los pseudopéptidos ensayados.
Número alterno Secuencia Tiempo de vida media (min)
20(2) VSRRRRRRGGRRRR < 5
13(1) VSRRRRRRGGRRR[CH2]R 10
12.(1) VSRRRRRRGGRR[CH2]RR 14
11.(1) VSRRRRRRGGR[CH2]RRR 14
10.(1) Deleción de Gly VSRRRRRRGG[CH2]RRRR 25
9(1) Deleción de Gly VSRRRRRRG[CH2]GRRRR 7
8(1) Varias especies VSRRRRRR[CH2]GGRRRR < 5
(7) VSRRRRR[CH2]RGGRRRR 24
(6) VSRRRR[CH2]RRGGRRRR 12
(5) VSRRR[CH2]RRRGGRRRR 50
(4) VSRR[CH2]RRRRGGRRRR 45
(3) VSR[CH2]RRRRRGGRRRR 22
(2) VS[CH2]RRRRRRGGRRRR 20
(1) V[CH2]SRRRRRRGGRRRR 55
Al observar la velocidad en que disminuye la concentración de pseudopéptido (Figura 27),
se optó por disminuir la concentración de suero humano al 50% y hacer muestreos cada 5
min con el fin de obtener gráficas de estabilidad con mayor número de datos (Figura 28).
0
0,2
0,4
0,6
0,8
1
0 20 40 60 80 100
señ
al p
seu
pé
pti
do
/se
ñal
p
atro
n in
tern
o
Tiempo min.
Ensayo estabilidad Pseudopéptido 1
50
Una vez establecidas las condiciones para monitorear la concentración del pseudopéptido
durante su incubación con suero humano al 50 %, (0,3 g/mL proteina total) se procedió a
montar el ensayo para los pseudopéptidos faltantes para calcular el tiempo de vida media de
cada uno, definido como el tiempo necesario para que la concentración de pseudopéptido
llegue la mitad de la concentracion inicial.
Como se puede observar en la Tabla 3 los pseudopéptidos presentaron rangos de vida
media diferentes dependiendo del lugar de la modificación, se destacan con mayor tiempo
de vida media, las moléculas 1, 4 y 5 aumentando aproximadamente 10 veces respecto al
péptido nativo.
ENSAYOS DE ACTIVIDAD ANTIMICROBIANA
Las siguientes son las cepas Gram positivas y Gram negativas que se utilizaron para
comprobar la susceptibilidad a los pseudopéptidos sintéticos.
Gram-positivas:
Staphylococcus aureus (ATCC 6538), Enterococcus faecalis (ATCC 29212), Streptococcus
mutans (ATCC 25175)
Gram-negativas:
Escherichia coli (ATCC 25922), Salmonella typhimurium (14028s) y sus modificados
genéticamente phoP S.typhimurium (MS7953), pcgL S. typhimurium (EG10627).
ENSAYO DE SENSIBILIDAD BACTERIANA
Los ensayos de sensibilidad bacteriana se llevaron a cabo mediante la técnica de difusión
radial (antibiograma) utilizando 4x107 UFC (Unidades formadoras de colonias) de bacterias
en 15 mL de medio con baja concentración de nutrientes, este se preparó con 10 g de
agarosa de baja electro endósmosis (Sigma Chem. Co., St. Louis, MO, EE.UU.), 0,02%
(v/v), Tween-20 (Merck, Darmstadt, Alemania) y 0,3 g TSB (Laboratorios Difco, Detroit,
MI, EE.UU.) en un volumen final de un litro, este se vertió en cajas de Petri dejándose
solidificar, luego se abrieron pozos con ayuda de capilares estériles para colocar de 2-25 µL
de cada uno de los pseudopéptidos y los antibióticos a ensayar (kanamicina, tetraciclina,
ampicilina) a una concentración de 1mg/mL,61 escogidos de acuerdo a la susceptibilidad de
las cepas, posteriormente se incubaron durante treinta minutos a 37°C para permitir la
51
difusión y se cubrieron con un medio de alta concentración de nutrientes compuesto de 20 g
de agar-agar (Difco Laboratorios, Detroit, EE.UU. MI,), 0,02% (v/v) de Tween-20 (Merck,
Darmstadt, Germany) y 10 g TSB (caldo tríptico de soya, por sus siglas en inglés
Trypticase Soy Broth) tampón fosfato salino (PBS), pH 7,2-7,4, en un volumen final de 1
litro, los halos de inhibición fueron medidos después de 24 horas.
RESULTADOS
Bacterias Gram Positivas
Las cepas fueron susceptibles al antibiótico tetraciclina, se usaron tres cantidades de 2, 5 y
10 µg , sin embargo los resultados más concluyentes se obtuvieron a 2 µg de pseudopéptido
(ver Anexo III). Las gráficas muestran los valores de los halos de inhibición cuyos
resultados se reportaron como unidades de actividad (UA), de acuerdo a la relación que
establece que 1 unidad de actividad es igual a 0,1 mm del halo de inhibición.68
Staphylococcus aureus (ATCC 6538): Se observa que esta cepa es ligeramente sensible a
kanamicina, el péptido 20 no presenta actividad a 2 µg respecto a lo que puede observarse
para la protamina, el pseudopéptido 12.(1) se destaca con la mayor actividad en las
moléculas ensayadas. (Figura 29A)
Enterococcus faecalis (ATCC 29212): Esta cepa es resistente a ampicilina y kanamicina,
en este ensayo se observa actividad moderada para la protamina y en menor grado para el
péptido 20, se destacan con una actividad similar a la protamina los pseudopéptidos
9.(1),10.(1) y 11.(1). (Figura 29B)
Streptococcus mutans (ATCC 25175): En este ensayo es la cepa con mayor susceptibilidad
a tetraciclina, presenta resistencia a ampicilina, kanamicina, también al péptido 20 y la
protamina. La mayoría de los péptidos presentan bajaactividad, perosin embargo se destaca
el pseudopéptido 9.(1) con la actividad más alta a la cantidad usada. (Figura 29C)
52
A).
B).
C).
Figura 29. Resultados de los antibiogramas para bacterias Gram positivas.
a 2 µg. (B) blanco, (A) ampicilina, (K) kanamicina, (T) tetraciclina.
0123456789
B A K T 1 2 3 4 5 6 78
(1)
PR
OTA
MIN
A B A K T9
(1)
10
(1)
11
(1)
12
(1)
13
(1)
20
(2)
PR
OTA
MIN
A
UA
Staphylococcus aureus (ATCC 6538)
02468
10
B A K T 1 2 3 4 5 6 78
(1)
PR
OTA
MIN
A B A K T9
(1)
10
(1)
11
(1)
12
(1)
13
(1)
20
(2)
PR
OTA
MIN
A
UA
Enterococcus faecalis (ATCC 29212)
0123456789
B A K T 1 2 3 4 5 6 78
(1)
PR
OTA
M…
B A K T9
(1)
10
(1)
11
(1)
12
(1)
13
(1)
20
(2)
PR
OTA
M…
UA
Streptococcus mutans ( ATCC 31989)
53
Bacterias Gram negativas
Este tipo de bacterias mostró una respuesta a los pseudopéptidos más variada respecto a
Gram positivas. En este caso se usaron tres cantidades de pseudopéptido 10, 20 y 25µg
(ver Anexo IV). Para Salmonella typhimurium y su modificada pHoP, cantidad que
permitió observar diferencias entre péptidos corresponde a 20 µg, sin embargo para pcgL S.
typhimurium y Eschericha coli la cantidad usada correspondió a 25 µg.
Salmonella typhimurium.(14028s): Esta bacteria es susceptible a tetraciclina, en menor
grado a kanamicina y presenta resistencia a ampicilina, la protamina y el péptido 20
manifiestan actividades similares, en general los pseudopéptidos presentaron un amplio
rango de actividades que se encuentran por debajo de la protamina y por encima de la
kanamicina (Figura 30A).
pHoP S.typhimurium (MS7953): Esta bacteria modificada es susceptible moderadamente
kanamicina y resistente a ampicilina y tetraciclina, la mayoría de pseudopéptidos presentan
actividad antimicrobiana similar a la protamina y el péptido 20, sin embargo se destacan
los pseudopéptidos 2 y 3 con actividad mayor que la kanamicina (Figura 30B).
pcgL S. typhimurium (EG10627): Esta bacteria es resistente a los antibióticos usados y a
la protamina, sin embargo se observa que la mayoría de pseudopéptidos incluyendo el
péptido 20 tienen actividad a excepción de los pseudopéptidos 5 y 7 los cuales no presentan
actividad (Figura 31A).
Eschericha coli: (ATCC 25922): Es una bacteria susceptible a kanamicina, tetraciclina, y
resistente a ampicilina, en la gráfica puede observarse que los pseudopéptidos presentan
una actividad similar a la protamina y al péptido 20, los pseudopéptidos 2, 7 y 9.(1)
presentan mayor actividad que los controles peptídicos (péptido 20 y protamina) y el
pseudopéptido 11 presenta actividad muy pequeña a la cantidad usada. (Figura 31B).
54
A).
B.)
Figura 30. Resultados de los antibiogramas para bacterias Gram negativas a 20 µg
(B) blanco, (A) ampicilina, (K) kanamicina, (T) tetraciclina.
0
2
4
6
8
10
12
B A K T 1 2 3 4 5 6 78
(1)
PR
OTA
MIN
A B A K T9
(1)
10
(1)
11
(1)
12
(1)
13
(1)
20
(2)
PR
OTA
MIN
A
UA
Salmonella typhimurium (14028s)
0
2
4
6
8
10
12
B A K T 1 2 3 4 5 6 78
(1)
PR
OTA
MIN
A B A K T9
(1)
10
(1)
11
(1)
12
(1)
13
(1)
20
(2)
PR
OTA
MIN
A
UA
phoP S.typhimurium (MS7953),
55
A).
B).
Figura 31. Resultados de los antibiogramas para bacterias Gram negativas a 25µg.
(B) blanco, (A) ampicilina, (K) kanamicina, (T) tetraciclina.
0
2
4
6
8
10
12
B A K T 1 2 3 4 5 6 7
8(1
)
PR
OTA
MIN
A B A K T
9(1
)
10
(1)
11
(1)
12
(1)
13
(1)
20
(2)
PR
OTA
MIN
A
UA
pcgL S. typhimurium (EG10627)
02468
1012
B A K T 1 2 3 4 5 6 78
(1)
PR
OTA
MIN
A B A K T9
(1)
10
(1)
11
(1)
12
(1)
13
(1)
20
(2)
PR
OTA
MIN
A
UA
Escherichia coli (ATCC 25922)
56
DETERMINACIÓN DE LA CONCENTRACIÓN INHIBITORIA 50 (CI50)
Este ensayo se llevó a cabo mediante la técnica de micro dilución en caldo siguiendo las
recomendaciones de la NCCLS, con el fin de obtener la concentración mínima inhibitoria
50, las diluciones seriadas de los antibióticos y péptidos se prepararon en placas de cultivo
de 96 pozos con una concentración de partida es de 0,5 mg/mL. De cada dilución se
tomaron 75 µL completando 150 µL con medio nutritivo que contenían las cepas a una
concentración de 1x106 UFC en 5 mL, posteriormente las placas se incubaron a 37°C en
agitación constante, la actividad se cuantificó mediante la lectura de la densidad óptica a
620 nm.
Tabla 4. Valores de CI50 de los pseudopéptidos frente a diferentes cepas bacterianas Gram positivas y Gram
negativas.( rojo y verde respetivamente).
Los resultados corroboran con los antibiogramas los resultados de los pseudopéptidos que
presentaron una alta actividad antimicrobiana (valores en color azul), y los pseudopéptidos
con baja actividad: en Staphylococcus aureus el pseudopéptido 1, para Enterococcus
faecalis los pseudopéptidos 7, 6, 5 para Salmomella typhimurium el pseudopéptidos 8.(1).
Algunos valores (color rojo) no correlacionan con los esperado para los antibiogramas.
57
INHIBICIÓN DE LA INVASIÓN A GLÓBULOS ROJOS POR P. falciparum
Los parásitos P. falciparum de la cepa FCB-2 resistente a cloroquina, se mantienen
en cultivo continuo y sincronizado en la fase de anillo con la técnica de sorbitol.84
Los
glóbulos rojos infectados (parasitemia> 5%) deben ser incubados en RPMI 1640 completo
suplementado con 25 mM buffer HEPES, 1 mg/mL. hipoxantina, 4 mg/mL de gentamicina,
5 U/ mL de penicilina, 2 g/L de glucosa, 5% de NaHCO3 y 10% de plasma O+ hasta que
llegen a la fase de esquizonte.
En placas de 96 pozos que contienen las muestras de péptidos a ensayar se colocan los
eritrocitos infectados y no infectados (volumen final por pozo 100 µL, que contiene
1,5% hematocrito y el 0,3% de parasitemia), las placas se incubaron durante 18 horas a
37°C con 5% de O2, 5% CO2 y 90% en N2, posteriormente se colectan las células por
centrifugación a 150 g durante 10 minutos y 50 µL del sobrenadante se sustituye por 100
µL de hidroetidina a una concentración de 15 µg/mL, a continuación se incuba durante 30
minutos a 37°C y se lavan con PBS, el sedimento se resuspende en 300 µL de PBS y se
cuantifica la parasitemia mediante citometría de flujo. El análisis se realiza con el software
Quest Cell.85
RESULTADOS
La Tabla 5 muestra los porcentajes de inhibición de la invasión a glóbulos rojos teniendo
como referencia un 100% de inhibición (glóbulos rojos sin tratar) y 0% de inhibición
(glóbulos rojos incubados con el parásito).
La mayoría de los pseudopéptidos presenta un nivel de inhibición medio alto, similar al
observado en el péptido 20 usado como control, la excepción es para el pseudopéptido 1
que parece promover la invasión al aumentar la concentración y el pseudopéptido 4 que no
presenta una tendencia definida. Dentro del grupo de moléculas ensayadas se destacan los
pseudopéptidos que presentaron inconvenientes en la síntesis con porcentajes de inhibición
superiores al 70% y se observa con el mayor porcentaje de inhibición 75% a 200 µM el
pseudopéptido 12.(1).
58
Tabla 5. Resultados de los ensayos de invasión de P. falciparum a glóbulos rojos realizados en tres
concentraciones de péptido diferentes 50, 100 y 200 µMolar.
MUESTRA 1 2 3 X SD % INHIBI INV
CO
NT
RO
LE
S
GR 0,05 0,06 0,06 0,06 0,006 100
C+ INVASION 14,79 14,53 14,56 14,63 0,142 0
CloroQ 1/27 (1,85 mg/ml) 2,01 2,03 2,02 2,02 0,010 86
CloroQ 1/54 (0,93 mg/ml) 1,68 1,68 1,73 1,70 0,029 88
EGTA (1,9 mg/ml) 4,07 4,04 3,92 4,01 0,079 73
1 200uM 14,82 15,10 14,90 14,94 0,144 -2
100uM 11,01 11,13 11,03 11,06 0,064 24
50uM 11,03 10,98 11,05 11,02 0,036 25
2 200uM 5,30 5,30 5,28 5,29 0,012 64
100uM 6,32 6,32 6,38 6,34 0,035 57
50uM 6,55 6,53 6,53 6,54 0,012 55
3 200uM 5,18 5,18 5,19 5,18 0,006 65
100uM 6,09 6,03 6,11 6,08 0,042 58
50uM 6,12 6,09 6,06 6,09 0,030 58
4 200uM 8,98 9,10 8,99 9,02 0,067 38
100uM 10,89 10,75 10,86 10,83 0,074 26
50uM 7,81 7,56 7,76 7,71 0,132 47
5 200uM 5,22 5,24 5,20 5,22 0,020 64
100uM 6,81 6,98 6,89 6,89 0,085 53
50uM 7,61 7,68 7,66 7,65 0,036 48
6 200uM 5,51 5,39 5,53 5,48 0,076 63
100uM 6,72 6,84 6,85 6,80 0,072 53
50uM 7,35 7,22 7,23 7,27 0,072 50
7 200uM 5,30 5,32 5,22 5,28 0,053 64
100uM 6,59 6,51 6,45 6,52 0,070 55
50uM 6,80 6,80 6,77 6,79 0,017 54
8.(1) 200uM 4,03 4,12 4,20 4,12 0,085 72
100uM 6,05 6,06 6,14 6,08 0,049 58
50uM 6,71 6,72 6,79 6,74 0,044 54
9.(1) 200uM 3,84 3,78 3,82 3,81 0,031 74
100uM 5,61 5,50 5,57 5,56 0,056 62
50uM 6,18 6,18 6,18 6,18 0,000 58
10.(1) 200uM 4,33 4,41 4,28 4,34 0,066 70
100uM 6,12 6,24 6,03 6,13 0,105 58
50uM 7,17 7,07 7,13 7,12 0,050 51
11.(1) 200uM 4,52 4,65 4,56 4,58 0,067 69
100uM 5,92 5,91 5,96 5,93 0,026 59
50uM 6,98 7,14 6,98 7,03 0,092 52
12.(1) 200uM 3,71 3,73 3,68 3,71 0,025 75
100uM 5,37 5,45 5,47 5,43 0,053 63
50uM 6,13 6,16 6,18 6,16 0,025 58
13.(1) 200uM 4,75 4,66 4,71 4,71 0,045 68
100uM 6,12 6,18 6,18 6,16 0,035 58
50uM 6,91 6,89 6,85 6,88 0,031 53
20.(2) 200uM 5,35 5,45 5,31 5,37 0,072 63
100uM 6,59 6,50 6,53 6,54 0,046 55
50uM 7,33 7,32 7,32 7,32 0,006 50
Protamina 200uM 1,75 1,69 1,74 1,73 0,032 88
100uM 4,92 4,93 4,94 4,93 0,010 66
50uM 4,75 4,72 4,76 4,74 0,021 68
70% - 100% INHIBIDOR FUERTE 10% - 29% INHIBIDOR BAJO
50% - 69% INHIBIDOR MEDIO-ALTO 0% - 9 NO INHIBE
30% - 49% INHIBIDOR MEDIO-BAJO <0% PROMUEVE INVASIÓN
59
ACTIVIDAD HEMOLÍTICA
Este ensayo se realiza con la finalidad de mostrar la citotoxicidad sobre glóbulos rojos
midiendo la cantidad de hemoglobina liberada en caso de existir ruptura de la membrana, el
protocolo presentado fue adaptado por Luisa F. Carreño en el laboratorio de Biocatálisis de
la Fundación Instituto de Inmunología de Colombia. Los eritrocitos de cordero se lavaron
varias veces con solución salina fisiológica (SSF) hasta obtener un sobrenadante traslúcido,
posteriormente se suspendieron en 4 % v/v de solución fisiológica, de la cual se toman 100
µL y se mezclan con 100 µL de solución de pseudopéptido a diferentes concentraciones
durante treinta minutos, posteriormente se centrifugó a 3000 rpm durante 10 min y se leyó
la absorbancia del sobrenadante a una longitud de onda de 405 nm.
RESULTADOS
Figura 32. Porcentaje de hemólisis obtenido para los diferentes pseudopéptidos a 1, 0.5 y 0.25 mg/mL.
Para calcular la actividad hemolítica se utilizó la fórmula:
%Hemólisis = 100*[(A –A0)/(At/A0)]
Siendo:
A= absorbancia de cada una de las muestras
A0= absorbancia de solución fisiológica (0% de hemólisis)
At= absorbancia de tritón X- 100 (usado como 100% de hemólisis)
010
2030
405060
7080
90100
% H
émo
lisis
Tratamiento
Hémolisis producida por los pseudopéptidos
1 mg/ml
0,5mg/ml
0,25mg/ml
60
El 0% de hemólisis se determinó por medio de un blanco con 200 μl de SSF mientras que el
100% de hemólisis correspondió a los glóbulos rojos en presencia de 100 μl de tritón X100
a una dilución de 1/100.
Aun cuando se realizaron ensayos a diferentes concentraciones (diluciones seriadas de
pseudopéptido y antibiótico) los resultados concluyentes se adquirieron en el rango de 1 a
0,25 mg/mL, (ver Anexo VII) en estas concentraciones se observó un efecto hemolítico
considerable de los antibióticos, destacándose la tetraciclina con valores altos y sostenidos,
en la protamina encontramos un máximo de 24 %, el péptido nativo 2077 mostro un efecto
máximo del 8 %, seguido del pseudopéptido 2 con un 4 %, las demás moléculas no
presentaron valores superiores a un 3,5% de hemolisis.
ENSAYO DE CITOTOXICIDAD EN CÉLULAS HT29
Este ensayo se realizó usando la técnica de la reducción in vivo de metil tiazol tetrazolio
(MTT), establecido por Mosmann86
, dicho ensayo fue adaptado en el laboratorio de
Biocatálisis de la Fundación Instituto de Inmunología de Colombia por Yuly Andrea
Guerrero, para realizarlo, se hicieron crecer las células adherentes (HT29) en cajas de
cultivo hasta obtener una confluencia entre células del 96-98%, estas se desprendieron de
las cajas mediante tratamiento con tripsina y se dispensaron en cajas de 96 pozos a razón de
50.000 en cada uno de ellos conservándose en crecimiento durante 24 horas permitiendo su
adherencia, posteriormente se eliminó el medio y se colocaron 100 µL de medio fresco
RPMI al 10 % en SFB y 100 µL de las soluciones a ensayar a diferentes concentraciones,
después de 24 horas se desechó el sobrenadante y se agregaron 100 µL de medio mínimo
(0,15 g de TSB / 500 ml de H20) y 50 µL de MTT (1mg/mL) en solución Buffer (PBS pH
7,2–7,4). Posteriormente se incubaron las células por 4 horas a 37°C para permitir la
formación de cristales de formazán y se disolvieron con 100 µL de alcohol isopropílico
(IPA) determinando la actividad óptica a 570 nm.
La viabilidad se determinó mediante la siguiente fórmula:
Como control positivo se utilizó PBS pH 7,2-7,4, y como control negativo, tritón X-114
(0.5%).
61
RESULTADOS
Figura 33. Citotoxicidad de pseudopéptidos y antibióticos sobre la línea celular HT29.
Las concentraciones que permitieron observar el efecto citotóxico fueron las comprendidas
entre (1-0,25 mg/mL). En este rango observa la variación del efecto citotóxico dependiente
de la concentración en los pseudopéptidos. Puede verse el efecto citotóxico de los
antibióticos siendo mayor para la tetraciclina (similar a el control positivo de citotoxicidad
tritón X100), seguido de la kanamicina y por último sin efecto citotóxico la ampicilina.
Para los pseudopéptidos se observa un comportamiento citotóxico marcado a la
concentración de 1 mg/mL excepto para la protamina y el pseudopéptido 6 que no
presentaron toxicidad a ninguna de las tres concentraciones analizadas, a la concentración
de 0,25 mg/mL, el efecto citotóxico es moderado para las moléculas, variando entre un
65% y un 40%, excepto para los pseudopéptido 13, 6 y 4, y los controles ampicilina,
kanamicina, protamina y péptido 20 los cuales no mostraron toxicidad a esta concentración.
0
10
20
30
40
50
60
70
80
90
100
Via
bili
dad
(%
)
CITOTOXICIDAD EXPRESADA COMO % DE VIABILIDAD EN CÉLULAS HT29
1 mg/ml
0,5mg/ml
0,25mg/ml
62
ANÁLISIS DE PERFILES DE ESTRUCTURA SECUNDARIA
Los ensayos se llevaron a cabo mediante dicroísmo circular (CD) a temperatura ambiente
con un espectropolarímetro Jasco J-810, Los espectros fueron registrados a 25°Celcius en
2,2,2-trifluoroetanol (TFE) al 30% a una concentración final de 0.2mM,87
en un intervalo
de longitud de onda de 190 a 260 nm.
RESULTADOS
Figura 34. Espectros de Dicroísmo circular de los pseudopéptidos,
tomados a 30% en TFE y 25° Celcius.
Como se puede observar en la Figura 34, todos los pseudopéptidos presentan un mismo
tipo de espectro, al ser comparados con los espectro canónicos que representan los
diferentes tipos de estructuras (ver Anexo V) se puede concluir que las moléculas no
presentan una estructura definida (conformación al azar “random coil”) presentando en el
espectro de dicroísmo circular un mínimo intenso característico cerca a la región de 200 nm
y un máximo pequeño en la región comprendida entre 210-220 nm.
Se realizó la deconvolución de los espectros, sin embargo los resultados entre los
programas usados no es concluyente en determinar la contribución de otro tipo de perfiles
de estructura secundaria en las conformaciones de los pseudopéptidos. (VER ANEXO VI).
-190000,00
-140000,00
-90000,00
-40000,00
10000,00
60000,00
190 200 210 220 230 240 250 260
Eli
pti
cid
ad
Mo
lar Ɵ
Longitud de onda (nm)
DC Pseudopéptidos
1
2
3
4
5
6
7
8,1
9,1
10,1
11,1
12,1
13,1
20,1
63
Tabla 6. Resumen de resultados.
1 V[C H 2 ]S R R R R R R GGR R R R 0,48 0 2,39 6,22 2,39 3,83 0,48 -2 2,39 42 55
2 V S [C H 2 ]R R R R R R GGR R R R 0,96 1,44 1,44 5,27 4,79 4,79 0,96 64 3,83 50 20
3 VS R [C H 2 ]R R R R R GGR R R R 0,96 0 0,48 4,79 7,18 2,39 1,91 65 2,34 59 22
4 VS R R [C H 2 ]R R R R GGR R R R 0,96 0,48 1,44 3,83 2,87 4,31 0,48 38 0,58 124 45
5 VS R R R [C H 2 ]R R R GGR R R R 0,96 0 2,39 6,7 2,39 0 0,48 64 1,8 45 50
6 VS R R R R [C H 2 ]R R GGR R R R 0,48 0,48 2,39 5,74 1,91 1,44 0 63 0,86 111 12
7 VS R R R R R [C H 2 ]R GGR R R R 0,48 0 2,87 3,35 0,24 0 0,48 64 1,03 41 24
8.(1) VS R R R R R R [C H 2 ]G GR R R R 0,48 0 2,87 0 0 2,39 0,48 72 0,8 49 5
9.(1) VS R R R R R R G[C H 2 ]G R R R R 0,48 1,91 3,35 5,74 1,91 3,83 3,83 74 1,52 44 7
10.(1) VS R R R R R R G G[C H 2 ]R R R R 0,96 2,39 1,91 4,31 1,91 5,74 0,96 70 3,07 60 25
11.(1) VS R R R R R R GG R [C H 2 ]R R R 0 1,91 1,91 2,87 2,39 4,79 0,96 69 0,92 45 14
12.(1) VS R R R R R R GGR R [C H 2 ] R R 2,87 0,96 2,39 3,35 2,39 3,35 0,48 75 1,49 36 14
13.(1) VS R R R R R R GGR R R [C H 2 ]R 0 0,96 1,91 5,74 2,87 3,83 0,48 68 0,93 125 10
20.(2) VS R R R R R R GGR R R R 2,87 2,39 2,39 7,18 2,39 0,48 0,96 63 8,71 104 5
Protamina P R R R R S S S R P VR R R R R P R
VS R R R R R R GGR R R R 0 1,44 2,39 7,18 2,87 6,7 0,96 88 24,82 93 n/r
A n/a 0 0,48 0 0 0 0 0 n/a 38,85 158 n/a
K n/a 1,44 0 0 4,79 2,87 0 5,27 n/a 48,76 100 n/a
T n/a 6,7 8,62 9,1 9,57 0,48 0 10,53 n/a 93,58 36 n/a
Tie
mpo d
e v
ida
media
p f
alc
iparu
m %
de
inh
ibic
ión
de
invasio
n 2
00u
MSecuencia
Sta
ph
ylo
coccu
s
au
reu
s s
erie
1 (
UA
)
En
terococcu
s
faecalis s
erie
1 (
UA
)
Str
epto
coccu
s
mu
tan
s s
erie
2 (
UA
)
Salm
om
ella
typh
imu
riu
m serie
3
(UA
)
pH
oP
S.typh
imu
riu
m
serie
2 (
UA
) Numeración
alternativa de los
péptidos y
pseudopéptidos
pcgL
S.
typh
imu
riu
m s
erie
3
(UA
)
Esch
eric
ha c
oli(U
A)
Activid
ad h
em
olítica
(0,5
mg/ m
L)
Citoto
xic
idad
célu
las H
T29, %
de
via
bilid
ad a
(
0,5
mg/ m
L)
n/r = no realizado n/a = no aplica A= ampicilina K= kanamicina T= tetraciclina
Bacterias Gram positivas Bacterias Gram negativas
64
DISCUSIÓN
Se conoce muy bien y desde hace mucho tiempo la existencia de secuencias peptídicas
difíciles de sintetizar mediante la química en fase solida propuesta por Merrifield88
, en el
caso de los pseudopéptidos derivados de la protamina encontramos un fenómeno similar, se
observó la imposibilidad de introducir el aminoaldehído derivado de la glicina en dos
residuos diferentes (pseudopéptidos 9 y 10 ) aun cuando se utilizaron las dos estrategias
químicas ampliamente utilizadas para sintetizar péptidos, t-Boc y F-moc, se demostró que
la modificación con este derivado es un proceso complejo, cuando se analizaron los
resultados de la síntesis, se observo claramente la evidencia química de la introducción de
la modificación mediante el test de káiser con una coloración amarilla como se puede
observar en la Figura 35
Test de Kaiser ( Amarillo)No hay aminos libres
Test de Kaiser ( Azul)hay aminos libres si ocurren los dos cortes propuesto en verde
1822.028 (-42) m/z, al terminar el pseudopéptido
Pseudopéptido 10
VSRRRRRRGG[CH2]RRRR
Pseudopéptido 9
VSRRRRRRG[CH2]GRRRR
Figura 35. Posible explicación a las deleciones de Gly en los pseudopeptidos 9 y 10.
Sin embargo al realizar el análisis químico del pseudopéptido terminado, se encontró que la
modificación no se llevó a cabo, sugiriendo que posiblemente la modificación con el
aminoaldehído procedente de la glicina es susceptible a hidrólisis durante la desprotección
65
como se sugiere en la figura 35, donde se muestra con líneas color verde la desprotección
del grupo t-Boc y al mismo tiempo la ruptura del enlace amina resultado de la
modificación, en los dos casos el tets de káiser muestra coloración azul, de esta manera al
terminar la síntesis se contara con una con una masa de 1822 umas correspondiente a la
perdida glicina modificada (-45 umas).
El mismo caso ocurre con la modificación entre la arginina 8 y la glicina 7 correspondiente
al pseudopéptido 8, en este observa la aparición de varias especies tanto de mayor como de
menor peso molecular, este caso es más complejo de analizar, sin embargo podría
especularse una doble acilación en el nitrógeno de la glicina (involucrada en la
modificación) con dos argininas para formar dos cadenas sobre este átomo (Figura 36), lo
cual se vería favorecido por el bajo impedimento estérico que tienen las glicinas al poseer
solo un hidrogeno como cadena lateral, de esta manera se puede elongar durante la síntesis
formando una especie de ramificación la cual concuerda con el mayor peso en el espectro
de masas 2833 m/z, esto explicaría en parte algunos de los mayores pesos observados en el
espectro de masas.
Siguiente acople de A.A.
+2833 m/z al terminar la síntesis
8.
VSRRRRRR[CH2]GGRRRR
Figura 36. Posible explicación a los mayores pesos encontrados en el pseudopeptido 8
66
El valor de +100 obtenido en la primera síntesis (pseudopéptidos color verde) concuerda
con el peso de una alanina, posiblemente corresponda a un error o contaminación durante la
síntesis, ya que se observa en los pseudopéptidos que continuaban en síntesis en un
momento especifico, también podría explicarse por la formación de aductos formados
durante el proceso de clivaje, algo muy común en síntesis t-Boc.
La técnica usada en el laboratorio para determinar la estabilidad de los pseudopéptidos a
extractos enzimáticos es el análisis electroforético mediante tinción con azul de Coomassie
y comparación de la intensidad de las bandas con un software de análisis de imágenes, sin
embargo al tener disponibilidad de un espectrómetro de masas tipo MALDI-TOF, se
decidió montar la técnica mediante este equipo, para realizar el seguimiento del tiempo de
vida media de los pseudopéptidos con el consecuente ahorro de reactivos y tiempo de
análisis. Aun cuando el ensayo en sí es el mismo, la preparación de la muestra para el
análisis es más rápida, fácil y los resultados pueden obtenerse directamente en cuestión de
minutos, con lo cual se demostró que fue posible realizar el seguimiento del tiempo de vida
media de los pseudopéptidos al ser expuestos a la actividad enzimática del SNH, de esta
manera se logró comparar los tiempos de vida media para cada una de las moléculas
sintetizadas respecto al péptido nativo, concluyendo que las modificaciones en las
diferentes regiones del péptido afectan de forma diferencial la estabilidad de los
pseudopéptidos. La modificación realizada en el residuo N terminar (pseudopéptido 1)
aumenta considerablemente la estabilidad de los pseudopéptidos aproximadamente más de
10 veces (tabla 3), indicando el papel que juegan las aminopeptidasas en la degradación de
esta secuencia. El pseudopéptido 5 también mostró un tiempo de vida aproximado de 50
min concluyendo que esta modificación puede ser una diana expuesta para las
endopeptidasas, así que estas modificaciones son las más importantes en miras de aumentar
la estabilidad del la secuencia peptídica, sin embargo es posible modular ampliamente los
tiempos de vida media desde unos 7 min hasta cerca de 60 min. (8.5 veces) dependiendo
del sitio modificado.
Mediante el ensayo de hemolisis se colocó de manifiesto la actividad hemolítica de los
antibióticos, sin embargo los pseudopéptidos presentaron una actividad hemolítica
claramente inferior incluso respecto a la protamina y al péptido nativo 2077, lo cual
67
demuestra que las modificaciones en general colaboran en la disminución del efecto
hemolítico remanente presente en el péptido nativo.
Los ensayos de difusión radial frente a diferentes cepas de bacterias demuestran que la
efectividad de la protamina y de los pseudopéptidos análogos más variada en bacterias
Gram negativas que en Gram positivas. Algunos estudios sugieren un efecto antimicrobiano
de la protamina sobre Gram positivas y tan solo una inhibición del crecimiento en Gram
negativas.89
Aun cuando estos reportes no son del todo comparables con el tipo de
moléculas trabajadas, podrían usarse como indicios en busca de un modelo de acción que
sea similar al de la protamina. La concentraciones óptimas de trabajo que permiten
observar diferencias en el caso de las cepas Gram positivas fueron las más pequeñas,
posiblemente a que a volúmenes mayores se logra un máximo de difusión siendo difícil de
observar diferencias entre moléculas. En el caso de las cepas Gram positivas al volumen de
2 µL se destaca una inhibición apreciable del pseudopéptido 12.(1) frente a Staphylococcus
aureus, 2, 9.(1), 10.(1) y 11.(1) frente a Enterococcus faecalis y 9 frente a Streptococcus
mutans.
En el caso de las cepas Gram negativas se observa una respuesta más variada, encontramos
pseudopéptidos prácticamente sin actividad a las diferentes concentraciones como es el
caso de 8.(1) en Salmonella typhimurium. En las cepas modificadas pHoP y pcgL, se puede
observar que prácticamente todos los péptidos presentan actividad, a excepción de los
pseudopéptidos 5 y 7 en la cepa pcgL; frente a Escherica coli se destacan con mayor
actividad los pseudopéptidos 2, 7 y 9(1). Los datos obtenidos de los valores de CI50 apoyan
ampliamente lo encontrado con los ensayos de difusión radial para los pseudopéptidos
nombrados anteriormente, los datos también están por debajo del rango de las
concentraciones reportadas para la protamina (0,5 y 4 mg/mL)73
en la inhibición de
bacterias Gram positivas y Gram negativas
El efecto sobre la inhibición de Plasmodium falciparum a glóbulos rojos no es tan variado.
Se enfatiza que las moléculas peptídicas 8.(1), 9.(1) y 10.(1) las cuales presentaron
problemas en la síntesis con deleciones de glicina y aparición de varias especies, fueron las
moléculas que presentaron mayores porcentajes de inhibición, indicando que la supresión
de una de las glicinas en el caso de las moléculas 9.(1) y 10.(1) puede aumentar el carácter
68
inhibidor, los pseudopéptidos a resaltar son 12.(1) que presento el mayor valor de
inhibición y el pseudopéptido 1 el cual promueve la invasión a medida que se aumenta la
concentración.
La estructura secundaria encontrada en los pseudopéptidos concuerda con lo reportado en la
literatura para la protamina90
observándose una conformación de tipo al azar, basados en la
superposición de todos los espectros y a la comparación respecto a los espectros canónicos
correspondientes, en este caso la deconvolución no presentan resultados concluyentes
respecto a otro tipo de contribuciones en la estructura, los programas usados SELCON3,
CONTINLL y CDSSTR se basan en una serie de proteínas de estructura conocida para
estimar la estructura secundaria de la proteína problema, sin embargo no trabajan muy bien
con pseudopéptidos que presentan modificaciones químicas como las aquí efectuadas,
puesto que el enlace peptídico presenta un máximo de absorción alrededor de la longitud de
onda 210 nm así que modificaciones en este tipo de enlaces pueden hacer que existan
desplazamientos de los máximos y mínimos y variaciones en las intensidades, ejemplo de
ello está en los efectos batocrómicos alrededor de 10 nm correspondientes a péptidos que
tienen grupos metileno unido al nitrógeno alfa.91
Los péptidos pequeños generalmente
presentan diferentes estructuras secundarias que se encuentran en equilibrio con la
conformación al azar92
tal vez por estas razones no se pudo realizar satisfactoriamente la
deconvolución de los pseudopéptido utilizando los programas clásicos.
Respecto a la citotoxicidad en células HT29 se puede ver un efecto muy marcado en cuanto
a la concentración siendo la mayoría de pseudopéptidos citotóxicos a la concentración de
1 mg/mL, sin embargo el efecto disminuye proporcionalmente con la concentración pero no
varían con la misma velocidad que lo hacen la kanamicina con una citotoxicidad intermedia
entre los antibióticos utilizados, un aspecto importante es la comparativa entre los
diferentes pseudopéptidos, como se puede observar en la Figura 33, la protamina es la
molécula en la que se observa la mayor viabilidad a 0,25 mg/mL seguida por los
pseudopéptidos 13(1), 5, 3 y 20(2). Los pseudopéptido 8(1), 9(1) y 12(1) presentan el
efecto citotóxico más alto a dicha concentración.
Una comparativa del efecto de las modificaciones en los diferentes escenarios ensayados
puede verse en la tabla 6.
69
CONCLUSIONES
1. Se realizaron con éxito las modificaciones del péptido en los diferentes enlaces
amida, sin embargo la síntesis de pseudopéptidos que involucran la inserción del
aminoaldehído proveniente del aminoácido glicina fue un proceso complejo que
necesita ser analizado a fondo.
2. Fue posible determinar la estabilidad de las moléculas en suero normal humano
mediante el uso de espectrometría de masas MALDI-TOF sin necesidad de la
utilización de moléculas marcadas isotópicamente.
3. Se estableció el espectro de actividad de los pseudopéptidos frente a diferentes
microorganismos y se concluye que la mayoría presentan actividad frente a
Plasmodium falciparum excepto para los pseudopéptidos 1 y 4 .
4. La caracterización estructural de los pseudopéptidos sugiere para estos una
conformación al azar tipo “random coil”
5. Las modificaciones en los residuos 1 y 5 contados a partir del extremo amino
terminal aumenta considerablemente el tiempo de vida media de los pseudopéptidos
en más de diez veces respecto al péptido nativo.
6. La modificación de los enlaces amida disminuye en más de un 50 % el valor de
hemólisis producido por el péptido nativo.
7. Es factible usar las modificaciones de los enlaces amida como estrategia en busca
de modular las diferentes características que puede presentar un péptido con
actividad antimicrobiana.
70
RECOMENDACIONES
Se sugiere realizar ensayos de actividad frente a otros tipos de microorganismos como:
hongos y micobacterias con el fin de definir mayor espectro de acción de este tipo de
moléculas.
Se recomienda en futuros trabajos realizar dos o más modificaciones en una misma
molécula con el fin de conseguir una modulación dirigida a diferentes determinantes
moleculares.
71
ANEXO I. ESPECTROS DE MASAS Y CROMATOGRAFÍAS PRIMERA SÍNTESIS
1865
.183
* 1 PSEUDO (PM 1864.14)\0_A2\1\1Ref
0.00
0.25
0.50
0.75
1.00
1.25
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 1.
Secuencia : V[CH2]SRRRRRRGGRRRR
Espectro de masas
1865.183
m/z
Inte
nsid
ad U
.A
Cromatograma
t-min
1864
.976
1791
.944
1908
.035
1693
.851
* 2 PSEUDO (PM 1864.14)\0_A3\1\1Ref
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 2.
Secuencia : VS[CH2]RRRRRRGGRRRR
Espectro de masas
1864.976
t-min
Cromatograma
m/z
Inte
nsid
ad U
.A
72
1865
.101
1626
.929
* 3 PSEUDO (PM 1864.14)\0_A4\1\1Ref
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 3.
Secuencia : VSR[CH2]RRRRRGGRRRR
Espectro de masas
1879.406
t-min
Cromatograma
m/z
Inte
nsid
ad U
.A1865.101
1864
.987
1470
.760
* 4 PSEUDO (PM 1864.14)\0_A5\1\1Ref
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 4.
Secuencia : VSRR[CH2]RRRRGGRRRR
Espectro de masas
t-min
Cromatograma
m/z
Inte
nsid
ad U
.A
1864.9876
73
1864
.853
1314
.571
* 5 PSEUDO (PM 1864.14)\0_A6\1\1Ref
0.00
0.25
0.50
0.75
1.00
1.25
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 5.
Secuencia : VSRRR[CH2]RRRGGRRRR
Espectro de masas
t-min
Cromatograma
m/z
Inte
nsid
ad U
.A1864.853
1865
.753
1722
.694
* 6 PSEUDO (PM 1864.14)\0_A7\1\1Ref
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 6.
Secuencia : VSRRRR[CH2]RRGGRRRR
Espectro de masas
t-min
Cromatograma
m/z
Inte
nsid
ad U
.A
1865.753
74
1864
.885
* 7 PSEUDO (PM 1864.14)\0_A8\1\1Ref
0.0
0.2
0.4
0.6
0.8
1.0
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 7.
Secuencia : VSRRRRR[CH2]RGGRRRR
Espectro de masas
t-min
Cromatograma1864.855
m/z
Inte
nsida
d U.
A
19
08.0
42
1812
.941
1865
.028
1978
.083
1722
.891
* 8 PSEUDO (PM 1864.14)\0_A9\1\1Ref
0.00
0.25
0.50
0.75
1.00
1.25
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 8.
Secuencia : VSRRRRRR[CH2]GGRRRR
Espectro de masas
t-min
Cromatograma1865.0282908.0421978.083
m/z
Inte
nsida
d U.
A
75
1822
.079
1979
.183
* 9 PSEUDO (PM 1864.14)\0_A10\1\1Ref
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 9.
Secuencia : VSRRRRRRG[CH2]GRRRR
Espectro de masas
1822.079
t-min
Cromatograma
m/z
Inte
nsid
ad U
.A
1823
.143
* 10 PSEUDO (PM 1864.14)\0_A11\1\1Ref
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 10.
Secuencia : VSRRRRRRGG[CH2]RRRR
Espectro de masas
t-min
1823.143Cromatograma
m/z
Inte
nsid
ad U
.A
76
1965
.030
* 11 PSEUDO (PM 1864.14)\0_A12\1\1Ref
0.00
0.25
0.50
0.75
1.00
1.25
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 11.
Secuencia : VSRRRRRRGGR[CH2]RRR
Espectro de masas
1965.030
t-min
Cromatograma
m/z
Inte
nsid
ad U
.A
19
65.3
84
* 12 PSEUDO (PM 1864.14)\0_B1\1\1Ref
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 12.
Secuencia : VSRRRRRRGGRR[CH2]RR
Espectro de masas
1879.406
t-min
Cromatograma
m/z
Inte
nsid
ad U
.A
1965.384
77
1965
.413
* 13 PSEUDO (PM 1864.14)\0_B2\1\1Ref
0.00
0.25
0.50
0.75
1.00
1.25
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
Pseudopéptido 13.
Secuencia : VSRRRRRRGGRRR[CH2]R
Espectro de masas
1879.406
t-min
Cromatograma
m/z
Inte
nsid
ad U
.A1965.413
Pseudopéptido 20.
Secuencia : VSRRRRRRGGRRRR
Espectro de masas
1879.406
t-min
Cromatograma
m/z
Inte
nsida
d U.
A
1979
.243
* 20 PEPTIDO (PM 1864.14)\0_B3\1\1Ref
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1200 1400 1600 1800 2000 2200 2400 2600 2800m/z
t-min
Cromatograma
1879.406
78
ANEXO II. ESPECTROS DE MASAS Y CROMATOGRAFÍAS SEGUNDA SÍNTESIS
1979
.314
1866
.194
2676
.688
2832
.856
2974
.927
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1500 2000 2500 3000 3500m/z
Pseudopéptido 8.(1)
Secuencia : VSRRRRRR[CH2]GGRRRR
Espectro de masas
m/z
Inte
nsid
ad U
.A
t-min
Cromatograma
2974.927
1866.194
1822
.080
2988
.653
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1500 2000 2500 3000 3500m/z
Pseudopéptido 9.(1)
Secuencia : VSRRRRRRG[CH2]GRRRR
Espectro de masas
m/z
Inte
nsid
ad U
.A
t-min
Cromatograma1822.080
79
Pseudopéptido 10.(1)
Secuencia : VSRRRRRRGG[CH2]RRRR
Espectro de masas
Cromatograma
m/z
Inte
nsid
ad U
.A
t-min
1822.127 1907.167
1864
.860
2946
.291
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1500 2000 2500 3000 3500m/z
Pseudopéptido 11.(1)
Secuencia : VSRRRRRRGGR[CH2]RRR
Espectro de masas
Cromatograma
m/z
Inte
nsid
ad U
.A
t-min
1864.860
80
1864
.663
0.0
0.2
0.4
0.6
0.8
1.0
1.2
4x10
Inte
ns. [
a.u.
]
1000 1500 2000 2500 3000 3500m/z
Pseudopéptido 12.(1)
Secuencia : VSRRRRRRGGRR[CH2]RR
Espectro de masas
m/z
Inte
nsid
ad U
.A
t-min
Cromatograma1864.663
1864
.774
1722
.703
3216
.133
0.00
0.25
0.50
0.75
1.00
1.25
4x10
Inte
ns. [
a.u.
]
1000 1500 2000 2500 3000 3500m/z
Pseudopéptido 13.(1)
Secuencia : VSRRRRRRGGRRR[CH2]R
Espectro de masas
Cromatograma
m/z
Inte
nsid
ad U
.A
t-min
1864.774
81
ANEXO III. ENSAYOS DE SENSIBILIDAD BACTERIANA, BACTERIAS GRAM
POSITIVAS.
Figura 37. Halos de inhibición en Bacterias Gram positivas.
82
Tabla 7 . Valores de los halos de inhibición para Bacterias Gram positivas
UNIDADES DE ACTIVIDAD GRAM POSITIVAS
Molécula Staphylococcus aureus 6538
Enterococcus faecalis 29212
Streptococcus mutans 31989
2 µg, 5 µL 10 µg 2 µL, 5 µg 10 µL 2 µg, 5 µg 10 µg
B 0.00
0.00
0.00 A 0.00
0.00
0.00
K 0.96
0.00
0.00 T 5.27
7.66
9.57
1 0.48 3.35 3.35 0.00 2.39 3.83 0.00 2.39 2.87
2 0.96 1.44 3.35 1.44 1.91 3.83 0.00 1.44 1.91
3 0.96 2.87 3.83 0.00 2.39 3.83 0.00 0.48 2.39
4 0.96 2.87 3.35 0.48 2.39 2.87 0.00 1.44 3.35
5 0.96 2.87 3.35 0.00 2.87 3.83 0.48 2.39 2.87
6 0.48 3.83 4.31 0.48 2.87 3.83 0.00 2.39 2.39
7 0.48 3.83 3.83 0.00 3.35 3.83 0.48 2.87 2.39
8(1) 0.48 3.35 3.35 0.00 3.83 3.83 0.00 2.87 2.87
PROTAMINA 2.39 1.91 2.87 1.44 3.35 3.35 0.48 1.91 1.44
B 0.00
0.48
0.00 A 0.00
0.48
0.00
K 1.44
0.00
0.00 T 6.70
8.62
9.10
9(1) 0.48 3.35 3.35 1.91 3.35 3.35 1.91 3.35 3.35
10(1) 0.96 3.35 3.83 2.39 3.35 3.35 0.00 1.91 2.87
11(1) 0.00 2.87 3.83 1.91 3.35 3.83 0.00 1.91 3.35
12(1) 2.87 3.83 3.83 0.96 3.35 3.83 0.96 2.39 2.87
13(1) 0.00 3.35 4.31 0.96 1.91 4.79 0.48 1.91 2.87
20(2) 0.00 4.31 3.35 1.44 3.83 3.83 0.00 2.39 2.87
PROTAMINA 2.87 3.35 3.35 2.39 2.39 3.83 0.00 2.39 1.91
(B) BLANCO, (A) AMPICILINA, (K).KANAMICINA, (T). TETRACICLINA, 1 Unidad de Actividad
(UA) es igual a 0,1 mm del halo de inhibición
83
ANEXO IV. ENSAYOS DE SENSIBILIDAD BACTERIANA, BACTERIAS GRAM
NEGATIVAS.
Figura 38. Halos de inhibición en Bacterias Gram negativas
84
TABLA 8. Valores de los halos de inhibición para bacterias gram positivas
UNIDADES DE ACTIVIDAD GRAM NEGATIVAS
Molécula
pHoP
S.typhimurium 7953
Salmonella
typhimurium. 14028
Eschericha coli 25922
pcgL S. typhimurium EG-10627
10µ
L 20µg 25µg 10 µg 20 µg 25 µg 10 µg 20 µg 25 µg 10 µg 20 µg 25 µg
B 0.00
0.00
0.00
0.00 A 0.24
0.00
0.00
0.00
K 2.87
3.83
8.62
0.00 T 0.24
11.01
11.97
0.00
1 0.24 2.39 3.35 1.44 3.35 6.22 0.48 1.44 3.35 0.00 0.00 3.83
2 0.35 4.79 4.79 4.31 3.35 5.27 0.96 1.91 8.14 0.00 0.00 4.79
3 0.48 7.18 4.79 0.00 1.91 4.79 1.91 2.87 3.83 0.00 1.91 2.39
4 0.00 2.87 4.31 0.48 3.83 3.83 0.48 2.39 3.83 0.00 0.00 4.31
5 0.00 2.39 7.66 1.91 2.39 6.70 0.48 3.35 3.83 0.00 0.00 0.00
6 1.91 1.91 6.35 0.48 2.39 5.74 0.00 2.87 3.35 1.91 2.87 1.44
7 0.24 0.24 6.22 1.44 2.87 3.35 0.48 2.87 6.22 0.00 0.00 0.00
8(1) 0.00 0.00 5.74 0.00 0.48 0.00 0.48 0.48 0.48 0.48 2.87 2.39
PROTAMINA 5.74 2.15 2.87 1.91 1.91 5.74 0.48 2.39 2.87 0.00 6.70 0.00
B 0.00
0.00
0.00
0.00 A 0.00
0.00
0.00
0.00
K 2.87
4.79
5.27
0.00 T 0.48
9.57
10.53
0.00
9(1) 0.00 1.91 4.79 0.00 0.00 5.74 3.83 3.83 9.10 0.00 1.44 3.83
10(1) 0.09 1.91 3.35 0.48 6.22 4.31 0.96 1.91 2.87 0.00 1.91 5.74
11(1) 0.09 2.39 2.87 1.91 3.35 2.87 0.96 0.48 0.48 0.00 3.35 4.79
12(1) 0.00 2.39 5.74 0.00 1.91 3.35 0.48 0.48 3.83 0.00 0.96 3.35
13(1) 0.48 2.87 6.70 0.48 2.87 5.74 0.48 3.35 3.83 0.00 2.87 3.83
20(2) 0.48 2.87 4.31 0.48 2.39 7.18 0.96 4.31 3.83 0.00 3.83 6.70
PROTAMINA 0.65 2.39 0.48 0.96 2.39 7.18 0.96 2.87 3.35 0.00 1.44 0.48
(B) BLANCO, (A) AMPICILINA, (K).KANAMICINA, (T). TETRACICLINA, 1 Unidad de Actividad
(UA) es igual a 0,1 mm del halo de inhibición
85
ANEXO V. ESPECTROS CANÓNICOS EN DICROÍSMO CIRCULAR
http://www.cryst.bbk.ac.uk/pps97/course/section8/ss_960531_AFrame_62.gif
Consulta: octubre 13/2012
86
ANEXO VI. DECONVOLUCIÓN DE LOS PSEUDOPÉPTIDOS SINTETIZADOS
DECONVOLUCIONES
SAMPLE: : 1
PROGRAM: : SELCON3
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : -.025 .067 -.026 .062 .282
.678
RMSD(Exp-Calc): 3.059
NRMSD(Exp-Cal): .243
SAMPLE: : 1
PROGRAM: : CONTINLL
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .000 .437 .000 .080 .143
.341
RMSD(Exp-Calc): .211
NRMSD(Exp-Cal): .017
SAMPLE: :1
PROGRAM: : CDSSTR
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : -.027 .014 .381 .197 .205
.156
RMSD(Exp-Calc): .074
NRMSD(Exp-Cal): .006
_______________________________________
_______________________________________
SAMPLE: : 2
PROGRAM: : SELCON3
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : -.010 .058 -.030 .069 .254
.630
RMSD(Exp-Calc): 2.593
NRMSD(Exp-Cal): .297
SAMPLE: : 2
PROGRAM: : CONTINLL
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .039 .342 .000 .138 .241
.2
40
RMSD(Exp-Calc): .368
NRMSD(Exp-Cal): .042
_______________________________________
_______________________________________
87
SAMPLE: : 3 PROGRAM: : SELCON3 Ref. Prot. Set: SMP56 Structure : H(r) H(d) S(r) S(d) Trn Unrd Fractions : -.030 .099 -.028 .061 .279 .644 RMSD(Exp-Calc): 3.522 NRMSD(Exp-Cal): .311 SAMPLE: : 3 PROGRAM: : CONTINLL Ref. Prot. Set: SMP56 Structure : H(r) H(d) S(r) S(d) Turn Unrd Fractions : .000 .452 .000 .131 .341 .076 RMSD(Exp-Calc): .097 NRMSD(Exp-Cal): .009 SAMPLE: :3 PROGRAM: : CDSSTR Ref. Prot. Set: SMP56 Structure : H(r) H(d) S(r) S(d) Trn Unrd Fractions : .005 .012 .105 .134 .361 .368 RMSD(Exp-Calc): 2.038 NRMSD(Exp-Cal): .180 ______________________________________________________________________________ SAMPLE: : 4 PROGRAM: : SELCON3 Ref. Prot. Set: SMP56 Structure : H(r) H(d) S(r) S(d) Trn Unrd Fractions : -.020 .131 -.024 .052 .278 .621 RMSD(Exp-Calc): 2.965 NRMSD(Exp-Cal): .236 SAMPLE: : 4 PROGRAM: : CONTINLL Ref. Prot. Set: SMP56 Structure : H(r) H(d) S(r) S(d) Turn Unrd Fractions : .000 .522 .000 .130 .119 .228 RMSD(Exp-Calc): .117 NRMSD(Exp-Cal): .009
SAMPLE: :4 PROGRAM: : CDSSTR Ref. Prot. Set: SMP56 Structure : H(r) H(d) S(r) S(d) Trn Unrd Fractions : .023 .068 .185 .132 .302 .276 RMSD(Exp-Calc): 3.577 NRMSD(Exp-Cal): .284 ______________________________________________________________________________ _______________________________________
_______________________________________
SAMPLE: : 5
PROGRAM: : SELCON3
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : .005 .080 .082 .062 .205
.521
RMSD(Exp-Calc): 3.179
NRMSD(Exp-Cal): .372
SAMPLE: : 5
PROGRAM: : CONTINLL
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .090 .303 .080 .084 .060
.381
RMSD(Exp-Calc): .365
NRMSD(Exp-Cal): .043
_______________________________________
_______________________________________
SAMPLE: : 6
PROGRAM: : CONTINLL
88
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .154 .454 .161 .198 .033
.000
RMSD(Exp-Calc): 1.921
NRMSD(Exp-Cal): .253
_______________________________________
_______________________________________
SAMPLE: : 7
PROGRAM: : SELCON3
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : -.003 .101 .113 .070 .198
.510
RMSD(Exp-Calc): 1.893
NRMSD(Exp-Cal): .210
SAMPLE: : 7
PROGRAM: : CONTINLL
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .134 .349 .000 .046 .037
.433
RMSD(Exp-Calc): .321
NRMSD(Exp-Cal): .036
SAMPLE: :7
PROGRAM: : CDSSTR
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : -.024 .015 .248 .126 .296
.355
RMSD(Exp-Calc): 1.627
NRMSD(Exp-Cal): .181
_______________________________________
_______________________________________
SAMPLE: : 8.1
PROGRAM: : CONTINLL
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .003 .224 .017 .117 .229
.410
RMSD(Exp-Calc): .275
NRMSD(Exp-Cal): .036
_______________________________________
_______________________________________
SAMPLE: : 9.1
PROGRAM: : SELCON3
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : .032 .166 -.023 .065 .270
.527
RMSD(Exp-Calc): 3.524
NRMSD(Exp-Cal): .259
SAMPLE: : 9.1
PROGRAM: : CONTINLL
89
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .204 .408 .000 .171 .217
.000
RMSD(Exp-Calc): 1.609
NRMSD(Exp-Cal): .118
SAMPLE: :9.1
PROGRAM: : CDSSTR
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : .076 .162 .155 .152 .231
.224
RMSD(Exp-Calc): 2.094
NRMSD(Exp-Cal): .154
_______________________________________
_______________________________________
SAMPLE: : 10.1
PROGRAM: : SELCON3
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : .044 .180 -.026 .068 .276
.503
RMSD(Exp-Calc): 6.238
NRMSD(Exp-Cal): .452
SAMPLE: : 10.1
PROGRAM: : CONTINLL
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .087 .531 .000 .180 .169
.033
RMSD(Exp-Calc): .133
NRMSD(Exp-Cal): .010
SAMPLE: :10.1
PROGRAM: : CDSSTR
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : .184 .199 .109 .144 .181
.183
RMSD(Exp-Calc): 2.051
NRMSD(Exp-Cal): .149
_______________________________________
_______________________________________
SAMPLE: : 11.1
PROGRAM: : SELCON3
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : .005 .074 .040 .063 .219
.565
RMSD(Exp-Calc): 3.149
NRMSD(Exp-Cal): .376
SAMPLE: : 11.1
PROGRAM: : CONTINLL
90
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .175 .382 .000 .195 .248
.000
RMSD(Exp-Calc): .538
NRMSD(Exp-Cal): .064
SAMPLE: :11.1
PROGRAM: : CDSSTR
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : -.018 .020 .313 .195 .246
.233
RMSD(Exp-Calc): .919
NRMSD(Exp-Cal): .110
_______________________________________
_______________________________________
SAMPLE: : 12.1
PROGRAM: : CONTINLL
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .000 .692 .000 .085 .145
.078
RMSD(Exp-Calc): .397
NRMSD(Exp-Cal): .018
SAMPLE: : 12.1
PROGRAM: : SELCON3
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : -.023 .106 .018 .061 .234
.596
RMSD(Exp-Calc): 7.723
NRMSD(Exp-Cal): .342
_______________________________________
_______________________________________
SAMPLE: : 13.1
PROGRAM: : CONTINLL
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .000 .605 .000 .158 .213
.025
RMSD(Exp-Calc): .259
NRMSD(Exp-Cal): .016
SAMPLE: :13.1
PROGRAM: : CDSSTR
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : -.006 .108 .113 .163 .296
.314
RMSD(Exp-Calc): 6.042
NRMSD(Exp-Cal): .362
SAMPLE: : 13.1
PROGRAM: : SELCON3
91
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : -.012 .130 -.020 .059 .259
.607
RMSD(Exp-Calc): 4.097
NRMSD(Exp-Cal): .246
SAMPLE: : 20.1
PROGRAM: : CONTINLL
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Turn
Unrd
Fractions : .104 .538 .000 .230 .000
.127
RMSD(Exp-Calc): .132
NRMSD(Exp-Cal): .010
_______________________________________
_______________________________________
SAMPLE: : 20.1
PROGRAM: : SELCON3
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : -.009 .179 -.029 .046 .269
.578
RMSD(Exp-Calc): 4.717
NRMSD(Exp-Cal): .342
SAMPLE: :20.1
PROGRAM: : CDSSTR
Ref. Prot. Set: SMP56
Structure : H(r) H(d) S(r) S(d) Trn
Unrd
Fractions : .176 .200 .112 .147 .179
.187
RMSD(Exp-Calc): 1.295
NRMSD(Exp-Cal): .094
92
ANEXO VII. HEMÓLISIS DE LOS PSEUDOPÉPTIDOS Y ANTIBIÓTICOS A
DIFERENTES CONCENTRACIONES
HEMOLISIS (%)
Concentración
/ Molécula
1
mg/ml
0,5
mg/ml
0,25
mg/ml
0,125
mg/ml
0,063
mg/ml
0,031
mg/ml
0,016
mg/ml
0,008
mg/ml
0,004
mg/ml
0,002
mg/ml
0,001
mg/ml
1 2.58 2.39 1.83 1.52 1.35 1.32 1.28 1.08 0.7 0.61 0.58
2 4.11 3.83 2.25 1.9 1.72 1.75 0.79 0.73 0.62 0.54 0.51
3 2.83 2.34 1.3 1.13 1.06 1.06 0.51 0.32 0.56 0.52 0.52
4 1.47 0.58 0.39 0.38 0.49 0.3 0.48 0.35 0.54 0.48 0.56
5 2.07 1.8 1.27 1.27 1.24 1.2 1.04 0.8 0.73 0.39 0.17
6 0.97 0.86 0.79 0.75 0.68 0.59 0.39 0.17 0.06 0.11 0.23
7 1.38 1.03 1 0.92 0.97 0.87 0.73 0.65 0.55 0.44 0.25
8.(1) 4.49 0.8 0.69 0.69 0.58 0.51 0.44 0.27 0.15 0.11 0.07
9.(1) 1.59 1.52 1.06 0.86 0.7 0.65 0.54 0.54 0.35 0.35 0.11
10.(1) 2.44 3.07 1.55 1.31 1.14 0.62 0.59 0.54 0.45 0.31 0.24
11.(1) 1.27 0.92 0.72 0.75 0.9 0.85 0.69 0.68 0.59 0.48 0.51
12.(1) 0.96 1.49 1.1 0.8 0.59 0.46 0.39 0.27 0.23 0.25 0.34
13.(1) 1.48 0.93 0.87 0.94 0.86 0.52 0.7 0.77 0.75 0.73 0.48
Protamina 13.95 24.82 1.04 1.13 0.94 0.73 0.63 0.63 0.54 0.35 0.13
20 6.87 8.71 1.23 1.17 0.73 0.49 0.59 0.56 0.28 0.48 0.14
Ampicilina 100 38.85 6.33 2.43 1.92 1.31 1.41 3.64 1.76 1.58 1.22
Kanamicina 100 48.76 5.9 1.93 1.92 3 1.39 1.62 1.63 1.14 1.25
Tetraciclina 93.95 93.58 95.9 82.4 24.5 16.1 12.3 5.91 3 1.79 2.06
93
ANEXO VIII. Viabilidad de los pseudopéptidos y antibióticos a diferentes concentraciones frente a la
línea Celular H29
VIABILIDAD (%)
Concentración
/ Molécula
1
mg/ml
0,5
mg/ml
0,25
mg/ml
0,125
mg/ml
0,063
mg/ml
0,031
mg/ml
0,016
mg/ml
0,008
mg/ml
0,004
mg/ml
0,002
mg/ml
0,001
mg/ml
Protamina 193 93 286 212 236 229 240 227 318 182 193
20.(2) 47 104 166 245 150 149 322 255 187 143 47
13(1) 19 125 206 216 252 269 250 233 341 228 19
12.(1) 21 36 83 133 191 162 161 150 200 187 21
11.(1) 23 45 112 189 227 215 243 147 269 140 23
10.(1) 100 60 77 132 181 187 194 137 105 94 100
9(1) 26 44 66 149 172 160 172 103 120 199 26
8(1) 23 49 57 125 186 114 152 126 118 228 23
7 31 41 109 133 188 114 168 105 132 162 31
6 113 114 108 173 190 96 108 92 136 155 113
5 23 45 182 226 146 202 222 244 262 285 23
4 27 124 144 217 202 307 265 243 352 335 27
3 27 59 181 154 218 241 232 201 245 274 27
2 123 50 94 110 119 194 150 240 266 138 123
1 21 42 170 194 266 168 248 203 202 199 21
Ampicilina 119 158 202 190 171 205 188 180 190 141 119
Kanamicina 46 100 195 199 158 239 177 166 200 138 46
Tetraciclina 30 36 55 44 44 117 96 155 207 126 30
94
BIBLIOGRAFÍA
1 Wegener HC, Aarestrup FM, Jensen LB, Hammerum AM, Bager F. Use of antimicrobial growth promoters in
food animals and Enterococcus faecium resistance to therapeutic antimicrobial drugs in Europe. Emerg
Infect Dis 1999;5:329 _/35.
2 Gaynes R, Monnet D. The contribution of antibiotic use on the frequency of antibiotic resistance in
hospitals. Ciba Found Symp 1997;207:47_/56.
3 Gaynes R. The impact of antimicrobial use on the emergence of antimicrobial-resistant bacteria in
hospitals. Infect Dis Clin North Am 1997;11:757_/65.
4 Marwick C. Animal feed antibiotic use raises drug resistance fear. J Am Med Assoc 1999;282:120_/2.
5 Gorbach SL. Antimicrobial use in animal feed/time to stop. N Engl J Med 2001;345:1202_/3.
6 UNICEF. Resistencia del Plasmodium falciparum a los antipaludicos. Paludismo 1993; 5(4): 4-5.
7 Cotrin A, Di Santi. In vivo and in vitro plasmodium resistance to chloroquine and quinine in the Brazilian
Amazon. Rev Inst Med Trop Sao Paulo 1997; 39(2): 85-9.
8 Jacoby GA. Antimicrobial-resistant pathogens in the 1990s. Annu Rev Med 1996;47:169_/79
9 Chambers HF. Methicillin resistance in staphylococci: molecular and biochemical basis and clinical
implications. Clin Microbiol Rev 1997; 10: 781-91.
10Leclercq R. Mechanisms of resistance to macrolides and lincosamides: nature of the resistance elements
and their clinical implications. Clin Infect Dis 2002; 34: 482-92.
11 “Streptococcus_mutans “http://es.wikipedia.org/wiki/Streptococcus_mutans Acceso 22/10/2010
12 Yung-Hua Li, Peter C. Y. Lau, Nan Tang, Gunnel Svensäter, Richard P. Ellen, and Dennis G. Cvitkovitch,
Novel Two-Component Regulatory System Involved in Biofilm Formation and Acid Resistance inStreptococcus mutans, J. Bacteriol. November 2002 vol. 184no. 22 6333-6342 13
Cetinkaya Y, Falk P, Mayhall CG. Vancomycin-Resistant Enterococci. Clin Microbiol Rev 2000
Oct 1; 13(4):686-707.
14 Arias, CA.; Contreras, GA.; Murray, BE. "Management of multidrug-resistant enterococcal infections.".Clin
Microbiol Infect (Jun 2010). 16 (6): 555–62.
15 Amyes SG (May 2007). "Enterococci and streptococci". Int. J. Antimicrob. Agents. 29 Suppl 3: S43–52.
16 Doyle, M.P. and Padhye, Escherichia coli. In Foodborne Bacterial Pathogens. Doyle, M.P., V.S. 1989. Ed.
Marcel Dekker, Inc. New York, NY.
17 “Escherichia_coli “http://es.wikipedia.org/wiki/Escherichia_coli . Acceso 22/10/2010
95
18
Poole, K. "Efflux-mediated multiresistance in Gram-negative bacteria". Clinical Microbiology and
Infection (2004). 10 (1): 12–26.
19 Cornelis P (editor). (2008). Pseudomonas: Genomics and Molecular Biology (1st ed.). Caister Academic
Press.
20 “Salmonella_typhimurium “ http://es.wikipedia.org/wiki/Salmonella_typhimurium Acceso 22/10/2010
21 Gunn JS, Ernst RK, McCoy AJ, Miller SI, Constitutive mutations of the Salmonella enterica serovar
Typhimurium transcriptional virulence regulator phoP. Infect Immun. 2000 Jun;68(6):3758-62.
22 Mouslim C, Hilbert F, Huang H, Groisman EA. Conflicting needs for a Salmonella hypervirulence gene in
host and non-host environments. Mol Microbiol. 2002 Aug;45(4):1019-27.
23 Cotrin A, Di Santi. Rev Inst Med Trop Sao Paulo 1997; 39(2): 85-9
24 Plasmodium falciparum “http://es.wikipedia.org/wiki/Plasmodium_falciparum” Acceso, 22/10/2010
25 Travis SM, Anderson NN, Forsyth WR, Espiritu C, Conway BD, Greenberg EP, McCray PB Jr, Lehrer RI,
Welsh MJ, Tack BF.. Bactericidal activity of mammalian cathelicidin-derived peptides. Infect Immun
2000;68:2748_/55.
26 Hirata M, Shimomura Y, Yoshida M, Morgan JG, Palings I, Wilson D, Yen MH, Wright SC, Larrick JW..
Characterization of a rabbit cationic protein (CAP18) with lipopolysaccharideinhibitory activity. Infect Immun
1994;62:1421_/6.
27 Sawa T, Kurahashi K, Ohara M, Gropper MA, Doshi V, Larrick JW, Wiener-Kronish JP. Evaluation of
antimicrobial and lipopolysaccharide-neutralizing effects of a synthetic CAP18 fragment against
Pseudomonas aeruginosa in a mouse model. Antimicrob Agents Chemother 1998;42:3269_/75.
28 Kim A. Brogden, Mark Ackermann, Paul B. McCray, Jr. Brian F. Tack. Antimicrobial peptides in animals and
their role in host defences International Journal of Antimicrobial Agents 22 (2003) 465_/478
29 “ The antimicrobial peptide data base” http://aps.unmc.edu/AP/about.php Acceso 30/10/2010
30 Hoffmann, J. A., F. C. Kafatos, C. A. Janeway, and R. A. Ezekowitz. Phylogenetic perspectives in innate
immunity. Science 1999-284: 1313-1318
31 Reddy K. V. R ; Yedery R. D ; Aranha C. Antimicrobial peptides: premises and promises International
Journal of Antimicrobial Agents 2004; 24: 536–547
32 Findlay, B., G.G. Zhanel, and F. Schweizer, Cationic amphiphiles, a new generation of antimicrobials
inspired by the natural antimicrobial peptide scaffold. Antimicrob Agents Chemother, 2010. 54(10): p. 4049-
4058.
33 Jenssen H, Hamill P, Hancock REW. Peptide antimicrobial agents. Clin Microbiol Rev. 2006;19:491-511.
34 Nissen-Meyer, J., and I . F . Nes. Ribosomally synthesized antimicrobial peptides: their function, structure,
biogenesis, and mechanism of action . Arch . Microbiol . 1997; 167:67-77.
96
35
Yang D, Biragyn A, Hoover DM, Lubkowski J, Oppenheim JJ. Multiple roles of antimicrobial defensins,
cathelicidins, and eosinophil-derived neurotoxin in host defense. Annu Rev Immunol. 2004;22:181-215.
36 Hale JD, Hancock RE. Alternative mechanisms of action of cationic antimicrobial peptides on bacteria.
Exprt Rev Anti Infect Ther. 2007; 5:951-9.
37 Teixeira, V., M.J. Feio, and M. Bastos, Role of lipids in the interaction of antimicrobial peptides with
membranes. Progress in Lipid Research, 2012. 51(2): p. 149-177.
38 LinksDubovskii PV, Volynsky PE, Polyansky AA, Karpunin DV, Chupin VV, Efremov RG, et al. Three-
dimensional structure/hydrophobicity of latarcins specifies their mode of membrane activity. Biochemistry.
2008;47:3525-33.
39 Yang L, Harrou TA, Weiss TM, Ding L, Huang Hw. Barrel-stave model or toroidal model? A case study on
melittin pores. Biophysical Journal. 2001;81:1475-85.
40 Park CB, Kim HS, Kim SC. Mechanism of action of the antimicrobial peptide Buforin II: Buforin II kills
microorganisms by penetrating the cell membrane and inhibiting the cell membrane and inhibiting cellular
functions. Biochem Biophys Res Commun. 1998;244:253-7.
41 Marchand C, Krajewski K, Lee HF, Antony S, Johnson AA, Amin R, Roller P, Kvaratskhelia M, Pommier Y.
Covalent binding of the natural antimicrobial peptide indolicin to DNA abasic sites. Nucl Acids Res.
2006;34:5157-65.
42 Kragol G, Lovas S, Varadi G, Condie BA, Hoffmann R, Otvos L Jr. The antibacterial peptide pyrrhocoricin
inhibits the ATPase actions of DnaK and prevents chaperone-assisted protein folding. Biochemestry.
2001;40:3016-26. 26. Otvos L Jr, O I, Rogers ME, Consolvo PJ, Condie BA, Lovas S, Bulet P, Blaszczyk-Thurin
M.. Interaction between heat shock protein and antimicrobial peptides. Biochemestry. 2000;39:14150-9.
43 Friedrich CL, Rozek A, Patrzkat A, Hancock REW. Structure and mechanism of action of an indolicina
peptide derivative with improved activity against Gram-positive bacteria. J Biol Cehm. 2001;276:24015-22.
44 Bellomio A, Vincent P, F. de Arcuri B, Farías R and Morero R. Microcin J25 has dual and independent
mechanisms of action in Escherichia coli: RNA polymerase inhibition and increased superoxide production. J
Bacteriol. 2007;189: 4180-6.
45 Wei Chen, Liaofu Luo. Classification of antimicrobial peptide using diversity measure with quadratic
discriminant analysis Journal of Microbiological Methods, 2009; 78, (1):94-96
46 Wang, Z. and Wang, G.* (2004) APD: the Antimicrobial Peptide Database (Abstract & paper). Nucleic Acids
Research 32, D590-D592.
47 Brogden KA. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria? Nat Rev Microbiol
2005;3:238-50.
48 Ganz, T. Defensins: antimicrobial peptides of innate immunity. Nature Rev Immunol 2003, 3:710-720
49 Perron GG, Zasloff M, Bell G. Experimental evolution of resistance to an antimicrobial peptide. Proc Biol
Sci. 2006;273: 251-6.
97
50
Bayer, Prasad, R., Jyotsna Chandra, Anjni Koul, M. Smriti, Archana Varma, Ronald A. Skurray, Neville Firth,
Melissa H. Brown, Su-Pin Koo and Michael R. Yeaman. In vitro resistance Staphylococcus aureus to thrombin
induced platelet microbicidal protein is associated with alterations in cytoplasmic membrane fluidity. Infect
Immun. 2000;68:3548-53
51 Andreu, D., Rivas, L. Animal antimicrobial peptides: An overview. Biopolymers 1998; 47: 415-433.
52 Radek, K. and R. Gallo, Antimicrobial peptides: natural effectors of the innate immune system. Seminars in
Immunopathology, 2007. 29(1): p. 27-43.
53 K. Suzuki y T. Ando, Studies protaminas XVI. The complete amino acid sequence of clupeine YII, J Biochem
1972; 72: 1419–1432
54 Boquet, Mg.; Ferrari, M.R.2; Spirito, S.E. Rev. Med. Vet. Teriogenología Cambios en la cromatina durante
la espermatogénesis en mamíferos. (B. Aires) 2009, 90, 1/2: 9 - 16.
55 Investigación y ciencia, http://www.investigacionyciencia.es/files/8522.jpg (consulta enero 23/2013)
56 J. Brange, Galenics of insulin, Springer-Verlag, Berlin 1987; 34–36.
57 L.B. Jaques, Protamine -antagonist to heparin, J. Can. Med. Assoc. 1973; 108: 1291–1297.
58 O’Reilly R, Goodman A, L.S. Gilman and A. Gilman, Editors, The pharmacological basis of therapeutics,
Macmillan, New York 1980;1347–1366
59 B.F. Miller, R. Abrams, A. Dorfman and M. Kleine, Antibacterial properties of protamine and histones,
Science 1942; 96: 428–430.
60 Arden Aspedon and Eduardo A. Groisman, The antibacterial action of protamine: evidence for disruption
of cytoplasmic membrane energization in Salmonella typhimurium, Microbiology, 1996 vol. 142 no. 123389-
3397.
61 Akazawa H, Sugihara H, Yajima M, Use of protamine in conjunction with high pressure processing as a
food preservative, JP 3091467 (1991).
62 Michiko Y, Anticarious agent, anticarious composition for oral cavity application and food or drink having
anticarious function, Japanese Patent JP 2250815 (1990).
63 Masami S, Agent for suppressing proliferation of oral bacteria, Japanese Patent JP 63192721, 1988
64 Sunkyu Kim, Sukwon S. Kim, Byeong Jae Lee. Correlation between the activities of α-helical antimicrobial
peptides and hydrophobicities represented as RPHPLC retention times Peptides, 2005; 26 (11), 2050-2056
65 Sangho Park, Sang-Ho Park, Hee-Chul Ahn, Sunkyu Kim, Sunny S. Kim, Byeong Jae Lee, Bong-Jin Lee.
Structural study of novel antimicrobial peptides, nigrocins, isolated from Rana nigromaculata FEBS Letters,
2001; 507 (1); 95-100.
66 Sung-Hee Lee, Seo-Jin Kim, Yoo-Sup Lee, Min-Dong Song, Ick-Hee Kim, Hyung-Sik Wo, De novo generation
of short antimicrobial peptides with simple amino acid composition Regulatory Peptides, In Press, Corrected
Proof, , http://www.ncbi.nlm.nih.gov/pubmed/20736034. Acceso 22/ 8/ 2010
98
67
Richard W Scott, William F DeGrado, Gregory N Tew De novo designed synthetic mimics of antimicrobial
peptides Review Article Current Opinion in Biotechnology, 2008; 19, (6); 620-627
68 Liliana Patricia Lesmes, Magda Yenith Bohorquez, Luisa Fernanda Carreño, et al. A C-terminal cationic
fragment derived from an arginine-rich peptide exhibits in vitro antibacterial and anti-plasmodial activities
governed by its secondary structure properties, Peptides 2009; 30 (12): 2150-2160.
69 Merrifield Bruce. Concept and early development of solid-phase peptide synthesis. (1997), Methods in
Enzymology. 289:3-13.
70 Atherton e. and R.C. Sheppard. Solid Phase Peptide Synthesis: a practical approach. IRL, Press: Oxford
University Press. pp. 13-33,63-66,87-105
71 Patch, J.A. and Barron, A.E. Mimicry of bioactive peptides via non-natural, sequence-specific
peptidomimetic oligomers Curr. Opin. Chem. Biol. 6, 872-877 (2002).
72 José Manuel Lozano1, Luz Mary Salazar, Carlos Parra, Nubia Barrera, Fanny Guzmán, José Libardo Torres-
Castellanos y Manuel Elkin Patarroyo, Modificación del esqueleto peptídico de fragmentos de la proteína
msp-1 del Plasmodium falciparum: Síntesis en fase sólida de pseudopéptidos amida reducida, Revista
Colombiana de Química, volumen 32, No. 1 DE 2003.
73 “Química organica.org”, http://www.quimicaorganica.org/aldehidos-y-cetonas/230-formacion-de-
iminas.html, acceso 15/10/2010.
74 Bauer AW, Kirby WM, Sherris JC, Turck M. Antibiotic susceptibility testing by a standardized single disk
method. Am J Clin Pathol. 1966;45(4):493–496
75“TABLA DE INTERPRETACION DE LOS RESULTADOS Método de difusión en agar (Normas CLSI - NCCLS Año
2005)” via on line, http://www.brizuela-lab.com.ar/tablan.htm Acceso 20/10 /2010
76 Lozano J.M., Espejo F., Diaz D., Guzmán F., Calvo J.C., Salazar L.M. and Patarroyo M.E. Reduced amide
pseudopeptide analogues of a malaria peptide possess secondary structural elements responsible for
induction of functional antibodies which react with native proteins expressed in Plasmodium falciparum
erythrocyte stages. The Journal of Peptide Research 1998; 52, (6):457-469.
77 Merrifield R. B.. "Solid Phase Peptide Synthesis. I. The Synthesis of a Tetrapeptide". J. Am. Chem. Soc.
1963; 85 (14): 2149–2154.
78 Houghten, R.A. General method for the rapid solid-phase synthesis of larger numbers of peptides:
Specificity of antigen-antibody interaction at the level of individual amino acids. Proc. Natl. Acad. Sci. USA
1985; 82:5131-5135.
79 Atherton, E.; Sheppard, R.C. (1989). Solid Phase peptide synthesis: a practical approach. Oxford, England:
IRL Press. ISBN 0199630674.
80 E. Kaiser, R. L. Colescott, C. D. Bossinger, P. I. Cook, Color test for detection of free terminal amino groups
in the solid-phase synthesis of peptides, Analytical Biochemistry 34 595 (1970).
99
81
Tam J.P., Heath W.F., and Merrifield B. SN2 deprotection of synthetic peptides with a low concentration of
HF in dimethyl sulphide: evidence and application in peptide synthesis. J. Am. Chem. Soc., 1983; 105, 6442,.
82 Tam J.P., Heath W.F., Merrifield B. SN1 and SN2 mechanism for the deprotection of synthetic peptides by
hydrogen fluoride. Studies to minimize the tyrosine alkylation side reaction. Int. J. Pept. Protein. Res., 1983;
21, 57.
83 Peptide mass calculator, http://www.ionsource.com/programs/PEPCALC.HTM Acceso 15/10/2011.
84 Lambros C, Vanderberg JP. Synchronization of Plasmodium falciparum erythrocytic stages in culture. J
Parasitol 1979; 65:418–20.
85 Van der Heyde HC, Elloso MM, vande Waa J, Schell K, Weidanz WP. Use of hydroethidine and flow
cytometry to assess the effects of leukocytes on the malarial parasite Plasmodium falciparum. Clin Diagn Lab
Immunol 1995;2:417–25.
86 Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and
cytotoxicity assay. Journal of Inmunological Methods. 1983. 65: 55-63.
87 Roccatano D, Colombo G, Fioroni M, Mark AE. Mechanism by which 2,2,2- trifluoroethanol/water mixtures
stabilize secondary-structure formation in peptides: a molecular dynamics study. Proc Natl Acad Sci USA
2002;99(19): 12179–12184.
88 Milton, R.C.d.L., S.C.F. Milton, and P.A. Adams, Prediction of difficult sequences in solid-phase peptide
synthesis. J Am Chem Soc, 1990. 112(16): p. 6039-6046.
89 Johansen, C. and L. Gram, Antimicrobial activity of protamine: Examination of the mode of action.
International Biodeterioration & Biodegradation, 1995. 36(3–4): p. 471.
90 Liang, J.F., V.C. Yang, and Y. Vaynshteyn, The minimal functional sequence of protamine. Biochemical and
Biophysical Research Communications, 2005. 336(2): p. 653-659.
91 Diseño, síntesis y evaluación de inhibidores de la proteína beta-amiloide. Desarrollo de un modelo de
fibrilogénesis, http://hdl.handle.net/10803/2788.
92Perczel, A., K. Park, and G.D. Fasman, Analysis of the circular dichroism spectrum of proteins using the
convex constraint algorithm: A practical guide. Analytical Biochemistry, 1992. 203(1): p. 83-93.