Hibridación del Carbono - dea.unsj.edu.ardea.unsj.edu.ar/quimica2/2- HIBRIDACION DEL...
-
Upload
truongngoc -
Category
Documents
-
view
231 -
download
1
Transcript of Hibridación del Carbono - dea.unsj.edu.ardea.unsj.edu.ar/quimica2/2- HIBRIDACION DEL...
Hibridación del Carbono • En química, se conoce como hibridación a la
interacción de orbitales atómicos dentro de un átomo para formar nuevos orbitales híbridos. Los orbitales atómicos híbridos son los que se superponen en la formación de los enlaces, dentro de la teoría del enlace de valencia, y justifican la geometría molecular.
• El químico Linus Pauling desarrolló por primera vez la teoría de la
hibridación con el fin de explicar la estructura de las moléculas como el metano (CH4) en 1931. Este concepto fue desarrollado para este tipo de sistemas químicos sencillos, pero el enfoque fue más tarde aplicado más ampliamente, y hoy se considera una heurística eficaz para la racionalización de las estructuras de compuestos orgánicos.
La configuración electrónica desarrollada para el carbono es:
El primer paso en la hibridación, es la promoción de un electrón del orbital 2s al orbital 2p.
2da. capa
2s 2px 2py 2pz
2da. capa
2s 2px 2py 2pz
4 orbitales híbridos sp3 cada uno ocupado por un electrón
Estado electrónico fundamental de átomo de carbono
2sp3
4 orbitales híbridos sp3
Estos orbítales son idénticos entre si, pero diferentes de los originales ya que tienen características de los orbítales “s” y “p” combinadas. Estos son los electrones que se comparten. En este tipo de hibridación se forman cuatro enlaces sencillos.
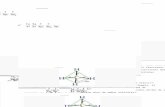
Esta hibridación da lugar a cuatro orbitales híbridos que se dirigen desde el centro de un tetraedro a sus vértices (geometría tetragonal), se combinan un orbital s y tres orbitales p, siendo el ángulo entre sus ejes de 109º28’.
Este tipo de hibridación lo
presentan las moléculas de agua, amoniaco y metano entre otras
En el metano los ángulos son los del tetraedro, sin embargo en el
agua el ángulo es menor, esto es debido a la repulsión de los pares de electrones que tiene el oxígeno sin compartir con los electrones de enlace. En el caso del amoniaco ocurre algo similar pero la repulsión es menor, por lo que los ángulos son mayores.
METANO
AGUA
AMONIACO
109,3° 105° 107°
2da. capa
2s 2px 2py 2pz
Hibridación sp2
2da. capa
2s 2px 2py 2pz
3 orbitales híbridos sp2 cada uno ocupado por un electrón y 1 orbital p con un electrón
2sp2 2pz
Hibridación sp2 de un átomo de carbono Estado
fundamental
Promoción
de electrón
Estado hibridizado
sp2-
orbitales sp2
Hibridación sp2 o trigonal:
Se produce al combinarse un orbital s con dos orbitales p del mismo átomo, dando lugar a tres orbitales híbridos que adquieren una configuración plana triangular, los orbitales híbridos están dirigidos desde el centro a los vértices de un triángulo equilátero, con ángulos entre sus ejes de 120º.
Este tipo de hibridación la
presentan las moléculas del eteno, benceno y en general todos los dobles enlaces en el caso de los compuestos orgánicos.
Ejemplo: ETENO
Se forma un enlace sigma por solapamiento de dos orbitales sp2 y un enlace pi por solapamiento lateral de dos orbitales p.
C 1s2 2s2 2px 2py1
2pz1, promociona un
electrón del orbital 2s al 2px, dando 1s2 2s1 2px
1 2py1
2pz1
H 1s1
Hibridación sp o diagonal En este tipo de hibridación sólo se combina un orbital “p” con el orbital “s”. Con este tipo de hibridación el carbono puede formar un triple enlace
Se produce cuando entran en juego, para la formación de un enlace covalente, un orbital de tipo s y otro de tipo p, dando lugar a dos orbitales híbridos que se colocan linealmente, siendo el ángulo entre sus ejes de 180º.
Este tipo de hibridación la
presentan el hidruro de berilio, fluoruro de berilio y moléculas orgánicas con triple enlace como el acetileno, entre otros.
2da. capa
2s 2px 2py 2pz
Hibridación sp
2da. capa
2s
2 orbitales híbridos sp cada uno ocupado por un electrón y 2 orbital p con un electrón cada uno
2px 2py 2pz 2sp 2py 2pz
C 1s2 2s2 2px 2py1
2pz1 promociona un electrón del orbital 2s al 2px, dando
1s2 2s1 2px1 2py
1 2pz
1 H 1s1 Se hibrida el 2s y el 2px, formándose dos orbitales híbridos sp con un
electrón cada uno de ellos. Se forman tres enlaces uno de tipo sigma y dos de tipo pi. Como los
electrones de los enlaces pi poseen , por la naturaleza del enlace, mucha movilidad, los enlaces pi se representan en muchas ocasiones en forma de nube electrónica por encima y debajo del enlace pi
ETINO o ACETILENO