Geometria molecular
-
Upload
anitax2612 -
Category
Education
-
view
5.576 -
download
0
description
Transcript of Geometria molecular

1
GEOMETRÍA MOLECULAR

2
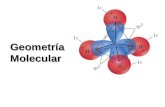
SI PUDIÉRAMOS OBSERVAR LAS MOLÉCULAS POR DENTRO CON UN POTENTE LENTE, VERÍAMOS QUE LOS ÁTOMOS QUE LAS CONFORMAN SE UBICAN EN EL ESPACIO EN POSICIONES BIEN DETERMINADAS. EL ORDENAMIENTO TRIDIMENSIONAL DE LOS ÁTOMOS EN UNA MOLÉCULA SE LLAMA GEOMETRÍA MOLECULAR.

3
LA POSICIÓN DE LOS ELECTRONES En una molécula con enlaces
covalentes hay pares de electrones que participan en los enlaces, y electrones desapareados, que no intervienen en los enlaces
La interacción eléctrica que se da entre estos pares de electrones, determina la disposición de los átomos en la molécula para minimizar repulsión electrostática

4
GEOMETRÍA MOLECULAR
R.J. Gilliespie y R. Nyholm desarrollaron un modelo basado en un criterio electrostático para predecir la geometría de la molécula, denominado REPULSIÓN DE PARES DE ELECTRONES DE VALENCIA (RPEV)

5
MODELO RPEV En el modelo de RPEV se suelen
utilizar las siguientes letras para representar a los
compuestos: - A: átomo central - X: Ligandos o átomos unidos al
átomo central -E: pares de electrones solitarios
asociados al átomo central

6
MODELO RPEVPredice 6 geometrías:LinealTrigonal planaTrigonal angularTetraédrica regularTetraédrica piramidalAngular

GEOMETRÍA MOLECULARPares electrónicos
Electrones libres
Geometría Molecular
Valor angular
Fórmula molecular o hibridación
Figura representativa
Ejemplos
2 0 Lineal 180⁰ sp ó AX2 --A-- BeH2
3 0 TrigonalPlana
120⁰ sp2 o AX3
ABCl3, AlCl3
2 2 Trigonal angular
< 120⁰ sp2 o AX2E .. A
SnCl2
4 0 Tetraédrica 109,5⁰ sp3 o AX4 A
CH4
3 2 Piramidal trigonal
< 109⁰ sp3 o AX3E . . A
NH3,
2 4 Angular 104,5⁰ sp3 o AX2E2 . . A . .
H2O, SCl2
7

8

9
LA HIPÓTESIS PRINCIPAL DEL MODELO RPEVLas regiones de alta concentración de electrones (enlaces y pares libres) se repelen entre sí
Los enlaces y los pares se sitúan de forma que estén lo más alejados posible entre sí

10
AX4 →tetraédrica

11
POLARIDAD MOLECULARCuando dos átomos diferentes se
unen, formando un enlace, se produce un leve desplazamiento de los electrones del enlace hacia el átomo más electronegativo.
La molécula adquiere un cierto grado de polarización que depende de la diferencia de electronegatividad entre los átomos que forman el enlace.

12
POLARIDAD Los enlaces covalentes y las moléculas
unidas por ellos pueden ser: Polares: existe una distribución asimétrica de
los electrones, el enlace o la molécula posee un polo (+) y uno (-), o un dipolo.
No polares: existe una distribución simétrica de los electrones, produciendo un enlace o una molécula sin dipolo.
En laces covalentes polares
Enlaces covalentes no polares
δ+H—Fδ- H--H

13
EL MOMENTO DIPOLAR (U)
Es una medida cuantitativa de la polaridad de una molécula.
Mientras mayor sea el desplazamiento electrónico en la molécula, mayor es su momento dipolar

14
El momento dipolar es una magnitud vectorial, es el producto de la carga de uno de los átomos por la distancia entre ambos.
Su dirección es la línea que une los núcleos de ambos átomos. Su sentido se toma por convenio del polo positivo hacia el negativo

15

16

17
CL BE CL3,0 1,5 3,0
3-1,5=1,51,5-1,5=0POR LO TANTO EL VECTOR RESULTANTE ES CERO, LA MOLÉCULA ES NO POLAR
SI LA SUMA ES DISTINTA DE CERO ES POLAR

18

19
FUERZAS INTERMOLECULARES
Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente).
Estas son las fuerzas que se deben vencer para que se produzca un cambio químico. Son estas fuerzas, por tanto, las que determinan las propiedades químicas de las sustancias.

20
INTERACCIONES MOLECULARES
PUENTE DE HIDRÓGENO
ATRACCIÓN DIPOLO-DIPOLO
ATRACCIÓN IÓN-DIPOLO
FUERZAS DE LONDON

21
ATRACCIÓN DIPOLO - DIPOLO
Este tipo de interacción aparece solamente entre moléculas polares. Además, son proporcionales a los valores de los momentos dipolares de las moléculas.

22
FUERZAS DIPOLO-DIPOLO
Las moléculas polares se atraen cuando el extremo positivo de una de ellas está cerca del negativo de otra.
Se establecen atracciones cuya intensidad depende de la carga de su dipolo (ley de Coulomb)

23
dipolo-dipolo

24
FUERZAS IÓN-DIPOLO
* Son atracciones entre un ión y el polo de carga opuesta de una molécula polar.
* La magnitud de la atracción aumenta con la carga del ión y la carga del dipolo.

25
IÓN- DIPOLO

26
FUERZAS DE LONDON O FUERZAS DE VAN DER WAALS
Son fuerzas muy débiles. Y surgen en moléculas NO POLARES Se producen cuando estas moléculas no
tienen polos y son inducidas a provocar un desplazamiento momentáneo.

27
OTRAS FUERZAS DE VAN DER WAALS
Fuerzas de dispersión: Dipolo inducido-dipolo inducido Donde una molécula polar induce un dipolo en
otra molécula no polar, generándose un polo positivo y otro negativa al que se le llama DIPOLO TRANSITORIO; originándose, de esta forma, la atracción electrostática.
Esta fuerza explica la disolución de algunos gases apolares (Cl2) en disolventes polares.

29
LAS FUERZAS: DE DISPERSIÓN DE LONDON, LAS FUERZAS DIPOLO-DIPOLO, DIPOLO- DIPOLO INDUCIDO INTEGRAN LAS LLAMADAS FUERZAS DE VAN DER WAALS.

30
Fuerzas de dispersión o de LondonPor un instante, las nubes electrónicas se distorsionan y forman un dipolo momentáneo. Polarizabilidad: facilidad para deformar la nube electrónica.

31
FUERZAS DIPOLO- DIPOLO INDUCIDO
Al acercarse un dipolo a una molécula no polar genera sobre ésta una distorsión de la nube de e-, originando un dipolo transitorio.

32
•El puente de hidrógeno es un tipo de interacción dipolo- dipolo particularmente fuerte, que se trata por separado por ser unos pocos los elementos que participan en su formación.
•Los iones y los dipolos se atren entre sí mediante fuerzas electrostáticas ión-dipolo que no son fuerzas de van der Waals.

33
PUENTE DE HIDRÓGENO * Son un tipo especial de
atracción dipolo-dipolo.* Ocurre en moléculas muy
polares que poseen átomos muy electronegativos (F, O, N) unidos a hidrógeno. Ejemplos: HF; H2O y NH3.
* La unión se establece entre los pares de e- libres y el átomo de H.
* Son fuerzas intermoleculares muy intensas y permanentes.
H2O liq.
H2O sól.

34
Enlace de hidrógeno

35
Las interacciones moleculares ordenadas en forma decreciente son:- -Iónicas-- atracción ión-dipolo--puente de hidrógeno-- atracción dipolo-dipolo-- fuerzas de van der Waals