Fuerzas de Van Der Waals
description
Transcript of Fuerzas de Van Der Waals

12/7/2015 Fuerzas de Van Der Waals
http://www.areaciencias.com/quimica/fuerzas-de-van-der-waals.html 1/7
COMPARTE FUERZAS DE VAN DER WAALS
8
Twittear
Seguir a @AreaCiencias
Comparte www.areaciencias.com
Ciencias Fisica Quimica Biologia Geologia Astronomia Ejercicios Tests
Inteligencia JuegosBrain
CienciasDivertidas
FUERZAS DE VAN DER WAALS
Las fuerzas de Van der Waals se llaman así en
honor al físico holandés Johannes van der Waals.
Estas fuerzas son las responsables de muchos
fenómenos físicos y químicos como la adhesión,
rozamiento, difusión, tensión superficial y la
viscosidad.
¿Qué son las Fuerzas de Van Der Waals?
Lo primero que hay que saber es que las
substancias químicas son formadas por moléculas
compuestas de átomos, unidos entre si por medio de
enlaces químicos (covalente, iónico o metálico).
La energía almacenada por estos enlaces, sumada
a la red molecular de todo el conjunto de moléculas,
determina la estabilidad de estos enlaces.
Piensa que si en varias moléculas, por ejemplo con
enlaces covalente, no hubiera ninguna fuerza de
unión entre ellas, estarían moviéndose libremente y
por lo tanto siempre estarían en estado gaseoso.
Como eso no es así, por que pueden estar también
en estado sólido o líquido, quiere decir que habrá
algún tipo de conexión entre las moléculas. Ha este
tipo de interacción o fuerza es lo que se conoce
fuerzas de interacción intermoleculares o de van der
Waals.
Office 365
Personal
69 €
Comprar
Office 365
Personal (1
mes)
7 €
Comprar
Auriculares
Comfort de
Microsoft (Ne...
15 €
Comprar
50Me gusta

12/7/2015 Fuerzas de Van Der Waals
http://www.areaciencias.com/quimica/fuerzas-de-van-der-waals.html 2/7
Be the first of your friends to like this
Area Ciencias10,323 likes
Like Page Share
Las fuerzas de van der Waals son fuerzas deestabilización molecular (dan estabilidad a la uniónentre varias moléculas), también conocidas comoatracciones intermoleculares o de largo alcance y sonlas fuerzas entre moléculas (fuerzas entre moleculamolecula).
Son mas débiles que las internas en una moléculaya que dependen exclusivamente del tamaño yforma de la molécula pudiendo ser de atracción
o de repulsión. Son tan débiles que no se las puedeconsiderar un enlace, como el enlace covalente oiónico, solo se las considera una atracción.
Para tener una idea de la poca fuerza que tienen, siun enlace covalente tuviera una fuerza de 100, las devan der Waals serían de valor 1 (100 veces menor).
De hecho las fuerzas de van der Waals son lasfuerzas atractivas o repulsivas entre moléculas (oentre partes de una misma molécula) distintas aaquellas debidas a un enlace (covalente, iónico ometálico). Incluyen a atracciones entre átomos,moléculas y superficies fuera de los enlacesnormales.
Antes de explicar cada una de las fuerzas posiblesde van der Waals es importante conocer que haymoléculas polares y no polares.
Moléculas Polares y NO Polares
Moléculas Polares son aquellas cuyos enlaces sonformados por átomos distintos con grandesdiferencias de electronegatividad, formandomoléculas polares. La molécula es eléctricamenteneutra en su conjunto por tener igual de partículas

12/7/2015 Fuerzas de Van Der Waals
http://www.areaciencias.com/quimica/fuerzas-de-van-der-waals.html 3/7
positivas y negativas, pero no existe simetría en ladistribución de la electricidad. La distribución de lascargas eléctricas no es simétrica respecto a uncentro.
Las moléculas están formadas por átomosdiferentes y la carga eléctrica está más concentradaen una zona de la molécula que en otra. En este casoocurre igual que en una pila, se forman poloseléctricos, con una pequeña carga negativa y
otra positiva separadas, por eso se llaman
polares.
Aquellas en las que no hay esa diferencia dezonas eléctricas positiva y negativa en la moléculase llaman NO polares.
Las moléculas polares tienen distorsionada su nubeelectrónica con respecto a su centro.
Este tipo de moléculas, las polares, tiene lo que sellama un dipolo permanente, es decir es como unimán pequeñito pero molecular, por eso, la partenegativa atraerá a la zona positiva de otrasmoléculas cercanas y viceversa.
Ejemplos de moléculas Polares: Agua H2O ,Amoníaco NH3 , Fluoruro de Hidrógeno HF , FosfinaPH3 , Cloformo CHCl3.
Moléculas NO Polares o también llamadasApolares: Cuando se forman en un enlace covalenteentre átomos iguales, la molécula es neutra, es decir,tiene carga eléctrica cero. Estas moléculas no tienenesas zonas de carga eléctrica separadas y por lo

12/7/2015 Fuerzas de Van Der Waals
http://www.areaciencias.com/quimica/fuerzas-de-van-der-waals.html 4/7
tanto no forman dipolos permanentes.
Ejemplos de Moléculas No Polares: Tetracloruro deCarbono CCl4 , Dióxido de Carbono CO2 , Cloro Cl2 ,Trióxido de Azufre SO3 , Hidrógeno H2.
Resumiendo, las MOLÉCULAS POLARES son lasque tienen una zona con una pequeña carga negativay otra zona con una pequeña carga positiva. (la partenegativa atraerá a la zona positiva de otrasmoléculas y viceversa).
Las MOLÉCULAS NO POLARES son las que notienen esas zonas de carga eléctrica separadas.
¿Cómo saber si una sustancia es polar o no?
Hay una forma sencilla, que nos vale para lamayoría de casos. LOS DISOLVENTES POLARESDISUELVEN A SUSTANCIAS POLARES, LOSDISOLVENTES APOLARES A SUSTACIAS APOLARES.
La regla química de que "lo semejante disuelve a losemejante". Es decir, ya sabemos que el agua es undisolvente polar. Si echas en ella azúcar, ¿sedisuelve?...si ¿verdad?. Pues ya sabes que el azúcarsería una sustancia Polar.
Pero, ¿y si echas aceite en el agua?. El aceitequeda flotando, no se disuelve en el agua. Por tantoel aceite sería una sustancia No Polar.
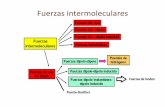
Fuerzas de Van der Waals
Ahora que ya sabemos que hay moléculas polaresy no polares explicaremos los 3 tipos de fuerzasdiferentes de van der Waals que pueden darse entremoléculas.
DIPOLODIPOLO: Cuando dos moléculas polares(dipolo) se aproximan, se produce una atracciónentre el polo positivo de una de ellas y el negativo dela otra . Se forma entre un dipolo positivo deuna molécula polar con el dipolo negativo de
otra polar. Una atracción dipolodipolo es unainteracción no covalente entre dos moléculas polares.Las moléculas que son dipolos se atraen entre sícuando la región positiva de una está cerca de laregión negativa de la otra. Podríamos decir que essimilar al enlace iónico pero mucho más débil. Estafuerza de atracción entre dos dipolos es tanto másintensa cuanto mayor es la polarización de dichasmoléculas polares.

12/7/2015 Fuerzas de Van Der Waals
http://www.areaciencias.com/quimica/fuerzas-de-van-der-waals.html 5/7
Ejemplos podrían ser el sulfuro de hidrógeno H2S ,el metanol CH3OH y la glucosa C6H12O6.
Los Puentes de hidrógeno es un tipo especial deinteracción dipolodipolo entre el átomo de hidrógenoque está formando un enlace polar, tal como N—H, O—H, ó F—H, y un átomo electronegativo como O, N óF.
INTERACCIONES IONICAS O DIPOLODIPOLOINDUCIDO: En ciertas ocasiones, una moléculapolar (dipolo), al estar próxima a otra no polar,induce en ésta un dipolo transitorio, produciendo unafuerza de atracción intermolecular llamada dipolodipolo inducido o interacción iónica. Son interaccionesque ocurren a nivel de catiónanión, entre distintasmoléculas cargadas, y que por lo mismo tenderán aformar una unión electrostática entre los extremos decargas opuestas debido a la atracción entre ellas.
Un ejemplo: El agua cuya molécula es un dipolo,produce una pequeña polarización en la molécula nopolar de oxígeno, la cual se transforma en un dipoloinducido.
Esto hace que el oxígeno y el dioxido de carbono,que son no polares presenten cierta solubilidad ensolventes polares, como el agua.
FUERZAS DE LONDON O DISPERSIÓN: En lasmoléculas no polares puede producirsetransitoriamente un desplazamiento relativo de loselectrones, originando un polo positivo y otro

12/7/2015 Fuerzas de Van Der Waals
http://www.areaciencias.com/quimica/fuerzas-de-van-der-waals.html 6/7
negativo (dipolo transitorio) que determinan unaatracción entre dichas moléculas (el polo positivo de
una molécula atrae al polo negativo de la otra, y
viceversa). Son dipolos instantáneos, desaparecerán
en muy poco tiempo.
Pensemos en una molécula como en algo no
estático, sino en movimiento, pero además
conteniendo electrones en constante movimiento. Es
razonable pensar que en un determinado momento la
distribución en esa molécula puede no ser
perfectamente simétrica y aparecen entonces
pequeños dipolos instantáneos en este momento.
Estas fuerzas de atracción son muy débiles y se
denominan fuerzas de London. Las fuerzas de London
se presentan en todas las sustancias moleculares.
Son el resultado de la atracción entre los extremos
positivo y negativo de dipolos inducidos en moléculas
adyacentes. En general, cuantos más electrones haya
en una molécula más fácilmente podrá polarizarse.
Así, las moléculas más grandes con muchos
electrones son relativamente polarizables. En
contraste, las moléculas más pequeñas son menos
polarizables porque tienen menos electrones.
Importancia de las Fuerzas de Van der Waals
Gracias a ellas podemos explicar la adhesión, el
rozamiento, la difusión, la tensión superficial y la
viscosidad. Por ejemplo, porque por la nafta es
liquida, el metano es un gas y el polietileno (que es
un polímero compuesto por C y por H únicamente) es
un solido. Las fuerzas de Van der Waals, aún siendo
tan débiles, definen el carácter químico de muchos
compuestos orgánicos.
Ecuación de Van der Waals
Van der Waals introdujo correcciones a la ecuación
de estado de un gas ideal, que tenían en cuenta el
volumen finito de las moléculas y las fuerzas
atractivas que una molécula ejercía sobre otra a
distancias muy cercanas entre ellas. Si te interesa,
en este enlace puedes ver su ecuación: Ecuación de
Van der Waals.
Por último te dejamos un video que explica las

12/7/2015 Fuerzas de Van Der Waals
http://www.areaciencias.com/quimica/fuerzas-de-van-der-waals.html 7/7
fuerzas de van der Waals por si todavía no lo tienesclaro:
FUERZAS INTERMOLECULARES. Dipolos Fuerzas de Va...
Si te ha gustado pulsa en Me gusta. Gracias
Twittear 8
© Se permite la total o parcial reproducción delcontenido, siempre y cuando se reconozca y seenlace a este artículo como la fuente de informaciónutilizada.
ENLACES RELACIONADOS
Enlace Ionico
Enlace Covalente
Compuestos Quimicos
Proteinas
Movimiento Caida Libre
Masa Peso y Gravedad
La Materia
Juegos de Ciencias Naturales
Libros de Ciencia Recomendados
50Me gusta