Estrucura atomica introducción quimica general
-
Upload
ignacio-sino -
Category
Education
-
view
111 -
download
5
Transcript of Estrucura atomica introducción quimica general

Introducción a la estructura atómica
• Bibliografía principal: Brown

El átomoEl átomoLeucipo y Demócrito (-450)La materia está formada por partículas muy pequeñas e indivisibles.John Dalton (1766 – 1844):Teoría atómica de Dalton (1803 – 1807)ELEMENTOS ÁTOMOS- Cada elemento está formado por partículas extremadamente pequeñas llamadas átomos.- Los átomos son indivisibles y no se pueden crear ni destruir en una reacción química.- Cada átomo de un elemento es exactamente igual a otro del mismo elemento y diferente de otros átomos de otros elementos.

Teoría atómica de Dalton (1803 – 1807)Teoría atómica de Dalton (1803 – 1807)
• ELEMENTOS ÁTOMOS
- Cada elemento está formado por partículas extremadamente pequeñas llamadas átomos.- Los átomos son indivisibles y no se pueden crear ni destruir en una reacción química.- Cada átomo de un elemento es exactamente igual a otro del mismo elemento y diferente de otros átomos de otros elementos.

- Ley de la composición constante: Los compuestos se forman cuando los átomos se combinan entre sí. Un compuesto dado tiene siempre el mismo número relativo y tipo de átomos.
- Ley de conservación de la materia: La masa total de los materiales presentes luego de una reacción química es la misma que la masa total antes de la reacción.

Desarrollo de la teoría atómica modernaDesarrollo de la teoría atómica moderna
Dalton: Conclusiones sobre el átomo basándose en observaciones macroscópicas sobre el mismo, pero nada se sabía de su estructura.
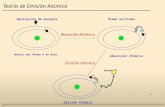
Dos tipos de investigación aproximadamente en 1900:- Naturaleza eléctrica de la materia.- Interacción de la materia con la energía en forma de
luz.Demostraron que el átomo está constituido por partículas subatómicas y permitieron desarrollar un modelo del mismo.

Al aplicar corriente eléctrica en un tubo al vacío el cátodo emitía radiaciones las cuales viajaban en línea recta hacia el ánodo y producían un resplandor en la pared opuesta al cátodo.
Dichas radiaciones se detectaban por una pantalla fluorescente.No se sabía si las radiaciones eran una nueva radiación o un haz invisible de partículas.
TUBO DE RAYOS CATÓDICOSTUBO DE RAYOS CATÓDICOS

- Todos los metales emiten idénticas partículas cuando se emplean como cátodos en un tubo de rayos catódicos que son atraídas por la placa positiva y repelidas por la negativa.
-Cuando los rayos se someten a la acción de un campo magnético se desvían de acuerdo a una partícula negativa.
-Dentro de los átomos hay partículas diminutas con carga eléctrica negativa a las que llamó electrones.
- Determinó la relación entre la carga eléctrica y la masa del electrón
e/m= 1,75882x 108C/g.
ThomsonThomson


R.A. MillikanR.A. Millikan
• Premio Nobel de física:1923.• Determinó la carga del electrón.• Le aplicó radiación a dichas gotas ionizándolas y
siguió su movimiento. • Sometió una gota de aceite a un condensador que
equilibrara la fuerza de gravedad y quedaba quieta.• Carga del e = -1.6033 x 10-19C • Relación carga masa de electrón: 1.76 x 108C/g • Masa del electrón = 9.10 x 10-28g

Experimento de MillikanExperimento de Millikan

Becquerel: Emisión espontánea de Becquerel: Emisión espontánea de radiación del Uranio. Radioactividadradiación del Uranio. Radioactividad
Becquerel, Marie Curie y su esposo Pierre recibieron el premio Nobel en Física en1903.
Radioactividad: emisión espontánea de radiación de alta energía. Rayos α: partículas positivas de alta velocidad con carga 2+.
Rayos β: electrones de alta velocidad.
Rayos γ: radiación de alta energía parecida a los rayos X que no consiste en partículas y no tiene carga.


Primer modelo atómico de ThomsonPrimer modelo atómico de ThomsonYa había evidencias que el átomo estaba formado por partículas aún más pequeñas.Thomson: los electrones son una fracción pequeña del tamaño del átomo.Modelo del “budín con pasas”
Electrones incrustados
Esfera uniforme positiva de materia

Modelo del átomo de RutherfordModelo del átomo de Rutherford• Premio Nobel de química en 1908.• Utilizó laminas muy delgadas de oro como blanco de
partículas α (carga 2+) provenientes de una fuente radiactiva.
• La mayoría de las partículas α no se desviaban, pero algunas de desviaban notablemente.
• Explicó sus resultados estableciendo: La mayor parte de los átomos es espacio vacío. Las cargas positivas deben estar concentradas en el centro
del átomo: núcleo.

Modelo del átomo de RuthefordModelo del átomo de Rutheford
Haz de partículas α que bombardean una lámina de oro. Casi todas pasan sin dispersarse pero algunas de dispersan notablemente.

radio atómico ~ 100 pm = 1 x 10-10mradio nuclear ~ 5 x 10-3pm = 5 x 10-15m
MODELO DEL ATOMO DE RUTHERFORDMODELO DEL ATOMO DE RUTHERFORD
Densidad del núcleo: 1013- 1014 g/mL!!

El protón y el neutrónEl protón y el neutrón
• Experimentos posteriores condujeron al descubrimiento de partículas positivas (protones) y partículas neutras (neutrones) en el núcleo.
• Protones: E. Rutherford en 1919.• Neutrones: James Chadwick lo encontró en 1932.• Los neutrones son partículas neutras y con masa
un poco mayor que la masa de los protones.

Visión moderna de la estructura atómicaVisión moderna de la estructura atómica
• Todo átomo tiene igual número de electrones y protones, por lo que los átomos no tienen carga eléctrica neta.
• Carga de 1 electrón: -1.602 x 10-19C.• Carga de un protón: +1.6033 x 10-19C.• Los neutrones no tienen carga.

La visión moderna de la estructura La visión moderna de la estructura atómicaatómica
• Se han descubierto hasta la actualidad muchas partículas nuevas pero solo tres se relacionan con el comportamiento químico: protón, neutrón y electrón.
• Los protones y neutrones están en el núcleo, los electrones están alrededor, atraídos por fuerzas electrostáticas.

Estructura del átomoEstructura del átomo• Thomson: descubrimiento del electrón (1897).• Millikan: carga del electrón (1909).• Becquerel: radioactividad (1896).• Thomson: modelo del budín.• Rutherford: experimento partículas alfa contra una
placa de oro. Modelo nuclear (1908).• Rutherford: (1909) protón• Chadwick (1932): bombardeo con partículas αlfa -
neutrón.

Partículas subatómicasPartículas subatómicas
Partícula Masa (uma) Masa (gramos)
Carga*(culombios)
Electrón 0,000549 (5,49 10-4)
9,1095 10-28 -1,6 . 10-19
(1-)
Protón 1,00728 1,6726 10-24 1,6 . 10-19
(1+)
Neutrón 1,00867 1,6750 10-24 0
* 1,6 10-19 Culombios = 1 unidad

Número atómico, número de masa e Número atómico, número de masa e isótoposisótopos
• ¿En qué difieren los átomos de diferentes elementos?
En su composición subatómica.
El número de protones en el núcleo es el número atómico.
Los átomos con el mismo número de protones pero diferente número de neutrones son isótopos de ese elemento.

Número atómico, número de masa e Número atómico, número de masa e isótoposisótopos
• Número atómico (Z): es el número de protones en el núcleo del átomo de un elemento.
• Número de masa (A): es el número total de neutrones y protones presentes en el núcleo de un átomo de un elemento.
• Isótopos: átomos que tienen el mismo número atómico pero diferente número de masa.

X
A
ZA : Número másico
Z : Número atómico
X : Símbolo químico
ISÓTOPOS: el mismo Z pero distinto A Numero de masa
Símbolo núclidoSímbolo núclido

Isótopos de HidrógenoIsótopos de Hidrógeno
Hidrógeno deuterio tritio

PESOS ATÓMICOSPESOS ATÓMICOSLa escala de masa atómica:
- Siglo XIX
Al hidrógeno, el átomo más liviano se le asignó una masa relativa de 1 (sin unidades).
- Actualidad: unidad de masa atómica (uma o u), 1/12 la masa del . Según este sistema, un átomo de hidrógeno 1H tiene una masa de 1,0078 uma.
- 1 uma = 1,66054 x 10 -24 1g = 6,02214x1023 uma
C12

Masas atómicas promedioMasas atómicas promedio
• La mayoría de los elementos se encuentran en la naturaleza como mezclas de isótopos.
• Se puede determinar la masa atómica promedio de un elemento utilizando las masas de sus isótopos y su abundancia relativa.
• La masa atómica promedio se conoce también como peso atómico.

El espectrómetro de masasEl espectrómetro de masasSe introduce una muestra gaseosa.Se bombardea con electrones y el choque de estos con la muestra genera partículas cargadas (generalmente 1+).La partículas son aceleradas a una rejilla cargada negativamente.Hay ranuras que permiten sólo el paso de un delgado haz.Luego el haz pasa por un imán que desvía las partículas, las de menor masa las desvía más y las de más masa menos.


LA TABLA PERIÓDICA• Si los elementos se ordenan de manera creciente
de sus números atómicos, sus propiedades físicas y químicas muestran un patrón repetitivo o periódico (en columnas verticales).
• Filas horizontales: períodos.– 1º período: 2 elementos.– 2º y 3º período: 8 elementos.– 4º y 5º período: 18 elementos.– 6º período: 32 elementos, pero 14 aparecen en la parte
inferior.– 7º período: incompleto.



MOLÉCULAS

IONES
Pierde un electrón, Forma unCatión.
Gana un electrón,Forma unanión