ENZIMAS. Catalizadores biológicos ► Las enzimas son catalizadores biológicos. Un catalizador es...
-
Upload
luisina-anchondo -
Category
Documents
-
view
250 -
download
0
Transcript of ENZIMAS. Catalizadores biológicos ► Las enzimas son catalizadores biológicos. Un catalizador es...

ENZIMAS

Catalizadores biológicosCatalizadores biológicos
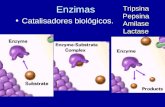
► Las enzimas son catalizadores biológicos. Un catalizador es un Las enzimas son catalizadores biológicos. Un catalizador es un agente capaz de acelerar una reacción química, sin formar agente capaz de acelerar una reacción química, sin formar parte de los productos finales. parte de los productos finales.
► Muestran alta especificidad de reacción y de sustratos.Muestran alta especificidad de reacción y de sustratos.
► Si bien la mayoría de las enzimas son proteínas, hay ARNs con Si bien la mayoría de las enzimas son proteínas, hay ARNs con actividad catalítica, ribozimas.actividad catalítica, ribozimas.
► Actúan disminuyendo la energía de activación Actúan disminuyendo la energía de activación
de una reacción química.de una reacción química.

Apoenzimas / coenzimasApoenzimas / coenzimas
► Muchas enzimas necesitan para actuar de una molécula no Muchas enzimas necesitan para actuar de una molécula no proteica: coenzima o grupo prostético. Algunas vitaminas están proteica: coenzima o grupo prostético. Algunas vitaminas están relacionadas con las coenzimas. Una coenzima pude unirse a relacionadas con las coenzimas. Una coenzima pude unirse a diferentes apoenzimas y actuar sobre diferentes sustratos (ej. diferentes apoenzimas y actuar sobre diferentes sustratos (ej. NAD, nicotinamida adenina dinucleótido, aceptora de HNAD, nicotinamida adenina dinucleótido, aceptora de H++ sustraídos al sustrato).sustraídos al sustrato).
HOLOENZIMA = APOENZIMA + COENZIMAHOLOENZIMA = APOENZIMA + COENZIMA
enzima total proteína no proteínicaenzima total proteína no proteínica
► Otras enzimas requieren para ser activas de iones metálicos que Otras enzimas requieren para ser activas de iones metálicos que donan o ceden electrones (Ejs. Citocromos, Fe; enzimas que usan donan o ceden electrones (Ejs. Citocromos, Fe; enzimas que usan ATP, Mg). ATP, Mg).

Reacción enzimáticaReacción enzimática
La enzima se une al o los sustratos formando un complejo transitorio La enzima se une al o los sustratos formando un complejo transitorio
E + S E + S ↔↔ ES → E + P ES → E + P

Sitio activoSitio activo Sitio activo o cataliticoSitio activo o catalitico: lugar de la enzima donde se fija el sustrato, : lugar de la enzima donde se fija el sustrato,
entidad física relativamente pequeña. Posee una conformación entidad física relativamente pequeña. Posee una conformación tridimensional altamente específica en el cual las cadenas tridimensional altamente específica en el cual las cadenas laterales de los aa aportan grupos funcionales esenciales. laterales de los aa aportan grupos funcionales esenciales.
Hexoquinasa. Los dos dominios de la enzima se aproximan y rodean al sustrato, la glucosa.
Proteasa ácida (similar a la pepsina). Centro activo localizado entre dos lóbulos, puede albergar 8 aa del sustrato.

Modelo Michaelis-MentenModelo Michaelis-Menten
► Para muchas enzimas la V de catálisis o formación del producto varía con la Para muchas enzimas la V de catálisis o formación del producto varía con la [S]:[S]: Cuando Cuando [S][S] es pequeña, V es casi proporcional a es pequeña, V es casi proporcional a [S][S] Cuando Cuando [S][S] es elevada, V es practicamente independiente de es elevada, V es practicamente independiente de [S][S]
↓↓La ecuación de M-M da cuenta de estas características cinéticas: La ecuación de M-M da cuenta de estas características cinéticas:
V= VV= Vmaxmax ____ ____[S][S]____ ; K____ ; KMM== k k22+ k+ k33
[S][S] + K + KM M kk11
► El valor de El valor de KKMM para una enzima depende de cada sustrato y de condiciones para una enzima depende de cada sustrato y de condiciones ambientales tales como temperatura y fuerza iónica.ambientales tales como temperatura y fuerza iónica.
KKMM = concentración de sustrato a la cual la velocidad de reacción se hace la = concentración de sustrato a la cual la velocidad de reacción se hace la mitad de su valor máximo. mitad de su valor máximo.
► KK33 = número de recambio, número de moléculas de sustrato convertidas en = número de recambio, número de moléculas de sustrato convertidas en producto por unidad de tiempo, cuando la enzima está completamente producto por unidad de tiempo, cuando la enzima está completamente saturada de sustrato.saturada de sustrato.
kk11 k k33
E + S ↔ ES → E + E + S ↔ ES → E + PP kk22

Cinética Michaeliana/no MichaelianaCinética Michaeliana/no Michaeliana
► La representación gráfica de la ecuación de Michaelis-Menten (velocidad de La representación gráfica de la ecuación de Michaelis-Menten (velocidad de reacción frente a [S]) es una hipérbole. La Vmax corresponde al valor reacción frente a [S]) es una hipérbole. La Vmax corresponde al valor máximo al que tiende la curva experimental, y la Kmáximo al que tiende la curva experimental, y la KMM corresponde a la corresponde a la concentración de sustrato a la cual la velocidad de la reacción es la mitad de concentración de sustrato a la cual la velocidad de la reacción es la mitad de la Vmax.la Vmax.
► Hay enzimas que no obedecen la ecuación de Michaelis-Menten. Se dice que Hay enzimas que no obedecen la ecuación de Michaelis-Menten. Se dice que su cinética no es Michaeliana. Esto ocurre con los su cinética no es Michaeliana. Esto ocurre con los enzimas alostéricasenzimas alostéricas, , cuya gráfica v frente a [S] no es una hipérbole, sino una sigmoide. En la cuya gráfica v frente a [S] no es una hipérbole, sino una sigmoide. En la cinética sigmoideacinética sigmoidea, pequeñas variaciones en la [S] en una zona crítica , pequeñas variaciones en la [S] en una zona crítica (cercana a la K(cercana a la KMM) se traduce en grandes variaciones en la velocidad de ) se traduce en grandes variaciones en la velocidad de reacción.reacción.

Inhibición enzimáticaInhibición enzimática► IrreversibleIrreversible.. El inhibidor queda covalentemente unido a la enzima o El inhibidor queda covalentemente unido a la enzima o
ligado muy fuertemente (ej. acción de gases neurotóxicos sobre la ligado muy fuertemente (ej. acción de gases neurotóxicos sobre la acetilcolinesterasa).acetilcolinesterasa).
► ReversibleReversible. Existe un equilibrio entre el inhibidor y el sustrato: . Existe un equilibrio entre el inhibidor y el sustrato: Inhibición competitivaInhibición competitiva. Un inhibidor parecido al sustrato se une al centro . Un inhibidor parecido al sustrato se une al centro
activo de la enzima impidiendo la unión del sustrato. La unión del sustrato activo de la enzima impidiendo la unión del sustrato. La unión del sustrato y el inhibidor son mutuamente excluyentes. Puede ser superada a y el inhibidor son mutuamente excluyentes. Puede ser superada a concentración suficientemente alta de sustrato.concentración suficientemente alta de sustrato.
Inhibición no competitivaInhibición no competitiva. El inhibidor y el sustrato pueden unirse . El inhibidor y el sustrato pueden unirse simultáneamente a una molécula de enzima.simultáneamente a una molécula de enzima.

Regulación de la actividad enzimáticaRegulación de la actividad enzimática
► Los niveles de sustrato determinan generalmente la mayor o Los niveles de sustrato determinan generalmente la mayor o menor actividad enzimática. menor actividad enzimática.
► En algunas vías metabólicas, cuando la cantidad de producto En algunas vías metabólicas, cuando la cantidad de producto final excede las necesidades, se frena la actividad final excede las necesidades, se frena la actividad enzimática: inhibición por retroalimentación (enzimática: inhibición por retroalimentación (feed-backfeed-back). En ). En otros casos, la enzima es estimulada por compuestos del otros casos, la enzima es estimulada por compuestos del medio (por ej. el sustrato). Son reversibles. medio (por ej. el sustrato). Son reversibles.

Enzimas alostéricasEnzimas alostéricas
► Además del sitio activo, poseen otros sitios a los cuales Además del sitio activo, poseen otros sitios a los cuales pueden unirse moléculas. pueden unirse moléculas.
► Están constituídas por 2 o más subunidades polipeptídicas. En Están constituídas por 2 o más subunidades polipeptídicas. En ellas ocurren interacciones alostéricas, la unión a un centro ellas ocurren interacciones alostéricas, la unión a un centro produce cambios conformacionales en las otras subunidades produce cambios conformacionales en las otras subunidades de la misma molécula y modifica la aptitud del sitio activo de la misma molécula y modifica la aptitud del sitio activo para recibir al sustrato.para recibir al sustrato.
Unión cooperativa del sustrato a una enzima alostérica. El sitio activo vacío en RT tiene una afinidad mayor por el sustrato que los centros en TT.

Enzimas constitutivas e induciblesEnzimas constitutivas e inducibles
► ConstitutivasConstitutivas.. La cantidad de enzima en las células La cantidad de enzima en las células permanece estable. Los procesos de síntesis y degradación permanece estable. Los procesos de síntesis y degradación enzimática se mantienen más o menos constantes.enzimática se mantienen más o menos constantes.
► InduciblesInducibles.. La síntesis se activa o deprime de acuerdo a los La síntesis se activa o deprime de acuerdo a los requerimientos celulares en un momento dado (ej. enzimas requerimientos celulares en un momento dado (ej. enzimas del metabolismo de la glucosa).del metabolismo de la glucosa).

Clasificación de las proteínas según la Clasificación de las proteínas según la reacción catalizadareacción catalizada
► OxidorreductasasOxidorreductasas. Reacciones de oxidorreducción , requieren . Reacciones de oxidorreducción , requieren de coenzimas. de coenzimas. Lactato deshidrogenasa: Lactato Lactato deshidrogenasa: Lactato ↔↔ piruvato (oxidación) piruvato (oxidación)
► TransferasasTransferasas. Transferencia de grupos de átomos (amina, . Transferencia de grupos de átomos (amina, carboxilo, fosforilo) de un sustrato a otro (ej. transaminasas, carboxilo, fosforilo) de un sustrato a otro (ej. transaminasas, cesión de un grupo amina).cesión de un grupo amina).
Glucoquinasa:Glucoquinasa:Glucosa + ATP Glucosa + ATP ↔ ↔ ADP + glucosa-6-fosfato ADP + glucosa-6-fosfato
► HidrolasasHidrolasas. Ruptura de enlaces (C-O, C-N, C-S, O-P) por adición . Ruptura de enlaces (C-O, C-N, C-S, O-P) por adición de agua (ej. ribonucleasa, ruptura uniones entre nucleótidos de de agua (ej. ribonucleasa, ruptura uniones entre nucleótidos de ARN).ARN). Lactasa: Lactosa + Agua Lactasa: Lactosa + Agua ↔↔ Glucosa + galactosa Glucosa + galactosa

Clasificación de las proteínas Clasificación de las proteínas (cont.)(cont.)
► LiasasLiasas. Ruptura de uniones C-C, C-S y C-N no por hidrólisis.. Ruptura de uniones C-C, C-S y C-N no por hidrólisis.
Acetato descarboxilasa: acetato Acetato descarboxilasa: acetato ↔↔ CO CO2 + acetona + acetona
► IsomerasasIsomerasas. Interconvierten isómeros.. Interconvierten isómeros.
► Ligasas o sintetasasLigasas o sintetasas. Catalizan la formación de enlaces entre C y . Catalizan la formación de enlaces entre C y O, N, S u otros átomos utilizando en general ATP O, N, S u otros átomos utilizando en general ATP
Glutamina sintetasa: Ácido glutámico + amoníaco + ATP Glutamina sintetasa: Ácido glutámico + amoníaco + ATP ↔↔ glutaminaglutamina