Uniones químicas
-
Upload
noemi-brzezinski -
Category
Education
-
view
86 -
download
0
Transcript of Uniones químicas

UNIONES QUÍMICAS

UNION QUIMICA
Fuerza que actúa entre2 átomos o grupos de átomos, con intensidad suficiente como para mantenerlos juntos en una misma especie, que tiene propiedades mensurables.

¿Por qué se combinan los átomos?Los átomos se combinan para alcanzar una configuración electrónica mas estable. La estabilidad máxima se logra cuando un átomo es isoeléctrico con un gas noble.

Símbolos de puntos de LewisUn símbolo de puntos de Lewis consta del símbolo del elemento y un punto por cada electrón de valencia de un átomo del elemento.Los elementos de un mismo grupo poseen configuración electrónica externa similares y, en consecuencia, también se asemejan los símbolos de puntos de Lewis.


Enlace Químico
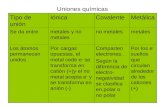
Tipos
Iónico Covalente Metálico

El Enlace Iónico

Cationes iones con carga positiva.
Aniones iones con carga negativa
Iones
Cationes
Aniones


El Enlace Covalente


Enlace covalente: Las fuerzas que mantienen unidos los átomos son también de naturaleza electrostática.
Tipos de enlace covalentes
•Enlace covalente común: el par electrónico compartido está formado por un electrón proveniente de cada uno de los átomos que intervienen:
-Enlace covalente apolar: los electrones se ubican según una distribución geométrica.

-Enlace covalente polar: La diferencia de atracción de los núcleos genera un dipolo permanente en la molécula.•Los átomos pueden compartir uno o mas pares de electrones y dar lugar a uniones covalentes simples, dobles o triples.•Enlace covalente dativo o coordinado: es la unión que ocurre entre dos átomos de dos elementos, en la que el para electrónico compartido es aportado por uno de los dos átomos.






1)Escriba la estructura fundamental del compuesto mediante símbolos químicos. En general, el átomo menos electronegativo ocupa posición central. El hidrogeno y el flúor suelen ocupar las posiciones terminales en las estructuras de Lewis.
2)Cuente el número total de electrones de valencia presentes.
3)Dibuje un enlace covalente sencillo entre el átomo central y cada uno de los átomos que lo rodean. Complete los octetos de los átomos enlazados al átomo central. (Tenga presente que la capa de valencia del átomo de hidrogeno se completa con sólo dos electrones). Los electrones pertenecientes al átomo central o a

los átomos que lo rodean deben quedar representados como pares libres si no participan en el enlace.4) Si el átomo central tiene menos de 8 electrones, trate de formar enlaces dobles o triples entre el átomo central y los átomos que lo rodean, utilizando los pares libres de los átomos circundantes para completar el octeto del átomo central.


El Enlace Metálico

Es la fuerza de atracción electrostática entre los núcleos de los átomos metálicos y los electrones libres o móviles que se encuentran en su estructura. Es una estructura en capas y las fuerzas entre los núcleos y los electrones no tienen dirección única: la atracción se produce en todas las direcciones posibles. Esto les otorga a los metales propiedades muy particulares, como su dureza y su maleabilidad, capacidad de adquirir diferentes formas.