Uniones Químicas 12
description
Transcript of Uniones Químicas 12
Uniones Qumicas
Uniones Qumicas
Las propiedades de las sustancias estn determinadas en parte por los enlaces qumicos que mantienen unidos a los tomos. Cuando los tomos interactan para formar un enlace qumico, solo entra en contacto sus regiones ms externas.
Se define Unin Qumica como la fuerza de unin que existe entre dos tomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial de electrones para adquirir ambos la configuracin electrnica estable correspondiente a los gases inertePor qu se unen los tomos?: esto se debe porque siguen una tendencia a llegar al estado de energa mnima (ms estable). En otras palabras, cuando dos tomos se unen para formar un enlace estable, se libera una cierta cantidad de Energa (energa de enlace).
La materia que nos rodea est constituida por sustancias con distinto aspecto y propiedades. El conocimiento de tales propiedades puede aportar alguna informacin acerca de las fuerzas que hacen unirse a las partculas que forman una sustancia. As, por ejemplo, los puntos de fusin y ebullicin de las diversas sustancias son indicativos de la mayor o menor fuerza de enlace entre las partculas (tomos, iones o molculas) que constituyen el slido o lquido (si son altos cabe pensar en enlaces fuertes y si son bajos en enlaces dbiles). Si una sustancia, en determinadas condiciones, conduce la corriente elctrica, podra pensarse en la existencia de partculas cargadas, ya que la corriente elctrica supone precisamente un desplazamiento de cargas. Otras propiedades pueden ser la solubilidad, la facilidad de deformacin, la dureza, la facilidad para romperse (fragilidad), etc.
El agua, por ejemplo, es una sustancia que a la presin atmosfrica funde a 0C, hierve a 100 C y apenas conduce la corriente elctrica, mientras que el hierro funde a 1535 C, hierve a 3233 C y s conduce la corriente elctrica; el diamante es muy duro, mientras que el sodio se puede cortar con un cuchillo, etc.
Otro concepto muy importante para establecer caractersticas de las uniones es la Eletronegatividad, que se define como "la capacidad relativa que tiene un tomo para atraer electrones de una unin qumica".
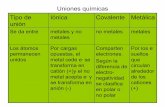
Linus Pauling diagram una tabla cuyos valores, basados en datos termoqumicos, han sido determinados en una escala arbitraria, denominada escala de Pauling, cuyo valor mximo es 4 que es el valor asignado al flor, el elemento ms electronegativo. El elemento menos electronegativo, el cesio, tiene una electronegatividad de 0,7. Teniendo en cuenta el concepto de electrinegatividad, podemos entender la existencia de diferentes tipos de uniones qumicas, de acuerdo a la fuerza con que los tomos atraen los electrones del enlace:
a) Cuando los valores de electrinegatividad de los tomos que intervienen en la unin sean muy diferentes.
b) Cuando ambos tomos posean Eletronegatividad baja y similar
c) Cuando los tomos posean electrinegatividad alta y similar.
En general, se puede observar que valores de Eletronegatividad de 2,5 o mayores son de los no metales y valores de 1,3 o menores son valores de metales alcalinos y alcalinotrreos. Entre ambos extremos se encuentran los valores de los metales de transicin.
Cuando los elementos que se unen presentan electronegatividades muy diferentes, la unin es tpicamente inica y cuando las electronegatividades son muy prximas, la unin es covalente.
Un criterio que podemos tomar como orientacin pero no como regla en todos los casos: si la diferencia de electronegatividades entre los elementos que se unen es mayor o igual a 1,9 el compuesto es inico. Si la diferencia es menos, el compuesto es covalente.
Ejemplos:
Tipos de unionesEjemplosDiferencia entre electro(-)
InicasNa+ Cl-Cl (3.0) Na (0,9) = 2,1
Covalente polarH2OO (3,5) H (2,1) = 1,4
Covalente no polarCH4C (2,5) H (2,1) = 0,4
En la formacin del enlace, los tomos pierden, ganan o comparten sus electrones de valencia, con el fin de alcanzar la configuracin electrnica y estabilidad del gas noble ms prximo a ellos. Es decir ocho electrones en su capa de valencia, con excepcin del helio que solo tiene dos, esto se conoce como Regla del Octeto.
Ejemplos: Formacin del in positivo: Na+.
Nao Na+ + 1 e- catintomo de sodio in sodio( 1s, 2s 2p6, 3s1) (1s, 2s 2p6) [Estructura del gas noble Ne] Formacin del ion negativo: Cl.
tomo de cloro in cloruro
(1s, 2s 2p6, 3s2 3p5) (1s, 2s 2p6, 3s2 3p6 )
[Estructura del gas noble Ar]El hecho de que existan tantas propiedades y que stas puedan tomar valores muy distintos dependiendo de la sustancia de que se trate, hace que resulte difcil clasificar en unos pocos grupos a todas las sustancias y cualquier regla que se establezca para ello dejar fuera a sustancias con propiedades intermedias o atpicas. No obstante, a pesar de estos inconvenientes, ha sido posible clasificar a la mayor parte de las sustancias en tres grandes grupos: En primer lugar nos encontramos con sustancias como el cloruro de sodio, sulfato de cobre, sulfato de calcio, fluoruro de calcio... que suelen ser compuestos slidos de aspecto cristalino, frgiles y con elevados puntos de fusin y ebullicin. Son, en general, ms o menos solubles en disolventes del tipo del agua y no lo son en disolventes tipo benceno. No son conductores de la corriente en estado slido, pero s lo son sus disoluciones acuosas y tambin ellos mismos cuando se funden. La existencia de este grupo de sustancias, est ligada a una forma de enlace que, por razones que luego veremos, se denomina enlace inico, designando consecuentemente dichas sustancias como compuestos inicos.
Enlace inico
Este enlace ocurre entre tomos de elementos cuyas electronegatividades son diferentes y hay transferencia completa de electrones desde un tomo al otro.
Un ejemplo de unin inica es el LiF
Li (1s2 2s1 ) Li+ (1s2) + e- tendr la CE del He
F (1s2 2s2 2p5) + e- F- (1s2 2s2 2p6) tendr la CE del Ne
Debido a su mayor electronegatividad el F atraer los electrones de la unin hacia su ncleo, esto producir la transferencia del electrn del Li hacia el F. Resulta la formacin de una partcula con carga (+) y otra con carga (-) con la CE estable. Este tipo de uniones se llaman IONICAS.Las fuerzas de atraccin se extienden en todas direcciones el ion Li+ se rodea de cierto nmero de F- y a la inversa. Por ello que el LiF no existe como molcula, sino que constituye una red tridimencional, en la cual cada Li+ est rodeado por 6 F- y al mismo tiempo cada F- rodeado por 6 Li+. Este ordenamiento regular, formado por repeticin de una estructura de geometra cbica llamada celda unitaria ejemplo del NaCl:
Caractersticas de los compuestos inicos El mineralogista francs Ren Just Hay (1743-1822), fue el primero que afirm que las formas externas regulares de los cristales inicos sugieren la existencia de una estructura microscpica ordenada, al suponer que cada cristal est formado por adiciones sucesivas de lo que hoy se conoce como clulas fundamentales para dar lugar a unas figuras geomtricas simples de ngulos constantes y de lados proporcionados. Mantuvo adems que diferencias en la forma cristalina implican diferencias en la composicin qumica.
La estructura cristalina de un slido inico est determinada por dos factores:
El tamao relativo de los iones, que ocasiona la geometra de la estructura.
La condicin de que la estructura total sea elctricamente neutra.
Los requisitos principales para la formacin de compuestos inicos son: energas de ionizacin relativamente bajas y afinidades electrnicas relativamente grandes, por lo que los compuestos tpicamente inicos son los formados por los elementos ubicados cerca de los extremos opuestos de la tabla peridica de los elementos.
En el dibujo se representa la estructura cristalina del NaCl. Cada in Cl esta rodeado por seis iones sodio, y cada in sodio esta rodeado por seis iones cloruro, en cualquier cristal de NaCl se encuentran miles de millones de iones con esta distribucin.
Segn la notacin de Lewis, la unin entre el Li y el F se representa
En los compuestos inicos las intensas fuerzas coulmbicas son las directas responsables de la estabilidad lograda por el sistema. En estado slido los iones interactan electrostticamente y se necesita bastante energa para separar esos iones. En estas condiciones los iones carecen de movilidad y no pueden conducir la corriente elctrica. Cuando estos cristales se disuelven en agua la red se desarma y los iones quedan libres.
Otras propiedades caractersticas de los compuestos inicos son:
Puntos de Fusin y ebullicin: la gran mayora son slidos a temperatura ambiente y tienen punto de fusin elevado.
Solubilidad: en general, son solubles en agua y otros solventes polares.
Dureza y fragilidad: Son duros y quebradizos, presentan resistencia al rayado.
Enlace CovalenteComo sabemos los tomos de los elementos adquieren similar estabilidad que los gases nobles si completan su capa externa. Una manera de hacerlo es compartir electrones con otros tomos que tambin necesitan alcanzar la estabilidad. En el enlace covalente las fuerzas que mantiene unidos los tomos son tambin de naturaleza electrosttica, pero se producen cuando dos tomos comparten sus electrones.
Existen distintos tipos de enlaces covalente:a) Covalente comn: este tipo de unin (A) establecida entre dos tomos en la cual el par electrnico est formado por un electrn de cada uno de los elementos. Este tipo de unin se establece entre tomos de un mismo elemento (enlace covalente (A)apolar) o diferentes elementos (covalente polar). Algunos elementos del Sistema Peridico tienen la particularidad de poder establecer uniones covalentes en las que entre dos tomos iguales se comparten ms de un par de electrones formndose enlaces covalentes mltiples. Este es el caso, por ejemplo, de las molculas de oxgeno (O2) y nitrgeno (N2).
En el segundo caso (B), los electrones no son atrados de la misma manera por los ncleos y pasarn ms tiempo cerca del ncleo del tomo ms electronegativo. La diferencia de atraccin de los ncleos genera un dipolo permanente sobre la molcula.
(B)
El Cl atrae al par de electrones del enlace con ms fuerza que el hidrgeno, de forma que ambos electrones estarn ms cerca del cloro, generndose as en la molcula una zona con un exceso de carga negativa (tomo de cloro) y otra con un defecto de carga negativa (tomo de hidrgeno).
El cloro no consigue arrancar del todo su electrn al hidrgeno, por lo que las cargas de ambos tomos son "parciales" y para designar este hecho se utilizan los smbolos - y +. El enlace covalente formado recibe el nombre de "enlace covalente polar". La molcula de HCl es una molcula polar porque en ella se aprecia una zona con mayor densidad de carga negativa separada de otra con defecto de carga negativa (dos polos).Se puede considerar un enlace covalente polar como uno intermedio entre un enlace covalente puro (no polar) y un enlace inico. En este sentido, se expresa a veces la polaridad del enlace como: Carcter inico parcial.
El carbono puede formar cuatro enlaces covalentes. En el diamante cada tomo est fuertemente unido a otros cuatro prximos situados en los vrtices de un tetraedro regular, los enlaces C C son muy fuertes y el cristal es muy duro. El grafito, consta de capas de tomos, cada uno tiene tres prximos, est unido a dos de ellos por enlaces covalente simple y el tercero por enlace doble. Estructura diamante Estructura grafitoUnin Metlica En el caso que se unen tomos que tienen electronegatividad baja y cercana, ninguno de los tomos atraer con gran fuerza los electrones de la unin. Los iones de una red metlica se disponen formando planos y los electrones de valencia se mueven libremente entre ellos. A pesar de estar formados por cargas del mismo signo, los planos no se repelen ya que la nube de electrones hace de pantalla, aunque pueden desplazarse unos sobre otros con facilidad. (ver figura). Este tipo de unin se denomina unin metlica y tiene como ejemplo principal los metales en su estado elemental.
Las propiedades de los metales de conducir la corriente elctrica y el calor demuestran la libertad de los electrones para moverse en la red.
Los metales tienen punto de fusin y densidad elevadas, el conjunto de electrones unen fuertemente a los iones positivos.
La ductilidad y maleabilidad metlica se explican: los iones que tienen igual carga, se pueden deslizar fcilmente unos sobre otros en varias direcciones. El brillo metlico tambin se encuentra asociado a la movilidad de los electrones.
En la conduccin electrnica que es el tipo de conduccin que tiene lugar en los metales, la carga es transportada por los electrones. En la conduccin ionica, la carga es transportada por los iones. Este es el mecanismo de conduccin en una sal fundida o en solucin electrnica. A causa de que los iones son demasiados voluminosos para viajar con facilidad a travs de la mayora de los slidos, el flujo de carga a travs de los slidos es casi siempre un resultado de la conduccin electrnica.FUERZAS INTERMOLECULARES
Como consecuencia de la estructura que presentan las molculas, se producen entre ellas diferentes fuerzas de atraccin. Estas fuerzas son de distinta intensidad y mantienen ms o menos unidas a las molculas entre s, determinando las propiedades de las sustancias, tales como: estado de agregacin, punto de ebullicin, solubilidad, etc.
Las fuerzas de atraccin intermoleculares se denominan fuerzas de Van der Waals.
Entre las fuerzas de Van der Waals se destacan:
Fuerzas de LondonDipolo-Dipolo InducidoDipolo-DipoloSMBOLOS USADOS
Molcula NO POLARDipolo INDUCIDO o TRANSITORIODipolo
FUERZAS DE LONDON
En las molculas no polares puede producirse transitoriamente un desplazamiento relativo de los electrones originando un polo positivo y otro negativo (dipolo transitorio) que determinan una atraccin entre dichas molculas. (El polo positivo de una molcula atrae al polo negativo de la otra, y viceversa).
Estas fuerzas de atraccin son muy dbiles y se denominan fuerzas de London.
FUERZAS DIPOLO - DIPOLO INDUCIDO
En ciertas ocasiones, una molcula polar (dipolo), al estar prxima a otra no polar, induce en sta un dipolo transitorio, produciendo una fuerza de atraccin intermolecular llamada dipolo-dipolo inducido.
As, el agua cuya molcula es un dipolo, produce una pequea polarizacin en la molcula no polar de OXGENO, la cual se transforma en un dipolo inducido. Esto hace que el OXGENO y el DIXIDO DE CARBONO, que son no polares presenten cierta solubilidad en solventes polares, como el agua.
FUERZAS DIPOLO DIPOLO
Cuando dos molculas polares (dipolo) se aproximan, se produce una atraccin entre el polo positivo de una de ellas y el negativo de la otra.
Esta fuerza de atraccin entre dos dipolos es tanto ms intensa cuanto mayor es la polarizacin de dichas molculas polares.
Estas fuerzas de atraccin, llamadas dipolo-dipolo, se observan en las molculas covalentes polares, como el sulfuro de hidrgeno H2S , el metanol CH3OH , la glucosa C6H12O6 , etc. Estas sustancias de elevada polaridad se disuelven en solventes polares tales como el agua.
Entre las fuerzas dipolo-dipolo tiene particular importancia la:
UNIN PUENTE DE HIDRGENO
En algunas sustancias que contienen HIDRGENO, como fluoruro de hidrgeno HF, agua H2O, y amoniaco NH3, se observa una forma de unin entre sus molculas, denominada unin puente de hidrgeno.
En el caso del HF, las molculas son covalentes polares como consecuencia de la diferencia de electronegatividad que existe entre el hidrgeno y el flor.
Esta polarizacin provoca la atraccin de la zona positiva de una molcula con la zona negativa de otra, formando un puente entre ambas molculas.
Las molculas de agua tambin son dipolos a causa de la diferencia de electronegatividad entre el oxgeno y el hidrgeno, y forman entre ellas uniones puente de hidrgeno.
Pierde un electrn
EMBED PBrush