Tablas de Datos y Resultados
-
Upload
diego-ortega-arica -
Category
Documents
-
view
212 -
download
0
description
Transcript of Tablas de Datos y Resultados
7/18/2019 Tablas de Datos y Resultados
http://slidepdf.com/reader/full/tablas-de-datos-y-resultados 1/6
TABLAS DE DATOS Y RESULTADOS
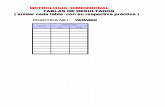
Tabla N°1: Condiciones de laboratorio
P(mmHg) T(°C) H.R.(%)756 23 92
Tabla N°2:Datos experimentales
Valoración del NaOH ≅0.01 N
W BHK 0.0257g
V NaOH gastado 10.9ml
PF (BHK ) 204.22g/mo
l
N corregida NaOH 0.01181N
Valoración del HCl≅0.05 N
V HCl 3ml
V NaOH gastado 12.5ml
N corregida HCl 0.0492N
Valoración del HAc≅0.05 N
con NaOH ≅0.01 N
V HAc 3ml
V NaOH gasta do 15.6ml
N corregidaHAc 0.0614N
Medidas de las conductividades
de las soluciones
7/18/2019 Tablas de Datos y Resultados
http://slidepdf.com/reader/full/tablas-de-datos-y-resultados 2/6
SOLUCIONE
S
N(0.01) N(0.001) N(0.0005)
HCl 412 μ S 421,36
μ S
422,74
μ S
HAc 16.3 μ S 49.2 μS 16.3 μS
Datos teóricos
HAc K i Λ∞
1.8×10−5
367.27S.cm2
. eq−1
HCl Λ∞
400.55 S.cm2
. eq−1
7/18/2019 Tablas de Datos y Resultados
http://slidepdf.com/reader/full/tablas-de-datos-y-resultados 3/6
EJEMPLO DE CÁLCULOS
1) Obtenga la constante de celda a partir de las medidas para el
KCl .
Sabemos que:k = ( l
A )
Dónde: k KCla21! C =1.40877×10−3
S /cm
=1370 μS
Reemplazando los valores se obtiene el valor de la constante de celda:
( l
A )= k
=1.40877×10
−3
1370×10−6
=1.0283 cm−1
2) Determine las concentraciones exactas de las soluciones y
diluciones.
Estandarización del NaOH ≅0.01 N
con biftalato de potasio
W BHK =0.0257 g P" ( BHK )=204.22 V gastado NaOH =10.9ml
Sabemos que: N NaOH =
W BHK
P" (BHK )× V gastado NaOH
N NaOH = 0.0257
204.22×10.9×10−3
# N NaOH =0.01154
7/18/2019 Tablas de Datos y Resultados
http://slidepdf.com/reader/full/tablas-de-datos-y-resultados 4/6
Estandarización del HCl≅0.05 N
utilizando NaOH
V HCl × N HCl=V NaOH × N NaOH
(3ml ) ( N HCl)=(12.5ml)(0.01181 N )
# N HCl=0.0492 N
3) Grafique Λ $s √ N para el HAc
10 20 30 40 50 60 70 80
0
0.02
0.04
0.06
0.08
0.1
0.12
f(x) = - 0x + 0.12
HAc
HAc
Linear (HAc)
7/18/2019 Tablas de Datos y Resultados
http://slidepdf.com/reader/full/tablas-de-datos-y-resultados 5/6
410 412 414 416 418 420 422 424
0
0.02
0.04
0.06
0.08
0.1
0.12
f(x) = - 0.01x + 3.09
HCl
HCl
Linear (HCl)
4) Calcule la conductividad límite y la constante de ionización del
HAc y la conductividad límite para el HCl , de los gráficos
obtenidos:
A partir de la gráfica se obtiene la conductividad límite prolongando la recta
hasta que la concentración sea igual a cero.
Λ∞ ( HAc )=75.81S.cm2
. eq−1
Λ∞ ( HAc )=423 S.cm2
. eq−1
Para calcular el grado de ionización y la constante de ionización se usa para el
HAc :
% = Λ
Λ∞ , para el HAc0.01 N
% = 16.3
75.81=0.215