Balanceo de ecuaciones químicas por el método del ión electrón en soluciones ácidas o neutras
Soluciones Químicas
-
Upload
masainzpereira -
Category
Travel
-
view
46.793 -
download
1
description
Transcript of Soluciones Químicas

Soluciones químicas
NM2 (2° medio)
Soluciones químicas
Química

SOLUCIONES
SOLUTO SOLVENTE
SEGÚN EL ESTADO FISICO DEL SOLVENTE
SOLIDA LIQUIDA GASEOSA
mezclas homogéneas de dos sustancias:

Son mezclas homogéneas de dos sustancias: soluto y solvente.
a) Soluto: es la sustancia que se disuelve
b) Solvente: o disolvente , es el medio donde se disuelve el soluto.
Según el estado físico del disolvente, las soluciones pueden ser sólidas, liquidas gaseosas.
a) Solución Liquida: cuando el solvente es liquido así:
- sólido en liquido
Ejemplo: ClNa en agua
- Liquido en liquido: Ejemplo: alcohol en agua
- Gas en liquido Ejemplo: co2 en agua

b) Solución Solida: cuando el solvente es solido:
- Solido en sólido: Ejemplo: las aleaciones
- Líquido en sólido Ejemplo: mercurio en oro
(amalgama)
- Gas en sólido: Ejemplo: hidrogeno en paladio
c) Solución Gaseosa :cuando el solvente es gas:
- Ejemplo: el aire Gas en gas:
- Líquido en gas: Ejemplo: vapor de agua en aire
- Sólido en gas: Ejemplo: partículas de polvo en el aire

Esta dada por la proporción de soluto en la solución.
Solución standard: es una solución cuya concentración es conocida y que sirve de comparación para otras.
Por la abundancia relativa del soluto en las soluciones, estas pueden ser:
a).- Diluida: cuando proporcionalmente tienen poco soluto
b).-Concentrada: cuando proporcionalmente tienen abundante soluto

c).- Saturadas: cuando la abundancia de soluto es tal que el solvente ya no es capaz de disolver mas soluto.
d).- Sobre Saturada: cuando tiene mas soluto que su punto de saturación, la sobre saturación se logra mediante procedimientos especiales como por ejemplo calentar la solución.

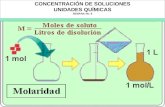
Molaridad: esta dada por el numero de moles de soluto que esta disuelto
en un litro de solución.
-Se calcula con la expresión:
Ejemplo: 49 g.de H2SO4 (PM 98 g) están disueltos en un litro de
solución
Molaridad=
Molaridad= 0.5 mol / lt.
= 0.5 M
Normalidad : Esta dada por el número de Eq.gr. De soluto
que esta disuelto en un litro de solución.
Se calcula con la expresión:
Ejemplo: si 1 eq. Del H2SO4 es 49 gr.
Y esta disuelto el un litro de solución, se tiene:
Normalidad =
CM = 1 eq. – gr./ lt.= 1N

Esta dado por el numero de moles de soluto que esta disuelto en 1 Kg. de solvente.
Se calcula con la expresión:
Ejemplo: si un mol de H2SO4 (98gr) esta disuelto en 1 Kg. De agua se tiene:
Molalidad =
CM = 1 mol/ Kg.. = 1 m
Que se lee “1 molal”

En 1909 el químico danés Sorensen definió el potencial hidrogeno (pH) como el logaritmo negativo de la
actividad de los iones hidrógeno. Esto es:
En soluciones diluidas, se acepta actividad aproximadamente igual a concentración molar.
El pH típicamente va de 0 a 14 en disolución acuosa, siendo las disoluciones con pH menores a 7 ácidas, y las tiene pH mayores a 7, básicos.

El pH = 7 indica la neutralidad de la disolución (siendo el disolvente agua). Se considera que p es un operador logarítmico sobre la concentración de una solución: p = -log(...)
También se define el pOH, que mide la concentración de iones OH-. Puesto que el agua está disociada en una pequeña extensión en iones OH- y H+, tenemos que:
Kw = [H+][OH-]=10-14
en donde [H+] es la concentración de iones de hidrógeno, [OH-] la de iones hidróxido, y Kw es una constante conocida como
producto iónico del agua.

El pH de una disolución es una medida de la concentración de iones hidrógeno. Una pequeña variación en el pH significa un
importante cambio en la concentración de los iones hidrógeno. Por ejemplo, la concentración de iones hidrógeno en los jugos gástricos (pH = 1) es casi un millón de veces mayor que la del
agua pura (pH = 7).

El valor de pH de una solución puede ser estimado si se sabe la concentración de iones H+.
Algunos ejemplos:
•Solución acuosa de Ácido clorhídrico(HCl) 0,1M:
Este es un ácido fuerte, por eso se encuentra completamente disociado y se encuentra lo suficientemente diluido para que la actividad sea próxima de la concentración.
Así [H+]=0,1 M y pH=-log[0,1]=1.

•Solución acuosa de Hidróxido de sodio (NaOH) 0,1M:
Esta es una base fuerte, por eso se encuentra completamente disociada y se encuentra suficientemente diluida para que la actividad sea próxima de la concentración.
Así [OH-]=0,1 M y pOH=-log[0,1]=1. Luego pH=14-1=13.