Sistema Renal
-
Upload
jocelyne-zamora -
Category
Documents
-
view
15 -
download
1
Transcript of Sistema Renal

Sistema Renal
Los sistemas renal y urinario están constituidos por un grupo complejo de órganos que en conjunto se encargan de filtrar los productos residuales de la sangre y de fabricar, almacenar y eliminar la orina. Estos órganos son esenciales para la hemostasia, ya que mantienen el equilibrio hídrico, el equilibrio acidobásico y la presión arterial. Los órganos fundamentales del sistema nefrourinario son los dos riñones y la vejiga urinaria. Durante el proceso de filtración de los productos residuales de la sangre, los riñones pueden exponerse a concentraciones elevadas de sustancias tóxicas endógenas y exógenas. De este modo, algunas células renales están expuestas a concentraciones mil veces superiores a las sanguíneas.
Los problemas que causan daños en los riñones pueden ser prerrenales (afectan al aporte sanguíneo a los riñones), renales (afectan al propio riñón) o posrenales (afectan a cualquier punto de la ruta que sigue la orina desde el riñón hasta la salida de la uretra o el pene). Los problemas posrenales suelen ser de tipo obstructivo; un punto de obstrucción muy frecuente es la próstata, que se encuentra entre la vejiga y la uretra. Cualquier trastorno preexistente de la próstata, la vejiga o los uréteres, en particular las infecciones, las obstrucciones o los cuerpos extraños (como los cálculos), puede comprometer la función renal y aumentar la sensibilidad a los defectos adquiridos o genéticos.
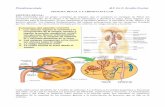
Anatomía y fisiopatología del riñón
El riñón humano es un órgano complejo cuya función consiste en filtrar los productos residuales de la sangre y producir orina. Los dos riñones desempeñan

además otras funciones vitales, como el mantenimiento de la homeostasia y la regulación de la presión arterial, la presión osmótica y el equilibrio acidobásico.
Los riñones reciben el 25 % del gasto cardíaco total, lo que supone una exposición potencial a las toxinas endógenas y exógenas. Los riñones se sitúan a ambos lados de la columna vertebral en la parte inferior de la espalda. Cada uno de ellos pesa unos 150 g y tiene aproximadamente el tamaño de una naranja. El riñón consta de tres capas: la corteza (capa exterior), la médula y la pelvis renal. La sangre fluye a la corteza y la médula a través de la arteria renal, que se ramifica en arterias cada vez más pequeñas. Cada una de las arterias termina en una unidad de filtración sanguínea denominada nefrona. Un riñón sano contiene aproximadamente 1.200.000 nefronas, estratégicamente situadas dentro de la corteza y la médula.
Una nefrona está formada por el glomérulo (un grupo de vasos sanguíneos muy finos), rodeado por la cápsula de Bowman (una membrana de dos capas), que desemboca en un túbulo contorneado. El plasma, la fracción líquida de la sangre, es empujado a través del glomérulo al interior de la cápsula de Bowman y pasa después, en forma de plasma filtrado, al túbulo contorneado. Alrededor del 99 % del agua y los nutrientes esenciales filtrados son reabsorbidos por las células tubulares y pasan a los capilares que rodean el túbulo contorneado. La sangre sin filtrar que permanece en el glomérulo, fluye también a los capilares y vuelve al corazón a través de la vena renal.
Las nefronas son conductos largos y serpenteantes compuestos por varios segmentos, cada uno de los cuales desempeña diversas funciones relacionadas con el mantenimiento de los mecanismos homeostásicos del organismo. Cada uno de los segmentos de la nefrona tiene un aporte sanguíneo diferenciado que regula el gradiente iónico.
Determinadas sustancias químicas pueden influir directamente sobre segmentos específicos de la nefrona de forma aguda o crónica, dependiendo del tipo y la dosis de la exposición xenobiótica. Según el segmento de la microanatomía sobre el que actúe, pueden afectarse diferentes aspectos de la función renal.
Los vasos sanguíneos renales sólo irrigan los elementos glomerulares y tubulares, aportando los productos residuales que hay que filtrar y absorbiendo nutrientes, proteínas y electrólitos, además de suministrar el oxígeno necesario para la viabilidad del órgano. El 90 % del flujo sanguíneo se dirige a la corteza, y el aporte disminuye gradualmente hacia la médula. Esa diferencia de flujo y la situación de las nefronas son esenciales para el mecanismo de contracorriente, que concentra aún más la orina y las posibles nefrotoxinas.
El glomérulo se encuentra entre las arteriolas aferentes y eferentes. Las arteriolas eferentes forman una red de capilares alrededor de cada unidad nefronal, con la excepción de la yuxtaposición del túbulo distal junto a la irrigación aferente del glomérulo. Los túbulos aferentes y eferentes, inervados por los nervios simpáticos,

responden a la estimulación vegetativa y a mediadores hormonales como la vasopresina y la hormona antidiurética (ADH). Una zona conocida como mácula densa, que forma parte del aparato yuxtaglomerular, produce renina, un mediador de la presión arterial, en respuesta a los cambios osmóticos y de la presión arterial. Las enzimas hepáticas convierten la renina en angiotensina II, un octapéptido que regula el flujo sanguíneo a los riñones, actuando preferentemente sobre las arteriolas aferentes y las células mesangiales del glomérulo.
El glomérulo sólo permite durante la filtración el paso de proteínas de tamaño determinado con una carga definida. La filtración del plasma está controlada por un equilibrio de las presiones oncótica e hidrostática. Los glucosaminoglucanos, unos azúcares especializados, proporcionan una carga aniónica negativa que inhibe, por fuerzas electrostáticas, la filtración de las moléculas con carga negativa. El estrato tricelular de la membrana basal glomerular presenta numerosos podocitos que aumentan la superficie de absorción y forman los poros por los que pasa el filtrado.
La lesión de la membrana basal especializada o del endotelio capilar puede permitir el paso a la orina de albúmina (un tipo de proteína) en grandes cantidades. La presencia en la orina de un exceso de albúmina o de otras microproteínas es un indicador de lesión glomerular o tubular.El intersticio renal es el espacio que existe entre las nefronas, y es mayor en la zona medular central que en la corteza exterior. En el intersticio hay células intersticiales muy próximas a los vasos medulares y a las células tubulares. Con el envejecimiento pueden proliferar las células intersticiales de la corteza, con la formación de fibrosis y cicatrices. Las células intersticiales contienen gotitas de lípidos y pueden participar en el control de la presión arterial mediante la liberación de factores de relajación o constricción vasculares. Las alteraciones crónicas delintersticio pueden afectar al glomérulo y los túbulos, y a la inversa. Por consiguiente, en las nefropatías terminales cuesta a veces definir con exactitud los mecanismos histopatológicos de la insuficiencia renal.
Formación de la orina
La orina se forma básicamente a través de tres procesos que se desarrollan en las nefronas. Los tres procesos básicos de formación de orina son:
FiltraciónEs un proceso que permite el paso de líquido desde el glomérulo hacia la cápsula de Bowman por la diferencia de presión sanguínea que hay entre ambas zonas.El líquido que ingresa al glomérulo tiene una composición química similar al plasma sanguíneo, pero sin proteínas, las cuales no logran atravesar los capilares glomerulares. Bajo condiciones normales, la porción celular de la sangre, es decir, los glóbulos rojos, los glóbulos blancos y las plaquetas, tampoco atraviesan los glomérulos. La razón anatómica fundamental por la que se produce la filtración del plasma en los glomérulos se debe, en primer lugar, a la permeabilidad del capilar glomerular; y en segundo lugar, a que la arteriola eferente tiene un diámetro

ligeramente menor al de la arteriola aferente, por lo que se crean así en el interior del glomérulo las presiones necesarias para que se produzca la filtración del plasma.
A través del índice de filtrado glomerular, es posible inferir que cada 24 horas se filtran, en ambos riñones, 180 litros aproximadamente. Los factores que influyen en la filtración glomerular son: flujo sanguíneo y efecto de las arteriolas aferente y eferente.
ReabsorciónMuchos de los componentes del plasma que son filtrados en el glomérulo, regresan de nuevo a la sangre. Es el proceso mediante el cual las sustancias pasan desde el interior del túbulo renal hacia los capilares peritubulares, es decir, hacia la sangre. Este proceso, permite la recuperación de agua, sales, azúcares y aminoácidos que fueron filtrados en el glomérulo.
SecreciónUna vez formada la orina en los glomérulos, discurre por los túbulos hasta llegar a la pelvis renal, desde donde pasa al uréter y llega a la vejiga, lugar donde es almacenada. Cuando el volumen supera los 250-500 cm3, sentimos la necesidad de orinar, debido a las contracciones y relajaciones del esfínter, que despierta el reflejo de la micción. La necesidad de orinar puede reprimirse voluntariamente durante cierto tiempo. La frecuencia de las micciones varía de un individuo a otro debido a que en ella intervienen factores personales como son el hábito, el estado psíquico de alegría o tensión, y el consumo en mayor o menor medida de bebidas alcohólicas. La cantidad de orina emitida en 24 horas en el hombre es de aproximadamente 1500 cm3. El aumento por encima de esta cifra se denomina poliuria y la disminución oliguria.
Insuficiencia Renal
En el curso de la insuficiencia renal, tanto aguda como crónica, la reducción del volumen de filtrado glomerular resulta en la retención de aniones de ácidos fijos, los que en condiciones normales son excretados por filtración glomerular. Este proceso resulta en un aumento del anión innominado del plasma. Simultáneamente, el daño presente en los túbulos renales reduce la capacidad de regeneración del bicarbonato filtrado así como la excreción renal de ácidos en forma de acidez titulable y amonio urinario. este daño resulta en una disminución de la concentración de bicarbonato en plasma. El resultado neto de la suma de estos dos procesos, insuficiencia glomerular y daño tubular, conduce al desarrollo de la acidosis metabólica de tipo elevado anión innominado que es característica de la insuficiencia renal o uremia.
Considerando que la alteración del estado ácido-base difiere en la forma aguda de insuficiencia renal con respecto a la crónica, analizaremos dichas situaciones por separado. En las formas más comunes de insuficiencia renal aguda de moderada

a severa, el aumento del nivel plasmático de urea y creatinina se acompaña de acidosis metabólica con elevado anión innominado.En la insuficiencia renal crónica, particularmente cuando la insuficiencia renal es de moderada intensidad, se desarrolla acidosis metabólica de tipo hiperclorémica (con anión indeterminado normal). El mecanismo principal responsable de la hipobicarbonatemia parece residir en una reducción de la anoniogénesis en el parénquima renal, mientras que la reducción de la reabsorción del bicarbonato filtrado tiene un papel de menor importancia. cuando la insuficiencia renal crónica es más avanzada y el volumen del filtrado glomerular se reduce por debajo de 20 a 30 ml/min y la urea y la creatinina se elevan a más de 40mg/dl, respectivamente, se observa el desarrollo de acidosis metabólica de elevado anión inominado.
Insuficiencia renal aguda
Se denomina insuficiencia renal aguda (IRA) a la reducción brusca, en horas o días, de la función renal; se produce una disminución del filtrado glomerular y un acumulo de productos nitrogenados séricos (aumento de urea y creatinina en sangre) con incapacidad para regular la homeostasis (equilibrio ácido-base e hidroelectrolítico). Aunque se suele asociar a una disminución de la diuresis (IRA oligúrica), hasta un 40% de los casos no cursan con oliguria e incluso puede existir poliuria (IRA no oligúrica). La IRA suele presentarse como una complicación de enfermedades graves previas, apareciendo entre el 5 al 30% de enfermos hospitalizados.
Clasificación Etiopatogenica
Desde el punto de vista fisiopatológico existen tres mecanismos por los que puedeproducirse un fracaso renal agudo:
a) IRA Prerrenal ó Funcional: Existe una inadecuada perfusión renal que compromete el filtrado glomerular; sería, por tanto, una respuesta fisiológica a la hipoperfusión renal pero el parénquima renal está íntegro. Es la causa más frecuente de IRA suponiendo el 60-70% de los casos. Es reversible si se actúa sobre la causa desencadenante de manera precoz.
b) IRA Renal, Parenquimatosa o Intrínseca: La causa del deterioro de la función renal es un daño en las estructuras anatómicas; se clasifica según la estructura primariamente dañada: glomérulos, túbulos, intersticio o vasos renales. Esta causa supone el 25% de los casos de IRA.
Desde un punto de vista clínico-patológico se dividen las causas de IRA intrínseca en 4 apartados:
NECROSIS TUBULAR AGUDA (NTA) : lesión de los túbulos renales por mecanismos isquémicos o tóxicos.
LESION GLOMERULAR: glomerulonefritis agudas y rápidamente progresivas, hipertensión maligna, vasculitis, síndrome hemolítico-urémico, púrpura trombótica trombocitopénica, toxemia del embarazo, esclerodermia.

LESIÓN TUBULOINTERSTICIAL: reacciones alérgicas a fármacos (antibióticos, AINES, diuréticos), infecciones (legionella, leptospira, citomegalovirus, cándidas).
LESIÓN DE GRANDES VASOS: obstrucción de arterias renales (placa aterosclerótica, trombosis, embolia), obstrucción de venas renales (trombosis, compresión).
c) IRA Posrenal u Obstructiva: Las causas son lesiones que produzcan un obstáculo en la vía urinaria que impida la salida de la orina formada, provocando un aumento de presión que se transmite retrógradamente , comprometiendo el filtrado glomerular. Supone un 5% de las causas de IRA. Pueden ser lesiones extrarrenales de uréteres-pelvis (litiasis, tumores, fibrosis..), vejiga (litiasis, coágulos, tumores, prosatatismo, vejiga neurógena), uretra (estenosis, fimosis) o también lesiones intrarrenales (depósito de cristales, coágulos, cilindros). Para que estas causas produzcan una IRA es necesario que la obstrucción sea grave, prolongada y que afecte a tracto urinario distal (meato uretral externo, cuello de la vejiga) o bien a los uréteres de manera bilateral o unilateral en paciente con un único riñón funcionante.
Insuficiencia renal crónica
La insuficiencia renal crónica (IRC) se define como la pérdida progresiva, permanente e irreversible de la tasa de filtración glomerular a lo largo de un tiempo variable, a veces incluso de años, expresada por una reducción del aclaramiento de creatinina estimado < 60 ml/min/1,73 m2 (1). También se puede definir como la presencia de daño renal persistente durante al menos 3 meses, secundario a la reducción lenta, progresiva e irreversible del número de nefronas con el consecuente síndrome clínico derivado de la incapacidad renal para llevar a cabo funciones depurativas, excretoras, reguladoras y endocrinometabólicas.
El término insuficiencia renal crónica terminal (IRCT) se ha utilizado fundamentalmente para referirse a aquella situación subsidiaria de inicio de tratamiento sustitutivo de la función renal, bien mediante diálisis o trasplante, con unas tasas de incidencia y prevalencia crecientes en las dos últimas décadas.
Estadios evolutivos de la IRC
La IRC es una enfermedad progresiva, que evoluciona en diferentes estadios en los que se van incrementando las manifestaciones clínicas. Dichos estadios se establecen basados en la función renal medida por el filtrado glomerular estimado.
La determinación de creatinina no es considerada como una buena medida de función renal, ya que no refleja el mismo grado de función en todos los pacientes. La creatinina depende de la masa muscular, edad, sexo y secreción tubular entre otros factores. El riñón es capaz de perder hasta un 50% de su función sin reflejar un incremento en la creatinina sérica. La recogida de orina de 24 horas está sujeta, a su vez, a variaciones importantes y errores considerables. Por ello, en las

diferentes guías se recomienda el cálculo estimado de la filtración glomerular, siendo recomendada la utilización de la fórmula de Cockroft-Gault .
Su progresión suele seguir un patrón constante, dependiente de la etiología y de las características del paciente; sin embargo, dicha evolución puede verse acelerada por diferentes factores patológicos y ralentizados por medidas terapéuticas pautadas.
En el año 2002, la National Kidney Foundation estadounidense publicó a través del proyecto K/DOQI (Kidney Disease Outcomes Quality Initiative) una serie de guías de práctica clínica sobre la evaluación, clasificación y estratificación de la ERC. Así se consiguió definir, clasificar en estadíos y evaluar los métodos de estudio de esta patología con el fin de retrasar su aparición, prevenir complicaciones y establecer un adecuado manejo terapéutico .
Esta clasificación permite, a su vez, la detección de pacientes de riesgo para el desarrollo de la enfermedad:
a)Estadios 1 y 2: daño renal con: FG 90 ml/min/ 1,73 y FG 60-89 ml/min/1,73 m2, respectivamente. En esta situación podemos encontrar: microalbuminuria/ proteinuria, alteración en el sedimento urinario y en las pruebas de imagen.
Aproximadamente el 75% de los individuos mayores de 70 años se encuentran en este estadio. La función renal global es suficiente para mantener al paciente asintomático, debido a la función adaptativa de las nefronas. El correcto plan de actuación en ambos estadios radica en el diagnóstico precoz y en el inicio de medidas preventivas con el fin de evitar la progresión.
b) Estadio 3: FG 30-59 ml/min/1,73 m2. Puede acompañarse de las siguientes alteraciones: aumento de urea y creatinina en sangre, alteraciones clínicas

(hipertensión, anemia), alteraciones de laboratorio (hiperlipidemia, hiperuricemia), alteraciones leves del metabolismo fosfo-cálcico y disminución de la capacidad de concentración urinaria (poliuria/nicturia).
La ERC, estadios 2-3, aumenta con la edad, siendo la prevalencia mayor en mujeres con una tendencia de aparición en edades medias, persistiendo en edades mayores de 65 años. Con el método Cockroft-Gault, casi la mitad de las mujeres mayores de 65 años tienen una ERC estadio 3 frente a un tercio de los varones.
Una vez alcanzado el estadio 3, comienzan a aparecer signos clínicos que demuestran la vulnerabilidad renal. La totalidad de los pacientes deben someterse a una valoración nefrológica global, con el fin de recibir tratamiento específico preventivo y detectar complicaciones.
c) Estadio 4: FG 15-29 ml/min/1,73 m2. En este estadio se produce una intensificación de alteraciones clínicas: anemia intensa refractaria, hipertensión acentuada, trastornos digestivos, circulatorios y neurológicos.
Puede haber acidosis metabólica, alteraciones moderadas del metabolismo fosfo-cálcico y prurito. Se conserva, no obstante, la excreción adecuada de potasio. En dicho estadio además de la instauración de terapéutica específica se hace indispensable la valoración de la instauración de una preparación para el tratamiento renal sustitutivo.
d) Estadio 5: FG < 15 ml/min/1,73 m2. Cursa con osteodistrofia renal y trastornos endocrinos y dermatológicos sobreañadidos a las alteraciones previas. Dicho estadio corresponde al síndrome urémico, en el que además de las medidas previas es obligada la valoración del inicio del tratamiento renal sustitutivo: diálisis —peritoneal/hemodiálisis— o trasplante renal.
Es conocido que los pacientes pertenecientes al estadio 5 no reciben una atención adecuada en estadios anteriores, y que en un alto porcentaje son remitidos tardíamente a los servicios de nefrología desde los centros de Atención Primaria y especializada. Entre los motivos destacan: edad avanzada, severa comorbilidad, ausencia de síntomas, factores económicos y un diagnóstico tardío.
Hemodiálisis
La hemodiálisis es el método más común para tratar la insuficiencia renal avanzada y permanente. Desde la década de los sesenta, cuando la hemodiálisis

se convirtió por primera vez en un tratamiento práctico para la insuficiencia renal, hemos aprendido mucho sobre cómo hacer que los tratamientos de hemodiálisis sean más eficaces y cómo minimizar sus efectos secundarios. En los últimos años, los aparatos para diálisis más compactos y simples han hecho que la diálisis en el hogar sea cada vez una opción más accesible. Pero incluso con mejores procedimientos y equipos, la hemodiálisis sigue siendo una terapia complicada e incómoda que requiere un esfuerzo coordinado de todo su equipo de profesionales de la salud, incluyendo su nefrólogo, enfermero de diálisis, técnico de diálisis, dietista y trabajador social. Los miembros más importantes de su equipo de profesionales de la salud son usted y su familia. Al aprender sobre su tratamiento, podrá trabajar con su equipo para obtener los mejores resultados posibles y poder llevar una vida plena y activa.
Principios de hemodiálisis
La hemodiálisis periódica tiene por objeto reemplazar al riñón en las funciones de excreción de sustancias de desecho y la regulación hidroeléctrica.
Esta función se realiza por medio del intercambio que se lleva a cabo a través de una membrana semipermeable, ubicada entre la sangre del paciente y la solución del baño de diálisis, cuya composición electrolítica es similar al líquido extra celular normal. la extracción de agua y sales acumuladas entre el periodo interdialisis se realiza por medio de un gradiente de presión hidrostática entre la sangre del paciente y el baño de diálisis.
El dispositivo que permite este intercambio de solutos y excreción de desechos es un dializador. para que ese intercambio se realice a nivel del dializador intervienen dos mecanismos:
Difusión Ultrafiltración
Difusión
Es una transferencia pasiva de solutos a través de una membrana semipermeable sin paso del solvente.
La transferencia de un soluto se define como la cantidad de dicho soluto que pasa de la sangre al baño de diálisis en una unidad de tiempo.
El sentido de intercambio viene determinado por las concentraciones respectivas de los solutos a uno y otro lado de la membrana semipermeable del dializador.
La cantidad de solutos extraída de la sangre en un tiempo dado, se puede expresar como la diferencia entre la cantidad de soluto a la entrada del dializador y la cantidad de solutos que se encuentra a la salida del dializador. esta diferencia se encuentra en el dializador.

La cantidad de sustancia que atraviesa la membrana semipermeable por difusión depende de 3 factores:
a) gradiente de concentraciónb) superficie de la membranac) coeficiente global de permeabilidad del dializador
a) El gradiente de concentración del soluto a uno y otro lado de la membrana, para alcanzar la transferencia máxima, debe ser lo más elevado posible. Esta condición se da, cuando en el baño de diálisis, no contiene el soluto considerado. Es el caso de la urea, creatinina y ácido úrico.
b) La superficie de la membrana, a mayor superficie, mayor difusión. Lo que limita esto, es la salida de sangre extracorpórea, a veces el paciente no tolera los volúmenes muy altos. Debido a esto hay nuevas tendencias de hacer dializadores con membranas más permeables y de menor superficie.
c) Coeficiente global de permeabilidad del dializador (RO). Este coeficiente está formado por varios factores, que son los que condicionan el paso de un soluto a través del dializador. Ejemplo: si se desea eliminar una molécula de urea, está debe pasar por la sangre, la membrana del dializador y alcanzar el liquido de diálisis.
La resistencia opuesta de cada uno de estos compartimientos se puede simbolizar como:
RS + RM + RD = RO, donde:RS resistencia sangreRM resistencia membranaRD resistencia dializado
El coeficiente global de permeabilidad de los dializadores es inversamente proporcional a la resistencia. Esto quiere decir que para aumentar la transferencia por difusión de un soluto, se debe disminuir la resistencia de cada uno de los compartimientos.
En resumen: Para bajar la resistencia de cada uno de los compartimientos se debe considerar la disminución de:
RS. Con diámetros menores en los capilares, menor será la resistencia. Los diámetros recomendados actualmente son de 200 a 220 micras.
RD. Al disminuir la velocidad de dializado, disminuye la cantidad de moléculas que atraviesan la membrana. Se requiere un flujo de al menos 500 a 600 ml/h.
RM. Membranas más gruesas retardaran la diálisis; por ejemplo, a las membranas de cuprofan se les disminuyó el diámetro de 30 a 8 micras.

La transferencia por difusión varía considerablemente de un soluto a otro. Es mayor conforme el peso molecular del soluto es menor.
Los 2 factores que aumenta la difusión de un soluto son el RO (Coeficiente global de permeabilidad del dializador) y el área eficaz del dializador (KOA).
Ultrafiltración
La ultrafiltración es la transferencia simultánea de soluto y solvente a través de una membrana semipermeable.
La transferencia de solutos por ultrafiltración depende: De las propiedades físicas de la membrana Del peso molecular de los solutos De la concentración de solutos en el plasma
El flujo de ultrafiltración depende de 3 factores: De la superficie del dializador De la permeabilidad hidráulica de la membrana (Factor de UF) De la presión transmembrana
Superficie del dializador: A mayor superficie, mayor es el flujo de ultrafiltración.
Permeabilidad hidráulica de la membrana: Es la propiedad física de la membrana que define su capacidad de transferencia de líquido por unidad de tiempo.
Transferencia de líquidos: se realiza por 2 presiones que permiten al agua atravesar la membrana:
la presión hidrostática la presión osmótica
La presión hidrostática: Es la diferencia de presiones entre el compartimiento de la sangre y el compartimiento del dializado. El líquido se desplaza del compartimiento de presión positivo hacia el presión negativa.
La ultrafiltración puede ser realizada por presión positiva o combinando presión positiva con presión negativa.
Ultrafiltración por presión osmótica: El desplazamiento de líquido por presión osmótica se realiza de menor a mayor concentración. Para ultrafiltrar por presión osmótica se debe aumentar la concentración del dializado con glucosa o con sodio. Este tipo de ultrafiltración se utiliza para diálisis peritoneal, en hemodiálisis se utiliza la presión hidrostática.
Cálculos para la ultrafiltración

Buscamos la diferencia entre el peso del paciente previo a la diálisis y el peso que se desea obtener, esto considerando la cantidad de líquido excedente en el paciente, esa deferencia la dividimos por el número de horas que durará el procedimiento, el valor resultante nos indica la cantidad de líquidos, en ml7h, que debe perder el paciente.
Dializadores
El dispositivo que permite el intercambio entre la sangre del paciente y el baño de diálisis es el dializador. esquemáticamente se compone de: una membrana semipermeable que separa dos compartimientos en los cuales circulan, respectivamente, la sangre del paciente y el baño de diálisis. Los símbolos Qs y Qd designan los caudales de sangre y baño de diálisis, Cs y CD, las concentraciones correspondientes y los índices e y s la entrada y salida del dializador.
Membrana semipermeable: Es un membrana porosa que permite el paso de solutos de determinado peso molecular. Las moléculas de alto peso como el caso de las proteínas, glóbulos rojos y bacterias no atraviesan la membrana semipermeable.
Cada dializador presenta una serie de características que son las que determinan su rendimiento, las cuales deben ser conocidas por toda enfermera que dializa.
Variables en los diferentes dializadores
Las variables en los diferentes dializadores son las siguientes: Tipo de membrana Superficie del dializador Volumen Diámetro del capilar Factor de ultrafiltración Capacidad de eliminación para moléculas de bajo y mediano peso
molecular
a) Tipo de membrana: Existen múltiples tipos de membranas, con diferentes grados de permeabilidad; ésta depende del tamaño del poro y el espesor de la membrana. Entre las menos permeables está el cuprofán, y entre las más permeables, poliacrilonitrilo, acetato de celulosa y policarbonato.
b) Superficie del dializador: Son de 0.6, 0.8, 1.2, 1.3, 1.5 m2. Por lo general, la superficie del dializador depende de la superficie corporal del paciente.
c) Volumen del dializador: Los volúmenes actuales son entre 50 y 150 ml. siempre son mejor tolerados los dializadores de volumen más pequeño. en los últimos tiempos se ha disminuido el volumen de los dializadores y se ha

aumentado la permeabilidad de la membrana para que sean mejor tolerados y obtener una adecuada eliminación de solutos.
d) Diámetro del capilar: En términos generales, el diámetro se encuentra entre 200 y 220 micras. La micra es la milésima parte de un milímetro. cuanto menor sea el diámetro del capilar más alta será la difusión de solutos.
e) Factor de ultrafiltración del dializador: Es una constante que depende de la permeabilidad hidráulica de la membrana. Esta propiedad física de la membrana es la que define el paso de líquido en una unidad de tiempo a una presión determinada (en mmHg), y se expresa en: ml/hora/mmHg.
f) Depuración del dializador: Es la cantidad de sangre que el dializador depura en un minuto. Esto especifica el rendimiento de cada dializador. El cálculo de la depuración se basa en molécula las pequeñas y medianas, como urea y Vit B12
respectivamente.
Liquido de diálisis
Es una solución acuosa, no estéril, con una composición de electrolitos similar al líquido extracelular. La concentración de electrolitos del baño de diálisis está calculada para corregir y regular la concentración de electrolitos en el plasma.
Está desprovisto de las sustancias que se desean eliminar, como urea, creatinina, etc. lo que produce el gradiente de concentración necesario para una buena difusión.
La solución del baño de diálisis no es estéril porque las bacterias por su peso molecular alto no atraviesan los poros de la membrana semipermeable.
Conductividad del baño:
Los electrolitos son compuestos químicos, que disueltos en el agua se separan en partículas con cargas eléctricas capaces de conducir la corriente eléctrica. La conducción de la solución del baño de diálisis es proporcional al número de iones que se encuentran en solución. Este potencial eléctrico que se halla en esta solución se mide en las máquinas por un sistema de electrodos que cuantifican la conductividad. El 90% de esta conductividad corresponde al sodio, principal catión del líquido extracelular.
La solución del baño de diálisis se obtiene a partir de una mezcla de 1 parte de concentrado y 35 partes de agua.

NAK
CaMgCl
Acet.
490080.5
122.552.5
3885.01260
mEq/lmEq/lmEq/lmEq/lmEq/lmEq/l
Composición de concentrado para 5l de agua.
La osmolaridad del concentrado es de 10300.5. Si la dividimos en 35 partes de agua nos da una osmoralidad en mEq/l de 293.3.
En los centros de hemodiálisis se cuenta con distintos tipos de baños de diálisis, los cuales se indican según la necesidad del paciente.
En el cuadro siguiente indicamos las concentraciones de electrolitos que hay en el liquido extracelular, debemos destacar su similitud.
Concentración en el baño de diálisis
Na 140 mEq/lK 2.3 mEq/lCa 3.5 mEq/lMg 3 mEq/lCl 110 mEq/lAcet. 38 mEq/l
Concentración en sangre
Na 138 a 145 mEq/lK 4 a 4.5 mEq/lCa 5 mEq/lMg 1.5 mEq/lCl 109 mEq/lAcet. 27 mEq/l
pH del baño de diálisis
Existe un pH óptimo (7.35 a 7.45) y el riñón regula, en gran parte, el pH corporal. En pacientes con Insuficiencia Renal se pierden estos mecanismos, los cuales deben ser reemplazados por la diálisis.
Concentración de los electrolitos en el baño de diálisis y la sangre
Sodio. La concentración normal sanguínea se encuentra entre 138 y 145 mEq/l. En el líquido de diálisis es de 140 mEq/l, no hay diferencia de concentración y no se pierde por difusión. El exceso de sodio es retirado por ultrafiltración. El agua extraída lleva con ella obligatoriamente las sustancias en ella disueltas, entre ellas el sodio. Con un litro de agua extracelular extraída se eliminan 140 mEq/l, lo que corresponde a 8.2 g/l de sodio. En los pacientes que pierden mucho sodio por orina, éste se podría compensar aumentando el sodio del baño de diálisis, pero surge el inconveniente que la máquina se deteriora al movilizar continuamente el dispositivo regulador de conductividad.
Cloro. La diferencia es mínima.

Potasio. La concentración sanguínea normal es de 4 a 4.5 mEq. En el líquido de diálisis lo común es usar 2.5 mEq/l. En pacientes con IRC el potasio suele estar muy aumentado, lo cual produce una gran difusión del potasio de la sangre al baño de diálisis. Toda concentración sanguínea superior a 6 mEq/l es muy riesgosa, ya que induce arritmias cardiacas.
Cuando los pacientes tienden a cifras muy elevadas de potasio, se le indica un baño de diálisis pobre en potasio (menor a 1 mEq/l), para aumentar el gradiente de difusión y que descienda más el nivel sanguíneo.
Para los pacientes que reciben digitálicos se coloca un baño rico en potasio, es decir de 3.5 mEq/l, para evitar la hipopotasemia durante la diálisis, ya que estas incrementan la sensibilidad a los digitálicos y puede llevar a las intoxicación por estos fármacos.
Calcio. La concentración sanguínea del calcio es de 5 mEq/l o sea 100 mg/l. La concentración del dializado es de 3.5 mEq/l, de esto se deducirá que el calcio difunde de la sangre al dializado. Pero el calcio sanguíneo el 40% está ligado a las proteínas, esto significa que sobre los 5 mEq/l, sólo van a difundir 3 mEq/l, porque las proteínas no atraviesan la membrana semipermeable. Como consecuencia la difusión se hace del baño de diálisis con 3.5 mEq a la sangre con 3 mEq/l.
Además debemos tener cuenta que todo paciente en insuficiencia renal tiene una baja concentración de calcio a consecuencia de la mala absorción en el intestino.
Magnesio. La concentración sanguínea es entre 2 y 3 mEq/l, la concentración en el líquido de diálisis es de 1.5 mEq/l, la concentración durante la diálisis es muy poca. Lo que aumenta en el período interdiálisis es muy poco y no es riesgoso. Lo que se debe tener en cuenta es que los medicamentos que toman los pacientes no tengan magnesio, esto puede llevar a un aumento riesgoso, porque este ion también intervienen para el funcionamiento correcto de la bomba Na+/k+.
Acetato. El líquido de diálisis contiene 36 mEq/l. Normalmente la sangre contiene bicarbonato y no acetato. El acetato atraviesa la membrana del dializador y va a la sangre, donde a nivel hepático se transforma en bicarbonato para neutralizar el exceso de ácidos.
Bicarbonato. Desde hace años se usaba el bicarbonato en el baño de diálisis como neutralizante de los ácidos. El inconveniente que tenía era que se precipitaba con el calcio, y por este motivo se dejó de usar. Hoy en día se puede dializar con bicarbonato, ya que los sistemas modernos incluidos en las máquinas de diálisis, evitan el problema de la precipitación.
Las desventajas del acetato frente del bicarbonato se deben a que el acetato es un cardiodepresor y vasodilatador periférico, produciendo vómitos e hipotensiones, sobre todo en pacientes añosos y pacientes cardiópatas.

Accesos Vasculares para Hemodiálisis
Fístula La fístula conecta una arteria con una vena. La vena se engrosa con el tiempo, permitiendo la colocación de las agujas. Una fístula es la mejor forma de obtener acceso al torrente sanguíneo para la hemodiálisis.
Ventajas Es permanente Va por debajo de la piel Dura más, hasta 20 años Provee el mejor flujo de sangre
para un mejor tratamiento Menos infecciones y otras
complicaciones Menos hospitalizaciones Mejor supervivencia (menos
riesgos de muerte que en los pacientes con catéter)
Desventajas Puede que no madure o se
desarrolle No es posible para todos los
pacientes Usualmente no puede utilizarse por 6 a 8 semanas
Injerto Un injerto o graft es un tubo, usualmente de plástico, que conecta una arteria con una vena, permitiendo colocar las agujas. Los injertos son la segunda mejor forma de acceder el torrente sanguíneo para la hemodiálisis.
Ventajas Permanente Va por debajo de la piel Puede usarse luego de 2
semanas, en algunos de los casos
Puede funcionar en pacientes con pobre venas
Desventajas Mayor probabilidad de
hospitalizaciones Mayor probabilidad de taparse
por coágulos Aumenta el riesgo de infecciones
serias Aumenta el riesgo de otras
complicaciones y procedimientos de reparación
No dura tanto como una fístula
Catéter Un catéter es un tubo que se inserta en la vena del cuello o por el pecho para proveer un acceso vascular para hemodiálisis. La punta del catéter termina en el corazón. Es usualmente un acceso temporal. Es la tercera opción para obtener acceso al torrente sanguíneo para hemodiálisis. Para algunos pacientes es la única opción y tiene que utilizarse como un acceso permanente.
Ventajas Desventajas

Puede utilizarse inmediatamente después de que se coloca
Mayor problema de infecciones, las cuales pueden ser muy serias o fatales
Aumento en las hospitalizaciones
No dura mucho, usualmente menos de un año
Podría requerir tratamientos prolongados
Uso prolongado puede llevar a una pobre diálisis
No puede ducharse sin aditamentos especiales
Se coagulan frecuentemente y requieren continuas intervenciones