Sistema endocrino 0
-
Upload
fabian-hoyos -
Category
Documents
-
view
176 -
download
0
Transcript of Sistema endocrino 0

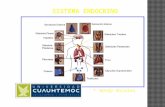
Sistema Endocrino
Jaime Alberto Mesa Franco

SISTEMA ENDOCRINO
OBJETIVO
Comprender y diferenciar los cambios adaptativos fisiológicos frente a los
estados patológicos en el sistema Endocrino que se presentan en el
binomio madre-hijo.
RESUMEN
El sistema endocrino es un conjunto de órganos encargado de secretar las
sustancias llamadas hormonas, que al ser vertidas al torrente sanguíneo
activan diversos mecanismos y ponen en funcionamiento diferentes
órganos del cuerpo.
Este sistema es el primero en ser analizado cuando se evidencia en la
madre un aumento exagerado de hormonas que afectan todo el organismo
en el embarazo.
En el sistema endocrino, el cambio más representativo es cuando la
placenta logra convertirse en un órgano capaz de producir grandes
cantidades de hormonas como los estrógenos y la progesterona.
1. CAMBIOS FISIOLÓGICOS
Las principales adaptaciones del sistema endocrino están asociadas con
los cambios en la morfología de las glándulas hipófisis, adrenal y tiroidea.
La concentración de las Hormonas Adrenocorticotropica (ACTH), Hormona
Liberadora de Corticotrópina (CRH), Hormona del Crecimiento (GH),
Cortisol, Hormonas Tiroideas como la Tiroxina (T4) y la Triyodotironina
(T3), y Globulina Ligadora de Tiroxina (TBG) están alteradas durante el
embarazo.
Las hormonas placentarias, especialmente los estrógenos, la
Gonadotropina Corionica Humana (HCG), la Hormona De Crecimiento
Placentaria y la CRH placentaria, y las alteraciones en la función hepática
y renal influencian estos cambios.

1.1. Anteparto
a) Eje Hipotálamo-Hipófisis-Adrenal (HHA)
Marcados cambios ocurren en el eje HHA durante el embarazo llevando a
aumento de su función. Estos cambios están mediados principalmente por
hormonas placentarias incluyendo ACTH, GH y CRH.
Los siguientes son los cambios fisiológicos:
- Aumento del peso de la hipófisis (100 mg).
- Aumento al doble del volumen de la hipófisis anterior.
- Hipertrofia e hiperplasia de los lactotrofos.
- Disminución en la producción de gonadotrofinas (FH y FSH).
- Disminución en las hormonas del crecimiento hipofisario.
- Producción de una variante placentaria de hormona de crecimiento.
- Incremento en la Hormona Liberadora de Corticotrópina (CRH),
principalmente de origen placentario que estimula la pituitaria fetal y
materna.
- Incremento en la ACTH y cortisol, este último estimula la CRH
placentaria y lleva a hipercotisolismo.
- Disminución en la TSH en el primer trimestre, dado el efecto
tirotrópico de la gonadotropina corionica humana.
- Disminución de 5-10 mOsm/kg en la osmolaridad plasmática como
resultado de la recaptación de osmo-receptores para liberación de
vasopresina.
- Diminución en el umbral osmótico para experimentar sed.
- Aumento en la depuración metabólica de vasopresina como
resultado de una vasopresina placentaria.
1.2. Función Hipofisaria Posterior
Las principales hormonas de la hipófisis posterior son la Arginina
Vasopresina (AVP) y la Oxitocina. Los cambios en la función de la hipófisis
posterior están asociados con cambios osmoreguladores y con el parto.
Los niveles de Arginina Vasopresina (AVP) están dentro de rangos
normales durante el embarazo; sin embargo el umbral al cual la AVP es
secretada, se da con una disminución en la osmolaridad plasmática entre
5 y 10 mOsm/kg .La AVP también modula la liberación de ACTH .Los

niveles de oxitocina progresivamente aumentan durante el embarazo, con
posterior incremento en el embarazo a término y en la lactancia.
1.3. Función Adrenal
El embarazo está caracterizado por un hipercortisolismo transitorio, a
expensas del cortisol sérico total y libre, con incremento de 3 a 4 veces de
cortisol total en el embarazo a término, el cortisol salival se aumenta el
doble a las 25 semanas. La mujer embarazada no evidencia signos de
hipercotisolismo porque la fracción de cortisol libre permanece dentro del
rango normal.
El incremento en el cortisol es paralelo al del ACTH. El incremento en el
Cortisol Total es generado principalmente por el aumento en el estrógeno,
provocado por la Globulina Transportadora de Cortisol (CBG) que se
aumenta a dos veces los valores normales en el segundo trimestre de
gestación. La CBG aumentada reduce el catabolismo hepático del cortisol
incrementando dos veces la vida media del mismo.
La Ilustración 1 es una representación esquemática del Eje Hipotálamo
Hipófisis Adrenal en la mujer no embarazada, embarazada y Postparto. Las
áreas sombreadas representan hipertrofia relativa de las glándulas
Adrenales.
Ilustración 1. Representación esquemática del Eje Hipotálamo-hipófisis-Adrenal (HHA)

Nota: Fuente: Mastorakos, G. & Ilias, I (2000). Maternal hypothalamic-adrenal axis in pregnancy and
the postpartum period: Postpartum-related disorders. Ann Ny Acad Sci, 900.100.
1.4. Eje Hipotálamo- Hipófisis- Tiroides (HHT)
Durante el embarazo, se presentan cambios notables en el eje HHP. Estos
cambios ocurren principalmente en la primera mitad del embarazo y se
mantienen hasta el parto. La disponibilidad de hormonas tiroidea se
aumenta del 40% al 100 %.
Las adaptaciones en el embarazo relacionadas a la función tiroidea simulan
un hipertiroidismo. La mujer embarazada puede ser descrita en un estado
de hipertiroxinemia, debido a que la función tiroidea no cambia durante el
embarazo. Este estado está asociado con periodos de estrógeno
aumentados (embarazo, anticonceptivos orales, terapia de remplazo de
estrógenos), disfunción hepática y uso de opiáceos (heroína y metadona).
Los cambios hormonales tiroideos son importantes en apoyar los estados
metabólicos alterados de carbohidratos, proteínas y lípidos del embarazo y
los cambios en la tasa metabólica basal. Los factores responsables para
los cambios en la función del eje Hipotálamo- Hipófisis- Tiroides (HHT)
durante el embarazo son los niveles elevados de gonadotropina corionica

humana, de la Globulina Ligadora de Tiroxina (TBG) y al aumento en la
excreción de yodo urinario, que disminuye los niveles de yodo plasmático
materno.
Las hormonas tiroideas son transportadas en el plasma, unidas a las
proteínas, tales como Globulina Ligadora de Tiroxina (TBG) y albumina.
En el embarazo aproximadamente el 75 % de la T4 se une a la Globulina
Ligadora de Tiroxina (TBG). La capacidad de esta hormona de unirse a la
tiroxina se duplica durante el embarazo; estos cambios incrementan los
niveles de Globulina Ligadora de Tiroxina (TBG) sérica, se incrementa la
T4 y T3 total.
Algunos estudios realizados por expertos, han demostrado un incremento
transitorio en la T4 libre en el primer trimestre relacionado al incremento en
la HCG con una disminución en el segundo y tercer trimestre. Las
concentraciones de T3 y T4 libres, aunque bajos, permanecen dentro de
límites fisiológicos normales. Por otro lado, la T3 y T4 total se aumentan del
40%-100% respecto a las no embarazadas Estas variaciones son
generadas principalmente por el aumento en la Globulina Ligadora de
Tiroxina (TBG) y Gonadotropina Corionica Humana (HCG), que se presenta
a su vez por el incremento en la producción de la yodonidasa tipo III por la
placenta. Esta enzima convierte la T4 a T3 reversa.
En algunos casos, las mujeres embarazadas sanas experimentan una
hipertiroxinemia transitoria, asociada con niveles más altos de los normales
de la Gonadotropina Corionica Humana (HCG), debido a que el incremento
en la T3 y T4 Total es menor al aumento presentado en la Globulina
Ligadora de Tiroxina (TBG), resultando en una relación disminuida T4/TBG,
el embarazo ha sido descrito como un estado de “hipotiroxinemia relativa.”
1.5. Intraparto
Los ejes HHA y HHT sufren alteraciones durante el periodo intraparto. La
CRH parece ser un disparador en la iniciación del trabajo de parto y la
activación del eje HHA puede servir como reloj biológico para la duración
de la gestación. La CRH plasmática materna, ACTH, B endorfina y los
niveles de cortisol se incrementan 7 veces más con el inicio del trabajo de
parto.
Los niveles de T3 total y Libre se incrementan durante el trabajo de parto.
Este cambio probablemente refleja la demanda energética del trabajo de
parto en el sistema materno. T3 yT4 tienen similares funciones pero la T3
es 5 veces más activa que la T4.

Las T3 y T4 incrementan las enzimas intracelulares, el número y actividad
de mitocondrias y sodio – potasio de la ATPasa.
1.6. Postparto
Las alteraciones en los ejes HHA y HHT durante el embarazo son
reversados durante el periodo posparto. Los niveles de CRH disminuyen
rápidamente con remoción de la placenta y la CRH placentaria. La ACTH
materna y los niveles de cortisol disminuyen rápidamente en el posparto y
alcanzan los valores normales de las mujeres no embarazadas entre 1 y 4
días posparto.
El eje HHA es deprimido, con una reducción en la CRH hipotalámica entre
3 y 6 semanas, retornando a niveles normales a las 12 semanas. Esta
depresión del eje HHA desempeña un papel fundamental en desordenes
posparto o en exacerbación de enfermedades autoinmunes en el periodo
posparto. Aunque la secreción de ACTH puede ser suprimida el cortisol
sérico total, está dentro de límites normales, probablemente secundario a
una leve hipertrofia de la corteza adrenal.
La hiperplasia de los lactotrofos de la adenohipofisis presenta picos en los
3 primeros días posparto, luego disminuye en tamaño por un mes en
mujeres que no lactan y más lentamente en las que están lactando, pero
nunca regresan al tamaño de las nulíparas. La prolactina cae al momento
del parto y regresa a valores normales de las mujeres no embarazadas a
los 3 meses; en el caso de las mujeres que amamantan, la prolactina se
incrementa después del parto, las B endorfinas disminuyen 24 horas
después del parto y en el posparto son más altas en el calostro que en el
plasma materno. La hormona del crecimiento en suero puede permanecer
elevada por varios meses. Después del parto, la remoción de la placenta y
la reducción de los estrógenos, la síntesis hepática de TBG disminuye, al
igual que la excreción renal de yodo.
Como resultado las alteraciones metabólicas en procesos tiroideos,
gradualmente reversan entre la cuarta y sexta semana, pero pueden
persistir por más de 6 semanas y hasta a 12.
La T4 libre puede ser baja y la TSH elevada en los primeros 3 a 4 días, con
lo cual se puede confundir la evaluación de la función tiroidea.
Las hormonas tiroideas son secretadas en la leche materna. Inicialmente
sus niveles son bajos, pero aumentan considerablemente hasta lograr
niveles de 4.3 mcg/dl. La T4 y la T3 de la leche materna pueden retardar el
desarrollo de hipotiroidismo, en algunos neonatos con este desorden. Estas

hormonas pueden también enmascarar síntomas clínicos e impedir el
diagnóstico de hipotiroidismo congénito.
2. IMPLICACIONES CLINICAS PARA LAS EMBARAZADAS Y SUS
FETOS
Los cambios en el eje HHA y HHT son críticos para el mantenimiento del
embarazo. Los ejes HHA materno y fetal y la interrelación entre la función
fetoplacentaria y materna son esenciales para la iniciación del trabajo de
parto. Las alteraciones en el eje HHA con infección o stress pueden llevar
a trabajo de parto pretérmino. Los desórdenes tiroideos son más comunes
en mujeres y no son infrecuentes en embarazadas, constituyéndose en el
segundo desorden endocrino, después de la diabetes durante el embarazo.
Los desórdenes de las glándulas adrenales e hipofisaria tales como
prolactinomas, pueden incrementar durante el embarazo debido a los
efectos estimulantes de los niveles elevados de prolactina, y la enfermedad
de Cushing1 son poco frecuentes. Esta enfermedad tiende a exacerbarse
durante el embarazo con remisión posparto y es más a menudo debido a
lesiones adrenales que aumentan la ACTH.
El diagnóstico de disfunción tiroidea durante el embarazo puede ser más
difícil dado que los síntomas a menudo se confunden con algunos de los
cambios fisiológicos usuales del embarazo y las pruebas de yodo
radioactivo no pueden ser usadas por los riegos para el feto.
En la Tabla 1, se presentan los parámetros bioquímicos de la función
Tiroidea durante la gestación.
Tabla 1. Parámetros bioquímicos de la función Tiroidea durante la gestación
1 Biblioteca Nacional de Medicina de EEUU (2014), define a la Enfermedad de Cushing como una afección en la cual la hipófisis, un órgano del sistema endocrino, secreta demasiada hormona corticotropina (ACTH, por sus siglas en inglés). Información disponible en http://www.nlm.nih.gov/medlineplus/spanish/ency/article/000348.htm

Nota: Fuente: Nader, S (2004). Thyroid disease and pregnancy in R.K. Creasy, R. Resnik, & J. D
Iarns (Eds). Maternal-fetal medicine: Principles and practice (5th ed.) Philadelphia, Saunders.
2.1. Necesidades de yodo durante el embarazo
La nutrición adecuada y los depósitos necesarios de yodo son esenciales
para la función normal de la tiroides materna y fetal, la Organización
Mundial de la Salud, indica que el Yodo favorece el adecuado crecimiento,
el desarrollo físico y mental del recién nacido previniendo deficiencia mental
y bocio. Este mineral es obtenido de los pescados, mariscos y de la sal
yodada. Se recomienda una ingesta de 200 mcg/día durante el embarazo
y lactancia. Este puede hacer parte de las vitaminas prenatales o ser
incluido como sal yodada. La deficiencia de este ocurre con ingestas
menores de 100 mcg/día.
La deficiencia de yodo es la causa más frecuente en el mundo de retardo
mental prevenible y aun el daño se presenta al momento del nacimiento.
Se ha incrementado el concepto que aun en áreas con suficiente yodo,
disfunción tiroidea subclínica marcada, puede incrementar el riesgo de
alteración posterior en el neuro-desarrollo de los recién nacidos.
VALORES NO EMBARAZADAS PRIMER TRIMESTRE SEGUNDO TRIMESTRE TERCER TRIMESTRE
T4 Total 3,9 - 11,6 µ g/dL 10,7 ± 0,20 11,5 ± 0,20 * 11,5 ± 0,20 †
T3 Total 90,9 - 208 ng/dL 205 ± 2,00 231 ± 3,00 * 233 ± 2,00 †
T3 / T4 Molar 10 - 23 x 23,1 ± 0,30 4,3 ± 0,30 ‡ 233 ± 2,00 †
Globulina Transportadora de
Torixina11 - 21 mg / litro 21,2 ± 0,30 28,5 ± 0,40 * 31,5 ± 0,30 *
Saturación de Globulina
Transportadora de Tiroxina28% - 60% 39,3 ± 0,60 30,9 ± 0,40 * 27,9 ± 0,30 *
T4 Libre 0,8 - 2,0 ng/dL 1,4 ± 0,02 1,1 ± 0,01 * 1,0 ± 0,01 *
T3 Libre 109 - 710 pg/dL 330 ± 0,06 270 ± 0,06 * 250 ± 0,06 *
Hormona Tiroideo-
estimulante0,2 - 4,0 mU/litro 0,75 ± 0,04 1,1 ± 0,04 * 1,29 ± 0,04 *
Gonadotropina Coriónica
HumanaIU/litro x 38,5 ± 1,50 16,4 ± 0,90 * 13,0 ± 1,50 *
* p < 0,001
† p = NS
‡ p < 0,005

2.2. Embarazada con hipertiroidismo
Un hipertiroidismo transitorio puede presentarse en embarazadas sanas
durante el primer trimestre; éste puede estar asociado con niveles
aumentados de Gonadotropina Corionica Humana (HCG), gestación
múltiple o náuseas y vómitos en el embarazo (NVE). Esta forma de
hipertiroidismo subclínico es caracterizado por T4 libre normal y TSH
disminuido. Otra forma de hipertiroidismo clínico transitorio está
caracterizada por T4 libre aumentada y TSH disminuida; aunque esta forma
es menos frecuente y puede estar asociada con gestación múltiple,
hiperémesis gravídica y desordenes trofoblasticos gestacionales con
marcado incremento de la producción de HCG.
Los desórdenes del trofoblasto tales como el embarazo molar
ocasionalmente causa hipertiroidismo bioquímico y en otros hallazgos
clínicos por los niveles altos de HCG secretada por la masa trofoblástica.
El hipertiroidismo crónico ocurre alrededor del 0.1% y el 0.4% de las
mujeres embarazadas. El diagnóstico de esta patología es difícil porque los
hallazgos se confunden con los de embarazadas normales, porque incluyen
fatiga, intolerancia al calor, piel caliente, labilidad emocional, insomnio,
aumento del apetito, sudoración, taquipnea, edema maleolar, palpitaciones
y presión del pulso aumentada. La falla para ganar peso con un buen
apetito y taquicardia persistente (más de 100 latidos/ minuto), son
sugestivos de hipertiroidismo en el embarazo. Los niveles aumentados de
T3 libre y T4 total (> de 15 mg/dl) son vistos con hipertiroidismo.
Entre el 85 y 95% del hipertiroidismo en mujeres embarazadas es casi
siempre por enfermedad de Graves.
En el caso de la embarazada con hipertiroidismo, si no se hace un control
adecuado de su patología, tiene un mayor nivel de riesgo para desarrollar
abruptio placentario, aborto, parto pretermino, restricción del crecimiento
intrauterino, ICC, tormenta tiroidea. Los neonatos pueden desarrollar
hipertiroidismo transitorio por el paso trasplacentario de IgG estimulante o
hipotiroidismo secundario a los efectos de drogas antitiroideas maternas
(metimazol).
El hipertiroidismo es tratado con drogas antitiroideas (thioamidas), las más
comunes son propilthiouracilo y metimazol, las cuales atraviesan la
placenta y pueden bloquear la síntesis de hormonas tiroideas por el feto.
La incidencia de hipotiroidismo en neonatos expuestos es de 1:100. Los
más bajos niveles de hormona estimulan la producción de TSH la cual
puede llevar a bocio y obstrucción traqueal. El metimazol tiene la ventaja

de ser administrado en menores dosis y con menor frecuencia, pero está
asociado con riesgo (aunque menor al 1%) de provocar defectos del cuero
cabelludo fetal (aplasia cutis) y la posibilidad de atresia de esófago. En
aproximadamente 30% de las embarazadas estas drogas pueden ser
transitoriamente descontinuadas en la gestación tardía.
2.3. Embarazada con hipotiroidismo
El hipotiroidismo en embarazadas con yodo suficiente, es usualmente un
factor secundario a enfermedades autoinmunes (ablación quirúrgica o
terapia con yodo radioactivo para enfermedad de graves y mixedema
idiopático o tiroiditis Hashimoto). Para mujeres con hipotiroidismo no
tratado tienen alta incidencia de infertilidad y aborto espontáneo. El
hipotiroidismo subclínico (TSH elevada y T4 libre normal) ocurre entre el 2
y el 5% de embarazos e incrementa el riesgo de prematurez, abruptio y
resultado neurológico alterado en lactantes. El riesgo de problemas
neurológicos tardíos en hijos de madres con hipotiroidismo, es mayor
cuando no se trata el hipotiroidismo subclínico en las primeras 10 a 12
semanas de gestación, porque el feto es completamente dependiente de la
hormona tiroidea materna para el desarrollo cerebral durante este periodo.
El diagnostico de hipotiroidismo durante el embarazo puede ser difícil
porque muchos signos y síntomas asociados como fatiga, aumento de
peso, constipación y amenorrea; los cuales están presentes en algunos
embarazos. El diagnostico se hace cuando la T4 libre es baja y la TSH
elevada. En caso de madres hipotiroideas previas la levotiroxina se puede
incrementar del 25 al 40% para mantener niveles séricos normales de TSH.
Los incrementos requeridos pueden ocurrir tan tempranamente alrededor
de la quinta semana de gestación, la embarazada con hipotiroidismo tiene
riesgo aumentado de perdida fetal o embarazo prolongado.
2.4. Desórdenes tiroideos posparto
El periodo posparto está asociado con desordenes tiroideos transitorios.
Las alteraciones fisiológicas del embarazo pueden ocultar hallazgos
clínicos de hipo o hipertiroidismo; por lo tanto, estos desordenes pueden
llegar a ser evidentes en el periodo posparto. Aunque estos desórdenes
transitorios son poco comunes en el posparto, también existe mayor riesgo
de desarrollar enfermedad de Graves especialmente en mayores a 35
años.

El Desorden Tiroideo Posparto (DTPP) es un fenómeno transitorio que se
presenta entre el 6 y 9% de mujeres posparto, principalmente en mujeres
con diabetes tipo 1 y la forma clásica aparece en los primeros 6 meses,
entre la sexta y octava semana después del parto, puede cursar con formas
leves de hiper o hipotiroidismo. Más del 25% de mujeres con DTPP pueden
permanecer hipotiroideas o desarrollar hipotiroidismo permanente en 5 –
15 años.
2.5. Lactancia materna en mujeres con desordenes tiroideos
La lactancia materna no se contraindica en mujeres con hipotiroidismo o
con hipertiroidismo. Cuando reciben propilthiouracilo, no está
contraindicada y este se prefiere al metimazol porque pasa a la leche en
más altas cantidades, lo mismo sucede para el propanolol.
2.6. Rol de las hormonas tiroideas maternas
Las hormonas tiroideas son críticas para el desarrollo cerebral,
neurogenesis y organización. La hormona tiroidea es encontrada en el
suero fetal y otros fluidos a las 7 semanas de gestación con niveles de T4
libres cerca de 1/3 de los niveles maternos, antes de que la tiroides fetal
esté produciendo hormonas.
Alrededor del séptimo mes de gestación, los receptores de hormonas
tiroideas y de yododinasa son encontrados en la corteza fetal con
receptores hormonales tiroideos nucleares presentes en el cerebro y en los
pulmones a las 9 semanas. Las hormonas tiroideas maternas son
trasferidas a los fetos en el primer trimestre comenzando en el momento de
la concepción e incrementando rápidamente en las próximas semanas,
alcanzando valores biológicos que correlacionan con los valores maternos.
Durante el segundo y tercer trimestre cuando la tiroides fetal está
produciendo hormona, mucha parte de la T4 necesaria para el desarrollo
es de origen materno.
El hipotiroidismo materno es particularmente dañino para el cerebro fetal
en la primera mitad de la gestación cuando la producción de T4 es baja. La
generación de T3, de T4 por incremento de la deyonidasa tipo II se
incrementa en la corteza cerebral en la mitad de la gestación alcanzando
valores similares a aquellos del cerebro del adulto.
3. FISIOLOGIA NEONATAL

3.1. Eventos transitorios
Las catecolaminas se producen al momento del nacimiento a niveles 20
veces más altos que los adultos, es mayor con parto vaginal que con
cesárea. Los niveles disminuyen después de las primeras horas. El nivel
aumentado de catecolaminas promueve adaptaciones extrauterinas
cardiorrespiratorias y está acompañado por el aumento de otras hormonas,
incluyendo renina, angiotensina II, arginina vasopresina (AVP), ACTH, B
endorfinas y cortisol.
3.2. Eje Hipotálamo Hipófisis Adrenal (HHA)
El tamaño de las adrenales disminuye aproximadamente el 25% en los
primeros 4 días después del nacimiento. La función hipofisaria adecuada
se ve tanto en recién nacidos a término como en pretérminos.
En el nacimiento, los niveles de cortisol libre están cerca de un tercio de
los niveles maternos posiblemente relacionado a los niveles más altos de
Globulina Trasportadora de Cortisol (CBG) en la madre. Los niveles de
cortisol se doblan durante el trabajo de parto y se incrementan en las
primeras dos horas después del nacimiento y descienden gradualmente en
la primera semana. Los niveles de ACTH y cortisol son más altos en los
neonatos nacidos por parto vaginal que en los nacidos por cesárea.
3.3. Eje hipotálamo hipófisis tiroides (HHT):
El recién nacido se encuentra en un estado de hipertiroidismo relativo dado
los marcados cambios de la función tiroidea al nacimiento. Los niveles de
TRH y TSH se incrementan rápidamente después del nacimiento seguido
por un incremento en la T4, T4 libre, T3 y T3 libre; la exposición del recién
nacido al medio ambiente extrauterino más frio, estimula los receptores
térmicos de la piel, liberación de TRH por hipotálamo y TSH por hipófisis.
Los niveles de T4 del recién nacido son usualmente entre el 10 y el 20%
menos que los valores maternos.
Las hormonas tiroideas en recién nacidos pretérmino, siguen patrones
similares a los recién nacidos a término, pero pueden tomar más tiempo
para alcanzar valores estables. Los niveles de hormona tiroidea están
inversamente relacionados a la edad gestacional. Los niveles de T4 libre,
T3 son más bajos y los niveles de T3 reversa son más altos en pretérmino

y en pequeños para la edad gestacional que en los neonatos a término en
las primeras semanas. Algunos pretérminos de muy bajo peso o enfermos
desarrollan un síntoma característico de hiper-tiroxinemia transitoria con
TSH normal a baja y T4 libre baja, niveles sin ninguna otra evidencia de
hipotiroidismo. El neonato pretérmino puede tomar de 3 a 8 semanas en
alcanzar los niveles a término de estas hormonas.
4. IMPLICACIONES CLINICAS PARA EL CIUDADO NEONATAL
La adaptación endocrina al nacimiento está influenciada por la edad
gestacional, el stress del parto, el estado de enfermedad posnatal y el grado
de asfixia perinatal. La función endocrina neonatal normal es crítica para el
crecimiento normal y desarrollo tanto antes como después del nacimiento.
Por ejemplo, la maduración bioquímica de los pulmones y la producción del
surfactante es dependiente del eje HHA y de sus hormonas incluyendo la
CRH y el cortisol, así como las hormonas tiroideas. Las hormonas tiroideas
son necesarias para el desarrollo pulmonar y la producción de surfactante,
crecimiento óseo, termogénesis y maduración del sistema nervioso
central.(SNC)
Dentro del SNC, estas hormonas son críticas para la arborización dendrítica
cerebral, sinaptogenesis, migración celular y crecimiento. Los efectos sobre
el crecimiento óseo y el desarrollo del SNC continúan hasta la niñez
temprana. Un eje HHA intacto es necesario para que el neonato responda
apropiadamente al stress y prevenir mala adaptación.
Las alteraciones en los ejes HHA y HHT influencian la transición a la vida
extrauterina; por ejemplo, la función tiroidea está estrechamente ligada a la
termorregulación y a la producción de calor de la grasa parda. Las
alteraciones del estado de salud por inmadurez o enfermedad aguda,
pueden resultar en disfunción transitoria adrenal o tiroidea.
El tamizaje para hipotiroidismo e hiperplasia adrenal congénita y el
diagnostico precoz de hipo e hipertiroidismo son muy importantes para el
crecimiento y el desarrollo futuros del lactante.
4.1. Hipertiroidismo neonatal
El hipertiroidismo neonatal es una patología poco común y se considera
usualmente como un desorden transitorio asociado con el paso
trasplacentario de inmunoglobulina estimulante tiroidea materna en
mujeres con enfermedad de Graves (TSI). Los niveles de TSI correlacionan

con el desarrollo de hipertiroidismo neonatal, por lo tanto el tamizaje
materno puede identificar el neonato a riesgo, una frecuencia cardiaca fetal
de más de 160 latidos /minuto después de las 22 semanas es un signo de
sospecha. Aunque este desorden es usualmente transitorio, aumento de la
morbilidad ha sido reportado usualmente como resultado de obstrucción
respiratoria, parto difícil debido a aumento de la tiroides o falla cardiaca de
gasto alta secundario a la taquicardia (>200 latidos/minuto).
Hallazgos clínicos tales como bajo peso al nacer, irritabilidad, taquicardia,
diarreas, sudoración o arritmias pueden estar presentes al nacimiento. Los
niveles de T4 y T4 libres están incrementados, pero también lo están en el
recién nacido normal. Si la madre esta con medicación antitiroidea, las
manifestaciones pueden ser retardadas entre 2 y 10 días. Estos neonatos
tienen una edad ósea avanzada y ocasionalmente craneosinostosis.
4.2. Hipotiroidismo neonatal
La principal causa de hipotiroidismo congénito es la disgenesia tiroidea, con
una incidencia de 1en 3000 a 4000 nacidos vivos; esta causa aún no está
totalmente aclarada. En algunos neonatos, el hipotiroidismo se da a causa
de un defecto en un solo gen o a factores familiares autoinmunes. En la
mayoría de los casos (aproximadamente el 85%), la causa es un defecto
embriogénico no familiar. Las mujeres son afectadas 2 veces más que los
hombres.
La mayoría de los neonatos son asintomáticos al nacimiento, con signos
clínicos aparentes solo entre el 5 y el 30%. Los hallazgos comunes tales
como fontanela anterior amplia, hipotonía, macroglosia y hernia umbilical,
pueden no desarrollarse por varias semanas o meses. Para el tiempo que
estos hallazgos se hacen evidentes, ya ha ocurrido un nivel de daño
neurológico importante, porque la hormona tiroidea inadecuada durante la
vida fetal y la infancia precoz altera el desarrollo del SNC. El mecanismo
exacto de injuria no está bien entendido, pero el grado de alteración
neurológica correlaciona con la duración y severidad del hipotiroidismo.
Aun con diagnostico precoz y tratamiento después del nacimiento estos
pacientes pueden tener alteraciones neurológicas sutiles.
4.3. Tamizaje neonatal para hipotiroidismo
El diagnóstico y tratamiento de hipotiroidismo congénito antes de los 3
meses de edad está asociado con una probabilidad aumentada de
desarrollo mental normal. El tamizaje involucra evaluación de niveles de T4

o de TSH. Los neonatos con hipotiroidismo congénito tienen niveles de T4
disminuidos por la disgenesia tiroidea y niveles elevados de TSH por el bajo
nivel de T4 que no suministra la inhibición del fed-back negativo de la
hipófisis anterior.
El tamizaje con TSH es más útil para detectar hipotiroidismo subclínico; el
tamizaje con T4 es más útil para detectar hipotiroidismo hipotalámico
pituitario central y para neonatos con un retardo en el incremento de la TSH.
Las muestra tomadas inmediatamente después del nacimiento, diferentes
a las del cordón umbilical (usualmente dentro de las primeras 24 horas),
son evitadas por el aumento usual de la TSH. Si el valor de la TSH excede
los valores del punto de corte que varían según la técnica de laboratorio,
se debe repetir después de 72 horas con T4 libre.
4.4. Hiperplasia adrenal congénita (HAC)
Es la causa más común de genitales ambiguos e insuficiencia adrenal,
comprende un grupo de desórdenes genéticos autosómicos recesivos, con
una frecuencia de 1 entre 15.000 nacidos vivos; estos neonatos tienen un
defecto en la síntesis de cortisol. Si adecuado feed-back negativo para el
cortisol, los niveles de ACTH están elevados especialmente en la primera
mitad de la gestación. Los excesos de ACTH estimulan la glándula adrenal
para producir precursores de cortisol y lleva a hiperplasia adrenal.
Los síntomas varían de forma leve a severa dependiendo del defecto
enzimático; en algunos casos, recién nacidas pueden tener genitales
ambiguos debido a la virilización. La terapia prenatal con corticosteroides
maternos puede prevenir o reducir la virilización de los genitales femeninos
si se inició antes de la semana 10.
El déficit enzimático más frecuente es el de la 21 hidroxilasa localizada en
el cromosoma 6, en la cual múltiples tipos de mutaciones y fenotipos
clínicos son vistos, esta mutación bloquea la conversión de progesterona a
precursores necesarios para la producción de aldosterona y cortisol, con
niveles disminuidos de estas hormonas.
La HAC es uno de los desórdenes evaluados en el tamizaje neonatal en
muchos países, midiendo los niveles plasmáticos de 17
hidroxiprogesterona, los cuales estarían elevados en esta entidad. Altas
tasas de falsos positivos a verdaderos positivos han sido reportados
especialmente en pretérminos enfermos y neonatos con bajo peso al nacer.
El tratamiento incluye terapia con glucocorticoide para suprimir la ACTH, la

aldosterona puede ser necesaria si el neonato tiene una forma perdedora
de sal.
5. CAMBIOS MADURACIONALES DURANTE LA INFANCIA Y LA
NIÑEZ
La maduración del eje HHA continúa durante la infancia y la niñez seguida
por cambios marcados en la pubertad. La involución de la glándula adrenal
es más prominente en el primer mes después del nacimiento y se completa
durante el primer año de vida; al mes de vida la glándula adrenal es el 50%
del tamaño del nacimiento. El ritmo circadiano de secreción de cortisol, es
visto entre las 8 y 12 semanas después del nacimiento en neonatos a
término.
La adrenarca inicia en el periodo prepuberal, alrededor de los 6 a 8 años
de edad y precede a la gonadarca. Las hormonas esteroideas incrementan
progresivamente y están asociadas con un incremento transitorio en el
crecimiento lineal y en la maduración ósea. La adrenarca incrementa la
producción de andrógenos y estrógenos necesarios para los cambios
puberales y ocurren varios años antes del inicio de la pubertad.
La función del eje HHT gradualmente cambia durante la infancia y la niñez,
las hormonas tiroideas son críticas para la maduración continuada del SNC
y el crecimiento óseo. El periodo crítico para la influencia de la hormona
tiroidea en el SNC continúa de 6 -8 meses después del nacimiento. Se ha
estimado que lactantes con hipotiroidismo importante pierden de 3 a 5
puntos de coeficiente intelectual por mes si no son tratados durante este
periodo, la capacidad de neonato de convertir T4 a T3 madura en el primer
mes. Durante la niñez los niveles de TSH tienden a permanecer más altos
que los del adulto.
CONCLUSIONES
El sistema endocrino es el encargado de producir las hormonas que
estimulan diversos mecanismos y ponen en funcionamientos
algunos órganos del cuerpo.
Las glándulas son órganos pequeños pero poderosos que están
situados en todo el cuerpo y que controlan importantes funciones del
organismo por medio de la liberación de hormonas.

Casi todos los componentes del sistema endocrino presentan
variaciones (aumento o disminución) durante la etapa gestacional.
El mayor cambio del sistema endocrino es la adición de la placenta
como órgano endocrino. Esta produce grandes cantidades de
estrógeno, progesterona, gonadotropina coriónica (HCG), lactógeno
placentario humano (hPL), relaxina y prostaglandinas.
La tiroides aumenta de tamaño en el primer trimestre y es posible
palparla con facilidad. En embarazos normales, se identifica una leve
situación hipertiroidea ya que aumenta el metabolismo basal, el
gasto cardiaco, la intolerancia al calor y desaparecen las reglas.
El correcto funcionamiento de las glándulas y de las hormonas
segregadas, inciden fundamentalmente en el desarrollo del neonato
intra-útero y extra-útero, por eso su control periódico por el
especialista de la salud, juega un papel fundamental.
BIBLIOGRAFÍA
Blackburn, S. (1992). Maternal, fetal & neonatal physiology: A clinical
perspective. (3ra Edición) St Louis: Saunders Elsevier.
Diccionario Académico de la medicina. (18 de 06 de 2014). Obtenido
de http://idiomamedico.com/diccionario.php
J., Rouse, D., Spong, C. (2009). William Obstetrics (23ra Edición).
McGraw - Hill Professional
Mastorakos, G. & Ilias, I (2000). Maternal hypothalamic-adrenal axis
in pregnancy and the postpartum period: Postpartum-related
disorders. Ann Ny Acad Sci, 900.100
Nader, S (2004). Thyroid disease and pregnancy in R.K. Creasy, R.
Resnik, & J. D Iarns (Eds). Maternal-fetal medicine: Principles and
practice (5th ed.) Philadelphia, Saunders.