Síndrome de QT largo congénito. De la genética al … 37 Nº 2 Abril-Junio 2008 OSCAR PELLIZZON...
Transcript of Síndrome de QT largo congénito. De la genética al … 37 Nº 2 Abril-Junio 2008 OSCAR PELLIZZON...

Revista de la Federación Argentina de Cardiología
ARTICULOS DE REVISION
118
En la última década, el hallazgo de mutaciones enlos genes que codifican los canales iónicos cardía-
cos provocó gran interés para comprender los mecanis-mos del síndrome de QT largo (SQTL) congénito. Estaentidad clínica se caracteriza por una repolarizaciónventricular prolongada (QTL) y propensión a la pre-sentación de arritmias ventriculares malignas (torsadesde pointes) que resultan en síncope y muerte súbita.
Existen dos formas clínicas hereditarias. Una varian-te autosómica recesiva (rara) asociada con sordera(Jerwel y Lange-Nielsen) y otra autosómica dominante(más común) con audición normal (Romano Ward).Desde 19751 se denomina a estas entidades "síndromede QT largo". La verdadera incidencia del SQTL esdesconocida, porque muchos individuos son asin-tomáticos y permanecen sin diagnóstico durantetodo su vida.
En la actualidad se estima que el síndrome de Roma-no-Ward se produce en 1/10.000 individuos, y el Jerwelly Lange-Nielsen entre 1-6 por millón de personas, y
producen entre 3.000 y 4.000 muertes súbitas por añoen los Estados Unidos2,3.
El SQTL secundario a un trastorno electrolítico o aterapias con drogas se denomina SQTL adquirido4.
Existen varias razones por las que debemos recono-cer precozmente a esta patología. Una de ellas es lasintomatología con la que se manifiesta (síncope y muer-te súbita) que generalmente se produce en niños o ado-lescentes y ante situaciones de estrés físico o emocio-nal. Otra de las razones es que esta enfermedad tieneuna muy alta mortalidad si no es tratada. En la actuali-dad existen terapias muy eficaces, por lo cual es ina-ceptable que existan pacientes sin diagnóstico. Final-mente, con el advenimiento de la biología molecular, sepuede identificar a los genes responsables que codifi-can los canales iónicos, cuyas mutaciones determinanlas diferentes variedades de SQTL. Además, el SQTLconforma un paradigma único que correlaciona elgenotipo con el fenotipo y permite tender un puenteentre la biología molecular y la cardiología clínica en elárea de la muerte súbita cardíaca5.
GENETICADesde 1991-1996 (años en que se descubrieron las
mutaciones que generan el SQTL)6-8 hasta el presentehubo grandes avances científicos en la determinaciónde las bases genéticas del SQTL. Hoy se conocen ochovariedades de esta enfermedad (Tabla 1). El análisisgenético permite identificar la mutación involucradaen el 60% de los casos, pero en el resto de los pacientes
Síndrome de QT largo congénito. De la genética altratamiento
OSCAR A. PELLIZZON, SEBASTIAN NANNINI, ANTONIA CATALANO
Centro de Arritmias. Servicio de Cardiología. Hospital Pro-vincial del Centenario.
Cátedra de Patología Médica I. Area Cardiología. Facultadde Ciencias Médicas. Universidad Nacional de Rosario.
Dirección postal: Oscar A. Pellizzón. Ocampo 1969. 2000 Ro-sario. Santa Fe. Argentina.
e-mail: [email protected] versión digitalizada de este trabajo está disponible en
www.fac.org.ar
El síndrome de QT largo congénito se caracteriza por un QT corregido prolongado, taquicardia ventri-cular polimorfa (torsade de pointes), síncope y muerte súbita. La identificación de mutaciones en variosgenes que codifican los canales iónicos generó un gran impacto en el manejo de los portadores y susfamiliares. Las causas de QT largo adquirido incluyen drogas, alteraciones electrolíticas, isquemia,bradiarritmias. El tratamiento agudo de las torsades de pointes se realiza con magnesio intravenoso ymarcapasos transitorio, con el objetivo de prevenir las recurrencias. Para el tratamiento crónico seutilizan betabloqueantes, denervación simpática izquierda, marcapasos definitivo y cardiodesfibriladorimplantable. La impresionante relación entre las mutaciones específicas y las alteraciones en el controliónico de la repolarización ventricular convierte a este síndrome en un paradigma de la correlaciónentre genotipo y fenotipo, determinando un nexo entre la biología molecular y la cardiologíaclínica en el área de la muerte súbita cardíaca. Rev Fed Arg Cardiol 2008; 37: 118-129
Palabras clave: Síndrome de QT largo. Genética. Muerte súbita cardíaca. Tratamiento.
ARTICULOS DE REVISION

Vol 37 Nº 2 Abril-Junio 2008
OSCAR PELLIZZON ET AL SINDROME DE QT LARGO CONGENITO
119
todavía no se puede ubicar dónde se encuentra la ano-malía.
Entre el 40% y el 45% de los pacientes con diagnósti-co genético presenta la variedad LQT1; aproximada-mente el 40-45% tiene el tipo LQT2 y el 5-8% de loscasos tiene LQT3.9 El resto de las formas de SQTL, queincluye LQT4, LQT5, LQT6, LQT7 (síndrome deAndersen-Tawil) y LQT8 (síndrome de Timothy) es muyinfrecuente y representa menos del 1% de los casos.
El LQT1 está causado por mutación del gen KCNQ1(KvLQT1) que codifica una subunidad del canal depotasio, el llamado componente lento de la corrienterepolarizante rectificadora tardía: IKs.9
En el LQT2, la mutación se encuentra en el genKCNH2 (HERG) que codifica en el canal iónico depotasio al componente rápido de la corriente repolari-zante rectificadora tardía: IKr.10 En la década del 90 seobservó que varias drogas, como la terfenadina y elcisapride, provocaban QTL por disminución de estacorriente.11
El tipo LQT3 está causado por mutaciones en el genSCN5A que codifica el canal de sodio. Estas mutacio-nes demoran la inactivación de la corriente tardía delsodio, prolongando la fase 2 del potencial de acción.6,12
El LQT4 es genética y fenotípicamente diferente delas otras variantes de QTL y resulta de una mutaciónen la ankyrina B, provocando una alteración en la or-ganización celular de la bomba de sodio, el intercam-biador sodio-calcio y en la señalización del ion calcioen el cardiomiocito.13
El LQT5 es una forma rara. El gen involucrado es elKCNE2 y codifica el canal de potasio minK alterandola función de la corriente IKs.14
El LQT6 también es una variedad infrecuente y estácausado por mutaciones en el gen KCNH2. Las mis-mas provocan, en la corriente IKr, una apertura más lentay un cierre más rápido que las corrientes normales.15
El LQT7 (síndrome de Andersen-Tawil) se manifies-ta por mutaciones en el gen KCNJ2 que codifica la co-rriente rectificadora de entrada de la corriente de potasioKir2.1 y está asociado a QTL, parálisis periódica y alte-raciones morfológicas óseas (Figura 1).16
El LQT8 (síndrome de Timothy) está causado pormutación del gen CACNA1C y es responsable de lamodulación del canal de calcio. Se manifiesta con QTL,arritmias, sindactilia y cardiopatías congénitas.17
El síndrome de Jerwell y Lange-Nielsen está relacio-nado con dos mutaciones genéticas: JLN1, causado pormutaciones homocigotas de KCNQ1 (las mutacionesheterocigotas producen el LQT1), y JLN2, causado pormutaciones homocigotas del KCNE1 (las mutacionesheterocigotas provocan el LQT5). Ambas mutacionesestán relacionadas con pérdida de función de la co-rriente IKs.18
Los tipos de QTL mencionados, excepto el LQT4,deben ser considerados dentro de las canalopatías.
DIAGNOSTICONo existen dudas diagnósticas cuando un paciente
se presenta con un síncope o un paro cardíaco resucita-do relacionado con un esfuerzo físico o estrés emocio-nal y el electrocardiograma (ECG) muestra un intervaloQTL. De todas maneras, el intervalo QT debe ser corre-gido (QTc) de acuerdo a la frecuencia cardíaca, a travésde la fórmula de Bazzet (QTc = QT/raíz cuadrada delRR) cuyo valor � 460 mseg es considerado prolongado(Tabla 2).19,20
Sin embargo, en muchos casos el valor del QT esborderline o limítrofe, y ante esta situación se requiere laevaluación de variables provistas por la historia clíni-ca y el ECG. Schwartz y colaboradores21 otorgaron unpuntaje a cada una de estas variables y, de acuerdo conla suma de puntos, determinaron una baja (� 0 pun-tos), intermedia (1 a 3 puntos) o alta (� 3,5 puntos) proba-bilidad de padecimiento de este síndrome (Tabla 3).
El QTc puede ser sobrestimado a frecuencias cardía-cas elevadas; por lo tanto se debe tener cuidado en suinterpretación cuando se trata de niños recién nacidoso muy pequeños.
Un QRc � 470 mseg en el hombre y � 480 mseg enlas mujeres tiene un 100% de especificidad para el diag-nóstico, y valores de QTc � 410 mseg son seguros paraseparar a los normales de los anormales. La dificultadexiste entre QTc de 410 mseg y 460 mseg ya que el 10%de los portadores asintomáticos tienen QTc normal, y el5% de los varones con historia de síncope o muertesúbita muestra un QTc � 440 mseg.22
TABLA 1
TIPOS GENETICOS DE SQTL
Tipo Gen Canal iónico
LQT1 KCNQ1 IKsLQT2 KCNH2 IKrLQT3 SCN5A INaLQT4 ANKB Na/CaLQT5 KCNE1 IKsLQT6 KCNE2 IKrLQT7 KCNJ2 IK1 (Kir 2.1)LQT8 CACNA1C ICa-LJLN1 KCNQ1 IKsJLN2 KCNE1 IKs
TABLA 2
VALORES DE QTcNORMAL Y PROLONGADO
Valores de QTc según edad y sexo (mseg)1-15 años Adultos masculino Adultos femenino
Normal < 440 < 430 < 450Limítrofe 440-460 430-450 450-470Prolongado > 460 > 450 > 470

Revista de la Federación Argentina de Cardiología
ARTICULOS DE REVISION
120
ESTUDIOS DIAGNOSTICOS EN QT LARGOSLIMITROFES
Prueba de esfuerzo. La prueba de ejercicio es usadapara evaluación y diagnóstico en pacientes con QTcborderline.23-25 La hipótesis es que el esfuerzo incrementalas catecolaminas endógenas y puede simular los even-tos clínicos y distinguir a los portadores de QTL y losnormales.
El incremento del QT con el ejercicio es un signo demal pronóstico y característico del SQTL, como así tam-bién la presencia de muescas en la onda T durante larecuperación. El LQT1 puede presentar una respuestacronotrópica disminuida y una exagerada prolonga-ción del QT después del ejercicio. El LQT2 puede teneracortamiento del QT y una frecuencia cardíaca normalante el esfuerzo. El LQT3, como el LQT2, también tieneacortamiento del intervalo QT a frecuencias cardíacaselevadas. De todas maneras, el valor predictivo positi-vo del ejercicio para hacer diagnóstico es pobre.26
Test de epinefrina o isoproterenol. Los expertos hanseñalado que el 25% de los pacientes con SQTL tieneECG no concluyente.27 Como ya se señaló, en muchasoportunidades no se puede realizar un diagnóstico pre-ciso porque: 1) las arritmias ventriculares relacionadascon el QTL pocas veces pueden ser documentadas, ex-cepto cuando se presentan en forma de "tormenta eléc-trica"; 2) la medición del QT no siempre es fácil y lapresencia de arritmia sinusal respiratoria complica laestimación del QTc; 3) los intervalos QT de los indivi-duos sanos y de los portadores a veces se superponen,
TABLA 3
CRITERIOS DIAGNOSTICOS
Puntos
Electrocardiograma (1)QTc (mseg) (2)
> 480 3460-470 2450 (masculino) 1
Torsades de pointes 2Alternancia onda T 1Muescas en onda T en 3 derivaciones 1Frecuencia cardíaca baja para la edad 0,5
Historia clínicaSíncope
con estrés 2sin estrés 1
Sordera congénita 0,5
Historia familiar (3)A. Miembro familiar con SQTL 1B. Muerte súbita inexplicada por debajo delos 30 años entre miembros familiares directos 0,5
(1): en ausencia de medicamentos o alteraciones conocidas queafectan al ECG. (2): QT corregido según la fórmula de Bazzet.(3): el mismo familiar no puede ser contado en A y B.
tanto como un tercio de los portadores de los genes delSQTL tienen un QTc borderline (430-460 mseg); 4) obvia-mente, la determinación genética es útil para el diag-nóstico preciso, pero con la actual tecnología, hasta un25-30% no puede ser determinado, y en nuestro mediono es posible hacer estos análisis. Por lo tanto, el diag-nóstico y el tratamiento proceden del análisis clínico yde las pruebas evaluativas a nuestro alcance.
Entre estos pacientes con QTL "ocultos", el mayorporcentaje tendrá genotipo LQT1.28 Dado que en estospacientes los síntomas son provocados por estímulosadrenérgicos, es lógica la utilización de la estimula-ción simpática a través de la infusión de isoproterenolo epinefrina.29 Recientemente se incorporó la utiliza-ción de infusión o bolo endovenoso de epinefrina28-31
como un método útil para el diagnóstico de un QTL nobien definido. El protocolo de la Clínica Mayo o el deShimizu puede poner de manifiesto un LQT1 con altogrado de exactitud. Esta prueba produce una respuestaparadójica del QT (prolongación > 30 mseg) y raramen-te induce arritmias ventriculares.32
Nosotros, históricamente, utilizamos infusión de iso-proterenol (1-10 microgramos/minuto) para evaluar elcomportamiento del QT y de la repolarización ventri-cular (Figura 2).
DISPARADORES DE EVENTOS CARDIACOSLos pacientes con LQT1 presentan síncope o muerte
súbita con los esfuerzos (nadar u otra actividad atléti-ca). Los pacientes con LQT2 tienen eventos cardíacoscon los estímulos auditivos (alarma del reloj, teléfono uotros). Los portadores de LQT3 presentan los síntomasantedichos mientras duermen.
Según el estudio de Schwartz, Priori y colaborado-res33, en el LQT1 el 63% de los eventos cardíacos sepresentó durante el ejercicio y solamente 3% en el repo-so o durante el sueño; a diferencia del LQT2 y LQT3,que en el 13% ocurre durante el ejercicio y en el 29-30%en reposo o sueño.
Una bradicardia fetal sugiere fuertemente un LQT1,y el bloqueo auriculoventricular 2:1 en los neonatosnos hace sospechar un LQT2.34 También se han obser-vado torsades de pointes en el postparto en las mujeresportadoras de LQT2.
Las correlaciones clínicas y disparadores arritmo-génicos partieron de estudios en los que se realizaronpruebas genéticas a familias de portadores. La literatu-ra más reciente presenta datos de pacientes no relacio-nados que muestran la misma asociación entre la clíni-ca y los gatillos de eventos; esto es debido a una gransuperposición entre los genotipos del SQTL.35
ELECTROCARDIOGRAMALos diferentes tipo de QTL no pueden ser diferencia-
dos solamente por la duración del QTc ya que existeuna sustancial superposición entre los genotipos y en-

Vol 37 Nº 2 Abril-Junio 2008
OSCAR PELLIZZON ET AL SINDROME DE QT LARGO CONGENITO
121
tre los portadores y no portadores de las mutaciones.Morfología de la onda T. Cuando analizamos ECGs
de las 3 variedades más frecuentes de SQTL (LQT1,LQT2 y LQT3) observamos que presentan diferentesmorfologías en la repolarización. El LQT1 presenta unaonda T de base ancha; el LQT2 muestra una onda T debaja amplitud; el LQT3 se caracteriza por un ST largo yonda T picuda de gran amplitud. Estos hallazgos elec-trocardiográficos fueron descriptos por Moss y colabo-radores36 y confirmados en modelos experimentales porAnzelevitch y colaboradores37. Este autor documentóla importancia de la heterogeneidad transmural en laduración del potencial de acción y la forma de la onda
T. La duración del potencial de acción del epicardio(que es el más corto) coincide con el pico de la onda T. Elpotencial de acción de las células M (que es el más lar-go) refleja el final de la onda T y el endocardio no tieneexpresión directa sobre el ECG, al menos que existauna importante heterogeneidad de la repolarización.
Zhang y colaboradores38 expandieron el análisis delECG y el genotipo. Identificaron otros diez tipos de re-polarización en el SQTL congénito (4 en el genotipoLQT1, 4 en el genotipo LQT2 y 2 en el genotipo LQT3).Sin embargo, existe una gran superposición de los ti-pos de repolarización entre los genotipos. Hasta untercio de los portadores del LQT3 presentan una repo-
Figura 1. Paciente de nuestra casuística con sín-drome de Andersen-Tawil. A. Taquicardia ven-tricular polimorfa bidireccional que motiva elingreso a nuestro hospital. Múltiples regímenesterapéuticos fueron ineficaces para revertir di-cha arritmia. B. La administración depropranolol y flecainida provocó la reversión aritmo sinusal, observándose un QTc 0,77 seg yonda U patológica típica de este síndrome. Elanálisis genético (Universidad de Utha) deter-minó una mutación en el gen KCNJ2 que codifi-ca la corriente rectificadora de entrada de la co-rriente de potasio Kir2.1.
B
A

Revista de la Federación Argentina de Cardiología
ARTICULOS DE REVISION
122
larización similar a los del LQT1.Las anormalidades en la onda U asociadas al SQTL
se caracterizan por ser prominentes, de aspecto extra-ño y a veces de aparición alternante. Las anormalida-des en la onda T se deben a una exagerada estimula-ción simpática39.
Esta diversidad de morfologías de la onda T podríaestar relacionada con diferentes efectos funcionales delas mutaciones, diferentes penetrancias y factoresmoduladores40.
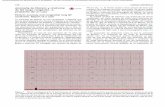
Alternancia de la onda T. Esta alteración es pocofrecuente y se caracteriza por cambios, latido a latido,
en la amplitud y la polaridad de la onda T durante elritmo sinusal (Figura 3). Shimizu y Anzelevitch41 de-mostraron, en condiciones experimentales, que esas va-riaciones en la onda T se debían a cambios en la dura-ción de los potenciales de acción de las células M. En elSQTL existiría un comportamiento variable de la repo-larización en las diversas regiones del miocardio, porlo cual se generarían cambios de gradientes entre elepicardio y el endocardio, o entre estos y la región delsubendocardio profundo donde abundan las célulasM.
La alternancia de la onda T puede asociarse a torsade
Figura 2. Paciente de 12 años admiti-do en nuestro servicio por síncopedurante el esfuerzo y sin cardiopatíaestructural. Al ingreso se observó, enel electrocardiograma, trastornos dela repolarización con ondas T negati-vas y ondas U no patológicas, aun-que en V3 la onda T se continuaríacon la onda U, conformando un QT-Uprolongado; sin embargo, el QTc es de0,39 seg en V5. La infusión de isopro-terenol produjo cambios en la repola-rización, apareciendo onda T bimodaly prolongación del intervalo QT (QTc0,57 seg), el cual sería más prolonga-do ya que la onda T terminaría másallá de la onda P del latido siguiente.
Figura 3. Paciente (sexo femenino) que in-gresó a nuestro hospital por síncope. En tiraelectrocardiográfica (DII) continua se obser-va una clara alternancia macroscópica de laonda T con extrasístoles ventriculares queocurren sobre la onda T y desencadenan unepisodio de torsade de pointes.

Vol 37 Nº 2 Abril-Junio 2008
OSCAR PELLIZZON ET AL SINDROME DE QT LARGO CONGENITO
123
de pointes y fibrilación ventricular por la presencia deuna dispersión transmural exagerada de la repolariza-ción, ampliando la ventana de la vulnerabilidad mio-cárdica.
ESTRATIFICACION DEL RIESGOEl Jerwell y Lange-Nielsen tiene peor pronóstico que
el Romano-Ward42, y dentro de este la estratificacióndel riesgo es compleja. Priori y colaboradores43 llevarona cabo un estudio en 647 pacientes con diagnósticogenético de LQT1, LQT2 y LQT3. Dentro de este grupode pacientes, el 13% había presentado un paro cardía-co o muerte súbita antes de los 40 años y previo al iniciode un tratamiento. Cuando se los comparó con los pa-cientes con LQT1, los pacientes con LQT2 y LQT3 tu-vieron mayor probabilidad de presentar un paro car-díaco o muerte súbita antes de los 40 años. El QTc fuepredictor de riesgo independiente entre los pacientescon LQT1 y LQT2 pero no en el LQT3. En el grupo totalno hubo diferencias respecto del sexo; pero cuando seanalizó de acuerdo con la variedad, las mujeres pre-sentaron más riesgo que los hombres en el LQT2, y loinverso ocurrió con el LQT3. En función de estos resul-tados, los autores propusieron un esquema de estratifi-cación del riesgo basado en el defecto genético, la dura-ción del QTc y el sexo. Las categorías fueron divididasen alto riesgo (50%: QTc � 500 mseg, LQT1, LQT2, va-rones con LQT3), riesgo intermedio (30-40%: QTc � 500mseg: mujeres con LQT2, mujeres y hombres con LQT3;QTc � 500 mseg: mujeres con LQT3) y bajo riesgo (<30%: QTc � 500 mseg y varones con LQT1 y LQT2).
TRATAMIENTOLas terapias actualmente aceptadas para los pacien-
tes con un SQTL son: betabloqueantes, restricción deactividades atléticas competitivas, denervación simpá-tica izquierda, marcapasos definitivos e implante deun cardiodesfibrilador (CDI).44 Además, todos los fami-liares directos deben ser evaluados, y en los países de-sarrollados el análisis genético determina la terapia gen-específica.
A continuación analizamos la terapéutica de urgen-cia y crónica para el paciente que se nos presenta sinto-mático y con arritmias ventriculares malignas (Tabla 4).
Tratamiento de urgenciaSulfato de magnesio. El magnesio es un modulador
de la actividad eléctrica transmembrana e intracelu-lar de la célula cardíaca. El sulfato de magnesioendovenoso es efectivo en las arritmias por postdespo-larizaciones precoces o tardías, como la torsade de pointes(arritmia típica del SQTL congénito y adquirido) pero noes eficaz en la taquicardia ventricular polimorfa no rela-cionada con el QTL. La administración de 2 g de magnesioseguida, si es necesario, por un segundo bolo a los 5-15minutos, finaliza la mayoría de las torsades de pointes.45
Isoproterenol y marcapasos transitorio. El isoprote-renol incrementa la frecuencia cardíaca y es efectivopara prevenir recurrencias de torsades de pointes. La do-sis habitual es de 2-10 microgramos/minuto. Esta dro-ga debe ser usada solamente cuando la torsade de pointesse debe a un SQTL adquirido y un marcapasos transi-torio no puede ser implantado inmediatamente.46 Enmodelos experimentales, la estimulación betaadrenér-gica induce torsade de pointes por incrementar la disper-sión transmural de la repolarización en LQT1 y LQT2pero la suprime por disminuirla en el LQT3.47
Tratamiento crónicoBetabloqueantes. La mayor información sobre la efi-
cacia de los betabloqueantes (BB) en el tratamiento delSQTL proviene del Registro Internacional de SQTL48,49,que incluyó 869 pacientes, el 69% de los cuales era sin-tomático. En este gran grupo la mortalidad fue del 2%.El 68% de los fallecidos no estaba bajo tratamiento o laterapia había comenzado dentro del primer año de vidapor haber padecido un evento cardíaco. Esto demostróque los pacientes que se tornan sintomáticos precoz-mente constituyen un grupo de muy alto riesgo de muer-te súbita. Cuando el análisis se realizó considerandopacientes que presentaron síncope y los síntomas co-menzaron después del primer año de vida, la mortali-dad en los tratados con BB fue sólo del 1,6% anual. Estamortalidad es muy baja, ya que antes del tratamientocon BB era del 50%. Los BB deben ser usados a dosisplena en todos los pacientes (propranolol 3 mg/kg/día o nadolol 1 mg/kg/día); el atenolol es menos eficazy no debe ser administrado. No debemos preocuparnossi la frecuencia cardíaca disminuye hasta 45 lat/min.
Denervación simpática izquierda. Este procedi-miento quirúrgico tiene un efecto antifibrilatorio y esutilizado en pacientes de muy alto riesgo de muerte
TABLA 4RECOMENDACIONES ACC/AHA/ESC (1)
Clase Evidencia
Evitar grandes esfuerzos físicosy deportes competitivos
Sintomáticos I BAsintomáticos I B
BetabloqueantesSintomáticos I BAsintomáticos
Denervación simpáticaizquierda + betabloqueantes
Síncope, torsade de pointes o paro cardíaco con BB IIB BCardiodesfibrilador + betabloqueantes
Paro cardíaco resucitado I ASíncope a pesar de betabloqueantes IIA BLQT2 y LQT3 IIB B
(1): J Am Coll Cardiol 2006; 48: 1064-1108.

Revista de la Federación Argentina de Cardiología
ARTICULOS DE REVISION
124
súbita. Schwartz, Priori y colaboradores50 evaluaron re-cientemente a la denervación simpática izquierda en147 pacientes con SQTL, el 90% de los cuales era sinto-mático y el 48% había presentado un paro cardíaco. ElQTc era muy largo (543 ± 65 mseg) y el 75% de los casosestaba tratado con BB. El tiempo medio de seguimientofue de 8 años. Durante ese lapso el 46% de los pacientesestuvo asintomático, el 31% presentó síncope, el 16%tuvo un paro cardíaco resucitado y el 7% padeció unamuerte súbita. El promedio anual de disminución deeventos fue del 91% (p < 0,001). Como se puede anali-zar de este trabajo, la denervación simpática izquierdadisminuye significativamente la frecuencia del paro car-díaco y del síncope, pero no es totalmente efectivo paraprevenir la muerte súbita.
Este procedimiento terapéutico parece muy eficaz,pero debe ser realizado en centros de referencia y porpersonal con mucho entrenamiento, elementos con losque no contamos en nuestro medio. A nuestro juiciopodría realizarse en los pacientes portadores de un CDIy choques eléctricos por tormentas arrítmicas.
Marcapasos definitivos. En la actualidad el marca-pasos definitivo desempeña un papel bastante limita-do.5 Aunque existen excepciones. Una de ellas está re-presentada por pacientes altamente sintomáticos den-tro del primer año de vida, en cuyo caso el marcapasospermite administrar dosis plena de BB y ayudar a pos-tergar el implante de un CDI, que en niños muy peque-ños es un problema complejo. En pacientes de mayoredad, características específicas del marcapasos pue-den complementar la utilidad del CDI y la estimula-ción rápida postchoque reduce la probabilidad de tor-menta eléctrica.
El marcapasos está claramente indicado en los SQTLadquiridos. Las drogas que prolongan la repolariza-ción generan torsades de pointes denominadas pausa obradicardia dependiente y el implante de un marcapa-sos transitorio salva vidas. Los SQTL congénitos tam-bién cursan con bradicardia sinusal o paros sinusalesespontáneos o inducidos por los betabloqueantes, ypuede producirse torsade de pointes.
La relación directa entre la longitud de ciclo y el in-tervalo QT hace que el marcapasos deba ser programa-do con frecuencias de estimulación rápidas (80 lat/min). En los casos en que se decide implantar un mar-capasos definitivo, este debe ser DDD (doble cámara)ya que en algunos pacientes puede haber bloqueoauriculoventricular funcional. Nosotros programamosa estos marcapasos con retardos AV prolongados (si laconducción nodal AV está conservada) para evitar laestimulación ventricular a frecuencias elevadas e in-ducir taquimiocardiopatía. Otras precauciones que sedeben tomar es la inactivación de las funciones dehistéresis y sueño para evitar los episodios de pausas obradicardias.51
Cardiodesfibrilador implantable. En la actualidad
el CDI tiene indicaciones precisas. Datos recientes in-dican que la terapia BB es efectiva en el 70% de loscasos, pero el 30% continúa en riesgo de muerte súbi-ta.52 Los pacientes que presentaron un paro cardíacoresucitado son de extremo riesgo, con una probabili-dad del 13% de fallecimiento a los 5 años, a pesar deltratamiento con BB. Este riesgo es aún mayor en niñosmenores de 10 años. El estudio más grande sobre CDI ySQTL realizado hasta el momento es el de Zareba ycolaboradores53 quienes analizaron a un grupo de 125pacientes a quienes se les implantó un CDI por haberpresentado un paro cardíaco (54 pacientes), síncoperecurrente a pesar de BB (19 pacientes), o síncope y/omuerte súbita de algún familiar directo (52 pacientes).Este grupo fue comparado con otro integrado por pa-cientes a quienes no se les indicó un CDI. La mortali-dad a los 3 años fue del 1,3% en aquellos que recibieronun CDI y del 16% en quienes no se implantó dicho dis-positivo durante el seguimiento (8 años). Los autoresconcluyeron que el CDI tiene una gran eficacia en ladisminución de mortalidad, aunque se necesitará unestudio prospectivo para determinar su verdadero be-neficio.
TERAPIAS DE ACUERDO CON EL GENOTIPOLQT1. Dado que en estos pacientes todos los even-
tos malignos se producen durante activación simpáti-ca, deben ser protegidos con betabloqueantes. Priori ycolaboradores54 evaluaron a 335 pacientes y observa-ron que la mortalidad fue del 0,53% y el porcentaje deeventos combinados (paro cardíaco y muerte súbita)fue del 1,6%, cifra muy baja que torna difícil justificar elimplante de un CDI en aquellos que no han presentadoun paro cardíaco o síncope recurrente a pesar del BB.
A estos pacientes no se les debe permitir la realiza-ción de actividades deportivas, particularmente la na-tación, ya que el 99% de los episodios arrítmicos seproduce durante esta actividad.
LQT2. En este grupo de pacientes los BB son menoseficaces. En un informe de Schwartz y colaboradores55,en el cual todos los pacientes eran sintomáticos, no seprodujo ninguna muerte súbita pero hubo un 4% deparos cardíacos entre 91 pacientes que recibían BB.Consideramos que esta cifra es alta para alguien que seencuentra medicado, por lo tanto el CDI debe ser tenidoen cuenta en este grupo.
En relación con los estímulos auditivos, en estos pa-cientes es un tema de preocupación ya que deben serevitados, especialmente mientras duermen.
Los pacientes con LQT2 son vulnerables cuando susniveles de potasio son bajos, lo cual debe ser tenidomuy en cuenta cuando sufren patologías en las que losmismos puedan alterarse. Se considera que siempre debeser mayor de 4 mmol/L.
LQT3. El manejo terapéutico en estos pacientes escomplejo, frustrante e incierto ya que los BB no los pro-

Vol 37 Nº 2 Abril-Junio 2008
OSCAR PELLIZZON ET AL SINDROME DE QT LARGO CONGENITO
125
tegen. En 1995, después de haber sido descubierta lamutación en el gen SCN5A, se utilizó a la mexiletinacon la intención de acortar el QT.56 Los resultados delas investigaciones indicaron que en el LQT1 y en elLQT2 no tiene utilidad, pero en el LQT3 podría acortarel QT hasta 90 mseg, aunque a pesar de eso la morta-lidad continúa siendo elevada. En muchos de estospacientes la muerte súbita es el primer evento, por locual es razonable implantar un CDI aun en los asinto-máticos.57
Dilemas en la terapiaUno de los aspectos más difíciles en la terapéutica
del SQTL es la decisión de tratar o no tratar a los asinto-máticos y a los familiares cercanos del paciente sinto-mático.
Se recomienda tratamiento de los asintomáticos enlas siguientes condiciones: 1) pacientes con sordera con-génita, dado que en ellos el riesgo de eventos cardíacoses particularmente alto; 2) en neonatos y lactantes, de-bido a que en los primeros meses de vida el riesgo esespecialmente elevado; 3) en hermanos de niños quehan muerto súbitamente; 4) en pacientes con alternan-cia de la onda T, que es un signo de marcada inestabili-dad eléctrica; 5) en pacientes con QTc > 600 mseg, yaque no permanecen libres de síntomas.
SINDROME DE QT LARGO EN SITUACIONESESPECIALES
Síndrome de muerte súbita del lactante. En estesíndrome, lo inesperado e inexplicable de la muertesúbita hace que la causa arrítmica sea una hipótesisposible, y se ha propuesto que el SQTL podría produ-cirse entre un 5% y un 10% de los casos. Es un fenóme-
no raro, que se presenta en aproximadamente el 0,1%de los recién nacidos vivos. La incidencia pico se en-cuentra entre los 2 y los 4 meses.58 La prolongación delQT puede deberse a: 1) factores genéticos; 2) medica-mentos; 3) factores condicionantes, como el estado delsueño que interactúa con el sistema nervioso autóno-mo; 4) alteraciones del sistema nervioso central.
De los genotipos conocidos, el LQT3 por mutacionesinherentes al gen SCN5A es fenotípicamente el candi-dato más probable como causante del síndrome demuerte súbita del lactante, ya que los eventos cardíacosacontecen típicamente durante el sueño y asociadoscon bradicardia. Asimismo, el síncope es raro, y la pri-mera presentación es comúnmente la muerte súbita.55
Recientemente59 se ha establecido que las mutacio-nes de un nuevo gen, denominado caveolin-3 (CAV3),que interviene en la formación de las caveolas (peque-ñas invaginaciones de la membrana celular), produceganancia de función en las corrientes tardías de sodioy similar al fenotipo celular y molecular del LQT3. Esteestudio es el primero que demostró una evidenciamolecular y funcional que implica patogénicamente algen CAV3 con el síndrome de muerte súbita del lactante.
Síndrome de QT largo y embarazo. Durante el em-barazo y el parto no existe incremento de ocurrenciasde eventos cardíacos en mujeres con SQTL. Sin embar-go, en el Registro Internacional del SQTL33,60 aproximada-mente el 10% de los pacientes tuvo su primer eventodurante el período postparto. Las razones propuestaspara explicar esa mayor probabilidad de eventos inclu-yen el incremento de la respuesta adrenérgica causadapor estrógenos y progesterona, la acción directa de es-tas hormonas sobre el número y la función de los cana-les iónicos anormales, la caída de la frecuencia cardía-
Figura 4. Paciente con síndrome deQTL adquirido secundario a la ad-ministración de roxitromicina. A. De-rivaciones electrocardiográficas (V3,V4, V5) que no muestran alteracionesmorfológicas de la onda T y QTC 430mseg. B. Al tercer día de haberse ad-ministrado roxitromicina presentacambios morfológicos de la onda T yprolongación del QTc 580 mseg aso-ciado con episodios sincopales. C.Electrocardiograma realizado duran-te los episodios sincopales en el quese observa prolongación del QT, al-ternancia de la onda T y episodio detorsade de pointes. La suspensión delantibiótico produjo normalización delQT y desaparición de la taquiarritmiaventricular.

Revista de la Federación Argentina de Cardiología
ARTICULOS DE REVISION
126
ca en comparación con la del tercer trimestre de gesta-ción, el estrés psicológico y los patrones de sueño alte-rados asociados con el cuidado del neonato. Se ha se-ñalado que la mayoría de las pacientes que han tenidoeventos en este período presentaba ansiedad, anorma-lidades del sueño, depresión, nutrición inadecuada, me-dicamentos y exposición a ruidos inesperados (como eldespertador). Recientemente, Seth, Moss y colaborado-res61 evaluaron a un grupo de mujeres durante y des-pués del primer embarazo (N = 391) y analizaron elriesgo de experimentar síncope, paro cardíaco resuci-tado y muerte súbita. Las conclusiones de este estudiodeterminaron que las mujeres tienen bajo riesgo de even-tos cardíacos durante el embarazo, pero el riesgo seincrementa durante los primeros nueve meses postparto,especialmente entre las portadoras del LQT2. Tambiénconfirmaron el efecto beneficioso de los BB durante esteperíodo.
Síndrome de QT largo y drogas. El SQTL más co-mún es el adquirido, siendo el más frecuente secunda-rio a la administración de fármacos (Figura 4). Las otrascausas que pueden inducir SQTL son: 1) cardiopatías(isquemia, insuficiencia cardíaca, miocardiopatía dila-tada e hipertrófica, miocarditis); 2) anormalidadesmetabólicas; 3) bradiarritmias, como el bloqueosinoauricular y el bloqueo auriculoventricular comple-to; 4) alteraciones en el metabolismo hepático de lasdrogas.
La arritmia ventricular que se produce en el SQTLadquirido es la torsade de pointes que se inicia con uncomplejo ventricular ectópico seguido por una pausacompensadora que termina con un latido sinusal, elcual frecuentemente tiene un QT muy prolongado yonda U muy exagerada. Una nueva extrasístole ventri-cular cae sobre la onda U del latido sinusal, producién-dose la torsade de pointes; esto es conocido como el fenó-meno de prolongación del QT pausa dependiente conciclo corto-largo-corto que inicia la arritmia (Figura 5).20
El tratamiento de esta taquiarritmia ventricular es lasuspensión de la droga, el incremento del potasio séri-co a 4,5-5 mmol/L y la infusión de magnesio (1-2 g/EV). En casos resistentes se debe implantar un marca-pasos transitorio e incrementar la frecuencia cardíacapara acortar el QT.
En la utilización de drogas antiarrítmicas, especial-mente la quinidina, fue donde primero se observó pro-longación del intervalo QT y torsade de pointes. Sin em-bargo en la actualidad existen drogas no cardíacas quetienen potencialidad proarrítmica, pero representansolamente el 2-3% de las prescripciones. La lista defármacos que pueden prolongar el QT es extensa yse puede consultar información sobre ellas enwww.qtdrugs.org .
Las drogas que inducen SQTL adquirido invariable-mente afectan a una corriente de potasio específica, elcomponente rápido de la corriente de potasio rectifica-dora tardía (IKr)62, la cual es expresada genéticamentepor el gen KCNH2 (HERG).
Hay una discordancia entre la potencia de prolon-gar el QT y la posibilidad de inducir torsade de pointes,ya que no todas las drogas generan esta arritmia. Estohace pensar que la droga por sí sola no produce torsadede pointes sino que existen otros factores de riesgo, comohipopotasemia, bradicardia, cardiopatía preexistente,sexo femenino, QTc basal > 460 mseg o coadministraciónde drogas que prolongan el QT y pueden predisponer aesta arritmia ventricular maligna.63 Estas observacio-nes han derivado en el concepto de "reserva de la repo-larización" que propone que hay una gran capacidaddel miocardio para efectuar la repolarización ordena-da y rápidamente a través de un mecanismo normal. Lapresencia de los factores de riesgo, particularmente lahipopotasemia, reduce esta reserva y explica por quéalgunos pacientes desarrollan torsade de pointes despuésde la administración de drogas que bloquean los cana-les IKr.64
Síndrome de QT largo y la historia. El 6 de mayo de1821, tras una larga y penosa enfermedad, murióNapoleón Bonaparte, antiguo emperador de los france-ses, enemigo de los ingleses y uno de los estrategas másgrandes de todos los tiempos. El fallecimiento tuvo lu-gar en Santa Elena, una isla británica del Atlántico Suren la que llevaba más de cinco años de destierro.Napoleón enfermó a los pocos días de llegar a SantaElena, y durante el tiempo que pasó en la isla nuncallegó a recuperarse. Todos los médicos que lo trataron(tanto ingleses como franceses) fueron incapaces dediagnosticar la enfermedad que lo aquejaba. La verda-
Figura 5. Electrocardiograma que muestrala típica secuencia de ciclos ventriculares cor-to-largo-corto que inicia una torsade de pointes.Los primeros cinco latidos son sinusales. Elquinto complejo (A) es seguido por unaextrasístole ventricular (B) con acoplamientoy pausa compensadora larga (*), luego otrolatido sinusal (C) y una extrasístole ventri-cular que inicia la torsade de pointes.

Vol 37 Nº 2 Abril-Junio 2008
OSCAR PELLIZZON ET AL SINDROME DE QT LARGO CONGENITO
127
dera causa de su muerte se desconoce, aunque se espe-cula que fue un cáncer gástrico. Napoleón sostenía queestaba siendo envenenado.
Un siglo y medio después de la muerte de Napoleón,el toxicólogo sueco Sten Forshufvud65 se interesó en elcaso debido a que se habían realizado nuevos avancespara detectar residuos de veneno en el cabello de loscadáveres. Forshufvud obtuvo una pequeña muestra yel análisis confirmó sus sospechas: el pelo contenía tre-ce veces más arsénico de lo normal. Más recientemente,Mari y colaboradores66, médicos forenses de la Univer-sidad de Florencia (Italia) señalaron que el arsénicobloquea los canales IKr e IKs y activa los canales IK-ATP provocando QT prolongado, torsade de pointes ymuerte súbita. Esta situación es profundizada por lahipopotasemia.
A Napoleón se le administraron, el día antes de mo-rir, altas dosis de calomel (cloruro de mercurio) y ade-más, por sus dolores estomacales, ingería crónicamenteeméticos. Estos medicamentos provocaban pérdida depotasio lo cual, asociado al arsénico, pudo provocarprolongación del QT. Por lo tanto, la causa inmediatade muerte del Emperador pudo haber sido una torsadede pointes debida a un SQTL.
CONCLUSIONESEl SQTL es una enfermedad genética infrecuente y a
menudo letal en una población particularmente joven(niños y adolescentes). En la última década nuestrosconocimientos sobre la genética y los mecanismos pa-tológicos progresaron significativamente. La genéticamolecular fortaleció nuestra comprensión sobre estesíndrome y aumentó el interés en la terapia denomina-da gen-específica. Lamentablemente, en nuestra prácti-ca clínica la posibilidad de los análisis genéticos noestán a nuestro alcance, pero los datos epidemiológi-cos, clínicos y el ECG nos permiten hacer diagnósticode certeza e instaurar tratamientos altamente eficaces.
SUMMARYCONGENITAL LONG QT SYNDROME
The congenital long QT syndrome is characterized byprolongation of the corrected QT interval, polymorphic ven-tricular tachycardia (torsade de pointes), syncope and sud-den death. The identification of several long QT syndromegenes, all encoding cardiac ion channels, has had a majorimpact on the management strategy for both patients andfamily members. Acquired causes of the long QT syndromeinclude drugs, electrolyte imbalance, bradyarrhythmias,myocardial ischemia. Short-term treatment is aimed at pre-venting the recurrences of torsade de pointes and includesintravenous magnesium and temporary cardiac pacing. Long-term management includes use of beta-blockers, left cardiacsympathetic denervation, permanent pacemaker placement,and cardioverter-defibrillator implantation. The impressivecorrelation between specific mutations and critical alterations
in the ionic control of ventricular repolarization makes thissyndrome a unique paradigm which allows to correlate geno-type and phenotype, thus providing a direct bridge betweenmolecular biology and clinical cardiology in the area of sud-den cardiac death.
Key words: Long QT syndrome. Genetic. Sudden cardiacdeath. Treatment.
Bibliografía
1. Schwartz PJ, Periti M, Malliani A: The long Q-T syndrome.Am Heart J 1975; 89: 378-390.
2. Wehrens XHT, Vos MA, Doevendans PA, Wellens HJJ: Novelinsights in the congenital long QT syndrome. Ann InternMed 2002; 137: 981-992.
3. Keating MT, Sanguinetti MC: Molecular and cellular mecha-nisms of cardiac arrhythmias. Cell 2001; 104: 569-580.
4. Roden DM: Mechanisms and management of proarrhythmia.Am J Cardiol 1998; 82: 491-571.
5. Schwartz PJ: The congenital long QT syndromes from geno-type to phenotype: clinical implications. J Intern Med 2006;259: 39-47.
6. Wang Q, Shen J, Splawski I, et al: SCN5A mutations associ-ated with an inherited cardiac arrhythmia, long QT syn-drome. Cell 1995; 80: 805-811.
7. Curran ME, Splawski I, Timothy KW, et al: A molecularbasis for cardiac arrhythmia: HERG mutations cause longQT syndrome. Cell 1995; 80: 795-803.
8. Wang Q, Curran ME, Splawski I, et al: Positional cloning ofa novel potassium channel gene: KvLQT1 mutations causecardiac arrhythmias. Nat Genet 1996; 12: 17-23.
9. Splawski I, Shen J, Timothy KW, et al: Spectrum of muta-tions in long-QT syndrome genes. KvLQT1, HERG, SCN5A,KCNE1, and KCNE2. Circulation 2000; 102: 1178-1185.
10. January CT, Gong Q, Zhou Z: Long QT syndrome: cellularbasis and arrhythmia mechanism in LQT2. J CardiovascElectrophysiol 2000; 11: 1413-1418.
11. Moss AJ, Kass RS: Long QT syndrome: from channels tocardiac arrhythmias. J Clin Invest 2005; 115: 2018-2024.
12. Wang Q, Shen J, Li Z, et al: Cardiac sodium channel muta-tions in patients with long QT syndrome, an inherited car-diac arrhythmia. Hum Mol Genet 1995; 4: 1603-1607.
13. Chauhan VS, Tuvia S, Buhusi M, Bennett V, Grant AO:Abnormal cardiac Na(+)channel properties and QT heartrate adaptation in neonatal ankyrin(B) knockout mice. CircRes 2000; 86: 441-447.
14. Bianchi L, Shen Z, Denni AT, et al: Cellular disfunction ofLQT5-minK-mutants; abnormalities of IKs, IKr and traf-ficking in long QT syndrome. Hum Mol Genet 1999; 8: 1499-1507.
15. Collins KK, Van Hare GF: Advances in congenital long QTsyndrome. Curr Opin Pediatr 2006; 18: 497-502.
16. Tristani-Firouzi M, Jensen R, Donaldson MR, et al: Func-tional and clinical characterization of KCNJ2 mutations as-sociated with LQT7 (Andersen syndrome). J Clin Invest2002; 110: 381-388.
17. Splawski I, Timothy KW, Sharpe LM, et al: Ca(V)1.2 cal-cium channel dysfunction causes a multisystem disorderincluding arrhythmia and autism. Cell 2004; 119: 19-31.
18. Schwartz PJ, Spazzolini C, Crotti L, et al: the Jervell andLange-Nielsen syndrome: natural history, molecular basis,and clinical outcome. Circulation 2006; 113: 783-790.
19. Schwartz P, Priori S, Napolitano C: The long QT syndrome.En: Zipes D, Jalife J (eds): Cardiac electrophysiology: fromcell to bedside (3rd ed). Philadelphia, WB Saunders 2000; pp597-615.
20. Yap YG, Camm JA: Drug induced QT prolongation andtorsades de pointes. Heart 2003; 89: 1363-1372.

Revista de la Federación Argentina de Cardiología
ARTICULOS DE REVISION
128
21. Schwartz PJ, Moss AJ, Vincent GM, Crampton RS: Diag-nostic criteria for the long QT syndrome: an update. Circu-lation 1993; 88: 782-784.
22. Roden DM, Lazzara R, Rosen M, et al: Multiple mecha-nism in the long QT syndrome current knowledge, gaps,and future directions. Circulation 1996; 94: 1996-2012.
23. Kaufman ES, Gorodeski EZ, Dettmer MM, Dikshteyn M:Use of autonomic maneuvers to probe phenotype/geno-type discordance in congenital long QT syndrome. Am JCardiol 2005; 96: 1425-1430.
24. Takenaka K, Ai T, Shimizu W, et al: Exercise stress testamplifies genotype-phenotype correlation in the LQT1 andLQT2 forms of the long-QT syndrome. Circulation 2003;107: 838-844.
25. Walker BD, Krahn AD, Klein GJ, et al: Burst bicycle exer-cise facilitates diagnosis of latent long QT syndrome. AmHeart J 2005; 150: 1059-1063.
26. Phillips JR, Case CL: Evaluation and treatment of pediatricpatients with congenital or acquired long QT interval syn-dromes. Progr Pediatr Cardiol 2001; 13: 101-110.
27. Priori SG, Napolitano C, Schwartz PJ: Low penetrance inthe long-QT syndrome: clinical impact. Circulation 1999;99: 529-533.
28. Shimizu W, Noda T, Takaki H, et al: Epinephrine un-masks latent mutation carriers with LQT1 form of con-genital long-QT syndrome. J Am Coll Cardiol 2003; 41:633-642.
29 . Viskin S: Drug challenge with epinephrine or isoproter-enol for diagnosing a long QT syndrome: should we trythis at home? J Cardiovasc Electrophysiol 2005; 16: 285-287.
30. Ackerman MJ, Khositseth A, Tester DJ, et al: Epinephrine-induced QT interval prolongation: a gene-specific para-doxical response in congenital long QT syndrome. MayoClin Proc 2002; 77: 413-421.
31. Khositseth A, Hejlik J, Shen WK, Ackerman MJ: Epine-phrine-induced T-wave notching in congenital long QT syn-drome. Heart Rhythm 2005; 2: 141-146.
32. Vyas H, Ackerman MJ: Epynephrine QT stress testing incongenital long QT syndrome. J Electrocardiol 2006; 39:S107-S113.
33. Schwartz PJ, Priori SG, Spazzolini C, et al: Genotype-phe-notype correlation in the long QT syndrome. Gene-specifictriggers for life-threatening arrhythmias. Circulation 2001;103: 89-95.
34. Lupaglazoff JM, Denjoy I, Villain E, et al: Long QT syn-drome in neonates: conduction disorders associated withHERG mutations and sinus bradycardia with KCNQ1 mu-tations. J Am Coll Cardiol 2004; 43: 8 26-830.
35. Tester DJ, Will ML, Haglund CM, Ackerman MJ: Compen-dium of cardiac channel mutations in 541 consecutive un-related patients referred for long QT syndrome genetic test-ing. Heart Rhythm 2005; 2: 507-517.
36. Moss AJ, Zareba W, Benhorin J, et al: ECG T-wave patternsin genetically distinct forms of the hereditary long QT syn-drome. Circulation 1995; 92: 2929-2934.
37. Antzelevitch C: Molecular genetics of arrhythmias and car-diovascular conditions associated with arrhythmias. JCardiovasc Electrophysiol 2003; 14: 1259-1272.
38. Zhang L, Timothy KW, Vincent GM, et al: Spectrum of ST-T-wave patterns and repolarization parameters in congeni-tal long-QT syndrome: ECG findings identify genotypes.Circulation 2000; 102: 2849-2855,
39. Schwartz PJ, Malliani A: Electrical alternation of the Twave: clinical and experimental evidence of its relationshipwith the sympathetic nervous system and with the longQT syndrome. Am Heart J 1975; 89: 45-50.
40. Zareba W: Genotype-specific ECG patterns in long QT syn-drome. J Electrocardiol 2006; 39: S101-S106.
41. Shimizu W, Anzelevitch C: Cellular and ionic basis for T-
wave alternant under long QT syndrome. Circulation 1999;99: 1499-1507.
42. Schwartz PJ, Spazzolini C, Crotti L, et al: The Jervelland Lange-Nielsen syndrome: natural history, molecu-lar basis, and clinical outcome. Circulation 2006; 113:783-790.
43. Priori SG, Schwartz PJ, Napolitano C, et al: Risk stratifica-tion in the long-QT ayndrome. N Engl J Med 2003; 348:1866-1874.
44. Zipes DP, Camm JA, Borggrefe M, et al: ACC/AHA/ESC2006 Guidelines for Management of Patients with Ven-tricular Arrhythmias and the Prevention of Sudden Car-diac Death: executive summary. J Am Coll Cardiol 2006;48: 1064-1108.
45. Tzivoni D, Banai S, Schuger C, et al: Treatment of torsadede pointes with magnesium sulfate. Circulation 1988; 77:392-397.
46. Viskin S: Torsade de pointes. Curr Treat Opt CardiovascMed 1999; 1: 187-195.
47. Shimizu W, Antzelevitch C: Differential effects of beta-adrenergic agonists and antagonists in LQT1, LQT2 andLQT3 models of the long QT syndrome. J Am Coll Cardiol2000; 35: 778-786.
48. Moss AJ, Schwartz PJ: Anniversary of the InternationalLong QT Syndrome Registry: an ongoing quest to uncoverthe secrets of LQTS. Circulation 2005; 111: 1199-1201.
49. Moss AJ, Zareba W, Hall WJ, et al: Effectiveness and limi-tations of beta˚-blocker therapy in congenital long-QT syn-drome. Circulation 2000; 101: 616-623.
50. Schwartz PJ, Priori SG, Cerrone M, et al: Left cardiac sym-pathetic denervation in the management of high-risk pa-tients affected by the long-QT syndrome. Circulation 2004;109: 1826-1833.
51. Viskin S: Cardiac pacing in the long QT syndrome: reviewof available data and practical recommendations. JCardiovasc Electrophysiol 2000; 11: 593-600.
52. Moss AJ, Zareba W, Hall WJ, et al: Effectiveness and limi-tations of beta-blocker therapy in congenital long QT syn-drome. Circulation 2000; 101: 116-123.
53. Zareba W, Moss AJ, Daubert JP, Hall WJ, Robinson JL,Andrews M: Implantable cardioverter defibrillator in high-risk long QT syndrome patients. J Cardiovasc Electrophysiol2003; 14: 337-341.
54. Priori SG, Napolitano C, Schwartz PJ, et al: Association oflong QT syndrome loci and cardiac events among patientstreated with beta-blockers. J Am Med Acad 2004; 292:1341-1344.
55. Schwartz PJ, Priori SG, Spazzolini C, et al: Genotype-phe-notype correlation in the long QT syndrome. Gene-specifictriggers for life-threatening arrhythmias. Circulation 2001;103: 89-95.
56. Schwartz PJ: Management of the long QT syndrome. NatClin Pract Cardiovasc Med 2005; 2: 346-351.
57. Zareba W, Moss AJ, Schwartz PJ, et al: Influence of geno-type on the clinical course of the long-QT syndrome. Inter-national Long-QT Syndrome Registry Research Group. NEngl J Med 1998; 339: 960-965.
58. Berul CI: Neonatal long QT syndrome and sudden cardiacdeath. Progr Pediatr Cardiol 2000; 1: 47-54.
59. Cronk LB, Ye B, Kaku T, et al: Novel mechanism for sud-den infant death syndrome: persistent late sodium currentsecondary to mutations in caveolin-3. Heart Rhythm 2007;4: 161-166.
60. Rashba EJ, Zareba W, Moss AJ, et al, for the LQTS Investi-gators: Influence of pregnancy in the risk for cardiac eventsin patients with hereditary long-QT syndrome. Circulation1998; 97: 451-456.
61. Seth R, Moss AJ, McNitt S, et al: Long QT syndromeand pregnancy. J Am Coll Cardiol 2007; 49: 1092-1098 .

Vol 37 Nº 2 Abril-Junio 2008
OSCAR PELLIZZON ET AL SINDROME DE QT LARGO CONGENITO
129
62. Sanguinetti MC, Bennett PB: Antiarrhythmic drug targetchoices and screening. Circ Res 2003; 96: 491-499.
63. Virgin S: Long QT syndromes and torsades de pointes.Lancet 1999; 354: 1625-1633.
64. Roden DM: Long QT syndrome: reduced repolarization re-
serve and the genetic link. J Intern Med 2006; 259: 59-69.65. Sten Forshufvud: www.wikipedia.org66. Mari F, Bertol E, Fineschi V, Karch SB: Channelling the Em-
peror: what really killed Napoleon? J R Soc Med 2004; 97:397-399.
La mera vida fisiológica no es, por supuesto, la Vida. Y tampoco lo es lamera vida psicologica. La Vida es el mundo. WITTGENSTEIN