QUÍMICA ORGÂNICA LIÇÃO 14 - AEROUBI - Base de Dados
Transcript of QUÍMICA ORGÂNICA LIÇÃO 14 - AEROUBI - Base de Dados

©Carla Padrel de Oliveira, Universidade Aberta, 2005 1
QUÍMICA ORGÂNICA
LIÇÃO 14
OBJECTIVOS:
Identificar a terminologia utilizada;
Descrever as diferentes classes de hidrocarbonetos;
Identificar os vários grupos funcionais existentes;
Compreender e aplicar as regras de nomenclatura IUPAC;
Distinguir os diferentes tipos de isómeros.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 2
A química orgânica é o ramo da Química que estuda os compostos de
carbono. Considera-se que Lémery (1645-1715) foi o pai desta ciência,
quando em 1685 publicou um livro de Química onde as substâncias eram
classificadas, de acordo com a sua origem, em minerais, vegetais ou
animais. Os compostos derivados de plantas ou animais (organismos vivos)
passaram a ser designados por orgânicos, enquanto os derivados de
minerais (matéria morta) foram designados por inorgânicos. Até cerca de
1828 acreditou-se que os compostos orgânicos só podiam ser obtidos pela
acção dos organismos vivos.
A química orgânica, tal como a conhecemos hoje, surgiu apenas em
1850 e ficou a dever-se aos trabalhos de Wöhler (1800-1822) que conseguiu
sintetizar a ureia (composto considerado orgânico) por aquecimento de
cianato de amónia (substância inorgânica).
Actualmente a Química Orgânica ou Química do Carbono, é definida
como o ramo da Química que se dedica ao estudo dos compostos
constituídos por átomos de carbono combinados com um ou mais elementos.
Muitos destes compostos resultam de sínteses efectuadas em laboratório e a
sua existência na natureza nem sempre é conhecida.
Grande parte das substâncias com que lidamos diariamente são
compostos orgânicos: o álcool etílico, o gás propano, a acetona, o ácido
acético (principal constituinte do vinagre), a gasolina, etc., onde o
elemento carbono aparece como constituinte principal do esqueleto suporte
da molécula.
Deste modo, não é difícil compreender o importante papel
desempenhado por esta ciência em domínios tão importantes como o da
tecnologia, já que se trata da química dos corantes, das tintas, do papel,
dos plásticos, da borracha, da alimentação e mesmo do vestuário, e da
medicina e biologia, pois, com excepção da água, os organismos vivos são
formados por moléculas orgânicas.
De uma maneira geral estes compostos apresentam propriedades e
características bastante diferentes dos compostos inorgânicos. Esta
afirmação pode ser verificada ao relembrar que os compostos orgânicos:

©Carla Padrel de Oliveira, Universidade Aberta, 2005 3
são normalmente combustíveis;
apresentam pontos de ebulição e de fusão inferiores;
são menos solúveis em água;
para a mesma fórmula química, podem apresentar várias fórmulas
estruturais;
participam em reacções de natureza molecular, por oposição à
natureza iónica e, consequentemente, são mais lentas;
apresentam pesos moleculares frequentemente superiores a 1
000;
são, frequentemente, uma fonte de alimento das bactérias.
Dado o elevado número e complexidade das diferentes substâncias
orgânicas actualmente existentes, a atribuição de um nome e respectiva
classificação tornou-se de tal forma extensa que a memorização era
impraticável e a comunicação entre as pessoas seria dificultada e até
perigosamente confusa. Assim, foi desenvolvida uma abordagem
sistemática baseada num conjunto de regras simples e que tem vindo a ser
sucessivamente aperfeiçoada. A nomenclatura actualmente adoptada pela
comunidade científica é baseada nas recomendações da International Union
of Pure and Applied Chemistry (IUPAC).
Coloca-se agora a questão: Como é possível ter tantos compostos de
carbono? Relembremos algumas das características deste elemento.
O elemento carbono é o primeiro do Grupo IVA da Tabela Periódica,
ou seja apresenta 4 electrões de valência (cf cap. 5.), sendo a sua
configuração electrónica representada por:
2226 221– pss C
De acordo com a regra do octeto, os átomos de moléculas mais
estáveis apresentam 8 electrões à sua volta, mas facilmente se compreende
que é pouco provável que este elemento ganhe ou perca 4 electrões para
formar respectivamente iões C4– ou iões C4+; contudo, se partilhar mais 4
electrões passa a estar rodeado por 8 electrões de valência. Assim, o átomo
de carbono é estável ao formar quatro ligações covalentes com outros

©Carla Padrel de Oliveira, Universidade Aberta, 2005 4
átomos, que poderão ser de carbono ou de outros elementos, tal como
veremos ao longo deste capítulo.
1. HIDROCARBONETOS
Os hidrocarbonetos, constituídos por apenas dois elementos (carbono
e hidrogénio) são a base de todos os compostos orgânicos.
Estruturalmente, os hidrocarbonetos podem ser divididos em dois
grandes grupos: hidrocarbonetos alifáticos e hidrocarbonetos aromáticos,
caracterizando- -se estes últimos por apresentarem um ciclo de 6 átomos
de carbono com características muito específicas, que mais adiante serão
estudadas. O grupo dos alifáticos pode ainda ser dividido em saturados, que
apenas apresentam ligações simples entre os carbonos da cadeia, e
insaturados que podem apresentar uma ou mais ligações múltiplas (ligações
duplas ou ligações triplas) – cf. Figura 1.
HIDROCARBONETOS
Alifáticos Aromáticos
Alcenos – ligações duplas
Saturados Insaturados
Alcanos Alcinos – ligações triplas
Radicais Alquilo
Figura 1.- Classificação dos hidrocarbonetos
Tal como tem sido referido, todos os compostos orgânicos têm uma
cadeia de átomos de carbono ligados. Vejamos alguns dos arranjos possíveis
que podem ser encontrados nos hidrocarbonetos:

©Carla Padrel de Oliveira, Universidade Aberta, 2005 5
1. Cadeias lineares simples:
C
H
H
H
C
H
H
C
H
H
C
H
H
H
2. Cadeias lineares ramificadas:
C
H
H C
H
H
C
H
C
H
H
HC HH
H
H
3. Anéis ou estruturas cíclicas:
C
H
H
C C
C
H
H
H
HH
H
4. Anéis ou estruturas cíclicas
ramificadas:
C
H
H
C C
C
H
H
C
HH
H
H
H
H
A nomenclatura destes compostos passa sempre pela identificação da
cadeia mais longa de átomos de carbono ligados, sendo as ramificações
objecto de posterior classificação.
Analisemos agora o seguinte exemplo:
C
H
H
H
C
H
H
C
H
C
H
H
HC
C H
HH
H
H

©Carla Padrel de Oliveira, Universidade Aberta, 2005 6
Normalmente, a tendência é identificar a cadeia principal como a
representada na horizontal, sem se reparar que esta pode não ser a cadeia
com maior número de átomos de carbono sequencialmente ligados.
Neste exemplo concreto, a cadeia principal contém não 4 átomos mas
5 átomos de carbono ligados:
C
H
H
H
C
H
H
C
H
C
H
H
HC
C H
HH
H
H
A informação quanto ao número de átomos de carbono que se
encontram representados na cadeia principal é dada pelo prefixo do nome
do composto em estudo, tal como é apresentado na Tabela 1.
Tabela 1. – Prefixos numéricos relacionados com o número de carbonos.
Nº átomos de C Prefixo Esquema estrutural
1 MET C
2 ET C – C
3 PROP C – C – C
4 BUT C – C – C – C
5 PENT C – C – C – C – C
6 HEX C – C – C – C – C – C
7 HEPT C – C – C – C – C – C – C
Em compostos que apresentem um número de átomos de carbono
superior a 7, é adoptado o prefixo da numeração grega correspondente à
mesma, de modo análogo ao prefixo das cadeias de 5, 6 e 7 átomos ligados,
respectivamente.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 7
ALCANOS – HIDROCARBONETOS ALIFÁTICOS SATURADOS
Estes compostos, constituídos por dois elementos (carbono e
hidrogénio) apresentam apenas ligações simples entre os átomos de carbono
que formam a cadeia, o ciclo ou anel.
Os alcanos, de fórmula geral ,...2,1,22 nnn e H C , são compostos
saturados, ou seja, não é possível adicionar mais átomos de hidrogénio.
A nomenclatura dos alcanos é formada pelo prefixo correspondente
ao número de átomos da cadeia principal e pelo sufixo ou terminação ANO;
na tabela 2. são apresentados os primeiros 7 alcanos de cadeia linear.
Tabela 2. – Primeiros sete alcanos de cadeia linear
Nome Fórmula Molecular
Fórmulas Estruturais Condensadas
metano CH4 CH4
etano C2H6 CH3 – CH3
propano C3H8 CH3 – CH2 – CH3
butano C4H10 CH3 – CH2 – CH2 – CH3
pentano C5H12 CH3 – CH2 – CH2 – CH2 – CH3
hexano C6H14 CH3 – CH2 – CH2 – CH2 – CH2 – CH3
heptano C7H16 CH3 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3
As fórmulas estruturais condensadas permitem, mais facilmente,
visualizar a organização espacial da molécula e a correspondente
identificação da cadeia carbonada.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 8
No caso de compostos de cadeias longas, é frequente agregar as
parcelas do mesmo tipo quando ligadas sequencialmente; por exemplo a
molécula de heptano
CH3 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3
pode também ser representada por :
CH3 – (CH2 )5 – CH3
Este tipo de representação, apesar de facilitar a escrita de moléculas mais
complicadas pode, por vezes, tornar-se confuso.
Um outro modo de descrever estes compostos é através da
representação da sua estrutura ou fórmula estrutural o que facilita bastante
a identificação dos compostos. Alguns exemplos são:
Metano
C
H
H
H
H
Etano
C
H
H
HC
H
H
H
Propano
C
H
H
HC
H
H
C
H
H
H

©Carla Padrel de Oliveira, Universidade Aberta, 2005 9
Ainda na classe dos alcanos existem os compostos cíclicos, onde a
cadeia de carbonos é fechada formando um ciclo ou anel. Estes compostos
apresentam a fórmula geral ,...4,3,2 nnn e H C , e o número de átomos de
carbono tem de ser igual ou superior a 3.
Para estes compostos cíclicos, o nome do alcano é precedido pela
palavra ciclo. Por exemplo, um anel com 3 átomos de carbono tem o nome
de ciclo propano:
C
C
H
C
H
H
H
H
H
Estes compostos são frequentemente representados por uma forma
simplificada onde cada vértice da figura é indicativo da existência de um
átomo de carbono, não se representando nenhum símbolo químico (a menos
que estritamente necessário). Neste caso o ciclo propano pode representar-
se apenas por um triângulo:
Outros exemplos de ciclo alcanos simples são:
Ciclobutano:
Ciclopentano:
Ciclohexano:
Note que cada vértice representa um grupo CH2
Um outro grupo de compostos, ainda pertencente à classe dos
hidrocarbonetos alifáticos saturados, são os radicais alquilo. Este grupo é
derivado do anterior, apenas com a diferença que apresenta menos um
átomo de hidrogénio no fim da cadeia e, de uma maneira geral, estes grupos

©Carla Padrel de Oliveira, Universidade Aberta, 2005 10
aparecem como ramificação ou radical nas moléculas dos compostos
orgânicos.
Tabela 3. – Primeiros quatro alquilos
Nome Fórmula Molecular
Fórmula de Estrutura
metil (o) CH3 CH3 –
etil (o) C2H5 CH3 – CH2 –
propil (o) C3H7 CH3 – CH2 – CH2-
butil (o) C4H9 CH3 – CH2 – CH2 – CH2-
Note que os nomes destes grupos terminam em IL ou em ILO,
consoante o tipo de molécula em estudo.
NOMENCLATURA DOS ALCANOS
Os nomes dos alcanos lineares são bastante fáceis de memorizar, e de
acordo com a tabela 2., com excepção dos quatro primeiros membros, o
número de átomos de carbono é explicitado através de um prefixo grego. No
entanto para moléculas mais complexas é necessário recorrer a algumas
regras (IUPAC):
1. O nome do composto é constituído pelo prefixo correspondente ao
número de átomos de carbono da cadeia contínua mais longa e
pelo sufixo ano;
2. A numeração tem início a partir da extremidade mais próxima do
átomo de carbono que apresenta um hidrogénio substituído;
3. Ao substituir um ou mais átomos de hidrogénio por outros grupos o
nome do composto deve indicar o número do átomo de carbono
que foi objecto de substituição;
4. As substituições múltiplas de grupos idênticos são identificadas
pelos prefixos di, tri, tetra, … para respectivamente dois, três ou
quatro grupos.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 11
Analisemos alguns exemplos:
Exemplo 1.
C
H
H
HC
H
C
H
H
H CH3
A cadeia mais longa contém 3 átomos de carbono, ou seja, trata-se
de um propano. Ao átomo de carbono número 2 está ligado um grupo
metilo, e consequentemente este composto tem o nome de 2-metil
propano.
Repare que neste caso a cadeia principal, tanto pode ser a
representada a cheio como a representada a tracejado; em ambos os casos
o nome do composto é o mesmo, pois existem apenas três átomos de
carbono. Nestas situações, considera-se a cadeia linear como cadeia
principal.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 12
Exemplo 2.
HC
H
H
20
C
H
H
C
H
C
H
H
H C
H
H
C
H
C
H
H
C HH
C H
H
H
CH3
1 2 3 4 5 6 7
Neste caso a cadeia mais longa apresenta 7 átomos de carbono,
tratando-se portanto de um heptano; como grupos substituintes temos um
grupo metilo (CH3) e um grupo etilo (C2H5). De acordo com as regras de
nomenclatura, começa-se a contar a partir da extremidade mais próxima do
átomo de carbono que apresenta um hidrogénio substituído, ou seja, neste
exemplo concreto, da esquerda para a direita.
Assim, o nome deste composto é 5–etil–2–metil–heptano. Repare que
a ordem de escrita dos radicais é alfabética relativamente à primeira letra
do prefixo do tipo de radical.
Exemplo 3:
C
H
C
H
H
H
CH3
1 2 3C
H
H
C
H
C
H
C HH
H
4 5H
H
Neste composto a cadeia mais longa apresenta 5 átomos de carbono,
tratando-se portanto de um pentano. Existem ainda dois grupos metilo e, de
acordo com as regras de nomenclatura, este composto tem o nome de 2,3–
dimetil–pentano.
No caso de existir mais do que um radical do mesmo tipo é necessário
indicar as posições destes e acrescentar o prefixo numérico respectivo. As

©Carla Padrel de Oliveira, Universidade Aberta, 2005 13
posições dos radicais iguais na cadeia principal devem ser escritas antes do
nome e separadas por vírgula, mesmo que se encontrem no mesmo átomo da
cadeia principal. O prefixo para dois radicais iguais é di, para três tri, para quatro
tetra, etc.
Exemplo 4:
C
H
C
H
H
H1 2 3
C
H
H
C
H
C
C HH
H
4 5H
H
H C HH
H
A cadeia principal é constituída por 5 átomos de carbono. Trata-se de
um pentano mas, agora, com dois grupos metilo no mesmo átomo de
carbono; o nome deste composto é 3,3–dimetil–pentano
Exemplo 5:
C C C CH2
C
C
C
C
C
HC
C
H
H
HH
HHH
H
H
H
H
H
H
H
H
H
H
H
H
1 2 3 4
5
6
7
CH H
H
C2H
5

©Carla Padrel de Oliveira, Universidade Aberta, 2005 14
A cadeia mais longa apresenta 7 átomos de carbono, tal como se
encontra assinalado na figura. Começando a contar da esquerda
(extremidade mais próxima do átomo de carbono que apresenta um
hidrogénio substituído), verificamos que na posição 2 o hidrogénio é
substituído por um grupo metilo, enquanto que nas posições 3, 4 e 5 há uma
substituição pelo grupo etilo. Assim, este composto tem o nome de 3,4,5–
trietil–2–dimetil–heptano.
Chama-se novamente a atenção de que a ordem de escrita dos
radicais é alfabética relativamente à primeira letra do prefixo do tipo de
radical e não ao prefixo indicativo do número de radicais.
ALCENOS
Estes compostos são semelhantes aos alcanos, mas apresentam, pelo
menos, uma ligação dupla na sua estrutura e agora o sufixo ou terminação é
ENO. A fórmula geral dos compostos que contêm apenas uma ligação dupla
é ,...4,3,2,2 nnn e H C

©Carla Padrel de Oliveira, Universidade Aberta, 2005 15
Tabela 4. – Primeiros seis alcenos de estrutura linear
Nome Fórmula
Molecular
Fórmula de Estrutura Condensada
eteno C2H4 CH2 = CH2
propeno C3H6 CH2 = CH – CH3
buteno
C4H8
CH2 = CH – CH2 – CH3
CH3 – CH = CH – CH3
penteno
C5H10
CH2 = CH – CH2 – CH2 – CH3
CH3 – CH = CH – CH2 – CH3
hexeno
C6H12
CH2 = CH – CH2 – CH2 – CH2 – CH3
CH3 – CH = CH – CH2 – CH2 – CH3
CH3 – CH2 – CH = CH – CH2 – CH3
NOMENCLATURA
Como pode ser observado na Tabela 4., para substâncias com 4 ou
mais átomos de carbono surgem várias formas de estrutura. Assim, a
nomenclatura dos alcenos passa, necessariamente, pela identificação das
posições das duplas ligações carbono–carbono. Tal como anteriormente o
nome do composto é determinado pelo número de átomos de carbono da
cadeia mais longa.
Por exemplo, para o buteno existem duas fórmulas possíveis:
CH2 = CH – CH2 – CH3 1 – buteno
CH3 – CH = CH – CH3 2 – buteno

©Carla Padrel de Oliveira, Universidade Aberta, 2005 16
Os números na designação 1–buteno e 2–buteno indicam a posição da
ligação dupla (entre dois átomos de carbono). O nome buteno significa que
se trata de um composto com 4 átomos de carbono na cadeia mais longa. É
ainda importante realçar que a fórmula CH3 – CH2 – CH = CH2 representa
também o 1–buteno, uma vez que neste caso a numeração mais baixa
significa que a contagem deve ter início no carbono mais à direita.
Estes dois compostos (1–buteno e 2–buteno) têm ambos a mesma
fórmula química, C4H8, mas apresentam fórmulas de estrutura diferentes,
correspondentes a diferentes posições da dupla ligação. Esta
aparentemente pequena diferença, é responsável pelas diferentes
propriedades físicas e químicas que existem entre estes compostos. Pode,
portanto, concluir-se que não é indiferente falar de um ou de outro.
Os compostos químicos que apresentam a mesma fórmula química
mas diferentes fórmulas de estrutura, são denominados isómeros, e serão
objecto de estudo no final deste capítulo.
Os alcenos que contenham mais do que uma ligação dupla devem ter,
no seu nome, a indicação do número de duplas ligações existentes, e quais
as respectivas posições. Esta indicação aparece entre o prefixo relativo ao
número de átomos de carbono na cadeia principal e antes do sufixo ENO, e
usam-se os termos di, tri, tetra, etc, consoante o número de ligações
duplas existentes.
Por exemplo, o composto de fórmula CH2 = CH – CH = CH – CH3 tem o
nome de 1,3–pentadieno, ou seja, apresenta duas duplas ligações situadas
no átomo de carbono 1 e no átomo de carbono 3.
Os alcenos ciclícos só são observados em compostos cujo número de
átomos de carbono é igual ou superior a 3. Nestes compostos, a numeração
dos átomos de carbono é importante para classificar radicais que possam
estar acoplados ao anel ou quando se está perante mais do que uma dupla
ligação. Por exemplo:

©Carla Padrel de Oliveira, Universidade Aberta, 2005 17
1,3–ciclopentadieno
C
C
C C
C
H
H
H
HH
H
1-metil–2,4,6–cicloheptatrieno
25
C
C
C C
C
C
C
2
34
5
6
7
1
HH
H
H
H
H
H
CH3
ALCINOS
Os alcinos são compostos análogos aos alcenos com a diferença de
conterem ligações triplas ao invés de duplas. A nomenclatura é em tudo
semelhante, sendo importante reparar que na diferença da terminação que
é, agora, o sufixo INO.
A fórmula geral dos alcinos é ,...4,3,2,2–2 nnn e H C
As regras de nomenclatura enunciadas para os alcenos são também
aplicáveis aos alcinos. Na tabela 5. apresentam-se os primeiros seis alcinos
de estrutura linear.
Também, neste caso, e como pode ser observado na Tabela, para
substâncias com 4 ou mais átomos de carbono, surgem várias formas de
1

©Carla Padrel de Oliveira, Universidade Aberta, 2005 18
estrutura. A nomenclatura dos alcinos passa, necessariamente, pela
identificação das posições das ligações triplas entre os átomos de carbono.
Por exemplo, quando nos referimos ao pentino (C5H8), devemos distinguir
entre:
CH C – CH2 – CH2 – CH3 1 – pentino
CH3 – C C – CH2 – CH3 2 – pentino
Tabela 5. – Primeiros seis alcinos de estrutura linear
Nome Fórmula Química Fórmula de Estrutura
Condensada
etino C2H2 CH CH
propino C3H4 CH C – CH3
butino C4H6 CH C – CH2 – CH3
CH3 – C C– CH3
pentino C5H8 CH C – CH2 – CH2 – CH3
CH3 – C C – CH2 – CH3
hexino
C6H10
CH C – CH2 – CH2 – CH2 – CH3
CH3 – C C – CH2 – CH2 – CH3
CH3 – CH2 – C C – CH2 – CH3

©Carla Padrel de Oliveira, Universidade Aberta, 2005 19
REGRAS GERAIS DE NOMENCLATURA:
1. A cadeia é numerada de tal forma que a soma dos números que se
atribuem aos grupos substituintes seja a menor possível;
2. Dois substituintes idênticos ligados ao mesmo átomo de carbono
são indicados cada um com um número;
3. A numeração dos substituintes numa cadeia lateral começa no
átomo de carbono ligado à cadeia principal;
4. Dois ou mais substituintes são denominados por ordem alfabética;
5. Os nomes dos substituintes são separados por traços e os números
por vírgulas.
ALCANOS
São denominados com prefixos indica-tivos do número de átomos de carbono da cadeia mais longa e apresentam a terminação ano
ALCENOS
São denominados com prefixos indicati-vos do número de átomos de carbono da cadeia mais longa que contém a dupla liga-ção e apresentam terminação eno;
Os átomos da cadeia principal são numerados a partir da extremidade mais próxima da dupla ligação. Se esta esti-ver no centro da ca-deia, numera-se a partir da extremida-de que dá índices mais baixos para os grupos substituintes.
O número indicati-vo da dupla ligação coloca-se no início, separado do nome do alceno por um traço.
ALCINOS
São denominados com prefixos indicati-vos do número de átomos de carbono da cadeia mais longa que contém a tripla liga-ção e apresentam a terminação ino;
Os átomos da cadeia principal são numerados a partir da extremidade mais próxima da tripla ligação;
O número indicati-vo da tripla ligação coloca-se no início, separado do nome do alcino por um traço.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 20
2. GRUPOS FUNCIONAIS
A maior parte das substâncias orgânicas pode ser agrupada num
número relativamente pequeno de classes, de acordo com o seu grupo
funcional. Designa-se por grupo funcional,o grupo de átomos que é, em
grande parte, responsável pelo comportamento químico da molécula em que
está inserido. Moléculas diferentes, que contêm o mesmo grupo funcional,
apresentam reacções químicas semelhantes. Assim, pode-se estudar e
compreender a maior parte das substâncias orgânicas se se conhecerem as
características do grupo funcional.
Na Tabela 6. são apresentados alguns exemplos de classes ou famílias
de compostos e os respectivos grupos funcionais. As designações R1 e R2 são
usadas para indicar a existência de cadeias laterais, que podem ser
constituídas por átomos de carbono ou por átomos de outros elementos.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 21
Tabela 6. – Famílias de compostos e correspondentes grupos funcionais
Famílias Grupo Funcional
Derivados Halogenados R1 –– X
(X representa um halogénio)
Álcoois OHR1
Éteres OR1 R2
Cetonas
O
C R1R2
Aldeídos
O
C HR1
Ácidos carboxílicos C
O
R1
OH
Ésteres C
O
R1
O R2
Amidas
Aminas N
HH
R1
Aminoácidos C
O
OH
H2N C
H
R1
C
O
R1
NH2
C
O
R1
NH2

©Carla Padrel de Oliveira, Universidade Aberta, 2005 22
DERIVADOS HALOGENADOS
Estes compostos resultam da substituição de um ou mais átomos de
hidrogénio da cadeia de um hidrocarboneto alifático, por um elemento do
grupo dos halogéneos: flúor, cloro, bromo ou iodo. A presença destes
elementos deve, por conseguinte, aparecer discriminada no nome do
composto, bem como a sua posição na cadeia principal. As regras de
nomenclatura são as mesmas e os radicais alquilo, ordenados
alfabeticamente, precedem o nome da cadeia principal.
No caso dos halogéneos estarem inseridos em cadeias com ligações
duplas ou triplas, a numeração da cadeia principal deve ser feita de modo a
que a múltipla ligação tenha o menor número possível.
Vejamos alguns exemplos:
H
C
H
C
Cl
C H
H
C
H
H
H HH
2–cloro–butano
27
C
H
H
H C
H
H
C
Br
H
C
Cl
Cl
C
H
H
H
3–bromo–2,2–dicloro–pentano
C
F
H
I C
H
Br
C
H
H
CH
H
3–bromo–4–fluor–4–iodo–1–buteno

©Carla Padrel de Oliveira, Universidade Aberta, 2005 23
29
C
H
H
H C C C
H
Cl
C
H
C
H
H
C
H
H
CH3
H1 3 4 5 6 72
4–cloro–5–metil–2–
heptino
ÁLCOOIS
Os álcoois, substâncias muito conhecidas e utilizadas no dia-a-dia,
são compostos derivados dos hidrocarbonetos alifáticos e obtidos por
substituição de um ou mais átomos de hidrogénio pelo grupo funcional
álcool, –OH, também designado por grupo hidroxilo, hidroxi ou grupo ol.
O nome de um álcool é obtido adicionando a letra l à designação do
hidrocarboneto que está na sua origem.
Analogamente ao que se observou para os alcenos e alcinos, podemos
ter álcoois com a mesma fórmula molecular mas com diferentes fórmulas de
estrutura, sendo portanto, necessário especificar a posição do grupo
funcional.
Relembrem-se algumas das regras de nomenclatura:
começa-se por identificar a cadeia mais longa de átomos de
carbono à qual o grupo OH está ligado;
a numeração é iniciada pelo lado mais próximo do grupo OH;
a indicação da posição do grupo é feita pela adição do respectivo
número antes do nome;
se no mesmo composto existir mais do que um grupo OH, essa
informação é dada pelo prefixo numérico colocado entre o nome e
a terminação ol;
Alguns exemplos de nomenclatura e respectivas fórmulas de estrutura
são apresentados na Tabela 7., para os seis primeiros membros da série.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 24
Tabela 7.– Seis primeiros álcoois da série
Nome Fórmulas de Estrutura Nomenclatura
metanol CH3OH
etanol CH3 – CH2OH
propanol CH3 – CH2 – CH2OH
CH3 – CHOH – CH3
1 – propanol
2 – propanol
butanol CH3 – CH2 – CH2 – CH2OH
CH3 – CH2 – CHOH – CH3
1 – butanol
2 – butanol
pentanol
CH3 – CH2 – CH2 – CH2 – CH2OH
CH3 – CH2 – CH2 – CHOH – CH3
CH3 – CH2 – CHOH – CH2 – CH3
1 – pentanol
2 – pentanol
3 – pentanol
Um exemplo de um álcool com mais do que um grupo hidroxilo é:
C
H
H
H C
OH
H
C
OH
H
C H
H
H
2,3–butanodiol
Estes compostos podem ainda ser classificados em função do tipo de
átomo de carbono ao qual o grupo funcional OH está ligado. Assim, se o
grupo hidroxilo se encontrar ligado a um átomo de carbono que , por sua
vez, está ligado a um só átomo de carbono, o álcool é considerado um
álcool primário:

©Carla Padrel de Oliveira, Universidade Aberta, 2005 25
C
H
H
H C
H
H
C
OH
H
H
1–propanol
No caso do grupo hidroxilo se encontrar ligado a um átomo de
carbono que, por sua vez, se encontra ligado a dois átomos de carbono,
então trata-se de um álcool secundário:
31
C
H
H
H C
OH
H
C
H
H
H
2–propanol
No caso do grupo funcional OH se encontrar ligado a um átomo de
carbono que está ligado a 3 átomos de carbono, então trata-se de um álcool
terciário:
C
H
H
H C
OH
CH3
C
H
H
H
2–metil–2–propanol

©Carla Padrel de Oliveira, Universidade Aberta, 2005 26
ÉTERES
Os éteres são compostos caracterizados por apresentarem um átomo
de oxigénio no meio de dois grupos alquilo. O nome destes é sempre
precedido pela palavra éter seguida do nome (por ordem alfabética) dos
respectivos grupos alquilo, tendo o último a terminação ílico. Quando os
dois grupos alquilo são iguais, o nome deste é precedido do prefixo di, para
informar da igualdade dos mesmos.
Analisemos alguns exemplos:
C
H
H
H C
H
H
HO
éter dimetílico
C
H
H
H C
H
H
CO
H
H
H
éter etilmetílico
C
H
H
H C
H
C
H
C
H
H
HO
H H
éter metilpropílico

©Carla Padrel de Oliveira, Universidade Aberta, 2005 27
CETONAS
Estes compostos são caracterizados pela presença de um átomo de
carbono secundário (isto é, ligado a dois átomos de carbono) com uma dupla
ligação a um átomo de oxigénio. Este grupo, representado por
O
C R1R2
é designado por grupo carbonilo.
A nomenclatura obedece às regras anteriormente enunciadas, mas
agora com o sufixo ona.
Vejamos alguns exemplos:
C C
H
C
O
H
H H
HH
propanona (conhecida
comercialmente por acetona)
C
H
H
C
H
H
H
C
H
H
C
H
H
H
C
O
2–pentanona
C
H
H
H
C
H
H
C
H
H
H
C
O
C
H
H
3–pentanona
Analogamente ao que já foi observado anteriormente, a posição do
grupo carbonilo pode variar, levando à escrita de fórmulas isómeras; assim,
o nome destes compostos é precedido por um número indicativo da posição
do grupo carbonilo.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 28
ALDEÍDOS
Os aldeídos são compostos que apresentam o grupo carbonilo sempre
num átomo de carbono primário, ou seja, numa das extremidades da
molécula:
O
C HR1
e apresentam a terminação al.
40
C
H
H
H
CO
H
etanal
C
H
H
C
H
H
C
H
H
H
CO
H
butanal
Como se poderá facilmente constatar, não é necessário indicar a
posição do grupo funcional, uma vez que este ocorre sempre num dos
extremos da molécula. Contudo, a numeração dos átomos da cadeia mais
longa, deverá ter início na extremidade na qual se encontra o grupo
funcional. Vejamos alguns exemplos:
C
H
H
C
H
H
C
H
C
H
H
C
H
H
O
Br
3–bromopentanal

©Carla Padrel de Oliveira, Universidade Aberta, 2005 29
C
H
H
C
Br
H
C
H
C
H
H
C
H
H
O
H
4–bromopentanal
ÁCIDOS CARBOXÍLICOS
Os ácidos carboxílicos são compostos que apresentam o grupo
funcional carboxilo, –COOH, numa das extremidades da cadeia; este átomo
de carbono liga-se por uma dupla ligação a um átomo de oxigénio e por uma
ligação simples a um grupo hidroxilo, –OH.
O nome destes compostos é sempre precedido pela palavra ácido,
seguindo-se o prefixo indicativo do número de átomos da cadeia principal
que contém o carbono do grupo funcional sendo a terminação em nóico.
Alguns exemplos são:
CO
OH
H
ácido metanóico
(também conhecido por ácido
fórmico)
C
H
H
H
CO
OH
ácido etanóico
(também conhecido por ácido
acético e constituinte principal do
vinagre)

©Carla Padrel de Oliveira, Universidade Aberta, 2005 30
44
C
H
H
C
H
H
C
H
H
H
CO
OH
ácido butanóico
C
H
H
H C
H
C
H
OOH
ácido 2–hidroxi–propanóico
(também conhecido por ácido
láctico)
ÉSTERES
Os ésteres são compostos que apresentam o seguinte grupo funcional:
C
O
R1
O R2
São substâncias que derivam dos ácidos carboxílicos, por substituição
do átomo de hidrogénio do grupo hidroxilo (–OH), por um radical alquilo (R2)
e o radical R1, que pode ser um grupo alquilo ou um átomo de hidrogénio.
A nomenclatura dos ésteres faz-se juntando o sufixo ato ao nome do
radical do ácido (R1), seguido do nome do radical do álcool (R2).
Vejamos alguns exemplos:

©Carla Padrel de Oliveira, Universidade Aberta, 2005 31
H
C
H
C
H
H
H
CO
O C
H
H
H
Radical R1 – propanoato (deriva do ácido propanóico)
Radical R2 - metilo
Logo, o nome deste composto é propanoato de metilo.
C
H
H
C
H
H
H
C
H
H
CO
O
H
O nome deste composto é metanoato de propilo
Os ésteres são substâncias bastante usadas no fabrico de perfumes e
como aromatizantes. O cheiro e sabor característico de alguns frutos deve-
se à presença destes compostos, embora em pequenas quantidades. Alguns
exemplos são:
C
H
H
H
C
H
H
CO
O
H
metanoato de etilo
(responsável pelo sabor do rum)
Neste caso, o radical R1 é derivado do ácido metanóico, assumindo portanto a designação de metanoato e o radical R2 é um grupo propilo (3 átomos de
carbono).

©Carla Padrel de Oliveira, Universidade Aberta, 2005 32
C
H
C
H
HC
HC
O
O
H H
C
H
C
HC
H
H
H
H H H
Este composto, responsável pelo sabor da banana, tem o nome de etanoato
de pentilo
AMIDAS
As amidas são compostos derivados dos ácidos carboxílicos que
apresentam o seguinte grupo funcional:
São obtidos, por substituição do grupo funcional hidroxilo, por um grupo –
NH2. Pode, ainda, verificar-se a substituição de um ou de ambos os átomos
de hidrogénio deste grupo por radicais alquilo, originando, respectivamente,
amidas secundárias ou terciárias.
Assim, a nomenclatura destas substâncias é diferente consoante
forem amidas primárias, secundárias ou terciárias.
Se o grupo NH2 não se encontrar substituído, o nome da amida
primária é construído a partir do correspondente ácido, substituindo a
terminação ÓICO por AMIDA:
C
O
R1
NH2

©Carla Padrel de Oliveira, Universidade Aberta, 2005 33
C
H
H
H
CO
NH2
C
H
H
C
H
H
H
C
H
H
CO
NH2
Etanamida, pois é um derivado do Butanamida, pois é um derivado
ácido etanóico (2 átomos de carbono). do ácido butanóico (4 átomos de
carbono)
Se um dos átomos de hidrogénio se encontra substituído por um radical
alquilo, o nome da amida secundária é precedido pela letra N (indicativo de
que um dos hidrogénios foi substituído) seguindo-se o nome do radical
substituinte.
CO
C
H
H
HN
CH3
H
Trata-se de uma amida
secundária, derivada da amida
primária de nome etanamida.
Como um dos átomos de
hidrogénio foi substituído por um
grupo metilo, então esta
substância tem o nome de N–
metiletanamida
Se ambos os átomos de hidrogénio são substituídos por um radical
alquilo, o nome da amida terciária é precedido por N,N (indicativo de que
ambos os átomos de hidrogénios foram substituídos), seguindo-se os nomes
dos radicais substituintes.
CO
C
H
H
HN
CH3
CH3
Trata-se de uma amida terciária,
derivada da amida primária de
nome etanamida.
Como ambos os átomos de
hidrogénio foram substituídos por
dois grupos metilo, então esta
substância tem o nome de N, N–
dimetiletanamida

©Carla Padrel de Oliveira, Universidade Aberta, 2005 34
AMINAS
As aminas são substâncias que derivam do amoníaco, NH3, por
substituição parcial ou total dos átomos de hidrogénio por radicais alquilo e
são representadas por:
N
HH
R1
Quando há a substituição de apenas um átomo de hidrogénio, trata-se
de uma amina primária, de dois trata-se de uma amina secundária e dos
três átomos de hidrogénio trata-se de uma amina terciária.
A nomenclatura destes compostos é construída a partir dos nomes,
por ordem alfabética, dos radicais alquilo substituintes, sempre com a
terminação AMINA.
N+
C
H
H
H
H
H
49
Esta é uma amina primária de
nome metilamina
N+
C
H
H
H
CH3
H
Amina secundária de nome
dimetilamina
N+
C
H
H
H
CH2
H
CH3
Amina secundária de nome
etilmetilamina. Note que os
grupos substituintes são
diferentes.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 35
N+
C
H
H
H
CH2
CH3
CH2CH
3
Amina terciária de nome
dietilmetilamina
AMINOÁCIDOS
Como o nome indica estes compostos englobam dois grupos
funcionais, o grupo carboxilo, –COOH, e o grupo amina, –NH2, e são
representados por:
C
O
OH
H2N C
H
R1
C
O
R1
NH2
São compostos de grande importância pois são as unidades
constituintes das proteínas, substâncias fundamentais em quase todos os
processos vitais.
Estas substâncias são normalmente conhecidos por nomes que não são
os indicados pela I.U.P.A.C., como é o caso da glicina, que é o aminoácido
mais simples:
53
C
H
H
CN
H
H
OH
O
De acordo com as regras de
nomenclatura esta substância tem
o nome de ácido 2–amino–etanóico

©Carla Padrel de Oliveira, Universidade Aberta, 2005 36
É de salientar que existem cerca de 20 aminoácidos essenciais e que é
a sequência ou ordem pela qual se ligam, que confere especificidade às
proteínas, o que não é objecto desta disciplina.
COMPOSTOS AROMÁTICOS
Os hidrocarbonetos aromáticos tomam esta designação devido aos
odores intensos que frequentemente apresentam.
O benzeno, descoberto em 1826, é o composto cuja estrutura está na
origem desta classe de compostos orgânicos. Esta substância, de fórmula
química C6H6 pode ser representada por uma estrutura em anel. Contudo, se
se considerar a descrição da molécula em termos de orbitais atómicas,
verifica-se que não é possível a fixação das várias ligações dentro do anel
hexagonal tratando-se de um híbrido de ressonância entre várias estruturas:
H
H
H
H
H
H
H
H
H
H
H
H
Estas representações teóricas, designadas por estruturas de Kékulé
ou híbridos de ressonância, ilustram o facto de a estrutura do benzeno não
corresponder às formas descritas por I nem por II, mas sim a uma situação
intermédia entre estas duas estruturas. Além disto, e porque as formas I e II
são exactamente equivalentes e apresentam a mesma estabilidade, o
híbrido de ressonância está igualmente relacionado com cada uma delas.
Contudo, isto não significa que as molécula do benzeno correspondam,
metade à estrutura I e metade à estrutura II nem que a molécula do
benzeno oscile entre uma e outra. As moléculas do benzeno são todas
I II

©Carla Padrel de Oliveira, Universidade Aberta, 2005 37
idênticas umas às outras e, cada uma delas, tem uma estrutura intermédia
entre I e II.
É ainda de salientar que o facto de desenharmos duas estruturas para
representar o benzeno não significa que qualquer delas tenha existência
real; as duas figuras são necessárias, por um lado, devido às nossas
limitações em representar as moléculas e por outro, porque qualquer delas
por si só, não bastaria para representar a molécula do benzeno.
É esta característica de ressonância electrónica que confere à
molécula do benzeno o seu carácter de aromaticidade.
Dado que esta descrição, através das estruturas de Kekulé, não é
nada prática, a aromaticidade do benzeno é vulgarmente representada por
uma das seguintes figuras:
ou
Este composto, tal como se observou para os hidrocarbonetos
alifáticos, pode apresentar derivados. Assim, o radical alquilo, formado pela
perda de um átomo de hidrogénio, é o radical fenil, de fórmula C6H5 –, e
representado por:
Na sequência do estudo que foi efectuado para os grupos funcionais,
podemos facilmente admitir que a este grupo fenil possa estar ligado
qualquer dos grupos funcionais anteriormente referidos. A nomenclatura
destes compostos aromáticos segue as regras IUPAC anteriormente
definidas.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 38
Vejamos alguns exemplos e respectiva nomenclatura:
1. Quando um grupo hidroxilo, -OH, se liga a um anel de benzeno forma um
álcool aromático designado por fenol:
68
OH
2. Os éteres podem também conter radicais fenil, como se poderá observar
nos seguintes exemplos:
O
éter difenílico
O CH3
éter fenilmetílico
3. No caso das cetonas a nomenclatura é obtida através da indicação dos
grupos substituintes acrescido da terminação cetona:
CH3
C
O
Fenilmetilcetona
4. Quando o anel benzénico se liga ao grupo aldeído temos:
C
O
H
Benzaldeído

©Carla Padrel de Oliveira, Universidade Aberta, 2005 39
5. Quando o anel benzénico se liga ao grupo carboxilo obtém-se:
OH
C
O
Ácido benzóico
6. Alguns exemplos de ésteres aromáticos são:
CH3
O
C
O
Benzoato de metilo
75
C C
H
H
H H
H
C
O
O
Propanoato de fenilo
7. Como amida aromática tem-se:
C
O
NH2
Benzamida

©Carla Padrel de Oliveira, Universidade Aberta, 2005 40
8. No caso das aminas, em que um dos grupos substituintes é o radical fenil
temos:
N+
CH3
H
Fenilmetilamina
Note-se que todos os exemplos apresentados seguem as mesmas
regras de nomenclatura mas, agora, um dos radicais substituintes é o grupo
fenil.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 41
3. Isómeros
A fórmula molecular de um composto, indica o tipo e o número de
átomos presentes num determinado composto. Alguns exemplos de fórmulas
moleculares são C2H6 ou C5H10O. Contudo, é frequente existir mais do que
um composto com a mesma fórmula molecular (por exemplo hexeno), ou
seja, é necessário recorrer às fórmulas estruturais para os diferenciar.
Compostos que apresentam a mesma fórmula química mas diferentes
fórmulas estruturais, têm o nome de isómeros. Estas diferenças nas
fórmulas estruturais podem ter origens diversas e, consequentemente,
podemos ter vários tipos de isomerismo.
ISOMERISMO ESTRUTURAL
Diz-se que estamos em presença de dois isómeros estruturais quando
as diferenças entre as respectivas fórmulas estruturais ocorrem no tipo de
cadeia, ou seja, na existência, ou não, de ramificações da cadeia carbonada
e da sua posição. Dentro deste conjunto podem-se ainda distinguir três sub–
conjuntos:

©Carla Padrel de Oliveira, Universidade Aberta, 2005 42
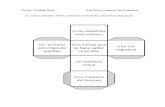
GRUPO FUNCIONAL
Diferente Igual
Cadeia carbonada
Diferente Igual
ISOMERIA FUNCIONAL ISOMERIA DE POSIÇÃO
ISOMERIA DE CADEIA
ISÓMEROS DE FUNÇÃO OU ISOMERIA FUNCIONAL
São compostos que, apresentando a mesma fórmula química,
pertencem a diferentes famílias, ou seja, diferem no grupo funcional.
Consideremos, por exemplo, o composto de fórmula química C2H6O e
vejamos as diferentes fórmulas de estrutura possíveis:
C
H
H
H
H
OH
C
H
etanol
C
H
H
H
C
H
H
H
O
éter dimetílico
De acordo com as representações, esta fórmula química pode
corresponder a um álcool ( o etanol) ou a um éter (o éter dimetílico). Pode-
se então dizer que estes dois compostos são isómeros de função.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 43
Analisemos agora as estruturas a seguir representadas, que
correspondem à fórmula química C3H6O; a primeira é uma cetona, de nome
propanona, e a segunda representa um aldeído de nome propanal
C
H
H
H
C
H
H
H
C
O
propanona
C
H
H
H
C
H
C
HO
H
propanal
ISÓMEROS DE CADEIA OU ISOMERIA DE CADEIA
São compostos com a mesma fórmula química mas com cadeias
carbonadas principais de diferente tamanho. Por exemplo, para um
composto com fórmula química C4H10, podemos escrever dois isómeros de
cadeia:
C
H
H
H H
H
C
H
H
C C
H
H
H
butano, butano normal, ou n – butano
C
H
H
H
H
C
H
H
C H
CH3
2-metil-propano, iso–butano, ou i–butano
ISÓMEROS DE POSIÇÃO OU ISOMERIA DE POSIÇÃO
São compostos que apresentam uma ou mais ligações múltiplas ou um
grupo funcional em diferentes posições na cadeia carbonada principal.

©Carla Padrel de Oliveira, Universidade Aberta, 2005 44
Vejamos, por exemplo, o composto butanol (um álcool) que pode apresentar
o grupo hidroxilo, -OH, em duas posições diferentes na cadeia principal:
C
H
H
H H
H
C
H
H
C C
H
H
OH
1 – butanol
C
H
H
H H
H
C
OH
H
C
H
H
H
C
2 – butanol
Trata-se do mesmo composto, o butanol, onde apenas há uma
variação de posição do grupo funcional.
Um outro exemplo, mas em que a diferença reside na posição da
ligação dupla, é:
1 – buteno
C
H
H
C
H
C
H
C
H
H
H
H
2 – buteno
C
H
C C
H
H
H
C
H
HH
H

©Carla Padrel de Oliveira, Universidade Aberta, 2005 45
ISOMERISMO GEOMÉTRICO
São designados por isómeros geométricos, os compostos para os quais
a mesma fórmula química corresponde a idênticas fórmulas de estrutura
mas com diferente orientação espacial, isto é, o arranjo espacial da
molécula é diferente.
Este tipo de isomerismo é vulgarmente observado em torno de uma
dupla ligação entre dois átomos de carbono, uma vez que uma das
características da dupla ligação é a sua relativa rigidez quando comparada
com uma ligação simples. Este carácter de rigidez vai impedir que haja uma
rotação em torno da ligação dupla e, portanto, há uma diferente orientação
no espaço.
Cada um dos carbonos em torno da dupla ligação está ligado a dois
grupos de diferente dimensão. Quando os átomos, ou grupos de átomos
iguais, se posicionarem do mesmo lado da dupla ligação, então o nome da
respectiva configuração é precedido pela palavra CIS; quando, pelo
contrário, os átomos ou grupos de átomos iguais se posicionarem em lados
opostos da dupla ligação o nome da respectiva configuração é precedido
pela palavra TRANS.
Analisemos o composto de fórmula química C4H8. Este composto
apresenta duas fórmulas com arranjos espaciais distintos:
C C
CH3
CH3
H
H
trans 2 – buteno
C C
CH3
H H
CH3
cis 2 – buteno

©Carla Padrel de Oliveira, Universidade Aberta, 2005 46
ISOMERISMO ÓPTICO
Isómeros ópticos são compostos cujas moléculas não são
sobreponíveis às suas imagens no espelho. Duas estruturas são sobreponíveis
se, quando colocadas uma sobre a outra, as posições de todos os átomos
forem coincidentes. Aos isómeros que não são sobreponíveis dá-se o nome
de compostos quirais e aqueles que forem sobreponíveis com a sua imagem
são designados por compostos aquirais.
Verifica-se que as moléculas mais simples que apresentam este tipo
de isomerismo contêm pelo menos um átomo de carbono assimétrico, isto é
um átomo de carbono ligado a quatro átomos, ou grupos de átomos,
diferentes.
Consideremos o composto 2–bromo–butano, de fórmula CH3-CHBr-CH2-
CH3.
Começamos por tentar identificar um átomo de carbono assimétrico, ou
seja, ligado a quatro átomos ou grupos de átomos diferentes. Verificamos
que nestas condições está apenas o carbono na posição 2, que tem ligados a
si um grupo metil, um átomo de hidrogénio, um átomo de bromo e um grupo
etil. Assim, considerando o arranjo tridimensional em torno deste átomo de
carbono pode observar-se o objecto e a imagem num espelho plano,
obtendo-se desta forma os isómeros ópticos, também designados de
enatiómeros:
C
CH3
H
C2H
5
BrC
CH3
BrH
C2H
5