QUIMICA Unidad N° 4 : - “ UNIONES QUÍMICAS” · 2 UNIONES QUÍMICAS Definimos unión química...
Transcript of QUIMICA Unidad N° 4 : - “ UNIONES QUÍMICAS” · 2 UNIONES QUÍMICAS Definimos unión química...

1
QUIMICA
Unidad N° 4 : - “ UNIONES QUÍMICAS”
Profesora Mercedes CARATINI - QUIMICA- ET 28 “REPÚBLICA FRANCESA”

2
UNIONES QUÍMICAS
Definimos unión química como la fuerza que actúa entre dos átomos o grupos de átomos, con
intensidad suficiente como para mantenerlos juntos en una especie diferente.
Los átomos se unen porque siguen la tendencia a llegar al estado de energía mínima (el más estable).
Cuando dos átomos se unen para formar un enlace estable se libera una cierta cantidad de energía. Esto
significa que se obtiene un sistema energéticamente favorable con menor energía que la correspondiente a
los átomos separados. Esta misma cantidad de energía deberá ser suministrada al sistema si queremos
separarlos, o sea romper la unión química.
En 1812 BERZELIUS propuso la hipótesis de que todas las combinaciones químicas se producían
por fuerzas eléctricas. Si bien la idea de Berzelius tuvo razón fue muy discutida en esa época ya que era
difícil comprender la existencia de N2, H2 en un esquema electrostático.
En el siglo pasado, los modelos moleculares se hicieron sobre la base de uniones entre átomos y
constituyó la llamada “Teoría clásica de la Valencia”, si bien fue muy útil, en ningún momento trató de
explicar el mecanismo de unión entre los átomos.
Hacia fines del siglo pasado se conocían dos tipos de compuestos: los que se podían explicar por la
presencia de cargas positivas y negativas que mantenían unidos a los átomos (Ej. NaCl) y otras que no
podían explicarse con los conocimientos de la época (Ej. CH4).
En 1869 MENDELEIEV presenta su tabla periódica y en 1904 ABEGG destacó la regla del ocho
para muchos elementos.
En 1913 MOSELEY estableció el concepto de número atómico, al ser ordenados los elementos por
su número atómico creciente, se resaltó la estabilidad de los elementos cuyos átomos contenían 8 electrones
en su última capa: los gases nobles o inertes, llamados así por su reactividad nula en esa época.
En 1916 KOSSEL explicó la formación de iones estables por la tendencia que tienen los átomos a
ganar o perder electrones para llegar a tener la configuración electrónica externa de los átomos de un gas
noble.
En ese mismo año fue LEWIS quien propuso que las uniones entre los compuestos no iónicos se
producía porque los electrones de 2 átomos diferentes se compartían de a pares, entre ambos átomos, de
manera tal que en la medida posible, se formaran octetos estables.
Los gases nobles son sustancias muy poco reactivas, son todos monoatómicos, lo que significa que ni
siquiera tienen tendencia a reaccionar consigo mismo. Recién en 1962 se pudieron preparar compuestos bien
definidos del Xe y del Kr (XeF4; XeO3; KrF2) en condiciones muy especiales. Su escasa reactividad induce a
pensar que sus CE son más estables que las de otros elementos.
La propuesta de Lewis fue una importante aproximación. Hoy sabemos que:
“Los átomos al combinarse tienden a adquirir una configuración electrónica que les dé la mayor
estabilidad posible: la del gas noble más cercano en número atómico”
Como los gases nobles, salvo el He presentan 8 electrones en su capa externa, la ley enunciada recibe
el nombre de Ley del Octeto.
Esta ley se cumple rigurosamente para los elementos representativos, no así para los demás.
Lewis desarrollo una manera práctica para representar las uniones químicas. Esta consiste en escribir
el símbolo del elemento y a su alrededor los electrones de la última capa. Los electrones se representan por
puntos, rayas, cruces, etc.
Ejemplo:

3
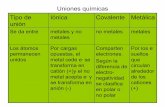
CLASIFICACIÓN DE LAS UNIONES QUÍMICAS
Para poder clasificar los tipos de uniones químicas debemos retomar una propiedad periódica, la
electronegatividad (capacidad que tienen los átomos para atraer electrones en una unión química).
De acuerdo a la tabla de electronegatividades, existen tres posibilidades de combinación entre
elementos que dan lugar a las distintas uniones químicas:
1) Que los valores de electronegatividad de los átomos que intervienen en la unión sean
de marcadas diferencias. UNIÓN IÓNICA
2) Que ambos posean electronegatividad alta y similar. UNIÓN COVALENTE
3) Que ambos posean electronegatividad baja y similar. UNIÓN METÁLICA.
UNIÓN IÓNICA.
La unión iónica ocurre entre átomos de elementos cuya diferencia de electronegatividad es notable y
su característica esencial es que hay una transferencia completa de electrones desde un átomo a otro con
formación de cationes y aniones.
Experimentalmente se ha determinado que la diferencia de electronegatividad es igual o mayor que 2.
Dicho de otra manera esta unión ocurre entre Metales y No Metales.
Por ejemplo considerando el cloruro de sodio, si escribimos la CE del Sodio y del Cloro veremos que
al átomo de sodio le sobra un electrón para adquirir la CE del gas noble más cercano (Ne) y al átomo de
cloro le falta un electrón para adquirir la CE del gas noble más cercano (Ar).
11 Na (CE) 1s2 2s2 2p6 3s1.
17 Cl (CE) 1s2 2s2 2p6 3s2 3p5.
El átomo de Na tiene 11p+ y 11 e- distribuidos en 3 niveles 1°) 2 e-; 2°) 8 e-; 3°) 1 e-. Si pierde el
último electrón se queda con un último nivel de 8 electrones y cumplimenta la ley del octeto
11 Na - 1 e- Na+ catión sodio
2-8-1 2-8
El átomo de Cl tiene 17 p+ y 17 e- distribuidos en 3 niveles de energía: 1°) 2 e- ; 2°) 8 e- ; 3°) 5 e-. Si
gana un electrón se queda con un último nivel de 8 electrones cumplimentando la ley del octeto.
17 Cl + 1e- 17 Cl- anión cloruro
2-8-7 2-8-8
El cloro tiende a atraer los electrones de la unión hacia su núcleo porque es el elemento más
electronegativo. Esto produce la transferencia del electrón del sodio (que tiene baja energía de ionización)
hacia el cloro (que tiene alta afinidad electrónica). El resultado es la formación de un catión y un anión. La
unión se produce debido a fuerzas de carácter electrostático y los iones se atraen mutuamente con una fuerza
cuya intensidad es inversamente proporcional al cuadrado de la distancia que los separa (Ley de Coulomb).
Sin embargo hay atracción hasta cierto punto ya que a distancias menores existen fuerzas de repulsión entre
las nubes electrónicas exteriores de los iones. La fuerza de atracción se extiende en todas direcciones del
espacio y el ion Na+ se rodea de cierto número de iones Cl- y recíprocamente.

4
El cloruro de sodio no existe en forma molecular, es decir que la fórmula NaCl no representa una
molécula de la sustancia sino que es su fórmula mínima (indica la mínima relación que debe haber entre
ellos). El cloruro de sodio forma una red tridimensional, en el cual cada Na+ está rodeado de 6 Cl- y al
mismo tiempo cada Cl- está rodeado por 6 Na+
El esquema representado es una red cristalina. Existen otros ordenamientos posibles para iones en
una red que dan origen a otras estructuras cristalinas.
Según la notación de Lewis la unión iónica se representa:
● ● _
● ●
Na+ ○ ● Na Cl ● ●
ESTRUCTURA DE LEWIS FÓRMULA MÍNIMA
PROPIEDADES DE LOS COMPUESTOS IÓNICOS
1) Cuando se encuentran en estado sólido, los iones formados se atraen entre sí por efecto de las
fuerzas electrostáticas formando redes cristal. La geometría de la red está determinada por el
tamaño de los iones y la necesaria neutralidad global del cristal.
2) En estado sólido no conducen la corriente eléctrica, ya que los iones que forman la red carecen de
movilidad, en solución o en estado de fusión conducen la corriente eléctrica, al disolverse en
agua la red cristalina se desarma, los iones quedan libres y pueden conducir la electricidad.
3) Poseen elevados puntos de fusión y de ebullición, ya que es muy difícil romper las fuerzas
electrostáticas. Ej.; Punto fusión NaCl = 801°C. Punto de ebullición NaCl = 1465°C
4) La mayoría son sólidos a temperatura ambiente y tienen puntos de fusión elevados.
5) Son solubles en agua y otros solventes polares.
6) Son duros y quebradizos. Presentan gran resistencia al rayado, pero si se les aplican fuerzas
moderadas se quiebran.
Cl

5
UNIÓN COVALENTE.
La unión covalente ocurre entre átomos de elementos cuya electronegatividad es alta y similar o su
diferencia muy pequeña, se produce por el compartimiento de pares electrónicos.
Dicho de otra manera esta unión ocurre entre dos No Metales iguales o diferentes.
Al representar la estructura de Lewis, se diferencian dos formas de compartir los electrones que darán
origen a dos clases de uniones covalentes.
UNIÓN COVALENTE COMUN
Se establece entre dos átomos en el cual el par electrónico compartido está formado por un electrón
proveniente de cada uno de los dos átomos entre los que se produce la unión.
Esta unión se puede establecer entre átomos de un mismo elemento (unión homonuclear) o entre
átomos de elementos diferentes (unión heteronuclear).
A su vez dos átomos pueden compartir uno o más pares de electrones, dando lugar a uniones
covalentes simples, dobles o triples.
Según la notación de Lewis la unión covalente común se representa:
En vez de usar la notación de Lewis, se puede usar en esta unión la fórmula desarrollada, en la cual
solo se representa el par de electrones compartidos por una raya. Para las sustancias anteriores:
H Cl H N H
H Otra forma es utilizar la fórmula molecular, llamada así porque se forman moléculas. En ellas se coloca
el símbolo del elemento, primero el elemento menos electronegativo, luego el más electronegativo y la
cantidad de átomos que hay de cada uno de ellos. Para las sustancias anteriores:
HCl NH3
Cloruro de hidrógeno Amoníaco.
UNION COVALENTE DATIVA O COORDINADA
Se establece entre dos átomos de dos elementos en el cual el par electrónico compartido es aportado
por uno solo de los átomos.
Tomemos como ejemplo el SO2.
El S y el O tiene 6 electrones en su último nivel energético, o sea que ambos necesitan 2 electrones
para cumplimentar la regla del octeto, formándose un enlace covalente doble, ambos átomos completan así
la configuración electrónica del gas noble.
De acuerdo a la regla del octeto no se podrían formar más enlaces
¿Cómo se unen entonces los dos átomos de oxigeno restantes?

6
El átomo de S, que al unirse por covalencia doble con un átomo de O ya alcanzó el octeto, tiene dos
pares de electrones sin compartir que aporta para la formación de un enlaces covalentes dativos. De esta
forma el S mantiene sus 8 electrones y cada O también.
Estructuralmente no se puede distinguir entre un enlace covalente común y un enlace covalente
dativo. Es un par de electrones compartido, independientemente de cómo se formó. El enlace covalente
dativo se representa por una flecha que va desde el dador hasta el aceptor de electrones.
Como al S le queda un par de electrones sin compartir podría formar otro enlace covalente dativo y
formar el compuesto SO3, cuya fórmula desarrollada es:
O = S O
O
Recordar para que exista una unión covalente dativa debe:
1) Existir por lo menos una unión covalente común.
2) El dador debe tener pares de electrones sin compartir
Las uniones covalentes pueden a su vez clasificarse en:
UNIONES COVALENTES POLARES
Los electrones compartidos pasan estadísticamente más tiempo cerca del núcleo del elemento más
electronegativo. La diferencia de atracción de los núcleos atómicos genera un dipolo permanente en la
molécula. Ej; HF, H2O.
UNIONES COVALENTES APOLARES
Los electrones compartidos son atraídos por ambos núcleos en igual magnitud, ya que ambos átomos
tienen la misma electronegatividad. Ej. Cl2, H2.

7
PROPIEDADES DE LOS COMPUESTOS COVALENTES
1) Son moléculas individuales unidas entre sí por fuerzas intermoleculares débiles, pueden
encontrarse en los tres estados de agregación: sólido, líquido, gaseoso.
2) Poseen bajos puntos de ebullición y de fusión, ya que las fuerzas intermoleculares que las unen
son débiles. Ej.: Punto de fusión del SO2 -75°C, punto de ebullición SO2 -10°C
3) No conducen la corriente eléctrica, ni el calor.
4) Su solubilidad depende de la polaridad del enlace. Las moléculas polares, como la sacarosa, son
solubles en solventes polares como el agua. En cambio las moléculas no polares, como el yodo,
son solubles en solventes no polares como el tetracloruro de carbono.
5) Los sólidos moleculares son blandos y no presentan gran resistencia mecánica.
UNIÓN METÁLICA
La unión metálica ocurre entre átomos con electronegatividad baja y cercana. Ninguno de los átomos
atraerá con gran fuerza los electrones de la unión. Esto hará que los electrones externos se hallen en un
estado relativamente libre y quede una red cristalina de cationes, cuya estabilidad se concreta por la
presencia de electrones entre ellos. Sin embargo, estos electrones no pertenecen a ningún átomo en
particular, sino al cristal como un todo.
El ejemplo de este tipo de unión son los metales en su estado elemental.

8
PROPIEDADES DE LOS COMPUESTOS METÁLICOS.
1) Los metales forman redes distintas a los compuestos iónicos.
2) Los metales conducen la corriente eléctrica y el calor, esto se debe a la libertad de los electrones
externos para moverse dentro de la red cristalina tridimensional.
3) Poseen puntos de fusión y de ebullición elevados, lo que indica que ese mar de electrones debe
unirse fuertemente a los iones positivos. Ej. Punto de fusión del Fe 1539°C, punto de ebullición
del Fe 2740°C.
4) Son dúctiles, maleables y poseen brillo, esto ocurre porque los iones tienen todas las mismas
cargas y se pueden deslizar fácilmente unos sobre otros en varias direcciones. El brillo se
encuentra asociado a la movilidad de los electrones.
5) Cuando los metales se calientan a ebullición no tienen brillo metálico, ni conducen la corriente
eléctrica. Son monoatómicos y carecen de enlaces.
TEORIA DE LA REPULSION DE LOS PARES ELECTRÓNICOS DE VALENCIA.
TRePEV
La estructura de Lewis solo permite representar las uniones químicas entre los átomos de forma
bidimensional, pero no indica nada de la tridimensional. Las moléculas de las diferentes sustancias tienen
distinta forma por la distribución geométrica que adoptan los átomos en el espacio. Un ejemplo el almidón y
la celulosa tienen la misma forma molecular, pero distinta distribución de sus átomo, esto hace la diferencia
por la cual nuestro cuerpo no puede procesar la celulosa pero sí el almidón.
Esta distribución es muy importante ya que no solo justifica sus propiedades sino que también permite
predecirlas. Por Ej.; la solubilidad, el punto de ebullición, etc.
Existen métodos experimentales para determinar los ángulos y longitudes de los enlaces en una molécula.
La distribución espacial puede ser:
1) En moléculas biatómicas como Cl2 ó HF la única posibilidad es la lineal
A – B
2) En moléculas con más de 2 átomos la situación es distinta:
B—A –B A
Ángulos de 180° B B Ángulos < 180°
CO2 SO2
Para explicar los datos experimentales acerca de la geometría molecular Sidwick y Power, tuvieron en
cuenta las interacciones electrostáticas entre los pares de electrones externos o de valencia. Posteriormente
Gillespie retomó y amplio la teoría.

9
“La distribución de los enlaces alrededor de un centro atómico depende del número de pares
electrónicos que rodean a ese átomo, ya que existen determinadas regiones de alta densidad
electrónica a su alrededor”
Un enlace covalente simple, doble, triple, etc. produce regiones de alta densidad electrónica que se ordenan
alrededor del átomo central de forma tal que su separación sea máxima con lo cual la repulsión que ejercen
entre sí es mínima.
: A : Dos pares de electrones distribuidos de forma lineal.
A Tres pares de electrones distribuidos de forma triangular simétrica.
Debemos diferenciar los electrones compartidos de los no compartidos.
Los pares de electrones no compartidos ocupan un espacio mayor alrededor del núcleo ya que se repelen con
mayor fuerza.
HIPÓTESIS DE ESTA TEORÍA.
1) El factor que determina la geometría molecular es el número de pares de electrones externos de los
átomos involucrados en la unión.
2) Los pares de electrones se repelen entre sí y se acomodan en el espacio de manera tal que la distancia
entre ellos sea la máxima posible para que la repulsión sea mínima.
3) Los pares de electrones no compartidos ocupan más espacio que los compartidos.
4) Los pares de electrones compartidos que forman enlaces múltiples se consideran equivalentes a un
par de electrones de un enlace simple.
Cuatro pares de electrones se ubican en los vértices de
un tetraedro regular

10
GEOMETRÍA MOLECULAR.
Es el orden en que se acomodan los átomos alrededor del átomo central y se relaciona con la
geometría electrónica.
FORMULA
PARES DE ELECTRONES
GEOMETRÍA MOLECULAR
EJEMPLOS
No compartid. Compartidos
AX2
----
2
-- A-- Lineal α = 180°
CO2; Cl2Be
1
2
A Angular α <120°
SO2; PbCl2
2
2
A Angular α < 109°
H2O; H2S
AX3
----
3
A Plana triangular α = 120°
BF3; NO31-
1
3
A
Piramidal α <109°05’
NH3; H30+
AX4
---
4
Tetraédrica α = 109° 05’
A
CH4; SO42 -
AX5
---
5
Bipirámide triangular.
α= 120° β =90°
PF5
AX6
---
6
Octaédrica
α= 90° β = 180°
SF6

11
FUERZAS INTERMOLECULARES
Son las fuerzas que mantienen unidas a las moléculas.
Son fuerzas débiles comparadas con las que mantienen unidos a los átomos en las uniones covalentes.
Ej; necesito menos calor para romper la unión entre las moléculas de agua (40,8 KJ.) que para romper el
enlace O-H de la misma cantidad de agua (930 KJ.).
Estas fuerzas reciben el nombre de FUERZAS DE VAN DER WAALS (en honor al holandés que
comenzó a estudiarlas. 1837-1923).
Estas fuerzas son las responsables de la existencia del estado sólido y líquido de la materia.
FUERZAS DE LONDON ó DIPOLO TRANSISTORIO
FUERZAS DE VAN DER WAALS FUERZAS DIPOLO-DIPOLO
PUENTE DE HIDRÓGENO
FUERZAS DE LONDON o DIPOLO TRANSITORIO
Son uniones características de las moléculas no polares. Ej.; O2, CH4; H2.
El movimiento de los electrones en estas moléculas genera dipolos transitorios, que cambian de manera
constante en sentido y magnitud. Estos dipolos al acercarse a otras moléculas generan o inducen otros
dipolos.
Dipolo Dipolo inducido
El átomo de helio tiene 2 electrones en movimiento, puede originarse por un momento mayor densidad de
electrones en una zona de la molécula que en la otra, generando un polo negativo y un polo positivo
transitorio. Este induce dipolos en otras moléculas.
A mayor número de electrones mayor posibilidad de dipolos transitorios. Estos dipolos también se generan
por la cercanía de una molécula polar.
Estas son las responsables de la condensación a bajas temperaturas, aún de los gases nobles.
FUERZAS DIPOLO-DIPOLO.
Estas fuerzas ocurren entre moléculas polares (en ellas existen dipolos).
Las moléculas se acomodan de manera que el polo positivo de una quede lo más cercano posible del polo
negativo de la otra. Así se produce atracción electrostática entre los dipolos opuestos.
Estas fuerzas solo ocurren si las moléculas están muy próximas.
+ -
-
+ -

12
Son las responsables de los altos puntos de fusión y de ebullición de las sustancias. Explican la atracción
entre iones y el extremo opuesto de una molécula polar. Se explica así la solubilidad de las sustancias
Iónicas. (Por formación del ion solvatado, los iones se rodean de moléculas de solvente, si es agua se
hidratan).
UNION PUENTE DE HIDRÓGENO.
Es un tipo especial de dipolo-dipolo, ocurre cuando un átomo de H, unido a un elemento muy
electronegativo por un enlace covalente, interacciona con un par electrónico no compartido de otro átomo de
alta electronegatividad, formándose puentes entre las moléculas.
H
H O H
O H O
H H H.
O
H
Los elementos más electronegativos son: F, O, N y a veces Cl.
Este tipo de unión es la responsable de los elevados puntos de ebullición de las sustancias y de las
singulares características del agua. Por ejemplo: en el agua líquida los puentes de H se forman y se rompen
continuamente. En el agua sólida (las moléculas están ordenadas en red) existe la máxima cantidad posible
de puentes de H por eso ocupa un volumen mayor que el agua líquida.
Los puentes de H pueden ser intermoleculares (dentro de una molécula) o intramoleculares (entre
moléculas)
La energía necesaria para romper esta unión es entre 5 y 25 KJ. Es la unión más fuerte de las tres.
FUERZAS DE ESTAS UNIONES
U. Covalente > Puente de H > F de London ≈ F dipolo-dipolo
100 10 1 1
MOMENTO DIPOLAR
El momento bipolar permite cuantificar el carácter polar de un enlace.
μ = q . l
μ: momento bipolar.
q: carga eléctrica.
l: distancia que separa las cargas eléctricas.
El momento bipolar se mide en Debyes (D)
Cl-

13
.
Cuando hay más de un enlace el momento bipolar puede ser:
1) μ = 0 Si hay simetría en los enlaces tal que los momentos bipolares se compensen entre sí. Por
ej.; CO2 δ- 2δ+ δ-
: Ö = C = Ö:
2) μ ≠ 0 Si no hay simetría en la molécula por ejemplo en el agua μ =1,03 D.
O
H H