Orgánica Práctica 7
-
Upload
kike-robichaux-aguilar-suarez -
Category
Documents
-
view
716 -
download
0
Transcript of Orgánica Práctica 7

5/17/2018 Orgánica Práctica 7 - slidepdf.com
http://slidepdf.com/reader/full/organica-practica-7 1/5
UNIVERSIDAD AUTÓNOMA DEL ESTADO DE MÉXICOFACULTAD DE QUÍMICA
LABORATORIO DE IDENTIFICACIÓN Y CARACTERIZACIÓN DE COMPUESTOS ORGÁNICOSREPORTE DE PRÁCTICA
Alumnos: Aguilar Suárez Luis Enrique Grupo: 41 Fecha: 24/04/2012
Santamaría Dávila Verónica Plan educativo: Químico Equipo: 7Torres Cadena Raúl
Zárate Rodríguez Karen Estefanía
Práctica 7 - Reacción SN1: Preparación e hidrólisis de cloruro de ter-butilo
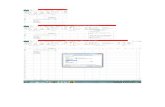
RESULTADOS
Tiempo (s) mL de
NaOH
gastados
X
(mol/L)
a - x
K
240 0.2 0.002 0.0164 1.12195 0.04997 0.00047889
840 0.4 0.004 0.0144 1.27777 0.10645 0.000291421440 0.5 0.005 0.0134 1.37313 0.13771 0.000219952040 0.5 0.005 0.0134 1.37313 0.13771 0.00016652
2640 0.5 0.005 0.0134 1.37313 0.13771 0.000199763240 0.6 0.006 0.0124 1.48387 0.17139 0.00019665
3840 0.9 0.009 0.0094 1.95744 0.29169 0.000174714440 0.11 0.010 0.0084 2.19048 0.34054 0.00017641
5040 0.10 0.011 0.0074 2.48649 0.39559 0.00018053
5640 0.10 0.011 0.0074 2.48649 0.39559 0.00016132
( ) (
) ( )

5/17/2018 Orgánica Práctica 7 - slidepdf.com
http://slidepdf.com/reader/full/organica-practica-7 2/5
Ecuación de regresión lineal: Coeficiente de relación: 0.9183
m = 0.00007
REACCIONES VERIFICADAS
OH + HCl Cl + H2O
Cl + H2O OH + HClEtOH
SN1
SN1
Obtención de cloruro de ter-butilo
Hidrólisis de cloruro de ter-butilo para obtención de terbutanol
y = 7E-05x + 0.0191
R² = 0.9183
0
0.05
0.1
0.15
0.2
0.25
0.3
0.35
0.4
0.45
0 1000 2000 3000 4000 5000 6000
l o g
[ a / ( a
- x ) ]
Tiempo (s)
Gráfica

5/17/2018 Orgánica Práctica 7 - slidepdf.com
http://slidepdf.com/reader/full/organica-practica-7 3/5
ANÁLISIS DE RESULTADOS
En base a la práctica desarrollada se calculó la constante de reacción cinética (k) de la reacción de
formación de ter-butanol a partir de cloruro de ter-butilo por una reacción SN1 con agua como
nucleófilo.
En la primera parte de la práctica se procedió a la generación de cloruro de ter-butilo, haciendo
reaccionar ter-butanol y ácido clorhídrico, mediante una reacción de sustitución nucleofílica
unimolecular, este tipo de reacciones se llevan a mediante la formación de un carbocatión y el
posterior ataque del nucleófilo al centro positivo. Debido a la formación de carbocationes, las
reacciones SN1 suceden cuando se tiene un sustrato que confiera una gran estabilidad a la especie
formada; en este caso, el ter-butanol posee un grupo hidroxilo que se protona en el medio ácido
en el que se encuentra convirtiéndolo en un excelente grupo saliente, H 2O. Se forma entonces un
carbocatión terciario que es altamente estable por efectos inductivos de los grupos metilos sobre
el carbono del centro. El disolvente tiene una amplia influencia en las reacciones SN1, pues en este
proceso ocurre una ruptura del enlace C-O, ayudada por las interacciones de las moléculas del
disolvente, los pares electrónicos libres del oxígeno interaccionan con los hidrógenos del agua y
empieza a romperse el enlace que lo mantiene unido al carbono. Inmediatamente, el carbocatiónformado también es estabilizado por el disolvente, la carga positiva situada con el carbono es
compensada por la densidad electrónica que se genera de los pares electrónicos libres del
oxígeno.
Entonces el cloruro actúa como agente nucleofílico, y ataca al carbocatión terciario para formar el
halogenuro de alquilo correspondiente. La reacción se llevó a cabo en un embudo de separación,
los reactivos se agitaron vigorosamente para incrementar la zona de contacto entre ellos y que la
reacción procediera con buenos rendimientos. Una vez terminada la agitación, se colocó el
embudo y se espero a que se separan las fases, el cloruro de ter-butilo tiene una densidad de 0.85
g/mL y como la del agua es de 1 g/mL, el cloruro de ter -butilo correspondía a la parte superior en
el embudo, y en la parte inferior se encontraba el agua junto el con ácido clorhídrico residual de lareacción. Se separaron ambas fases y se procedió a lavar con carbonato de sodio, esto se hace
para neutralizar el posible HCl que quedó sin reaccionar y así formar agua y la sal correspondiente.
Se lavó dos veces el cloruro de ter-butilo, en los que la fase acuosa era desechada.
Como el producto era muy volátil, se procuró mantener cerrado el embudo de separación, se
depositó en un vaso de precipitado el cloruro de ter-butilo y se secó con sulfato de sodio anhidro,
a fin de eliminar agua que haya quedado en la mezcla de reacción y posteriormente se procedió a
purificar el cloruro mediante una destilación simple. Se determinó el volumen y se obtuvo 0.9 mL,
una vez que se empezó a destilar el producto (en un intervalo de 42 a 45°C), el volumen que se
obtuvo fue mínimo, alrededor de 0.1 mL. Este volumen no era suficiente para realizar las pruebas
de cinética química, entonces junto con el equipo __ reunimos los volúmenes obtenidos por
destilación del producto y solo se obtuvieron 0.2 mL. Para realizar la prueba de cinética se redujo
el volumen de aforó a 50 mL para obtener una concentración apreciables.
El objetivo de esta práctica era determinar la constante de reacción de hidrólisis de cloruro de ter-
butilo, esto da como producto la generación de ter-butanol. La reacción se lleva a cabo mediante
un mecanismo SN1, en el que se forma un carbocatión por la ruptura del enlace C-Cl; esta forma
parte del paso determinante de la velocidad de reacción, es decir del paso lento.

5/17/2018 Orgánica Práctica 7 - slidepdf.com
http://slidepdf.com/reader/full/organica-practica-7 4/5
Un mecanismo SN1 sigue una reacción de primer orden, en el que la velocidad se ve afectada solo
por la concentración de cloruro de ter-butilo
Se preparó una solución de concentración 0.0184 M de cloruro de ter-butilo, el aforó se realizo
con una mezcla al 70% de etanol en agua; recordemos que en esta reacción el agua es el nucleófilo
que ataca al carbocatión, sin embargo esta reacción por si sola es lenta, el etanol sirve como un
catalizador para acelerar la formación del ter-butanol. En cuanto se pusieron en contacto el
halogenuro de alquilo y la mezcla de etanol agua, se cronometró el tiempo, sin embargo, tuvimos
problemas en conseguir una pipeta de 5 mL así que tomamos la primer alícuota a los 4 minutos, y
a partir de ahí cada 10 minutos.
De la reacción de formación de ter-butanol, a partir de la hidrólisis de cloruro de ter-butilo, se
obtiene como subproducto HCl. La cantidad de este ácido es igual a la cantidad de ter-butanol que
se esta generando y que es diferente a diversos lapsos de tiempo en los que la reacción se esta
verificando. Para determinar con que rapidez se forman estos productos, se tomaron alícuotas dela mezcla y se titulo con NaOH 0.1 N, con fenolftaleína como indicador. El indicador en medio
ácido es incoloro, pero al pasar el pH igual a 8 se vuelve rosa. Este cambio indica que la reacción se
ha llevado por completo y que se ha neutralizado el ácido.
En un principio se observó que el volumen de NaOH que se necesitaba para observar el cambio de
color aumentaba con cada prueba, y esto era lógico pues a medida que transcurría el tiempo se
generaba una mayor cantidad de ter-butanol y por lo tanto de ácido. Sin embargo en tres de las
pruebas se gastó el mismo volumen de NaOH, 0.5 mL, una razón lógica para que esto suceda.
Después de estas pruebas se observó un ligero incremento que siguió concordando con lo
esperado en el aumento del volumen de hidróxido necesario, sin embargo, en las últimas trespruebas se mantuvo de igual manera constante.
Una vez recuperados estos datos de tiempo y volumen se procede a calcular la concentración de
NaOH gastados, ahora observemos la estequiometria de ambas reacciones
Por lo que se observa que la relación de HCl y NaOH es 1:1, y que el HCl generado también
proviene de 1 mol de cloruro de ter-butilo, por lo que la concentración calculada de hidróxido de
sodio corresponde de manera indirecta a los moles de cloruro de ter-butilo que reaccionaron para
formar el ter-butanol. La velocidad de reacción solo depende de la concentración del halogenuro
de alquilo que reacciona. Al restar ambas concentraciones obtenemos la diferencia de
concentración entre los moles iniciales y los moles que ya habían reaccionado.
Aplicando la formula siguiente, se obtiene los valores de la constante a diversos intervalos de
tiempo. Se encontró que el primer valor

5/17/2018 Orgánica Práctica 7 - slidepdf.com
http://slidepdf.com/reader/full/organica-practica-7 5/5
OH
H Cl
OH2
Cl
Cl
Cl
OH2OH2
- HOH
Obtención de cloruro de ter -butilo
Hidrólisis de cloruro de ter-butilo: Obtención de ter-butanol
MECANISMOS DE REACCIÓN
.Rendimiento teórico y experimental de la reacción
2)Mecanismos de reacción (De ambas reacciones)
3.Tabla con los valores experimentales y calculados (sugiero que lo hagan en excel)
4.Gráfica con regresión lineal y valor de k obtenido mediante la pendiente.
5.Conclusiones acerca del valor de k obtenido por ambos métodos y posibles aplicaciones de este
sencillo experimento para el cálculo de más propiedades fisicoquímicas....