números cuánticos
-
Upload
natalia-cubillos -
Category
Education
-
view
69 -
download
3
Transcript of números cuánticos
Unidad 1:
Estructura AtómicaQuímica – 1º Medio
Colegio Senda Nueva – Prof. Natalia Cubillos B. http://www.colegiosendanueva.com
Chile – ( 56-2 ) – 22 77 24 81 / 8- 493 97 47
NATURALEZA DUAL DEL ELECTRÓN
Colegio Senda Nueva – Prof. Natalia Cubillos B. http://www.colegiosendanueva.com
Chile – ( 56-2 ) – 22 77 24 81 / 8- 493 97 47
El electrón tiene un comportamiento dual de corpúsculo y onda, pues posee masa y se mueve a velocidades elevadas. Al comportarse el electrón como una onda, es imposible conocer en forma simultánea su posición exacta y su velocidad; por lo tanto, sólo existe la probabilidad de encontrar un electrón en cierto momento y en una región dada en el átomo.
MECÁNICA CUÁNTICA
Colegio Senda Nueva – Prof. Natalia Cubillos B. http://www.colegiosendanueva.com
Chile – ( 56-2 ) – 22 77 24 81 / 8- 493 97 47
Principio de incertidumbre, y se refiere a la incapacidad de determinar exactamente la posición, velocidad y energía, de manera simultánea, de un electrón dentro del átomo.
Schrödinger queda establecido que los electrones no giran en órbitas alrededor del núcleo tal como lo había propuesto N. Bohr, sino que en orbitales.
En síntesis, la distribución de los electrones alrededor del núcleo obedece a una serie de reglas o principios de la teoría mecanocuántica, que se traducen en un modelo matemático que reconoce tres números básicos denominados números cuánticos.
NÚMEROS CUÁNTICOS
Colegio Senda Nueva – Prof. Natalia Cubillos B. http://www.colegiosendanueva.com
Chile – ( 56-2 ) – 22 77 24 81 / 8- 493 97 47
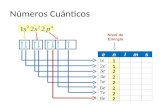
1. Número cuántico principal (n): corresponde a los niveles de energía quea su vez estarían formados por uno o más .n = 1, 2, 3, ….
2. Número cuántico secundario (l): también conocido como númerocuántico de momento angular o azimutal.Este define la forma que tiene el orbital.
Se calcula considerando: l = 0, 1, 2, ..., (n-1)
Por ejemplo: Si n = 1, l = 0Si n = 2, l = 0, 1Si n = 3, l = 0, 1, 2Si n = 4, l = 0, 1, 2 ,3
Colegio Senda Nueva – Prof. Natalia Cubillos B. http://www.colegiosendanueva.com
Chile – ( 56-2 ) – 22 77 24 81 / 8- 493 97 47
3. Número magnético (ml): describe la orientación del orbital en el espacio.
Por ejemplo: a. Para l = 0 (s), m = 0, esto significa que existe un solo orbital. b. Para l = 1 (p), m va desde el -1, 0, 1, esto significa que existen tres orbitales, los que se conocen como px, py, pz o como p1, p2, p3. c. Para l = 2 (d), m va desde el -2, -1, 0, +1, +2, lo que significa que en el subnivel 2 existen cinco orbitales, los que se conocen como d1, d2, d3, d4, d5.
4. espín (s): para comprender su significado debemos considerar que los electrones se desplazan girando sobre su propio eje, lo que genera a su alrededor un campo magnético que permitiría la existencia de un máximo de dos electrones por orbital con espines opuestos + 1/2 y –1/2.