Modelo Mecano Cuántico. - sgcciencias.files.wordpress.com · •Propiedades del electrón: masa,...
Transcript of Modelo Mecano Cuántico. - sgcciencias.files.wordpress.com · •Propiedades del electrón: masa,...

Modelo Mecano Cuántico.Taller PSU Química 2018.

Contenidos Mínimos Obligatorios
• Descripción básica de la Cuantización de la energía, organización y comportamiento de los electrones del átomo, utilizando los cuatro números cuánticos (principal, secundario magnético y spin).

• Propiedades del electrón: masa, carga y espín
• Dualidad onda-partícula del electrón .
• Principio de incertidumbre de Heisenberg.
• Números cuánticos y su significado.
• Orbitales atómicos.
• Principio del llenado de orbitales, a partir del principio de exclusión de Pauli, el principio de mínima energía y máxima multiplicidad de Hund.
• Configuración electrónica.

• El modelo mecano cuántico surgió alrededorde 1925, como resultados de los trabajosrealizados por diversos investigadores. Estemodelo nos permite explicar la composicióndel átomo y algunos fenómenos físicos de laspartículas que lo constituyen.
• Quienes sentaron las bases del nuevo modelomecánico cuántico fueron tres científicos:

• En 1924, Louis de Broglie, postuló que loselectrones tenían un comportamiento dual deonda y partícula. Cualquier partícula que tienemasa y que se mueve a cierta velocidad,también se comporta como onda.
• Hoy se sabe que la luz presenta un carácterdual onda-partícula, es decir, presentacaracterísticas ondulatorias y corpusculares.

Aportes de Schrödinger
• En 1927, Erwin Schrödinger, alumno de Bohr, logra representar el comportamiento del electrón mediante una ecuación de onda.
• Los valores obtenidos al resolver la ecuación deonda, representan los orbitales atómicos(regiones de alta probabilidad de encontrarelectrones en torno al núcleo), distintas a lasorbitas fijas y estacionarias planteadas por Bohr.

Aportes de Heisenberg
• En 1928, Heisenberg, concluye que es imposible determinar con exactitud la posición y velocidad de una partícula, ya que mientras más exacta sea la determinación de una, más inexacta será la otra.

Conclusión modelo mecano cuántico.
• Así para el electrón si se considera sudualidad partícula – onda y el principio deincertidumbre, no es posible determinar conexactitud su trayectoria específica, pero sies posible determinar el área o sección delátomo en que existe mayor probabilidadde encontrarlo.

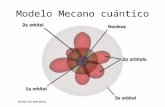
• En el átomo, los electrones se encuentran ocupando diferentes orbitales atómicos. Estos orbitales se agrupan en niveles de energía.
• Un orbital atómico es una región del espacio que se encuentra alrededor del núcleo en la que existe mayor probabilidad de encontrar un electrón.

Números cuánticos
• A partir de la ecuación matemática descritapor Schrödinger se derivan los númeroscuánticos. Estos describen los orbitalesatómicos e identifican los electrones dentrodel átomo; estos son:
• número cuántico principal(n),
• número cuántico del momento angular(l),número cuántico magnético(ml)
• número de cuántico de spin(ms).

Número cuántico principal (n)
• Este número corresponde a cada uno de los niveles o capas de energía del átomo.
• Los niveles de energía dependen de cuan cerca estén del núcleo: mientras más cerca, menor es la energía.

• Representa el nivel de energía o volumen del orbital. Dicho de otra manera el número cuántico principal determina el tamaño de las órbitas, por tanto, la distancia al núcleo de un electrón vendrá determinada por este número cuántico. Todas las órbitas con el mismo número cuántico principal forman una capa o nivel.
El número cuántico principal toma valores enteros comenzando por n=1, 2, 3, 4………

Número cuántico Secundario (ℓ )
• Es conocido también como numero cuánticodel momento angular, este número determinala distribución que adopta la nube electrónicay la forma geométrica del orbital. Cada nivelde ℓ representa un determinado orbitalatómico, como se muestra a continuación.

• Por lo tanto el número cuántico secundario nos dice los subniveles que hay dentro del nivel atómico, como se observa a continuación:


ORBITAL DE TIPO p
Posee una simetría de esfera achatada la orientación esta dada por el eje cartesiano.

ORBITAL DE TIPO dPosee una simetría elíptica y 5 tipos de orbitales d.

ORBITAL DE TIPO fPosee una simetría elíptica y 7 tipos de orbitales f.

Número cuántico Magnético (m)
• Determina la orientación del orbital atómico y la regula frente a un campo magnético externo. Este numero depende del azimutal y toma valores desde –ℓ hasta + ℓ pasando por 0.

Número cuántico Espín (s)
• Describe el sentido de la rotación del electrón en torno a su propio eje (imaginario). Se distinguen dos tipos de spin: negativo y positivo, según giren en el sentido que lo hacen los punteros de un reloj o en sentido contrario respectivamente.

• Si el electrón fuese considerado como una esfera tendría dos sentidos de rotación: horario y antihorario. Se acostumbra asociar a estos dos sentidos los siguientes números -1/2 y +1/2

Notación cuántica
En resumen, un electrón puede ser representado simbólicamente por:

Ejercicios de Nº Cuánticos
• Determine los números cuánticos del ultimo electrón que ingresa a los orbitales (Utiliza la notación cuántica para recordar):
• 2p5
• 3s1
• 5s1
• 6d7
• 7s2
• 3d5

Complete la siguiente tabla:

Configuración electrónica
La configuración electrónica de un elementoes la forma en la cual se distribuyen loselectrones en los orbitales del átomo en suestado fundamental .Para escribir laconfiguración electrónica de un átomodebemos conocer y cumplir ciertas reglas yprincipios básicos.

Principio de mínima energía o principio de aufbau:
• Estable que los electrones deben ocupar losniveles de más baja energía , que son losque se encuentra más cercano al núcleo;estos se van llenando en orden creciente.los orbitales de más baja de energía solo seocupan una vez que se completa la cantidadmáxima de los orbitales de menor energía .Para seguir el orden correcto se debeutilizar la regla de las diagonales.


Principio de exclusión de Pauli:
• Este principio plantea que en un átomo no puede haber dos electrones que tengan los mismos números cuánticos n, l, ml y ms. Debido a esto se concluye que en cada orbital se puede aceptar como máximo dos electrones, los cuales deben tener espines contrarios


Regla de máxima multiplicidad de Hund:
• Esta regla establece que la distribuciónelectrónica más estable será aquella en quelos subniveles presente mayor cantidad deespines paralelos. En este sentido, loselectrones van ocupando los subniveles
( orbitales) de forma que cada electrónadicional que entra se ubica en orbitalesdiferentes con el mismo sentido del espín.