MEDITERRÁNEA - ua
Transcript of MEDITERRÁNEA - ua

MEDITERRÁNEA SERIE DE ESTUDIOS SOBRE BIOLOGÍA TERRESTRE MEDITERRÁNEA
Número 5 ^ Diciembre 1981
I SUMARIO \ J. GARCÍA-ALBA y M. MOREY p á g ¡ n a
La vegetación de las dunas litorales y su relación con la morfología dunar y el gradiente de influencia marina 3
j J. M. CABO e I. CAMACHO Aves acuáticas de la mar chica de Melilla, julio 1977 - junio 1978 y verano 1979 23
GONZALO MATEO Sobre la influencia atlántica en la flora de la Sierra de Mira (Cuenca - España) 35
NARCIS PRAT ! Quiromidos de Catalunya. (2.a nota) 43
F. V. FAUS y J. R. VERICAD 1 Sobre nidos aéreos de rata negra, Rattus rattus (Linnaeus,
1758), en el naranjal saguntino (Valencia) 67
J. A. GIL - DELGADO \ í La avifauna del naranjal valenciano. III. El verdecillo
(Serinus serinus L.) 97
C. BONET y J. A. GIL - DELGADO Contribución sobre las odonatocenosis de la provincia de Valencia (España) 115
DEPARTAMENTO DE BIOLOGÍA - FACULTAD DE CIENCIAS UNIVERSIDAD DE ALICANTE
PUBLICACIÓN PATROCINADA POR LA CAJA DE AHORROS PROVINCIAL DE ALICANTE

MEDITERRÁNEA SERIE DE ESTUDIOS SOBRE BIOLOGÍA TERRESTRE MEDITERRÁNEA
Número 5 * Diciembre 1981
SUMARIO J. GARCÍA-ALBA y M. MOREY Página
La vegetación de las dunas litorales y su relación con la morfología dunar y el gradiente de influencia marina 3
J. M. CABO e I. CAMACHO Aves acuáticas de la mar chica de Melilla, julio 1977 - junio 1978 y verano 1979 23
GONZALO MATEO Sobre la influencia atlántica en la flora de la Sierra de Mira (Cuenca - España) 35
NARCIS PRAT Quiromidos de Catalunya. (2.a nota) 43
F. V. FAUS y J. R. VERICAD Sobre nidos aéreos de rata negra, Rattus rattus (Linnaeus, 1758), en el naranjal saguntino (Valencia) 67
J. A. GIL - DELGADO La avifauna del naranjal valenciano. III. El verdecillo (Serinus serinus L.) 97
C. BONET y J. A. GIL - DELGADO Contribución sobre las odonatocenosis de la provincia de Valencia (España) 115
DEPARTAMENTO DE BIOLOGÍA - FACULTAD DE CIENCIAS UNIVERSIDAD DE ALICANTE
PUBLICACIÓN PATROCINADA POR LA CAJA DE AHORROS PROVINCIAL DE ALICANTE

I.S.B.N.: 84 — 600 — 0592 — 5 Título Clave: Mediterránea (Alicante) Edita: Dpto. Biología. Facultad de Ciencias de Alicante Depósito Legal: A — 807 — 1982 Impreso y Compuesto en: Coop. A. G. GUTENBBRG
Río Turia, 11 - Alicante Teléfonos 286999 y 283436

Mediterránea, 5 - Págs. (3 - 22), Año 1981
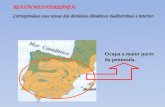
LA VEGETACIÓN DE LAS DUNAS LITORALES Y SU RELACIÓN CON LA MORFOLOGÍA DUNAR
Y EL GRADIENTE DE INFLUENCIA MARINA.
Por J. García-AIbá y M. Morey
Las dunas litorales son ecosistemas singulares caracterizados por poseer suelos brutos no evolucionados o con perfil poco diferenciado, de textura netamente arenosa y con o sin horizonte de humus diferenciado (DUCHAUFOUR, 1975). Estas características edá-ficas, unidas a su proximidad al mar, hacen que solo un número relativamente limitado de especies vegetales sean capaces de vivir en estas condiciones ambientales, por lo cual la flora propia de estos ecosistemas es relativamente uniforme y diferencial respecto a los ecosistemas próximos, estando constituida esencialmente por especies psammófitas, xerófitas, halófitas, oligotrofas y resistentes al viento y a la movilidad del sustrato.
Las formaciones de dunas litorales han sido consideradas tra-dicionalmente como lugares improductivos y faltos de interés económico; pero modernamente se ha descubierto una serie de valores de tales ecosistemas, que van desde su interés como fuente de arena para la construcción y la industria hasta su aprovechamiento como zona recreativa con capacidad de atracción turística, alcanzando los terrenos dunares precios muy elevados para urbanizaciones. Tales aprovechamientos producen efectos negativos sobre estos ecosistemas, que van desde la degradación más o menos acusada (nitrofilia inducida por ia simple concentración veraniega de personas que acuden a la playa, con aparición de especies ruderales) hasta la destrucción parcial a causa de los areneros o incluso total por las urbanizaciones. Por ello hemos creído interesante estudiar estos ecosistemas en algunos aspectos florísticos y ecológicos antes de que sea demasiado tarde. En los últimos años una serie de inves-
3

tigadores españoles han dedicado sus esfuerzos a este problema (ALVAREZ, 1972; LORÍENTE, 1974; LORÍENTE Y GONZÁLEZ MORALES, 1974; LOSA Y ALONSO, 1974).
Desde el punto de vista fitosociológico, la vegetación de las dunas litorales se ha clasificado dentro de la División Ammophilea arenariae O. Bolos, 1968, que comprende las siguientes Clases: Ca-kiletea marítimae R. Tx. y Preising, 1950, correspondiente a las playas, con el Orden Euphorbietalia peplis, y Ammophiletea Br.-BI. y R. Tx., 1973, con el Orden Ammophiletalia Br.-BI. (1931) 1933, correspondiente a las dunas. Ambas clases se subdividen en categorías inferiores con sus correspondientes especies características, acompañantes, etc. (LORÍENTE Y GONZÁLEZ MORALES, 1974).
Hemos querido realizar un estudio ecológico de varios sistemas de dunas litorales de Asturias y Galicia, que incluyen lugares relativamente bien conservados y lugares más degradados con el fin de ordenar las comunidades vegetales de los distintos sistemas a partir de muéstreos cuantitativos estratificados, siguiendo un gradiente perpendicular a la línea de la costa,.basado en la morfología de las dunas.
MATERIAL Y MÉTODOS
Se han estudiado tres sistemas de dunas litorales de la provincia de Oviedo (Verdicio, Xagó y El Espartol) y uno de la de Pontevedra correspondiente a la playa de La Lanzada (FIGURA 1). La toma de muestras se realizó en los meses de mayo y junio.
Se escogió un tipo de muestreo por transecciones perpendiculares a la línea de la costa (FIGURA 1), de tal modo que se realiza por tramos siguiendo el perfil de las dunas, es decir, se trataría realmente de un muestreo estratificado siguiendo un presunto gradiente ambiental perpendicular a la línea de la costa.
4

PL AYA DE VERDI !
PL. OE XAGO \ \
PL DE EL E S P " " " " ! '*
PLAYA DE
LA LANZADA
u r b . « i « ! ¡ i -
PLAYA DE XAGO PLAYA DE VERDICIO
Figura 1.—Situación de los sistemas de dunas con indicación de las transecciones realizadas.
5

En cada transición se distinguen las siguientes zonas:
A.—Playa: Comprendida entre el mar y el principio del frente de las dunas primarias. Se caracteriza por su suave pendiente, nunca superior al 15%. A veces se distinguen a simple vista dos comunidades vegetales aparentemente distintas, en cuyo caso se han muestrea-do separadamente.
B.—Frente anterior de las dunas primarias: Comprende desde el final de la playa hasta la parte superior de las dunas primarias y se caracteriza por tener una pendiente relativamente fuerte (entre 15 y 40% en nuestro caso).
C—Parte superior de las dunas primarias: Es ia zona prácticamente horizontal que forma la cima de las dunas primarias.
D.—Frente posterior de las dunas primarias: Como su nombre indica, corresponde a la zona de detrás de las dunas primarias con pendiente a veces muy acusada (hasta un 45%).
E.—Dunas secundarias: Son las muestras más alejadas del mar y comprenden desde comunidades típicamente dunares hasta comunidades de transición a la vegetación normal de la zona (prados generalmente). El horizonte de humus ya suele estar diferenciado.
De acuerdo con esta clasificación de la morfología dunar, los lugares de muestreo pueden observarse en la FIGURA 2.
6

VERDICIO O r i e n t a c i ó n 330
m-^-^\ >om_ __.
1.B <*
- - 21
2.B
- 6 -
17'/T**
— 12 • -
Vt .B 60V
-6 -1
X A G O TRANSECCIÓN III 8.C Or. 305 „ „7.Bs>* t i JU* , i«*S.D
17.E
X A G O TRANS. II Or. 329
XAGO Or. 3 57
m ü - - — ^
T R A N S . I
18.A
I — - — 8 0 m .
21 20 R n
19.A
- 1 2 -
'ae
_7
30
•5
22.E " "
•• - 22
23.E
'^itf^ • ¿0
\
EL ESPARTAL 25. B 26.C
Or. 321
LA LANZADA TRANS.I
Or. 240 28 2 0°/.
29.C 30.C
• :-*Y»¿-£v
LA LANZADA TRANS. n 33 B 3A.c Or. 223
Figura 2.—Perfiles transversales de las transecciones con indicación de las zonas homogéneas (véase el texto).
7

En la playa de Verdicio, la duna primaria estudiada está abierta por la parte posterior a la influencia del mar por el arroyo que discurre al fondo, de modo que sólo topográficamente puede hablarse de un frente posterior de duna primaria. Por otra parte, la dinámica de formación de dicha duna, con un aporte continuo de arena desde el mar y un arrastre de la misma por la acción del arroyo que discurre tras ella, hacen que la arena del frente posterior se renueve periódicamente por derrumbes (G. FLOR, comunicación personal), por lo cual ninguna comunidad que allí se asiente puede progresar hacia etapas de mayor madurez. Por todo ello se han considerado todas las muestras de esta duna como pertenecientes a la zona B.
En cada lugar de muestreo se tomaron los siguientes datos: orientación, pendiente y distancia y altura sobre el nivel medio de marea. Se determinó, además, la frecuencia relativa de las distintas especies usando un cuadrado de muestreo de 60x60 cms dividido en 16 subcuadrados ¡guales. Este cuadrado fue lanzado al azar 10 veces en cada lugar de muestreo, con lo cual las frecuencias obtenidas pueden variar entre 0 y 160 para cada especie. Para evitar el efecto de subestimación de las especies menos frecuentes, se adoptó el criterio de asignar una frecuencia de uno a aquellas especies que, estando presentes, no quedaban incluidas en ninguna muestra.
En primer lugar se aplicó un análisis de componentes principales con tipificación de coordenadas y rotación de ejes a todas las muestras usando una computadora electrónica IBM 7070 del Centro de Cálculo Electrónico del C.S.I.C. (Madrid) y posteriormente otro análisis de componentes principales con transformación logarítmica de los datos y rotación de ejes en una computadora UNIVAC del Centro de Cálculo de la Universidad de Santiago de Compostela. En este último análisis no se incluyeron los datos de las dunas de Galicia. (SEAL, 1964; FERNANDEZ ALES y otros, 1975).
También se calculó la diversidad específica aplicando la fórmula de SHANNON (SHANNON-WEAVER, 1963).
RESULTADOS Y DISCUSIÓN
Se identificó un total de 64 táxones, la mayor parte de ellos a nivel de especie, que se muestran con sus correspondientes frecuencias totales en la TABLA 1. Como se ve, Calystegia soldanella, Am-mophila arenaria, Eryngium maritimun, Euphorbia paralias y Agropyrum junceum son las más frecuentes y al mismo tiempo las más características de estos ecosistemas (LORÍENTE Y GONZÁLEZ MORALES, 1974).
8

TABLA 1.—Relación de especies observadas, con indicación de su frecuencia relativa en tanto por ciento.
Especie Aira caryophyllea L. Agropyrum junceum P. Br. Ammophila arenaria Link Anagallis arvensis L Andriala integrifolia L Anthyllis vulneraria L. Arbutus unedo L. Artemisia crithmifolia L Asperula cynanchica Rauhin L. var. marítima Lge. Atriplex hastata L. Calystegia soldanella (L) R. Br. Cakile marítima Scop. Carex arenaria L. Carpobrotus acinaciformis (L.) L Bolus Catapodium marínum (L.) C.F. Hub. Cerastium sp. Chlora perfoliata L. Clematis vitalba L. Crepis virens L. Críthmum marítumum L. Crucianella marítima L. Dactylis glomerata L Equisetum sp. Eryngium maritimum L. Erythraea littoralis Fries. Euphorbia paralias L. Festuca dumeterum L. Helichrysum stoechas (L.) D.C. Honkenya peploides (L.) Ehrh. Hypochoerís radicata L. Koeleria albescens D.C.
Frecuencia 2,9
45,7 80,0
5,7 37,1 11,4 2,9
11,4 14,3 2,9
85,7 20,0 40,0
8,6 20,0 11,4 11,4 2,9 5,7
25,7 42,9 2,9 2,9
65,7 5,7
57,1 5,7 5.7
37,1 17,1 17,1
9

Lagurus ovatusL. Linaria sp. Lotus corniculatusL. Malcolmia littorea R. Br. Medicago marina L Medicago suffruticosa RAM. Musgo Ononis red i nata L. Ononis repens L. Ononis sp. Otanthus maritimus (L.) Hoffgg. y Link Pancratium maritimum L Phleum arenarium L. Pinus pinaster Ait.ssp. atlántica H. del Villar Plantago coronopus L. Poa sp. Polygala vulgaris L. Polygonum maritimum L. Populus nigra L. Pte/7s aquilina L flívó/a peregrina L. Salsola kali L. Scolymus hispanicus L. Sedum acre L. Sese// sp. Si lene inflata L. Smilax áspera L. Tamarix galilea L. Thrincia hirta Roth. Trifolium repens L. L//ex europaeus L. Wc/'a sp. Vu/p/a unigluniis Dum
37,1 2,9 2,9 8,6
14,3 2,9
14,3 5,7 5,7 2,9
11,4 22,9 17,1 5,7 2,9 2,9 2,9
14,3 2,9
14,3 8,6
17,1 5,7 2,9 5,7 2,9
20,0 2,9
34,3 14,3 2,9 2,9
42,9
10

En el análisis de componentes a partir de los datos no transformados el porcentaje de información recogida por los primeros ejes es bastante aceptable, aproximándose al 50% en los tres primeros componentes.
Componente Información recogida
Información acumulada
1 II
III IV V
20,00 13,97 10,16 8,29 6,90
20,00 33,97 44,13 52,42 59,32
Los factores de carga más representativos para los dos primeros componentes se muestran en la TABLA 2.
TABLA 2.—Factores de carga del primer análisis de componentes principales ordenados por sus valores absolutos decrecientes.
EJE I POSITIVOS Lagurus ovatus Cerastium sp. Phleum arenarium Carex arenaria Asperula cynanchica Musgo Poa sp. Anthyllis vulneraria Koeleria albescens Pteris aquilina Vulpia uniglumis Thrincia hirta Smilax áspera Trifolium repens Ononis red ¡nata Andryala integrifolia Erythraea littoralis Chlora perfoliata
NEGATIVOS Agropyrum junceum Cakile marítima Malcolmia littorea Salsola kali
EJE Anagallis arvensis Helichrysum stoechas Scolymus hispanicus Ononis sp. Sedum acre Seseli sp. Malcomía littorea
Agropyrum ¡unceum Cakile marítima Salsola kali Honkenia peploides
11

La proyección de los lugares de muestreo sobre el espacio formado por los dos primeros ejes de coordenadas puede observarse en la FIGURA 3. Todas las muestras propias de playa y del frente anterior de las dunas primarias (Zonas A y B) son muy similares y están caracterizadas por la presencia de Agropyrum junceum, Cakíle marítima y Salsola kali (TABLA 2). Por otra parte, se observa un comportamiento diferencial de las dunas de Galicia frente a las de Asturias,
EJE II
C (30)
-,o A c -s
-40
•35
30
•20
•10
O E °EE oE
$r 10
i , 5 °d 2,° 25 30 —t—
.-.o m *•";; '/?• c D
- 5
EJE I
Figura 3.—Proyección de las muestras sobre los dos primeros ejes del análisis de componentes principales. Puntos: Verdicio. Círculos blancos: Xagó. Círculos negros: El Espartal. Triángulos negros: La Lanzada. Las letras que acompañan los lugares de muestreo indican la zona del sistema dunar a que pertenecen.
12

caracterizado por los valores negativos más elevados para el componente I y valores positivos también más elevados para el II; es decir, que se diferencian fundamentalmente por la presencia de Ana-gallis arvensis, Helichrysum stoechas, Scolymus hispánicas, Ono-nis sp.; Sedum acre, Seseli sp. y Malcolmia littorea. Estas especies, efectivamente, se han encontrado únicamente en las dunas de Galicia y, en conjunto, parecen de distribución más mediterránea que las demás. Cabe pensar en este caso en un efecto climático y bio-geográfico, puesto que las dunas gallegas estudiadas están enclavadas en una zona de clima mediterráneo subhúmedo con tendencia a atlántico europeo (Subregión IV (V)), mientras que las dunas asturianas están en la Subregión V (VI) o de clima atlántico europeo (ALLUE ANDRADE, 1966). Realmente en el mapa del citado autor, la playa de La Lanzada aparece en la Subregión V (VI), pero los estudios que estamos realizando en el Departamento de Ecología de la Universidad de Santiago demuestran claramente que toda la zona de las Rías Bajas pertenece al clima citado anteriormente.
El componente I marca una dirección de variación florística tal, que se suceden hacia la parte positiva los lugares de muestreo correspondientes a las sucesivas zonas desde el mar hasta el interior, marcadas por las especies factores de carga positivos para este eje (véase la TABLA 2).
Se ha visto como todos los lugares de muestreo de playa y frente anterior de las dunas primarias son muy similares y se encuentran muy agrupados en la parte negativa de ambos ejes. Ampliando la escala para poder observar mejor su distribución (FIGURA 4), se observa que las comunidades de playa se agrupan en el extremo más negativo para los dos ejes, sea cual sea el sistema dunar a que pertenecen, excepto en el caso de Galicia, que ya se ha indicado que tiene un comportamiento distinto. La muestra número 30, correspondiente a la zona C de La Lanzada, queda totalmente discriminada de los demás, como si fuera florísticamente muy distinta. Cabe señalar que dicha muestra está separada de las demás de su sistema dunar por una carretera muy frecuentada, por lo cual es posible que sus diferencias florísticas sean debidas, no sólo a la posible ruderalidad impuesta por la proximidad de dicha carretera, sino también a la ruptura de la dinámica del sistema causada por dicha carretera.
13

T
Csl -I
r
-*-
i '
u ' (J
"O
CD
• m
LU —i
LÜ
« .O 0 0
O' *oo<
o w
SI
co o -o "O co
O) g — ü " 10 fl) 10
c <D jO O 05 _ o 2 g U ( D m
£ E 3 O ~ CT
*8f 75 £ «
w b
co
O)
L
ÜJ
—) LU
14

Con objeto de eliminar el posible efecto biológico provocado por las dunas gallegas, se sometieron a un nuevo análisis de componentes principales previa transformación logarítmica los datos correspondientes a las dunas asturianas. Con ello se gana información, pues el porcentaje de varianza recogido por los cinco primeros ejes alcanza en este nuevo análisis más del 72% frente al 59% del análisis anterior.
Los factores de carga para los dos primeros ejes de coordenadas pueden verse en la TABLA 3 y la proyección de los lugares del muestreo sobre los dos primeros ejes en la FIGURA 5.
TABLA 3.—Factores de carga del segundo análisis de componentes principales (sólo Asturias) ordenadas por sus valores absolutos decrecientes.
EJE I POSITIVOS Musgo Cerastium sp. Anthyllis vulneraria Ononis reclinata Smilax áspera Poa sp. Aira caryophyllea Lotus corniculatus Pteris aquilina Phleum arenarium Lagurus ovatus Trifolium repens Asperula cynanchica Koeleria albescens Añónala integrifolia
NEGATIVOS Calystegia soldanella Agropyrum junceum Ononis repens Equisetum sp. Crucianella marítima
EJE Calystegia soldanella Ammophila arenarla Euphorbia paralias Agropyrum junceum Eryngium marltimum Carex arenaria Vulpla uniglumis
Cakile marítima Salsola kali Polygonum marltimum
15

EJ E II
B OB• J>
BO CDOD » O C J l
B B B "^
*5 —t—
3.5 .-as 05 1 15 EJE I
•-13
Figura 5. -Proyección de las muestras sobre los dos primeros ejes del análisis de componentes principales con transformación logarítmica y referido sólo a Asturias. La misma simbología que en la figura 3.
Nuevamente se observa la similitud entre todas las muestras de cada una de las zonas topográficas en que se dividieron las dunas. En este caso, las muestras de la zona de playa (A) quedan muy diferenciadas de las de la zona B o del frente anterior de las dunas primarias, y están caracterizadas por la presencia de Cakile marítima, Salsola kali y Polygonum maritimum. Hay que señalar el Irregular comportamiento de la muestra 19 de Xagó, que se comporta como una muestra de la zona B por fa elevada frecuencia de Agropy-rum junceum y Ammophila arenaria, propias de este nivel. Las muestras del frente anterior de las dunas primarias (zona B) se caracterizan por la presencia de Calystegia soldanella, Agropyrum junceum, Ammophila arenaria, Euphorbia paralias y Eryngium maritimum, fundamentalmente, mientras que las de las zonas C y D son relativamente parecidas a las de la zona B. Finalmente, las comunidades de dunas secundarias (zona E) están caracterizadas por la presencia de musgo, Cerastium sp., Anthylis vulneraria, Ononis re-clinata, Smilax áspera, Poa sp., Aira cariophyllea, Lotus cornicula-tus, que parecen marcar una transición a comunidades pratenses.
Comparando los resultados obtenidos en los dos análisis efectuados, se observa que coinciden en lo fundamental; pero que, según sea el tipo de análisis aplicado, algunos hechos se nos presen-
16

tan mejor o peor diferenciados. Así, es evidente que sólo el último de los análisis nos diferencia claramente y caracteriza bien las muestras de playa (A) y las del frente anterior de las dunas primarias (B), dejando, en cambio muy desdibujadas las diferencias entre las muestras de esta última zona y las de las zonas C y D. Ello se debe a que, al realizaren el segundo análisis una transformación logarítmica de los datos, queda proporclonalmente aumentada la frecuencia, muy baja en la realidad, de las especies propias de las zonas A y B, con lo cual adquieren más peso estadístico en el tratamiento analítico. En cambio en el primer análisis, las muestras correspondientes a las zonas del frente posterior de las dunas primarias (D) y las de las dunas secundarlas (E) quedan proporcionalmente más diferenciadas de las demás que en el último análisis.
Considerando conjuntamente todos los resultados obtenidos, pueden caracterizarse las comunidades correspondientes a las distintas zonas topográficas de las dunas estudiadas. La zona de playa (A) se caracteriza por las especies Cakile marítima, Salsola kali y Polygonum maritimum. Las comunidades del frente anterior de las dunas primarias (B) se diferencian de las anteriores por la presencia de Calystegia soldanella y Agropyrum junceum y comienza a encontrarse a veces Ammophila arenaria, que, junto con Euphorbia para-lias y Eryngium maritimum, caracteriza las zonas C y D. Finalmente, las especies características de las comunidades de dunas secundarias (E) dependen en gran parte de las características florís-ticas de la región en la que se asientan las dunas. En nuestro caso pueden asignarse como más características el musgo, cuya presencia está ligada a la aparición de un horizonte de humus más o menos definido, Cerastium sp., Anthyllis vulneraria, Lagurus ovatus, Phleum arenarium, Ononis reclinata, Smilax áspera y Carex arenaria, entre otras. Mientras que las especies características de la playa y frente anterior de las dunas son las mismas que señalan los fitoso-ciólogos, las de las otras zonas corresponden, en parte, a ciertas fa-cies localizadas en términos generales en dunas secundarias por algunos autores (LORÍENTE y GONZÁLEZ MORALES, 1974).
Los valores obtenidos de diversidad específica oscilan entre 0,92 y 3,78. En líneas generales, se obtienen valores más elevados en las zonas más alejadas del mar, es decir en las dunas secundarias con horizonte de humus. (FIGURA 6). Esto parece reflejar la existencia de una sucesión en sentido mar-tierra. También se observa que en la mayor parte de las transecciones aparece un descenso de la diversidad en la zona B, lo cual se explica si se tiene en cuenta la clara dominancia de Agropyrum junceum sobre las demás especies. Es notable la semejanza entre el perfil de diversidad de las dunas de El Espartal y La Lanzada, que son bastante semejantes entre sí en cuanto a perfil topográfico e intensidad de la Influencia humana.
17

- I 1 1 1 1-
\
\ - t 1 ( I 1 1 1 1 -
o 0 u.
<•-» W 0 Z¡
E 0 •o w 0 L_ C0 O)
« o 0 -o •o ce -o
0 > b
I co a O)
«> o
i» <
„ 2
Cí CN
18

El comportamiento diferencial de las dunas de Galicia con respecto a las de Asturias, que ya quedaba bien manifiesto a través del primer análisis de componente principales, vuelve a presentarse cuando se observa el comportamiento de la diversidad frente a las coordenadas del primer componente (FIGURA 7). También en este caso, la muestra de La Lanzada n.° 30 se separa significativamente de todas las demás.
Agrupando los valores de diversidad de todos los lugares de muestreo semejantes, se calcularon las medias, desviaciones típicas y coeficientes de variación, que figuran en la TABLA 4. Cabe destacar el ya comentado aumento de la diversidad a medida que los lugares de muestreo están más alejados del mar y la progresiva disminución del coeficiente de variación en la misma dirección, lo cual nos indica una creciente homogeneización de las comunidades dunares en el sentido indicado, poniendo de manifiesto la existencia de una sucesión en el sentido mar-tierra. El elevado valor del coeficiente de variación de la zona B puede interpretarse en función de la inestabilidad de las comunidades de dicha zona en la que Agropyrum junceum intenta continuamente fijar la duna, consiguiendo, a veces, ocupar el frente dunar completa o parcialmente, por lo cual las comunidades de esta zona oscilan a lo largo del tiempo en cuanto a grado de madurez.
TABLA 4.—Valores medios y medidas de dispersión de la diversidad específica de ios distintos lugares de muestreo.
Diversidad Lugares de muestreo media (H) s C.V. Playa A 1,56 0,37 24,0% Frente ant. de las d. primarias B 1,52 0,62 40,5% Parte sup. de las d. primarias C 2,55 0,59 23,0% Frente post. de las d. prims. D 2,88 0,24 8,3% Dunas secundarias E 3,53 0,26 7,4%
19

"o , o
o o
+s
a
"o ^-^m m m _
%* <
a < Q
ce ÜJ >
ÜJ —> ÜJ
a, U) cu c 0
O a. E o
CO m i _
co 0} 3 E co a a>
CO | D 'co CO
|1 CO "O
i* _ co a> 2-£ > *: co
S ° c >* •O co "5 © as co a> o. CC "5
CO
O)
20

RESUMEN
Se han estudiado cuatro sistemas de dunas litorales de Asturias y Galicia por medio de un muestreo estratificado con análisis florístico cuantitativo. Los datos se sometieron a un análisis de componentes principales con y sin transformación logarítmica. Estos análisis ponen de manifiesto la existencia de una sucesión de comunidades a lo largo de un gradiente mar-tierra, siendo la propia morfología de la duna la que condiciona la distribución de dichas comunidades. Se dan las especies características de cada comunidad. Se constata un aumento de la diversidad en el sentido mar-tierra, lo que parece reflejar un aumento de la madurez en la sucesión.
SUMMARY
THE VEGETATION OF SAND DUNES AND ITS RELATIONSHIP WITH THE DUNE MORPHOLOGY AND MARINE INFLUENCE.
The vegetation of our sand dunes in Asturias and Galicia (Spain) has been studied, sampling along gradients of marine in-fluence from the sea inland.
A factorial analysis of principal components has been applied to all the floristlcal data obtained. In order to elimínate the biogeo-graphical component, it has been also applied to the asturian data only. A succesion of plant communities from the beach inland is shown. The dune morphology itself explalns the distribution of the communities. The characteristic species of each community are usted. Species diversity increases along the gradient sea-inland, re-flectlng the growth maturity.
Departamento de Ecología Facultad de Ciencias Universidad de Oviedo
Departamento de Ecología Facultad de Biología Universidad de Santiago
21

BIBLIOGRAFÍA
ALVAREZ, R. (1972). Estudio de la flora y vegetación de las playas de Galicia.
Trabajos Compostelanos de Biología, 2: 35-66.
ALLUE ANDRADE, J.L. (1966). Subregiones Fitoclimáticas de España.
Ministerio de Agricultura. MADRID.
DUCHAUFOUR, P. (1975). Manual de Edafología. Toray-Masson. BARCELONA.
FERNANDEZ ALES, R.; SANCHO, A. Y TORRES, A. (1975). Introducción al análisis multivariante.
Depto. de Ecología. Universidad de Sevilla.
LORÍENTE, E. (1974). Vegetación y flora de las playas y dunas de la provincia de Santander.
Institución Cultural de Cantabria (C.S.I.C.) Santander.
LORÍENTE, E. y GONZÁLEZ MORALES, J.A. (1974). Liencres: el paisaje dunar más importante del Cantábrico.
Publ. Inst. Etnogr. y Flok., 6: 213-236.
LOSA, J.M. y ALONSO, J.L. (1974). Playas arenícolas de la playa del Testal (Noya, España).
Trabajos Compostelanos de Biología, 4: 9-23.
SEAL, H. (1964). Multivariate Statístical Analysis for Biologists. Methuen. LONDRES.
SHANNON, CE. y WEAVER, W. (1963). The mathematical theory of communication.
Universlty of Illinois Press. Urbana.
22

Mediterránea, 5 - Págs. (23 - 33), Año 1981
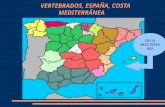
AVES ACUÁTICAS DE LA MAR CHICA DE MELILLA,
JULIO 1977 • JUNIO 1978 Y VERANO 1979
Por J. M. Cabo1 e I. Camacho1
INTRODUCCIÓN
La laguna costera llamada Mar Chica, está situada a unos 3 Kms. de la ciudad de Melilla, orientada en dirección E-SE; tiene forma elíptica, con unos 25 Kms. en su eje mayor y 6¿7 Kms. en su eje menor. (Fig. 1)
El borde oriental está formado por una barrera de arena de unos 300-400 m. de ancho, llamada Restinga, interrumpida en un punto que lo pone en comunicación con el Mar Mediterráneo, llamada Bocana. Su profundidad máxima se alcanza frente a Nador, con unos 7 m.
La red hidrográfica es muy escasa, con unos pocos ríos y arroyos de curso estacional y carácter torrencial, que sólo en ocasiones llegan a verter sus aguas en ella.
MATERIAL Y MÉTODOS
Se ha hecho una serie de observaciones desde el mes de julio de 1977 hasta junio de 1978, excepto los meses de septiembre, abril y mayo, que aparecen en el cuadro resumen con un guión en su casilla correspondiente, y posteriormente en julio, agosto y septiembre de 1979. Estos últimos meses nos han servido para confirmar algunos datos que consideramos dudosos y que habíamos observado anteriormente.
(1) Departamento de Zoología. Universidad de Granada.
23

co CM
CM co CM 00
O) • h . O) O) <
O o <M
O c O CM
co
s 3 (O Ul oc o oc o < 3 ü
O >. 03
.o co <
5 o ü os
s .o
i
I I
I I
CM CM
CM
I I I
l i l i
CM
-
m
o • < *
co
o co
co co
o
I I I I I
I I I
CM
O
O
o o co
o T —
o
co o m
o o
co CM
co CM
co
o o
I I I
o o
o o
o in CM CM
I I
I I
co
¡i
u K O O)
0) co
o in co
o m
o o o
o o CM
o
1T>
o co
I I I I I I I I I I
O)
< CM
CO - i -i - CO
CO
co o i - • > * co co
CO til CO
O UJ O .
co UJ
co
o co n c¡> Ü
T3 o Q_
CO CD
<5 c
h C0
<
CO Cu>
Q -
3
CO
k -
<
B ü CO O)
OJ
O) UJ
(D n 3
CO
CO
Q . O O
CD O sz Q.
(0 c k_ o
"O « CO c o
• o co H
(0 o o c >. .c >> ffl Q. co co c <
i ro co CO c <
CD Q . O CD c CD Q. C0 C0 c <
« CD a. >> o 10 co c <
1 I 3 CO
oc
i 8 -1
U-
O)
C0
t5 o » Q. O
CO
E CD CO X
3
ffl
CO 3
13 CO
<o .c O
co 3
!Q 3
T3 CO 3
• o CO k_ C0 n O
C0 X CD
C0
CO 3
• o C0
CO JZ O
m co 3 CJ co co 3
r Ct>
E 3 Z
24

O CM lO CM
T - • * T-
o o co
o T —
LO
o o
o
N-
CM T —
1 ^ . CO
o co
o m
CM O O CM
y- O O
l i l i
I I I I I I I I
CM
co -3-
O co
o O
O co
T —
LO CM
o m
o co
o
LO
LO
*-
o LO
T~
y~
-
T~
O o CM
O CO
o
co LO
CM
co
co
• > *
T -
o o CM
O
LO
O T - o CO CM
CM
LO CM
LO
co
00
CM
O
CM
O O CM
O CM CO
L O CO CM
O CO CM
t--
O O T —
O o CM
O o co
I I I I I T- 0 0 CM O
CM
o a> CM
LO co
o CM
o
co
a.
o
| co co o
E
3
x: >. CU es U) c
D
O '
co O) c
C0 • . -
i2 3
1? C ct¡ O) c
co
o ü 3 co o Q.
JZ
CO O) c
s í " t
<D
-*-• •-.iÜ
É ?
co 3 3
c
s • = •D
m
CO c O)
.c
C0-r-o
* - l
c_ C0
F X . C0 -} a. o c C0
b
í !
co
CU
• )
co ,_ ü T3 c
CU O)
I ~ C C0
I! o •o
- i ü
o o cu
O
o "O c
C0
c cñ 55
efl T3
£ cu co n o o c cu
>
o u
o
co cu
25

B u - A r e g
Bocana
*
Rest inga
Kana^rkemar
M A R
MEDITERRÁNEO
Fuerte de [a Restinga
Ras Qu iv iana
"ig.
26

Las visitas no se han hecho de modo sistemático y regular, no obstante se pueden calcular en una media de 3 veces por mes.
Las zonas más interesantes desde el punto de vista ornitológico resultaron ser (Fig. I):
1) Karia-Arkeman: En el extremo inferior S-SE donde se encuentran unas salinas hoy abandonadas, con zonas encharcadas y manchas de vegetación halófila. Estas salinas están limitadas por el N-NE por bosques de eucaliptos y por el S-SO por campos de cultivos.
2) Muelle del Carbón: Situada en el extremo opuesto al anterior. Formada de arenales-fangosos con manchas ralas de vegetación halófila.
3) La Bocana: Situada en la Restinga y que en este último verano, como consecuencia de la formación de bancos de arena, ha adquirido mayor interés que en los años anteriores al ser visitado éste por gran número de especies acuáticas. Presenta una vegetación halófila en su margen interior (orilla de La Mar Chica) y de dunas en su margen externo (orilla del Mediterráneo).
Las visitas a las tres zonas descritas se hacían el mismo día, excepto en alguna ocasión en que sólo se ha visitado alguna de ellas. El recorrido en cada una se hacía a pie y utilizando prismáticos.
RESULTADOS
En el cuadro resumen se recoge el número máximo de aves observado en el conjunto de visitas llevadas a cabo cada uno de los meses.
La gráfica I muestra la evolución de la máxima población observada a lo largo de dicho período. Destacan en la misma las cifras invernales próximas a los 4.000 individuos, mientras que en verano apenas llegan a 500 en julio de 1977.
DISCUSIÓN SOBRE ALGUNA DE LAS ESPECIES
En las visitas realizadas en verano hemos observado la presencia de algunas aves fundamentalmente migratorias, algunas de ellas susceptibles de confusión con algunas otras, por su gran parecido, como ocurre con algunos limícolos como Tringa nebularia y T. totanus, otras en cambio no, como agujas y vuelvepiedras por su característica coloración estival. No obstante, el verano de 1979 se han hecho observaciones para cerciorarse de la presencia de algunos de ellos. La confirmación llevada a cabo va avalada por datos
27

4000 -
3750 -
3500 -
32 50 -
3000 -
2 7 50 -
número 2 500 -de aves
22 50 -
2000 -
1750 -
1500 •
1250 -
1000 -
750 •
500 •
250 •
J l A S O N D E F M A M y J J 1 A S
1977 1978 1979
que hemos encontrado en la bibliografía y que a continuación se citan:
Fúlica atra L (Focha común)
Llama la atención su ausencia, al menos en las observaciones llevadas a cabo en verano, no obstante conocerse varios lugares de nidificación en el N-W de África, Bernis (1966). Esta ausencia, real o aparente, quizá sea debida al carácter más receloso en la época de cría, que la haría menos visible al buscar protección entre la vegetación.
Las cifras invernales, por el contrario, la muestran como la más abundante entre todas las aves acuáticas, aspecto semejante al que ocurre en la avifauna acuática europea.
Haematopus ostralegus L. (Ostrero)
En numerosas ocasiones hemos podido observar la presencia estival del ostrero. Algunas de ellas son: en el año 1977, el 25-VII, 15 individuos; el 27-VII, 9 y el 29-VII, 37; el día 10-VIII, 43; el 16-VIII, 40 y el 19-VIII, 37.
28
* ' i—
GRÁFICA I

En el año 1979, el 23-VII, 15 individuos; el 3-VIII, 25; el 23-VIII, 22 y el 4-IX, 23.
La presencia de esta ave ha estado ligada casi indefectiblemente al Muelle del Carbón y Restinga, formado por fondos fangosos y arenosos. Sólo hay una cita en Karia-Arkeman, en septiembre, con 1 solo individuo de los 23 observados.
VALVERDE (1956), cita en julio uno en la desembocadura del Lucus (Larache) y también se le ha citado nidificando en Cabo Negro.
Numenius arquatus L. (Zarapito real)
Poco abundante y repartido a lo largo de todo el año. Las citas estivales encontradas han sido 25-VII-1977, 9; el 20-VI-1978, 2 y el 11 y 23 del VIII de 1979, 1 en cada ocasión.
Según ETCHECOPAR y HÜE (1964) se encuentra presente en Marruecos a lo largo de todo el año, ya que probablemente los inmaduros permanecen muy al sur de su área de nidificación. En el sur de España también se han observado intentos de reproducción, BERNIS (1966).
Limosa limosa L. (Aguja col i negra)
Sólo se ha observado en agosto y septiembre de 1979. De las tres visitas de agosto, los días 3,11 y 23, sólo se vio un individuo el día 11, mientras que el 4-IX-79, 41.
ETCHECOPAR y HÜE (1964) y BERNIS (1966) manifiestan que quedan individuos no nidificantes en diferentes latitudes. Por otro lado VALVERDE (1956) cita unos 2.000 individuos en migración activa postnupcial en el Guadalquivir el 24 de junio.
Tanto Tringa totanus como T.hypoleucos su presencia estival no es tan rara ya que aunque migradores se conocen citas de nidificación en el sur de la Península, así como también en Marruecos, BERNIS (1966) y ETCHECOPAR (1964).
Arenaria interpres L. (Vuelvepiedras)
Tenemos anotaciones estivales de julio, agosto y septiembre. Por otra parte su reconocimiento no ofrece duda debido a su típica coloración estival.
Citas españolas de agosto de 1969 se pueden ver en VAUGHAN (1971) en Santa Pola (Alicante), con 2 individuos. Otras más meridionales, también de agosto, son recuperaciones en Cádiz y Lanzarote, BERNIS (1966).
29

ALGUNOS DATOS SOBRE NIDIFICACION
Aunque el trabajo ha sido orientado más hacia la variedad de la avifauna y en especial la presencia estival de algunas de ellas, se han recogido sólo unos pocos datos de reproducción de algunas de ellas ya que los meses de abril y mayo, que son clave para los estudios de esta índole no se han podido visitar.
Las especies cuya nldificación se ha comprobado han sido 3:
De Phoenicopterus ruber(L.) se observaron 5 pollos, que aún no volaban bien, el 4-IX-1979. Además tenemos datos del día 25-VII-1977 con 3 inmaduros y también el 19-VIII se vieron inmaduros aunque no se anotó su número, pero era bajo.
Aunque no se ha comprobado materialmente la nidificación, la presencia de inmaduros en fechas tempranas como en julio nos lleva a asegurar que nidifican aunque en pequeña cantidad ya que de otro modo no se podría explicar la presencia aquí de estas aves. Por otra parte la observación de jóvenes que aún no volaban bien apoyan esta aseveración.
Charadrius alexandrinus L. (Chorlitejo patlnegro)
El 20-VI-1978 se vieron varias parejas con actitudes reproductoras en la Bocana y observándose 3 pollos que aún no volaban.
Himantopus himantopus L. (Cigüeñuela)
El 4-IX-1979 se vio un pollo volantón en Karia-Arkeman. En años anteriores ya se había visto una conducta reproductora que hizo sospechar su nidificación.
Sterna hirundo L. (Charrán común)
A finales de junio de 1978 se capturó un pollo que seguidamente se puso en libertad.
RESUMEN Y CONCLUSIONES
En nuestras observaciones se ve que a partir de julio, aumenta la población, debido al incremento sufrido como consecuencia de la reproducción y que se verá aumentada con la llegada de los invernantes especialmente a partir de octubre.
En enero comienza un descenso brusco, debido a la disminución de Fúlica atra y que prosigue con la partida de los nidificantes septentrionales, hasta llegar a junio que registra las cifras más bajas del año. Algunos de estos típicos nidificantes dejan algunos individuos en esta zona, destacando entre ellos: Haematopus ostra-legus, Numenius arquatus, Limosa limosa, Tringa totánus, T. hypo-leucos y Arenaria interpres.
30

En total se han encontrado 32 especies diferentes de aves acuáticas, observándose la máxima variedad desde diciembre a marzo. La mayor abundancia ha correspondido a los mismos meses con cifras superiores a los 4.000 individuos en enero e inferiores a los 500 en julio de 1977.
Los Laro-limícolos son los que aportan mayor variedad con un total de 20 especies diferentes, de las que 15 corresponden a Limí-colas y 5 a Láridos. De los primeros, destacan por su número: Cha-radrius alexandrinus, Limosa limosa, Tringa totanus, T. hypoleu-cós, Calidris canutus e Himantopus himantopus; de los segundos: Larus argentatus y L. ridibundus.
Finalmente las especies más abundantes, en orden numérico decreciente fueron: Fúlica atra, Anas penélope, Larus argentatus, L. ridibundus y Phoenicopterus ruber.
31

RESUMEN
Durante 1978 y 1979 se hizo una serie de observaciones sobre aves acuáticas en la Mar Chica (Melilla).
En conjunto se contaron 32 especies diferentes, siendo la más abundante: Charadríus alexandrinus, Limosa limosa, Tringa tota-ñus y T. hypoleucos. Algunas de ellas, así como Haematopus ostra-legus y Arenaria interpres dejan algunos individuos en época invernal.
La especie más abundante fue Fúlica atra, con más de 2.000 individuos en enero.
SUMMARY
Some observations on waterfowl in the Mar Chica (Melilla) du-ring 1978 and 1979, was made.
32 different species has been seen, being the four more abun-dant: Charadrius alexandrinus, Limosa limosa, Tringa totanus and T. hypoleucos. A few of them, as well as some Haematopus ostrale-gus and Arenaria interpres remain in winter season.
The most abundant species was Fúlica atra, with more than 2.000 specimens in january.
32

BIBLIOGRAFÍA
BERNIS, F. (1966): Aves migradoras ibéricas. Fascículo 4.°, 503-705. Ed. S.E.O. Madrid.
ETCHECOPAR, R.D. & HÜE, F., (1964): Les Oiseaux du Nord de L'Afrique. Ed. N. Bou-bée y Cié. 606 pag. París.
JUANA, E. de, (1976): Nuevos datos de invierno sobre aves de Marruecos. Ardeola, Vol. 23: 49-62.
VALVERDE, J.A., (1955): Aves de Marruecos español en Julio. Ardeola, Vol. II, n.° 1:87-114.
(1956): Aves de Marruecos español en Julio. Ardeola, Vol. II, n.° 2: 213-240.
VÁUGHAN, R., (1971): Nota sobre aves acuáticas observadas en las salinas de Santa Pola (Alicante), 20-30 de agosto 1969. Ardeola, Vol. 15: 94.
33


Mediterránea, 5 - Págs. (35 - 41), Año 1981
SOBRE LA INFLUENCIA ATLÁNTICA EN LA FLORA DE LA SIERRA DE MIRA
(CUENCA, ESPAÑA)
Por Gonzalo Mateo Departamento de Botánica.
Fac. Ciencias Biológicas. Universidad de Valencia.
La Sierra de Mira es un sistema montañoso que comienza en las elevaciones situadas entre Camporrobles y Mira, en el límite de las provincias de Valencia y Cuenca; sigue en dirección al NE. a través de una línea de crestas con altitudes entre 1.200 y 14.40 m., y acaba en el valle del Turia, entre los términos de Tuéjar y Aras de Al-puente.
En ella se aprecia una gran riqueza y variabilidad en cuanto a flora y vegetación, gracias a reunirse allí varios factores entre los que destacan:
— Una situación geográfica puente entre dos regiones naturales, tan peculiares y diferenciadas, como son la meseta ibérica y el litoral levantino. Lo cual se concreta corológicamente en ser la frontera entre las provincias Castellano-Maestrazgo-Manchega y Valenciano-Catalano-Provenzal-Balear. (Rivas-Martínez, 1973).
— Una gran variabilidad de sustratos geológicos, desde cuarcitas paleozoicas hasta llanuras cuaternarias de aluvión pasando por importantes masas de areniscas y conglomerados triásicos, calizas jurásicas y cretácicas y diversas rocas sedimentarias terciarias.
Dentro de la variada gama de condiciones ecológicas así originadas algunas de ellas tienden a favorecer el desarrollo de las especies y comunidades de óptimo atlántico o subatlántico; principalmente las siguientes:
1°.—La presencia de montañas de elevación relativamente im-
35

portante (Pelado 1.422 m., Mazmorra 1.411, Ranera 1.430), a una distancia de 90-95 kms. del mar, sin que se presente ninguna otra sierra más elevada de por medio.
2°.—La gran superficie cubierta por sustrato silícico, principalmente areniscas y conglomerados triásicos, así como cuarcitas or-dovícicas y sedimentos arenosos cuaternarios producto de la disgregación de las anteriores rocas. Todos ellos originadores de suelos con mucha mayor capacidad de retención de agua que los calizos.
3°.—Las precipitaciones recibidas, bastante más elevadas que las de los llanos periféricos a la sierra, pues superan ios 600 mm. en las áreas de mediana elevación, y alcanzan los 700-800 mm. en las más elevadas; siendo siempre la sequía estival no demasiado acusada; por lo que podemos calificar su bioclima de subhúmedo. (Rivas-Martínez, 1979).
Dentro de las múltiples especies concretas, de carácter en alguna medida atlántico, que se presentan, vamos a elegir y comentar algunas de las más representativas; aclarando que tomamos el concepto de atlánticas en su sentido más amplio, y sin matizar subdivisiones del elemento, por otro lado sujetas a constante revisión a medida que avanzan los conocimientos sobre las áreas de las especies y, por tanto, muy discutibles y no aceptadas de un modo unificado por los especialistas.
Podemos, sin embargo, afirmar que están ausentes los elementos euatlánticos, en sentido restringido (Dupont, 1962) exclusivos de la provincia Atlántica; por lo que los táxones que alcanzan esta zona son e lementos s u b a t l á n t i c o s , a t l án t i co -med i te r ráneos , subatlántico-submediterráneos, etc.
Quercus pyrenaica Willd. : Genuino representante de la flora iberoatlántica, con óptimo en las montañas mediterráneas sometidas a mayor influencia atlántica. Resulta relativamente abundante en esta sierra, en localidades protegidaá de las montañas silícicas; a donde llega, como puede apreciarse en el mapa (fig. 1.a) por vía ibérica, alcanzando allí uno de sus límites en cuanto a penetración en territorio mediterráneo.
Cytisus scoparius (L.) Link.: Más extendido que el anterior por la provincia atlántica, resulta igualmente abundante por el territorio iberoatlántico, presentando un areal similar en la península ibérica, y alcanzando de modo finícola los rodenos de la sierra de Mira.
Viola rivinlana Reichenb. : De área más amplia en Europa, se comporta en la península como iberoatlántica. Presente en las umbrías más frescas de nuestra sierra, en el área potencial del melojar.
Carum verticillatum (L.) Koch : Especie de acentuado matiz
36

d
^
m
-a w.
o Q> >—
<
ai "~
D) Ü_
a o
o c <D v_ > N
Q.
en D O
d;
!CIX
>(E) ICD
d)(
•(D
O
37

atlántico, relativamente frecuente en esta zona, donde se refugia en los juncales de MOLINIETALIA y HOLOSCHOENETALIA sobre suelos más húmedos.
Erica cinérea L: Quizá la especie más claramente atlántica de las encontradas en la zona. Común en los brezales de la gran provincia atlántica, desde Portugal a las costas del mar del Norte; penetra en el Pirineo occidental (Villar, 1980), en algunas áreas mediterráneas del sur de Francia (Aubert, Barbero & Loisel, 1971), en Cataluña (Font Quer 1949, O. de Bolos 1951) y el macizo Ibérico. Dentro de éste resulta abundante en las sierras de la Demanda y Urbión (Vicioso, 1941), con mayor influencia atlántica; de donde pasa a la rama noro-riental del Sistema Central (S.a de Ayllón, Mayor 1964) y a la Serranía de Cuenca (G. López, 1976), alcanzando su límite en el territorio que estamos considerando (Fig. 2.a).
Calluna vulgaris (L) Salisb.: Como la anterior, tiene su óptimo en los brezales atlánticos, aunque su área es amplia y mayor su penetración en territorio mediterráneo. Muy abundante en esta sierra, donde interviene en gran número de comunidades silicícolas de brezal, jaral, pinar, etc.
Anagallis tenella L: Especie ya conocida de áreas iberolevanti-nas, en concreto del valle del Júcar (Rivas Goday & Mansanet, 1972), donde se asocia con Erica erigena R. Ross sobre suelos permanentemente húmedos. En la sierra de Mira aparece en márgenes de arroyos de montaña, en comunidades de MOLINIO-HOLOSCHOENION en transición hacia las de MONTIO CARDAMI-NETEA.
Littorella uniflora (L) Asch.: Casi desconocida en las áreas mediterráneas peninsulares. Se presenta en esta zona en una laguna próxima a Sinarcas, en comunidades fragmentarias de LITTORE-LLETEA, pertenecientes a la alianza Eleocharition multicaulis.
Campánula lusitanica L: Especie de óptimo iberoatlántico, común en los pastizales terofíticos silicícolas de la mitad oeste de la península, que encuentran en estas montañas su límite oriental.
Jasione crispa (Pourret) Sampaio subsp. sesslliflora (Boiss. & Reuter) Rivas-Martínez: Especie propia de la subprovincia cántabro-atlántica, que penetra discretamente en territorio mediterráneo, a través de algunas de sus subespecies, como la presente.
Narcissus pseudonarcissus L: Especie de importantes requerimientos hídricos, con óptimo en áreas atlánticas, escasamente representada en área mediterránea; siendo ésta, pese a presentarse abundantemente en ella, una de sus localidades extremas.
Danthonia decumbens (L) DC: Frecuente en los pastizales húmedos atlánticos y medioeuropeos, alcanza en esta zona uno de sus límites en cuanto a penetración en territorio mediterráneo.
38

Q
cu • o
, d <u \_ <
Ol CM
Ó) \L
a Q) i _
<D C O
O o
' l _
Lü
39

Anthoxanthum amarum Brot.: Interesante especie, considerada en el reciente último tomo de Flora Europea como endémica del NW ibérico, pero que llega a alcanzar la provincia de Valencia por las umbrías de las montañas silícicas de la sierra de Mira; presentándose en los herbazales densos de los claros de bosque.
Eleocharis aclcularis (L.) Roemer & Schultes y E. multicaulis (Sm.) Desv.: Estas dos pequeñas ciperáceas de óptimo atlántico, casi desconocidas en área mediterránea ibérica, se presentan bastante localizadas, sobre suelos inundados casi todo el año, en comunidades de Eleocharition multicaulis.
40

BIBLIOGRAFÍA COMENTADA EN EL TEXTO.
AUBERT, G.; M. BARBERO & R. LOISEL (1971). Les callunaies dans le sud-est de la France et le nord-ouest de l'ltalie. Bull. Soc. Bot. Fr. 118: 679-700.
BOLOS, O. de (1951). El elemento fitogeográfico eurosiberiano en las sierras litorales catalanas. Collec. Bot. III: 1-41.
DUPONT, P. (1962). La Flore atlantique européenne. Introduction á l'étude du secteur Ibero-Atlantique. Doc. Cart. Pr. Veg., Fac. Sciences, Toulouse.
FONT QUER, P. (1949). Acerca de la presencia de algunas plantas atlánticas y suba-tlánticas en Cataluña. Portugalia Acta Biol. ser. B: 87-96.
LÓPEZ, G. (1976). Contribución al conocimiento fitosociológico de la Serranía de Cuenca. I. Anal. Inst. Bot. Cav. 33: 5-87.
MAYOR, M. (1964). Especies pirenaicas en el tramo oriental del Sistema Central. Anal. Inst. Bot. Cav. 22: 409-420.
RIVAS GODAY, S. & J. MANSANET (1972). Acerca del comportamiento edáfico de la Erica mediterránea (hibernica) en España. Anal. R. Acad. Farm. 38: 95-106.
RIVAS-MARTINEZ, S. (1973). Avance sobre una síntesis corológica de la Península Ibérica, Baleares y Canarias. Anal. Inst. Bot. Cav. 30: 69-87.
(1979). Brezales y jarales de Europa occidental (Revisión fítosociológica de las clases Calluno-Ulicetea y Cisto-Lavanduletea). Lazaroa 1: 5-127.
VICIOSO, C. (1941). Materiales para el estudio de la flora soriana. Anal. Jard. Bot. Madrid 2: 188-236.
VILLAR, L (1980). Catálogo florístico del Pirineo occidental español. P. Cent. Pir. Biol. Exp. n.° 11, Jaca.
RESUMEN
A consecuencia de reunirse una serie de factores climáticos, topográficos y geológicos particulares, se presentan en la sierra de Mira, limítrofe entre las provincias dé Cuenca y Valencia, una serie de especies vegetales son marcada influencia atlántica, cuyas peculiaridades se comentan brevemente.
4 1


Mediterránea, 5 - Págs. (43 - 66), Año 1981
QUIRONÓMIDOS DE CATALUNYA. (2.a NOTA)
Por Narcis Prat1
INTRODUCCIÓN
En trabajos anteriores hemos señalado la falta de estudios sobre los insectos acuáticos en nuestro país y en particular sobre los qulronómidos (PRAT, 1977; 1979). Después de una primera nota sobre algunos quironómidos recolectados en Cataluña (PRAT, 1977), en el presente trabajo se citan 35 especies de las cuales 16 son nuevas para la fauna española con lo que hasta el momento se elevan a 147 las especies de quironómidos citadas en España, cifra aún escasa si comparamos con las 448 de Inglaterra (PINDER, 1978) o las 1.404 conocidas en Europa (FITTKAU & REISS, 1978).
El material recolectado procede de diferentes localidades de Cataluña que se indican en la TABLA I y se reflejan en el mapa de la FIG. 1. Entre las recolecciones hay muchos tipos de habitats diferentes, desde lagos de montaña, pasando por ríos y algunos lagos o estanques de la zona baja del país, hasta lagunas litorales y salinas. He de agradecer a algunos colegas la recogida de gran parte del material. L Campas y J.M. Vilaseca me proporcionaron el material de los lagos de montaña, C. Cornet y M.A. Bibiloni el del río Ter en Set-cases, J. Sanz el de los «estanys de Sant Miquel de Campmajor», J. Gosálbez y X. Ferrer el referente al delta del Ebro y J. Fernández y T. Yélamos el de las salinas de Cubelles.
(1) Departamento de Ecología. Fac. Biología. Universidad de Barcelona. Gran Via, 585. Barcelona.
43

TABLA I
Localidades de recolección de quironómidos.
Lagos de montaña: Llac Llong (Lleida). 13.VIII.1975. altitud: 2.000 m. Llac Redó (Lleida). 2.VII.1975. altitud: 2.1000 m.
Otros lagos: Llac de Banyoles (Gerona), sin fecha, alt.: 175 m. Estanys de San Miquel de Campmajor (Gerona), Estany de Colomers i Negre Gran. 27.X.1975 y 5.X.1975. altitud: 200 m.
Ríos y rieras: Afluente lateral al Ter en Setcases (Gerona) (obtenidos por eclosión en el laboratorio), alt.: 1.270 metros. Riera de Gualba en Sta. Fe del Montseny (Barcelona). Abril de 1976. alt.: 1.000 m. Riera de Osor en Osor (Gerona). 6.111.1971. alt.: 310 metros. Riera de Sta. Coloma en Anglés (Gerona). 29.1.1975. alt.: 220 m. Río Ebro en Aseó (Tarragona). Julio de 1978. alt.: 100 metros.
Lagunas del litoral y salinas. El Remolar (Barcelona). 11.IV.1978,
Cubelles (Barcelona). Febrero y marzo de 1976. Delta del Ebro (Tarragona):
L 'Encanyissada. 30.X.1975. 22.X.1976. 30.X.1976. 6.VI.1978. La Tancada. 6.VI.1976. Sant. Caries de la Rápita. 6.VI.1976. Salines de Sant Antoni. 6.VI.1976.
44

FIG. 1.—Situación de las localidades de muestreo. 1. Lagos Pirenaicos, Llong i Redó. 2. Río Ter en Setcases. 3. Estanys de Campmajor (Banyoles) y lago de Banyo-
les. 4. Riera de Santa Coloma en Anglés (Gerona). 5. Riera de Osor en Osor (Gerona). 6. Sta. Fe del Montseny. 7. El Remolar (desembocadura del Llobregat en
Barcelona. 8. Salinas de Cubelles (Barcelona). 9. Río Ebro en Aseó (Tarragona).
10. La Tancada. 11. L'Encanyissada. 12. Salinas de San Antonio. 13. Sant Caries de la Rápita (Tarragona).
i r

Los métodos de recoleción, preservación, preparación y examen del material han sido recientemente descritos en otro trabajo (PRAT, 1979). Para cada especie se indica: sinonimia si procede, el material recolectado, las características sistemáticas diferenciales y su distribución y ecología.
CATALOGO DE ESPECIES.
Sub-familia Tanypodinae
Psectrotanypus varius (Fab.) 1787 Material estudiado: Sta. Fe del Montseny. Abril 1976. 1 c y 4 9 9-
Long. ala: 3,38 mm. LRi = 0,65. (n = 1).
Es la única especie europea del género y se caracteriza por sus manchas alares (FITTKAU, 1962; fig. 59). En nuestro material el color del cuerpo es similar. En el hipopigo el terguito IX no tiene sedas y el estilo no es tan largo como describe el autor citado. Distribución y ecología. Especie holártica (FITTKAU, 1962) citada anteriormente de nuestro país en la provincia de Granada (LAVILLE, 1970).
Especie más propia de aguas estancadas (SHILOVA, 1976) aunque también puede encontrarse en ríos (LINDEGAARD, 1972) y puede resistir un cierto grado de anoxia (TOÜRENQ, 1975). Nosotros capturamos algunas pupas (que eclosionaron en el laboratorio) entre la hojarasca del litoral del pequeño embalse de Sta. Fe del Montseny (Barcelona).
Zavrelimyia barbatipes (Kieffer) 1911. Mat. est : Riera de Santa Coloma en Anglés (Gerona). 1 o- y 2
9 9(material obtenido por eclosión de pupas capturadas en 29.I.75). AR= 1,9; LRi = 0,67(n = 1).
La diferenciación específica se basa en la localización de las manchas alares (FIG. 2). (FITTKAU, 1962, fig. 238a; GOETGUEBUER, 1936, fig. 17 sub. Ablabesmyia). Distribución y ecología. Especie presente en Europa central extendiéndose hasta los Pirineos e Inglaterra (FITTKAU & REISS, 1978). Nueva para España.
Propia de ríos y torrentes con poca corriente y con detritus (LINDEGAARD, 1972; LEHMANN, 1971) donde normalmente no es muy abundante (LAVILLE & LAVAN DI ER, 1977). Nuestras pupas fueron capturadas en un torrente de aguas frías y limpias.
46

FIG. 2.—Ala y manchas alares de Zavrelimyia hirtimana (dibujo de M.A. Puig).
Zavrelimyia hirtimana (Kieffer) 1918 Mat. est.: Estany de Colomers (Sant Miquel de Campmajor,Gerona).
27.X.1975. 1 9 (leg. J. Sanz).
La característica sistemática diferencial de esta especie es la falta de la mancha proximal en el ala (FIG. 3). (FITTKAU, 1962, fig.238b). Distribución y ecología. Europa central, Fennoscandia, Francia e Inglaterra (FITTKAU & REISS, 1978). Nueva para España.
Según FITTKAU (loe. cit.) vive en aguas temporales de inundación. El «estany de Colomers» sufre fuertes fluctuaciones en el nivel de sus aguas aunque no llega a secarse.
FIG. 3.—Ala de Zavrelimyia barbatipes (dibujo de M.A. Puig).
47

Sub-familia Orthocladiinae.
Halocladius (Halocladius) varians (Staeger) 1839 Mat. est.: Salines de Cubelles (Barcelona). 28.11.1976: 8 o-o- y 1 9
(leg. J. Fernández y T. Yélamos). Delta del Ebro: La Marquesa 1 o*. Isla de Buda, 5 o-o* (leg. J. Sanz, sin fecha). San Carlos de la Rápita. 6.VI.T976. 2 crcr (leg. J. Gosálbez).
Nuevas capturas de una especie ya citada anteriormente por nosotros del Delta del Ebro (PRAT, 1977) que confirman la presencia habitual y abundante de este qulronómido en medios halobiontes (TOUTENQ, 1975).
Abundante en todas las costas europeas llegando hasta las Azores. Citada anteriormente de España sub. Cricotopus vitripennis var. halophilus (HIRVENJOVA, 1973).
Cricotopus (Isocladius) ornatus (Meigen) 1818. Mat. est.: Llac de Banyoles, 1 9 (sin fecha).
El número de sedas dorso-laterales se encuentra aún más reducido que en los ejemplares capturados en los embalses españoles (PRAT, 1979).
Especie de amplia distribución paleártica (HIRVENJOVA, 1973). Capturada en Canarias (STORA, 1936) y también en un embalse cercano a Sevilla (PRAT, 1979). Eurihalina y halobionte (HIRVENJOVA, loe. cit.).
Cricotopus (Isocladius) sylvestris (Fab.) 1749. Mat. est.: Sta. Fe del Montseny. Abril. 1976. 2 crcr. Remolar
11.IV.1978, 5 crcr y 4 9 9 - Sant Caries de la Rápita. 6.VI.1976. 7 o-o- y 3 9 9 (leg. J. Gosálbez).
Muy variable en sus características morfológicas principalmente en sus rasgos de coloración (PRAT, 1979).
Señalada de toda la región holártica, de Formosa y Java (HIRVENJOVA, 1973). Se conoce de diversos lugares de la península y Cataluña así como de Canarias (STORA, 1936; PRAT, 1977; 1979). Especie euritópica que vive desde los lagos de alta montaña hasta zonas de agua salobre o sobre plantaciones de arroz.
Cricotopus (Isocladius) trifasciatus (Panzer) 1809. Mat. est.: L'Encanyissada. 6.VI.1978. 29 c e y 13 9 9 (leg. X. Fe
rrer). AR= 1,32-1,57; LR1 = 0,52-0,57; sedas sc t= 8; sedas Ib =8-14; long. del a la= 1,79-2,11. (n = 3).
Esta especie se caracteriza por la presencia de sedas np en el tórax (3 en nuestros ejemplares), por su metatarso anterior completamente oscuro y por la mancha triangular que existe en el centro
48

del cuarto segmento abdominal. En una de las hembras se contaron 28 sedas Sz en la primera pata. (Nomenclatura de HIRVENJOVA, 1973). Nuestros ejemplares corresponden por el tamaño del ala a la «kleinere form» de HIRVENJOVA (loe. cit.) Distribución y ecología. Especie presente en toda Europa, en América del Norte y en Java. Anteriormente la habíamos citado del río Ter (PRAT, 1977).
Algunos autores la consideran minadora de plantas acuáticas principalmente Potamogetón (THIENEMANN, 1950), aunque también se ha encontrado en forma libre (LINDEGAARD, 1972). En L'En-canyissada se recogió material sobre Potamogetón pectinatus.
Eukiefferiella bavarica Goetghebuer, 1934 Mat. est.: Setcases (Gerona). 1 o\ (Eclosión en laboratorio), leg. C.
Cornet y M.A. Bibiloni). long. a la= 1,23; AR= 0,44.
Hipopiglo con punta anal (FIG. 4B) y con la presencia de la vena r 2 + 3 en las alas. Se distingue de las especies próximas £. calves-cens y E. discoloripes por la forma puntiaguda de su antena (FIG. 4C); el bajo valor de AR y el lóbulo del hipopigio más alargado que en E. calvescens (FIG. 4B comparar con fig. 14 en PRAT, 1979).
B A C - 50 JJ
FIG. 4.—Eukiefferiella bavarica. A: hipopigio, visión dorsal. B: apódenlas internos. C: porción distal de la antena.
49

Distribución y ecología. Especie de centro-Europa (LEHMANN, 1972) encontrada recientemente en los Pirineos (LAVILLE & LAVAN-DIER, 1977). Especie nueva para la fauna española.
Como todas las especies de este género propia de ríos, en lugares con fuerte corriente, sobre las piedras y entre los musgos (LEHMANN, 1972).
FIG. 5.—Eukiefferiella brevicalcar. A: hipopigio (visión dorsal). B: porción distal de la antena.
Eukiefferiella brevicalcar (Kieffer) 1911 Mat. est.: Osor (Gerona). 6.111.1971. 2 c e
long. a la= 1,93-1,95; AR= 0,62-0.63. (n = 2).
Hipopigio sin punta anal y con lóbulo basal digitiforme (FIG. 5A). Parte del final de la antena puntiaguda (FIG. 5B). Se distingue por su tamaño y por el valor del AR de la especie próxima E. tyrolen-sis. Nuestros ejemplares se sitúan por su tamaño en el límite inferior de la especie según las medidas de LEHMANN (1971).
50

Distribución y ecología. Especie de centro y norte-Europa no citada hasta el momento en los Pirineos (LEHMANN, 1972). Nueva para España. Vive en ríos tanto entre los musgos como entre el sedimento. También en fuentes.
Eukiefferiella calvescens Edwards 1929 Mat. est.: Osor (Gerona). 6.111.1971. 3 ccr .
AR= 0,74; long. ala = 1,88 (n = 1).
Se caracteriza por su lóbulo anal poco desarrollado y por el valor bajo del AR (LEHMANN, 1972; PRAT, 1979). Distribución y ecología. Especie Europea (LEHMANN, 1972). En España la hemos citado anteriormente del Ter (PRAT, 1977) y de un embalse en Asturias (PRAT, 1979).
La larva vive en ríos y torrentes tanto en alta montaña (LAVILLE & LAVANDIER, 1977) como en zonas bajas (LAVILLE, 1979). Entre la costra algar de las piedras o entre los musgos (LAVILLE & LAVANDIER, loe. cit., LEHMANN, 1972). Es un componente habitual de los elementos de la deriva en los ríos, así es abundante en el Ter como en otros ríos (WILSON, 1977; LAVILLE, 1979).
Rheocricotopus fuscipes Kieffer 1909 sinonimia: fíh. dispar Goetgh. 1913 (FITTKAU & REISS, 1968). Mat. est.: Osor. 6.111.1971. Acrcr. Sta. Fe del Montseny. 27.111.1976.1 O".
AR= 1,3 (Sta. Fe); long. a la= 2,16 mm. (Sta. Fe); 2,44-2,66 mm. (Osor), (n = 2).
Es muy importante en este género la forma de un apéndice interno («Third claspette») rectangular en esta especie (FIG. 6A). En el ditistilo no existe «crista dorsalis» (FIGS. 6A y 6B)(LEHMANN, 1969). En la muestra de Sta. Fe se obtuvo también una exuvia pupal que presentaba las características de Rh. dispar (LEHMANN, 1969) con un «shagreen» en el segmento III algo más extendido y un lóbulo anal con 31 filamentos (21-27 en LEHMANN, loe. cit.). Distribución y ecología. Europa central, Suecia y Finlandia (LEHMANN, 1969). Inglaterra (WILSON, 1977; PINDER, 1978). Nueva para España.
Propia de ríos con corriente, entre piedras o plantas acuáticas. Las pupas son una de las especies acompañantes en los ríos ingleses (WILSON, 1977).
51

FIG. 6.—Rheocricotopus fuscipes. Hipopigio. A: visión dorsal. B: apodémas internos.
•?rr//y/. • >/, •' >/////#/>
c
FIG. 7.— Rheocricotopus fove-atus. A y B: hipopigio, visión dorsal y apode-mas internos. C: segmento II del abdomen. Quetotaxia.
52

Rheocricotopus foveatus Edwards 1929 sinonimia: Rh. gallicus (in LIMNOFAUNA EUROPEA, FITTKAU & REISS, 1978). Mat. est.: Sta. Fe del Montseny. 27.111.1976. 1 o-.
AR= 1,1; long. ala = 2,38. Color más claro
Esta especie se diferencia por una vena costal alargada aunque en nuestro ejemplar lo era en menor grado que en LEHMANN (1969, fig. 17a), el lóbulo anal del ala reducido es también característico y ello la diferencia de las especies próximas Rh. tyrolensis y Rh. gallicus ya que las características del hipopigio son similares en las tres especies (FIG. 7 A,B). Nuestro ejemplar presentaba una disposición diferente de las sedas en el segmento II que ia dada por LEHMANN (1969), (FIG. 7C). Distribución y ecología. Alemania, Rumania y Francia (LEHMANN, 1969), Inglaterra (PINDER, 1978). Nueva para España.
Especie propia de ríos. En el río Lot (Francia; LAVILLE, 1979) se encuentra de manera poco abundante entre las recolecciones de pupas.
Bryophaenoclaudius illimbatus Edwards, 1929. sinonimia: B. flexidens (in LIMNOFAUNA EUROPEA, FITTKAU & REISS, 1978). Mat. est.: Estany de Colomers (Sant Miquel de Campmajor).
5.X.1975. 1 o- (leg. J. Sanz). AR= 1,72; long. a la= 1,35 mm.; LRi= 0,58.
Esta especie viene definida por la forma de su hipopigio y encaja muy bien en la clave de clasificación de PINDER (1978). Su punta anal es redondeada y corta con 7 sedas en su base. En el gonocoxi-to existe sólo un lóbulo basal redondeado con 9 sedas más grandes (FIG. 8). B. femineus tiene un hipopigio similar pero es más grande (long. ala= 2,7) y tiene un AR menor (0,7) lo que distingue a las dos especies (PINDER, 1978). Distribución y ecología. Conocida sólo de Inglaterra y de los Cárpatos. Nueva en España. No hay datos sobre su ecología.
53

FIG. 8.—Bryophaenocladius illimbatus. Hipopigio: visión dorsal y apodemas internos.
Metriocnemus hygropetricus Kieffer 1912 Mat. est.: Sta. Fe del Montseny. Abril de 1976. 1 c r , l 9 .
AR= 1,35; long. a la= 1,91 mm.
Esta especie tiene el hipopigio con un lóbulo basal lo que le distingue de la mayoría de las especies de este género. Es muy semejante a M. hirtimanus del que se distingue solamente por el color de los balancines que son oscuros en esta especie. El falapodema es ancho (LEHMANN, 1971, fig. 20) a diferencia de la forma que tiene en M. hirtimanus (PRAT, 1977). Distribución y ecología. Especie presente en toda Europa. En España estaba citada anteriormente de Sierra Nevada (LAVILLE, 1970).
La larva vive entre musgos en los ríos y puede ser también propia de superficies higropétricas (LINDEGAARD, 1972).
Parametriocnemus stylatus (Kieffer) 1924 Mat. est.: Osor. 6.111.1971. 2 crcr
AR= 0,99-1,01; long. ala = 1,97-2,13.
54

Especie característica por su hipopigio. (BRUNDIN, 1956, fig. 100; PINDER, 1978, fig. 134B). Distribución y ecología. Centro y Norte Europa. Azores. Madeira (REISS, 1968). Inglaterra, Islandia, Francia (LAVILLE, 1972). Encontrada anteriormente cerca del embalse de Susqueda (Gerona)(PRAT, 1977).
Aguas corrientes o tranquilas bien oxigenadas. En las colecciones de pupas de la deriva de los ríos puede ser frecuente durante todo el año (WILSON, 1977; LAVILLE, 1979).
Corynoneura scutellata (Winnertz) 1846 Mat. est.: Llac Llong. 13. VIII.1975. 2 o- c (leg. L Campas y J.M. Vi-
laseca). AR= 1,06; long.a la= 1,35 (n = 1).
Es característica la disposición de los apodemas internos de esta especie (SCHLEE, 1968). También puede diferenciarse por su lóbulo anal del ala poco desarrollados y por la forma puntiaguda del lóbulo del ditistilo (PUNDER, 1978). Distribución y ecología; Especie paleártica que llega hasta los Pirineos (LAVILLE, 1972). No citada anteriormente de España.
Vive sobre plantas acuáticas y musgos (THIENEMANN, 1950), principalmente en las aguas frías y oligotróficas de los lagos (LAVILLE, 1972).
Thienemanniella clavicornis Kieffer, 1911. Mat. est.: Setcases. 1 o\ (pupas eclosionadas en el laboratorio), (leg.
C. Cornet y M.A. Blbiloni). AR= 0,34; long. a la= 1,07 mm.
Antena con 11 segmentos, el último de los cuales tiene una longitud inferior a los 2-3 segmentos que le anteceden (SCHLEE, 1968; PINDER, 1978). Distribución y ecología. Alemania, Bélgica, Inglaterra e Islandia (LEHMANN, 1971). En España habíamos capturado una hembra atrl-buible a este género en el embalse de Velle (Orense)(PRAT, 1979).
Larva que vive en ríos y torrentes de aguas frías y rápidas, lo que concuerda con la localización de las pupas eclosionadas en nuestro laboratorio.
Sub-familia Chironominae
Tribu Chironomini
Chironomus calipterus Kieffer 1908 Mat. est.: L'Encanyissada. 30.X.1976. 150 c e y 1 9 (leg. J. Gosál-bez).
Esta especie se distingue de los demás Chironomus por ser la
55

única que tiene manchas en las alas (LAVILLE & TOURENQ, 1967, fig. 11), aunque éste no sea el carácter diferencial usado en la reciente revisión del género por LINDEBERG & WIEDERHOLM (1979). Nuestros ejemplares eran algo mayores que los descritos en la Ca-marga francesa (TOURENQ, 1975), pues medían hasta 6 mm. de longitud alar. Distribución y ecología. Europa, Israel, Pakistán, Etiopía (TOURENQ, 1975). En España estaba citada del coto Doñana (LAVILLE & TOURENQ, 1967; sub. Ch. hexasticus).
Es una especie eurihalina que coloniza desde medios de agua dulce (canales, arrozales) hasta agua salobre. (TOURENQ, 1975).
Chironomus salinarius Kieffer 1915 Mat. est.: Salinas de Cubelles. 28.11:1976. 6 o-o- y 1 9. íbid.
23.111.1976 51 o- o- y 1 9. íbid. sin fecha. 7 c c (leg. J. Fernández y T. Yélamos). Salinas de San Antonio (Delta del Ebro). 6.VI.1976. 4 o- a (leg. J. Gosálbez). Cubelles. (Febrero). AR= 3,13; LR= 1,39; long. ala.= 3,43 (n = 1). Salinas San Antonio: AR= 3,3; LR= 1,39; BR= 5,95; long. ala.: 2,83 (n = 1).
Esta especie es típica por la configuración de su hipopigio con el apéndice 1 más oscuro y alargado (STRENZKE, 1959; LINDEBERG & WIEDERHOLM, 1979). Aunque por la conformación cromosomáti-ca se pueden distinguir tres especies diferentes dentro de esta misma (MICHAILOVA, 1974), no es posible la diferenciación morfológica de las mismas. Distribución y ecología. Europa hasta el Mar Negro (TOURENQ, 1975). Nueva para la fauna española.
Halófila y halobionte, puede vivir en aguas sobresaturadas de sal y resistir la desecación. Larvas del tipo Ch. gr. salinarius eran muy frecuentes en diferentes charcas de las salinas de Cubelles.
Chironomus riparius Meigen sinonimia: Chironomus thummi (LINDEBERG & WIEDERHOLM, 1979). Mat. est.: Estany de Colomers. 27.X.1975. 2 o-o- y 1 9 (leg. J. Sanz).
long. ala = 2,92 mm.; AR = 3,72; LR = 1,44; BR = 3,5 (n = 1).
Aunque es difícil separar las diferentes especies del grupo thummi (LINDEBERG & WIEDERHOLM) nuestros ejemplares son muy similares a la descripción de esta especie efectuada por STRENZKE (1959). Distribución y ecología. Europa (TOURENQ, 1975). Citada de las marismas del Guadalquivir (LAVILLE & TOURENQ, 1968).
56

Propia de lugares con agua estancada, tolerando aguas muy contaminadas e incluso habita en ios desagües de las depuradoras.
Cryptochironomus supplicans (Meigen) 1850 Mat. est.: L'Encanyissada. 30.X.1976. 1 o- (leg. J. Gosálbez).
long. ala= 3,9 mm.; AR= 3,4.
Esta especie es característica por su estilo sesgado (FIG. 9A) y su punta anal que se ensancha hacia el final así como por la presencia de tubérculos frontales en la cabeza (PINDER, 1978). Distribución y ecología. Europa central, Inglaterra y Fennoscandia (FITTKAU & REISS, 1978) llegando a Rusia e Irak (TOURENQ, 1975). Nueva para España.
Especie propia de aguas estancadas tanto dulces como salobres aunque normalmente poco abundante (SANDBERG, 1969; TOURENQ, 1975). También encontrada en embalses (SHILOVA, 1976).
100 p 5 0 P
FIG. 9.—Cryptochironomus supplicans. Hipopigio. A: visión dorsal. B: apéndice 1. C: detalle de la porción inferior del apéndice 1.
57

Dicrotendipes peringueyanus Kieffer, 1924. Mat. est.: L'Encanyissada. 22.X.1976. 104 ero- y 1 9 (leg. J. Gosál-bez).
Especie muy característica por sus manchas alares y la forma de su hipopigio (FREEMAN, 1957). Distribución y ecología. Citada del centro de África (FREEMAN, 1957) y de la Carharga francesa (TOURENQ, 1975) así como del norte de África (REISS, 1977).
En la Camarga vive en aguas poco saladas invadidas por la vegetación.
Pagastiella orophila Edwards, 1929 Mat. est.: Llac Llong. 13.VIII.1975. 4 ero- y 3 9 9 (leg. L Campas &
J.M. Vilaseca). long.ala.= 1,58-1,61 mm.; AR= 1,39-1,57; LR = 1,03 (n = 2).
Género de conformación alar e hipopigio muy característicos (EDWARDS, 1929; BRUNDIN, 1949). Distribución y ecología. Centro Europa, Inglaterra, Suecia, Italia y los Pirineos franceses (LAVILLE, 1972). Nueva para España.
Propia de lagos y embalses de aguas frías (LAVILLE, 1972; SHI-LOVA, 1976). En los lagos pirenaicos franceses vive sobre Potamogetón praelongus.
Parachironomus arcuatus Goetghebuer, 1919 Mat. est.: L'Encanyissada. 30.X.1975. 9 o-o- (leg. J. Gosálbez). Aseó
(río Ebro), 1 pupa o\ Julio, 1978. long. ala. = 2,64; AR = 2,76 (n = 1).
Especie muy característica por la longitud del apéndice 1 que sólo llega a la base del ditistilo (FIG. 10)(LEHMANN, 1970). Distribución y ecología. Especie repartida por toda Europa (REISS, 1968). Nueva para España.
Especie propia de ríos y del litoral de los lagos y embalses así como en las charcas de la Camarga francesa, donde realiza galerías dentro de los tallos de Potamogetón (LEHMANN, 1970; SHILOVA, 1976; TOURENQ, 1975).
Nosotros la hemos encontrado asociada a la vegetación sobre las piedras del río Ebro en Aseó, así como en las lagunas litorales del Ebro en su desembocadura.
58

FIG. AO.—Parachironomus arcuatus. A: hipopigio, visión dorsal y apodemas internos. B: detalle del apéndice 1.
59

Pentapedilum sordens (v.d. Wulp) 1874 Mat. est.: Estany de Colomers. XI.1975.1 a (eclosión en laboratorio),
(leg. J. Sanz). iong. ala.= 1,98 mm.; AR= 1,87; LR= 1,22.
Especie que se distingue por su ditistilo corto y ancho así como por la seda lateral del apéndice.1 (PINDER, 1978, fig. 165D). Distribución y ecología. Europa y U.S.A. (REISS, 1968). Anteriormente la habíamos encontrado en el lago de Estanya (Lleida) (PRAT, 1977).
Habita preferentemente la zona litoral de los lagos (REISS, 1968; SANDBERG, 1969; SHILOVA, 1976).
Polypedilum convictum (Walker) 1856 Mat. est.: Sta. Fe del Montseny. 1.X.1975. 1 c .
El hipopigio de esta especie es muy característico (PRAT, en prensa; PINDER, 1974, fig. 3a). Distribución y ecología. Europa y América del Norte (LEHMANN, 1971). Anteriormente lo habíamos encontrado en un embalse de Galicia (PRAT, en prensa).
Especie propia de ríos donde puede construir pequeñas galerías con granos de arena (LEHMANN, 1971; PINDER, 1974; LINDEGAARD-PETERSEN, 1972) y también habita en el litoral de lagos (REISS, 1968).
Polypedilum laetum (Meigen) 1818 Mat. est.: Estany de Colomers. 8.XI.1975. 1 9 (leg. J. Sanz).
Color de las alas muy característico. Distribución y ecología. Europa. En España la habíamos encontrado anteriormente en Lleida (PRAT, 1977) y de un embalse de Málaga (PRAT, en prensa).
Especie euritópica tanto de ríos como de aguas estancadas (LEHMANN, 1971). La larva puede'incluso vivir entre las masas de Sphaerotilus (WASSON, 1977).
Polypedilum nubeculosum (Meigen) 1818 Mat. est.: Estany de Colomers. 27.XI.1975. 1 9- Estany Negre (Sant
Miquel de Campmajor) 27.XI.1975. 2 ero- (leg. J. Sanz).
Distribución y ecología. Especie ampliamente distribuida por la región holártica que se conoce en España del coto de Doñana (LAVI-LLE & TOURENQ, 1968) del río Ter en Anglés (Gerona)(PRAT, 1977) y de algunos embalses (PRAT, en prensa).
Es una especie muy frecuente y abundante tanto en ríos como en lagos y embalses, donde se le puede encontrar a cierta profundidad.
60

Sub-familia Tanytarsini
Micropsectra apposita (Walker) 1856. Mat. est.: Sta. Fe del Montseny. 27.111.1976. 6 o-o-.
long. ala.= 2,58-2,8; AR= 1,17-1,2; LR= 1,42-1,54; long. apéndice 2a = 85 mieras. (n = 2).
M. apposita es muy similar a M. contracta incluso en la genitalia masculina (PINDER, 1978) y se diferencian sólo en la hembra y la pupa y por su localización en diferentes medios, ya que la primera (como este caso) es propia de ríos o pequeños lagos en la zona litoral, mientras la segunda se encuentra en las partes profundas de los lagos. Distribución y ecología. Europa. En España citamos bajo este nombre algunos ejemplares del lago de Sanabria (PRAT, en prensa) aunque podría tratarse de M. contracta.
Vive en aguas frías y fluyentes a diferencia de M. contracta que como se ha señalado anteriormente es propia de lagos profundos.
Paratanytarsus confusus Palmen 1960 Mat. est.: Estany de Colomers. X.1975. 1 o- (leg. J. Sanz).
long. ala.= 1,93mm.;AR= 1,19; LR= 1,5. Distribución y ecología. Finlandia, Alemania y Francia (TOURENQ, 1975). Rusia (SHILOVA, 1976). En España: Cataluña (PRAT, 1977) y algunos embalses (PRAT, en prensa).
Especie propia de lagos y embalses e incluso aguas salobres (PALMEN, 1960; LEHMANN, 1971; TOURENQ, 1975; LAVILLE, 1979).
Paratanytarsus handlirschi Goetghebuer, 1931. sinonimia: P. bituberculatus [in: PRAT, (en prensa); PINDER, 1978]. Mat. est.: Estany Negre Gran (Sant Miquel de Campmajor). 8.XI.1975.
1 o* (leg. J. Sanz). long. ala. = 1,82mm.;AR= 1,23.
Este ejemplar presenta como característica el tener sobre los tubérculos del terguio anal solo 1 seda en cada uno (en los embalses poseían dos y hay señalados casos con más sedas). Distribución y ecología. Especie repartida por toda Europa (también sub. P. atrolineatus). En España se conocía anteriormente de los Picos de Europa (sub. Lundstroemia pseudopraecox, LAVILLE, 1972), y la habíamos encontrado en algún embalse (PRAT, en prensa).
Se ha encontrado tanto en ríos como en lagos y embalses, en estos en la zona litoral (REISS, 1968; LEHMANN, 1971; LAVILLE, 1972; SHILOVA, 1976).
Paratanytarsus laetipes (Zett.) 1850 Mat. est.: Estany Negre Gran (San Miquel de Campmajor). 1 o- (eclo-
sionado en el laboratorio)(leg. J. Sanz).
61

long. ala. = 1,52 mm.; AR= 1,18; LR= 1,45; long. apéndice 2a = 36,9 mieras.
Es una especie muy característica por su apéndice 1a sencillo, por el lóbulo del apéndice 2 y por la forma de las láminas del apéndice 2a (FIG. 11). Es una de las especies más pequeñas del género Para tanytarsus.
50 ju
FIG. 11.—Paratanytarsus laetipes. A: visión dorsal del hipopigio. B: apéndice 2a.
62

Distribución y ecología. Suecia, Finlandia, Inglaterra, Holanda, Bélgica, Austria, Alemania y Rumania (REISS, 1968). Nuevo para España.
No se tienen datos sobre la ecología de la especie. El ejemplar que obtuvimos en el laboratorio provenía de una muestra tomada en unos estanques de agua dulce muy alcalina cerca de Banyoles (Gerona). Estos estanques están siempre llenos de agua a pesar de las fluctuaciones del nivel que pueden ocurrir.
Tanytarsus fimbriatus Reiss & Fittkau, 1971 Mat. est.: L'Encanyissada. 6.VI.1978. 1 c (leg. X. Ferrer).
long. ala. = 2,2 mm.; AR= 1,31; LR= 2,02; long. apéndice 2a = 25,6 mieras.
Individuo de color verde (en vivo) con las características manchas oscuras en los segmentos 2-4 del macho. Distribución y ecología. Especie Paleártica que llega hasta Siberia (LAVILLE, 1972). Yugoslavia, Grecia y Argelia (REISS, 1977). Conocida en España de las marismas del Guadalquivir de donde proceden los tipos que sirvieron para describir a la especie (LAVILLE & TOU-RENQ, 1968; REISS & FITTKAU, 1971).
Especie que prefiere aguas salobres (TOURENQ, 1975) y también en fuentes termales (REISS, 1977). El macho fue capturado en el momento de la eclosión sobre una masa de Potamogetón natans.
Tanytarsus lugens (Kieffer) 1916 Mat. est.: Llac redó. 2.VII.1975. 1 cr (leg. Ll. Campás-J.M. Vilaseca).
long. ala.= 2,56 mm.; AR= 1,42; LR= 1,3.
Especie muy similar a T. batophllus (especie encontrada en los embalses, PRAT, en prensa). Se caracteriza por la ausencia del apéndice 1a y por la mayor longitud del segundo palpo maxilar respecto del tercero. Distribución y ecología. Noruega, Suecia, Alemania, Finlandia (REISS & FITTKAU, 1971). No citada en España ni de los Pirineos.
Especie estenotérmica de aguas frías, es una forma relicta glaciar según SANDBERG (1969).
63

CONCLUSIONES
De las 35 especies citadas en este catálogo 16 son nuevas par la fauna española, ello es lógico cuando un grupo sistemático se halla poco estudiado en un país, como es el caso de los quironómidos. Por otra parte la variedad de especies encontradas se debe a la poca superposición de los medios muestreados, es decir, del lugar de procedencia de la muestras. Por ello, la mayoría de las especies se encuentran en uno solo de los puntos de muestreo y no en los otros. Cuando una especie coincide en diferentes lugares de muestreo, se debe a la afinidad de estos lugares en sus condiciones de vida (caso de Ch. salinarius en las salinas de Cubelles y de San Antonio, o de Rheocricotopus fuscipes en Sta. Fe del Montseny y la riera de Osor) o se trata de una especie eurioica (como Crícotopus sylvestris).
SUMMARY
New records of Chironomidae from Catalonia are presented. 35 species are estudied of which 16 are new records to the Spanish fauna. For each species location of sampling site, some morphometric parameters, systematics remarks and comments on their ecology and distribution are made; for some of the species the wings or the hipopigium are figured.
64

BIBLIOGRAFÍA.
BRUNDIN, L. (1949). Chironomiden un andere Bodentiere der schwedischen Urgebir-seen. Ein Beitrag zur kenntnis der bodenfaunistichen Charakterzüge schwedis-cher oligotropher Seen. Rept. Inst. Freshwat. Res. Drottningholm 39: 1-914.
EDWARDS, F.W. (1929). British non-biting midges (Díptera, Chironomidae). Trans. Ent. Soc. London, 77: 279-430.
FITTKAU, E.J. (1962). Die Tanypodinae (Díptera, Chironomidae). Abh. Larvalsist. Inserten. 6: 1-433.
FITKAU, E.J. & REISS, F. (1978). Chironomidae. In: lllies, J. (ed.). Limnofauna Europea. Págs. 404-440. Verlag, Sttutgart. Swets & Zeitlinger, Amsterdam.
FREEMAN, P. (1957). A study of Chironomidae (Díptera) of África south of the Sahara. III. Bull. Br. mus. nat. Hist. Ent. 5: 323-426.
GOETGHEBUER, M. (1936). Tendipedidae (Chironomidae). a: subfamilie Pelopiinae (Tanypodinae). A. Die Imagines. In: Lidner(ed-). Die Fliegen der Palearktischen Región. 13: 1-138.
HIRVENJOVA, M. (1973). Revisión der Gattung Cricotopus van der Wulp und ihrer Ver-wandten (Díptera, Chironomidae). Ann. zooi. fenn. 10: 1-363.
LAVILLE, H. (1970). Some Chironomidae (excl. Diamesinae) from southem Spain. Steenstrupia, 1: 21-23.
(1972). Recherches ecologiques sur les Chironomides págs. (Díptera) des lacs de montange. These. Universite Paul Sabatíer. Toulouse. 413
(1979). Etude de la derive des exuvíes nymphales de Chironomides au ni-veau du confluent Lot-Truyére. Annls. Limnol. 15(2): 155-180.
LAVILLE, H. & TOURENQ, N. (1967). Contribution a la connaissance de trois chironomides en Camargue et des marismas du Guadalquivir. Annl. Limnol. 3:185-204.
(1968). Nouvelles récoltes de Chironomides en Camargue et dans les ma-rismes du Guadalquivir. Ann. Limnol. 4: 73-80.
LAVILLE, H. & LAVANDIER, P. (1977). Les Chironomides (Díptera) d'un torrent Pyre-neen d'haut montagne: L'estaragne. Annl. Limnol. 13: 57-81.
LEHMANN, J. (1969). Die europaische Arten der Gattung Rheocricoíopus un drei neuer Art-vertreter dieser Gattung aus der Orientalis (Díptera, Chironomidae). Arch. Hydrobiol. 66: 348-381.
(1970). Revisión der europaischer Arten (Imagines a o- und Puppen) der Gattung Parachironomus Lenz. Hidrobiología. 36: 129-158.
(1971). Chironomiden der Fulda. Systematische, okologische und faunisti-che Untersuchugen. Arch. Hydrobiol. Suppl. 37: 466-555.
(1972). Revisión europaischer Arten von Eukiefferiella Thienemann Beit. Ent. 22: 347-405.
LINDEBERG, B. & WIEDERHOLM, T. (1979). Notes on taxonomy of European species of Chironomus (Díptera). Ent. scand. Suppl. 10: 99-116.
LINDEGAARD-PETERSEN, C. (1972). An ecological investigaron of the Chironomidae (Díptera) from a Danish lowland stream (Lindin A). Arch. Hydrobiol. 69:465-507.
MICHAILOVA, P. (1974). Zwei neue Arten der Gattung Chironomus (Díptera, Chironomidae) von der bulgarischen Schwarzmeerküste. Zooi. Beitr. 20: 339-357.
PALMEN, E. (1960). Paratanytarsus-krXen (Díptera, Chironomidae) aus dem mesohali-nen und oligohalinen Brackwasser der Finnisschen Meerbusens. Suom. hyOnt. Aikak. 26: 280-291.
PINDER, L.C.V. (1978). A key to the adult males of British Chironomidae (Díptera). F.B.A., scient. public. n.° 37 (2 vols.).
PRAT, N. (1977). Quironómidos de Cataluña. Graellsia, 31: 157-185. (1979). Quironómidos de los embalses españoles (1.a parte) Graellsia; 33:
37-96. (en prensa). Quironómidos de los embalses españoles (2.a parte), ibid.
6 5

REISS, F. (1968). Okülogische und systematische Untersuchugen aus Chironomiden (Díptera) des Bodensees. Arch. Hydrobiol. 64: 176-323.
(1977). Verbreintungsmuster bei paláarktischen Chironomidenarten. Spi-xiana. 1: 85-97.
REISS, F. & FITTKAU, E.J. (1971). Taxonomie und Okologie der Europaisch Verbreiter Tanytarsus-Arten. Arch. Hydrobiol: Suppl. 40: 78-200.
SANDBERG, G. (1969). A quantitative study of chironomid distribution and emergence ¡n Lake Ekren. Arch. Hydrobiol. Suppl. 35: 119-201.
SCHLEE, D. (1968). Verglelchende Merkmalanalyse zur Morphologie un Phylogenie der Co/ynoneura-Gruppe (Diptera, Chironomidae). Stuttg. Beitr. Naturk. 180:1-150.
SHILOVA, A.l. (1976). Khironomidy Rybinskogo Vodokhranilischa. Izd. Nauka Lenin-grad. 294.
STORA, R. (1936). Fam. Chironomidae. In Frey, R. (ed.). Die Dipterenfauna der Kanaris-chen Inseln und Ihre probleme. Comentat. Biol. 6: 21-30.
STRENZKE, K. (1959). Revisión der Gattung Chironomus. Arch. Hydrobiol. 56: 1-42. THIENEMANN, A. (1950). Lunzer Chironomiden. Arch. Hydrobiol. Suppl. 18: 1-202. TOURENQ, J.N. (1975). Recherches ecologiques sur les Chironomides (Diptera) de Ca-
margue. These. Université Paul Sabatier. Toulouse. 424 págs. WASSON, J.G. (1977). Quelques aspects de l'ecologie d'une riviére polluée: l'lsére
dans la región Grenobloise. Trav. Lab. Hydrobiol. Piscic. Grenoble. 66-68:119-161.
WILSON, R.S. (1977). Chironomid pupal exuviae in the River Chew. Fresh. Biol. 7:9-17.
66

Mediterránea, 5 - Págs. (67 - 96), Año 1981
SOBRE NIDOS AÉREOS DE RATA NEGRA, Rattus rattus (Linnaeus, 1758),
EN EL NARANJAL SAGUNTINO (VALENCIA)
Por F. V. FAUS y J. R. VERICAD<1>
INTRODUCCIÓN
Las investigaciones sobre roedores comensales como la rata negra (Rattus rattus), la rata parda (Rattus norvegicus) y el ratón doméstico (Mus musculus) se han centrado, sobre todo, en aspectos de su control por su importancia en la salud pública y en la economía. La revisión de BROOKS (1973) sobre roedores comensales a nivel mundial, así como las referencias que contiene, constituyen un buen ejemplo de ello.
ZIMMERMANN (1953) ya señalaba la urgencia de nuevas investigaciones sobre R. rattus en el área mediterránea, donde al contrario que en Centroeuropa es menos comensal. Así, JIRSIK (1955) para Checoslovaquia y MEYLAN (com.verb.) para Suiza indican el estricto comensalismo de esta rata que ocupa graneros y otras construcciones humanas, habitadas o no, encontrándosela sólo muy excep-cionalmente en la naturaleza. En cambio, SAINT-GIRONS (1973) y LE LOUARN y SAINT-GIRONS (1977) resaltan que en la región mediterránea de Francia es donde puede observarse su biotopo natural. NIETHAMMER y MARTENS (1975) inciden en lo mismo, así como las publicaciones de FELTEN y STORCH (1970), TOSCHI (1965) y SANTI-Nl (1972, 1977) para Italia, NIETHAMMER (1971), ONDRIAS (1965) y
(1) Centro Pirenaico de Biología experimental. Apartado 64, JACA (Huesca)
67

WETTSTEIN (1941) para Grecia, FELTEN et al. (1971) para Anatolia occidental, AHARONI (1932) y ATALLAH (1978) para Palestina y, por último, BLANC et. al. (1962), BROSSET(1960), CABRERA (1932), LA-TASTE (1885), SAINT-GIRONS y PETTER (1965) para el Magreb.
Sobre R. rattus en Iberia se confirma la misma opinión con los trabajos de CABRERA (1914), LEHMANN (1969), VALVERDE (1960), VERICAD (1970) y VERICAD y MEYLAN (1973). A pesar de la recomendación de Zimmermann, ninguna de las referencias aquí expuestas, muchas de ellas posteriores a 1953, estudian con profundidad la biología de R. rattus. Normalmente, dado que se trata en su gran mayoría de fáunulas o faunas regionales o nacionales, se la cita en ellas de manera colateral, indicándose sólo los lugares de captura y el estado biológico de los ejemplares capturados. Algunos de estos trabajos discuten aspectos de nomenclatura de R. rattus en Europa y el área mediterránea, que todavía no están claros, así como aspectos biométricos,
Según lo que conocemos, solamente los escritos de KAH-MANN y HAEDRICH (1957) y KAHMANN y QAGLAR (1970) se refieren exclusivamente a la rata negra en la región mediterránea. El primer trabajo presenta y discute los resultados obtenidos de las observaciones y capturas realizados de R. rattus en la isla de Córcega. El segundo contribuye al conocimiento de los hábitos alimentarios de la especie, resaltando las contradicciones que sobre este tema aparecen en los artículos publicados hasta aquel momento.
Si sobre la biología y requerimientos ecológicos de R. rattus el conocimiento que se tiene es tan escaso y fragmentario, como se deduce de la revisión que acabamos de hacer, sobre el tema que nos ocupa, cual es, el estudio de los nidos aéreos de R. rattus, es fácil de suponer que aún hay menos antecedentes.
La capacidad de R. rattus para llevar vida arborícola es conocida de antiguo. Los nidos aéreos son consecuencia de esa vida arborícola. Algunas de las referencias citadas hasta ahora hablan de ello, pero sin entrar en gran detalle. Así, LATASTE (1885) dice que en los oasis saharianos ha capturado R. rattus en la parte alta de las palmeras; CABRERA (1932) hace notar que en Marruecos ha encontrado esta rata en sitios con arbolado. Dice textualmente: «...la he obtenido en bosquetes de adelfas, siendo seguramente un animal arborícola como lo es en España el R. r. frugivorus». CABRERA (1914) señala que R. r. frugivorus en Iberia anida generalmente en árboles aunque se establece también en graneros y palomares. LE LOUARN y SAINT-GIRONS (1977) hacen notar que R. rattus en la zona mediterránea se instala en arboledas y espesuras donde construye un nido esférico con fragmentos vegetales o viven en madrigueras. NIETHAMMER (1970) describe someramente los nidos esféricos de este animal constituidos por hojas sueltas de lentisco y alcorno-
68

que, y situados a metro y medio del suelo en un zarzal. Añade, además, que estos nidos, de las cercanías de Lisboa, son similares a los que R. rattus hace en el Mediterráneo. También, ATALLAH (1978) describe nidos aéreos de R. r. frugivorus sobre acacias, formados por hojas y tronquillos del mismo árbol, y localizados a más de dos metros de altura. Observó, asimismo, madrigueras del mismo animal en la base del árbol.
En fin, otros autores señalan igualmente la construcción de nidos aéreos por parte de la rata negra, cuya composición y altura varían según los materiales que tenga a disposición y del árbol soporte. KAHMANN y HAEDRICH (1957) dedican parte de su trabajo a los nidos de R. rattus en la isla de Córcega, de los cuales encontraron cerca de un centenar en diferentes biotopos. Son los autores más explícitos y hablan sobre el soporte de los nidos, altura, materiales de construcción utilizados y número de individuos presentes.
En nuestro trabajo, al contrario que en el de los autores precedentes, el material proviene de un único biotopo (naranjal), recogido tras búsqueda exhaustiva en el área de estudio. Ello ha permitido generalizar la tendencia en ia construcción de nidos aéreos por parte de R. rattus en aspectos tales como dimensiones, composición cualitativa y cuantitativa, orientación, situación en la copa de los naranjos y distribución espacial de los nidos.
ÁREA DE ESTUDIO.
La zona estudiada, descrita ya anteriormente por GIL-DELGADO y ESCARRE (1977) y GIL-DELGADO et a/.(1979), está situada en el término municipal de Sagunto, en la provincia de Valencia, concretamente en la partida de Montíver que corresponde a las cuadrículas UTM YJ3597 e YJ3697. La parcela ocupa una superficie de 16.919 hectáreas y está constituida por 23 huertos dedicados exclusivamente al cultivo del naranjo.. Tiene una altitud de 30 metros sobre el nivel del mar y se encuentra a una distancia de 4 kilómetros de la línea de costa mediterránea y a 2,5 de la ciudad de Sagunto.
La totalidad de los árboles frutales son naranjos (Citrus auran-tium) de diferentes «variedades» (clementina, navel, navelina, sanguina, satsuma y valencia). Hay también unos pocos nísperos y algún limonero. La altura de los naranjos varía de 2 a 5 metros, exceptuando los plantones que son mucho más pequeños. La distancia entre ellos oscila de 4 a 5 metros, y se distribuyen homogéneamente a modo de malla cuadrangular. Puede ocurrir que falte un naranjo o bien que esa falta se sustituya por un plantón. El estrato herbáceo lo componen no menos de 50 especies (GIL-DELGADO et al., 1979).
69

MATERIALES Y MÉTODOS.
Durante el período de tiempo comprendido entre el mes de diciembre del año 1977 y diciembre de 1978, en el área de estudio ya descrita, se recogieron un total de 119 nidos aéreos de R. rattus. En cada estación del año se efectuaron dos búsquedas sistemáticas y exhaustivas de nidos, árbol por árbol, lo que representa un total de ocho búsquedas o barridos y 60 días completos de trabajo de campo.
Se han distinguido cuatro tipos de nidos: A) nidos aéreos de R. rattus, construidos con material de naranjo, de estructura completa y en uso; B) nidos aéreos de R. rattus, elaborados con material de naranjo, abandonados e incompletos en su estructura; C) nidos de gorrión común (Passer domesticus) ocupados por R. rattus; y D) nidos de mirlo común (Turdus merula) utilizados también por R. rattus. En la TABLA I se indica el número de nidos de cada tipo recogidos por estación y en total.
Una vez localizado el nido, se le numeraba, señalando con un subíndice la clase a la que pertenecía, tomándose también su situación en el campo por medio de unas coordenadas preestablecidas que correspondían a cada árbol, y datándose la fecha de recogida.
Ya situado el nido espacial y temporalmente se anotaban los siguientes datos:
a) Dimensiones del naranjo soporte del nido: At (altura total del naranjo, desde el suelo a la rama más alta), Rn (radio de la copa del naranjo, tomado desde el tronco a la rama más exterior en el sentido del emplazamiento del nido), Cb (cobertura, definida por el cociente entre el diámetro mayor y menor de la copa del naranjo) y Dt (diámetro del tronco del naranjo, calculado a partir del perímetro del mismo el cual se tomaba por la base del tronco a una distancia de 20 centímetros del suelo).
A B C D Total
INVIERNO 22
5 — 2
29
PRIMA VERA 20 16 — 3
39
VERANO 6
12 1
— 19
OTOÑO 12 12 5 3
32
ANUAL 60 45
6 8
119
TABLA I.— Número de nidos aéreos de R. rattus recogidos estacional y anualmente, según cada tipo considerado.
70

b) Dimensiones de la situación espacial del nido respecto al árbol soporte: Rne (radio nido-eje del tronco, cuya distancia en línea recta va desde el centro imaginario del tronco al centro del nido), Ans (altura o distancia que va desde el centro del nido al suelo, per-pendicularmente) y Or (orientación del nido, tomada desde la base del naranjo y en referencia al Norte).
c) Dimensiones propias del nido: Dm (diámetro mayor), Din' (diámetro menor, perpendicularmente al primero), H (alzada o altura del nido), Sb (número de ramas sobre las que se emplaza el nido), V (volumen hipotético calculado mediante el producto Dm x Dm' x H) y Pf (peso en fresco del nido).
Las dimensiones se dan en centímetros, la orientación en grados y radianes, el peso en gramos y el volumen en centímetros cúbicos.
Por otro lado, también se observaba la posible presencia de madrigueras, localizándose al pie del naranjo analizado en la mayoría de los casos y/o en los árboles cercanos, tomándose los siguientes datos: dm (diámetro mayor de la boca de entrada de la madriguera), dm' (diámetro menor de la boca de entrada de la madriguera) y f (profundidad de la entrada de la madriguera).
Los materiales de construcción del nido fueron analizados cualitativa y cuantitativamente. Se distinguieron: ramilletes (R), tomándose la longitud total de la rama principal (l.t.), la anchura por la base de rotura (ampl.) y el número de hojas (n.° h.): y, ramltas (r), sin hojas, sobre las que se medía la longitud total (l.t.), el espesor por el extremo de rotura (ampl.) y el número de bifurcaciones (n.° b.).
Para el estudio de la distribución espacial de los nidos se levantaron mapas de trabajo a partir de un plano a escala 1:2.000, facilitado por la Hermandad de Labradores de Sagunto. Se hizo uno para cada huerto, a escala mitad del original, en los que se representaban los frutales.
DIMENSIONES DEL NIDO.
Se han estudiado las seis dimensiones del nido aéreo de R. rat-tus, ya descritas con anterioridad en el apartado de material y métodos, y que son: Dm, Dm', H, Sb, V y Pf.
En la TABLA Ij se dan los valores mínimo (mn) y máximo (mx), la media artimética (X) con su error estándar (sm) y la desviación típica (s) de las dimensiones de los 60 nidos del tipo A considerados. Solamente en una dimensión, Dm, se ha encontrado que el valor calculado de X2 corresponde a p>0.05, y la distribución de los datos se ajusta bien a una distribución normal, lo cual no ocurre con las de-
71

mn-mx X sm s
Dm
10-50 26.48
1.08 8.33
Dm'
8-40 19.43 0.91 6.97
H
7-51 18.73
1.12 8.63
Sb
1-10 5.00 0.27 2.05
V
560-59400 11739.08
1608.07 12351.84
Pf
14.31-1090.07 190.44 28.85
221.63
TABLA II.— Valores mínimo (mnj y máximo (mx), media aritmética (X) con su error estándar (sm) y desviación típica (s) de los 60 datos de los nidos aéreos tipo A de R. rattus para cada una de las seis dimensiones analizadas.
más dimensiones. En cuanto al número de ramitas que constituyen el soporte del nido, Sb, en cuyo análisis los grupos de números se han asimilado a clases de frecuencia, podemos aceptar igualmente que se ajusta bien su distribución a una normal. Sin embargo, para las distribuciones de los datos de H y Dm' debemos rechazar la normalidad, con lo cual podemos suponer que vienen determinadas por unas pautas de comportamiento en la construcción del nido, existiendo cierta selección en estas dimensiones. V y Pf son variables que dependen de las anteriores y, por tanto, tampoco se distribuyen normalmente. No obstante, se ha de tener en cuenta que bajo la denominación de nidos A se hallan agrupados nidos aéreos comunitarios, de reproducción e individuales, por lo que las conclusiones aquí expresadas deben considerarse como provisionales.
INVIERNO PRIMAVERA VERANO OTOÑO ANUAL Dm Dm' H Sb V Pf
41.7 40.2 55.2 35.7
119.5 108.5
29.1 40.3 32.6 51.5
105.1 100.5
23.5 24.0 27.8 31.0 62.4 50.0
19.5 24.8 41.5 36.1 94.3 94.7
31.5 35.9 46.1 41.0
105.2 116.4
TABLA III.— Valores estacionales y anuales del coeficiente de variación para las seis dimensiones analizadas de los nidos aéreos tipo A de R. réttus, a partir de las variables originales.
72

En la TABLA III se muestran los valores estacionales y anuales del coeficiente de variación para las seis dimensiones estudiadas de los nidos aéreos tipo A de R. rattus. Generalmente, se observa un descenso progresivo en el valor del coeficiente de Invierno a Verano, aumentando luego en Otoño. Pudiera suceder que ésto se relacionase con la aparición de nidos con carnada en los meses de reproducción y con la posterior actividad nidificadora de los ejemplares jóvenes de R. rattus.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA DEL NIDO.
Los nidos aéreos de R. rattus, de forma generalmente esférica, están compuestos en su totalidad por materiales procedentes de los naranjos como son ramilletes con hojas, ramitas y hojas sueltas, pertenecientes seguramente al mismo árbol soporte. Esporádicamente, y en cantidades inapreciables, pueden encontrarse restos animales y/o vegetales de alimentación u otros materiales de construcción.
Se ha calculado el tanto por ciento respecto al peso total del nido de los elementos hallados en 16 nidos tipo A, de los que 3 se recogieron en Primavera, 2 en Verano y 11 en Otoño. En la TABLA IV damos el promedio del tanto por ciento, habiendo agrupado los nidos estacionaimente. Los materiales más abundantes son los rami-
ESTACIONES RAMILLETES RAMITAS HOJAS Primavera 32.46 8.38 57.80 Verano 43.14 16.15 37.50 Otoño 52.31 5.83 40.72
TABLA IV.— Porcentajes medios de los materiales hallados en 16 nidos aéreos tipo A de R. rattus, habiéndolos agrupado por estaciones.
Metes y las hojas sueltas, mientras que, comparativamente, las ramitas sin hojas son más escasas. En cambio, el análisis de 5 nidos C y 4 D hizo ver que cuando R. rattus ocupa un nido de gorrión o de mirlo común el aporte de materiales provenientes de los naranjos es poco frecuente y escaso.
Para el estudio de los elementos de contrucción encontrados (ramilletes, ramitas y hojas) se han tomado las variables indicadas en material y métodos. Dichos elementos proceden de 2 nidos de Primavera, 2 de Verano y 7 de Otoño, nidos todos del tipo A. En la TABLA V se dan los valores del número de datos de cada serie (n), el
73

n mn-mx X sm s
RAMILLETES l.t.
145 1.3-25.1
8.69 0.39 4.65
ampl.
145 0.03-0.45
0.18 0.01 0.07
n.°h.
244 1-35 4.62 0.29 4.63
l.t.
145 2.0-26.6
9.21 0.43 5.19
RAMITAS ampl.
145 0.02-0.43
0.17 0.01 0.07
n.°b.
145 1-7 1.95 0.12 1.43
TABLA V.— Número de_datos (n), valores mínimos (mn) y máximo (mx), media aritmética (X) y su error estándar (sm), y desviación típica (s) de las medidas de los materiales de 11 nidos aéreos tipo A de R. rattus, respecto al total de datos.
mínimo (mn) y el máximo (mx), la media aritmética (X) y su error estándar (sm), y la desviación típica (s) de las series. Para el análisis del n.° h. y n.° b. los grupos de números se han asimilado a clases de frecuencia. Se ha comprobado que sólo la anchura de las ramitas (ampl.) se ajusta a una distribución normal, reflejo, seguramente, del universo de donde proviene la meustra; sin embargo, dicho ajuste no se verifica con las restantes variables, lo que nos hace suponer que existe cierta preferencia, teniendo en cuenta que algunas medidas como ei número de hojas de los ramilletes (n.° h.) y el número de bifurcaciones de la ramitas (n.° b.) son posiblemente imagen del universo muestreado.
RAMILLETES l.t. ampl. n.° h.
RAMITAS l.t. ampl. N.° b.
PRIMAVERA
— —
89.6
26.0 36.4 31.4
VERANO
52.2 38.3 98.2
61.6 49.5 82.5
OTOÑO ANUAL
47.0 53.5 35.9 39.5 92.9 98.3
52.6 56.3 34.6 43.3 63.3 73.2
TABLA VI.— Valores estacionales y anuales del coeficiente de variación para las dimensiones analizadas de los materiales de 11 nidos aéreos tipo A de R. rattus.
74

En la TABLA VI se aprecian los valores estacionales y anuales del coeficiente de variación para cada dimensión analizada de los materiales de los 11 nidos aéreos de R. rattus antes considerados. Estacionalmente, los valores más altos se observan en Verano y el coeficiente no experimenta grandes cambios estacionales excepto en las medidas de las ramitas cuyas oscilaciones son considerables. El incremento del coeficiente de variación durante el Verano se podría explicar puesto que una mayor variabilidad de las dimensiones de los materiales contribuiría a dar mayor consistencia y compactibilidad a la estructura del nido, las cuales son necesarias ya que en el período de estío la actividad reproductora de R. rattus parece ser más elevada y los nidos tienen que ser más resistentes para poder albergar, aparte de los adultos, a la carnada.
ORIENTACIÓN.
El estudio de las respuestas de orientación de los organismos o sus señales de actividad es de gran significado ecológico, ya que es por medio de aquellas respuestas que tales organismos encuentran su más favorable microclima.
Autores como KING et al. (1964), KOLLER (1955) y THORNE (1958) han demostrado que los roedores, ante cambios de temperatura ambiental, construyen nidos de diferente tamaño.
Así pues, los roedores, generalizando, pueden expresar su ter-mopreferendum mediante la orientación del nido y/o el tañamo del mismo, con lo que se consigue no sólo la adecuada protección de los adultos sino que se compensa la escasa homeotermia de las crías (MAXWELL y MORTON, 1975, y otros), evitándose así la mortalidad de las mismas.
Para el estudio de la orientación de los nidos aéreos de R. rattus hemos utilizado los datos, tomados respecto al Norte, de 102 nidos A y B, cuya situación se representa en la FIGURA 1, en una sección idealizada de una copa de naranjo de 3 metros de radio, para cada estación y el conjunto de las cuatro. En la TABLA Vil se da el número de datos de cada serie (n), los valores mínimo (mn) y máximo (mx), los promedios (X) y el error estádar (sm), y la desviación típica (s). Los datos originales de orientación de los nidos se han transformado en radianes. Según los valores medios de orientación los resultados corresponden al Sureste para el Invierno y al Sur en las demás estaciones y anualmente.
Asimismo, según explica MARGALEF (1977, p. 355) se ha calculado la dirección media y la intensidad de orientación tanto estacional como anualmente. Los resultados de orientación media coinciden, como era de esperar, con los anteriores. La intensidad de orien-
75

> E a
O
lo CO
o c a> ai c o o
CO
E ~° 1 5 - CD
¿i CD
m ->* CD < T 3 co O O -p-
2 §
P — CD CD T J
^ . c a W Q. CD o § « s™ CD CD
O c
> c
76

INVIERNO PRIMAVERA VERANO OTOÑO ANUAL n mn-mx X sm s
25 0.17-4.89
2.56 0.26 1.25
35 1.48-5.85
3.02 0.20 1.15
18 0.87-5.32
2.97 0.31 1.27
24 0.17-6.02
2.80 0.28 1.35
102 0.17-6.02
2.84 0.12 1.24
TABLA VIL—Número de datos (n), valores mínimo (mn) y máximo (mx), media aritmética (X) con su error estándar (sm) y desviación típica (s), para cada estación y anualmente, de las medidas de orientación de 102 nidos aéreos A y B de R. rattus, transformadas en radianes.
tación no es muy alta, siendo el valor anual de 0.46 y el más grande el de Primavera, 0.53, para una escala de 0 a 1.
La tendencia de R. rattus a construir los nidos en orientación básicamente Sur, tal como podríamos intuir por los resultados expuestos justamente antes, referidos a la orientación media y según la representación gráfica de los datos de orientación de la FIGURA 1, se ha deducido significativa para el total anual de los 101 nidos A y B considerados, ya que los valores calculados de X2 son mayores que los teóricos (p<0.05). Estacionalmente, y teniendo en cuenta las orientaciones de los nidos hallados en las épocas respectivas, llegamos a la misma conclusión que en el punto anterior para Primavera y Otoño; en Invierno y Verano los valores observados de X2
son menores que los esperados (p>0.05) y la tendencia en la orientación no es significativa. Pensamos que esto puede estar relacionado con la presencia de crías en los nidos, con escasa capacidad homeotérmica por tanto. En efecto, según datos propios y bibliográficos, la reproducción se presenta en Primavera, Verano y Otoño. El Invierno parece ser la época de anestro, sin crías en los nidos aéreos, por lo que, consecuentemente, la necesidad de un microcli-ma favorable se ve disminuida. En Verano sí que pueden encontrarse crías en los nidos, pero por la mayor benevolencia climática, esa necesidad de un microclima adecuado se ve, igualmente, disminuida.
Finalmente, hemos comprobado que los atributos «estación del año» y «orientación de los nidos» son independientes entre sí, habiendo obtenido valores de X2 correspondientes a p>0.05, pu-diendo concluir, en definitiva, que la tendencia de R. rattus a cons-truit nidos aéreos con la misma orientación no varía estacionalmente.
77

COORDENADAS DEL NIDO RESPECTO AL ÁRBOL Y AL SUELO.
Tal como se ha indicado en los dos primeros párrafos del apartado de orientación de los nidos, tomada en referencia al eje del tronco del naranjo, aquella que se podría considerar como una expresión de las necesidades térmicas del constructor y usuario del nido. Las copas de los árboles, tanto aislados como en formaciones, gozan de un régimen microclimático propio más o menos acentuado (KALMA y STANHILL, 1972). Es lógico pensar, pues, que la posición del nido en la copa del árbol, definida por las coordenadas del nido respecto al árbol soporte y al suelo, Rne y Ans, pueda responder a determinadas preferencias térmicas. Por ello, vamos a estudiar aquí dichas dimensiones en 101 nidos aéreos A y B de.fí. rattus, para cada estación del año y el total anual.
En la TABLA VMJ se dan los valores mínimo (mn) y máximo (mx), la media aritmética (X) y su error estándar (sm), y la desviación típica (s) de los datos anuales de Rne y Ans. Se ha verificado para ambas dimensiones que los datos se distribuyen normalmente, puesto que los valores calculados de X2 corresponden a p>0.05.
En cuanto a la variable Rne se ha comprobado una dependencia significativa entre el número de nidos y las distancias al tronco en las que se localizan, ya que el valor hallado de X2,18.92, es mayor que el teórico, 5.99 (p<0.05), existiendo una preferencia en situar los nidos entre 1 y 3 metros. Igualmente, para la dimensión Ans hay una dependencia significativa entre esta variable y el número de nidos, con un valor observado de X2 de 9.15, mayor que el esperado, 3.84 (p<0.05), situándose preferentemente los nidos a alturas que varían de 2 a 3 metros.
De otro lado, hemos averiguado que los caracteres «estaciones del año», y «distancias al suelo en las que se localizan los nidos» son independientes entre sí; el valor calculado de X2 es 1.96, menor que el teórico, 7.81 (p>0.05), por lo que se deduce que la tendencia de R. rattus a ubicar los nidos a determinadas alturas dentro de la copa de los naranjos no varía a lo largo del año. También se ha verificado, además, la Independencia entre los atributos «orientación de los nidos» y «distancias a las que se sitúan los nidos respecto al suelo»; los valores calculados de X2 han resultado ser menores que los teóricos (p>0.05).
Considerando las variables ahora analizadas, Rne y Ans, y las dimensiones del árbol At (altura del naranjo) y Rn (radio de la copa), se ha obtenido el coeficiente de correlación a partir de los datos anuales de los 60 nidos tipo A de R. rattus. Hemos observado valores significativos del coeficiente para las relaciones siguientes: At/Ans (r = 0.32), At/Rne (r = 0.40) y Rn/Rne (r = 0.63), mientras que pa-
78

Rne Ans mn-mx . 40-300 129-301 X 181.47 210.51 sm 5.99 3.38 s 59.88 33.75
TABLA VIII.— Valores mínimo (mn) y máximo (mx), media aritmética (X) y error estándar (sm), y desviación típica (s) de los datos anuales de las dimensiones Rne y Ans de los nidos aéreos de R. rattus.
ra At/Rn (r = 0.22), Rn/Ans (r = 0.20) y Ans/Rne (r = 0.04) no lo son. El hecho de que las dimensiones At y Ans, y Rn y Rne estén correlacionadas positiva y significativamente es evidente, puesto que son At y Rn las variables indicadoras del desarrollo de la copa del naranjo y, en última instancia, las que determinan los valores de Rne y Ans.
DISTRIBUCIÓN ESPACIAL DE LOS NIDOS.
Los factores que influyen en la distribución espacial de una especie pueden agruparse en tres componentes de amplio significado: biológica (reproducción, mortalidad, migración, etc.), etológicay ambiental (heterogeneidad). Cada una de estas componentes, o su combinación, determinan la distribución espacial de cada especie en el habitat donde vive. Lo mismo puede aplicarse, evidentemente, a determinadas señales de su actividad, como son, en este caso, los nidos.
Para el análisis del tipo de distribución de los nidos aéreos de R. rattus en la parcela hemos utilizado los siguientes índices:
a) índice de dispersión de BLACKMAN (1942), l = s2/X, por el que aceptamos que la distribución de los elementos de una población es al azar cuando se ajusta a una distribución teórica de Poisson y el valor del cociente varianza/media es igual o cercano a la unidad, regular cuando es ostensiblemente menor y contagiosa si es mayor. Para comprobar si las desviaciones del cociente respecto a la unidad son significativas aplicamos el test de X2 y los resultados se comparan con los valores teóricos. Este test es bueno para averiguar el tipo de distribución que siguen los componentes de la población en consideración, pero no es lo bastante eficiente para establecer el grado de contagio o agregación. No obstante, el hecho de que se verifique un buen ajuste a una distribución de Poisson no quiere decir forzosamente que los elementos se distribuyan al azar sino que no refutamos la hipótesis de que lo sea, pues puede existir una distribución contagiosa y no detectarse.
79

b) índice de MORISITA (1959), Id, a partir del cual deducimos el tamaño de los agregados existentes para cada estación del año y el total de datos del conjunto de las mismas.
c) índice compuesto, \sl\2s, que representa el índice de Morisita calculado para una superficie dada dividido por el índice que corresponde a una superficie doble, y detecta estructuras que escapan a una formulación estadística simple.
Para el empleo del índice de Morisita y el índice compuesto se han utilizado siete tamaños diferentes de unidad de muestreo, tratándose de cuadros de superficie creciente y doble del anterior, correspondiendo a 25, 50, 100, 200, 400, 800 y 1.600 árboles. Como el área que abarca la copa de un naranjo es aproximadamente s = 7i2.5 metros cuadrados, a cada tamaño de cuadrado le corresponderá una superficie de 2 5 X T I X 2 . 5 2 , 50X7IX2.52, ..., 1.600 x n x 2.52 metros cuadrados. Se han tomado un total de 20 cuadrados para cada unidad de muestreo, escogidos al azar. Los mapas de trabajo han sido cuadriculados previamente para cada uno de los siete tamaños distintos de cuadrado.
En la TABLA IX se dan los resultados del índice de Blackman, señalando con un asterisco aquellos valores que corresponden a una distribución contagiosa, para cada tamaño de cuadrado, tanto estacional como anualmente, y a partir del número total de cuadrículas de la parcela. Según los valores calculados, en Invierno la distribución de los nidos es contagiosa para las agrupaciones de 50, 200 y 1.600 árboles, en Primavera también lo es para todos los tama-
INVIERNO PRIMAVERA VERANO OTOÑO ANUAL
25(338) 50(154) 100(84) 200(39) 400(21) 800(10) 1600(5)
1.15 1.69* 1.17 1,84* 1.33 1.73 3.17*
2.12* 2.27* 3.66* 3.16* 4.70* 4.58* 2.23
1.06 1.00 1.16 1.50* 1.43 1.56 0.38
1.46* 1.60* 2:14* 2.28* 1.48 2.11* 2.95*
2.26* 3.20* 3.60* 5.31* 4.49* 6.25* 2.35*
TABLA IX.—Resultados del índice de dispersión de Blackman en cada distinta agrupación de naranjos, estacional y anualmente, para los nidos aéreos de R. rattus. Las cifras entre paréntesis indican el total de cuadrículas en cada unidad de muestreo. Los asteriscos señalan las distribuciones que presentan contagio.
80

ños de cuadrado excepto en el de 1.600, en Verano sólo se presenta contagio en la agrupación de 200 naranjos y en Otoño en todos los tamaños de cuadrado exceptuando el de 400; anualmente hay contagio en todas las agrupaciones a excepción de la de 1.600 árboles. Aquellos tamaños de cuadrado que no presentan distribución contagiosa tienen valores de I que corresponden a una distribución al azar.
En la TABLA X podemos apreciar los valores calculados para el índice de Morisita y el índice compuesto en cada uno de los tamaños de cuadrado considerados, tanto estacional como anualmente.
Deducimos que, según los resultados del índice de Morisita, en Invierno hay dos tamaños de agregado que corresponden a las agrupaciones de 50 y 400 árboles, en Primavera hay de 100 y 400, en Verano los nidos se distribuyen al azar y no hay agregación, y en Otoño el agregado preferido es el que corresponde a la agrupación de 200 naranjos. Para el total anual la agrupación óptima de los nidos se presenta en las agrupaciones de 25 y 800 árboles. Según los resultados del índice compuesto, el cual nos da una idea más aproximada
N.° árboles
Invierno Id IS/I2S
Primavera Id IS/I2S
Verano Id. IS/I2S
Otoño Id IS/I2S
Anual Id IS/I2S
25
0.00 —
0.00 —
0.00 —
0.00 —
8.00 —
50
5.33 0.00
3.33 0.00
0.00 00
0.00 co
5.27 1.52
100
0.00 00
7.86 0.42
0.71 0.00
0.00 00
2.52 2.09
200'
1.09 0.00
1.80 4.38
0.96 0.75
1.67 0.00
1.51 1.67
400
1.45 0.75
1.81 0.99
0.84 1.13
1.55 1.07
1.37 1.11
800
1.19 1.22
1.56 1.17
1.28 0.67
1.53 1.02
1.54 0.89
1.60C
1.30 0.91
1.25 1.25
1.08 1.19
1.30 1.18
1.24 1.25
TABLA X.—Valores calculados para el índice de Morisita (Id) y el índice compuesto (Is/l2s) en cada unidad de muestreo considerada, tanto estacional como anualmente, de los nidos aéreos de R. rattus.
81

del tamaño de los agregados, los valores corresponden a una agrupación óptima de 200 naranjos y otro agregado más grande de 1.600 en Primavera, en Invierno el agregado preferido corresponde a la agrupación de 800 árboles, en Verano hay dos tamaños de agregado de 400 y 1.600, al igual que en Otoño cuyos agregados preferidos son también de 400 y 1.600 naranjos. Anualmente hay dos agrupaciones óptimas de 100 y 400 árboles. Como vemos, respecto a este último índice, se observan estacional y anualmente dos tamaños de agregado, predominando según los resultados estacionales uno grande de 1.600 naranjos y otro menor que oscila de 200 a 400; sin embargo, no se determina la presencia de agregados menores debido quizás al pequeño número de nidos de cada estación, sobre todo en Verano donde es bastante menor. En la FIGURA 2 podemos observar la localización exacta de los nidos aéreos de R. rattus en el área de estudio, así como los tamaños de agregado asignados anualmente según el índice compuesto Is/l2s.
No obstante, ya que cada uno de los índices aplicados para el estudio de la distribución de los nidos de R. rattus y la deducción del tamaño de los agregados existentes, tanto estacional como anualmente, presentan eficiencias diferentes, no podemos ser estrictos en la asignación de las agrupaciones óptimas. Considerando conjuntamente los resultados del índice de dispersión de Blackman (I = s2/X), índice de Morisita (Id) y el índice compuesto (ls/Í2S) podemos deducir, a grandes rasgos, que: en Invierno hay dos tamaños de agregado de 50 y 200 árboles y otro que variaría de 800 a 1.600 como mínimo; en Primavera habría un agregado que oscilaría de 100 a 400 naranjos y otro mayor de 1.600 al menos; en Verano se observarían dos agregados preferidos que variarían de 200 a 400 árboles y otro de 1.600 como mínimo, respectivamente; y, en Otoño, habría dos agrupaciones preferidas, oscilando una de 200 a 400 naranjos y otra de 1.600 al menos. Anualmente se apreciaría una agregación general para todos los tamaños de cuadrado.
Por otra parte, se ha hecho una comprobación sobre el tipo de distribución que siguen los nidos a'éreos de R. rattus dentro de los agregados. Para ello hemos considerado la agrupación de 400 árboles, la cual se dividió en un total de 16 cuadrículas, analizándose los agregados situados en cinco campos de naranjos (5, 3a, 118D, 124 y 127), basándonos en el índice de Blackman. Según los resultados, se deduce que, para cada estación y en todos los campos, los nidos se distribuyen al azar dentro de los agregados, excepto en Primavera donde en los campos 5 y 118D los nidos muestran una distribución contagiosa al igual que en Otoño para el campo 3a. Anualmente el contagio es general en todos los campos aquí estudiados.
82

co o ® !=: 'I E ro
CD (O O O
¡5 2 Oí C
cB ©
á © S E
. c Q: .2
«I gffl 2 có -03 -2 « w co — O o 2 w .2 c c <D O £ •o o o c o> * O O
CO c o N 5 g "O a>
« s 03 CO nf
T3 > •-CO ?g o co c E -^ •;=
co Z3 C CO
c -o o CO .2 § Q-o -o y
O CO t
< £ > | CO T
CM
< O
83

CONSTRUCCIÓN DEL NIDO.
Es muy probable que R. rattus se provea de materiales para la construcción del nido (ramilletes, hojas y ramitas) del mismo sitio donde fija su emplazamiento, porque en muchos casos se ha observado que, al quitar el nido, el lugar de nidificación aparecía desprovisto de ramas y hojas.
La técnica de construcción del nido podría consistir simplemente en la imbricación recíproca de ramilletes, hojas y ramitas hasta conseguir una estructura resistente y apropiada a las necesidades nidificadoras de R. rattus.
Los ramilletes y ramitas quedan cortados en sección transversal por su base de unión con la rama anterior y horizontalmente a la superficie de contacto, terminando como en cuña.
MADRIGUERAS.
Las madrigueras o guaridas de R. rattus, excavadas bajo tierra, constan de una boca de entrada (73.33% de los casos observados) o varias (de 2 a 6 en el 26.67% de las observaciones) de sección aproximadamente circular y situadas generalmente en la base del tronco del naranjo soporte del nido aéreo, en las cercanías o junto a los naranjos circundantes. Estos orificios de entrada a las madrigueras son de fácil localízación por sus dimensiones considerables y por su habitual disposición cerca de los troncos de los árboles.
Su utilización debe ser complementaria con la de los nidos aéreos (BROADBOOKS, 1974), como por ejemplo en casos de inundación cuando el riego de los huertos, por la destrucción de uno u otro en períodos de limpieza, laboreo, poda o sulfatación de los campos, como refugio alternativo en defensa de los predadores, etc.
mn-mx X sm s
dm 6-23 10.67 0.70 3.57
dm' 3-15 7.22 0.44 2.26
f 11-47 20.44
1.63 8.29
TABLA XI.— Valores mínimo (mn) y máximo (mx), media aritmética (X) con su error estándar (sm), y desviación típica (s) de las dimensiones dm, dm' y f de las 27 bocas de entrada halladas para las madrigueras de R. rattus.
84

En la TABLA XI se dan, para un total de 27 madrigueras encontradas, los valores^mínimo (mn) y máximo (mx) de las medidas, la media artimética (X) con su error estándar (sm) y la desviación típica (s) de las dimensiones dm, dm' y f de los orificios de entrada a las madrigueras.
OBSERVACIONES DE R. rattus.
En los nidos aéreos de R. rattus, tanto A como C y D, se realizaron las siguientes observaciones: en Invierno fue vista en 9 ocasiones, encontrando 2 parejas y 6 individuos solitarios en sendos nidos tipo A, descubriendo también un ejemplar en un nido de mirlo común; en Primavera se observó en 2 oportunidades, una con 3 ejemplares y otra de un individuo solitario, ambas en nidos A; en Verano se realizaron 3 observaciones, todas en nidos tipo A, hallando 2 carnadas (una de 10 crías, sin presencia de adultos, y otra de 6 con la hembra) y un nido con una hembra y 2 ratas jóvenes; y, en Otoño, se vio a R, rattus en 6 ocasiones, encontrándose una pareja, una cama-da con 2 crías y la hembra, y 2 individuos aislados, todos en nidos A, hallando también otros 2 ejemplares solitrios en sendos nidos de gorrión común. Estacionalmente se verificaron, en definitiva, 9 observaciones de R. rattus en Invierno, 2 en Primavera, 3 en Verano y 6 en Otoño.
En la mayoría de las ocasiones, la reacción de los ejemplares, tanto adultos como subadultos, al percatarse de nuestra presencia era huir rápidamente saltando con habilidad entre las ramas al suelo o bien a otros naranjos, e incluso saltando directamente desde el nido a tierra salvando distancias de cuatro y cinco metros (ésto fue observado en tres ocasiones).
En la TABLA XII se dan las referencias de las observaciones de R. rattus, citando la fecha y el campo donde se llevaron a cabo, así como la «variedad» de naranja, las dimensiones At y Ans, el tipo de nido, y el sexo y la categoría de edad de los ejemplares vistos.
OCUPACIÓN DE OTROS NIDOS POR R. rattus.
Del total de 119 nidos aéreos descubiertos de R. rattus, 14 eran de ave, correspondiendo 6 a nidos de gorrión común, P. domesticus, y 8 a nidos de mirlo común, T. merula. En estos últimos se han encontrado más restos de alimentación que en los nidos de gorrión, lo que nos induce a pensar que los primeros son más propicios para ser utilizados como comedero mientras que los segundos se usarían como refugio y lugar de descanso.
El aporte de materiales de construcción como ramilletes, hojas y ramitas, por parte de R. rattus, a estos nidos suele ser más bien escaso y poco frecuente. Tanto en los nidos de gorrión común como en los de mirlo, ocupados por rata negra, hemos hallado solamente individuos solitarios.
85

«Variedad» Tipo de nido Categoría Fecha y campo
8 XII-118D 8 XII-11 8 XII-11 8 XII-11
28 XII-4 28 XII-4 30 XII-7 30 XII-3 24 I-6 4 IV-118D
19 IV-11
10 VIII-5 22 VIII-118D
7 IX-3
4 X-124 4 X-124 4 X-124
11 X-11
9 XI-125 9 XI-125
de árbol
valencia nave I nave I nave I nave I nave I nave I clementina nave i valencia nave I
nave I valencia
clementina
nave I nave I nave I nave I
clementina clementina
At
3.88 2.84 3.25 3.47 3.50 2.55 2.87 3.05 3.17 3.83 3.53
3.62 3.57
3.31
3.68 3.40 3.50 3.47
3.50 3.53
Ans
2.57 1.95 2.00 2.34 2.44 2.51 2.00 2.10 2.11 2.45 2.73
2.47 2.67
2.61
2.00 2.24 1.83 1.90
2.52 2.95
A C D
2nn 1n 1n 2n 1n 1n 1n 1n
1 2n 3n
10n I9 ,6n
I 9 ,2n
1 o",1n 19 1n. I 9 ,2n
1n 1n
de edad
ad. ad. ad. ad.
sad. ad. ad. ad.
n sad. ad. 2ad. 1sad.
cr. 9ad. 6juv. 9ad. 2juv. ad. ad. juv. 9ad. 2cr. ad. ad.
TABLA XII.—Observaciones de R. rattus en los nidos aéreos tipo A, C y D. Se indica la fecha y el campo de la obsevación, la «variedad» de naranjos, las dimensiones At y Ans (en metros), el tipo de nido y la categoría de edad del ejemplar observado (cr.: cría, juv.: juvenil, sad.: subadulto y ad.: adulto). También damos el sexo del individuo (n = sexo desconocido).
Por otro lado, en ningún caso se ha observado que los nidos aéreos de R. rattus, después de abandonados, hayan sido aprovechados por otros vertebrados.
DISCUSIÓN GENERAL Y CONCLUSIONES.
Los nidos aéreos de R. rattus de la parcela de naranjal estudiada son generalmente de forma esférica, y están compuestos en su totalidad por materiales procedentes de los naranjos y, muy proba-
86

blemente, del mismo árbol soporte. Los ramilletes con hojas y las hojas sueltas representan la fracción más importante en la composición del nido; las ramitas sin hojas son, comparativamente, menos abundantes. En ninguno de los nidos tipo A revisados se ha encontrado entrada alguna bien definida. Los pocos datos existentes sobre composición de nidos de KAHMANN y HAEDRICH (1957), NIETHAMMER (1970) y ATALLAH (1978), señalan que R. rattus utiliza diversos materiales vegetales (hojas, talljtos, ramitas) que pueden provenir del soporte mismo o no. Los nidos responden en el empleo de los materiales a los que tienen a su mayor disposición, evidentemente. Eso explicaría la uniformidad en la composición cualitativa de los nidos estudiados, pues proceden todos de un mismo biotopo.
Respecto al somero análisis que se ha efectuado de algunas variables continuas o discontinuas de los materiales de los nidos se ha comprobado que varias de las distribuciones de frecuencia se acomodan a una distribución normal y otras no. Las que lo hacen se debe seguramente a que provienen de un universo que presenta tal tipo de distribución, como sería el caso del grosor de las ramitas. Las variables que pueden tener más significado biológico son la longitud de los ramilletes y de las ramitas, puesto que dependen de la rata; estas variables no se acomodan a una distribución normal, lo que indicaría que por parte de la rata hay cierta selección al cortar las ramas y los ramilletes. Otras variables como el número de hojas de los ramilletes o el número de bifurcaciones de las ramitas tampoco siguen una distribución normal, siendo muy posible que aquí la rata no efectúe selección alguna y representen tan sólo el tipo de distribución del universo del que provienen. Los valores del coeficiente de variación calculados para cada estación del año, de cada una de las variables consideradas de los materiales componentes de los nidos, son más elevados en Verano que en las restantes épocas. Esto podría estar motivado por la necesidad de una mayor consistencia y compactibilidad del nido, que debe soportar por un lado el peso de los adultos y las crías, y por otro ofrecer a éstas una protección mecánica y quizá térmica.
Los nidos aéreos de R. rattus representan indudablemente parte de las actividades de la población productora de los mismos. Por ello, la obtención de información sobre el grado de variabilidad de las dimensiones de los nidos y su peso no deja de tener interés. Se ha visto que sólo la distribución de los datos de Dm y Sb corresponden a una normal; las dimensiones restantes (H y Dm') y las que dependen de ellas (volumen y peso) no lo hacen. Podría deducirse aquí que H y Dm' vienen determinadas por unas pautas de comportamiento en la construcción del nido.
Trabajos experimentales han demostrado que las ratas, y también los ratones, construyen nidos de tamaño diferente en respuesta a cambios de temperatura ambiental (KOLLER, 1955; THORNE, 1958). El tamaño del nido puede considerarse, así, como una medida
87

del comportamiento asociado a la homeotermia, el cual puede llegar a tener carácter hereditario (KING er al., 1964). Parece también claro que la actividad tiroidea, por su influencia en la actividad me-tabólica y la temperatura, pueda estar relacionada con la construcción de nidos de tamaño determinado (RICHTER, 1941). Además, conviene recordar aquí que las crías de homeotermos tardan un tiempo en ser capaces de regular su temperatura corporal (cf. MAXWELL y MORTONr, 1975). Es claro que en nuestro trabajo los extremos citados ahora no los hemos comprobado, pero tienen un carácter sugerente que permite interpretar biológicamente algunas de las conclusiones. Así, el valor del coeficiente de variación calculado para cada una de las dimensiones básicas de los nidos saguntinos disminuye de manera general de Invierno a Verano y aumenta de nuevo en Otoño. La explicación de dicha disminución sería que a medida que se acerca el Verano la población de ratas está formada, sobre todo, por individuos prestos a reproducirse, y la construcción del nido viene determinada por las necesidades de parto y ulterior protección de las crías; o dicho de otra manera, los nidos son resultado de una pauta de conducta en la determinación del tamaño, más estricta que en otras épocas. El aumento del valor del coeficiente en Otoño indicaría que los jóvenes, ya independientes, construyen nidos de acuerdo con sus necesidades, y posiblemente inexperiencia, coexistiendo en la zona de estudio con los nidos de los ejemplares adultos.
Más arriba hemos hecho unas consideraciones sobre la relación existente, comprobada por autores ya citados, entre el tamaño del nido y la temperatura ambiental o la actividad tiroidea, así como la importancia del tamaño del nido, aparte del tipo de materiales utilizados en su construcción, en la termorregulación o en la consecución de un microclima adecuado. Pues bien, el caso que nos ocupa, cual es el de los nidos aéreos de R. rattus, cabe pensar que estaría relacionado con los dos aspectos citados en el párrafo anterior mediante la orientación de los nidos y las coordenadas respecto al eje del tronco del naranjo y las coordenadas al suelo; las respuestas de orientación de los organismos o sus señales de actividad, como son los nidos aéreos, son de gran significado ecológico, ya que por medio de tales respuestas los organismos encuentran su microclima más favorable. Por otro lado, la situación del nido en la copa del árbol soporte, definida por sus coordenadas respecto ai eje del árbol y al suelo, puede ser considerada asimismo como expresión de las necesidadestérmicasdelconstructordelnidopuestoquelascopasde los árboles, tanto aislados como en formaciones más o menos densas, gozan de un microclima propio más o menos acentuado (aspectos microclimáticos de la copa del naranjo han sido tratados entre otros por KALMA y STANHILL, 1972). Como consecuencia de todo ello podemos decir que tanto el tamaño del nidos como su orientación respecto al eje del árbol y sus coordenadas respecto al árbol y al suelo son los medios que de manera aislada o conjunta expresan
88

las exigencias térmicas de la especie, tanto en la apropiada protección de los adultos como de las crías, cuya escasa homeotermia se ve así compensada.
Vamos a tratar ahora de interpretar adecuadamente los resultados conseguidos al estudiar la orientación y la situación espacial del nido en la copa del naranjo soporté. La orientación media de los nidos se ha encontrado que es Sur para Primavera, Verano y Otoño, así como para el conjunto de datos de las cuatro estaciones; para el Invierno la orientación media es Sureste. Las distribuciones de frecuencia de los datos de orientación siguen una distribución normal, según se ha comprobado. Hemos confirmado, por medio de estadística de atributos, que esta tendencia a nidificar en orientación Sur es significativa para el total de datos. Asimismo, se ha comprobado que para Primavera y Otoño existe la misma tendencia significativa a nidificar en orientación Sur; en cambio, en Invierno y Verano no, aceptando la hipótesis nula de que hay independencia entre la orientación y el número de nidos. La explicación biológica más congruente en estas conclusiones se relacionaría con la presencia de crías o no en los nidos. Ya se ha visto que la época de reproducción se presenta en Primavera, Verano y Otoño. Así, en Verano el mantenimiento de un microcNma adecuado para la protección de las crías no es necesario por la benignidad climática de la estación. En Invierno, época de anestro, y, por tanto, sin crías en los nidos, las necesidades de los adultos en cuanto a microclima no son muy exigentes. Esto explicaría que en dichas dos estaciones no hay una tendencia significativa a nidificar en orientación básicamente Sur. Por último, también se ha verificado que existe independencia entre los atributos «estación del año» y «orientación», lo cual significa que la tendencia a construir nidos con la misma orientación no varía estacionalmente.
Respecto a la situación espacial del nido en la copa del árbol soporte cabe comentar que los resultados a que se ha llegado son de más difícil interpretación. Ello puede ser debido, por un lado, al desconocimiento que tenemos del microclima de la copa del naranjo en las densidades que se presenta en Sagunto, y por otro porque se ha encontrado que existe una correlación significativa positiva entre las dimensiones del árbol soporte (altura y radio medio de la copa) y las coordenadas del nido respecto al eje del tronco del naranjo y al suelo.
Tanto los individuos de una población como los restos o señales de su actividad, en este caso los nidos aéreos, pueden presentarse en tres tipos básicos de distribución espacial: al azar, uniforme y contagiosa. El primer paso a dar es conocer qué tipo de distribución siguen esos individuos o señales, y el segundo sería develar qué causas determinan el tipo de distribución hallado.
Normalmente, las distribuciones uniformes o regulares son ra-
89

ras en la naturaleza, presentándose casi sólo en superficies pequeñas, y son debidas, sobre todo, a comportamiento territorial. Como este no es el caso de nuestro estudio quedarían entonces dos posibilidades: azar o contagiosa. Conviene recordar aquí que la primera hipótesis que se considera es la de que los elementos de la población se distribuyan al azar, cosa que se acepta cuando los datos se ajustan a una distribución de Poisson. Sin embargo, el hecho de que haya un buen ajuste no quiere decir que los elementos se distribuyan al azar, sino que no desechamos la hipótesis de que lo sea, pues pueden distribuirse de modo contagioso aquellos elementos y no poder detectarse. Esto quiere decir que la detección de una distribución contagiosa presenta ciertos problemas, teniendo la superficie de la unidad de muestreo gran efecto sobre los resultados a los que se llegue. Además, la deducción del tamaño del agregado en una distribución contagiosa que hemos efectuado por medio de. diversos índices tampoco es fácil, pues cada índice tiene una eficiencia propia en la detección del tamaño del agregado y da sólo valores indicativos. En general, se puede decir que la distribución espacial de los nidos aéreos de R. rattus es contagiosa en cada una de las estaciones del año, y presenta dos niveles de agregación que varían de tamaño según las estaciones. Así, el tamaño de agregado menor sería aproximadamente de unos 5.000 metros cuadrados y el mayor de como mínimo 22.000.
De las tres componentes que influyen en la distribución espacial de los animales: biológica, etológica y ambiental, podemos decir al menos que en este caso el contagio de los nidos no está producido por una componente ambiental, como podría ser la heterogeneidad del substrato, y en este caso el substrato es ciertamente homogéneo (monocultivo). Así pues, el origen de esta distribución contagiosa habría que achacarlo a factores biológicos o etológicos o quizás a ambos.
También se deduce que, por las observaciones realizadas, R. rattus ocupa y utiliza preferentemente los nidos de mirlo común, T. merula, como plataformas de alimentación o comederos, y los nidos de gorrión, P. domesticus, como refugio y cama ocasionales.
Ya, por último, cabría hacer algún comentario sobre el significado de los nidos aéreos de R. rattus y deducir sus relaciones con los nidos subterráneos excavados por los mismos animales en las cercanías del nido aéreo. El hecho de que se hayan encontrado carnadas en los nidos aéreos, algunas recientemente nacidas, así como individuos solitarios y, a veces, adultos y/o subadultos en grupos de hasta tres individuos, sugiere que sirven como lugar de parto y cría y como refugio individual y social. Se confirman aquí los datos al respecto de KAHMANN y HAEDRICH (1957) en la isla de Córcega, ATALLAH (1978) en Palestina y SANTINI (1977) para el Parque de la Maremma en Italia. Más arriba se ha hablado de que tanto el tamaño del nido como su orientación y situación espacial podrían muy bien
90

venir determinados por la necesidad de conseguir un microclima favorable, bien para las crías, bien para los adultos. GENEST-VILLARD (1972) comprobó, en efecto, que la temperatura del interior de los nidos aéreos del especializado múrido africano Tamnomys rutilans se mantenía bastante constante y más alta que la temperatura exterior, la cual podía variar hasta ocho grados. El mismo autor señala que este hecho tiene gran importancia en ei mantenimiento de la temperatura corporal de este roedor en sus descansos de las salidas nocturnas. El trabajo ahora citado constituye un buen punto de apoyo en algunos de los argumentos utilizados a lo largo de esta discusión.
Parece que los nidos aéreos de R. rattus no estarían solamente relacionados con cuestiones microclimáticas. PACKARD y GAR-NER (1964) consideran que, para algunos roedores como el Ochro-tomys nattalli, los nidos aéreos pueden tener cierto valor adaptativo y favorecer la supervivencia frente a catástrofes como inundaciones y algunos depredadores. En el caso de los nidos aéreos del naranjal saguntino habría que buscarles valor adaptativo junto con los nidos subterráneos, los cuales suelen ser excavados por las mismas ratas en la base de los troncos de los naranjos; así, ambos tipos de nidos tendrían un uso complementario. Hay que suponer, por otro lado, que cuando se riegan los naranjales éstos quedan prácticamente inundados al igual que los nidos subterráneos; salir de ellos, al primer síntoma de inundación y trepar para refugiarse en los nidos aéreos, es la reacción lógica. Así pues, deducimos que tanto los nidos aéreos como los subterráneos presentan soluciones alternativas para aumentar la supervivencia de R. rattus. En el caso concreto que nos ocupa parece que los que muestran mayor valor adaptativo son los nidos subterráneos, pues de manera normal la rata negra en el área mediterránea tiende a llevar vida arborícola. Cabe preguntarse qué pasaría en las poblaciones habitantes de zonas no cultivadas y ver si presentan dicha solución alternativa, o si sólo es propia de zonas de cultivo donde existe de modo casi continuado una presión humana por parte de-los labradores al echar abajo los nidos aéreos. BROADBOOKS (1974) indica que cree que las ardillas del género Eutamias son los únicos esciúridos, y, posiblemente, los únicos roedores, en los que grupos familiares utilizan a la vez nidos aéreos y subterráneos. Sin embargo, nuestro caso puede ser otro *rnás.
91

RESUMEN.
El estudio de diversos aspectos ecológicos sobre la nidifica-ción aérea de rata negra, R. rattus, en una parcela de naranjales del municipio de Sagunto (Valencia, España) muestra una tendencia de la especie a nidificar en este tipo de cultivo.
Los nidos aéreos, de forma generalmente esférica, han presentado una composición cualitativa uniforme a base de ramilletes con hojas y hojas sueltas procedentes de los mismos naranjos; su utilización como lugar de parto y cría así como refugio individual y social es evidente. No obstante, R. rattus puede instalarse en nidos de gorrión, Passer domesticus, y mirlo común, Turdus merula, para usarlos como comederos y camas ocasionales, respectivamente.
La tendencia a construir nidos con la misma orientación, preferentemente al Sur, no varió estacionalmente.
Tanto el tamaño de los nidos como su orientación y situación espacial definida por las coordenadas respecto al árbol y al suelo vendrían determinados por la necesidad de conseguir un microcli-ma favorable.
La distribución espacial de los nidos resultó ser contagiosa tanto para el total de datos como para cada época del año, presentándose dos niveles de agregación diferentes que variaron según las estaciones.
La construcción de nidos subterráneos, o madrigueras, junto a la de los nidos aéreos, se entiende como solución alternativa para aumentar la supervivencia de la especie, pues ambos son de uso complementario.
92

SUMMARY.
A study oí the aerial nesting of the black rat, Rattus rattus, in orange groves at Sagunto (Valencia, Spain) shows a preference of this species to nest in this kind of tree.
The aerial nests, commonly spherical in shape, have uniform qualitative composition. They are made of small leafed branches and loóse leaves from the same orange tree. It is evident that they are used for the birth and rearing of the young as well as individual and social shelter. R. rattus also occupies house sparrow (Passer domesticus) and blackbird (Turdus merula) nests, which are used occasionally as eating and resting places.
There is a tendency to build the nest in the south part of the tree, and this does not vary seasonally.
The size of the nests and their position in the tree (nest orienta-tion and its spatial location defined by the coordinates to the tree axis and the ground) may be chosen to provide a favourable micro-climate.
The distribution of the nests within the grove appears to be con-tagious for the total year data, and for every season separately, at two different levéis of aggregation. The size of clumps vary accor-ding to the season at both levéis.
The alternative use by this species of underground nests cióse to the tree-nests is considered to increase the survivorship of individuáis.
KEY WORDS: Aerial nests; black rat; orange grove; Sagunto, Spain.
93

FIGURA 3.—Nido aéreo individual de R. rattus sobre la rama de un naranjo.
FIGURA 4.—Nido aéreo, probablemente comunitario, de R. rattus en el naranjal saguntino.
94

BIBLIOGRAFÍA
AHARONI, B. (1932). Die Muriden von Palástina und Syrien. Z.f. Sáugetierk. 7:166-240. ATALLAH, S. (1978). Mammals of the Eastern Mediterranean Región: their Ecology,
Sistematics ans zoogeographical Relationships. Part II. Sáugetierk. Mitt. 26 (1). BLACKMAN, G.E. (1942). Statistical and ecological studies in the distrlbution of spe-
cies in plant comunities. I. Dispersión as a facet in the study of changes in plant population. Ann. Bot. London. N.S. 6: 351-370.
BLANC, G.; DELAGE, B.; et ASCIONE, L. (1962). Etude épidémio-écologique dans le fo-rét du Cherrot. Arch. Inst. Pasteur du Maroc. 6 (3): 223-292.
BROADBOOKS, H.E. (1974). Tree nests of chipmunks with comments on associated behavlour and ecology. J. of Mammalogy. 55 (3): 630-639.
BROOKS, J.E. (1973). A Review of Commensal Rodents and their control. Critica! Re-views in Environmental Control. New York. 3: 405-453.
BROSSET, A. (1960). Les mammiféres du Maroc Oriental. Leur répartition. Leur status actuel. Bull. Soc. Se. Nat. et Phys. du Maroc. 40 :243-263.
CABRERA, A. (1914). Fauna Ibérica: Mamíferos. Mus. Cien. Nat. Madrid. 441 pp. CABRERA, A. (1932). Los Mamíferos de Marruecos. Trab. Mus. Nac. Cien. Nat. Madrid.
Ser. Zool. n.° 57. FELTEN, H. und STORCH, G. (1970). Kleinsáuger von den italienischer Nittelmeer-
Inseln Pantellarie und Lampedusa. Senckenbergiana biol. 51 (3/4): 159-173. FELTEN, H; SPITZENBERGER, F.; und STORCH, G. (1971). Zur Klein-sáugerfauna
West-Anatolien. T. I. Senckenbergiana biol. 52 (6): 393-424. GENEST-VILLARD, H. (1972). Contribution a l'écologie et l'éthologie d'un petit ron-
geur arboricole, Thamnomys rutilans, en République Centrafricane. Mamma-lia. 36 (4): 543-578.'
GIL-DELGADO, J.A. y ESCARRE, A. (1977). Avifauna del naranjal valenciano. I. Datos preliminares sobre mirlo (Turdus merula L.). Mediterránea.2: 89-109.
GIL-DELGADO, J.A.; PARDO, R.; BELLOT, J.; y LUCAS, I. (1979). Avifauna del naranjal valenciano. II. El gorrión común (Passer domesticus L.). Mediterránea. 3:69-99.
JIRSIK, J. (1955). Die Hausratte, R. rattus (Linné, 1758) wieder in der Tschechoslowa-kei. Sáugetierk. Mitt. 3: 21-29.
KAHMANN, von H. und HAEDRICH, B. (1957). Eine untersuchung an R. rattus Lin-naeus, 1758 (Mamm., Rod.) auf der Insel Korsika. Zoologischer Anzeiger. 158: 233-257.
KAHMANN, von H. und CAGLAR, M. (1970). Die Pflanzenkost der Hausratte, R. rattus (Linnaeus, 1758) in Mittelmeergebiet. Sáugetierk Mitt. 18: 45-52.
KALMA, J.D. and STANHILL, G. (1972). The climate of an orange orchard: physical characteristics and microclimate relationships. Agricultural Meteorology. 10 (3): 185-201.
KING, J.A.; MAAS, D.; and WEISMAN, R.G. (1964). Geographic variation in nest size among species of Peromyscus. Evolution. 18: 230-234.
KOLLER, G. (1955). Hormonale und psychische Steuerung belm Nestbau weiser Máu-se. Verh. Deutsch. Zool. Ges. Freiburg. (1955): 123-132.
LATASTE, F. (1885). Etude de la faune des Vertebres du Barbarie (Algérie, Tunisie, Maroc). Catalogue provisoir des Mammiféres apélagiques sauvages. Act. Soc. Linn. Bordeaux. 34: 129-259.
LEHMANN, E. von, (1969). Zur Sáugetierfauna Südandalusiens. Sitz. Ges. Naturfors-ch. Freunde zur Berlín. (N.F.). 9 (1/2): 15-32.
LE LOUARN, H. et SAINT-GIRONS, M.C. (1977). Les Rongeurs de France. Ann. Zool. Ecol. anim. (n.° hors serie). INRA. 161 pp.
MARGALEF, R. (1977). Ecología. Ed. Omega. Barcelona. 951 pp. MAXWELL. C.S. and MORTON, M.L. (1975). Comparative thermoregulatory capabili-
ties of neonatal ground squirrels. J. of Mammal. 56 (4): 821-828. MEYLAN, A (1966). Liste de Mammiféres de Suisse. Bull. Soc. Vaod. Se. Nat. N.° 321,
Vol. 69 (Lausanne, Suisse). 95

MORISITA, M. (1959). Measuring the dispersión of individuáis and analysis of the dis-tributional patterns. Mem. Fac. Sci. Kyushu. Univ. Ser. E. Biol. 2: 215-235.
NIETHAMMER, J. (1970). Über Kleinsáuger aus Portugal. Bonn. Zool. Beitr. 21 (1/2): 89-118.
NIETHAMMER, J. (1971). Kleinsáuger von Kithira, Griechenland. Saugertierk. Mitt. 19 (4): 363-365.
NIETHAMMER, J. und MARTENS, J. (1975). Die Gattungen Rattus und Maxomys in Afghanistan und Nepal. Z. f. Sáugetierk. 40 (6): 325-355.
ONDRIAS, J.C. (1965). Die Sáugetiere Griechenlands. Sáugetierk. Mitt. 13(3): 109-127. PACKARD, R.L and GARNER, H. (1964). Arboreal nests of the golden mouse in eas-
tern Texas. J. of Mammal. 45 (3): 369-374. RICHTER, C.P. (1941). Behaviour and endocrine regulations of the invernal environ-
ment. Endocrinology. 2: 193-195. SAINT-GIRONS, M.C. (1973). Les Mammiféres de Franee et du Benelux (faune marine
exceptée). Doin. Paris. 481 pp. SAINT-GIRONS, M.C. et PETTER, F. (1965). Les Rongeurs du Maroc. Trav. Inst. Scient.
Chérif. S. Zool. n.° 31. 55 pp. SANTINI, L. (1972). Biología e comportamento dei Mammiferi Roditori nocivi in Italia
alie sostanze alimentan consérvate. Ed. TEP. Piacenza. 24 pp. SANTINI, L (1977). Primi rellevi sulla micrommalofauna terrestre (Insectívora, Roden-
tia) del Parco della Maremma. Informatore Botánico Italiano. 9 (2): 164-173. THORNE, D. (1958). Shredding behaviour of the white-footed mouse, Peromyscus ma-
niculatus osgoodi, with special reference to nest building, temperature and light. Thorne Ecol. Res. Station. Bull. No. 6.
TOSCHI, A. (1965). Fauna d'ltalia. Vol. Vil, Mammalia (Lagomorpha, Rodentia, Carnívora, Ungulata, Cetácea). Typ. Calderini. Bologna. 647 pp.
VALVERDE, J.A. (1960). Vertebrados de las Marismas del Guadalquivir. Arch. Inst. Acl. Almería. 9: 9-168.
VERICAD, J.R. (1970). Estudio faunístico y biológico de los mamíferos montaraces del Pirineo. P. Cent. pir. Biol. exp. 4: 7-229.
VERICAD, J.R. et MEYLAN, A. (1973). Resultats de quelques piégeages de Micromam-miféres dans le Sud-est de l'Espagne. Mammalia. 37 (2): 333-341.
WETTSTEIN, O. (1941). Die Sáugetierwelt der Ágáis, nebst einer Revisión des Ras-senkreises von Erinaceus europaeus. Ann. Nat. Hist. Mus. Wien. 52: 245-278.
ZIMMERMANN, K. (1953). Die Rodentia Kretas. Z. /. Sáugetierk. 17: 21-51.
96

Mediterránea, 5 - Págs. (97 - 114), Año 1981
LA AVIFAUNA DEL NARANJAL VALENCIANO. III. EL VERDECILLO (Serinus serinus L.)
Por J.A. GIL-DELGADO (1)
Originario de la áreas forestales abiertas .del Sur de Europa, el Verdecillo (Serinus serinus) ha colonizado y forman su principal habitat en la actualidad, parques, jardines y tierras cultivadas arboladas (LACK, 1971). En estas últimas deben incluirse los huertos dedicados al cultivo de naranjos.
Con anterioridad, en este sistema fueron tratados el Mirlo (Tur-dus merula), (GIL-DELGADO y ESCARRE, 1977) y el Gorrión Común (Passer domesticus), (GIL-DELGADO y cois., 1979). En coexistencia con estas se presenta el Verdecillo durante la temporada de nidifi-cación.
Con datos extraídos de 1975 a 1978, ambos años incluidos, es propósito de este artículo dar a conocer los resultados obtenidos, en especial los concernientes a la duración de la estación de nidifi-cación, tamaño de la puesta, éxito reproductor hasta que las crías abandonan el nido y densidad. Esta última, señalada ya en otros medios naturales ibéricos, (PURROY, 1974 y 1975; PERIS y cois., 1975).
(1) Departamento de Ecología, Facultad de Ciencias Biológicas. Universidad de Valencia. Burjasot, Valencia, España.
97

ÁREA DE ESTUDIO.
Constituida básicamente por una parcela con extensión 16,919 Ha., situada en la Partida de Montiver, término municipal de Sagun-to (Valencia). Los caracteres principales de los huertos englobados en la parcela y la vegetación de los mismos ya fueron definidos por GIL-DELGADO y ESCARRE (1977) y GIL-DELGADO y cois. (1979). Además, un pequeño número de nidadas proceden de naranjales situados en las localidades de Museros y Picasent, ambas en la provincia de Valencia, mapas 696 y 722, escala 1:50.000 respectivamente.
MATERIAL Y MÉTODO.
Para determinar el número de parejas nidificantes sobre la parcela, hemos empleado la técnica de buscar nidos en una superficie conocida de antemano, la de la parcela saguntina (VAL NOLAN, 1963) y el método de la parcela (BLONDEL, 1965; GARCÍA y PU-RROY, 1973; PEDROCCHI, 1973 y 1975) en los mismos huertos, técnica mixta ya empleada en el mismo escenario por GIL-DELGADO y ESCARRE (1977) para censar la población de Mirlos (T. merula).
El material y modo de proceder con los nidos para el análisis del tamaño de la puesta, longitud del período de incubación, estancia de los polluelos en el nido, y supervivencia, es idéntico al utilizado para el Mirlo y Gorrión Común (GIL-DELGADO y ESCARRE, 1977; GIL-DELGADO y cois., 1979). La extensión de la temporada reproductora fue obtenida en el curso de 1977.
Las pequeñas dimensiones del nido dificultan su localización, en virtud de ello, el reflejo de los resultados concernientes a la estación de nidificación serán explicados en dicho apartado.
RESULTADOS.
CONSTRUCCIÓN DEL NIDO.
Las reducidas dimensiones del nido, como anteriormente indicamos, hacen difícil su localización, dificultades que aumentan al tratar de obtener información precisa sobre el comienzo de edificación. Finos hilachos de materia vegetal pueden indicar el inicio de los nidos. Sin embargo, un solitario dato podemos señalar a partir de un aporte secundario sobre un intento de nidificación por abandono de la construcción en el quinto día (25-II a 2-III de 1977), cuando llevaba construida la mitad de la base. No obstante, cuatro nidos fueron encontrados con escasa cantidad de volumen construido, 1/4
98

de la base aproximadamente, y coincidente con el tercer día de elaboración del nido arriba indicado.
Igualmente conflictivo resulta precisar ei momento en que finaliza el aporte de material una vez que, al menos en apariencia, el nido está acabado.
Intervalos variables entre tres y ocho días transcurren desde que los cuatro nidos antes reseñados fueron encontrados hasta el acabado en apariencia de los mismos, TABLA I; y supuesto constante el tiempo necesario desde el inicio de construcción hasta obtener 1/4 de La base edificada, resulta entre seis y once días la total elaboración del nido. En estos cuatro nidos, transcurren dos días desde su terminación hasta la deposición del primer huevo, TABLA I. Sin embargo, espacios superiores muestran tres entre los seis nidos restantes hallados aparentemente acabados y expuestos en la misma TABLA. En conjunto, de ocho a trece días parecen necesarios desde que se inicia la edificación del nido hasta que es depositado el primer huevo, con un valor máximo de 16 en función de los intervalos mayores.
TAMAÑO DE LA PUESTA.
Un huevo es depositado diariamente y es entre dos y cinco el número de huevos por nido, las puestas con cuatro huevos son las más frecuentes, 76,5%, TABLA II.
Sobre un total de 102 nidos, las frecuencias absolutas y relativas de cada tipo de puestas pueden observarse en la TABLA II, con un tamaño medio de 3,7 huevos por nido.
Distribuidas en función del mes en que el primer huevo es depositado, puede apreciarse en la TABLA II el tamaño medio para cada mes, caracterizado por el paulatino descenso del número medio de huevos por nido desde marzo a mayo con posterior elevación en los dos últimos meses de la temporada de melificación. En la TABLA II aparecen en columnas las puestas pertenecientes a los cinco meses que dura la estación de nidificación, diferenciadas en las procedentes de Sagunto [columna (2) de cada mes] y las que provienen de Museros-Picasent [columna (1)]. Para Sagunto, en 1977, el tamaño medio de la puesta resultó de 3,87 huevos por nido, valor que debe acercarse más a la realidad al ser reflejo del total de la estación reproductora.
Para 1975,1976 y 1978 los tamaños medios respectivos señalan valores de 3,45; 3,6; y 3,83 huevos por nido. Sin embargo el.menor tamaño obtenido en los dos primeros años señalados debe ser reflejo de los meses de procedencia de las nidadas, abril y mayo, que pre-
99

Inicio del nido
25-2-1977
Edificado Vi base
28-11-1977 2-111-1977 9-111-1977 9-111-1978
17-111-1978
Intervalo en días
3 7 4 8
Acabado en
apariencia
5-111-1977 16-111-1977 13-111-1978 25-111-1978 5-111-1977
26-111-1976 26-111-1977 26-111-1977 19-IV-1978 8-VI-1977
Deposición 1.° huevo
7-111-1977 18-111-1977 15-111-1978 27-111-1978 6-111-1977
28-111-1976 29-111-1977 31-111-1977 22-IV-1978 10-VI-1977
Interval. días acabado 1.° huevo
2 2 2 2 1 2 3 5 3 2
TABLA I.—Fechas e intervalos entre las fases sucesivas durante la construcción de los nidos. Cada fila corresponde a un nido y la primera fecha de cada fila coincide con el día de localización. Por ello, el intervalo acabado-1.0 huevo de las seis últimas filas son tan sólo indicadoras, puesto que, pudieran haber sido terminados en días anteriores a los citados.
Tamaño de la Marzo Abril Mayo Junio Julio
puesta (1) (2) (1) (2) (1) (2) (1) (2) (1) (2) Total
2 1 3 2 4 1 25 5
n 1 28 x 4 3,8
N 29 X 3,8
3 1 3 3 21
1
4 28 3,7 3,7
32 3,7
TABLA II.—Frecuencia
2 3 9
2 6
15
14 23 3,5.3,5
37 3,5
3 4
3
3 4
del tamaño de la p
1 4
uert
1
1 4
a en
8 15 78
102
3,7
7,84 14,7 76,48
los distintos meses de la temporada de nidificación en la localidad de Sagunto (columnas (2)), y Picasent - Museros (columnas (1)). n = Número total de nidos para cada columna (1) y (2) y mes. x = tamaño medio de la puesta para las n. N = Número total de nidos en cada mes procedente del conjunto de localidades (1) (2). X = Tamaño medio de la puesta para las N.
100

sentan tamaños medios de puestas menores según podemos observar en la TABLA II.
Mediante la aplicación del análisis de varianza, un camino, no se aprecian diferencias significativas entre los tamaños medios de la puesta:
F05;3;98 > 1-9212 : F05;1;100 > °>9696; F05;3;98 > 1 '8 2 2 5-
entre años, localidades y meses respectivamente.
Para el análisis entre localidades englobamos las muestras de Museros y Picasent. También los nidos procedentes del mes de Julio, (1), lo incluímos en el anterior mes.
ESTANCIA DE LOS POLLOS EN EL NIDO.
En quince nidadas con un total de cuarenta y cuatro pollos pudimos establecer el tiempo que tardaron los jóvenes en emanciparse del nido, al conocer con exactitud los instantes de eclosión y abandono del nido de las crías. De los nidos tratados, ocho mantenían pollos de la misma edad, los siete restantes presentaban diferencias de uno a dos días entre el primogénito y el benjamín de los hermanos. Entre doce y dieciseis, por media catorce, son el número de días que tardan en saltar del nido, TABLA III, si los análisis son efectuados respecto al primer pollo que deserta del nido. Algo me-
1.° eclosión Edad de los po-Intervalo en días
9 10 11 12 13 14 15 16 17 18 N X
1.° huevo a eclosión
1
4 2 2 1 1
11 14,9
Incubación
1
4 2 2 1 1
11 12,8
a 1.° abandono
2 2 6 4 1
15 14
líos al a donar r
8 9
17 8 4
44 13,
TABLA III.—Valores medios y frecuencias para cada intervalo en función del número de días. Los valores de N para las columnas 2, 3 y 4 marcan el número de nidos. N en el caso de la quinta columna señala el total de pollos.
101

ñor, 13,8 días, si se obtiene a partir de la edad real de las crías, ya que la primera en saltar suele arrastrar consigo a las demás, bien que ello pudiera estar influido por nuestra presencia.
USO DEL NIDO.
Utilizados para una sola crianza. En general, si quedan abandonados durante el período de deposición o incubación, el abandono es definitivo. Excepción resultó una nidada con puesta del primer huevo en 22-IV-78 e inmediata interrupción del proceso, quizá como respuesta a una hoguera dispuesta a escasos metros el día siguiente. No obstante, el nido fue reocupado a partir del 27-IV hasta contener cuatro huevos recientes sobre el 30 de abril, de manera que la hembra permanecía echada sobre un total de 5 huevos.
Dos nidos seguidos desde la postura del primer huevo hasta el abandono del mismo ocuparon idéntico espacio de tiempo ambos: 29 días.
El intervalo transcurrido desde el inicio de la elaboración del nido hasta la emancipación de los pollos debe rondar los cuarenta días, 28 a 47 días según sumatorios de mínimos o máximos procedentes de las TABLAS I y II respectivamente.
ESTACIÓN DE NIDIFICACION.
En 1977, el primer huevo fue depositado el 3 de marzo, y en el 6 del mismo mes en el siguiente año. La última nidada en 1977 se inició entre el 5 y el 6 de julio. La actividad diaria nidificante sobre la parcela saguntina durante 1977 queda expuesta en la FIGURA 1. Consideramos nidos activos todos aquellos que contenían huevos o pollos. Para los nidos con avanzado estado de incubación o desarrollo de los pollos, les fueron aplicadas las medias expresadas en la TABLA III para la construcción de la FIGURA.
Ciertas nidadas debieron pasar desapercibidas, en base a descubrir en exploraciones secundarias nidos con evidentes síntomas de uso y no localizados en la visita inmediata anterior. El reducido tamaño de los nidos facilita estos errores, salvo intensiva manipulación del follaje de cada árbol para obligar a la hembra a dejar el nido, constantes en el transcurso de la temporada de reproducción. Por todo ello la representación de la actividad de nidificación a lo largo de 1977, debe ser al menos proporcional a la representada en la FIGURA 1, con intensidad máxima en el período de finales de marzo y principios de abril, con clara expresión en la FIGURA.
102

NAD
15
10
MARZO ABRIL JUNIO JULIO
FIGURA 1.— Número de nidos activos diarios, NAD, a lo largo de estación de nidificación correspondiente a 1977.
Una segunda cima, mucho más baja, aparece a mediados de ¡unió.
103

SUPERVIVENCIA Y ANÁLISIS DE LA MORTALIDAD.
Sobre una muestra Inicial de 290 huevos, 95 pollos lograron emanciparse del nido, 32,7%. La eclosión tiene lugar en el 66,9% de los huevos iniciales. Sin embargo, el éxito de supervivencia es variable en el transcurso de la temporada de reproducción según se puede apreciar en la TABLA IV, que refleja el éxito reproductor para cada mes, y que desciende según avanza la temporada de reproducción. Modelo similar presenta el éxito en la eclosión salvo el incre-
Número de huevos
97 94 83 12 4
290
Eclosiones
70 61 48 12 3
194
%
72,2 64,9 57,8
100 75 66,9
Supervivientes
41 36 18 0 0
95
%
42,2 38,3 21,7
0 0
32,7
Marzo Abril Mayo Junio Julio
TOTAL
TABLA IV.—Éxito en la eclosión y supervivencia en relación a los meses de que proceden los huevos. La última fila señala los resultados totales.
mentó de finales de la estación reproductora a nivel global. No obstante, para el caso del éxito en la eclosión el proceso no se repite en la totalidad de secuencias anuales para localidades y meses consecutivos, TABLA V, que por otra parte refleja el modelo global en el caso del éxito reproductor hasta el momento de emanciparse los pollos del nido.
En función del número inicial de nidos, 80, el 40% tiene éxito, es decir, al menos un pollo se emancipa.
De la TABLA IV podemos obtener la mortalidad global a partir del número inicial de huevos, así como la parcial para cada mes, y que al comparar los distintos meses es en abril cuando la pérdida en pollos es menor. No obstante, la mortalidad durante la fase huevo aumenta de marzo a mayo. A partir del octavo día de vida, la mortalidad es mínima como muestra la FIGURA 2.
En la fase huevo, un total de 121 fracasaron. En estos incluímos 25 procedentes de nidos que no cumplían la condición de haber sido localizados, con al menos 10 días antes de producirse la eclosión y, por tanto, no señalados en el valor absoluto Inicial de la TABLA IV. La predación (37,2%) es la principal causante de las pérdidas de huevos. Poda de los naranjos con la consiguiente destruc-
104

Mes - año Localidad Éxito en la Éxito en la eclosión % vivencia %
Marzo Abril Mayo
Abril Mayo
Marzo Abril Mayo Junio Julio
Marzo Abril Mayo
- 1976 1976 1976
1976 1976
1977 1977 1977 1977 1977
1978 1978 1978
Sagunto Sagunto Sagunto
Museros& Museros
Sagunto Sagunto& Sagunto& Sagunto& Sagunto&
Sagunto& Sagunto Sagunto&
88,9 58,9 27,6
X2= 19.01 P<0.001 100 92,3
X2=1.67p>0.05 69,6 0
26,7 100 75
X2 = 20.05 p<0.001 60 72 0
X2=1.26 p>0.05
55,5 30,8
0
100 69,2
36,2 0 0 0 0
40 36 0
TABLA V.—Resultados de la secuencia de meses consecutivos para los años y localidades indicadas en relación con el éxito en la eclosión y supervivencia. Valores en % del número inicial de huevos. X2global = 12.55, con p<0.02 y 4 g. de I. & Sobre número de huevos pertenecientes a 5 o menos nidos.
ción del nido (19,8%), factores climáticos adversos (13,2%), abandonos de la puesta (9,9%), huevos hueros (18,2%) y los que caen del nido (1,7%) completan el cuadro de causas que afectan al éxito durante el período de incubación.
Sobre un total de 115 pollos desaparecidos mientras permanecían en el nido, la predación actúa sobre el 48,7%, la poda al 8,7% y la inanición al 42,6%. En esta última incluímos los muertos por enfermedad y aquellos que por carencia de alimento, carencia de recursos o por competencia entre hermanos, terminaban por morir. Al igual que para la fase huevo, los 16 pollos de más que no aparecen en la TABLA IV, provienen de nidos que no cumplen la condición anteriormente fijada.
La predación durante la fase pollo incide principalmente entre los cuatro y ocho días de vida, mientras que la inanición disminuye con el crecimiento de los pollos, TABLA VI.
105

V .
\ \
8 12 Edad en d í a » .
FIGURA 2.—Curvas de mortalidad para el Verdecillo para los distintos meses que ocupa la temporada de reproducción. Marzo.— Línea continua. Abril.— Línea discontinua Mayo.— Línea discontinua punteada. E indica el momento de la eclosión.
Predación Inanición
0 - 4 7,7
46,2
5 - 8 79,5 43,6
9- abn 12,8 10,2
TABLA VI: Variación de la incidencia de la predación e inanición según avanza el desarrollo de las crías (en %). abn.—Abandono del nido. Las dos cifras de la fila edad en cada columna incluidas. Edad: señalada por intervalos entre días de vida.
106

El éxito en la eclosión aumenta con el tamaño de la puesta. De igual manera, el número de eclosiones por nido crece según la puesta se hace mayor, TABLA Vil, donde también puede apreciarse el más alto número de supervivientes por nido según aumenta el tamaño de la puesta.
Tamaño de la puesta
2 3 4 5
TABLA Vil
Ni Eclosión %
3 83,3 7 85,7
53 91,5 1 100
Éxito de la eclosión y
N2
2 4
25
superv
Superv. Ri %
75 1,6 66,7 2,6 72 3,6
5
Ivientesen relación
F¡2
1,5 2 2,9
con el tamaño de la puesta. Ni y N2 refleja el número de nidos para la eclosión y supervivencia respectivamente, y R1 señala el número medio de eclosiones por nido y R2 el de jóvenes que llegan a emanciparse del nido de media.
CRECIMIENTO DE LOS POLLOS.
Al nacer, los pollos pesan alrededor de dos gramos. El aumento en peso puede observarse en la TABLA VIII en la que señalamos los pesos medios, desde la eclosión, día 0, hasta que dejan las crías el nido. El aumento de la longitud alar está reflejada en la misma TABLA. La longitud tomada en los primeros días de vida es reflejo del tamaño del alón.
Los pollos abandonan el nido al alcanzar los diez a doce gramos de peso.
A los pollos pesados o medidos, les era conocido el día de eclosión. No obstante, las medidas y las muestras proceden de individuos de distintos nidos y épocas y tan solo una pequeña parte de los pollos pudo ser seguido durante todo el estadio de permanencia en el nido. La muerte de algunos individuos por inanición o predación rompía la secuencia de. obtención de datos. Además, las muestras están repartidas por todo el período reproductor. De ahí que los valores obtenidos deben representar resultados meramente indicativos.
107

Edad Peso medio en gr. Longitud media de ala Tamaño de en días o alón en mm. la muestra
0 1 2 3 4 5 6 7 8 9
10 11 12 13
TABLA VIII.
2 2,76±0,16 3 3,66±0,33 4,81 ±0,2 5,87±0,2 7,12±0,39 7,5 ±0,5 9,5 ±0,9 9,53±0,3 9 ±0,7
10,4 ±0,3 11,6 ±0,5 9,7 ±1,2
—Ganancia en peso
5 5,46±0,2 7,33±0,2 9 ±0,57
10,5 ±0,69 15,87±0,7 20,25±0,77 23,1 ±1,3 27,3 ±1,5 31,8 ±0,5 30,5 ±1,7 38,2 ±0,7 41,1 ±1,1 40,7 ±0,7
y aumento de la lonc
1 13 9 3
11 16 8 8 6
15 6
11 8 3
litud alar, en su caso del alón (ver texto). El día 0 coincide con la eclosión.
DENSIDAD
La FIGURA 3 muestra la distribución de las 50 parejas establecidas en la parcela durante la estación de nidificación correspondiente a 1977. El año anterior mantenía una población de similar tamaño, TABLA IX, que permite apreciar la inexistencia de cambios poblacionales entre las dos estaciones reproductoras.
Año Número de parejas Densidad (1) 1976 49 28,96 1977 50 29,55
TABLA IX: Número de parejas y densidad del Verdecillo (Serinus serinus) en los naranjales de Sagunto. (1).—La densidad establedida por el número de parejas en 10 Ha.
108

• o
•• \ ••. / i * ••
*# t**r • V
*•
w co
CO O
COT)
o m CO « cu -o co c
c
O o co o Q. ro
c CO
co 3 1C U5C15 ce w CO
08 O O
^ co
co
"55 • * — <
CO Q. 05
CO
— C 05
c "o 3
.Q
CO
Q
cr> < DC 3 03 Li-
co CO
_ l
6 o CD
"O l -
> 0)
• o
co o u. 05 -o CO
• • - • c CO ü
co o
_ l
co o cu
• o co
CO Ü
CO
o
co o 3 o
o co o
>• co
o •v
"c
cd -C ü o
CO c 3
o Q. co
•CO
E 05
T 3 CO
co o T3 CO CO IC CU co co 05 CO Q. O
c Q.
109

DISCUSIÓN.
El Verdecillo (Serinus serinus) forma parte de la comunidad or-nítica nidificante en los naranjales. Sin embargo, no llega a alcanzar las densidades del Gorrión Común (Passer domesticus) en este tipo de cultivos (GIL-DELGADO y cois., 1979). Nó obstante, la preferencia por las áreas cultivadas arboladas (LACK, 1971) es puesta de manifiesto al compararlas con el tamaño de las poblaciones establecidas en otros me/Jios naturales ibéricos (PURROY, 1974 y 1975; PE-RIS y cois., 1975) que señalan densidades mucho más bajas que las obtenidas sobre los huertos de naranjos.
HINDE (1975) cita un período de incubación de trece días para el Verderón Común (Cardelius chloris), similar espacio de tiempo es el obtenido para el Verdecillo en el presente estudio.
La estación de nidificación ocupa desde principios de marzo a finales de julio, más corta que la establecida por HEIM de BALSACy MAYAUD (1962) sobre el Noroeste de África, al iniciarse en Sagunto con algo más de dos meses de retraso. Sin embargo, en comparación con el Gorrión Común (Passer domesticus), el Verdecillo muestra un adelanto de una veintena de días (GIL-DELGADO y cois., 1979) y es la primera especie de la comunidad ornítica de los naranjales en comenzar las funciones reproductoras.
LACK (1954) señala que, ai menos en algunas especies, existen mayores probabilidades de éxito en las nidadas de la fase temprana correspondiente a la'totalidad de la estación nidificante, aplicable al Verdecillo según muestra la TABLA V que expresa la disminución del éxito reproductor conforme avanza la estación de nidificación, con especial notoriedad en Sagunto donde aparecen valores nulos en mayo y siguientes meses.
La mortalidad afecta por igual a huevos y pollos. Es la predación, por cuanto incide en ambas fases, la causante principal de las bajas ocurridas. La importancia de la predación como causa primordial de las pérdidas habidas durante ia permanencia en el nido es señalada entre otros por VAL NOLAN, 1963; RIBAUT, 1964; HORN, 1968; HOLM, 1973; ROBERTSON, 1973; BEST, 1978; GIL-DELGADO y cois., 1979. No obstante, en el Verdecillo durante la fase pollo, las pérdidas por inanición, enfermedad, etc..,. son similares a las originadas por la predación. Sin embargo, mientras la frecuencia de muertes debidas a inanición y enfermedad desciende según crecen los pollos, la predación actúa preferentemente sobre pollos de 5 a 8 días de vida, TABLA VI.
KLOMP (1970) clasifica las aves con variación estacional del tamaño de la puesta en dos categorías, especies con declinación paulatina del tamaño medio de las puestas a partir del inicio de la estación de nidificación y especies que, tras elevarse el tamaño medio de la puerta, desciende a continuación. Un tercer tipo estaría definido por el Chochín de los Cactus (Campylorhynchus brunneicapillus) con elevación del tamaño medio de la puesta conforme avanza la estación de nidificación (ANDERSON Y ANDERSON, 1960), SNOW
110

(1955), PULUAINEN (1977), GIL-DELGADO y cois (1979), entre otros, señalan especies pertenecientes a la segunda categoría definida por KLOMP (1970). El descenso paulatino del tamaño medio de la puesta expuesto por KLUIJVER (1951) en el Carbonero Común (Pa-rus major), refleja el modelo de la especie tratada en este artículo. Sin embargo, el posterior crecimiento del tamaño medio de la puesta, TABLA II, parece sugerir un nuevo modelo.en el que tras un descenso del tamaño medio de la puesta, desde el inicio de la estación de reproducción, se eleva de nuevo al final de la temporada de nidifi-cación. No Obstante, en relación con el valor de F = 1.8225 <Fo5j3;98 debemos concluir con que la variación intermensual aparecida es debida al azar. El Verdecillo, en definitiva, mantiene el mismo tamaño de la puesta durante toda la temporada.
HEIM de BALSAC y MAYAUD (1962) señalan una media de 3,8 huevos por nido en el Noroeste de África, ligeramente superior a la establecida en Sagunto, TABLA II. LACK (1954) expone la disminución del tamaño medio de la puesta según decrece la latitud, aplicable al Mirlo (Turdus merula) de los naranjales saguntinos respecto a poblaciones europeas más septentrionales (GIL-DELGADO y ESCA-RRE, 1977), aunque en el Gorrión Común (Passer domesticus) no es cierto, al presentar la población saguntina un tamaño medio de puesta superior (GIL-DELGADO y cois. 1979) a los procedentes de latitudes más altas, ¿sería resultado de los distintos hábitos durante la estación de nidificación (Ej. Nidificación sobre árbol y propia construcción del nido)? No obstante, al comparar el tamaño medio de la puesta del Verdecillo de Sagunto con las procedentes del N.W. de África, el modelo es similar, aunque pudiera tratarse como resultado de la procedencia de las nidadas aquí estudiadas y pertenecientes a bajas altitudes, en virtud de que el tamaño medio de la puesta se incrementa con la altitud (JOHNSON, 1960), si bien en otras especies decrece (JOHNSON, 1956), alternativas ambas señaladas por CODY (1971).
111

RESUMEN
El análisis cuantitativo de una población de Verdecillo (Serinus serinus) en el naranjal de Sagunto (Valencia, España) durante dos años consecutivos, señala densidades de 28,9 y 29,5 parejas por 10 Ha. en 1976 y 1977 respectivamente.
El período medio de incubación resultó de 12,8 días y el valor medio de la estancia de los pollos en el nido es de 14 días.
La estación de nidificación queda establecida entre los inicios de marzo y la tercera decena de julio. La intensidad nidificante es máxima entre finales de marzo y principios de abril.
El éxito reproductor en función del número inicial de huevos es del 32,7%. La mortalidad es similar en las dos fases, huevo y pollo, 33,1 y 34,2% respectivamente. La predación es la principal causante de las pérdidas ocurridas al intervenir en las dos fases. Sin embargo, durante la fase de pollo, las pérdidas debidas a predación e inanición son equivalentes. Los pollos al nacer pesan alrededor de dos gramos. Los pesos y longitud alar hasta los trece días de vida quedan señalados.
El tamaño medio de la puesta, 3,7 huevos por nido, es inferior al establecido para el N.W. de África y varía entre 2 y 5 huevos por nido.
SUMMARY.
The quantitative analysis of a Serin (Serinus serinus) popuia-tion in a orange grove in Sagunto (Valencia, Spain), shows a bree-ding density of 28,9 and 29,5 pairs/10 Ha. for two consecutives years (1976 and 1977). The average hatching time is 12,8 days. The youngs remain in the nest for an average of 14 days.
The breeding season starts early March and finish within the last ten days of July. The maximun breeding rates are from the last days of March to first days of April. The reproductive success is 32,7% on the initial number of eggs. The mortality is similar for eggs and for youngs, 33,1% and 34,2% respectively. The predation is the most common cause of deaths in both stages. However, in the young sfage the predation and starvation are equivalent.
On hatching the youngs weight about 2 grs. Weight and lenghts of the wings are given until the youngs are 13 days olds.
Average clutch-size is 3,7 lower to that established for Nord West África and it varíes between 2 and 5 eggs per nest.
112

BIBLIOGRAFÍA
ANDERSON, A.H. y ANDERSON, A. (1960). Life history of the Cactus Wren. Part III. The nesting cycle. Cóndor, 62: 351-369.
BEST, LB. (1978). Field Sparrow reproductive success and nesting ecology. Auk, 95: 9-22.
BLONDEL, J. (1965). Etude des populations d'oiseaux dans une garrigue méditerra-néenne: description du milieu, de la méthode de travail et exposé des pré-miers resultáis obtenus á la période de reproduction. La Ierre et la Vie, 112: 311-341.
CODY, M.L. (1971). Ecological aspects of reproduction, pp 461-512 en Farner, D.S. & Kings, J.R. eds, Avian Biology, vol I, Academic Press, New York, 586 pp.
COULSON, J.C. (1956). Mortality and egg production of the Meadow Pipit with special reference to altitud. Bird Study, 3: 119-132.
GARCÍA, L y PURROY, F.J. (1973). Evaluación de comunidades de aves por el método de la parcela. Resultados obtenidos en el matorral mediterráneo de la Punta del Sabinar (Almería). Bol. Est. Cen. de Ecología, 4: 41-49.'
GIL-DELGADO, J.A. y ESCARRE, A. (1977). Avifauna del naranjal vaienciano I. Datos preliminares sobre Mirlo {Turdus merula). Mediterránea, 2: 89-109.
GIL-DELGADO, J.A.; PARDO, R.; BELLOT, J.; y LUCAS, I. (1979). Avifauna del naranjal valenciano, II, El Gorrión Común (Passer dómesticus L.). Mediterránea, 3: 69-99.
HEIM de BALSAC, H. y MAYAUD, N. (1962). Les Oiseaux du Nord Ouest de L'Afrique. P. Lechevalier ed., Paris, 486 pp.
HINDE, R.A. (1955). The Courtship and copulation of the Greenfich {Chloris chloris). Behaviour, 7: 207-233.
HOLM, C.H. (1973). Breeding sex ratios, territoriality and reproductive success ¡n the Red-winged Blackblrd {Agelaius phoeniceus). Ecology, 54: 356-365.
HORN, H.S. (1968). The adaptative significance of colonial nesting in the Brewer Blackbird, Euphagus cyanocephalus. Ecology, 49: 682-694.
JOHNSON, R.E. (1960). Variation ¡n breeding season and cluth size in Song Sparrow of the Pacific coast. Cóndor, 56: 268-273.
KLOMP, H. (1970). The determination of cluth-size In birds. A reviev. Árdea, 58:1-124. KLUIJVER, H.N. (1951). The population ecology of the Great Tlt. Árdea, 9: 1-135. LACK, D. (1954). The natural regulation of animal numbers. Claredon
Press, Oxford, 341 pp. LACK, D. (1971). Ecological isolation in birds. Blackwell scientific publications. Ox
ford and Edimburgh, 341 pp. PEDROCCHI, C. (1973). Estudios en bpsques de coniferas del Plri neo Central. Serie A:
Pinar con acebo de San Juan de la Peña; 2) Utilización de métodos de cuadrícula al estudio de la densidad de nidificación de aves. Pirineos, 109: 73-77.
PEDROCCHI, C. (1975). Efecto topoclimático en la densidad de nidi ficación de aves. P. Centr. pir. Biol. exp., 7: 163-167.
PERIS, S.; SUAREZ, F.; y TELLERIA, J.L (1975). Estudio ornitológico del sabinar (Juni-perus thurifera L.) de Maranchón (Guadalajara). Descripción de la vegetación y aplicación del método de la parcela. Ardeola, 22: 3-27.
PULLIAINEN, E. (1977). Habitat selection and cluth-size in the Meadow Pipit, Anthus pratensis, in Finland, especially in Lapland. Aquilo, 17: 1-6.
PURROY, F.J. (1974). Contribución al conocimiento ornitológico de los pinares pirenaicos. Ardeola, 20: 245-261.
PURROY, F.J. (1975). Evolución anual de la avifauna de un bosque mixto de coniferas y frondosas en Navarra. Ardeola, 21: 669-697.
RIBAUT, J.P. (1964). Dynamique d'une population de merles noirs Turdus merula L. Revue Suisse Zoo!., 71: 816-902.
1 13

ROBERTSON, R.J. (1973). Optimal niche space of the Redwinged Blackbird: spatial and temporal patterns of nesting activity and success. Ecology, 54: 1085-1093.
SNOW, D.W. (1955). The breeding of the Blackbird, Song Thrush and Mistle Thrush in Great Britain. Part II. Cluth-slze. Bird Study, 2: 72-84.
VAL NOLAN, Jr. (1963). Reproductive success of birds ¡n declduous scrub habitat. Ecology, 44: 305-313,
1 1 4

Mediterránea, 5 - Págs. (115 - 128), Año 1981
CONTRIBUCIÓN SOBRE LAS ODONATOCENOSIS DE LA PROVINCIA DE VALENCIA (ESPAÑA)
Por C. BONET y J.A. GIL-DELGADO1
Como señala COMPTE (1965), la odonatofauna de la Península Ibérica dista de estar bien conocidad, especialmente en lo referente sobre ciertos aspectos de la biología. Entre estos, la composición de las comunidades de odonatos, cualitativa y cuantitativamente, revisten importancia especial desde el punto de vista ecológico.
Es pretensión nuestra dar a conocer los resultados obtenidos sobre tres cursos de agua de la Provincia de Valencia de las comunidades de odonatos presentes en el transcurso de 1977, así como el tiempo de duración de los ¡magos.
ÁREA DE ESTUDIO.
Los cursos de agua estudiados están localizados en los términos de Estivella, Torrente y en los límites de Alboraya y Almacera, y que discurren a lo largo del Barranco de la Horteta; Barranco del Ca-rraixet; y acequia del Bobalar, ésta última de construcción artificial.
Barranco de Horteta: En el término de Torrente, en la vertiente sur de la Sie
rra de Perenchiza y a 19 Kms. de la línea costera mediterránea aproximadamente. Se trata de una charca circular en cuyas orillas abundan Juncus spp; Arundo spp; y Typha spp. con entrada continua de agua y sali-
115

da por desbordamiento sobre un camino de tierra que cruza el arroyo.
Barranco del Carraixet: Se escogieron dos estaciones de cien metros de longi
tud cada una y separadas por un ensanchamiento de la corriente. El agua como en Horteta fluye durante todo el año. A 3 Kms. de la línea costera en los márgenes destacan Juncus spp y Arundo spp. A menos de diez metros de altitud el barranco actúa de límite entre los términos de Alboraya y Almacera. Mapa 696. 1:50.000, del S.G.E. 1976 en los UTM YJ2776.
Acequia del Bobalar: Artificial, construida en la década de los treinta, discu
rre entre naranjos y almendros en el término de Estive-lla, mapa 668 a escala 1:50.000 del S.G.E. 1975 y en los UTM YJ2799. A 13 Kms. de la costa está situado a 160 m. de altitud. Con anchura constante, inferior al metro, el centro está colonizado por Juncus spp y Typha spp. El agua, a pesar de depender de las necesidades de riego de los huertos circundantes, fluye continuamente aunque el nivel de las mismas varía diariamente. La longitud de la acequia es de 700 m.
MATERIAL Y MÉTODO.
Para conocer las especies de odonatos presentes se capturaron ejemplares para su posterior verificación en el laboratorio. No obstante, ciertas especies de fácil identificación, ej. Anax impera-tor, no fueron recogidas.
El número de visitas a cada área fue de 47 a la Acequia del Bobalar entre las 10 h. 30' y las 16 h., 31 de 10 h. 30' a 14 h. sobre el Barranco del Carraixet y 5 al Barranco de la Horteta entre las 10 h. y 14 h. 30'. Para completar el catálogo de especies se efectuaron en las dos primeras estaciones mencionadas visitas vespertinas, 17 h. a 21 h. en número de 7 al Barranco del Carraixet y 24 sobre la Acequia del Bobalar.
En cada visita se utilizaba un plano del curso de agua, distinto para cada sesión de trabajo, donde quedaban anotadas las manifestaciones de los individuos pertenecientes a las diferentes especies y señalando sobre el plano el lugar de contacto con cada ejemplar de manera que al final de cada sesión de trabajo era posible cuanti-ficar el número de individuos de las distintas especies, proceso similar al seguido por el método de transectos, censo linear para co-
116

munidades de aves (PURROY, 1972). En el Barranco del Carraixet, algunas especies se presentaron en fuertes agregaciones, para ellas los valores que señalemos son aproximativos según las clases 0-10; 10-50; 50-100; más de 100 individuos.
RESULTADOS.
Un total de 22 especies, 12 Zygoptera y 10 Anisoptera, se encontraron en el conjunto de las tres localidades. Su presencia o ausencia en las mismas puede apreciarse en la TABLA I. El grado de afinidad entre las tres áreas estudiadas es de 44,4. Tomadas dos a dos Estivella y Torrente presentan mayor afinidad, TABLA II.
La aplicación de la distribución X2 (MARGALEF, 1974) al estudio de afinidad entre colectivos, presencia y ausencia, tomadas las localidades dos a dos, señala valores de 1,8; 3,56; y 1,34, todos ellos con p<0,05 que expresan la carencia de diferencias entre las comunidades estudiadas. A tal fin, similares resultados aparecen tras su aplicación sobre Zygoptera y Anisoptera, TABLA II, tomadas independientemente.
DURACIÓN ANUAL DE LOS IMAGOS.
La FIGURA 1 presenta el intervalo anual en que las distintas especies se muestran en estado de ¡mago en el Barranco del Carraixet y la Acequia del Bobalar. A nivel del conjunto global de especies la comunidad presente en el Barranco del Carraixet mantiene un período de mayor longitud anual con individuos adultos, finales de febrero a noviembre. En Estivella, aunque la desaparición de los ¡magos ocurre hacia la misma época, los primeros ¡magos aparecen con un mes de retraso respecto al Barranco del Carraixet. Respecto al Barranco de la Horteta, el exiguo número de visitas efectuadas no permite precisar los intervalos específicos anuales.
Entre las especies bien representadas en las dos localidades, /. elegans, C. tenellum, A. imperator, y C. erithraea, muestran un período de vuelo más extenso en el Barranco del Carraixet con aparición anterior y desaparición posterior. Esta norma es también seguida a nivel genérico en Calpteryx, Coenagrion y Simpetrum. La aparición con dos meses de antelación en Estivella de S. fusca respecto a los ¡magos del Barranco del Carraixet de la misma especie constituyeron la excepción. Las restantes especies presentes en las localidades mencionadas en este apartado, TABLA I, fueron puntuales, contactos en una visita.
El período de vuelo más amplio lo mantiene /. elegans sobre el Barranco del Carraixet y coincidente con el indicado para el total de la comunidad. En dicha especie el intervalo obtenido es superior al
117

ZYGOPTERA
FIGURA 1.—Intervalo anual de vuelo de las diferentes especies sobre el Barranco del Carraixet (línea continua) y la Acequia del Bobalar (línea discontinua). CS: C. splendens. CH: C. haemorrhoidalis. LV: L viridis. SF: S. fusca. PL: P. latipes. C -.Coenagrion spp. CM: C. mercuriale. IE: /. elegans. CT: C. tenellum. EV: £ viridulum. AM: A. mixta. AC: A cyanea. Al: /A. imperator. OC: O. chrysostigma. O : Orthetrum spp. CE: C. erythraea. S :Sympetrum spp.
118

ESPECIE Calopteryx Calopteryx Lestes Sympecma
haemorrhoidalis splendens virídis fusca
ALBORAYA ESTIVELLA TORRENTE
Platycnemis acutipennis Platycnemis ¡atipes Coenagrion lindeni Coenagrion mercuriale Coenagrion puella Ischnura elegans Ceriagrion tenellum Erythromma viridulum Gomphus pulchellus Aeschna mixta Aeschna cyanea Anax imperator Orthetrum chrysostigma Orthetrum coerulescens Orthetrum brunneum Crocothemis erythraea Sympetrum striolatum Sympetrum fonscolombei TOTAL
x x X
X X
X X X X
X X
X 14
X X
X X
X X X X
X X X X
15
X X X X
X X
X X
X X X
X 15
TABLA I.— Distribución de las especies en las tres localidades estudiadas. Alboraya = Barranco del Carraixet. Estivella = Acequia de Bobalar. Torrente = Horteta. La x señala la presencia de la especie, y en el total el número de especies encontradas en cada localidad.
Acequia del Bobalar
Barranco del Carraixet
Barranco de la Horteta
Acequia del Bobalar 52,6
1,3968 0
57,9 0,321 0,6857
Barranco del Carraixet
45 1f5468 1,0714
TABLA II.—Grado de afinidad entre localidades, valor superior de cada cuadrícula, valores de chi-cuadrado para Zygoptera, cifra media, y Anisoptera, cifra inferior de cada cuadrícula.
119

reflejado para otros países, AGUESSE (1968) para Francia; CONSI-GLIO y cois. (1974) en las cercanías de Roma (Italia); y ROBERT (1958) para Suiza. En general y para el conjunto de especies se aprecia esta mayor amplitud en fase ¡mago, con aparición más temprana y desaparición más tardía, bien ambas (ROBERT, 1958; AGUESSE, 1968; CONSIGLIO y cois., 1974).
ABUNDANCIA ANUAL
Los recuentos lineales efectuados en los recorridos por las orillas, permiten cifrar las frecuencias diarias de las distintas especies. En algunos casos, por dificultades de identificación entre especies pertenecientes al mismo género, los resultados vienen expresados a nivel genérico. Durante los transectos lucía el sol y no soplaba el viento, ello con el fin de mantener las condiciones climatológicas constantes. Las frecuencias diarias están basadas únicamente sobre las observaciones matinales.
/. elegans, C. tenellum y Coenagrion spp, aparecen en agregados en el Barranco del Carraixet y en más abundancia los dos primeros citados, FIGURA 2. En este centro, L viridis y O. chrysostigma son puntuales al igual que P. ¡atipes y C. haemorrhoidalis en la Acequia del Bobalar.
El número de individuos de cada especie censados por sesión se muestran en las FIGURAS 2, Zygoptera, y 3, Anisoptera. Las especies puntuales no están representadas. Zygoptera: E. viridulum, falta en Estivella y su presencia en el Ba
rranco del Carraixet es más o menos constante mientras muestra actividad de vuelo. Otro tanto ocurre con S. fusca en ambas localidades, a pesar del intervalo de julio que debe coincidir con la fase de desarrollo larvario indicada en Francia por AGUESSE (1968) para los meses de mayo y junio. Un mes de retraso presente en dicho proceso la especie en las localidades aquí estudiadas.
/. elegans, tiene a principios de mayo una pequeña cima en Estivella, FIGURA 2, menor no obstante qué los máximos de agosto a principios de septiembre. Hacia el 20 de agosto puede apreciarse un descenso de individuos que vuelve a recuperarse hasta alcanzar la tercera cima de principios de septiembre. A continuación se inicia el descenso hasta su desaparición a mediados de octubre. Su aparición a finales de marzo ocurre con un mes de retraso en relación con el Barranco del Carraixet, donde una primera y pequeña cima se observa hacia el 20 de abril, con descenso posterior y elevarse a finales de mayo por encima de los 50 individuos, abundancia existen-
120

/ / / /
\ I \ I
FIGURA 2.—Frecuencia de individuos (Zygoptera) en el Barranco del Carraixet (pisos A y B) y en la Acequia del Bobalar (estratos C y D). Línea de puntos: /. elegans. Línea discontinua gruesa: C. tenellum. Línea discontinua punteada gruesa: Coenagrion spp. Línea continua gruesa: P. ¡atipes. Línea continua fina: L. virídis. Línea discontinua fina: E. viridulum. Línea discontinua punteada fina: S. fusca. Línea de x: C. splendens. Los trazos horizontales del estrato A muestran el intervalo en que las especies correspondientes a los trazos mantuvieron más de 25 individuos.
121

' \ / \
/ \ ' x ^
/
K i'-- ' 1 \ ñ~
1 < ' • •
I •"> *
U
\ \
- . \ ~ '
V
FIGURA 3.—Frecuencia de individuos (Anisoptera) sobre ei Barranco de la Horteta (estrato A) y Acequia del Bobalar (estrato B). Línea continua gruesa: A. imperator. Línea continua fina: Orthetrum spp. Línea discontinua: C. erythraea. Línea discontinua punteada: Aeschna cyanea. Línea de puntos: Sympetrum spp.
122

te hasta el 14 de julio. No obstante, hasta la primera quincena de septiembre los censos mostraron valores superiores a los quince ejemplares. Desaparecen los últimos individuos un mes después que en la Acequia del Bobalar.
L viridis, puntual en el área más cercana a la costa, presenta una cima inicial a principios de agosto en Estive-lla, FIGURA 2, a continuación puede apreciarse un descenso de la población hasta la tercera decena de agosto para crecer y a principios de septiembre reflejar los superiores valores. Más abundante durante septiembre y octubre que en los restantes meses que presenta la fase ¡mago. En la Acequia del Bobalar es ia especie de desaparición más tardía.
Las especies pertenecientes al género Coenagrion tienen una permanencia de la fase imago más amplia en el Barranco del Carraixet. En Estivella, sólo C. mercuriale y presente únicamente desde fines de mayo a principios de agosto al igual que Ceriagrion tenellum en esta localidad. Las dos especies en el Barranco del Carraixet, TABLA I, desde la primera decena de julio a finales de agosto presentan valores comprendidos entre 10 y 50 individuos. La presencia de ¡magos duplica en el intervalo anual sobre el Barranco del Carraixet al período activo de vuelo en Estivella. Similar modelo presenta C. tene-llum, si bien su desaparición es más temprana que en Coenagrion. C. tenellum es la especie más abundante en el Barranco del Carraixet, una vez que alcanza la cima entre principios de junio y tercera decena de agosto. La frecuencia de individuos y duración de la fase de imago en el resto de las especies existentes en el Barranco del Carraixet puede apreciarse en la FIGURA 2.
Anisoptera: La duración anual de los ¡magos se muestra en la FIGURA 1, para las localidades en ellas citadas. En ei límite de Alboraya y Almacera falta A. cyanea, por otro lado A. mixta es puntual en Estivella. Entre las dos localidades puede apreciarse en las FIGURAS 1 y 3 mayor longitud del período de vuelo activo para las especies comunes en el Barranco del Carraixet. Aeschna llega a coexistir con A. imperator en Estivella, donde las especies pertenecientes a los géneros Orthetrum y Sympetrum son más abundantes de septiembre a noviembre. C. eryth-raea, presenta dos cimas a finales de junio y agosto respectivamente. Sus efectivos hasta el octavo mes del año son superiores a Orthetrum y Sympetrum.
COEXISTENCIA DE ESPECIES.
Aunque a lo largo del año el número de especies para cada localidad varía entre catorce y quince, TABLA I, el número de ellas que
123

FIGURA 4.—Frecuencias acumuladas de las cinco especies más abundantes en Estivella. La línea gruesa continua expresa el número total de odonatos sobre la Acequia del Bobalar en las distintas visitas. La figura permite apreciar, que es a principios de septiembre cuando aparece el mayor número de individuos sobre el área estudiada.
124

03
r--CM CO CM CO
CD T3
O O c CO
ce
X
r--
-3-
c\i • * CM • * • * CM CM co CD m
CD 00 CM CM co co co
co CO T3 03
O
co 03
-*—< "co " > o o c
co C0
> co
O) CM
CM T - 1 - T - CM
CD
ü CD Q. C0 CD
03 • o 03 Ü
CD T3
CO CD
05
Q. E
co
o
CD
ll Ir °>
Q. CD
« CD
CD
O CD Q. CO _
LU O -J
.co C c
•5- CD
a S- • o £ Q-* ^ g. ,°> .« c 5 S.2 CD CD i -C C 2> O ü <0 ^ ^ C * - » - O) co co o
i £ o
co
co 5 "5
Illa CO - 2 3 co
£ . 5 c U ü gj O CD i2 O C3 ^
o
CD Q. E
CO
c ^
CD -Q
CO £-CD C CO P
* : o ^ co
i : *- CD CD o o
i : o c »- ü x O Ü 00
CD
CD
O
(D
E 3 ü
o3
< _ l m < h-
C0
CD - 1 — ' 1 _ O X
125

llegan a coexistir es menor, 10 en el Barranco del Carraixet y en Hor-teta y 9 sobre la Ace.quia del Bobalar. Los resultados obtenidos en Horteta se muestranen la TABLA III, donde puede apreciarse que el mayor número de individuos que coincide con el máximo de especies coexistentes se da en el mes de septiembre. Este mismo mes mantiene igualmente mayor abundancia conjunta en Estivella, reflejo de las mayores frecuencias de L viridis, Orthetrum spp y Sympe-trum spp, FIGURA 4. En Álboraya, los máximos preceden de junio y julio en función de C. tenellum e /. elegans.
El número de especies que llegan a coexistir es similar al señalado para algunas comunidades francesas de Saboya y el Delfinado (DEGRANGE y SEASSAU, 1974) y al máximo obtenido por CONSI-GLIO y cois. (1974) en las cercanías de Roma (Italia).
DISCUSIÓN.
Para las especies no puntuales, el período de vuelo establecido en el conjunto de las tres zonas de estudio, resultan en general superiores a las citadas para otros países europeos. Así, C. haemorr-
shoidalis, C. splendens, L. viridis, P. ¡atipes, I. elegans, A. mixta, entre otras especies aquí tratadas desaparecen más tardíamente que las citadas de AGUESSE (1968) para Europa Occidental y Norte de África. Igualmente, /. elegans y A. imperator aparecen con sensible antelación en particular sobre el Barranco del Carraixet.
Respecto a los resultados de COMPTE (1965) para España, C. splendens y A. mixta, presentan en el área estudiada desaparición más tardía.
Entre las tres localidades, la más cercana a la costa, marca la ocurrencia de un intervalo anual de vuelo más extenso para el conjunto de la odonatofauna.
En función de la clasificación geonémica establecida por CON-Cl y NIELSSEN (1956), puede apreciarse que la composición de la odonatofauna está influida principalmente por elementos mediterráneos y euroasiáticos con alguna incrustación etiópica.
126

RESUMEN.
El estudio de tres cursos de agua en tres localidades cercanas a la costa en la Provincia de Valencia (España), muestra la existencia conjunta de 22 especies, 15 en la Acequia del Bobalar (Estivella) y Barranco de Horteta (Torrente) y 14 en el Barranco del Carraixet (Alboraya). No obstante, únicamente 10 llegan a coexistir. La frecuencia mensual para cada especie y para la comunidad en cada localidad es analizada. La composición geonémica de la odonatoce-nosis está formada por elementos mediterráneos y euroasiáticos.
Las tres comunidades no presentan diferencias, y los períodos de vuelo se mantienen por espacio de tiempo superior que en otros paises europeos.
Conteos lineales fueron utilizados para determinar el número de individuos en cada sesión de trabajo.
SUMMARY.
The study of three water way in three near sealine localities in the Provincia de Valencia (Spain), shows as a whole 22 species of dragonflies, 15 on the Acequia de Bobalar (Estivella) and Barranco de Horteta (Torrente) and 14 on the Barranco del Carraixet (Alboraya). However, only 10 species coexist.
The monthiy frecuency for species and community are analy-zed. The communities are composed for Mediterranean and Euroa-sian members.
There is not differences between the three communities and the flies cycles are more long that other European countries.
Linear census was usabled to determine the individual num-bers on each work sesión.
127

BIBLIOGRAFÍA.
AGUESSE, P. (1968). Les Odonates de l'Europe Occidentale, du Nord de l'Afrique et des Mes Atlantiques. Masson, París. 258 pp.
COMPTE, A. (1965). Distribución, ecología y biocenosis de los odonatos ibéricos. Inst. de Biol. Aplicada. 39: 33-64.
CONCI, C. y NIELSSEN, C. (1956). Fauna d'ltalia. Odonata. Ed. Calderini, Bologna, 295 pp.
CONSIGLIO, C; ÁRGANO, A.; y BOITANI, L (1974). Osservazione ecologiche sugli Odonati adulti di uno stagno dell'ltalia céntrale. Fragmenta entomológica, 9: 263-281.
DEGRANGE, C. y SEASSAU, M. (1974). Odonates Corduliidae de Savoie et du Dauphi-né. Travaux du Laboratoir Hydrobiologique, 64: 289-308.
MARGALEF, R. (1974). Ecología. Ed. Omega. 951 pp. PURROY, F.J. (1972). Comunidades de aves nidificantes en el bosque pirenaico de
Abeto Blanco {Abies alba L). Bol. de la est. centr. de écol., 1: 41-44. ROBERT, P.A. (1958). Les libellules (Odonates). Delachaux et Niestlé Neuchátel.
359 pp.
128