Medición del crecimiento de microalgas
description
Transcript of Medición del crecimiento de microalgas

UNIVERSIDAD AUTÓNOMA DE QUERÉTARO
Cultivo de microalgas Reporte de servicio social
Dirigido por: Dra. Marieke Koopmans
Balderas Hernández Diana Cecilia;Cruz Calixto Jhosafat
25/07/2014

Contenido
I. Introducción ................................................................................................................ 2
II. Antecedentes .............................................................................................................. 2
III. Objetivo ................................................................................................................... 5
IV. Metodología ............................................................................................................. 5
a) Microalgas ............................................................................................................... 5
b) Preparación del medio e inoculación ....................................................................... 5
i. Medio de 1L .......................................................................................................... 5
ii. Medio de 10 y 20L ................................................................................................ 6
c) Densidad óptica (técnica turbidimétrica) .................................................................. 6
d) Medida del peso seco .............................................................................................. 7
e) Conteo al microscopio ............................................................................................. 8
f) Cosecha ................................................................................................................ 10
V. Resultados y discusiones .......................................................................................... 11
a) Observaciones ....................................................................................................... 11
b) Conteo al microscopio ........................................................................................... 12
c) Peso seco .............................................................................................................. 13
d) Cultivo en volumen de 1L ...................................................................................... 14
e) Cultivo en volumen de 10 y 20 ............................................................................... 16
f) Comparación entre los volúmenes de cultivo ........................................................ 18
VI. Conclusiones ......................................................................................................... 19
VII. Recomendaciones ................................................................................................. 20
VIII. Bibliografía ............................................................................................................. 21

I. Introducción
La energía es la fuerza que dirige el crecimiento económico y el desarrollo mundial. En
años recientes, el rápido desarrollo de la economía mundial ha agotado las fuentes de
combustibles fósiles trayendo consigo problemas ambientales importantes, por lo tanto, el
desarrollo y la utilización de nuevas fuentes de energía se ha convertido en una práctica
común en todo mundo. (Marcilla et al, 2012).
El estudio de diferentes aspectos relacionados al comportamiento de las microalgas ha
recibido un interés importante debido al amplio campo de aplicación de estos organismos.
Generalmente, las microalgas contienen cantidades importantes de lípidos, carbohidratos,
proteínas y pigmentos, entre otros componentes. Los cultivos de microalgas han sido
principalmente desarrollados como una importante fuente de productos de nutrición
acuícola, suplementos alimenticios y farmacéuticos; pero también se han sugerido como
buenos candidatos para la producción de combustible. Varios estudios publicados
muestran la posibilidad de obtener biodiesel de alta calidad mediante esterificación y
transesterificación convencionales a partir de los lípidos acumulados en las células de las
microalgas (Valdés et al, 2012).
II. Antecedentes
El incremento en el consumo de energía ha causado varias preocupaciones acerca de la
seguridad energética y la degradación del medio ambiente, más y más atención de parte
de las comunidades académicas e industriales se ha dirigido a producir energía renovable
a partir de biomasa, principalmente biodiesel (Wu et al, 2012) a partir de oleaginosas. Sin
embargo, el cultivo de estas plantas no es sustentable debido al requerimiento de grandes
superficies cultivables, consumo de agua y desplazamiento de otros cultivos destinados
al consumo como alimentos para los seres humanos (Halim et al, 2012).
Las microalgas han sido reconocidas como una prometedora fuente alternativa de lípidos
para la producción de biodiesel. Estas son un grupo de diversos organismos fotosintéticos
que pueden acumular grandes cantidades de lípidos, hasta el 50% del peso seco total en
algunas especies (Halim et al, 2012). El crecimiento de las microalgas se puede generar
en sistemas abiertos como estanques y canales artificiales o sistemas cerrados como
fotobioreactores tubulares o laminares. Siendo las microalgas una forma de vida vegetal

requiere para su crecimiento fuentes de luz, carbono y nutrientes, dichos nutrientes
pueden obtenerse de aguas de desecho mientras que el carbono lo obtienen de la
atmosfera (Demirbas y Demirbas, 2011, Chun-Yen et al, 2011).
Los recipientes de cultivo comúnmente usados son de materiales no tóxicos como las
cajas de Petri, matraces Erlenmeyer, matraces Ferenback, o garrafas, adecuados para
cultivos de laboratorio. Para cultivos a gran escala los recipientes de plástico, madera y
concreto son los más recomendables. En cultivos masivos la aireación es un factor
importante para la homogenización de los nutrientes y para evitar la sedimentación de las
microalgas. Algunas especies suelen acumularse en lugares donde el agua no se mezcla,
éstas también depende de la forma del recipiente de cultivo que cuando no es adecuado
retarda el crecimiento (Torrentera et al, 1989). El crecimiento y la división celular son
afectados por la temperatura y por la penetración de la luz en el cultivo. En los cultivos a
gran escala la profundidad es tan grande que la intensidad de la luz incidente no es
suficiente para la fotosíntesis, hasta el fondo del tanque. La adición de CO2 amortigua el
agua contra los cambios de pH, es recomendable la inyección de CO2 (0.5%) para
contribuir al proceso fotosintético (Catalá-Esteve L, 2013).
Aunque muchas variedades de microalgas tiene un alto contenido lipídico natural, como
se muestra en el cuadro II:1 junto con otros compuestos disponibles, es posible
incrementar la concentración optimizando los factores de crecimiento, como los niveles de
nitrógeno disponibles (Fei-Fei et al, 2013), la intensidad de la luz, la temperatura, la
salinidad, la concentración de CO2 y el procedimiento de cosechado (Elmoraghy et al,
2012). Por eso es necesario poder controlar estas variables durante el cultivo. Sin
embargo, el aumento en la acumulación de lípidos no resulta necesariamente en el
aumento de la productividad. La acumulación se refiere al contenido total de lípidos en
relación al total de la biomasa mientras que la productividad se refiere al total de lípidos
producidos (Brennan y Owende, 2010; Ghasemi et al, 2012).
Cuadro II:1 Perfil de composición de la biomasa de diferentes especies de microalgas.
Especie Lípidos
(%)
Proteína cruda (%)
Carbohidratos (%)
Clorofila total (%)
Carotenoides (%)
Ácidos grasos ω3 (%)
Fuente

Para este estudio se utilizaron únicamente tres especies de microalgas, en el cuadro II:2
se presenta la taxonomía de cada especie.
Cuadro II:2 Clasificación taxonómica.
Especie Taxonomía
C. kessleri Reino: Plantae Filo: Chlorophyta Clase: Trebouxiophyceae Orden: Chlorellales Familia: Chlorellaceae Género: Chlorella
N. oleoabundans Reino: Plantae Filo: Chlorophyta Clase: Chlorophyceae Orden: Sphaeropleales Familia: Neochloridaceae Género: Neochloris
Phaeodactylum Reino: Chromista Filo: Ochrophyta Clase: Bacillariophyceae Orden: Naviculales Familia: Phaeodactylaceae
Phaeodactylum 18 34.6 26.1 2.04 0.243 2.5 Rebolloso-Fuentes, M. (2001)
Nannochloropsis ssp.
18.4 28.8 37.6 0.29 0.06 2.24 Rebolloso-Fuentes, M. (2001)
N. oleoabundans
*35-65 32.2-12.3
9.4-3
*Custodio-Franco, (A. 2013) Band-Schmidt (1999)
Chrorella. vulgaris
14-22 51-58 *16
Becker (2007) *Morris-Quevedo (1999)

III. Objetivo
Evaluar el crecimiento de las especies de microalgas C. kessleri, N. oleoabundans y
Phaeodactylum, cultivadas bajo condiciones controladas en un laboratorio y ambientales
dentro de un invernadero.
IV. Metodología
a) Microalgas
Se utilizaron cepas de Chlorella kessleri, Neochloris oleoabundans, y Phaeodactylum
provenientes de la Universidad Autónoma Metropolitana (UAM). Se cultivaron en 100ml
de agua, previamente esterilizada en una autoclave a una temperatura y presión de 121°C
y 103kPa respectivamente durante 20 minutos, a una concentración de 0.1% Bayfolan
forte, almacenándolas en una incubadora con iluminación 12 horas al día a 120rpm. Se
realiza este mismo procedimiento dos veces al mes.
b) Preparación del medio e inoculación
i. Medio de 1L
En 900 ml de agua se agregan 3 ml de cloro y se deja
en aireación constante durante 24 horas. Después de
transcurridas las 24 horas, se agregan 0.5g de tiosulfato
de sodio y se deja nuevamente en aireación constante
por lo menos 4 horas. Al termino del tiempo de aireación,
se agregan 0.9 ml de solución nutritiva (Bayfolan forte),
inmediatamente después se toman 100 ml de la cepa y
se agregan al agua con
aireación constante e
iluminación, etiquetando los nuevos cultivos con la
especie que contienen, fecha de inoculación, y
concentración de Bayfolan forte del medio. Después de
inocular hay que medir la densidad óptica para saber la
concentración inicial.
Ilustración IV:1 Preparación medio de 1L.
Ilustración IV:2 Preparación medio de 10L.

ii. Medio de 10 y 20L
En 10L de agua se agregan 30 ml de cloro y se deja en aireación constante durante 24
horas. Después de transcurridas las 24 horas, se agregan 5g de tiosulfato de sodio y se
deja nuevamente en aireación al menos durante 4 horas. Al término del tiempo de
aireación, se agregan 10 ml de solución nutritiva (Bayfolan forte), inmediatamente después
se toma 1L de la cepa y se agrega al agua con aireación constante, etiquetando los nuevos
cultivos con la especie que contienen, fecha de inoculación, y concentración del medio.
Una vez que la concentración de los 10L llegue a una densidad óptica aproximada de 1ua
(unidades de absorbancia), se agregan otros 10L que hayan sido previamente preparados
de acuerdo a la metodología anterior para aumentar el volumen del cultivo.
c) Densidad óptica (técnica turbidimétrica)
Está basada en la medida de la turbidez de los medios de cultivo en los que crecen
microorganismos unicelulares. La turbidez es proporcional a la masa de las células en
suspensión.
Ilustración VI:3 Cultivo en volumen
de 10L.
Ilustración VI:4 Cultivo en volumen
de 20L

Se utiliza un espectrofotómetro visible (Thermo scientific) para determinar densidad óptica
de la muestra. Se realiza la medición a 3 longitudes de onda (530, 680 y 750 nm). Se
utilizan las lecturas a 750 nm para medir la tasa de crecimiento porque la absorbancia a
esta longitud de onda es proporcional al número de células que hay en un cultivo y es una
medida eficaz debido a que ningún pigmento absorbe a 750 nm. Las otras lecturas, son
para la absorción de pigmentos carotenoides (530 nm) y para la absorción de clorofila a
(680 nm).
Agitar el medio para que las muestras sean lo más homogéneas posibles, especialmente
en el medio de 10 y 20L.
Cuando las lecturas superen la unidad de absorbancia, se deben realizar las diluciones
necesarias para mantener valores menores a uno. Cuando se realice cualquier dilución
de la muestra, esta debe leerse por duplicado.
El valor promedio de las dos lecturas obtenidas para cada dilución se multiplicara por el
factor de dilución y así reportar en graficas de acuerdo al valor real.
Ejemplo:
Registrar la hora exacta de la medición para establecer un comportamiento real del
crecimiento.
d) Medida del peso seco
Consiste en la filtración del cultivo a través de una membrana que retenga las células y su
posterior desecación hasta peso constante.
0
0.5
1
1.5
2
2.5
0 5 10 15
Ab
sorb
anci
a (7
50
nm
)
Dias
C. Kessleri
N. oleabundans
Phaeodactilum

Se coloca el papel filtro (Whatman #1) en la estufa a 70°C un día antes de la medición
(peso papel filtro). Una vez que el papel filtro este a peso constante, se saca de la estufa,
se deja enfriar en un desecador y luego se debe tomar lectura del peso. Con la ayuda de
una pipeta y agitando el medio para que las muestras sean lo más homogéneas posibles,
se lleva a cabo la filtración de 10 ml de muestra del cultivo, por duplicado. Se seca en la
estufa a 70 °C la muestra filtrada, durante un día (peso muestra seca). Al día siguiente se
pesa el papel, después de haberlo dejado enfriar en un desecador, para establecer la
fracción de peso que corresponde a la muestra. Al final se multiplica por un factor de 100
para obtener una concentración de g/L.
𝑝𝑒𝑠𝑜 𝑠𝑒𝑐𝑜 =(𝑝𝑒𝑠𝑜 𝑚𝑢𝑒𝑠𝑡𝑟𝑎 𝑠𝑒𝑐𝑎 − 𝑝𝑒𝑠𝑜 𝑝𝑎𝑝𝑒𝑙 𝑓𝑖𝑙𝑡𝑟𝑜)
10𝑚𝑙× 1000𝑚𝑙 =
𝑔
𝐿
e) Conteo al microscopio
Se efectúa un conteo directo de células en un área determinada para obtener el número
de células por mililitro de muestra.
Utilizando una cámara Neubauer, se toma una muestra del cultivo con ayuda de una pipeta
Pasteur y se coloca en la cámara limpia y completamente seca. Se observa en el
microscopio con el objetivo 40x. Con el número de células obtenidas, se define el número
de microalgas por mililitro de muestra.
El número de células es la suma de todas las células contadas en todos los cuadros.
Ejemplo.
Como el volumen de 1 cuadro grande es:
0,1 cm x 0,1 cm = 0,01 cm2 de superficie
0,01 cm2 x 0,1 mm (profundidad) = 0,01 cm2 x 0,01 cm = 0,0001 cm3 = 0,0001 ml
La fórmula para recuento con cuadros grandes en cámara de Neubauer

En el caso de que se haga una dilución, se tomara en cuenta ese factor para encontrar la
concentración:
Contar las células en los cuadros donde se les haga más fácil su observación y encontrar
una cantidad de por lo menos 300 células.
El cuadrado grande central (que se puede ver en su totalidad con el objetivo 10X; ver
figura), está dividido en 25 cuadrados medianos (con el objetivo 40X se pueden ver los
cuadrados medianos completamente; ver figura), cada uno de ellos con 16 cuadrados
pequeños en su interior. Los cuatro cuadrados grandes de las esquinas (no se muestran
en la figura), están formados por 16 cuadrados medianos.
El recuento se puede realizar tanto en el cuadrado grande central como en los de las
esquinas, dependiendo del tamaño de las células en estudio.

f) Cosecha
La cosecha se realiza en tinas con capacidad suficiente para el medio de 20 L. Dejando
que el agua de evapore para obtener microalgas secas. El medio de cultivo debe estar en
un rango aproximado de 1.5ua cuando se deposite en las tinas.
Las tinas deben estar forradas con plástico grueso por el interior, para hacer más sencilla
la recolección de las microalgas secas y tener la menor perdida posible. También se deben
cubrir con una malla negra para evitar contaminaciones en el cultivo y aumentar la
temperatura de secado dentro de la tina.
Etiquetar la tina con la especie, el día y la absorbancia a la que inicia el secado.
Pesar la materia seca obtenida, guardar en recipientes cerrados, etiquetando con la
especie, fecha de inoculación en medio de 20L y fecha de cosecha.

V. Resultados y discusiones
a) Observaciones
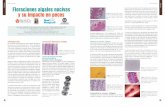
Se observaron las caracteristicas físicas de las especies de microalgas Chlorella kessleri,
Neochloris oleabundans y Phaeodactylum (Cuadro V.1), cultivadas en recipientes de 1L
con Bayfolan 0.1%, aereación 24 horas al dia e iluminacion artificial.
Cuadro V:1 Observaciones e imágenes de las especies de microalgas cultivadas.
Especie Observaciones Imagen 40x
C. kessleri Células bien separadas, de igual tamaño entre ellas y pequeñas en comparación con otras especies.
Tienen movimiento vibratorio escaso. Había pocas agrupaciones.
Tienen buena distribución pero comienzan a agruparse en pares.
Imagen IV:5 Forrado del interior de las tinas. Imagen IV:6 Etiquetado y cobertura de las
tinas con malla negra.

N. oleoabundans
Habia varias agrupaciones de celulas y estas variaban en tamaño, habia celulas muy pequeñas respecto a las demas.
Existia poco movimiento vibratorio o casi nulo. Tenian tamaño variado, grandes y muy pequeñas.
Tienen un tamaño pequeño y homogeneo entre ellas. No se han agrupado mas.
Phaeodactylum Había escasas células alargadas y ovoides con la pared celular bien definida.
Hay gran población con respecto a las demás especies, no se encuentran aisladas pero tampoco están aglutinadas entre ellas.
Continúa la presencia de microalgas alargadas aunque en menor proporción que las ovoides.
b) Conteo al microscopio
Se midió el crecimiento de las especies microalgales utilizando la técnica de conteo al
microscopio, se estableció una relación respecto a la densidad óptica a 750nm que nos
permite obtener un valor exacto de número de células por mililitro de forma rápida y
eficiente sin tener que realizar nuevamente la metodología descrita anteriormente. En las
gráficas de la figura V:1 se muestran las ecuaciones de densidad óptica de las tres
especies estudiadas, podemos observar que la especie C. kessleri muestra la mejor

correlación entre los puntos obtenidos, a diferencia de N. oleoabundans y Phaeodactylum
cuya relación entre la absorbancia y el conteo de células es muy dispersa y por lo tanto,
el cálculo de células a partir de la ecuación será inexacto.
Figura V:1 Variación de la concentración de células respecto a la densidad óptica de C. kessleri, N. oleoabundans y Phaeodactylum.
c) Peso seco
El monitoreo del peso seco de los cultivos de microalgas nos permite obtener la cantidad
de materia seca que se puede alcanzar en una determinada fase del cultivo, a partir del
valor de densidad óptica a 750nm podremos predecir el rendimiento en la cosecha. En
figura V:2 se muestra las ecuaciones de peso seco de las tres especies estudiadas, para
comprobar su veracidad se puede comparar el rendimiento teórico con el real.
Desafortunadamente C. kessleri y N. oleoabundans no alcanzaron una densidad óptica
alta debida a factores ajenos al cultivo, pero las correlaciones obtenidas por parte de las
tres especies nos permite asegurar resultados confiables.
y = 1E+07x -556363
R² = 0.7988
0
10
20
30
40
50
60
70
0 1 2
Cel
ls/m
l
Mill
on
es
Absorbancia (750nm)
C. kessleri
y = 2E+07x -819450
R² = 0.7245
0
10
20
30
40
50
60
70
0 1 2
Cel
ls/m
l
Mill
on
es
Absorbancia (750nm)
N. oleabundans
y = 3E+07x -6E+06
R² = 0.7059
0
10
20
30
40
50
60
70
0 1 2
Cel
ls/m
l
Mill
on
es
Absorbancia (750nm)
Phaeodactylum

Figura V:2 Variación del peso seco respecto a la densidad óptica de C. kessleri, N. oleoabundans y
Phaeodactylum.
d) Cultivo en volumen de 1L
Se cultivaron en volúmenes de 1L, 9 generaciones para las especies C. kessleri y N.
oleoabundans y 8 generaciones para la especie Pheodactylum, dentro de un lapso de
tiempo que comprende del 27/08/2013 al 13/06/2014. En figura V:3 se presentan todas
las generaciones cultivadas para cada especie, las generaciones están ubicadas en orden
cronológico comprendido en el periodo de estudio, expresado anteriormente. En
Phaeodactylum no se cultivó la generación 6 (G6) y en las otras dos especies esta
generación tuvo un comportamiento diferente, puesto que tiende a disminuir el peso seco
en el penúltimo día de cultivo y luego vuelve a incrementar, esta diferencia pudo haber
sido producto de no tener un agitado adecuado del medio que contenía a las microalgas
al momento de tomar la muestra, tal circunstancia se considera como un error debido al
operador.
y = 0.5933x + 0.1363
R² = 0.9304
0
0.2
0.4
0.6
0.8
1
1.2
1.4
1.6
0 1 2
Pes
o s
eco
(g/
L)
Absorbancia (750nm)
C. kessleri y = 0.4506x + 0.1681
R² = 0.9901
0
0.2
0.4
0.6
0.8
1
1.2
1.4
1.6
0 1 2
Pes
o s
eco
(g/
L)
Absorbancia (750nm)
N. oleabundans y = 0.5661x + 0.1825
R² = 0.9879
0
0.2
0.4
0.6
0.8
1
1.2
1.4
1.6
0 1 2
Pes
o s
eco
(g/
L)
Absorbancia (750nm)
Phaeodactylum

Figura V:3 Peso seco respecto a los días de cultivo para las generaciones cultivadas en un volumen de 1L de C. kessleri, N. oleoabundans y Phaeodactylum.
Con base a la gráfica podemos decir que se puede obtener de 0.4 a 1.2 g de C. kessleri/L
habiendo transcurrido alrededor de 10 días, indicando que su crecimiento no es constante
entre generaciones principalmente después de la séptima generación. N. oleoabundans
tiene una diferencia de peso seco menor en los mismos 10 días, ayudando a establecer
que en un periodo de tiempo determinado se obtendrá una cantidad definida de peso seco,
solo la última generación fue la que presentó un comportamiento diferente. Para
Phaeodactylum el comportamiento de las generaciones es muy similar entre ellas
siguiendo casi la misma trayectoria y dando un mejor crecimiento de la especie durante
todas las inoculaciones realizadas.
Es importante destacar que, cuando es una misma generación, las especies de microalgas
se comportan de forma similar entre ellas, es decir, que C. kessleri, N. oleoabundans y
Phaeodactylum cultivadas en volumen de 1L, son susceptibles a los mismos factores. Se
obtuvo la ecuación exponencial de crecimiento para cada generación que se cultivó en
volumen de 1L de cada especie, y así, se pudo conocer el incremento del peso seco por
día, en el cuadro V:2 se presenta un resumen de los datos extraídos y el análisis
estadístico de la tasa de incremento del peso seco por día para cada especie.
0.0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
0 10 20
Pes
o s
eco
g/L
Dias
C. kessleri
0.0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
0 10 20
Pes
o s
eco
g/L
Dias
N. oleoabundans
0.0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
0 10 20
Pes
o s
eco
g/L
Dias
Phaeodactylum

Cuadro V:2 Datos generales para cada especie, tomando en cuenta todas las generaciones cultivadas en volumen de 1L.
C. kessleri N. oleoabundans Phaeodactylum
N (número de generaciones
cultivadas) 9 9 8
Densidad óptica máxima (ua)
1.983 2.368 2.031
Peso seco máximo (g/L)
1.310 1.235 1.332
Promedio de la tasa de incremento de
peso seco (g/L/día) 0.113 0.116 0.124
Desviación estándar (g/L)
0.041 0.037 0.037
Podemos observar que a pesar de que N. oleoabundans alcanzó la densidad óptica más
alta, en comparación con las otras especies, ésto no quiere decir que su peso seco sea
también el más alto, por otro lado Phaeodactylum tiene la mayor tasa de incremento de
densidad óptica diaria, el peso seco obtenido es mayor, comparándolo con las demás
especies, además de que se ve favorecido por la desviación estándar. C. kessleri se ve
afectada por los altos valores de desviación estándar, pero a pesar de ser el cultivo que
menor valor de densidad óptica alcanzó, el peso seco que se calculó mediante el uso de
la ecuación ocupa el segundo lugar.
e) Cultivo en volumen de 10 y 20
El cultivo en volúmenes de 10 y 20L se llevó a cabo dentro de un invernadero, pero la
temperatura dentro de éste era muy susceptible a las condiciones ambientales e incluso
a los cambios que había entre el día y la noche.
Primero se inocula un medio de 10L y después de alcanzar cierta absorbancia, se puede
realizar una dilución a 20L para obtener mayor cantidad de microalgas con el mismo monto
de cepa. Cómo no se conocía la absorbancia adecuada para realizar la dilución se llevaron
a cabo 2-3 generaciones de cultivo para encontrar un valor que permitiera la dilución y así
obtener buen crecimiento en el volumen de 20L y poder cosechar de mayor materia seca.
La primera generación (G1) se inoculó el 09/09/2013 (día 0) para las tres especies en
volúmenes de 10L, se realizó la dilución a 20L solo para C. kessleri el 13/09/2013 (día 4)

y para N. oleoabundans y Phaeodactylum el 20/09/2013 (dia11). En esta generación se
alcanzaron valores de absorbancia cercanos a 0.6ua antes de la dilución (figura V:4) y el
comportamiento de crecimiento después de la dilución continuó para las tres especies
logrando llegar a 0.8ua en volumen de 20L. Excepto para Phaeodactylum que no registró
buen crecimiento desde el inicio.
La segunda generación (G2) se inoculó el 03/10/2013 (día 0) solo para las especies N.
oleoabundans y Phaeodactylum, la dilución se hizo el 15/10/2013 (día 10) a valores
cercanos a 0.8 ua., pero el crecimiento en volumen de 20L solo igualo el valor obtenido
antes de la dilución (Figura V:4), Phaeodactylum volvió a presentar problemas de
crecimiento al inicio pero se recuperó después de la dilución.
La tercera generación G3 se inoculó el 27/01/2014 (día 0) para todas las especies, la
dilución se realizó el 4/02/2014 (día 8) cuando las absorbancias casi alcanzaban la unidad
(Figura V:4), aunque Phaeodactylum ya había llegado a 1.6ua en ese momento. En el
medio de 20L se hizo notar un crecimiento continuo llegando a valores de 1.4 ua para C.
kessleri y N. oleoabundans, mientras que Phaeodactylum alcanzó nuevamente valores de
1.6ua, esta generación tuvo el mejor crecimiento y podemos realizar la dilución desde un
valor de 1 ua y aun así obtener un buen crecimiento en medios de 20 L.
Figura V:4 Crecimiento de C. kessleri, N. oleoabundans y Phaeodactylum en un volumen de 10 y 20L.
0
0.2
0.4
0.6
0.8
1
1.2
1.4
1.6
0 10 20
Ab
sorb
anci
a (7
50
nm
)
Dias
C. kessleri
0.0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
1.6
0 10 20
Ab
sorb
anci
a (7
50
nm
)
Dias
N. oleoabundans
0
0.2
0.4
0.6
0.8
1
1.2
1.4
1.6
0 10 20
Ab
sorb
anci
a (7
50
nm
)
Dias
Phaeodactylum

En los cultivos en volumen de 10L encontramos que se puede realizar la dilución a 20L
con una absorbancia de 1 y cosechar en un periodo aproximado de 25 días para todas las
especies, con una absorbancia cercana a 1.5. En base a observaciones donde dejamos
que el crecimiento siguiera después de los 25 días se notaron acumulaciones marrones y
por eso sugerimos que el cultivo no supere 30 días.
Se calculó el rendimiento teórico (a partir de la ecuación de peso seco para cada especie)
al momento de pasar la tercera generacion de microalgas cultivadas en volumen de 10 y
20L a las tinas de secado. Tras cosechar esta misma generación de microalgas en tinas
de evaporacion se obtuvo un rendimiento real. Ambos valores se expresan en el cuadro
V:3. La diferencia de valores puede ser resultado a que en las tinas de cosecha los cultivos
siguieron creciendo, no se sabe si esto ocurrio porque se dejo de medir en ese lapso de
tiempo (alrededor de 30 dias).
Cuadro V:3 rendimiento teórico y real de la tercera generación (G3) de cultivo de microalgas en volumen de 10 y 20L.
C. kessleri
(g de materia seca/L)
N. oleoabundans
(g de materia seca/L)
Phaeodactylum
(g de materia seca/L)
Rendimiento
teórico 0.968 0.768 1.105
Rendimiento
real 1.9013 1.7814 1.9570
f) Comparación entre los volúmenes de cultivo
Se realizó una comparación entre los cultivos de 1L dentro del laboratorio y los de 10L en
el invernadero, inoculados el mismo día (09/09/2013) para observar como afectaban las
condiciones el crecimiento en los dos lugares.

Figura V:5 Crecimiento en volúmenes de 1L y 10L de las tres especies inoculadas el 09/09/2013.
En Figura V:5 se observa que si tienen el mismo comportamiento en los dos volúmenes
para C. kessleri y N. oleoabundans que comenzaron en valores similares de absorbancia
pero que en Phaeodactylum esta circunstancia no favoreció a que el crecimiento se
pareciera entre los dos volúmenes.
Con los resultados anteriores puede decirse que no existe una variación entre el cultivo
en laboratorio, bajo condiciones controladas, y el de invernadero, bajo condiciones
ambientales; pero si se compara la misma generación de volumen de 1L expuesta en la
figura V:5 con la tercera generación de volumen de 10 y 20L no hay una comportamiento
parecido en el crecimiento, siendo mucho mayor en el invernadero, sugiriendo que las
condiciones ambientales favorables para el cultivo en general se dieron en el periodo del
27/01/2014 al 19/02/2014.
VI. Conclusiones
Se evaluó el crecimiento de tres especies de microalgas bajo las mismas condiciones de
cultivo entre ellas. A lo largo de todas las generaciones en donde se llevó a cabo el conteo
de células en relación a la absorbancia a 750nm, nos dimos cuenta de que es complicado
lograr obtener una correlación cercana a la unidad, ya que esta medición es muy
susceptible al error humano, afortunadamente, este aspecto no tuvo gran influencia sobre
0
0.2
0.4
0.6
0.8
1
1.2
0 5 10
Ab
sorb
anci
a (7
50
nm
)
Dias
C. kessleri
0
0.2
0.4
0.6
0.8
1
1.2
0 5 10
Ab
sorb
anci
a (7
50
nm
)
Dias
N. oleoabundans
0
0.2
0.4
0.6
0.8
1
1.2
0 5 10
Ab
sorb
anci
a (7
50
nm
)
Dias
Phaeodactylum

la medición del peso seco respecto a la absorbancia que si permitió obtener correlaciones
más grandes entre los datos y nos da una medida fiable del peso seco de una muestra
microalgal.
En las generaciones del cultivo de 1L para las tres especies, se encontró que
considerando como aspectos importantes, las características de la experiencia práctica,
de tasa de incremento de peso seco diario, valores de absorbancia máximos, tiempos de
crecimiento, y el análisis estadístico, Phaeodactylum se considera como la mejor opción
de las tres especies estudiadas. En el cultivo en volumen de 10L se definió como 1ua el
valor adecuado para la dilución a 20L y que a partir de este valor hacia arriba se obtendrán
buenos crecimientos en este volumen en un periodo aproximado de 25 días a partir de la
inoculación del medio de 10L. Comparando los resultados de peso seco que se puede
obtener con la última absorbancia registrada al momento de la cosecha del volumen de
20L y el peso seco obtenido realmente después del secado encontramos que se cosechó
más cantidad de materia seca de lo que se esperaba teóricamente lo que significa que
puede seguir creciendo en el periodo de secado en las tinas donde no se realizaron
mediciones.
Con la comparación entre los medios de 1 y 10L podemos decir que a pesar de que hayan
coincidido en el crecimiento durante una generación inoculada en la misma fecha, no
sucede así con generaciones inoculadas en distintas fechas, entendiendo que cuando las
condiciones ambientales cambian el crecimiento también lo hace.
VII. Recomendaciones
La inoculación para un medio de 10L se debe hacer con 1L de microalgas que alcancen
un valor no menor 1ua, para que el crecimiento sea eficiente.
Para realizar un buen monitoreo del crecimiento es imprescindible agitar bien el medio
de cultivo para homogenizar la muestra.
Sí que el crecimiento no es favorable, se puede agregar la cantidad de Bayfolan forte
equivalente al 0.1% del volumen total.
Es importante tener cuidado de mantener aireación constante en todo el cultivo.
Cuidar que no se contamine el cultivo en la fase de secado.

Cada preparación de cultivo e inoculación de los medios de 1, 10 y 20L debe hacerse
con las medidas de sanidad más estrictas posibles, limpiando el área de trabajo,
lavando los recipientes con agua y jabón y desinfectando mangueras y filtros con cloro.
Tratar de cosechar los cultivos de 20L en un periodo no mayor a 30 días o antes de
que se puedan ver aglutinaciones marrones.
VIII. Bibliografía
(s.f.). Obtenido de http://www.fao.org/docrep/field/003/ab473s/ab473s02.htm
Band-Schmidt. (1999). Efecto de la composicion bioquimica de microalgas sobre el valor
nutritivo de dos cepas de Artemia. Tesis para obtener el grado de Maestro en
Ciencias, CICIMAR .
Becker, E. W. (1994). Microalgae Biotechnology and microbiology. Cambridge University
Press, Cambridge.
Brennan, L., & Owende, P. (2010). Biofuels from microalgae—A review of technologies
for production, processing, and extractions of biofuels and co-products.
Renewable and Sustainable Energy Reviews 14, 557–577 .
Catalá-Esteve, L. (2013). Contribución al estudio del crecimiento y las posibilidades del
aprovechamiento termoquímico de las microalgas Nannochloropsis gaditana y
Nannochloropsis oculata.
Chun-Yen, C., Kuei-Ling, Y., Rifka, A., Duu-Jong, L., & Jo-Shu, C. (2011). Cultivation,
photobioreactor design and harvesting of microalgae for biodiesel production: A
critical review. Bioresource Technology 102, 71–81 .
Custodio-Franco, A. (2013). Biodiesel de microalgas: Avancos e desafíos. Quim Nova,
437-448.
Demirbas, A., & Demirbas, M. (2011). Importance of algae oil as a source of biodiesel.
Energy Conversion and Management 52, 163–170 .
Elmoraghy, M., Webster, T., & Farag, I. (2012). Microalgae Lipid Triggering by Cooling
Stressing. Journal of Energy and Power Engineering 6, 1918-1924 .
Fei-Fei, C., Pei-Na, C., Pei-Jie, C., Wen-Wei, L., Paul, K. L., & Raymond, J. Z. (2013).
Phosphorus plays an important role in enhancing biodiesel productivity of
Chlorella vulgaris under nitrogen deficiency. Bioresource Technology 134, 341–
346.

Ghasemi, Y., Rasoul-Amini, S., Naseri, A., Montazeri-Najafabady, N., Mibasher, M., &
Dabbagh, F. (2012). Microalgae Biofuel Potentials (Review). Applied Biochemistry
and Microbiology 48(2), 126–144.
Halim, R., Danquah, M., & Webley, P. (2012). Extraction of oil from microalgae for
biodiesel production: A review. Biotechnology Advances 30, 709–732 .
Infante, C., Angulo, A., Zárate, A., Flores, J., Barrios, F., & Zapata, C. (2012). Cultivation
of Chlorella sp. microalgae in batch culture: cell growth kinetics.
Marcilla, A., Catalá, L., García-Quesada, J., Valdés, F., & Hernández, M. (2012). A
review of thermochemical conversion of microalgae. Renewable and Sustainable
Energy Reviews.
Morris-Quevedo, H., Quintana-Cabrales, M., Almarales-Arceo, A., & Hernandez-Nazario,
L. (1999). Composición bioquímica y evaluación de la calidad proteica de la
biomasa autotrófica de chlorella vulgaris. Rev Cubana Aliment Nutr.
Rebolloso-Fuentes, M. (2000 ). Biomass nutrient profile of the microalga Phaeodactylum
tricornutum. Journal of food Biochemstry, 57-76.
Torrentera-Blanco, L., Tacon, A. (1989). La producción de alimento vivo y su importancia
en acuacultura. Programa cooperativo gubernamental.
Valdés, J., Hernández, F., Catalá-L, A., & Marcilla, M. (2012). Estimation of CO2
stripping/CO2 microalgae consumption ratios in a bubble column photobioreactor
using the analysis of the pH profiles. Application to Nannochloropsis oculata
microalgae culture. Renewable and sustainable, 1-6.
Wu, X., Ruan, R., Du, Z., & Liu, Y. (2012). Current Status and Prospects of Biodiesel
Production from MicroAlgae. Energies 5, 2667-2682.