MANUAL DE DIAGNÓSTICO INMUNOLÓGICO...
Transcript of MANUAL DE DIAGNÓSTICO INMUNOLÓGICO...

UNIVERSIDAD DE EL SALVADOR
FACULTAD DE MEDICINA
DEPARTAMENTO DE MICROBIOLOGÍA
PROGRAMA Y
MANUAL DE DIAGNÓSTICO INMUNOLÓGICO
2019
COORDINADOR
Lic. Mauricio Alejandro Valladares Morales
CO-COORDINADOR
Licda Rita Evelyn Valencia de Recinos

2
CONTENIDO PROGRAMÁTICO
I. GENERALIDADES
Nombre de la Asignatura: Diagnóstico Inmunológico
Código: DXI1101
Impartidas a estudiantes de: Licenciatura en Laboratorio Clínico
Ubicación en el currículum: 4° año primer ciclo
Pre-requisitos: Microbiología y Parasitología Médica
Química Clínica
Unidades Valorativas: 4
Horas semanales: 4 horas teóricas
2 horas prácticas
Duración del ciclo: 16 semanas
Año lectivo: 2019
II. DESCRIPCIÓN
La asignatura de Diagnóstico Inmunológico pretende, proporcionar al estudiante
de Microbiología el conocimiento teórico – práctico necesarios para contribuir en el
diagnóstico de enfermedades infecciosas y otro tipo de patologías, a través de la
aplicación de los principios científicos de la inmunología básica y clínica y además del
buen trabajo realizado en el laboratorio. Para ello aspiramos llegar a orientar
adecuadamente al estudiante de Microbiología para que su trabajo lo desempeñe con
objetividad y responsabilidad.
III. OBJETIVOS
OBJETIVO GENERAL
Interpretar los fundamentos teóricos metodológicos de la Inmunología para la aplicación
de las diferentes técnicas que contribuirán al diagnóstico clínico en el humano.

3
Objetivos Informativos
En el área de los conocimientos que el alumno:
1. Comprenda y explique los mecanismos fisiológicos y bioquímicos que conducen a
la respuesta inmune en el humano
2. Sepa puntualizar la importancia de la respuesta inmune como factor de resistencia
y producción de la enfermedad.
3. Entienda cual es la función del inmunodiagnóstico en la medición de la respuesta
inmune en el humano.
4. Aplique los conocimientos teóricos de inmunología básica y clínica en las técnicas
de laboratorio de inmunodiagnóstico.
5. Interprete los resultados obtenidos en las pruebas de laboratorio, haciendo uso de
sus conocimientos teóricos de inmunología.
Objetivos Formativos
En el área de hábitos y actitudes:
1. Fomentar en el alumno la honestidad y el sentido de responsabilidad que requiere
el trabajo de laboratorio de inmunodiagnóstico.
2. Fomentar el deseo de superación continuo, cultivando el hábito de la consulta
bibliográfica en libros y revistas científicas, así como la lectura crítica de los
mismos, como parte del aprendizaje.
3. Aprenda a trabajar en grupo
4. Ensaye la técnica de exponer y debatir de forma crítica el material de apoyo en las
diferentes actividades de la asignatura.
5. Fomentar en el estudiante el sentido de responsabilidad en las tareas asignadas.
IV. DESCRIPCION DE ACTIVIDADES ACADEMICAS
El curso comprende las siguientes actividades: Clases teóricas, laboratorio,
sesiones de grupo, consultoría programadas y seminarios. La asistencia a cada una de
ellas es de carácter obligatorio. Las inasistencias deberán ser justificadas y
respaldadas con la respectiva documentación.

4
ACTIVIDAD N ° ACTIVIDAD
POR SEMANA
HORARIO
Clases 17 1 Martes de 8:00 a
10:00 am
Prácticas de
laboratorio
12 1 Martes de 10:00 a
12:00 m
Sesiones grupo/
controles lectura*
12 1 Jueves de 8:00 a
10:00 am
V. METODOLOGÍA
Clases:
Se impartirán de una a dos clases teóricas por semana el día martes de 8:00 a
10:00 am, según la calendarización. La asistencia puntual y permanencia en ellas se
considerará obligatoria.
Cada profesor participante en el curso utilizará el material y equipo que considere
necesarios para el mejor aprovechamiento y asimilación de la temática a desarrollar.
Cabe aclarar que queda a discreción de cada docente el préstamo de material utilizado
en su exposición.
Prácticas de laboratorio:
Cada semana se desarrollará una práctica de laboratorio, que tendrá una duración
de dos horas, los días martes de 10:00 a 12:00 am. Según los objetivos que
corresponden a la práctica que se realizará ese día, se hará una breve explicación y
distribución de los materiales con los cuales se contará para el desarrollo de la técnica
antes de cada práctica. Para ello todos los estudiantes estarán en la obligación de
desarrollar previo a la práctica, una guía la cual está incluida en su manual, ya que
esta será de apoyo para el desarrollo y comprensión de la misma. Deberán además
realizar flujogramas esquematizados, así como también durante el laboratorio tomar
notas, anotar los resultados, hacer observaciones, análisis e interpretación de los
mismos.

5
Cada práctica de laboratorio está diseñada para que se trabaje en pareja y los
estudiantes conservarán el área de trabajo asignada hasta el final del curso, siendo
directamente responsables de que se cumplan las normas de bioseguridad básicas y
traer los implementos que se requieran tales como: guantes, lentes protectores,
papel toalla, jabón, lápiz graso, tirro, fósforos, etc. Además es OBLIGACION, que para
el desarrollo de cada práctica el estudiante lleve consigo su manual de laboratorio y su
propia gabacha para el desarrollo de la misma.
Sesiones de grupo y controles de lectura
Las sesiones de grupo y/o controles de lectura serán realizadas en el transcurso de
las semanas que dure la asignatura y se desarrollarán de acuerdo a los contenidos
programáticos de ella. El material para ello se facilitará con la debida anticipación. El
estudiante leerá el mismo de forma analítica y crítica, haciendo uso de subrayado y/o
elaborando cuestionarios, resúmenes o mapas conceptuales con la finalidad de una
mejor comprensión del tema.
VI. SISTEMA DE EVALUACION
Este componente pretende evaluar el aprendizaje de los estudiantes a lo largo de
la asignatura y asi mismo constatar los resultados con el avance obtenido de cada
estudiante. Se aplica una evaluación sumativa que permite la acreditación que exige el
Reglamento de Evaluación de la Universidad de El Salvador. La nota mínima de
promoción es de seis punto cero (6.0). Además habrá un examen de suficiencia, al
cual tendrán derecho todos aquellos estudiantes cuya nota final sea entre 5.0 y 5.9.
Este examen esta normado por el Reglamento de Administración Académica de la
Universidad de El Salvador en el artículo 17-A. La nota del examen de suficiencia se
promediará con la calificación final obtenida en el ciclo, y el promedio será la nota
final definitiva (nota final 50% más examen de suficiencia 50%)
A. Evaluaciones Exámenes
Habrán dos exámenes, los cuales serán teórico – prácticos. En el teórico se evaluarán
aspectos impartidos en las clases y en el práctico las destrezas adquiridas durante el
trabajo en el laboratorio. Cada uno tiene su respectivo porcentaje.

6
Nota importante:
Con la finalidad que se aclaren dudas se hará una revisión de cada examen y será
el día de entrega de notas con base al reglamento de gestión académica (Ver más
adelante)
La realización, así como la revisión y resolución de cada examen, se hará dentro del
horario de las actividades del curso, ya que no se harán revisiones individuales.
B. Evaluaciones frecuentes
Exámenes cortos de laboratorio
Los días martes se realizará antes de iniciar clases un examen corto
correspondiente a la práctica de la semana anterior. En él se evaluará el contenido de
la guía prelaboratorio, el contenido del manual y los resultados obtenidos en la
práctica. La inasistencia a uno de estos exámenes equivale a cero, excepto cuando sea
justificada de acuerdo a lo establecido en el artículo 19 del Reglamento de Registro
Académico; en estos casos el coordinador comunicará al estudiante el procedimiento a
seguir.
Exámenes de Sesiones de Grupo:
Estos constarán de dos evaluaciones cortas: un examen pre-sesión con el que se
pretende mediante preguntas generales constatar que el estudiante ha leído y
estudiado el material asignado y un examen post-sesión en el cual se analizará el
grado de comprensión de cada estudiante al finalizar la discusión del material de
apoyo brindado.
IMPORTANTE: Si un estudiante llega 15 minutos después de iniciada la actividad se
tomará como inasistencia y perderá su nota
Exámenes de controles de lectura:
La evaluación será realizada con base a un examen de un tema específico versado en
un material de lectura previamente entregado a los estudiantes. Dichos temas llevan
relación con las sesiones de grupo a realizar.

7
Examen de Suficiencia.
En él se examinarán todos los contenidos programáticos de la asignatura
incluyendo las clases, sesiones de grupo, laboratorios y seminarios y corresponderá al
70% y el examen práctico el 30%
Consideraciones para todo tipo de evaluación:
a) Toda actividad ponderada será evaluada de forma individual, salvo alguna
excepción.
b) Aquel estudiante que haga uso de métodos ilegales para contestar algún examen
recibirá en primera instancia una amonestación verbal pero si persiste se le
retirará el examen perdiendo dicha nota. Si el fraude se considera muy grave se
procederá según lo señalado en el régimen disciplinario de la Universidad de El
Salvador.
c) Si algún estudiante llega tarde a una evaluación después de iniciada, pero aún no
ha salido ninguno de sus compañeros, podrá comenzar la prueba, pero terminará
en el momento en el que el profesor lo indique para todo el grupo. Pero si el
estudiante llega después que haya salido un estudiante, no podrá hacer el examen
en ese momento.
d) La resolución en casos de inasistencia a una actividad evaluada se hará en base a
los términos descritos en el “Normativo de interés para el estudiante” (ver más
adelante).
e) Los exámenes diferidos teóricos por acuerdo del coordinador serán realizados en
forma oral.
C. NORMAS Y CRITERIOS PARA RESPONDER UN EXAMEN
1. Las consultas de estudiantes se limitaran únicamente al aspecto del formato del
examen. Si hay observaciones con las preguntas se discutirá posteriormente con sus
representantes estudiantiles.
2. Es responsabilidad del estudiante verificar que el examen este completo, si faltan
páginas y no lo comunica al encargado de aula, se calificará con las preguntas contestadas.

8
3. El estudiante responderá las preguntas del examen utilizando un bolígrafo (tinta color
azul o negro). No utilice bolígrafo con tinta borrable.
4. Las respuestas marcadas y/o escritas con lápiz, no tendrán valor y se perderá dicha
pregunta.
5. No usar Liquid paper, si lo usa la respuesta será anulada y calificada como mala
6. Cualquier tachadura o enmendadura anula la respuesta de la pregunta
7. No usar abreviaciones, siglas ni signos en sus respuestas de lo contrario no serán
tomadas en cuenta al momento de calificarlas. Escríbalas únicamente cuando la pregunta
se lo solicita.
8. Con respecto a las preguntas de múltiple escoge encierre en un círculo la respuesta que
usted crea conveniente.
9. En las respuestas de complementar limítese a responder el número de dificultades que
se le soliciten, si agrega demás y estas son incorrectas, se calificara como malo, puesto
evidencia la falta de conocimiento al respecto y que son respuestas al azar.
10. Si deja en el examen dos respuestas señaladas, perderá dicha pregunta.
11. En la preguntas de complementar, Si no sabe las respuestas no debe dejar líneas o
casillas en blanco, Márquelas con una “X” ó trace una línea a lo largo del espacio de la
respuesta.
D. PORCENTAJES DE PONDERACIÓN
ACTIVIDAD PORCENTAJE
I Promedio de exámenes teóricos 34%
II
III
Promedio de exámenes prácticos
Promedio de exámenes de
laboratorio
16%
25%
IV Promedio de sesiones de grupo 15%
V Promedio controles de lecturas 10%
VII NOTA DE PROMOCIÓN 100%

9
NORMAS DE PRESENTACIÓN DE LOS ESTUDIANTES:
1. Es obligatorio en el laboratorio el uso de la gabacha, correctamente abotonada y que
llegue hasta nivel de las rodillas. Si se presenta sin gabacha el instructor le pedirá que se
retire y perderá dicha práctica de laboratorio y su respectiva nota.
2. Es responsabilidad del estudiante de llevar a cada práctica su Manual de Laboratorio e
insumos de uso personal como jabón, papel toalla, tirro, guantes, lápiz graso, fósforos,
etc.
3. Es responsabilidad del estudiante de llevar al laboratorio cuando se requiera pro-
pipetas y lentes protectores como norma de bioseguridad adicional para así evitar
cualquier accidente de laboratorio
4. No se permitirá el uso de pulseras, anillos, aretes largos, así como tampoco el cabello
largo sin recoger durante en el desarrollo de las prácticas de laboratorio. Todo ello con la
finalidad de cumplir las debidas normas de bioseguridad.
5. En todas las actividades de Diagnóstico Inmunológico es obligatorio vestirse
adecuadamente, y no se permitirá el ingreso a actividades académicas a estudiantes con
pantalones cortos o “pants”, pantalones rasgados, camisas centro, zapatos sin calcetines o
sandalias, minifaldas, no podrá usar gorras y apagara el teléfono celular.
Comunicación con la Coordinación: Los representantes de asignatura serán el nexo entre
los profesores y el grupo de estudiantes. Los estudiantes deberán de transmitir sus
inquietudes sobre las actividades de aprendizaje con la coordinación, preferiblemente por
medio de los representantes. Las peticiones de los estudiantes deberán de ser por escrito
y estar enmarcadas dentro de lo establecido en la Ley Orgánica de la Universidad y su
respectivo reglamento.

10
ASPECTO LEGAL REGLAMENTO DE LA GESTIÓN ACADÉMICO-ADMINISTRATIVA DE LA UNIVERSIDAD DE EL SALVADOR. SEGÚN ACUERDO N° 009/2015-2017 V DE LA ASAMBLEA GENERAL UNIVERSITARIA DE LA UNIVERSIDAD DE EL SALVADOR." Artículo 118. El estudiante que hubiere reprobado Unidades de Aprendizaje, en segunda matrícula, queda sujeto a inscribir la carga académica que se le asigne en la asesoría, de acuerdo a los siguientes parámetros:
a) El estudiante que inscriba una unidad de aprendizaje en tercera matrícula podrá inscribir como máximo dos adicionales en primera o segunda matrícula; y b) El estudiante que inscriba dos unidades de aprendizaje en tercera matrícula no podrá inscribir ninguna unidad de aprendizaje adicional.
*Artículo 119. El límite de inscripción de una unidad de aprendizaje es hasta la tercera matrícula. Ninguna instancia podrá autorizar cuarta matrícula. Salvo si el estudiante ha cursado al menos el 60% del pensum de su carrera, dicha autorización deberá ser solicitada debidamente fundamentada por escrito y atestada ante la Junta Directiva de la Facultad anexando su record académico; la Junta Directiva valorara, las circunstancias de reprobación y el historial académico del estudiante, resolviendo de manera fundamentada antes de iniciar el ciclo donde el estudiante pretende cursar la Unidad de Aprendizaje. Cuando a un estudiante se le autorice la inscripción en cuarta matricula, no podrá cursar otra unidad de aprendizaje adicional en el ciclo. * Artículo 122. Se permitirá la condición de estudiante oyente a todo estudiante que tenga algún trámite o proceso administrativo pendiente de cualquier resolución por la Junta Directiva correspondiente y/o Consejo Superior Universitario, debidamente comprobados, que tenga como objetivo cambios de carrera, traslados de Facultad, equivalencias de Unidades de Aprendizaje o inscripciones extemporáneas, entre otros. Artículo 125. El retiro de unidades de aprendizaje, en período ordinario podrá ser realizado en línea o en la Administración Académica de la Facultad respectiva, dentro de las cuatro semanas de iniciado el ciclo académico correspondiente. *Artículo 128. El retiro especial de todas las Unidades de Aprendizaje, será autorizado por la Junta Directiva de la Facultad a partir de la undécima hasta la décima sexta semana de iniciado el Ciclo por causa justificada. Para efectos del inciso anterior serán consideradas como causales las siguientes:
a) Enfermedades graves y/o incapacitantes; b) Accidentes graves y/o incapacitantes; c) Problemas durante el embarazo, según constancia médica; d) Cuando el estudiante fuese favorecido con beca para realizar estudios en el extranjero; e) Situación económica, según documento probatorio o declaración jurada; f) Situación laboral; y

11
g) Otras causas de fuerza mayor o caso fortuito valoradas por Junta Directiva de la Facultad
Para atestar en relación a los literales “a”, “b” y “c” deberán presentar constancia médica con el visto bueno de Bienestar Universitario; a excepción de las emitidas por el Instituto Salvadoreño del Seguro Social. En aquellas facultades multidisciplinarias que no cuenten con Bienestar Universitario, el visto bueno lo emitirá el médico autorizado por la respectiva Facultad. Artículo 136. Se define como sistema de evaluación como el proceso de evaluación, calificación, revisión, complementación y registro los resultados de la evaluación de los aprendizajes. Artículo 137. Tanto en la evaluación formativa como en la sumativa es requerida la medición del comportamiento y del conocimiento, a fin de garantizar el logro de los objetivos de la Unidad de Aprendizaje y metas propuestas. Las evaluaciones Formativa y Sumativa no pueden separarse en su operativización, para la calificación en el proceso de evaluación del aprendizaje; los porcentajes de ponderación se deberán establecer en cada uno de los planes y programas de estudio, de acuerdo a las especificidades de las áreas de formación. Artículo 138. Las actividades de evaluación deberán estar relacionadas con los objetivos de aprendizaje establecidos en los Planes y Programas de Estudio. Asimismo, sus ponderaciones deberán establecerse en el Programa de la Unidad de Aprendizaje y se darán a conocer al estudiante al inicio del ciclo. En cada uno de los programas de las unidades de aprendizaje, se podrán planificar actividades ex aula; estas deberán ser previamente autorizadas por la Jefatura de la Unidad Académica correspondiente. Artículo 139. Los diferentes tipos de instrumentos de evaluación, deberán estar determinados en los correspondientes planes y programas de estudio, relacionados con los Objetivos de aprendizaje. Artículo 140. La ejecución de las evaluaciones será responsabilidad del o los docentes encargados de la unidad de aprendizaje, para lo cual es su deber;
a) Elaborar, aplicar y calificar las pruebas sumativas; b) Definir previamente los porcentajes correspondientes a cada parte de las pruebas administradas. c) Entregar las notas en un plazo máximo de quince días hábiles después de la fecha de realización de la prueba, en forma individual al estudiante. d) Previo a la entrega de notas, el docente deberá exponer la solución de la prueba realizada y entregar el respectivo instrumento de evaluación, el que será devuelto inmediatamente después de que el estudiante constate su nota y analice la posibilidad de solicitar revisión. El instrumento de evaluación deberá de ser devuelto al estudiante después de finalizado el período de revisión.

12
e) Registrar los resultados en el sistema informático académico de la Universidad de El Salvador, ingresando las notas en el sistema, dentro de los treinta días hábiles posteriores a la prueba, exceptuando las evaluaciones finales que no deberán de sobrepasar el período de cierre de registro de calificaciones del calendario de actividades académicas administrativas, y la calificación de las notas de toda evaluación deberán ser en tinta, en números y letras.
Artículo 142. La Junta Directiva de Facultad, aprobará el calendario general de las evaluaciones, de acuerdo al calendario de actividades académicas–administrativas aprobado por el Consejo Superior Universitario. La Dirección o Jefatura responsable informará a estudiantes, personal académico y administrativo sobre el calendario antes mencionado por todos los medios a su alcance y no podrá ser modificado arbitrariamente. Artículo 143. Las actividades de evaluación de un mismo nivel de estudio se calendarizarán, evitando la simultaneidad de las evaluaciones parciales, debiendo existir un periodo mínimo de 24 horas, entre evaluaciones. Artículo 144. Para efecto de registro de las notas, cada Administración Académica de Facultad y los docentes deberán tener acceso durante todo el ciclo al Sistema Integral Informático de la Universidad de El Salvador, el cual procesara las notas finales automáticamente. Artículo 145. Una vez las notas de las actividades evaluadas hayan sido ingresadas al sistema de registro de notas, no podrán ser modificadas, salvo autorización motivada de la Junta Directiva. El período de corrección y/o modificación de notas caduca cuando finaliza el ciclo académico respectivo. *Artículo 146. Para efectos de asignar una calificación a una evaluación en los procesos de aprendizaje, se utilizara una escala de notas de cero punto cero cero (0.00) a diez punto cero cero (10.00). La nota mínima de aprobación por unidad de aprendizaje será de seis punto cero cero (6.00) para las carreras a nivel de grado, debiendo obtener al final de la carrera el Coeficiente de Unidades de Merito establecido en el Reglamento correspondiente. La calificación de cada actividad evaluada deberá considerarse hasta la centésima y la nota final de ciclo deberá aproximarse a la décima inmediata superior, cuando la centésima sea igual o mayor a cinco (5). Se programará un mínimo de 4 evaluaciones por ciclo con su respectivo porcentaje, se registrará un rango de 4 a 10 notas en el sistema establecido para tal fin. *Artículo 147. El estudiante para tener derecho a las evaluaciones en cada unidad de aprendizaje, deberá tener una asistencia a las actividades académicas mayor o igual al 75% entre el período de una evaluación y la próxima. Salvo que los estudiantes presenten una causa justificada de inasistencia de las previstas en el Artículo 151 del presente reglamento.

13
Artículo 148. Una vez publicada la nota de la medición sumativa, los estudiantes que no estén conformes con la misma, tendrán derecho dentro de los tres días hábiles siguientes a la publicación oficial de estas, a solicitar en forma individual y por escrito la revisión ordinaria de la prueba ante el Jefe o Director de Escuela responsable. El o los docentes responsables, señalarán lugar, día y hora dentro de los recintos universitarios para realizarla. El estudiante tendrá derecho a estar presente al momento de realizarse la revisión y exponer las réplicas pertinentes, para lo cual la dirección de la Unidad Académica respectiva deberá garantizar que se le haya devuelto el instrumento de evaluación con anticipación. Posterior a la revisión ordinaria deberán de ser publicadas de forma oficial las notas definitivas obtenidas por el estudiante en el proceso de aprendizaje; los resultados deberán hacerse constar en un acta, la cual firmará el docente y el estudiante. La nota de la prueba objeto de revisión únicamente se podrá mantener o aumentar. Artículo 149. Cuando el estudiante se encuentre en discrepancia con el resultado de la revisión ordinaria, podrá solicitar ante el jefe de departamento o director de escuela respectivo una revisión extraordinaria, dentro de los tres días hábiles siguientes a la publicación oficial de los resultados obtenidos en dicha revisión. La revisión extraordinaria procederá a juicio del jefe de departamento o director de escuela siempre y cuando se encuentren debidamente fundamentadas las razones con la especificación de las temáticas de las pruebas en que radique la inconformidad, en caso de ser favorable la decisión del Jefe de Departamento o Director de Escuela deberá señalar el lugar, día y hora dentro de los recintos universitarios para realizarla; el estudiante tendrá derecho a estar presente al momento de realizarse la revisión y exponer las réplicas pertinentes. La revisión extraordinaria será administrada por un tribunal conformado por el respectivo jefe de departamento o director de escuela, el docente responsable de la revisión ordinaria y otro docente de la especialidad de que se trate. Los resultados deberán hacerse constar en un acta, la cual firmarán los miembros del tribunal y el estudiante, si quisiere. La nota así obtenida no admitirá recurso alguno. *Artículo 150. Si el estudiante no se presenta a una evaluación por causa justificada, éste podrá solicitar por escrito su realización en forma diferida a más tardar dentro del quinto día hábil de haberse realizado ésta, ante el jefe de departamento o director de escuela, según el caso, quien resolverá a más tardar al tercer día hábil de presentada la solicitud, concediéndola o denegándola. En caso de ser favorable, deberá indicarse el lugar, día y hora para su realización, notificándole oficialmente al estudiante y al docente responsable con al menos tres días de anticipación a su realización, la cual deberá estar considerada dentro de la programación del ciclo, en caso de no estarlo, esta deberá ser programada dentro de los

14
cinco días hábiles contados a partir del día siguiente de la notificación oficial al estudiante, respetando la calendarización de actividades del sistema de evaluación establecido en el programa de la unidad de aprendizaje. La prueba diferida solamente podrá incluir las temáticas correspondientes a la prueba solicitada. En caso de ser desfavorable la solicitud, el estudiante tendrá derecho a solicitar a la Junta Directiva la revisión de la actuación del Jefe de Departamento o Director de Escuela. Artículo 151. Se admitirán únicamente como motivos justificativos de ausencia a una actividad evaluada sumativa, los siguientes: a) Problemas de salud; b) Problemas laborales; c) Muerte del cónyuge o parientes hasta el segundo grado de consanguinidad; d) Programación de dos o más evaluaciones en la misma fecha; e) Cumplimiento de actividades oficiales; f) Cumplimiento de misiones oficiales; y g) Caso fortuito y fuerza mayor debidamente comprobada. Los motivos antes mencionados deberán sustentarse con los respectivos atestados. Las solicitudes para exámenes diferidos deberán de ser presentadas al coordinador de la asignatura el tiempo estipulado por el reglamento de administración académica. Artículo 152. Cuando en una prueba sumativa ordinaria escritas, resultaren reprobados entre el 51 y 60% de estudiantes, estos tendrán derecho a solicitar al Jefe de Departamento o Escuela respectivo, la repetición de la prueba en la unidad de aprendizaje de que se trate, dentro del plazo de tres días hábiles después de haber sido publicadas oficialmente las notas. El jefe de Departamento o Director de Escuela vista la solicitud, resolverá señalando lugar, día, hora y responsable de practicar la prueba dentro de las 48 horas siguientes a la solicitud previo notificación a los solicitantes. Cuando resultaren reprobados más del 60% de estudiantes en una prueba sumativa, esta se repetirá de oficio, observando el tramite anterior. En ambos casos, el Jefe de Departamento o Director de escuela, junto con el docente responsable efectuaran un análisis de los factores que ocasionaron los resultados, a efecto de establecer criterios que mejoren el proceso de aprendizaje. La repetición de pruebas se realizará una sola vez y a ella se someterá solo los estudiantes que así lo deseen. LA NOTA OBTENIDA EN LA PRUEBA REPETIDA SUSTITUIRÁ A LA ANTERIOR. Artículo 153. Los estudiantes de todas las Facultades de la Universidad de El Salvador que al finalizar el ciclo académico, obtuvieren una nota final entre cinco punto cero cero (5.00) y cinco punto noventa y cuatro (5.94) en una Unidad de Aprendizaje, tendrán derecho a un examen de suficiencia, en el cual se examinaran todos los contenidos desarrollados en la misma y podrán incluir pruebas y/o prácticas clínicas o de laboratorio y otros, según las particularidades de la especialidad.

15
Artículo 154. En el caso de la realización de la prueba de suficiencia, la nota obtenida en el mismo se promediará con la nota final obtenida en el ciclo, y el resultado será la nota final definitiva que deberá registrarse en la respectiva Administración Académica. Para las pruebas de suficiencia no aplicara la repetición de pruebas. Artículo 155. Cuando se compruebe fraude por parte del estudiante en la realización de una evaluación, se sancionará según la gravedad de la misma, de acuerdo a lo estipulado en el Reglamento Disciplinario de la Universidad de El Salvador. VIII-PRESENTACIÓN TEMÁTICA DE LA ASIGNATURA
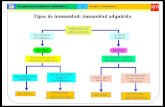
1. Integración de los mecanismos inmunes innatos y adquiridos Objetivos. Al finalizar la clase el estudiante será capaz de:
• Interpretar como los mecanismos Innatos y Adquiridos se integran en la respuesta del Sistema Inmune
• Explicar las características básicas de los mecanismos de acción de la respuesta inmune innata.
• Explicar las características básicas de los mecanismos de acción de la respuesta inmunidad adquirida
• Interpretar los procesos comunes en ambas respuestas • Ilustrar la colaboración inherente entre la inmunidad innata y la adquirida
Contenido
• Mecanismos inmunes innatos – Barreras de la inmunidad innata: componentes y función – Factores humorales y celulares que participan.
• Mecanismos inmunes adquiridos – Factores humorales y celulares que participan – Presentación de antígeno – Mecanismos de enlace en la respuesta inmune
• ¿Cómo el sistema inmune adquirido requiere de la ayuda del sistema inmune
innato? y viceversa
2. Regulación de la respuesta inmune Objetivos.
Al finalizar la clase el estudiante será capaz de:
Describir los mecanismos de regulación de la respuesta inmune
Explicar los mecanismos de regulación humoral y celular
Mencionar el papel de la apoptosis en la regulación
Conceptualizar la función de tolerancia en la regulación Contenidos

16
Mecanismos de regulación, regulación mediada por células CD8+, regulación por anticuerpos
Apoptosis y su papel en la regulación de la respuesta inmune. Auto-reconocimiento y tolerancia inmunológica.
3. Bases físico químicas de la reacción antígeno – anticuerpo
Objetivos. Al finalizar la clase el estudiante será capaz de:
Explicar las etapas de la interacción antígeno-anticuerpo y los tipos de enlaces involucrados en ello
Describir la teoría del enrejado
Mencionar los diversos factores que influyen en la interacción antígeno-anticuerpo
Explicar los términos afinidad, avidez, exactitud, sensibilidad, precisión, confiabilidad y especificidad relacionaos con las técnicas serológicas
Contenido
Interacción antígeno-anticuerpo .Etapas. Tipos de enlaces químicos que intervienen. Teoría del enrejado.
Factores que influyen: pH, Tiempo, Temperatura, Concentración de iones, concentración de reactantes.
Propiedades de las pruebas serológicas e inmunológicas: afinidad, avidez, exactitud, sensibilidad, precisión, confiabilidad y especificidad.
Métodos de Laboratorio Clínico para detectar la reacción Antígeno– Anticuerpo
4. Pruebas de precipitación Objetivos: Al finalizar la clase el estudiante será capaz de:
Explicar que es una reacción de ´precipitación y los reactantes participantes
Explicar el fundamento de las diferentes variantes de las pruebas de precipitación y el tipo de anticuerpo que se detectan en ellas.
Analizar en que consisten las pruebas de precipitación en medio líquidos y medio sólidos
Contenidos: Principios de cada una de las variantes de las pruebas de precipitación. Prueba de Ascoli. Inmunodifusión simple, doble y radial .Técnicas y usos de cada una
5. Aglutinación y variantes Objetivos: Al finalizar la clase el estudiante será capaz de:
Explicar el fundamento de las variantes de las reacciones de aglutinación
Explicar la forma de realización de cada una y su forma de lectura

17
Mencionar los factores que influyen en la reacción
Mencionar los usos de cada variante y sus limitaciones Contenido: Fundamentos de las técnicas de aglutinación directa e indirecta. Tipo de antígeno usado. Tipo de anticuerpo detectado. Partículas portadoras del antígeno en las pruebas de aglutinación indirecta. Usos. Prueba de inhibición de la aglutinación
6. Electroforesis I Objetivos: A finalizar la clase el estudiante será capaz de:
Explicar el fundamento de las técnicas de electroforesis.
Analizar en que consisten cada variante de las técnicas de electroforesis y sus usos Contenido: Principios de la Electroforesis en papel, inmunoelectroforesis de contracorriente, electroinmunodifusión simple y doble. Técnicas y usos. Limitaciones
7. Electroforesis II: Electroforesis en gel (SDS – PAGE). Blotting. Objetivos: Al finalizar la clase el estudiante será capaz de:
Explicar el fundamento de la electroforesis en gel y de la técnica de Blotting
Analizar en que consisten cada una de esas técnicas y sus usos
Contenido: Fundamento de la electroforesis en gel (SDS-PAGE). Fundamento de la técnica de Blotting. Técnicas. Variantes. Usos. Limitaciones
8. Cromatografía Objetivos: Al finalizar la clase el estudiante será capaz de:
Explicar el fundamento de la técnica de Cromatografía
Explicar los diferentes tipos de Cromatografía existentes
Inmunocromatografía. Fundamento. Usos. Ventajas y limitantes Contenido: Fundamentos y utilidad de las técnicas de Cromatografía y sus variantes.
9. . Métodos inmunoquímicos y fisicoquímicos Objetivos: Al finalizar la clase el estudiante será capaz de:
Explicar como se determina la viscosidad sérica y su significado.

18
Definir Crioaglutininas y Piroglobulinas, asi como también las técnicas por medio de las cuales se detectan y su significado clínico
Explicar en que consiste la Nefelometría
Mencionar los métodos por medio de los cuales se detectan complejos inmunitarios en tejidos y en líquidos biológicos
Contenido: Nefelometría: técnica, usos. Determinación de viscosidad sérica, usos. Definición de Crioaglutininas y Piroglobulinas, técnicas para su determinación, usos. Métodos utilizados para la determinación de complejos inmunes en tejidos y circulantes.
10 Inmunofluorescencia Objetivos: Al finalizar la clase el estudiante será capaz de:
Explicar el fundamento de las técnicas de inmunofluorescencia directa e indirecta
Describir la forma de realización de cada una de esas técnicas
Comprender el uso de la amplificación con el sistema biotina-avidina
Conocer la aplicación (uso) de cada variante. Contenido: Fundamento de las técnicas de inmunofluorescencia directa e indirecta. Características del microscopio de inmunofluorescencia. Tipos de fluorocromos más usados. Técnicas Usos de las variantes de inmunofluorescencia. Limitantes
11. Radioinmunoensayo
Objetivos: Al finalizar la clase el estudiante será capaz de:
Explicar el fundamento de RIA
Describir en que consisten cada una de esas técnicas y sus usos
Explicar las ventajas y desventajas de cada una
12. . ELISA. Variantes Objetivos: Al finalizar la clase el estudiante será capaz de:
Explicar el fundamento de ELISA
Describir en que consisten cada una de esas técnicas y sus usos
Explicar las ventajas y desventajas de cada una Contenidos Fundamento de la técnica de ELISA. Uso de marcadores. Ventajas. Desventajas. Limitaciones. Técnica. Formas de lectura. Usos.

19
13. Métodos de laboratorio para detectar inmunidad celular: Objetivos: Al finalizar la clase el estudiante será capaz de:
Explicar el fundamento de las pruebas de hipersensibilidad in vivo
Describir la forma de realizar las técnicas de separación de células.
Mencionar los usos de cada una de esas pruebas
Contenido: Fundamentos de las pruebas para determinar hipersensibilidad in vivo. Separación de células (Ficoll – Hypaque y otras técnicas).Técnicas .Usos. Limitantes
14. Valoración de macrófagos y PMN. Objetivos: Al finalizar la clase el estudiante será capaz de:
Comprender las técnicas usadas in vitro para la valoración de la función de macrófagos y PMN
Contenidos: Análisis de monocitos y macrófagos: técnicas para medir su función: pruebas de movilidad, de reconocimiento y adherencia, ingestión, para la degranulación, para medir la muerte intracelular quimioluminiscencia.
15. Análisis y valoración de Linfocitos T y B
Objetivos: Al finalizar la clase el estudiante será capaz de:
Explicar en qué consiste la activación con mitógenos
Comprender en que consiste el cultivo de linfocitos mixtos.
Explicar cómo se realiza el análisis y valoración de linfocitos T y B. Contenidos: Técnicas empleadas para medir la activación de linfocitos in vitro: activación con mitógenos y por estimulación antigénica. Cultivo mixto de linfocitos y linfólisis mediada por células. Aplicación clínica de análisis celulares de linfocitos T y B
16. Técnicas elementales de Biología Molecular I Objetivos: Al finalizar la clase el estudiante será capaz de:
Explicar que es el ADN recombinante
Conocer que son las enzimas de restricción usadas e estas técnicas su función

20
Explicar que son las sondas de hibridación, clonación de secuencias específicas de ADN su identificación
Técnica de Southern, Northern y Dot Blot.
Describir la técnica de la Reacción en Cadena de la Polimerasa (PCR)
Analizar cada paso de dichas técnicas y su finalidad Contenidos: Definición de ADN recombinante. Enzimas de restricción y sus usos. Definición de sondas de hibridación y clonación de sondas y su respectiva identificación Técnicas de Southern, Northern y Dot Blot Explicación breve de los pasos de cada técnica y su finalidad Fundamentos de las sondas de hibridación. Técnica de PCR: pasos, usos, ventajas y desventajas.
17. Técnicas elementales de Biología Molecular II Reacción en Cadena de la Polimerasa (PCR) Objetivos: Al finalizar la clase el estudiante será capaz de:
Conocer los pasos esenciales de la técnica de PCR
Conocer los elementos necesarios para la realización de esta técnica
Describir como se realiza en análisis del producto amplificado su identificación
Desventajas de la PCR
Variantes de la PCR. Breve explicación. Diferencias entre cada una
Usos en nuestro país

21
SESIONES DE GRUPO
1. Producción de anticuerpos policlonales
2. Anticuerpos monoclonales
3. Hipersensibilidad I y II
4. Autoinmunidad
5. Inmunodeficiencias primarias
6. Marcadores tumorales
7. Inmunología de los trasplantes de órganos, tejidos y células. Pruebas de
histocompatibilidad
CONTROLES DE LECTURA
1. Vacunas
2. Hipersensibilidad III y IV
3. Inmunodeficiencias secundarias
4. Citometría de flujo
5. Laboratorio de histocompatibilidad y trasplante de órganos

22
Diagnóstico Inmunológico
(DXI-1101)
Manual de Laboratorio
CONTENIDO
PRÁCTICAS DE LABORATORIO
BIOSEGURIDAD
1. Conocimiento y manejo de Micropipetas.
2. Preparación de diluciones directas y seriadas.
3. Extracción de sangre con fines serológicos y tipeo sanguíneo.
4. Preparación de suspensiones de glóbulos rojos.
5. Adsorción de anticuerpos.
6. Inoculación de animales para la preparación de sueros inmunes.
7. Pruebas de precipitación en medios líquidos y sólidos
8. Aglutinación directa.
9. Aglutinación Indirecta
10. Inmunocromatografía
11. Pruebas no treponémicas y treponémicas para el diagnóstico de sífilis.
12. Prueba de ELISA

23
INTRODUCCIÓN
Todas las especialidades médicas tienen un gran atractivo, espero que la de
ustedes estudiantes, a partir de este curso pueda ser la Inmunología posiblemente porque
tiene íntima relación con todas las ciencias básicas biomédicas y en la totalidad de
especialidades médicas.
El presente manual pretende proporcionar al estudiante de Microbiología la
información básica a cerca de los principales tipos de técnicas inmunológicas, como parte
de su formación. Aquí se estudia cada técnica sin especificar una aplicación particular
para el trabajo hospitalario o de otra índole.
Se presenta un breve fundamento teórico de cada técnica, seguido de una
descripción general de los procedimientos, los reactivos, notas sobre los principales
cuidados y en algunas ocasiones la interpretación. También como parte del manual, este
consta de material gráfico para ilustrar algunas de sus prácticas, con la finalidad de
mejorar la claridad y calidad de sus contenidos, en la medida de lo posible y dentro de las
limitaciones del costo.
Esperamos que el presente manual sirva a los fines de una buena educación y
formación profesional del estudiante de Microbiología, en pro de la salud y bienestar de
nuestro pueblo salvadoreño.

24
NORMAS DE SEGURIDAD
El estudiante debe tener presente que durante el desarrollo de las prácticas de laboratorio
estará manejando material infeccioso o potencialmente infeccioso (suero, plasma, sangre
completa, bacterias). Evidentemente el riesgo de adquirir una infección en el laboratorio
es alto y por lo tanto debe ser minimizado y controlado mediante un plan de bioseguridad
en el laboratorio clínico.
1. Deberá tener puesta en forma adecuada su equipo de protección personal (EPP):
mascarilla, guantes, lentes protectores, gorro quirúrgico y gabacha. De no contar
con su equipo de protección completo, NO podrá desarrollar su práctica de
laboratorio
2. No deberá comer, fumar ni utilizar su celular dentro del laboratorio
3. Deberá procurar no llevar las manos a la boca, ojos, nariz, u orejas.
4. No pipetear con la boca
5. Si accidentalmente se contaminara la boca o los ojos con algún cultivo o
suspensión bacteriana, o muestra clínica enjuáguese inmediatamente con
abundante agua tibia, si en caso fuese la boca, enjuáguese con una solución débil
de peróxido de hidrógeno (1%). Antes de hacer uso consulte a su instructor.
6. Las mesas de trabajo deberán ser adecuadamente desinfectadas antes y después
de cada práctica. Se les proporcionará el desinfectante apropiado.
7. Antes de retirarse se lavará adecuadamente las manos con abundante agua y
jabón. Repetir el lavado de manos dos veces.
8. En caso de que derrame o quiebre un tubo, caja de Petri u otro envase
conteniendo microorganismos o muestras clínicas cúbralos con desinfectante.
Coloque un papel absorbente encima y espere de 10 – 15 minutos. Después
remueva todo el material y descártelo en un recipiente especial para material
contaminado.
9. Todo material en uso que se presuma está contaminado (pipetas, cajas de Petri,
tubos, láminas y otros materiales) deberá ser colocado al terminar de usarse en los
depósitos especiales para material contaminado.

25
10. Si sus manos se contaminan accidentalmente, pida inmediatamente la
colaboración a su instructor para que le aplique el desinfectante. No intente
hacerlo usted mismo, pues posiblemente contaminará el frasco que lo contiene. Si
la contaminación fuese en su ropa de vestir o su gabacha, acuda a si instructor
para que le indique la forma más adecuada de proceder.
11. Se evitará contaminaciones indeseables si mantiene el material de laboratorio en
el sitio asignado para éstos. Nunca lo deje abandonado sobre las mesas de trabajo.
12. Evitar mantener bolsones, carteras y otros objetos personales sobre la mesa de
trabajo. Se designará el sitio adecuado para resguardar sus pertenencias
13. Evitar correr dentro del laboratorio para evitar accidentes
14. Prestar atención adecuada a las indicaciones de su docente instructor para el
desarrollo adecuado de la práctica de laboratorio correspondiente
15. Mantener ordenados los bancos de laboratorio y los pupitres para evitar
accidentes.

26
GUIA PRELABORATORIO N ° 1
USO Y MANEJO DE MICROPIPETAS Y CONOCIMIENTO BASICO DE OTRO TIPO
DE PIPETAS
1. Concepto de Micropipeta o pipetas automáticas
2. Partes que conforman las micropipetas
3. Manejo correcto de las mismas
4. Cuidados que se debe tener antes y durante el uso
5. Pipetas graduadas:
a. Tipos
b. Diferencias entre ellas.
c. Uso de pipetas con líquidos peligrosos
6. Concepto de pro-pipeta
a. Forma correcta del manejo con las pipetas
7. Concepto de menisco. Medida de soluciones coloreadas e incoloras
a) Errores de lectura

27
PRACTICA No. 1
CONOCIMIENTO Y MANEJO DE MICROPIPETAS
El uso de procedimientos serológicos exige que los reactivos indicados
en las diferentes técnicas se midan con exactitud y precisión a fin de obtener
resultados con alto grado de precisión y confiabilidad.
MICROPIPETAS
Este tipo de pipeta especial tiene como propósito general
la dispensación de volúmenes pequeños de forma exacta y
precisa. El funcionamiento de este tipo especial de pipeta
se basa en el principio del desplazamiento del aire y en la
utilización de puntas desechables. Con las micropipetas se
pueden medir un amplio rango de volúmenes desde 1µl
hasta 1000 µl, siendo muy útiles en el inmundiagnóstico
donde se pueden usar volúmenes inferiores a 1 ml de
muestra. Las puntas desechables son de polipropileno.
Hay micropipetas de volumen fijo y otras se puede ir
ajustando.
El volumen de la pipeta se muestra claramente en una
pantalla situada en el mango. El ajuste del volumen se lleva
acabo fácilmente girando el émbolo en dirección de las agujas del reloj o
viceversa. Si se fuerza excesivamente el giro del émbolo, fuera del rango
definido por la pipeta, podemos hacer saltar los mecanismos de la pipeta y
dañarla.
*PPS: Polisulfuro de fenileno , *PVDF: Fluoruro de polivinildeno

28
Inserción y expulsión de puntas
Antes de insertar la punta hay que asegurarse de que el cono esté limpio.
Presione la punta en el cono de la pipeta de forma firme para asegurar su
correcta inserción. El ajuste es correcto cuando se observa un anillo visible
entre la punta y el cono de la pipeta. NUNCA debe de tocarse con los dedos
la superficie de la punta que entrará en contacto con la muestra.
Cada pipeta viene provista de un dispositivo expulsa puntas que reduce el
riesgo de contaminación en la manipulación. El dispositivo expulsa puntas
debe de ser presionado con firmeza para asegurarse que esta se realiza en un
contenedor.
OBJETIVOS
Que el estudiante:
1. Ensaye las diferentes partes que consta una pipeta automática o
micropipeta.
2. Conceptualice que existen diferentes tipos de micropipetas con
base a los volúmenes necesitados
3. Experimente el uso y medición de volúmenes con las micropipetas
4. Reconozca otros tipos de pipetas que son usadas en el trabajo de
laboratorio.
Material (por lado de mesa)
- Pipetas automáticas
- Solución concentrada de hemoglobina
- 2 Frascos conteniendo agua destilada
- 2 gradillas con 5 tubos de ensayo cada una
- 2 pipetas serológicas de 10, 5, 2, 1 y 0.2 ml (para demostración)

29
- Pipetas volumétricas, Pasteur y de Mohr (para demostración)
- Pro-pipetas (traída por el alumno)
Técnica de pipeteado
1. Presione el botón del émbolo hasta la primera parada.
2. Sitúe la punta debajo de la superficie del líquido (2-3 mm) y
suavemente libere el émbolo. Retirar cuidadosamente la punta del
líquido, tocando contra la pared para liberar el exceso de líquido.
3. El líquido es dispensado presionando el émbolo hasta la primera
parada. Después de una corta interrupción continuar presionando el
émbolo hasta la segunda parada
4. Este procedimiento vaciará completamente la punta asegurándonos la
precisión de la dispensación.
Recomendaciones
Mantener la pipeta verticalmente y situar la punta unos mm por debajo de
la superficie del líquido.
Cuando se dispensen líquidos espesos o viscosos es conveniente aspirar y
dispensar por lo menos 5 veces antes de realizar el pipeteado definitivo.
Controlar los movimientos de la mano manteniéndolos constantes.
Cuando se pipeteen líquidos que tienen temperatura diferente a la del
medio ambiente, enjuagar varias veces la punta antes de usarla.
Para la limpieza de la pipeta utilice etanol y un paño suave. Se recomienda
limpiar el cono regularmente.
Para realizar una medición lo más exacta posible en una pipeta lo menos
que se pude medir es la décima parte de su capacidad total
Para no dañar el sistema interno de pistones que posee la micropipeta:

30
El líquido nunca debe entrar en contacto con el cono de la micropipeta
Nunca vuelque la micropipeta con la parte de arriba hacia abajo
Nunca coloque la micropipeta en forma horizontal si la punta tiene
líquido
Nunca ajuste el volumen fuera del rango de la micropipeta
En su práctica de laboratorio se proporcionará micropipetas para que se
familiaricen con cada una de sus partes y su forma adecuada de manejo.
CONOCIMIENTO Y MANEJO DE PIPETAS GRADUADAS
El uso de procedimientos serológicos exige que los reactivos indicados
en las diferentes técnicas se midan con exactitud y precisión a fin de obtener
resultados con alto grado de confiabilidad. Para ello se utiliza un instrumento
volumétrico, denominado pipeta, que permite medir alícuotas de líquido con
bastante precisión. Suelen ser de vidrio de borosilicato (pyrex) y consiste en
un tubo transparente que termina en una de sus
puntas en forma cónica. Existen varios tipos de
pipetas entre las que podemos mencionar las
pipetas graduadas (volumétricas, serológicas,
Mohr), micropipetas, pipetas Pasteur etc. De
ellas las pipetas serológicas (A) son de uso muy
extendido en los laboratorios y se identifican
porque su graduación llega hasta el extremo
inferior, debiendo soplar para vaciar el
contenido total de ella. Otras pipetas graduadas

31
muy similares son las denominadas pipetas de
Mohr (B), con la diferencia de que en estas la
graduación no llega hasta la punta y el volumen se
mide entre la línea cero y la última línea antes del
extremo inferior, razón por la cual no hay necesidad
de soplar para vaciar el volumen total de la misma.
Es muy importante saber diferenciar entre ambos tipos de pipetas, ya que a
simple vista son muy similares.
Con respecto a las pipetas volumétricas, estas sirven para medir un
volumen exacto con gran precisión. Este tipo de pipetas tienen el
inconveniente que no se pueden medir volúmenes diferentes a su capacidad
total, es decir, que si la pipeta su capacidad es de 5 ml, solo ese volumen se
pude medir.
Respecto a las pipetas Pasteur, estas se utilizan para trasladar líquido de
un recipiente a otro, no tienen ningún tipo de graduación.
Es indispensable que el personal de laboratorio se familiarice con el
manejo de los diferentes tipos de pipetas que se utilizan para medir
volúmenes de reactivos utilizados. Sin embargo, es particularmente útil que
adquiera destreza con el tipo de pipeta que más se usa en el laboratorio de
serología; ésta es, la pipeta serológica graduada hasta la punta, la que ha de
soplarse para que salga todo su contenido.
MENISCO: es el borde superior e inferior de una columna de
líquido que se está midiendo (en este caso con una pipeta). El

32
menisco está formado por dos bordes visibles: uno superior (M) y uno
inferior (G).
Lectura del menisco
Cuando se midan soluciones transparentes el contenido de la pipeta
debe leerse a partir de la parte inferior del menisco; con soluciones
coloreadas (ejemplo: suspensión de glóbulos rojos), se lee a partir de la parte
superior del mismo, y siempre debe procurarse que la temperatura del
líquido a medir sea similar a la temperatura de calibración de la pipeta
Para los procedimientos de pipeteo debe de utilizarse siempre un dispositivo
especial (pro-pipeta). El pipeteo con la boca debe de estar estrictamente
prohibido
No puede insistirse lo suficiente en la importancia de usar dispositivos de
pipeteo. Los riesgos más comunes que entraña el uso de pipetas es la succión
bucal. La aspiración por la boca y la ingesta de material peligroso han dado
lugar al aumento de infecciones en el laboratorio.
También pueden transferirse agentes patógenos a la boca si se coloca un
dedo contaminado en el extremo de la pipeta por el que se hace la succión.
Un riesgo menos conocido del pipeteo con la boca es la inhalación de
aerosoles provocados por la succión. Los tapones de algodón que se colocan
en el extremo de la pipeta no constituyen un filtro microbiano eficiente pues
permiten el paso de partículas durante la succión. Cuando el tapón está muy
ajustado se requiere de una succión muy enérgica con lo que aumenta el
riesgo de aspirar a la vez el algodón, el aerosol e incluso el líquido. El uso de
pro-pipetas evita la ingestión de patógenos

33
También pueden generarse aerosoles cuando el líquido de una pipeta gotea
sobre la superficie de trabajo, cuando se mezclan cultivos alternando succión
y soplado, y cuando se sopla por la pipeta para que salga la última gota.
Las pipetas que tengan los extremos de succión agrietados o astillados deben
desecharse ya que dañan las juntas herméticas por las que se insertan la pro-
pipeta y crean un peligro.
NOTA IMPORTANTE: El primer paso de una buena técnica de pipeteo es
seleccionar la pipeta más apta para el volumen que se desea medir. Es
precisamente este volumen el que determina la pipeta a utilizar: “El volumen
a pipetear debe de ser lo más cercano posible a la capacidad máxima de la
pipeta”. Además, debe de considerarse que el volumen mínimo que una
pipeta puede dispensar con precisión es aproximadamente el 10% de su
capacidad. Una vez seleccionada la pipeta hay que cerciorarse si es de soplar
o no soplar.
USO DE PROPIPETA
Herramienta de goma, creada especialmente para asegurar la
transferencia de líquidos de todo tipo especialmente los que poseen
propiedades especificas (infecciosos, corrosivos, tóxicos, oloríferos,
radiactivos o estériles)
Formas de Uso
Para expeler el aire presione con los dedos pulgar e índice la válvula A
y con el resto de dedos presione el bulbo B para crear un vacío.

34
Introduzca la punta de la pipeta en el líquido y succione hacia arriba
presionando la válvula S ubicada en la parte
inferior.
Para descargar presione la válvula E que se encuentra al
costado de la válvula S, Las tres válvulas posen bolillas de
vidrio que controlan el vacío para un preciso trabajo de
llenado y vaciado de las pipetas.
PARA INSERTAR LA PIPETA
B

35
GUIA PRELABORATORIO N ° 2
PREPARACION DE DILUCIONES DIRECTAS Y SERIADAS
1. Concepto de soluto y diluyente
2. Diluyentes más usados en serología
3. ¿Cómo se expresa una dilución?
a. Significado de cada término en la representación de una dilución
4. Concepto de dilución directa y seriada. Usos
5. Ejercicios en la preparación de diluciones:
a. ¿Cuántos mililitros de una dilución 1:5 se pueden preparar con
250 µl de suero?
b. Si usted quiere preparar 25 ml de una dilución 1:2 ¿Cuántos ml
de suero necesitará?

36
PRACTICA N ° 2
PREPARACION DE DILUCIONES DIRECTAS Y SERIADAS
Cuando se prepara una solución menos concentrada a partir de una más
concentrada, se hace una dilución. Es una mezcla homogénea, uniforme y
estable formada por dos componentes: la sustancia presente en mayor
cantidad se le denomina solvente (diluyente) y la menor cantidad se le llama
soluto y es la sustancia disuelta.
Dependiendo de lo que se va a diluir (soluto), el diluyente puede ser
agua destilada, solución salina, fosfato buffer, etc. Si el soluto es glóbulo rojo
se utilizan los dos últimos diluyentes.
Las diluciones pueden expresarse como: una fracción 1/10 o como una
proporción 1:10 en la cual el primer término o numerador indica la parte del
soluto en la dilución y el segundo término o denominador, el volumen total o
final de la dilución. Ejemplo: En una dilución 1:10, hay una parte del soluto y
9 partes del solvente, haciendo un volumen final de 10.
Dilución Directa:
Una dilución es directa cuando se realiza en un solo paso, desde la dilución
original hasta la dilución final
Ejemplo: Al pasar 1 ml de soluto a un tubo que contiene 4 ml de
solvente, se obtiene un volumen final de 5 ml, con lo que se ha disminuido la
concentración 5 veces, es decir, el factor de dilución (FD) es de 5. El FD es el
número de veces que disminuye la concentración del soluto en un paso de
dilución.

37
Dilución Seriada:
Cuando se prepara un conjunto de diluciones en secuencia cada una a partir
de la anterior, con un factor de dilución constante, le llamamos diluciones
seriadas. En las diluciones seriadas el denominador es expresado siempre
como múltiplo de la dilución original; 1/2, 1/4, 1/8; 1/5, 1/25, 1/125, etc.
Ejemplo:
En el caso anterior el factor de dilución es 10, ya que se diluye 10 veces la
solución precedente.
OBJETIVO
Que el estudiante:
1. Aprenda a preparar diluciones, calculando las cantidades de
diluyente y de soluto que deberá emplear para obtener las
diluciones deseadas.
Material (por lado de mesa)
- 2 gradillas
- 15 tubos de 12 x 75 mm
- Micropipetas
- Agua destilada

38
- Solución concentrada de hemoglobina
Nota: Las diluciones se hacen para cuantificar anticuerpos, antígenos u otros
reactivos.
Procedimiento
En ésta práctica, el alumno preparará dos diferentes diluciones a partir de
una solución concentrada de hemoglobina.
En el primer caso practicará con las llamadas diluciones seriadas dobles (1/2)
o lo que es lo mismo diluciones seriadas usando como factor de dilución 2.
En el segundo el “factor de dilución" será 5, o sea (1/5) y se obtiene el
mismo tipo de dilución seriada.
Parte A
Dilución seriada usando factor de dilución de 2:
1. Coloque en una gradilla una fila de 10 tubos de 12 x 75 mm y numérelos
del 1 al 10
2. Coloque en los tubos numerados del 2 al 10, 500 µl de agua destilada (ó
0.5 ml usando una pipeta de 5 ml graduada en décimas)
3. En el primer tubo coloque 500 µl de solución concentrada de
hemoglobina y 500 µl en el tubo No.2 (o coloque con una pipeta de 1 ml
graduada en centésimas, 0.5 ml en ambos tubos), mezcle el contenido del
tubo 2, llenando la pipeta por aspiración, teniendo cuidado en no hacer
burbujas.

39
4. Utilizando la misma pipeta y punta pase 500 µl de la dilución del 2° tubo
al tercer tubo y mezcle en la forma descrita anteriormente (ó 0.5 ml con
una pipeta de 1 ml)
5. Siempre usando la misma pipeta y punta pase 500 µl (ó 0.5 ml usando la
misma pipeta de 1 ml) del tercer tubo al cuarto y repita el mismo
procedimiento de mezclado para éste y todos los tubos siguientes. Del
décimo tubo descarte 500 µl (ó 0.5 ml) para que todos los tubos
contengan igual volumen 500 µl (ó 0.5 ml con pipeta serológica)
6. Las diluciones finales serán: 1:1 en el primer tubo, 1:2 en el segundo
tubo, 1:4 en el tercero, etc. En el décimo tubo la dilución será 1:512
Parte B
Dilución seriada usando factor de dilución de 5:
1. Coloque en una gradilla una serie de 5 tubos de 12 x 75 mm y numérelos
del 1 al 5
2. Pipetee en los tubos 2, 3, 4 y 5, 400 µl de agua destilada (ó con una pipeta
de 1 ml graduada en décimas pipetee 0.4 ml)
3. Con otra punta coloque 400 µl (ó 0.4 ml con otra pipeta de 1 ml) de
solución concentrada de hemoglobina en el primer tubo.
4. En el segundo tubo coloque 100µl (ó 0.1ml) de solución de hemoglobina
concentrada, mezcle el contenido de este tubo, llenando la pipeta por
aspiración, teniendo cuidado de no hacer burbujas.

40
5. Utilizando la misma pipeta y punta del numeral anterior pase 100µl (ó
0.1 ml con la misma pipeta de 1 ml) del segundo al tercer tubo, mezcle el
contenido y repita el procedimiento hasta llegar al quinto tubo, del cual
después de mezclar descartará 100µl (ó 0.1 ml)
6. Las diluciones finales serán: 1:1 en el primer tubo, 1:25 en el segundo,
1:125 en el tercero, etc. En el quinto tubo la dilución final será 1:625
NOTA
Una dilución 1:1 denota que el soluto está puro sin diluir, es decir existe una
parte de soluto en una parte de volumen total o final. Hay que hacer
mención de que dependiendo de la técnica o prueba realizada, una dilución
seriada inicia desde el soluto puro (1:1), pero en otras no. Así que hay que
tomar en cuenta eso para efectuar el procedimiento adecuado.

41
GUIA DE PRELABORATORIO Nº 3
EXTRACCION DE SANGRE CON FINES SEROLÓGICOS Y TIPEO SANGUINEO
A. Venóclisis humana:
1. . Formas de obtención de sangre.
2. Sitios anatómicos usados según edad.
3. Técnica de sangrado.
4. Técnica de manipulación de sangre con fines serológicos.
5. Prevención de hematomas
6. Prevención de hemólisis
7. ¿Qué sucede si el torniquete se aplica por demasiado tiempo?
8. Formas de resolver problemas durante la extracción de sangre
venosa
9. Anticoagulantes. Uso, mecanismo de acción, ejemplos.
10. Diferencia entre suero y plasma
B. Tipeo sanguíneo:
1. Fundamento de la prueba
2. Estructura química de los antígenos de los grupos sanguíneos
3. Utilidad de la prueba
4. Posibles errores al realizar la prueba
5. Resultados

42
PRACTICA No. 3
EXTRACCIÓN DE SANGRE CON FINES SEROLOGICOS Y TIPEO SANGUINEO
La venoclisis (punción venosa o flebotomía) es un procedimiento que se
usa en el laboratorio de Serología con la finalidad de extraer sangre a
pacientes y para hacer inoculaciones y sangrías en animales de
experimentación
La obtención de una muestra de sangre es importante porque en ella se
puede investigar la presencia de parásitos, bacterias u otros; pero también se
hace con fines serológicos, es decir, para estudiar la presencia de
inmunoglobulinas (anticuerpos).
El sitio para obtener una muestra de sangre varía si es en el hombre o
en animales de laboratorio, por ejemplo: en el ratón se obtiene de la cola, en
el conejo de la vena de la oreja o del corazón; en el ternero y caballo de la
yugular; en el humano depende de la edad, siendo en el adulto la más
utilizada la vena cefálica media de el antebrazo, y menos frecuente yugular,
femoral, etc. En cambio en el recién nacido para pequeños volúmenes se usa
el lóbulo de la oreja y el talón del pie y para volúmenes un poco más grandes
se puede usa venas de la cabeza.
Unas pocas palabras bien elegidas servirán para tranquilizar al paciente.
La autoconfianza y seguridad de la persona que va a extraer la muestra
contribuirán a establecer una relación adecuada. El paciente debe de estar en
una posición confortable con el brazo accesible al personal que tomará la
muestra. Los enfermos ambulatorios deben ser sentados cómodamente de
preferencia en una silla provista de brazo para un apoyo firme.

43
OBJETIVOS
Que el estudiante:
1. Aprenda a extraer adecuadamente una muestra de sangre venosa
humana
2. Realice un tipeo sanguíneo.
3. Aprenda a reportar adecuadamente los resultados del tipeo sanguíneo
Material
- Jeringas de 10 ml con agujas número 22
- Algodón, alcohol, bandas de hule, tirro
- Pipetas Pasteur estériles, bulbos
- Tubos 16 x 100 mm con tapón de rosca estériles
- Centrífuga / gradillas
- Guantes
- Tubos 13 x 100 mm con tapón con y sin anticoagulante
- Lentes protectores
- Reactivos: anti A, anti B, anti D, palillos de madera
Láminas de vidrio 1 x 2 1/2”
PROCEDIMIENTO
PARTE A. EXTRACCIÓN DE SANGRE VENOSA HUMANA
1. El sitio más adecuado para la extracción de sangre venosa, es la vena que
se halla en el pliegue anterior del codo, en el punto donde sea más gruesa y
fácilmente visible, aprovechando de preferencia, una de las ramas que
forman una “Y” inmediatamente arriba del lugar donde se juntan.
2. Si el paciente se encuentra en el laboratorio, haga que se siente de manera
que quede colocado paralelamente a la mesa de trabajo donde se hará la

44
extracción de sangre. Ponga el brazo del paciente sobre la superficie de la
mesa de trabajo, apoyándolo en un pequeño cojín dispuesto debajo del
codo, con la palma de la mano vuelta hacia arriba.
Si el paciente se encuentra en cama, haga que extienda el brazo en posición
descansada
3. Hay que asegurarse de que la aguja esté bien fija a la jeringa y de que no
esté obstruida.
4. Realizar la asepsia con alcohol el sitio que se va a puncionar. En los adultos
se selecciona una vena bien visible o palpable en la superficie de flexión del
codo.
5. Aplicar un torniquete un poco por encima del pliegue de flexión del brazo,
para permitir que las venas se vuelvan más prominentes. Si las venas aún no
son suficientemente prominentes instruya al paciente a que abra y cierre la
mano varias veces. Nunca toque el área en la cual aplicó alcohol, para evitar
contaminación.
6. Tome la jeringa con la mano derecha, colocando la yema del dedo índice
sobre la base de la aguja.
7. Coloque la aguja sobre la vena, con el bisel hacia arriba. Introduzca la aguja
en el centro de la vena sin titubeos.
Nunca intente puncionar la vena por un lado, ni introduzca la aguja con el
bisel hacia abajo. Siempre debe tenerse precaución de no introducir aire en
las venas, ya que unos centímetros de aire en una vena puede causar la
muerte al individuo.
8. Una vez la aguja está en el interior de la vena (1.0 – 1.5 cm.) con la mano
izquierda tire hacia atrás el émbolo de la jeringa muy lentamente, debiendo

45
entrar sangre en ella. Siga tirando del émbolo hasta llenar la jeringa con la
cantidad de sangre que necesite, haga que el paciente abra el puño
9. Retire el torniquete.
10. Coloque una porción de algodón seco sobre la parte donde se encuentra
oculta la aguja. Saque la aguja con un movimiento rápido por debajo de la
pieza de algodón.
11. Pida al paciente que presione firmemente la pieza de algodón durante
tres minutos con el brazo extendido. No se recomienda flexionar el brazo
luego de la extracción de sangre para así evitar la formación de hematomas.
En el tubo sin anticoagulante coloque 9 ml de la sangre cuidadosamente
removiendo para ello la aguja utilizando y depositando suavemente sobre las
paredes del tubo el contenido de la jeringa, rotule correctamente y déjela
coagular.
El mililitro restante colóquelo en el tubo con anticoagulante de la misma
forma y agite el tubo suavemente.
NOTA:
- Evite puncionar en un área con hematoma, fístulas, quemaduras,
escoriaciones de la piel, cicatrices o del costado en que se ha realizado
mastectomía reciente.
- Evite puncionar en el brazo donde hay venoclisis, inyección intramuscular
previa o administración de medicamentos vía intravenosa.
CONSIDERACIONES ADICIONALES PARA LA BUENA CALIDAD DE LA
EXTRACCIÓN DE MUESTRA
Para prevenir la formación de hematoma:
No puncionar directamente sobre la pared de la vena.
Remover el torniquete antes de retirar la aguja.

46
Sostener las venas superficiales al momento de la punción.
Asegurarse que la aguja penetre completamente hacia el lumen de la vena.
La penetración parcial permite que la sangre escape hacia el tejido blando,
rodeando la vena vía el bisel de la aguja.
Aplicar una presión adecuada en el sitio de la punción.
Para prevenir la hemólisis (principal interferente en muchas pruebas):
Mezclar los tubos con anticoagulante gentilmente (en forma de 8) de
15-20 veces.
Evite la extracción sanguínea directamente de un hematoma.
Evite la extracción forzada generada por el aspirado violento del
émbolo, en el caso de jeringas. Evite la formación de espuma en la
muestra.
Asegúrese que el sitio de venipunción esté seco.
Evite la venipunción traumática.
En tubos no llenados al vacío, puede ocurrir hemólisis al llenarlos
cuando se hace una fuerte presión sobre el émbolo provocando un
chorro de sangre violento.
Evite el uso de tubos sucios, con restos de detergente o de agua
La aplicación prolongada del torniquete conlleva...
A la hemoconcentración de elementos no filtrables (ej. proteínas). La
presión hidrostática ocasiona que el agua y algunos elementos
filtrables abandonen el espacio extracelular y se acumulen en la
sangre. En algunos casos esto ocasiona serias interferencias en los
análisis a efectuar.
Un aumento del volumen del paquete globular sanguíneo.

47
Alteraciones dentro de los parámetros evaluados en la química
sanguínea.
GUÍA PARA LA RESOLUCIÓN DE PROBLEMAS DURANTE LA EXTRACCIÓN
VENOSA
Si no se obtiene muestra sanguínea o la misma es incompleta...
Cambie la posición de la aguja. Un leve movimiento hacia delante
(cuando hay menos de 2/3 de la aguja dentro de la piel), en el ángulo
correcto ayuda. Es muy probable que no se encuentre en el lumen.
En caso de una penetración muy profunda (cuando hay más de 2/3 de
la aguja dentro de la piel), un leve movimiento hacia atrás favorece la
entrada al lumen venoso. Asegúrese que el ángulo sea el correcto.
En caso fallido, tome en cuenta lo siguiente:
Afloje el torniquete. Este podría estar obstruyendo el flujo sanguíneo.
Pruebe otro tubo. Es posible que no haya vacío en el que se está
utilizando.
Fije nuevamente la vena. Algunas veces las venas se mueven del sitio
de la punción.
Si la sangre deja de fluir en el tubo...
Es probable que la aguja se haya salido de la vena durante el recambio de
tubos. Con movimientos gentiles, redirecciónela. Para evitar lo anterior,
mantenga el equipo firmemente sin ejercer una presión que cause molestias
al paciente.
Es probable que la vena haya colapsado; afloje el torniquete para
incrementar el flujo venoso, remueva la aguja ligeramente y vuelva a
redireccionarla. Si esto no es exitoso, remueva la aguja, tenga los cuidados

48
correspondientes en el sitio de la punción. Puncione nuevamente en un lugar
diferente.
Otros problemas que deben considerarse…
Si se forma un hematoma bajo la piel adyacente al sitio de la punción, afloje
el torniquete y retire la aguja. Aplique presión firmemente sobre el
hematoma. Aconseje el uso de paños intermitentes de agua fría y caliente.
Pudiera suceder que se atraviese una arteria, en estos casos la sangre se
observa de color rojo brillante. Afloje el torniquete, retire suavemente la
aguja y aplique una presión uniforme y constante durante 5 minutos.
Obtención de sueros. Cuando la sangre se haya coagulado si fuere necesario,
separe el coágulo de la superficie del tubo por medio de un aplicador.
Centrifugue por 15 minutos a 1,500 rpm, separe el suero con una pipeta
Pasteur y coloque en un tubo limpio 13 x 100. No se olvide de identificar
adecuadamente con nombre y fecha la muestra. Guárdelo a temperatura de
refrigeración, hasta el siguiente laboratorio.
Siempre debe tenerse cuidado de que, para obtener buenos resultados, es
preferible seguir algunas indicaciones especiales.
NOTA IMPORTANTE: Tomar la muestra en ayunas para evitar suero “quiloso”

49

50
PARTE B. TIPEO SANGUÍNEO:
El sistema sanguíneo ABO fue descubierto en 1901 por Karl Landsteiner
al observar la aglutinación de los eritrocitos humanos por otros sueros
también de humanos. Demostró que los glóbulos rojos poseían por lo menos
dos factores designados aglutinógenos A y B, con los que se podía explicar los
cuatro grupos sanguíneos que existían y así postuló que cada persona podía
tener uno de ellos(A o B), ambos (AB) o ninguno (O).
El grupo A presenta en su estructura N-acetil-galactosamina, en tanto que el
grupo B posee galactosa, ambas unidas al último residuo de galactosa de la
cadena madre.
En 1940, Landsteiner y Wiener descubrieron que el factor Rh estaba
presente en el 85% de los eritrocitos humanos y los del mono Rhesus (de ahí
el nombre de este sistema). Dentro de este sistema de grupo sanguíneo se
recurre al uso de letras mayúsculas y minúsculas para designar a los seis
antígenos más comunes: D, C, E c, d, e, de los cuales el primero es utilizado
como sinónimo de Rh.
IMPORTANTE
1. Seguir rigurosamente las instrucciones del fabricante para la preparación
de los reactivos.
2. Dejar que las muestras y reactivos lleguen a temperatura ambiente antes
de iniciar los procedimientos.
3. Evitar la combinación de reactivos de diferentes casas comerciales.
4. Llevar un registro diario del control de temperatura de las refrigeradoras y
baños de María.

51
5. Procesar los controles de las casas comerciales y el control interno en
cada tiraje de muestras
Procedimiento
1. Escoja dos láminas portaobjetos 3x2" ó 3x1½" pulgadas limpias y
desengrasadas. Con un lápiz graso, divida una de ellas en dos partes
iguales y rotúlelas A y B
2. Rotule la otra lámina con D (Rh)
3. Coloque una gota de sangre en cada una de las secciones rotuladas.
4. Agregue una gota de antisuero A sobre la gota de sangre identificada
como “A”, una gota de antisuero B sobre la sangre rotulada como “B” y
una del antisuero D sobre el área correspondiente (factor Rh)
5. Mézclelas sin extender con aplicadores de madera diferentes. Rote la
lámina durante uno a dos minutos.
6. Observe los resultados
7. Repórtelos e interprete
RESULTADOS
* Presencia de grumos o agregados se considera aglutinación positiva. Si
la suspensión permanece homogénea es negativa.
Grupo sanguíneo Antígeno en eritrocito Anticuerpo en plasma
A A Anti-B
B B Anti-A
AB A + B -
O H Anti-A + Anti-B

52
FUENTES DE ERROR EN LA REALIZACIÓN DEL TIPEO SANGUÍNEO
1. Material sucio causa falsos positivos / negativos
2. Contaminación bacteriana de la muestra
3. Contaminación de reactivos
4. Proporción incorrecta de la relación muestra / reactivo
5. Uso de reactivos vencidos
6. Presencia de hemólisis en la muestra
7. Incorrecta identificación de la muestra
8. Inadecuada agitación
9. Falta o incorrecta adición de reactivos
NOTA:
El procedimiento de tipeo sanguíneo se puede realizar por diversas técnicas,
como por ejemplo, aglutinación en lámina, pero también puede hacerse por
aglutinación en tubos usando suspensiones de glóbulos rojos y plasma y
también por medio de técnicas de cromatografía

53

54
GUIA DE PRELABORATORIO Nº 4
PREPARACIÓN DE SUSPENSIÓN DE GLÓBULOS ROJOS
1. Aplicaciones de las suspensiones de glóbulos rojos
2. Del procedimiento escriba:
a. ¿Por qué se filtra la sangre con gasa?
b. Objetivo del lavado de eritrocito
c. Concentración óptima. Razón.
3. Cuidados a tomar en cuenta.
4. Causas de error.
5. Cálculos.

55
PRACTICA No. 4
PREPARACION DE SUSPENSIONES DE GLOBULOS ROJOS
En muchas pruebas serológicas se utilizan suspensiones de glóbulos rojos
de humanos o de animales de laboratorio. Para su preparación se utiliza
sangre completa colectada en un tubo con anticoagulante.
La concentración de dichas suspensiones depende de la prueba a realizar, y
con ello se establece un equilibrio entre los inmunorreactantes involucrados
para hacer visible la reacción in vitro.
OBJETIVO
Que el estudiante:
1. Practique la preparación de suspensiones de glóbulos rojos a partir de
una muestra de sangre.
Material (por lado de mesa)
- 2 tubos de 12 x 75 mm
- 2 pipetas de 5 ml graduadas en décimas
- 2 pipetas de 10 ml graduadas en décimas
- Centrífuga
- Pipetas Pasteur y bulbos de hule
- Erlenmeyers con sangre
- Solución salina al 0.85%
- 2 embudos con gasa
- 4 trozos de papel parafinado
- 4 tubos de centrífuga graduados

56
- Guantes y lentes protectores
Procedimiento
Parte A
1. Filtre a través de gasa (doble) aproximadamente 4 ml de sangre colectada
con anticoagulante y reciba el filtrado en un tubo 12 x 75 mm. Con ello se
retiene las partículas grandes como coágulos o fibrina
2. Añada al filtrado, solución salina al 0.85% hasta la graduación superior del
tubo.
3. Tape la boca del tubo con papel parafinado y mezcle suavemente por
inversión para no lisar los glóbulos
Descarte el papel parafinado
4. Centrifugue el tubo a 1500 rpm por 10 minutos
5. Separe y descarte el sobrenadante con una pipeta Pasteur
6. Repita el procedimiento con los glóbulos empacados, a partir del número
dos, unas dos veces más o hasta que el sobrenadante salga claro. Esto se
hace con la finalidad de obtener un paquete globular libre de plasma y otros
constituyentes del mismo
7. Después del último lavado separe cuidadosamente el sobrenadante con
una pipeta Pasteur y descártelo. Lea el volumen de glóbulos rojos empacados
(sedimentados)
8. Pase el sedimento de los glóbulos rojos empacados a un tubo de centrífuga
graduado y lea el volumen de glóbulos rojos empacados (sedimentados).
9. Prepare la suspensión al 2 % aplicando la siguiente fórmula:

57
VT = V de células empacadas x 100 = V x 100
% de células deseadas 2
VT
V
%
=
=
=
Volumen total de la suspensión que se preparará
Volumen aproximado del paquete de eritrocitos
Porcentaje de células deseadas, en este caso 2%
Ejemplo: teniendo 0.5 ml de células empacadas, ¿Qué volumen de
suspensión al 2% se puede preparar?
Aplicando la fórmula tenemos:
VT = 0.5 x 100 = 50 = 25 ml
2 2
Por lo tanto se agregará solución salina a los glóbulos empacados hasta
completar un volumen de 25 ml.
Parte B
1. Repita el procedimiento de la parte A de ésta práctica y prepare una
suspensión de glóbulos rojos al 5%
2. Reporte sus cálculos y resultados a su instructor

58
GUÍA PRELABORATORIO N ° 5
ADSORCIÓN DE ANTICUERPOS
1. ¿Qué es la adsorción de anticuerpos?
2. Fundamento de la técnica.
3. Finalidad de la misma
4. Causas de error e interpretación.
5. Usos en el laboratorio clínico.
6. ¿Qué es una reacción cruzada?
7. ¿Qué son determinantes antigénicos?
8. ¿Qué es titulación de aglutininas?

59
PRACTICA No. 5
ADSORCION DE ANTICUERPOS
Una característica propia de los anticuerpos es su especificidad; esta
propiedad selectiva ha sido ampliamente utilizada para el análisis antigénico
de bacterias y otras de estructura compleja; sin embargo, cuando existen
determinantes antigénicos muy parecidos en su estructura, los anticuerpos
formados reaccionan con estos, dando lugar a lo que se conoce como
reacciones cruzadas.
La adsorción de anticuerpos es un procedimiento utilizado para eliminar
anticuerpos de un suero. Con ello se evitan reacciones serológicas cruzadas
FUNDAMENTO: Al mezclar una sustancia inmunogénica con un
antisuero heterólogo (suero polivalente), cada anticuerpo reaccionará con su
correspondiente determinante antigénico, otros anticuerpos permanecen
libres en el suero, al remover los complejos antigéno – anticuerpo, formados
por medio de centrifugación nos quedaremos con un suero adsorbido.
Este proceso puede realizarse con eritrocitos lavados, eritrocitos
tratados con enzimas o con eritrocitos tratados con formol
La adsorción tiene las siguientes aplicaciones:
1. Eliminar crioaglutininas o aglutininas calientes a fin de valorar la
presencia de aloanticuerpos.
2. Determinar el número de determinantes antigénicos que posee un
inmunógeno, como por ejemplo, cualquier microorganismo
3. Eliminar anticuerpos no deseados, como anti-A, anti-B u otros a fin de
preparar antisueros para someter a detección las unidades de
donantes por lo que respecta a antígenos eritrocitarios.

60
4. Eliminar un solo anticuerpo de un suero polivalente, mediante el uso
de eritrocitos con los antígenos adecuados. Esto ayuda a la detección
de los demás antígenos que quedan en el suero adsorbido
5. Determinar pureza del suero
6. Determinar el grado de reactividad de un suero de pacientes poli
transfundidos
OBJETIVO
Que el estudiante sea capaz de:
1. Experimentar la adsorción de aglutininas A y B del suero sanguíneo,
usando eritrocitos grupo A y B y que posteriormente compruebe sus
resultados mediante pruebas cuantitativas de aglutinación.
Material (por lado de mesa)
- Suero humano anti A y B
- Solución salina 0.85 %
- Suspensión de glóbulos rojos humanos, grupo A y B al 5% en solución
salina.0.85 %
- Tubos de ensayo de 12 x 75 mm y gradillas
- Guantes y lentes protectores
- Micropipetas de 100 y 1000 µL (o Pipetas serológicas de 1 ml.) (16)
- Pipetas Pasteur (4)
- Bulbos de hule (2)
- Tubos cónicos de centrífuga de 15 ml (2)
- Tapones de hule (2)

61
Procedimiento
A. Titulación de aglutininas A y B en el suero
1. Coloque 6 tubos de 12 x 75 mm en una gradilla
2. Deposite 600µl (ó 0.6 ml) del suero en el tubo No 1 y 300µl (ó 0.3 ml)
de solución salina en cada uno de los tubos restantes
3. Haga dilución seriada del suero usando un factor de 2
4. Añada 300µl (ó 0.3 ml) de suspensión de glóbulos grupo A al 5% en
solución salina a cada uno de los tubos
5. Agite los tubos y centrifúguelos a baja revolución por 30 segundos
6. Resuspenda cuidadosamente los glóbulos empacados en cada tubo y
obsérvelos para determinar si hay aglutinación
7. El título de aglutininas A (Anti A) en el suero será dado por la dilución
más alta que presenta aglutinación
Este procedimiento deberá repetirse en igual forma usando suspensión de
glóbulos rojos grupo B, para determinar el título de aglutininas B (Anti B) en
el suero.
B. Adsorción de aglutininas A del suero
1. Coloque 1000µl (ó 1 ml) de suero en un tubo 13 x 100
2. Añádale 1000µl (ó 1 ml) de suspensión al 5% de glóbulos rojos grupo A
en solución salina. Coloque un tapón en la boca del tubo
3. Agite el tubo suavemente por inversión, centrifúguelo por 30
segundos a 1500 rpm

62
4. Retire el suero sobrenadante del tubo con una pipeta Pasteur y
colóquelo en un tubo rotulado “suero adsorbido para A”
Este procedimiento deberá repetirse en igual forma usando suspensión de
glóbulos rojos grupo B, para observar las aglutininas B del suero, y al final
deberá rotularse “suero adsorbido para B”
C. Titulación de aglutininas en el suero adsorbido
Repita la titulación de aglutininas A y B en el suero absorbido, en la
misma forma que lo hizo anteriormente en la parte A de esta práctica.
Anote sus resultados:

63
Título de Aglutininas A B
Suero sin adsorber
Suero adsorbido para A
Suero adsorbido para B
NOTA: ¿Adsorción y absorción es lo mismo? NO.
La absorción es cuando una sustancia se introduce en la estructura de otra,
por ejemplo, una esponja absorbe agua, entonces si cortamos la esponja en
pedazos vamos a encontrar agua en todas las partes de la estructura de la
esponja.
La adsorción es un fenómeno superficial, la sustancia adsorbida no se
introduce en el volumen del cuerpo, sino que solo se adhiere a su superficie.
GUIA PRELABORATORIO N ° 6

64
INOCULACIÓN DE ANIMALES PARA LA PREPARACIÓN DE SUEROS INMUNES
1. Generalidades sobre el bioterio. Condiciones del mismo.
2. Animales más utilizados.
3. Alimentación, cuido y manejo de los animales.
4. Identificación de animales de experimentación.
5. Definición de antígeno.
6. Preparación del antígeno (ver manual) Razone cada paso.
7. Esquema de inmunización
8. Vías más utilizadas.
9. Monitoreo de producción de anticuerpos.
10. Sangrado final
11. Usos de los sueros inmunes.

65
PRACTICA No. 6
INOCULACION DE ANIMALES PARA LA PREPARACION DE SUEROS INMUNES
Los sueros inmunes o antisueros contienen anticuerpos contra un
determinado antígeno y suelen producirse en animales de laboratorio como
por ejemplo: conejos, cobayos, ratones o en animales de gran tamaño como
caballos, ovejas, terneros, etc.
Dichos anticuerpos pueden considerarse como herramientas biológicas de
mucha utilidad para la detección y caracterización de sustancias de interés
diagnóstico o investigativo debido a su especificidad
La producción de antisueros se hace por medio de inyecciones del antígeno
(inmunización), el cual puede administrarse por vía intravenosa,
intraperitoneal o subcutánea. La dosis y la vía de inoculación depende de la
naturaleza física del antígeno (inmunógeno), asi como también de la
inmunogenicidad de la sustancia inoculada
Los anticuerpos a obtener son Policlonales, los cuales presentan una
naturaleza heterogénea y van dirigidos contra epitopos diferentes de la
molécula de inmunógeno inoculado, reaccionando con diverso grado de
afinidad en la medida que se ajusten con el epitopo.
ANIMAL DEL LABORATORIO:
Es cualquier especie animal utilizado en experimentación con fines
científicos, es decir, mantenido bajo determinadas condiciones y utilizado
como instrumento de medida. Este al ser sometido a una experimentación
proporciona datos, los cuales son utilizados como información para los

66
resultados. Como ejemplo de esos animales tenemos: Ratones, ratas,
cobayos, hámster, conejos, carneros, gallinas, perros, gatos, etc.
Actualmente se utilizan una variedad de modelos animales o bio-
modelos, siendo el conejo uno de los más utilizados para análisis o ensayos
de laboratorio, en la biotecnología o investigación científica.
El conejo es originario de la península Ibérica y de allí se extendió a distintas
regiones del Mediterráneo y posteriormente hacia Europa. En las
colonizaciones de Austria, Nueva Zelanda y América se introdujo estos
animales, todos provenientes de stock salvaje.
Escogencia de la especie de animal a inmunizar:
El primer requisito para que una molécula sea inmunogénica es su carácter
de "extraña" para el individuo. Esto es, la albúmina sérica bovina no va a
despertar una repuesta inmune al ser inyectada en una vaca, pero sí puede
ser un excelente inmunógeno en un conejo, por ejemplo.
Una mayor distancia filogenética entre la especie de la cual proviene el
antígeno, y la especie que se inmuniza, generalmente se asocia con una
mayor inmunogenicidad, debido a que las diferencias estructurales entre sus
componentes ortólogos tienden a ser mayores.
Al escoger la especie de animal a inmunizar, debe tomarse en cuenta un
aspecto práctico: el volumen de antisuero requerido. A su vez, esto depende
de la dilución final a la cual se utilizará el antisuero. Es posible utilizar
especies tan pequeñas como el ratón (que proporciona alrededor de 1 ml de
suero), hasta especies de producción industrial como el caballo (del que se
obtiene hasta 12-15 litros de plasma en tres días de sangría). Sin embargo,
generalmente los animales más utilizados son los conejos y los cobayos (para

67
volúmenes pequeños), o los carneros y las cabras (para volúmenes mayores).
En principio, todo antígeno debe ser administrado a una especie distinta de
la que proviene. La edad óptima del animal a inmunizar es preferiblemente la
de adulto joven, por ser una etapa en la cual el sistema inmune se encuentra
plenamente desarrollado. Para algunos antígenos, podrían hallarse
diferencias de inmunogenicidad según el sexo del animal.
VENTAJAS DEL USO DEL CONEJO COMO ANIMAL DE LABORATORIO
- Fácil cuidado y mantenimiento
- Alimentación sencilla por sus hábitos de alimento
- Su costo es bajo
- Posee grandes vasos en la oreja
- Tiene calidad y cantidad de anticuerpos
DESVENTAJAS
Sufren una gran variedad de enfermedades y reacciones extremadamente
variables a la mayoría de anestésicos generales.
BIOTERIO
Es una instalación destinada para animales de laboratorio y su diseño y
tamaño dependen de las actividades de investigación de la institución, de los
animales a albergar, la relación física con el resto de la institución y la
localización geográfica.
Para un buen manejo de los animales, comodidad del personal y protección
de la salud se requiere que las instalaciones para animales estén separadas
del área para el personal, como oficinas o cuartos de conferencias. Los
animales deben de albergarse en áreas dedicadas para ese propósito y no en
laboratorios solo por conveniencia.

68
El Bioterio debe de contar por lo menos con áreas para:
Albergue, cuido y saneamiento de animales.
Recepción, cuarentena y separación de animales.
Separación de especies para aislamiento de proyectos individuales.
Almacenamiento.
Espacio para lavado y esterilización de material. etc.
CARACTERÍSTICAS.
1. Deben de ser construidos de material que facilite la limpieza y
resistentes a la corrosión.
2. Libres de bordes cortantes o proyecciones que puedan dañar a los
animales.
3. Adecuada ventilación.
4. Libre de humedad excesiva.
5. Con buena iluminación
6. Espacio adecuado (depende del tipo de animal).
7. Que tenga un fácil acceso de agua y alimentos para el animal.
8. Variaciones de temperatura mínimas
9. Adecuado control de ruido.
ALIMENTACION, CUIDO Y MANEJO DE ANIMALES
Se debe de ser muy cuidadosos en la adquisición, transporte,
almacenamiento y manejo de alimentos para reducir la introducción de
enfermedades y contaminantes químicos. La existencia de alimentos debe de
rotarse a manera de que el más viejo sea utilizado primero. El área de
almacenamiento debe de mantenerse limpia y cerrada para evitar la entrada

69
de pestes. Debe de almacenarse en estantes y protegidos de la humedad
para evitar el deterioro del mismo.
Los comederos deben de diseñarse y colocarse para permitir fácil acceso al
alimento y para minimizar la contaminación con orina y heces. También si los
animales se albergan en grupo debe de haber suficiente espacio y puntos de
alimentación para evitar la competencia por el alimento.
En cuanto al suministro de agua debe de ser potable y en la medida de lo
posible se debe de controlar su pH, dureza y contaminantes microbiológicos.
IDENTIFICACION DE ANIMALES DE EXPERIMENTACIÓN
Los métodos de marcaje deben de permitir una fácil identificación del animal
y deben de ser selectivos, de aplicación rápida e indolora. En algunos casos
debe de usarse anestesia para evitar el dolor en el animal.
Entre estos métodos se incluyen: tarjetas en cuartos, estantes, corrales y
jaulas con información escrita o en códigos de barra, collares, bandas, placas
y etiquetas, tintes coloreados, orificios y muescas en las orejas, tatuajes y
marcas congeladas.
Las tarjetas de identificación deben de incluir la fuente del animal, la cepa,
nombres y localizaciones de los responsables, datos pertinentes y número de
protocolo cuando sea aplicable.
OBJETIVOS
Que el estudiante:
1. Aprenda a inocular animales de laboratorio, para la preparación de
antisueros.
2. Practique un esquema de inmunización para obtener antisueros

70
3. Ejecute una técnica de sangrado en un animal debidamente
inmunizado
Materiales
- Conejos
- Suspensión de E. coli (Ag), S. typhi (Ag O y H)
- Suero humano estéril (Ag)
- Jeringas de 5 ml con aguja hipodérmica No 22
- Jeringas de tuberculina con aguja hipodérmica No 25
- Algodón con alcohol 70%
- Guantes y lentes protectores
Procedimiento
1. Seleccionar al menos 1 conejo joven, de un peso corporal de al menos 2Kg
para la inmunización. Los animales deben examinarse para verificar que no
muestren signos de infección u otras patologías, y deben mantenerse en
condiciones de adecuadas, en jaulas claramente rotuladas.
2. A intervalos de 4 días inyectar 0.5 ml, 1.0 ml, 1.5 ml y 2.0 ml de suspensión
de antígeno e inocularla por vía subcutánea en el dorso o lomo del cuerpo
del conejo (Ver figura de conformación corporal del conejo). Siguiendo este
esquema de inmunización se pretende que el animal de experimentación
responda adecuadamente al estímulo inmunogénico produciendo una
adecuada concentración de anticuerpos.
3. Después de 6 a 10 días de la última inoculación, sangrar el conejo y
determinar la presencia de anticuerpos, lo cual se puede realizar con pruebas
de aglutinación o precipitación, dependiendo del inmunógeno usado.

71
4. Si el título de anticuerpos es bajo, poner una quinta inyección de 3.0 ml
(dosis de refuerzo)
1. Sangrar el conejo del corazón o de la vena marginal de la oreja a los 10
días después de la última inyección, separar el suero del coágulo, añadir al
suero mertiolate 1:10.000 como preservador y guardarlo en pequeñas
alícuotas en el refrigerador congeladas.
Esquema de inmunización para la obtención de un antisuero de conejo
contra: __________________________________
_____________________________________________________________________________
Día :
Fecha:
Dosis:
Vía:
_____________________________________________________________________________

72
FIGURAS:
CONEJO RAZA NUEVA ZELANDA. Conformación corporal.
Sangría en conejo a través de la arteria central de la oreja. A la izquierda se señalan la arteria central (A), utilizada para la sangría, y la vena marginal (V), utilizada para la inyección intravenosa. A la derecha se muestra la forma para realizar la punción de la arteria, en forma muy superficial, con una aguja calibre 22 o 20 sin jeringa. La sangre se recoge por goteo libre en un tubo.
A
B

73
PREPARACIÓN DE ANTIGENOS
Antígeno somático “O” de Escherichia coli.
1. Inocular cepa de E. coli a agar eosina azul de metileno por 18 – 24 horas a
36 1°C. En este caso particular se usa ese medio de cultivo para ver las
características propias de dicha bacteria en él.
2. Resembrar a agar tripticasa soya (TSA) para eliminar azucares e
inhibidores del medio EMB (o Mac Conkey si es el caso) e incubar 18 – 24
horas a 36 1°C
3. Resembrar a tubos que contengan de 6 a 7 ml de caldo tripticasa soya
TSC. . Incubar 12 horas a 36 1°C. Dicha incubación tiene que ser lo más
exacta posible ya que en esas condiciones y tiempo la bacteria se
encuentra en la fase de crecimiento exponencial, recuperándose la mayor
cantidad posible de antígeno bacteriano al realizar el procedimiento.
4. Centrifugar a 2500 rpm por 10 minutos
5. Descartar el sobrenadante con pipeta Pasteur
6. Resuspender en 5 ml de solución salina 0.85 % estéril
7. Centrifugar a 2500 rpm por 10 minutos. Descartar el sobrenadante con
pipeta Pasteur
8. Repetir los pasos 6 y 7 dos o tres veces más. Con estos pasos (6 y 7) se
pretende eliminar el caldo de cultivo y los restos del metabolismo
bacteriano, dejando solo a la bacteria en el tubo.
9. Resuspender el sedimento con solución salina 0.85% estéril formalinizada
al 0.03%. Al utilizar esta solución se da inicio a la “inactivación bacteriana”
y la etapa de muerte

74
10. Calentar en Baño de María hirviendo por 1½ horas. Bajo estas condiciones
la bacteria se “rompe” y libera el antígeno somático (Ag O) el cual es
termoestable, pudiéndose recuperar al final del proceso.
11. Estandarizar con el tubo #5 de la escala MacFarland usando solución
salina 0.85% estéril (15 x 108 UFC/ml). A esta concentración se logra una
adecuada estimulación del sistema inmune del animal de
experimentación.
12. Inocular placas de agar sangre, tripticasa soya y MacConkey como control
de calidad e incubar a 36°C. En dichas placas no debe de haber
crecimiento al final de la incubación.
13. Guardar los tubos con el antígeno en alícuotas congelados hasta el
momento de usar. Es muy importante que no se estén congelando y
descongelando los tubos con el Ag, ya que el poder inmunogénico se
perdería con ello. Si se van a guardar por mucho tiempo es necesario
añadir thimerosal 1:1000 para preservar y evitar asi contaminación
bacteriana.
NOTA: para preparar el antígeno somático de Salmonella typhi es el mismo
procedimiento, pero el paso 10 es por 2½ horas

75
GUÍA PRELABORATORIO N ° 7
INMUNODIFUSIÓN
1. Concepto de inmunodifusión.
2. Técnica:
a. Características del gel.
b. Método de preparación.
3. Técnica de Ouchterlony:
a. Factores químicos y físicos a tomar en cuenta.
b. Lecturas: Identidad, No Identidad e Identidad Parcial. Significado
de cada una.
4. Inmunodifusión Radial:
a. Técnica
b. Lectura
c. Usos.
5. Prueba de Ascoli (Prueba del anillo).
a. Técnica. Cuidados a tomar en cuenta
b. Lectura
c. Usos.

76
PRACTICA No. 7
PRUEBAS DE PRECIPITACIÓN EN MEDIOS LÍQUIDOS Y SÓLIDOS
La reacción de precipitación ocurre cuando se combina un anticuerpo,
por lo menos divalente, con un antígeno soluble y esto conlleva a la
formación de agregados que precipitan.
Como las reacciones de precipitación son fácilmente observables "in vitro",
éstas resultan pruebas serológicas muy útiles, especialmente para medir
concentraciones de anticuerpos.
Para que la precipitación ocurra en forma máxima se necesita que tanto el
antígeno como el anticuerpo estén en concentraciones óptimas, cuando
cualquiera de los reactantes están en exceso no se pueden formar grandes
agregados antígeno-anticuerpo.
Los estudios de precipitación pueden realizarse no sólo en medios líquidos
sino también en geles de agar.
Cuando se deposita un antígeno y su anticuerpo específico en áreas
adyacentes de un gel, difunden uno hacia el otro a través del gel, dando
lugar a una reacción de precipitación que es fácilmente apreciable como una
línea opaca.
Entre las técnicas de inmunodifusión más útiles está la de Ouchterlony.
En esta técnica se coloca el antisuero en un orificio realizado en el centro de
una capa de agar purificado y los antígenos solubles se depositan en una
serie de orificios alrededor del pozo que contiene el anticuerpo. Si existen en
el antisuero anticuerpos homólogos a los antígenos ensayados, se formará
una línea o líneas opacas de precipitación en el agar, entre los orificios que
contienen el antígeno y el anticuerpo.

77
OBJETIVOS
Que el alumno sea capaz de:
1. Aprender las técnicas de algunas pruebas de precipitación
2. Conocer los elementos participantes en estas reacciones
3. Observar las bandas de precipitación (líneas opacas) que se forman en el
agar
4. Interpretar el significado de dichas bandas de precipitación.
Materiales y reactivos
- Agar purificado
- Antígenos
- Sueros homólogos
- Placas y láminas para demostración
- Guantes y lentes protectores
Parte A
Técnica de OUCHTERLONY (a partir de placas preparadas)
Procedimiento
1. Realice 3 orificios en su lámina de agar purificado
2. Llene el orificio central con el antisuero y luego llene los 2 orificios de
la periferia con diferentes antígenos. Un orificio para cada antígeno.

78
3. Incube las láminas a temperatura ambiente en cámara húmeda
durante 7 días, examínela periódicamente y observe la aparición de
bandas de precipitación.
Parte B
Técnica de OUCHTERLONY (Incluyendo preparación de lámina)
Materiales y reactivos
- Lámina 3 x 1.5 pulgadas
- Tubo 10 x 75 mm
- Micropipeta de 1000 µl (ó 1 Pipeta de 10 ml)
- Agar purificado y Buffer fosfato pH 7.1
- Antígeno y sueros homólogos
Procedimiento
1. Coloque 8 ml del agar purificado en una lámina desengrasada, déjelo
solidificar y hágale 3 orificios según dibujo de la parte A.
Coloque el antisuero y los antígenos desconocidos en los orificios
previamente identificados (ver esquema). Procure que los reactantes no
rebasen los orificios y se derramen sobre el agar
2. Incube a temperatura ambiente, en cámara húmeda durante 7 días,
examine la lámina periódicamente, observe la aparición de bandas de
precipitación

79
En la reacción de Identidad la fusión o continuación suave de la línea de
precipitado común a ambos antígenos, indica de que estos poseen
determinantes antigénicos similares o comunes y usan los mismos
anticuerpos para precipitar. Podrían ser el mismo antígeno o dos antígenos
muy similares que sean indistinguibles antigénicamente. En la reacción de No
Identidad, en la que se dá el cruce de dos líneas de precipitación en forma
independiente, indica que el antisuero posee anticuerpos para ambos
antígenos, pero que los antígenos no poseen epitopos en común. Cuando
aparece una pequeña saliente o espolón en una línea de precipitación
fusionada entre dos antígenos (Identidad Parcial), indica que hay epitopos
similares en ambos (la línea fusionada), pero además, uno de los antígenos
posee epitopos que no están presentes en el otro (el que señala la saliente) y
para los cuales el suero posee los anticuerpos correspondientes. Esto es
importante, pues dos antígenos pueden ser parcialmente similares y sin
embargo dar una reacción de identidad, sin espolón, si en el suero usado no
existen anticuerpos contra los antígenos que los diferencian
estructuralmente.

80
INMUNODIFUSION RADIAL SIMPLE (TECNICA DE MANCINI)
Esta técnica fue introducida en 1965 por Mancini ha demostrado su mayor
utilidad para cuantificar inmunoglobulinas y proteínas séricas. Está basada en
el principio de que existe una relación cuantitativa entre la cantidad de
antígeno colocado en un pozo realizado en la placa de agar que tiene
incorporado el anticuerpo y el anillo de precipitado resultante.
El antígeno a cuantificar y varias diluciones del antígeno estándar son
colocados en pozos sucesivos. El antígeno difunde a partir del pozo,
formando un gradiente de concentración. Al comienzo está presente en una
concentración relativamente alta y crea complejos solubles, conforme el
antígeno difunda más, la concentración va disminuyendo de forma continua
hasta que alcanza un punto en el que los inmunorreactantes están próximos
a sus concentraciones óptimas y se produce un anillo de precipitado.
El área circunscripta del anillo de precipitado es proporcional a la
concentración del antígeno. Con los diámetros correspondientes a los
estándares de concentración conocida se traza la curva patrón que sirve para
determinar la concentración del antígeno.

81
2. PRECIPITACIÓN EN MEDIO LÍQUIDO.PRUEBA DE ASCOLI
El fenómeno de la precipitación en líquido fue descubierto en 1897 por
Krauss, que observó que los filtrados de cultivo de bacterias entéricas
precipitan al mezclarse con antisueros homólogos pero no con los
heterólogos .En 1902, Ascoli modificó la prueba de la precipitación al
desarrollar una prueba interfacial o de tipo anular. En esta forma de
precipitación, una serie de pequeños tubos llenos en parte con antisuero (el
más denso de los reactivos) se cubre cuidadosamente con diluciones del
antígeno. Se dá la formación de un anillo de precipitación en la interfase
conforme los reactantes difunden uno hacia el otro.
PROCEDIMIENTO
1. Rotule un tubo Durham.
2. Agregue cuidadosamente son una pipeta Pasteur de
punta larga hasta el fondo del tubo antisuero
3. Con otra pipeta, coloque sin formar burbujas el
suero
4. Fije el tubo en posición vertical a una superficie
libre de vibraciones. Espere de 10 a 30 minutos
5. Observe la formación del anillo de precipitación

82
GUÍA PRELABORATORIO N ° 11
INMUNOCROMATOGRAFIA
1. ¿Qué es la cromatografía?
2. Fundamento de Inmunocromatografía
3. Sustancias empleadas como marcadores
4. Usos de la inmunocromatografia, ventajas y desventajas
5. Procedimiento. Cuidados a tomar en cuenta
6. Lectura de las pruebas. Significado

83
PRACTICA No. 8
INMUNOCROMATOGRAFIA
La inmunocromatografía es una de las técnicas más modernas que se están
empleando en el inmunodiagnóstico y es un tipo de prueba de interacción
primaria cuyas principales ventajas son la sencillez y rapidez de su
procedimiento. No requiere de instrumentos ni equipamiento especial, lo
que la hace una excelente herramienta de apoyo no solo en el ámbito de
análisis en un laboratorio sino que también para trabajos de campo. Cada vez
son más las aplicaciones de esta técnica, siendo la más conocida el test de
embarazo, y posteriormenete han surgido otras pruebas útiles por ejemplo:
PSA, test sobre sífilis, VIH, Cryptosporidium sp, sangre oculta en heces, etc.
En esta prueba uno de los componentes está marcado con nanopartículas
coloreadas, por ejemplo con metales pesados por ejemplo oro coloidal o
selenio coloidal que generan bandas de color rosa o azul respectivamente.
Otros marcadores pueden ser partículas de látex coloreadas o de carbón.
La reacción se lleva a cabo en un dispositivo que tienen una tira de material
poroso como la nitrocelulosa.
En las tiras se puede distinguir 5 zonas:
1. Zona de siembra de la muestra
2. Zona de conjugado
3. Zona de detección
4. Zona de control
5. Región absorbente
La realización de la prueba es bien sencilla: la muestra con el antígeno a
analizar se coloca en la zona de siembra de la muestra, y fluye por capilaridad

84
hasta la zona de conjugado, en donde el anticuerpo específico marcado
(conjugado) se halla inmovilizado. Al pasar la muestra se solubiliza al
conjugado y en caso de haber Ag en la muestra se forman inmunocomplejos,
los cuales siguen migrando lateralmente hasta la zona de detección, en la
cual se hallan fijados a la membrana anticuerpos específicos contra otro
epÍtopo del Ag, de tal forma que los inmunocomplejos son fijados en esta
zona de detección, formando una banda coloreada, según el marcador
utilizado.
La muestra fluye por capilaridad hasta la zona de control. Aquí el exceso de
conjugado es capturado por un Ac anti-conjugado, formándose una banda
coloreada tanto si el antígeno está presente en la muestra como si no lo está.
Este control indica que la prueba ha sido realizada correctamente y todos los
reactivos funcionan bien. Al final, el resto de la muestra es absorbida en la
región absorbente.
Esta prueba también puede ser utilizada para detectar anticuerpos, para lo
cual el conjugado es el Ag específico marcado. En la zona de detección está
fijado un Ac anti-Ig (dependiendo de la especie en la cual se buscan los Acs),
el cual capturará los complejos inmunes formados si la muestra posee Acs
específicos. En la zona de control un Ac específico para el conjugado (en este
caso Ag marcado) captura el exceso de Ag solubilizado por la muestra.
MATERIALES Y REACTIVOS
Micropipetas ( o pipetas Pasteur)
Sets de pruebas rápidas de inmunocromatografía
Muestras de suero u orina (depende del tipo de determinación)
Descartes

85
PROCEDIMIENTO
1. Atemperar la bolsa del kit antes de abrirlo, sacar el cassette de la bolsa
sellada y usarla lo antes posible.
2. Coloque el cassette en una superficie plana y limpia. Vierte 3 gotas de
muestra (aprox. 100 µl) con una pipeta Pasteur o pipeta automática
en el pozo marcado (S) y empiece a medir el tiempo. Evite atrapar
burbujas de aire en el pozo (S).
3. Espere a que la línea (c) de color aparezca. Lea los resultados en el
tiempo estipulado por kit. Ello depende del análisis realizado. Ni leer la
prueba después del tiempo dicho pro el fabricante ya que carecerán de
valor.
POSITIVO: aparecen dos líneas coloreadas distintivas. Una debe de estar en
el área de control (C) y la otra línea en el área de prueba (T).
La intensidad de color en el área T puede variar dependiendo de la
concentración del analito presente en la muestra. Por lo tanto, cualquier
color de la región de prueba (T) debe de ser considerado como positivo.

86
NEGATIVO: aparece una línea coloreada en la región de control (C ) pero no
aparecen en la región de prueba (T).
INVALIDO: la línea de control no aparece. Las razones más comunes para una
prueba inválida son usar cantidad insuficiente de muestra o no seguir los
pasos debidos del procedimiento. Hay que revisar los pasos realizados y
repetir la prueba con una placa nueva. Si el problema persiste, no continúe
utilizando el reactivo y recurra a un nuevo set.
NOTA
La principal desventaja de este tipo de pruebas es que no se pueden realizar
ensayos cuantitativos, solo es un ensayo cualitativo. Además en unos casos
específicos la detección de Ag o Ac no pueden ser usados como criterio único
para establecer o descartar el diagnóstico de una infección.

87
GUÍA PRELABORATORIO N ° 9
AGLUTINACIÓN DIRECTA
1. Definición de Reacción de Aglutinación.
2. Tipos diferentes de aglutinación directa.
3. Características de los reactantes
4. Factores físicos y químicos que influyen.
5. Utilidad de la prueba.
6. Descripción y utilidad de la aglutinación bacteriana. Interpretación.
7. Descripción, utilidad y significado de título en la prueba de Antígenos
Febriles. ¿Qué es título significativo?
8. Pruebas que se incluyen en la prueba de antígenos febriles.
9. Formas de reportar cada una de las pruebas.
10. Razón de uso de sueros controles positivos y negativos
Tipeo sanguíneo:
a) Antígenos de grupo sanguíneo. Composición
b) Usos de la prueba
c) Técnica. Resultados
d) Cuidados a tomar en cuenta
e) Posibles errores

88
PRACTICA No. 9
AGLUTINACION DIRECTA
La aglutinación es una reacción serológica clásica en la cual se da la
aglomeración de una suspensión celular mediante un anticuerpo específico.
Esto se da cuando antígenos particulados, que se hallan en la superficie de
una célula ej. Eritrocito o bacterias, se exponen a un anticuerpo específico en
condiciones adecuadas. En estas reacciones el determinante antigénico está
sobre la superficie de una partícula o de una célula.
Con estas técnicas se pueden detectar tanto antígenos como anticuerpos.
Es de importancia mencionar que las técnicas de aglutinación, asi como las
de precipitación pueden presentar el fenómeno de zona, ya que se basan en
la formación de conglomerados. Si se tiene un exceso de anticuerpos, podría
llegarse a inhibir la formación de grumos ya que la saturación de los sitios
antigénicos impediría formar puentes entre las partículas. Por ello es
importante trabajar con diluciones en estas técnicas evitando asi las
reacciones falsas negativas.
Las técnicas de aglutinación pueden hacerse de forma semi cuantitativa
haciendo diferentes diluciones de la muestra para establecer un título o
cantidad relativa del analito investigado (antígeno o anticuerpo

89
89
AGLUTINACION BACTERIANA
El diagnóstico de las infecciones bacterianas se hace identificando el
agente causal aislado de muestras clínicas apropiadas. En algunos casos la
identificación definitiva depende de reacciones de aglutinación usando
antisueros específicos. Cuando no es posible aislar el agente causal, el
diagnóstico de la enfermedad deberá intentarse por medio de la
determinación cualitativa y cuantitativa de anticuerpos contra el posible
agente etiológico, en el suero del paciente. Este procedimiento se utiliza
frecuentemente en el estudio de estados febriles indeterminados
PRUEBA DE ANTIGENOS FEBRILES
La salmonelosis, fiebre tifoidea, brucelosis y el tifus son enfermedades
que en alguna etapa de su evolución presentan una característica en común:
fiebre. A pesar de que el método definitivo para establecer la etiología de
estas enfermedades es a través del aislamiento del agente patógeno, esto
resulta difícil debido a que la investigación se realiza frecuentemente en
períodos tardíos de la enfermedad y luego de una terapia antibiótica. Por ello
es de suma importancia diagnóstica la detección de los anticuerpos
específicos producidos en el curso de cada una de estas patologías. Una
prueba aislada es de escaso valor, siendo necesarias 2 o más pruebas
seriadas a fin de poner en evidencia cambios en el título de anticuerpos.
En el suero de pacientes con fiebre tifoidea y personas vacunadas contra esta
enfermedad se detectan anticuerpos dirigidos contra los antígenos O y H de
Salmonella typhi. La determinación de estos anticuerpos forma parte de la
prueba de Antígenos Febriles, y se denomina Prueba de Widal.

90
90
Bases inmunológicas de la reacción de Widal. Esta prueba demuestra la
presencia de anticuerpos aglutinantes (aglutininas) contra los antígenos H
(flagelar) u O (somático) de S typhi en el suero de pacientes con fiebre
tifoidea. Los anticuerpos contra el antígeno O aparecen luego de 6 a 8 días de
iniciada la enfermedad y desaparecen después de 3 a 6 meses. Los
anticuerpos contra el antígeno H aparecen a los 8 a 12 días, alcanzando
títulos más elevados con respecto al anti-O y pueden persistir por más de un
año.
Los anticuerpos contra el antígeno Vi aparecen más tardíamente, a la tercera
semana, pero lo hacen en títulos bajos.
Anticuerpo Tiempo
detección
Duración Nivel Títulos Influencia por
vacunación
Anti-O 6-8 días 3-6 meses ++ No
Anti-H 8-12 días > 12 meses +++ Si
Anti-Vi 21-28 días Indefinida + Si
Limitaciones de la reacción de Widal
La importancia de la aglutinación de Widal radica en ser un método
serológico rápido, barato y ampliamente conocido para el diagnóstico de la
fiebre tifoidea, pero tienen grandes limitaciones por reacciones antigénicas
cruzadas con otras bacterias (principalmente enterobacterias, incluyendo
Salmonella no typhi), parásitos, virus y hongos, llevando con frecuencia al
médico a síndromes febriles como fiebre tifoidea.

91
91
Como ejemplo de estos falsos positivos se ha descrito en fiebre paratifoidea
por Paratyphi A, títulos Anti-O y Anti-H >/ 100 en un 53% y 22% de los
pacientes respectivamente.
En pacientes con malaria estudiados en Nigeria con Hemocultivos negativos a
S. typhi se encontraron reacciones de Widal positivas con títulos de 1:40,
1:80 y 1:160 en el 85%, 12% y 3% de los casos respectivamente. En la India se
reportó test de Widal con títulos >1:100 en el 12%,17% y 24% de pacientes
con Malaria por Plasmodium vivax, P falciparum con bajas parasitemias y
altas parasitemias respectivamente.
Los falsos positivos en la reacción de Widal también han sido descritos en
procesos no infecciosos, como enfermedades autoinmunes (artritis
reumatoide, lupus eritematoso sistémico) y hepatopatías crónicas, lo cual
contribuye aun más a su baja especificidad.
Otro elemento a considerar es la presencia de Anti-O y Anti-H en la población
sana, lo cual está determinado principalmente por la prevalencia de
salmonelosis en una comunidad determinada.
En la reacción de Widal también hay que tomar en cuenta los falsos negativos
entre los cuales tenemos:
1. Antibioticoterapia temprana, lo cual retrasa la aparición de
anticuerpos (descrito principalmente con cloranfenicol)
2. Uso de corticosteroides
3. Medición temprana de anticuerpos (primera semana)
4. Inmunodeficiencias adquiridas y congénitas
5. Portadores crónicos de Salmonella typhi

92
92
6. Relacionadas a estandarización de la prueba
Interpretación clínica de la reacción de Widal
Un diagnóstico de fiebre tifoidea puede considerarse si los títulos iniciales se
cuadruplican entre una y cuatro semanas. Pero el médico no puede esperar
este tiempo para establecer un tratamiento por lo que se debe de considerar
la posibilidad de esta entidad con un título aislado determinado.
Este punto de corte depende de la prevalencia de salmonelosis en la
comunidad estudiada, siendo así, se han establecido protocolos diagnósticos
en varios países, tomando en cuenta los estudios realizados en sus regiones.
En general, algunos autores recomiendan tener en cuenta la fiebre tifoidea
con títulos Anti-O >/ 160-200 y/o Anti-H >/ 160-200 en zonas endémicas de
América Latina; en zonas no endémicas se deben de pensar con títulos más
bajos >/ Anti-O 1:80 – 1:100. Además se debe de tener claro que una
reacción negativa no excluye el diagnóstico de fiebre tifoidea en el contexto
de un cuadro clínico compatible.
Conclusiones
1. La reacción de Widal no es el “gold estándar” para el diagnóstico de
fiebre tifoidea
2. La reacción de Widal sobre diagnóstica fiebre tifoidea teniendo en
cuenta sus numerosas reacciones cruzadas
3. Para la interpretación de la reacción de Widal se debe de conocer la
prevalencia de la fiebre tifoidea en una determinada área.

93
93
Reacción de Weil Félix:
Debido a la dificultad existente para el aislamiento de las Rickettsia sp
productoras de tifus, el antígeno empleado para la determinación de
anticuerpos es de especies de Proteus que presentan reacciones cruzadas
con el antígeno somático (O) de dichas bacterias. Para evitar falsos
positivos, se suprime el antígeno flagelar (H) y esto se expresa como
Proteus OX19.
Reacción de Huddleson:
Es un método serológico que detecta anticuerpos contra los agentes
causales de Brucelosis. Esta prueba es parte también de los Antígenos
Febriles.
OBJETIVOS
Que el estudiante:
1. Compruebe la reacción de aglutinación usando un antígeno bacteriano y
un antisuero conocido
2. Explique el mecanismo de la reacción
3. Evidencie la presencia de anticuerpos en sueros de pacientes
sospechosos de padecer alguna enfermedad infecciosa usando una
suspensión de antígeno conocido (antígenos febriles)
Materiales (por lado de mesa)
- Antisuero E. coli
- Cultivo de E. coli en medio sólido
- Suero de paciente en estado febril
- 2 tapaderas de caja de Petri

94
94
- 3 pipetas Pasteur y bulbos de hule
- Lentes protectores
- Aplicadores de madera
Frascos con solución salina 0.85 % estéril
Guantes y lentes protectores
Parte A. Identificación de bacterias usando un antisuero conocido
Procedimiento
1. Con un lápiz graso divida la parte interna de una tapadera de la caja de
Petri en dos partes iguales, y rotúlelas como control (C) y muestra (M),
coloque una gota de solución salina 0.85% estéril en cada división.
2. Con el asa bacteriológica tome una pequeña cantidad de cultivo de
Escherichia coli y mézclela con cada una de las gotas de solución salina
colocadas en las divisiones.
3. Agregue una gota de antisuero Escherichia coli a la división M, mezcle con
un asa esterilizada o un aplicador de madera
4. Rote suavemente la tapadera sobre la superficie de la mesa durante dos o
tres minutos
5. Incline la tapadera, obsérvela con ayuda de luz transmitida y reflejada,
determine si hay aglutinación en la preparación. Observe la aglutinación
de Escherichia coli con su suero homólogo.
Materiales (por lado de mesa)
- Suero humano de paciente con estado febril
- Antígenos

95
95
- Salmonella typhi “O” y “H”
- Salmonella paratyphi A y B
- Brucella abortus “AB”
- Proteus 0 X 19
- Micropipetas de 100 µl (o pipeta de 0.2 ml graduada hasta la punta)
- 6 tapaderas de cajas de Petri
- Aplicadores de madera
Parte B. Determinación de anticuerpos en suero sanguíneo, usando
Antígenos febriles (antígenos bacterianos conocidos)
Procedimiento
1. Dividida dos tapaderas de caja de Petri por su parte interna en tres partes
iguales. Identifique cada división con las iniciales del antígeno que
colocará posteriormente
2. Coloque 50 µl de suero en cada una de las seis diferentes divisiones
3. Coloque a la par cada una de las muestras de suero, una gota del
correspondiente antígeno
4. Con un aplicador de madera mezcle cada uno de los sueros con su
antígeno. Use un aplicador de madera para cada diferente antígeno
5. Rote suavemente la tapadera sobre la superficie de la mesa durante 2 a 3
minutos.
6. Incline la tapadera, observándola con la ayuda de luz transmitida y
reflejada, determine si hay aglutinación.

96
96
Si hay aglutinación con alguno de los antígenos determine el título de
anticuerpos presentes en el suero según se describe a continuación:
1. Divida una tapadera de caja de Petri por su parte interna en 5 partes
iguales. En las divisiones de la tapadera coloque 80 µl, 40 µl, 20 µl, 10 µl y
5 µl de suero positivo, utilice una división para cada volumen. Las
diluciones correspondientes de suero serán: 1: 20, 1:40, 1:80, 1:160 y
1:320
2. Con un aplicador de madera mezcle cada volumen de suero con la gota de
antígeno, empezando por las diluciones mayores, o sea con 1:320
3. Rote suavemente la tapadera sobre la superficie de la mesa durante 2 ó 3
minutos
4. Obsérvese si hay aglutinación, en igual forma que lo hizo anteriormente.
El titulo de aglutininas del suero estudiado es dado por la dilución más
alta que presenta aglutinación visible.
En algunas enfermedades no se puede obtener mayor información cuando la
medición del título de anticuerpos se hace solamente una vez durante el
curso de una enfermedad. Tal información puede ser obtenida solamente por
varias determinaciones de anticuerpos en pacientes febriles.
Sin embargo, hay algunas enfermedades en las cuales una sola medición del
título de anticuerpos, es significativo.
El cuadro 1 puede ser útil para interpretar los resultados en la prueba
serológica de antígenos febriles

97
97
ANTÍGENO ENFERMEDAD TÍTULO SIGNIFICATIVO
Salmonella O Fiebre Tifoidea 1:80
Salmonella H Fiebre Tiroidea 1:80
Antígeno grupo A
(Para A)
Fiebre Paratifoidea 1:80
Antígeno grupo B
(Para B)
Fiebre Paratifoidea 1:80
B. abortus Brucelosis 1:80
Proteus 0 X 19 Tifus 1:160 y más
Significativo en personas no vacunadas
La ventaja de las reacciones de aglutinación desde el punto de vista de su
utilidad en el laboratorio es que son muy sencillas de realizar, no requieren
de ningún equipo para su lectura. Son rápidas y fáciles de implementar.
Además presentan una mayor sensibilidad que las reacciones de
precipitación por lo que han sido sustituidas en muchos casos. Pero es de
hacer notar que las reacciones de aglutinación presentan una menos
sensibilidad que las reacciones de interacción primaria como ELISA e
Inmunofluorescencia por lo que en determinados casos se prefiera el empleo
de una de esas dos técnicas para la detección de anticuerpos contra un
determinado agente patógeno. Las ventajas enumeradas hacen de las
reacciones de aglutinación una valiosa herramienta para diversos estudios
serológicos (búsqueda de Acs específicos contra agentes patógenos) y para la
detección de antígenos en fluidos biológicos.

98
98
NOTAS: El empleo de plasma y de sueros contaminados o muy lipémicos, así como de
sueros que contienen cantidades significativas de fibrinógeno, es una de las
causas de falsos positivos.
Antes de usar se llevarán las suspensiones antigénicas a temperatura
ambiente, evitando dejarlas a dicha temperatura más del tiempo necesario
(autoaglutinación)
La contaminación bacteriana de las suspensiones, muestras o la solución
salina, son causas de resultados falsos positivos. La solución salina fisiológica
estéril debe de ser de preparación reciente y guardada en refrigeración.
La congelación de los reactivos, su imperfecta agitación antes del uso y la
observación del tiempo más allá del período estipulado son causas generales
de falsos positivos
La limpieza de tubos, láminas y pipetas es muy importante. Restos de
detergente pueden falsear los resultados. También las láminas con restos de
grasa dificultan la lectura. Debe de eliminarse cualquier resto de polvo y
huellas dactilares pasándoles un paño ligeramente humedecido en alcohol,
antes de realizar la prueba.
La ausencia sistemática de controles positivos y negativos puede hacer pasar
por alto la reactividad de los reactivos utilizados.
Los reactivos vencidos pueden dar falsos negativos

99
99
Representación esquemática de las Reacciones de Aglutinación:
A) Aglutinación Directa (Activa) para detección de anticuerpos B) Aglutinación Indirecta (Pasiva) para detección de anticuerpos C) Aglutinación pasiva inversa para detección de antígenos

100
100
GUIA PRELABORATORIO N ° 10
AGLUTINACIÓN INDIRECTA
1. Principio de la Aglutinación pasiva o indirecta
2. Partículas acarreadoras utilizadas. Función.
3. Propiedades de las partículas de látex.
4. Fundamentos de cada prueba a realizar y sensibilidad de cada una
5. De cada una de las pruebas a realizar investigue:
a. Reactante conocido.
b. Reactante investigado.
c. Muestra.
d. Material.
e. Determinación. Título. Reporte.
f. Utilidad como prueba diagnóstica.
g. Falsos positivos o negativos

101
101
PRACTICA No. 10
AGLUTINACION INDIRECTA
Como las pruebas de aglutinación son índices muy sensibles de la
presencia de anticuerpos, es conveniente transformar sistemas de
precipitación en sistemas de aglutinación. Se habla entonces de aglutinación
pasiva que se lleva a cabo cubriendo una partícula insoluble (poliestireno,
látex, bentonita, carbón o glóbulos rojos) con una capa de antígenos
pequeños o anticuerpos.
Las pruebas a desarrollar en esta práctica usan como soporte de Ag o Ac las
partículas de látex. Dichas partículas son esferas microscópicas constituidas
por polímeros de estireno y las más usadas miden 0.81 de diámetro. Por la
presencia en su superficie de grupos sulfato están cargadas negativamente y
se repelen entre si, manteniéndose en suspensión .La característica más
importante de estas partículas es que forman suspensiones estables
Existen muchas pruebas diagnósticas basadas en éste método: factor
reumatoide, pruebas de embarazo, proteína C reactiva, ASO, etc.
Además se estudiará la prueba de hemaglutinación pasiva en forma
demostrativa.
OBJETIVOS
Que el estudiante logre:
1. Explicar en qué consisten las pruebas de aglutinación pasiva
2. Definir los elementos que participan en este tipo de pruebas
3. Realizar algunas de las técnicas de aglutinación pasiva

102
102
Parte A. Factor Reumatoideo
La artritis reumatoide es un síndrome clínico de etiología desconocida que se
caracteriza por una inflamación inespecífica y generalmente simétrica de las
articulaciones, que a veces evoluciona hacia la destrucción de las estructuras
articulares y periarticulares.
En la articulación enferma se observa un engrosamiento de la membrana
sinovial con formación de pliegues y proliferación de linfocitos. Estas células,
que forman folículos linfoides son los responsables de la síntesis de Factores
Reumatoideos, que son una variedad de Igs ya sea IgM, IgA, Ig G o IgE con
predominio de la IgM en contra de la IgG parcialmente desnaturalizada
(modificada). Estas Igs son capaces de formar complejos con la IgG
modificada y particularmente con determinantes antigénicos del fragmento
Fc. Esta totalidad de Ig se conoce bajo el nombre de Factores Reumatoides.
Son numerosas las pruebas para la búsqueda de tales factores, utilizando
glóbulos rojos humanos recubiertos con IgG humana o animal, pero han sido
descritos también otros métodos en general más sensibles, utilizando
partículas de látex de poliestireno recubiertos con IgG humano.
Los FR de tipo IgM se han encontrado en el 85 a 90% de los adultos con
artritis reumatoide, aunque no es específico de la enfermedad puesto que
también se han encontrado en individuos sanos (3 a 5% de los casos)
Se han encontrado reacciones falsamente positivas con el uso del látex
debido principalmente a la fracción C1 del complemento, la cual puede ser
eliminada inactivando el suero a 56°C por 30 minutos o por la dilución de la
muestra.

103
103
FUNDAMENTO: El factor reumatoideo de tipo IgM se detecta en presencia de
IgG (que en este caso es el antígeno) adsorbido sobre partículas de látex,
produciéndose una aglutinación visible macroscópicamente.
Materiales y reactivos
-Látex (látex de poliestireno sensibilizados con IgG humana, estabilizada y
suspendidos en Tampón Glicina pH 8.2)
-Suero humano sospechoso (no hemolizado, no lipémico)
-Suero control positivo
-Suero control negativo
-Lámina de vidrio oscuro con 6 divisiones de cerámica
-Pipetas capilares y bulbos de hule
-Aplicadores de madera
Guantes y lentes protectores
Procedimiento
Determinación cualitativa
1. Agregar sobre una lámina de vidrio oscuro 1 gota de látex y una gota
del suero problema.
2. Mezclar con aplicador y luego con movimiento oscilatorio rotar
durante 1 minuto
Posibles resultados:
Positivo = aglutinación evidente, a los 2 minutos
Negativo = no aglutinación después de 2 minutos
Determinación semicuantitativa:

104
104
Si la muestra de suero del paciente resulta positiva con la prueba cualitativa
realizar esta determinación.
Procedimiento:
1. Preparar diluciones dobles de la muestra 1:2 hasta 1:64 con Tampón
glicina pH 8.2
2. Colocar 40 l de c/u de las diluciones en cada uno de los anillos de la
lámina y añadir luego 40 l del reactivo de látex c/u, mezclar con
aplicador y dar movimiento rotativo a la lámina. Leer a los 2 minutos
La dilución más elevada en la que se ha obtenido aglutinación visible,
representa el título de la muestra
Título = I/ml = 25 x Dilución Casa LATEST
Título = I/ml = 8 x Dilución Casa ELITECH
Ejemplo: si la última dilución visible es en la dilución 1: 8 en reporte se dará
usando el factor correspondiente a la casa comercial:
25 x 8 (casa LATEST) = 200 µ l/ml
Reporte: 200 µ l/ml de Factor Reumatoideo

105
105
Observaciones
Los factores reumatoides no están presentes exclusivamente en la artritis
reumatoide, también están en la sífilis, en el lupus eritematoso sistémico, en
la enfermedades crónicas hepáticas, pulmonares o renales.
Por otro lado, sujetos afectados de artritis reumatoide pueden resultar
negativos a esta prueba.
Sueros hemolisados y ciertas proteínas (diferentes al FR) pueden ser causa de
resultados erróneos.
Parte B. Proteína C reactiva
Se produce en el hígado, es una lectina, es decir, una proteína que reconoce
y se liga a los polisacáridos de los microorganismos y al hacerlo activa el
complemento y estimula la fagocitosis.
Es una proteína termolábil que no atraviesa la barrera placentaria. Su
nombre se debe a su capacidad de para precipitar los polisacáridos C de los
neumococos.

106
106
La proteína C reactiva (PCr) aparece precozmente en el suero humano en
respuesta a una gran variedad de procesos inflamatorios y de necrosis
tisulares (infección bacteriana, reumatismo agudo, infarto del miocardio,
algunas enfermedades virales, artritis reumatoide, algunas neoplasias
malignas, etc.) La concentración plasmáticas de la PCr aumenta rápidamente
en la fase inicial de la enfermedad más precozmente que la velocidad de
eritrosedimentación (VES) y desaparece rápidamente después de la
recuperación, para lo cual su determinación no tiene solo importancia
diagnóstica sino que es útil en el seguimiento de la evolución de un proceso
maligno y también en su aporte en el tratamiento terapéutico.
Particularmente es útil en pacientes post operatorios ya que la PCr permite
evidenciar eventualmente complicaciones infecciosas o inflamatorias. La PCr
puede aparecer al final del primer trimestre del embarazo, permanecer
positiva hasta el momento del parto. Hay también aumento de la PCr en
mujeres con tratamiento de anticonceptivos orales y en corredores de largas
distancias.
FUNDAMENTO: La PCR se detecta en suero por reacción con un anticuerpo
específico adsorbido sobre un soporte inerte de látex. La PCR se une a los
anticuerpos adsorbidos produciendo la aglutinación de las partículas de látex.
Materiales y reactivos
-Reactivo Látex proteína C. (látex de poliestireno sensibilizados con IgG
monoclonal anti – PCr suspendidas en tampón glicina pH 8.2)
-Suero humano sospechoso

107
107
-Suero control positivo
-Suero control negativo
-Lámina de vidrio oscuro
-Pipetas
Aplicadores de madera
Guantes y lentes protectores
Determinación cualitativa para proteína C reactiva en suero
Procedimiento
1. Agregar sobre una lámina de vidrio oscuro 1 gota del reactivo Látex
Proteína C reactiva.
2. 1 gota del suero problema (sospechoso)
3. Mezclar con aplicador y luego agitar circularmente por 1 minuto
Resultado
Positivo = Aglutinación evidente a los 2 minutos = 0.6 mg/dl
Negativo = No aglutinación
Determinación Semi-cuantitativa
Si la muestra de suero del paciente resulta positiva con la prueba cualitativa
realizar esta determinación.
Procedimiento:
1. Preparar diluciones dobles de la muestra 1:2 hasta 1:64 con solución
salina 0.85% estéril
2. Colocar 40 l de c/u de las diluciones en c/u de los anillos de la lámina
y añadir 1 gota del reactivo látex proteína Cr, mezclar y dar
movimiento rotatorio a la lámina. Leer a los 2 minutos

108
108
La dilución más elevada en la que se observa aglutinación, representa el
título de la muestra
Título (mg/dl = 0.6 x dilución)
Ejemplo: si la última aglutinación visible se da en la dilución 1:16 se reportará
según lo siguiente:
0.6 x 16 = 9.6mg / dl
Reporte: 9.6 mg / dl de Proteína C reactiva
Nota: los sueros marcadamente lipémicos o contaminados pueden dar
resultados falsos positivos.
Parte C. Diagnóstico de embarazo por prueba de látex directa en orina
La gonadotropina corionica humana (GCh) es una hormona glicoproteica
secretada por las células trofoblásticas de la placenta. Comienza a secretarse
en la fase más temprana de la etapa gestacional y aumenta constantemente
hasta alcanzar un pico, alrededor de las 9 semanas después del comienzo del
último período menstrual normal, cuyos niveles son muy variables de una
mujer a otra.
La presencia de GCh en suero y orina la vuelve un marcador excelente en la
confirmación de embarazo. La hormona puede ser detectada tanto en orina
como en suero desde 7 a 10 días después de la concepción
La concentración de GCh continúa su rápido incremento excediendo a los 100
ml U/ml después de faltar la menstruación y de 30,000 a 200,000 ml U/ml
después de 10 a 12 semanas de embarazo

109
109
FUNDAMENTO: La muestra se pone en contacto con un reactivo de látex
sensibilizado con anticuerpos monoclonales anti-hGC. Si la muestra contiene
hGC, está se unirá en forma sensible y específica produciéndose una
aglutinación visible macroscópicamente.
Materiales y Reactivos
- Reactivo de Látex – Anti GCh
- Pipetas plásticas
- Láminas de vidrio oscuras
- Orina sospechosa
Guantes y lentes protectores
Recolección de la muestra
En frasco de vidrio limpio colectar la primera orina de la mañana (por
contener más alta concentración de GCh).
La prueba se recomienda hacerla tan pronto como sea posible o dentro de
las 24 horas de haber sido obtenida la muestra
Procedimiento
1. Agregar sobre una lámina de vidrio oscuro 1 gota del reactivo de látex
anti GCh previamente mezclado para homogenizar
2. Agregar 2 gotas de la orina.
3. Mezclar y rotar la lámina por 2 minutos.
Resultados
Positivo = aglutinación visible a los 2 minutos
Negativo = no aglutinación o aglutinación después de 2 minutos

110
110
La sensibilidad de la prueba es de 300 ml UI/ml = Casa ELITECH
La sensibilidad de la prueba es de 200 UI/ml = Casa HUMAN
Notas
Puede obtenerse un resultado negativo en casos de embarazo muy temprano
por bajos niveles de GCh. La prueba puede repetirse a las 48 horas con nueva
muestra de orina
Casos como mola hidatidiforme, corioepitelioma y ciertos tumores
trofoblásticos y no trofoblásticos, pueden dar la prueba positiva con elevados
niveles de GCh en ausencia de embarazo
Con casos de embarazo extra uterino, toxemia, muerte fetal o aborto, la
excreción de GCh tiende a disminuir.
Hematuria, proteiunuria, y / contaminación bacteriana dan resultados
erróneos
En el caso de resultado negativo se reporta de la manera siguiente:
REPORTE : Negativo a la fecha.
Parte D. Prueba de Anti-estreptolisina O (ASO)
En el curso de la infección producida por Streptococcus pyogenes se produce
la secreción de numerosas sustancias entre ellos se encuentran 2
hemolisinas: la estreptolisina O y la S
La estreptolisina O es una toxina capaz de estimular la producción de un
anticuerpo específico o anticuerpos (ASO). La presencia y niveles altos de

111
111
estos Acs en una muestra de suero puede reflejar la naturaleza y la seriedad
de la infección estreptocócica y sus posibles efectos como la fiebre reumática
y la glomerulonefritis aguda
Las pruebas más recientes para determinar los Acs antiestreptolisina O,
utilizan partículas de látex de poliestireno sensibilizadas con estreptolisina O,
y suspendidas y estabilizados en una solución buffer
FUNDAMENTO: Al ponerse en contacto las partículas de látex con un suero
que contiene Acs contra la estreptolisina O, ocurre aglutinación si los niveles
son de 200 UI/ml o mayores
Si los niveles de antiestreptolisina O, son inferiores, el látex permanece
disperso uniformemente y no se produce aglutinación
Materiales y Reactivos
- Frasco de látex con estreptolisina O en glicina – salina buffereada con
0.1% de azida de sodio como preservativo
- Suero control positivo
- Suero control negativo
- Suero sospechoso
- Tarjetas o láminas de vidrio
- Aplicadores
- Pipetas plásticas descartables
- Guantes y lentes protectores

112
112
Colección y preparación de la muestra
- Sangre recolectada en tubo sin anticoagulante
- Separar el suero (si no es usado en el momento puede guardarse por 48
horas a 2 – 8°C o por 2 semanas a –20°C)
- No se recomienda el uso de suero lipémicos o contaminado con bacterias
pues dan falsos positivos.
Se recomienda que el material debe de estar bien lavado y sin restos de
detergente para no introducir error (falsos positivos o falsos negativos)
Prueba cualitativa
Procedimiento:
1. Colocar en la lámina con círculos de cerámica 1 gota (50 l) de suero
sospechoso
2. Adicionar 1 gota del reactivo de látex (ASO)
3. Mezclar con aplicador, rotar por 2 minutos y leer si hay aglutinación o
no.
Determinación Semi-cuantitativa
Si existiera aglutinación en la prueba anterior proceder a la titulación.
Procedimiento:
1. En tubos 12 x 75 mm prepare diluciones del suero 1:2, 1:4, 1:8, 1:16,
1:32, utilizando solución salina 0.85% de preferencia estéril.
2. Colocar en la lámina 1 gota de cada una de las diluciones del suero y
agregar 1 gota (50 l) del reactivo látex ASO
3. Mezclar con diferente aplicador o mezclar con el mismo, pero iniciando
desde la mayor hasta la menor dilución.

113
113
4. Observar si hay aglutinación
5. Reportar el título de la mayor dilución del suero en la cual hay
aglutinación visible multiplicando dicha dilución por 200
El reactivo látex ASO podría no aglutinar en caso de muestras conteniendo
menos de 200 UI/ml de antiestreptolisina O.
Títulos elevados de ASO pueden asociarse con espondilitis anquilosante,
glomerulonefritis, sepsis puerperal, fiebre escarlatina y amigdalitis y en casos
agudos de artritis reumatoide
Parte D
HEMAGLUTINACION PASIVA (demostrativa)
Otra aplicación de la aglutinación indirecta es la prueba de Hemaglutinación
rápida para descartar donantes de sangre chagásicos.
La enfermedad de Chagas es endémica en El Salvador y representa un peligro
potencial para las personas que reciben transfusiones sanguíneas.
Se conocen muchas variantes de la prueba de hemaglutinación pasiva. Es la
más sencilla, la unión del antígeno al glóbulo rojo es un fenómeno
espontáneo, es decir que los glóbulos rojos humanos actúan como
portadores inertes de antígenos (glóbulos rojos sensibilizados).
En esta prueba se usan glóbulos rojos previamente tratados con tanino
(ácido tánico o galotánico) y sensibilizados con antígenos soluble de
Trypanosoma cruzi. Al ponerse en contacto dichos glóbulos rojos con un
suero con anticuerpos contra Trypanosoma cruzi, se producirá aglutinación.

114
114
Procedimiento
1. Colocar 1 gota de solución salina 0.85% pH 6.8 en los pozos 1, 2, 3 y 4.
(1 gota = 25 l)
2. Colocar 1 gota del suero problema en el pozo 1. (1 gota = 25 l)
3. Diluir y mezclar en el pozo 1 la gota del suero con la solución salina, tomar
Una gota y pasar al pozo 2, mezclar y pasar una gota al pozo 3, etc.
4. Agregar 1 gota de glóbulos rojos de pollo sensibilizados con el Ag al pozo 3
y 4 y mezclar suavemente.
5. Incubar a temperatura ambiente por 30 minutos en una superficie plana y
proteger de posibles vibraciones
6. Lectura – visual
Título significativo > 1:16

115
115
INTERPRETACION DE RESULTADOS
NEGATIVO: Presencia de un sedimento en el fondo del pozo en forma de
botón
POSITIVO: Formación de una película o manto en el pozo
DUDOSO: Presencia de un anillo de bordes regulares. En este caso se debe
de realizar un nuevo análisis con otro método.

116
116

117
117
GUIA PRELABORATORIO N ° 11
PRUEBAS NO TREPONÉMICAS Y TREPONEMICAS PARA EL DIAGNÓSTICO DE
SÍFILIS
1. Pruebas de laboratorio
Técnica de campo oscuro
Pruebas no treponémicas. ¿Qué es una reacción de floculación?
a. VDRL
b. RPR
* Tipo de antígeno
Pruebas Treponémicas
a. TPI
b. FTA-ABS
c. MHA-TP
* ¿En que consisten?
Reactividad de cada tipo de prueba en cada etapa de la enfermedad.
2. VDRL y RPR
Procedimiento
Resultados. Reporte.
Limitaciones. Falsos positivos
3. FTA-ABS.
Procedimiento
Resultados
Ventajas y desventajas

118
118
PRACTICA N° 11
PRUEBAS NO TREPONÉMICAS Y TREPONEMICAS PARA EL DIAGNÓSTICO DE
SÍFILIS
La historia de las pruebas serológicas para el diagnóstico de Sífilis
empiezan a partir de 1906, cuando Wasserman y colaboradores descubren
que en el suero de los individuos infectados por Treponema pallidum
aparecían unos anticuerpos que reaccionaban con antígenos preparados a
partir de tejidos infectados por esta bacteria. Después de este
descubrimiento aparecieron pruebas rápidas para la detección de la sífilis
que empleaban como antígenos extractos de tejido no infectado por el
treponema
El VDRL, desarrollado e introducido por el “Veneral Deseases Reference
Laboratory” en 1946, continúa usándose con algunas variaciones de la
prueba original. En este tipo de pruebas se examina el suero en busca de
reaginas. Estos anticuerpos (IgM, IgG) se desarrollan en respuesta a la propia
cardiolipina (que es un fosfolípido) liberada de los tejidos del individuo
infectado.
Los antígenos que utiliza son a base de cardiolipina, lecitina y colesterol
purificado y estabilizado y detecta las substancias o anticuerpos
denominados “reaginas”. La prueba se lee por floculación (variante de la
precipitación). Para evitar reacciones inespecíficas el antígeno debe ser
altamente purificado y se le agrega cloruro de colina lo que hace innecesario
inactivar la muestra de suero (Inhibir el Complemento).

119
119
Otra variante es la prueba Prueba Rápida de Reagina (RPR) que utiliza
como antígeno una suspensión estabilizada de cardiolipina-lecitina-colesterol
y partículas de carbón, es también una prueba de floculación, pero puede
realizarse en suero como en plasma de pacientes sospechosos de padecer la
infección con treponema.
Ambas pruebas se usan para la detección cualitativa y semicuantitativa de
anticuerpos y los resultados son superponibles excepto cuando se estudia el
LCR y en el diagnóstico de sífilis congénita, que debe de utilizarse el VDRL.
La cuantificación sirve para controlar el curso de la infección y la respuesta al
tratamiento.
Los anticuerpos empiezan a detectarse con estas técnicas 1-2 semanas tras la
aparición del chancro (o sea unas 4 a 6 semanas tras la infección). Sin
tratamiento los títulos van aumentando progresivamente durante la etapa
secundaria y luego van declinando. La respuesta al tratamiento se traduce en
una disminución de los títulos y en casos de curación, ambas pruebas se
negativizan en 6 a 18 meses.
El inconveniente de las pruebas no treponémicas al no ser específicas es que
dan lugar a falsos positivos diversos, por lo que al salir REACTIVAS estas
técnicas deben de confirmarse con una prueba treponémica.
Las pruebas treponémicas si bien es cierto que son específicas, pues detectan
anticuerpos contra el Treponema pallidum, no son útiles para controlar la
enfermedad ni la respuesta al tratamiento y su cuantificación no aporta
información pronostica. Permanecen positivas durante años, incluso después
de la curación de la enfermedad.

120
120
PARTE I
OBJETIVOS
Que el estudiante logre:
1. Explicar el fundamento de las pruebas no treponémicas
2. Compruebe los alcances y limitaciones de estas pruebas
Materiales y Reactivos
- Suspensión de antígeno para VDRL
- Suspensión de antígeno para RPR
- Suero control positivo
- Suero control negativo
- Suero o plasma de paciente sospechoso
- Tarjetas de cartón para la prueba
- Aplicadores de madera
- Láminas de vidrio transparentes con círculos de cerámica
- Microscopios
- Pipetas Pasteur y bulbos de hule
Guantes y lentes protectores

121
121
Prueba cualitativa VDRL.
Procedimiento:
1. Coloque 50 l (2 gotas) de la muestra (suero o plasma)
2. Añada 22 l del antígeno (1 gota) con dispensador de aguja calibre 12
provista con el reactivo VDRL
3. Agitar horizontalmente la placa 180 rpm durante 4 minutos.
4. Observar inmediatamente al microscopio con objetivo 40x.
Prueba cuantitativa en placa para suero o plasma
1. Preparar diluciones de la muestra 1:2, 1:4, 1:8, 1:6 y 1:32 con
solución salina 0.85%.
2. Coloque 50 l de c/u de las diluciones en la lámina de vidrio .
3. Luego con aguja calibre 10, colocar 1 gota del Ag.
4. Agitar y leer igual que en el paso anterior
Técnica cualitativa en placa para LCR
1. Diluir el Ag. 1:2 con solución de cloruro de sodio 10 g/dl. (Emplear
dentro de las 2 horas de preparado)
2. Colocar 50 l del LCR y con 10 l del Ag diluido (aguja calibre 6, 1
gota).
3. Mezclar y agitar horizontalmente la placa por 8 minutos a 180 rpm.
4. Leer al microscopio con objetivo 40x
Interpretación de los resultados
REACTIVO (R): presencia de floculación (conglomerados relativamente
voluminosos de partículas sobre un fondo claro)

122
122
NO REACTIVO (NR): ausencia completa de floculación ( se observará una
suspensión homogénea de partículas delgadas y cortas, semejantes a agujas)
DEBIL REACTIVO (DR): Se formarán numerosos conglomerados pequeños
repartidos entre partículas sueltas. Este resultado debe confirmarse con una
prueba cuantitativa.
Prueba cuantitativa reportar la inversa de la última dilución que se observa
floculación.
Como control de calidad de la prueba se recomienda usar un suero de
reactividad conocida como control positivo y uno "no reactivo" como control
negativo
Limitaciones del procedimiento
Se puede observar resultados falsos positivos en individuos con cuadros
como hepatitis, cáncer, diabetes y enfermedades autoinmunes, aunque son
títulos bajos y la historia clínica no coincide con las características de sífilis.

123
123
Prueba RPR: Prueba no treponémica que titula reaginas relacionadas con
infección sifilítica
El reactivo RPR está constituido por una suspensión estabilizada de
cardiolipina-lecitina-colesterol y partículas de carbón
En muestras positivas hay una floculación de las partículas de carbón, la cual
está ausente en las muestras negativas.
Material y Reactivos
- Suero control positivo "reactivo"
- Suero control negativo " no reactivo"
- Reactivo carbón cardiotipina-lecitina-colesterol
- Porta objetos de cartón
- 1 aguja calibrada dosificadora
Guantes y lentes protectores
Procedimiento:
1. Agregar sobre los círculos de las tarjetas de cartón 1 gota del antígeno
(carbón-cardiolipina-lecitina-colesterol)
2. Adicionar al anterior 1 gota del suero sospechoso
3. Rotar por 8 minutos a 100 rpm a mano o por rotador
4. Leer.
Resultados e Interpretación:
Reactivo: pequeños y grandes flóculos
Reactivo débil: pequeños flóculos dispersos y partículas de carbón al centro.
No Reactivo: no flóculos, partículas de carbón concentradas al centro

124
124
Los reactivos se pueden confirmar con las pruebas cuantitativas o pruebas
treponémicas específicas (FTA-ABS, TPI, etc.).
Proceso Cuantitativo de RPR
Hacer 5 diluciones dobles de la muestra (1:2,1:4, 1:8, 1:16) con solución
salina 0.9% y luego colocar 50 l en c/u de los círculos respectivos, luego
agregar 1 gota del Ag y agitar por 8 minutos a 100 rpm. Leer y reportar la
última dilución en la que se observa floculación.
FUENTES DE ERROR VDRL /RPR
1. No mezclar el antígeno.
2. No leer inmediatamente la reacción después del tiempo estipulado.
3. Rotador con velocidad inadecuada.
4. Aguja dispensadora de reactivo sucia o deteriorada.
5. No dispensar las gotas en forma vertical.
6. No utilizar los reactivos a temperatura ambiente.
7. Mala iluminación para la lectura.
8. Diluciones inexactas.

125
125
9. Uso de reactivos vencidos o en malas condiciones.
10. Muestras hiperlipémicas.
Situaciones en las que salen REACTIVAS estas pruebas (VDRL /RPR)
1. En primer lugar se deben considerar las treponematosis: sífilis,
frambesia, pinta, bejel, y además fiebre recurrente, leptospirosis,
enfermedad de Lyme y otras borreliosis. Estas afecciones provocan una
reacción serológica reactiva verdadera.
2. Enfermedades por micobacterias: tuberculosis y lepra.
3. Otras enfermedades producidas por bacterias: neumonías
neumocócicas, endocarditis infecciosa, chancro blando y escarlatina.
4. Enfermedades virales: mononucleosis infecciosa, neumonías virales,
sarampión, varicela, hepatitis infecciosa.
5. Enfermedades por clamidias: linfogranuloma venéreo.
6. Enfermedades parasitarias: paludismo y tripanosomiasis.
7. Enfermedades por deficiencias o irregularidades del sistema inmune:
anemias hemolíticas autoinmunes, enfermedades del colágeno,
síndrome antifosfolipídico primario.
Además influye el error técnico, que puede dar un falso reactivo o falso no
reactivo: cambio de muestra, cristalería sucia, poco adiestramiento del
personal para hacer las lecturas, etc.

126
126
Casos en los que un paciente con sífilis puede tener una serología NO
REACTIVA
1. Durante el período de incubación de la enfermedad y hasta 15 días
después de la aparición del chancro sifilítico, pues no se han producido
aún las reaginas por el paciente.
2. En pacientes con títulos muy altos de anticuerpos anticardiolipina (1 ó
2 % de los pacientes con sífilis) se observa una reacción de prozona
(exceso de anticuerpos). En estos casos no se produce floculación, a
menos que se diluya el suero del paciente.
PARTE II
PRUEBAS CON ANTICUERPOS TREPONÉMICOS: FTA-ABS
Esta es una prueba que usa Inmunofluorescencia indirecta (T pallidum
muerto + suero del paciente + gammaglobulina humana marcada) y muestra
especificidad y sensibilidad excelentes para los anticuerpos en la sífilis si el
suero se absorbe con espiroquetas de la cepa Reiter antes de la prueba FTA.
La prueba FTA-ABS es la primera en volverse positiva en la sífilis temprana, de
manera rutinaria es positiva en la etapa secundaria y, por lo común,
permanece positiva años después del tratamiento efectivo, razón por la cual
no puede emplearse para evaluar la eficacia del tratamiento. La presencia de
IgM FTA en la sangre de los recién nacidos es una buena evidencia de
infección congénita.
Esta prueba es cara y lleva tiempo su realización, por lo que no se aconseja
para la evaluación masiva sino para la confirmación de las pruebas no

127
127
treponémicas reactivas y el diagnóstico de los estadios más avanzados de a
sífilis donde las pruebas no treponémicas no son útiles.
TECNICA DE FTA-ABS
1. Reconstituir el buffer fosfato salino (BFS) y llevar a un litro con agua
destilada. Conservar el buffer reconstituido entre 2 a 8 ° C
2. sacar los portaobjetos necesarios para trabajar y dejarlos 15 minutos a
temperatura ambiente
3. Preparar una dilución 1/5 de los sueros controles y de los desconocidos
con el absorbente. Por ejem. 10 ul de muestra + 40 ul de absorbente
4. Cubrir generosamente las áreas reactivas con las diluciones respectivas
del control positivo, control negativo y sueros desconocidos
5. Incubar en cámara húmeda 30 minutos a T ° ambiente
6. Lavar con BFS, dos lavados de 5 minutos c/u. colocar los portaobjetos
en frascos Coplin conteniendo BFS, agitando suavemente durante los
lavados
7. Diluir la anti gammaglobulina humana marcada con isotiocianato de
fluoresceína en BFS, según el título indicado en el frasco. Ejemplo:
Título 1/100 colocar 0.01 ml de anti gamma en 1 ml de BFS
8. Secar cuidadosamente los bordes laterales externos del portaobjeto
con papel absorbente, manteniendo húmedas las áreas reactivas
9. Cubrir cada área reactiva con la dilución de anti gamma e incubar en
cámara húmeda 30 minutos a T ° ambiente
10. Repetir los pasos 6 y 8

128
128
11. Colocar medio de montaje sobre el portaobjeto y cuidadosamente
cubrir el área reactiva con un cubreobjeto sin presionar fuerte
Para obtener buenos resultados se aconseja leer inmediatamente en el
microscopio de fluorescencia. Si los portaobjetos se van a conservar sellar
los bordes del preparado para prevenir el secado del medio de montaje y
guardar entre 2 a 8 ° C en la oscuridad
NOTA: Para detectar la unión de los anticuerpos a tejidos o células se
requiere el uso de un microscopio de fluorescencia. Este contiene una fuente
de luz de alta intensidad (lámpara de mercurio), filtros de excitación que
producen una longitud de onda capaz de causar la activación de la
fluorescencia y un filtro de barrera que retira las longitudes de onda que
interfieren con la luz. Cuando se observan en el microscopio de fluorescencia
contra un fondo oscuro, los anticuerpos fluorescentes adheridos
específicamente a antígenos se pueden visualizar por medio de su color
brillante.
El microscopio de fluorescencia con epiiluminación es uno de los más
utilizados. En este el rayo de luz se dirige a través del filtro excitador hacia
abajo en dirección al espécimen. Un espejo dicroico permite el paso de
longitudes de onda selectas en una sola dirección. Después de llegar al
espécimen, la luz se refleja a través del espejo dicroico y la luz fluorescente
emitida se visualiza en el ocular.

129
129
Técnica Indirecta
Es una técnica netamente serológica ya que busca anticuerpos en la muestra.
Se siguen los pasos como en la técnica directa, luego estos anticuerpos se
visualizan mediante la utilización de una antiinmunoglobulina conjugada con
una molécula fluorescente.

130
130
MICROSCOPIO DE EPILUMINACIÓN

131
131
GUIA PRELABORATORIO N ° 12
PRUEBA DE ELISA
1. Generalidades de ensayos inmunoenzimáticos.
2. ELISA directo e indirecto (principios)
3. ELISA para Chagas. ¿Qué reactante se conoce y cuál se investiga?
4. Reactivos empleados
5. Precauciones a tomar en cuenta
6. Procedimiento
7. Resultados

132
132
PRACTICA No. 12
ENSAYO INMUNOADSORBENTE LIGADO A ENZIMA: ELISA
Las técnicas de inmunoanálisis en las que se utilizan reactivos marcados
para detectar antígenos, presentan extraordinaria sensibilidad y los reactivos
que se utilizan en los mismos, resultan económicos. Las determinaciones de
anticuerpos en fase sólida, utilizan ligandos marcados, por ejemplo, con
enzimas que se usan en la prueba de inmunoabsorción ligada a enzimas o
ELISA (del inglés, Enzyme Linked Inmunoaborbent Assay) o marcadores
fluorescentes. Estos métodos de análisis inmunológicos son probablemente
los más utilizados, ya que permiten llevar a cabo, una gran cantidad de
determinaciones en un corto espacio de tiempo.En estas pruebas, los
antígenos se pueden determinar mediante pruebas tipo "sándwich" o
competitivas, en las que la detección se puede llevar a cabo utilizando
cualquiera de los marcadores que se han mencionado.
El ligando marcado con una enzima, como la peroxidasa o la fosfastasa
alcalina, tiene afinidad con el antígeno problema y se puede determinar la
cantidad fijada, mediante la adición de un cromógeno, que es un sustrato
incoloro capaz de transformarse en un compuesto coloreado de la molécula
de ligando. La cantidad de anticuerpo o antígeno que contiene la muestra
problema, se calcula a partir de la cantidad de producto coloreado que se
forma mediante la medida de la densidad óptica.

133
133
Representación esquemática de los diseños de ELISA no competitivos más utilizados. A)
Cuantificación de antígeno; B) Cuantificación de anticuerpos; C) Cuantificación de
antígeno o anticuerpo (puede ser utilizado para cualquiera de los dos fines)
ELISA PARA DETECCIÓN DE ANTICUERPOS anti- T cruzi
PRINCIPIO Bioelisa CHAGAS
Este es un método inmunoenzimático en el cual se han recubierto los pocillos
de una placa de micro titulación con antígenos recombinantes que
representan 4 epitopos inmunodominantes de T cruzi. A dichos pocillos se les
añade las muestras de sueros o plasmas a analizar. Si en una muestra están
presentes anticuerpos específicos frente a T cruzi se formará un complejo
estable con el antígeno que recubre el pocillo. Después de lavar para extraer
todo el material no unido se añaden IgG de conejo anti-IgG y anti-IgM
humanas marcadas con peroxidasa y, si el complejo antígeno-anticuerpo está
presente, el conjugado se unirá con el complejo. Después de un segundo
lavado, se añade el sustrato enzimático y el cromógeno. Esta solución
desarrollará un color azul si la muestra es positiva. El color azul cambia a
amarillo después de parar la reacción con ácido sulfúrico. La intensidad de

134
134
color es directamente proporcional a la concentración de anticuerpos anti-T
cruzi. Los pocillos que contengan muestras negativas no desarrollarán color.
MATERIAL Y REACTIVOS PROVISTOS
1. MICROPLACA: 12 x 8 pocillos recubiertos con antígenos recombinantes de
T cruzi
2. Conjugado concentrado: anticuerpos de conejo anti IgG y anti IgM
humanas conjugados con peroxidasa. Contiene colorante rojo, mertiolato
sódico al 0.02% y proteínas estabilizadoras. A diluir 1/51 con el diluyente del
conjugado antes de usarse.
3. Diluyente del conjugado: tampón Tris que contiene colorante amarillo,
aditivos y mertiolato sódico al 0.02%. Para diluir el conjugado concentrado.
4. Diluyente de las muestras: Tampón Tris con proteínas estabilizadoras,
azida sódica < 0.1%, Tritón X-100 < 1.0%, como conservante y etilenglicol 8%.
Listo para usar.
5. Solución de lavado concentrada: tampón fosfato concentrado (10x) que
contiene Tween 20 al 1% y mertiolato sódico al 0.01%. A diluir 1/10 con agua
destilada o desionizada antes de utilizarse.
6. Tampón sustrato: tampón citrato-acetato que contiene peróxido de
hidrógeno.
7.Cromógeno(TMB)3,3,5,5´´-tetrametilbenzidina disuelta en dimetilsulfóxido.
8. Control positivo: suero humano inactivado y diluido que contiene
anticuerpos contra T cruzi. Posee colorante verde y azida sódica > 0.1% como
conservante. Listo para usar

135
135
9. Control negativo: suero humano diluido negativo para anti-T cruzi.
Contiene colorante amarillo y azida sódica > 0.1% como conservante. Listo
para usar
10. Solución de parada: ácido sulfúrico 1N.
PRECAUCIONES
No permitir que los reactivos entren en contacto con piel o los ojos; si
esto ocurre, lavar con abundante cantidad de agua
Usar guantes, no pipetear ningún reactivo con la boca, no fumar
Depositar todos los materiales usados en el descarte adecuado para
material biocontaminante. Los restos que contengan ácido deben de
ser neutralizados antes de añadir hipoclorito de sodio.
Los componentes con azida sódica pueden reaccionar con las tuberías
y desagües de plomo o cobre dando lugar a azidas metálicas altamente
explosivas. Al desechar los restos de reactivos deje correr agua
abundante. Además azida sódica es nociva por ingestión.
Restos de jabones y/o agentes oxidantes en los recipientes utilizados
pueden interferir en la reacción del sustrato-TMB
Es muy importante preparar la solución sustrato-TMB justo 5 a 10
minutos antes de ser empleada y mantenerla bien tapada y al abrigo
de la luz
PROCEDIMIENTO
Todos los reactivos deben de estar a temperatura ambiente antes de
empezar el ensayo
Los reactivos líquidos deben de homogenizarse suavemente antes de usarse.

136
136
1. Reservar 6 pocillos para blanco y controles. Dosificar 200 l de
diluyente de las muestras al resto de pocillos. A continuación dosificar
10 l de cada muestra en los pocillos designados previamente.
2. Dosificar 200 l de control negativo a 3 pocillos y 200 l de control
positivo a 2 pocillos. NO DILUIR LOS CONTROLES, ya están listos para
usar. Dejar un pocillo vacío para el blanco de sustrato.
3. Cubrir la placa con una lámina adhesiva, agitarla suavemente e incubar
1 hora a 37ºC.
4. Desechar la lámina adhesiva. Aspirar el contenido de los pocillos y
llenarlos completamente (aprox. 350 l) con solución de lavado
diluida. Repetir el proceso de aspiración lavado 3 veces más.
Asegurarse de que cada columna de pocillos esté en remojo al menos
15 segundos antes del nuevo ciclo de aspiración. Después del último
lavado golpear la placa invertida sobre un papel absorbente para
eliminar cualquier exceso de líquido en los pocillos.
5. Agregar 100 l de conjugado diluido en todos los pocillos, a excepción
del pocillo para el blanco de sustrato.
6. Cubrir la placa con una lámina adhesiva, e incubar 30 minutos a 37ºC.
7. Durante los últimos 5-10 minutos de incubación, preparar la solución
sustrato cromógeno. Para una placa añadir 280 l de la solución de
cromógeno (TMB) a un vial de tampón sustrato (14 ml) y mezclar bien.
Si no se utiliza toda la placa, preparar la cantidad necesaria según se
indica en la siguiente tabla. La solución final debe ser incolora,
descartar en caso de que se vuelva azul.

137
137
Tiras requeridas 1 2 4 6 8 10 12
Tampón sustrato ml 1 2 4 6 8 10 12
Cromógeno (TMB) l 20 40 80 120 160 200 240
8. Desechar la lámina adhesiva. Aspirar y lavar la placa como en el punto
4
9. Añadir 100 l de sustrato-TMB a todos los pocillos
10. Incubar sin cubrir por 30 minutos a temperatura ambiente (20-25ºC)
11. Añadir 100 l de solución de parada a cada pocillo, guardando la
misma secuencia y con los mismos intervalos observados en la adición
del sustrato-TMB.
12. Ajustar el cero del lector con el pocillo del blanco a 450nm y leer la
absorbancia de cada uno de los pocillos en el plazo máximo de 30
minutos.
TÉCNICA DE ELISA PARA DETERMINAR HIV- 1/2 VERSIÓN 2 MATERIALES Y REACTIVOS PROPORCIONADOS:
Microplacas: 12 hileras de 8 pocillos sensibilizados con los antígenos
VIH-1 y VIH-2 purificados ** (R1)
Solución de lavado concentrada: Tampón Tris NaCl pH 7.4 (R2)
Control negativo**(R3)
Control umbral** (R4)
Control positivo**(R5)
Diluyente de muestras: solución de suero de ternera **(R6)
Conjugado: antígenos VIH-1 y VIH-2 purificados marcados con
peroxidasa. Liofilizados (R7a)
Diluyente de conjugado: solución de leche descremada coloreada(R7b)
Tampón para sustrato de peroxidasa: solución de citrato de sodio y
acetato de sodio pH 4.0 (R8)

138
138
Cromógeno: solución conteniendo tetrametil bencidina (R9)
Solución de parado: ácido sulfúrico 1N **(R10)
** Listos para su uso
MATERIAL Y SOLUCIONES NO PROPORCIONADAS
Agua destilada
Hipoclorito de sodio y bicarbonato de sodio
Pipetas automáticas
Descartes para material contaminado
Baño maría o incubadora de Microplacas a 37°C +/- 1
Dispositivo de lavado manual, semi automático o aparato de lavado
para placas de microtitulación
Espectrofotómetro con filtros de 450 nm y 620-700 nm
Papel absorbente
MUESTRA: suero o plasma obtenido con EDTA Preparación de reactivos para su uso:
Diluya la solución de lavado concentrada 20 veces en agua destilada.
Para preparar la solución de conjugado: quite el tapón del reactivo
rotulado como “Conjugado” y vierta el contenido de un frasco de
diluyente de conjugado en el frasco del conjugado liofilizado. Vuelva a
taparlo y déjelo reposar por 10 minutos, agitándole y dándole la vuelta
de vez en cuando para facilitar su disolución.
Para preparar el cromógeno: diluya 11 veces la solución de cromógeno
(tetrametil bencidina) en el tampón sustrato.
PROCEDIMIENTO:
1. Establezca cuidadosamente el plan de distribución e identificación de
muestras
2. Prepare la solución de lavado diluida
3. Saque la microplaca del embalaje protector
4. Deposite directamente sin lavar antes la placa de forma sucesiva:
4.1 25 l de diluyente en cada pocillo
4.2 75 l de suero control negativo en A1

139
139
75 l de suero control umbral en B1, C1 y D1
75 l de suero control positivo en E1
75 l de la primera muestra en F1
75 l de la segunda muestra en G1 etc. Agite la microplaca cuidadosamente después de la fase de pipeteado para homogenizar.
5. Cubra con una película autoadhesiva los pozos utilizados para evitar
evaporaciones
6. Incube la microplaca en baño maría con termostato o en una
incubadora seca para Microplacas durante 30 +/- 5 minutos a 37° +/-
1°C
7. Retire la película adhesiva. Aspire el contenido de todos los pocillos en
un descarte con hipoclorito de sodio y añada a cada pocillo 370 l de
solución de lavado. Deje actuar por un mínimo de 30 segundos. Aspire
de nuevo. Repita el lavado por lo menos 2 veces. El volumen residual
debe de ser inferior a 10l y si es necesario seque la placa dándole la
vuelta sobre una hoja de papel absorbente.
8. Distribuya rápidamente 100 l de la solución de conjugado en todos
los pocillos. El conjugado debe de agitarse antes de su uso
9. Cubra con una película autoadhesiva los pozos utilizados para evitar
evaporaciones
10. Incube la microplaca 30 +/- 5 minutos a temperatura ambiente.
11. Retire la película adhesiva y lave 5 veces siguiendo el mismo
procedimiento explicado anteriormente
12. Distribuya rápidamente 80 l de la solución de revelado de la actividad
enzimática (conjugado diluido preparado anticipadamente) en todos
los pocillos
13. Deje que se desarrolle la reacción en la oscuridad durante 30 +/- 5
minutos a temperatura ambiente. Durante esta incubación no usar
película adhesiva.
14. Añadir 100 l de solución de parada. Homogenizar la mezcla
15. Esperar un mínimo de 4 minutos después de añadida la solución de
parada y en los próximos 30 minutos leer la densidad óptica a
450/620- 700 nm con un lector de placas.

140
140
Las muestras positivas se observan de un color amarillo similar o màs intenso que los controles positivos o umbrales. CALCULO EL INTERPRETACION DE RESULTADOS La presencia o ausencia de anticuerpos anti HIV-1 y HIV-2 se determina comparando para cada muestra la absorbancia registrada con la del valor umbral. Las muestras cuya absorbancia sea menor a la del valor umbral se consideran negativas. Si es superior a la del valor umbral se consideran positivas.

141
141
BIBLIOGRAFÍA
1. Fuentes Paredes Flor, Mendoza Yanavilca Rosa Amelia, Rivera Rodríguez
Ricardo, Vara Márquez Marino Dante. Guía de Manejo y Cuidado de animales de
laboratorio: Conejo. Lima Ministerio de Salud, Instituto Nacional de Salud, 2010.
2. Kindt, Thomas J, Goldsby Richard. Inmunología de Kuby. 6ª edición Mc Graw Hill
Interamericana. México 2007
3. Pico Beltrán, María Cristina. Inmunología Experimental. 1° edición. Editorial Félix
Varela. La Habana. 1997.
4. Regueiro, J. R. Inmunología 3° edición. Editorial Médica Panamericana. 2002
5. Roitt, Iván Inmunología 9° edición .Editorial Harcout Brace. 2002
6. Roitt, Iván Inmunología. Fundamentos. 17° edición. Editorial Médica
Panamericana. 1994.
7. Rojas Espinosa, Oscar Inmunología (de memoria) 3 ° edición. Editorial Médica
Panamericana México D F 2006
8. Rojas, William .Inmunología. 12° edición. Corporación para Investigaciones
Biológicas .Colombia 2001.
9. Rojas, William .Inmunología. 17° edición. Corporación para Investigaciones
Biológicas .Colombia 2015
10. Salinas Carmona, Mario César La Inmunología en la salud y la enfermedad 1°ed.
Editorial Médica Panamericana México 2010
11. Stites D. P. Inmunología Básica y Clínica 10° edición. Editorial Manual Moderno
2002.

142
142
UNIVERSIDAD DE EL SALVADOR, FACULTAD DE MEDICINA HOJA DE REGISTRO
DIAGNOSTICO INMUNOLOGICO CICLO I –AÑO 2019
NOMBRE _________________________________________________ GRUPO___________
DOCENTE ___________________________________________ TELÉFONO_______________
EXAMENES TEÓRICOS EXÁMENES PRÁCTICOS
1 2 PROMEDIO 34% 1 2 PROMEDIO 16%
LABORATORIOS
1 2 3 4 5 6 7 8 9 10 11 12
PROMEDIO 25%
SESIONES DE GRUPO
1 2 3 4 5 6 7 PROMEDIO 15%
CONTROLES DE LECTURA
1 2 3 4 5 PROMEDIO 10%
NOTAFINAL ___________EXAMEN SUFICIENCIA ____________ 50% _____________ 50%_______________
NOTA PROMOCIÓN
FOTO

143
143
DEPARTAMENTO DE MICROBIOLOGIA
FACULTAD DE MEDICINA
UNIVERSIDAD DE EL SALVADOR
Final 25 Av. Nte., Ciudad universitaria, San Salvador, El Salvador, Centro América. Tel.: (503)2 225-1500, ext. 4246, 4247, Fax: (503) 22258822.
SOLICITUD DE REVISION DE EXAMEN
San Salvador____de___________de_____
Estimado: _________________________________________________
Nombre de Coordinador
Coordinador de: ____________________________________________
Asignatura
Grupo de Laboratorio: ___________________
Instructor responsable: _________________________________________
Yo, ______________________________________carné N ° ________________del grupo______
Nombre del estudiante
Solicito atentamente la revisión del ___________________________________________________
Descripción del examen: primero, segundo, etc.
______________________________que fue realizado el día______________________________
Fecha completa: día, mes, año
_______________________________por no estar de acuerdo con la nota asignada de ________, esperando
una respuesta favorable.
Atentamente.
Nombre completo: ______________________________________
Firma:
Resolución: _____________________________________________________________________
_______________________________________________________________________________
Nombre y firma del Coordinador: ____________________________________________________
NOTA: Esta solicitud deberá de ser presentada en original y duplicado a más tardar 3 día hábiles después de
publicadas las notas. La revisión se enmarcará dentro de lo acordado en el art. 20 del Reglamento de
Administración Académica

144
144
DEPARTAMENTO DE MICROBIOLOGIA
FACULTAD DE MEDICINA
UNIVERSIDAD DE EL SALVADOR
Final 25 Av. Nte., Ciudad universitaria, San Salvador, El Salvador, Centro América. Tel.: (503) 2225-1500, ext. 4246, 4247, Fax: (503) 22258822.
SOLICITUD DE EXAMEN DIFERIDO
San Salvador____de___________de_____
Estimado: _________________________________________________
Nombre de Coordinador
Coordinador de: ____________________________________________
Asignatura
Yo, ______________________________________carné N ° ________________del grupo______
Nombre del estudiante
Solicito atentamente la realización diferida de
___________________________________________________
Descripción del examen: primero, segundo, etc.
______________________________que fue realizado el día_______________________________________
Fecha completa: día, mes, año
al cual no pude asistir por la siguiente razón
________________________________________________________________________________________
________________________________ lo cual justifico con el documento anexo presentado.
Esperando una respuesta favorable, atentamente
Nombre completo: ______________________________________
Firma:
Resolución: _____________________________________________________________________
_______________________________________________________________________________
Nombre y firma del Coordinador: ____________________________________________________
NOTA: Esta solicitud deberá de ser presentada en original y duplicado a más tardar 5º día hábil después de
realizada la prueba y anexando el documento que justifica su ausencia a la actividad programada.