Los atomos
Transcript of Los atomos

REPUBLICA BOLIVARIANA DE VENEZUELAMINISTERIO DEL PODER POPULAR
PARA LA EDUCACION UNIVERSITARIAUNIVERSIDAD BOLIVARIANA
ALDEA UNIVERSITARIA´´CRISTO REY´´FUNDACION MISION SUCRE - APURE
PROFESORA:ING. YANIRA ROJAS
SAN FERNANDO MAYO DEL 2013
LOS ATOMOS

¿Qué ES UN ATOMO?
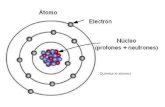
En química y física, átomo es una de las unidades mas pequeña de la materia que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos
partícula subatómica
núcleo atómico Neutrones y protones
orbital electrones


Modelo de Thomson
es una teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson, quien descubrió el electrón en 1898, mucho antes del descubrimiento del protón y del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, como un budín de pasas (o un panque).Se pensaba que los electrones se distribuían uniformemente alrededor del átomo. En otras ocasiones, en lugar de una nube de carga negativa se postulaba con una nube de carga positiva.

Modelo de Dalton
El modelo atómico de Dalton fue expuesto en un libro llamado “Nuevo sistema de filosofía química”, y en síntesis decía lo siguiente:La materia está formada por partículas pequeñísimas llamadas “átomos”. Estos átomos no se pueden dividir ni romper, no se crean ni se destruyen en ninguna reacción química, y nunca cambian. Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa y dimensiones; por ejemplo, todos los átomos de hidrógeno son iguales. Por otro lado, los átomos de elementos diferentes, son diferentes; por ejemplo, los átomos de oxígeno son diferentes a los átomos de hidrógeno. Los átomos pueden combinarse para formar compuestos químicos. Por ejemplo, los átomos de hidrógeno y oxígeno pueden combinarse y formar moléculas de agua. Los átomos, al combinarse para formar compuestos guardan relaciones simples. Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto. Por ejemplo, un átomo de carbono con uno de oxígeno forman monóxido de carbono (CO), mientras que dos átomos de oxígeno con uno de carbono, forman dióxido de carbono (CO2)

Modelo de Rutherford
El modelo atómico de Rutherford es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford para explicar los resultados de su experimento de la lamina de oro, realizado en 1911.El modelo de Rutherford fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza", constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo", muy pequeño, que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo en el cual el átomo poseía un núcleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extranuclear se encuentran los electrones de carga negativa.

Modelo de Bohr
Bohr unió la idea de átomo nuclear de Rutherford con las ideas de una nueva rama de la Ciencia: la Física Cuántica. Así, en 1913 formuló una hipótesis sobre la estructura atómica en la que estableció tres postulados:¤ El electrón no puede girar en cualquier órbita, sino sólo en un cierto número de órbitas estables. En el modelo de Rutherford se aceptaba un número infinito de órbitas.¤ Cuando el electrón gira en estas órbitas no emite energía.¤ Cuando un átomo estable sufre una interacción, como puede ser el impacto de un electrón o el choque con otro átomo, uno de sus electrones puede pasar a otra órbita estable o ser arrancado del átomo.El átomo de hidrógeno según el modelo atómico de Bohr¤ El átomo de hidrógeno tiene un núcleo con un protón.¤ El átomo de hidrógeno tiene un electrón que está girando en la primera órbita alrededor del núcleo. Esta órbita es la de menor energía.¤ Si se le comunica energía a este electrón, saltará desde la primera órbita a otra de mayor energía. cuando regrese a la primera órbita emitirá energía en forma de radiación luminosa.