Producción de cianobacterias extremófilas como estrategia ...
LAS CIANOBACTERIAS, PRODUCTORES …tab.facmed.unam.mx/files/15-CARLOS-GOMEZ-LOJERO.pdf · Los...
Transcript of LAS CIANOBACTERIAS, PRODUCTORES …tab.facmed.unam.mx/files/15-CARLOS-GOMEZ-LOJERO.pdf · Los...
281
LAS CIANOBACTERIAS, PRODUCTORES PRIMARIOS Y SUS ANTENAS COSECHADORAS DE LUZ
CYANOBACTERIA, PRIMARY PRODUCERS AND THEIR LIGHT HARVESTING
ANTENNAS
Carlos Gómez Lojero1 y Emma Berta Gutiérrez Cirlos Madrid
1Departamento de Bioquímica Centro de Investigación y Estudios Avanzados I.P.N. Apartado Postal 14-740, 07000 México, DF, México
2Laboratorio de Bioquímica y Bioenergética. Unidad de Biomedicina. F.E.S. Iztacala. Universidad Nacional Autónoma de México. Avenida de los Barrios #1.
Los Reyes Iztacala. Tlalnepantla, Edo. De México, CP. 54090. México. Correspondencia: [email protected]; tel: (5255) 57473948
Resumen
Se estima que la radiación del sol que llega a la superficie de la tierra
actualmente, no es muy diferente, solo con menos radiación ultravioleta, que la
que había hace 2600-2800 millones de años, tiempo en el que las cianobacterias o
un antecesor de ellas inventaron la fotosíntesis oxigénica. El filtro de ozono (O3)
que detiene a la luz ultravioleta se formó como consecuencia de la producción
biológica del oxígeno por los organismos fotosintéticos. La radiación que nos llega
es la llamada luz visible en el rango de 400-700 nm de longitud de onda, además
el rojo lejano o infrarrojo cercano en el rango de 700-900 nm. La luz es modificada
por los medios que atraviesa, ya sea bajo la sombra de un bosque o al penetrar en
una columna de agua o por bacterias fotosintética en tapetes microbianos. En
estos hábitats distintos las cianobacterias han diversificado sus pigmentos para
Cárdenas Monroy C, González Andrade M, Guevara Flores A, Lara Lemus R, Matuz Mares D, Molina Jijón E, Torres Durán PV. Mensaje Bioquímico, Vol. XL, 281-304, Depto. de Bioquímica, Facultad de Medicina, Universidad Nacional Autónoma de México. Cd. Universitaria, CDMX.,MÉXICO.,(2016). (http://bioq9c1.fmedic.unam.mx/TAB)
(ISSN-0188-137X)
MENSAJE BIOQUÍMICO, VOL. XL (2016)
282
aprovechar esta variedad de energía en todo el tiempo que han residido en este
planeta. Algunos ejemplos con los que hemos trabajado en el laboratorio son
muestra de la adaptación de las cianobacterias a las diferentes radiaciones que
les llegan: la luz roja es aprovechada por los organismos que están en la
superficie del agua como Arthrospira maxima que contiene proteínas pigmentadas
con ficocianobilina y clorofila a. La luz amarilla y verde que predomina conforme se
desciende (de 10 a 25 m) en una columna de agua, es utilizada por Fremyella
diplosiphon que contiene además de los pigmentos mencionados, ficoeritrina. A
mayores profundidades, Synechococcus marinus contiene además el pigmento
urobilina. Entre 75 y 200 m de profundidad en el mar Prochlorococcus marinus
contiene divinil clorofila b que es eficiente para captar luz azul. En tapetes debajo
de otras cianobacterias o bajo capas de arena en la playa se encuentra
Synechococcus PCC 7335 que contiene una nuevo ficobilisoma, con una nueva
proteína con ficocianobilina y clorofila f que son capaces de absorber luz del rojo
lejano.
Palabras clave: cianobacteria, ficobilisoma, aclimatación.
Abstract
It has been estimated that the radiation of the sun that reaches the Earth´s
Surface is not very different from the one received 2.6 – 2.8 billion years ago,
except with less UV radiation now. At that time, cyanobacteria or a predecessor
invented oxygenic photosynthesis. The ozone (O3) filter stops UV light and was
formed as a consequence of the biological production of oxygen by the
photosynthetic organisms. The visible light that is part of the sun’s radiation is in
the range of wavelengths from 400 to 700 nm, and the far red or near infrared light
is in the range from 700 to 900 nm of wavelength, those are the main radiations
that we receive. The radiation is modified by the different densities of media that it
traverses, for example the shadow of a forest, a water column or a microbial mat.
In these different habitats, cyanobacteria have diversified their pigments to take
advantage of all energy available in the planet. Some cyanobacteria that we have
characterized in the lab are examples of the adaptation to the different radiations
that they can harvest. Red light is used by cyanobacteria that lives in the surface of
water bodies as Arthrospira maxima that has proteins with phycocyanobilin and
chlorophyll a. Yellow light is predominant in depths of a water column and that is
used by Fremyella diplosiphon that additionally to the previous pigments, it
contains phycoerithrobilin. At higher depths Synechococcus marinus contains an
additional pigment, phycourobilin which absorbs green light. Between 75 and 200
Gómez Lojero C y Gutiérrez Cirlos Madrid EM
283
m depth in the sea we find Prochlorocuccus marinus which contains divinil-
chlorophyll b that is efficient to absorb blue light. In microbial mats underneath of
other cyanobacteria or in the sand of the beach we can find Synechococcus PCC
7335 that contains a new type of phycobilisome with a new protein with
phycocyanobilin and chlorophyll f that are capable of absorbing energy from the far
red light. Our presentation will be around those cyanobacteria mentioned above.
Keywords: cyanobacteria, phycobilisome, acclimatization.
Introducción
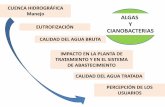
Los organismos autótrofos son capaces de sintetizar las moléculas que
forman a las células a partir de moléculas simples, usando la energía de la tierra o
litoautótrofos (se encuentra en ventilas negras o blancas y en las fuentes
sulfurosas) o la radiación del sol, (denominados fotoautótrofos). Los autótrofos no
solo son capaces de sustentarse así mismos de energía y de bloques básicos
(bases nitrogenadas, aminoácidos, ac. grasos, carbohidratos), sino de mantener a
todos los seres vivos del planeta por lo que son los “productores primarios”.
Aparición en el tiempo de los productores primarios
Los fotoautótrofos son los organismos más abundantes de la tierra y
surgieron hace 3500 millones de años. Las bacterias que llevan a cabo la
fotosíntesis anoxigénica inventaron la fotosíntesis óxido-reductora, base de la
fotosíntesis más exitosa del planeta. Consiste en tomar electrones de un donador
primario, tal como el ácido sulfhídrico (H2S) y con la energía de la radiación solar
incrementar su energía para poder reducir a un aceptor de electrones tal como el
bióxido de carbono (CO2) y transformarlo en un carbohidrato.
2H2S + CO2 + 4hν 2S° + CH2O + H2O
Esta fue la única forma de fotosíntesis por 750 millones de años, ver reloj
Biogeológico Figura 1, [1]. En ese tiempo el planeta fue agotando las fuentes de
sulfuros al irse enfriando, situación que presionaba a los organismos a inventar
una forma de fotosíntesis que utilizara un donador de electrones muy abundante
en la tierra. Este era el escenario para la aparición de la fotosíntesis oxigénica. La
forma de fotosíntesis más exitosa del planeta, la llevan a cabo más de 95% de los
productores primarios actuales.
MENSAJE BIOQUÍMICO, VOL. XL (2016)
284
Figura 1. Reloj Biogeológico de la Tierra. Basado en David Des Marais, Ames Research Center de la NASA. Las estimaciones de tiempo están basadas en la cuantificación de isótopos radiactivos de vida media larga, así como de isótopos no radiactivos utilizados preferentemente por las enzimas (carbono y azufre ligeros). También precipitaciones de metales debido a un cambio en su estado de oxidación, tales como el fierro y el manganeso. La aparición de las cianobacterias y con ellas el incremento de oxígeno en la atmósfera y la precipitación de bandas de fierro. Los eventos de la aparición de los productores primarios es el siguiente:
1. Hace 3500 millones de años la naturaleza inventa la fotosíntesis óxido-reductora
en el reloj señalado “Bacteria Fototrófica”
2. Entre 2800-2600 millones de años aparición de la fotosíntesis oxigénica, en la
Figura “Cianobacteria”
3. Alrededor de 1300 millones de años ocurre el primer evento endosimbiótico de
organismos fotosintéticos. Un eucariote fagocita una cianobacteria que se
convertirá en el cloroplasto. En el reloj aparece como “Arqueoplástido” es el origen
de las algas glaucofitas, rodofitas y clorofitas.
Gómez Lojero C y Gutiérrez Cirlos Madrid EM
285
4. Hace 400 millones de años aparecen las primeras plantas en la Figura señaladas
como “Las plantas saltan a la superficie terrestre”, provenientes de un organismo
emparentado con las clorofitas.
5. Hace 300-200 millones de años se lleva a cabo una segunda y tercera
endosimbiosis, un eucariote heterótrofo fagocita a un eucariote fotosintético, ese
mimo organismo pierde la capacidad fotosintética y fagocita a otro eucariote
fotosintético y así sucesivamente. Aparecen las diatomeas, dinoflagelados, algas
pardas etc. En la Figura 1 aparece como “Segunda endosimbiosis”.
Alrededor de 2600 millones de años (ver reloj Biogeológico), aparecen las
cianobacterias inventoras de la fotosíntesis oxigénica que toman los electrones del agua (H2O, ver la semejanza con el ácido sulfhídrico) y liberan oxígeno (O2).
2H2O* + CO2 + 4hν *O2 + CH2O + H2O
Con grandes ventajas, siendo el donador, el agua, que se encuentra distribuida a todo lo largo de la superficie terrestre y el oxígeno, un producto que, al ser un gas, no tiene que tener ningún sistema para ser expulsado de la célula. No es difícil imaginar el éxito por 1000 millones de años (ver reloj Biogeológico), de las cianobacterias y que finalmente la vida toma posesión del planeta completo. Con la aparición del oxígeno comienza la transformación de la atmósfera de la tierra y establece un ambiente propicio para el metabolismo oxidativo y dar paso al surgimiento de organismos más complejos, los eucariotes (Figura 1 LECA de las siglas en inglés equivalentes al último ancestro común de los eucariotes).Hace 1300 millones de años sucede un evento por medio del cual la fotosíntesis oxigénica aparecerá en los eucariotes. Una cianobacteria es fagocitada por un eucariote, se indigesta y se inicia la evolución del organelo fotosintético de los eucariotes que es el cloroplasto. Este evento se conoce como la primera endosimbiosis y da origen a tres grandes grupos de eucariotes fotosintéticos, las algas glaucofitas, las algas verdes y las algas rojas. Estos nuevos socios de las cianobacterias ayudan a elevar más la concentración del oxígeno en la atmósfera. Fue tal el éxito de estos nuevos organismos que Lynn Margulis afirma [2], “Antes del Cámbrico las cianobacterias tuvieron sus días de abundancia, diversidad y dominio sobre el paisaje terrestre. Su declinación de dominio fue probablemente debido a muchos factores, el no menos importante fue el gran éxito de las algas y las plantas que las sucedieron”.
Entre 500-450 millones de años, un organismo cercano a las algas verdes, salta a la superficie terrestre (Figura 1) y se inicia la colonización de la misma lo que permitirá ahora a los animales poblarla ya que contarán con productores primarios para su sustento. En el mesozoico se llevan a cabo varias endosimbiosis, esta vez un organismo eucariote no fotosintético endocita a un eucariote fotosintético y aparecen las algas como Diatomeas, algas pardas o kelps
MENSAJE BIOQUÍMICO, VOL. XL (2016)
286
y dinoflagelados. Estos organismos provienen de distintas endosimbiosis inclusive de endosimbiosis sucesivas. A diferencia de la primera endosimbiosis en que todos los organismos provienen de un solo evento por lo que algas glaucofitas, algas rojas, algas verdes y plantas son monofiléticas. Finalmente, para terminar con el relato de la aparición histórica de los productores primarios, quiero mencionar la invención de la agricultura. Esta se ilustra en la Figura 2 con los tres granos representativos y la participación de tres grandes civilizaciones. En el medio oriente con los Sumerios en la Desembocadura del Tigris y Eufrates, el nacimiento del trigo y probablemente del lino. En el valle del Yan Tze Quian la aparición del arroz. En Meso-América en el Valle del río Balsas la domesticación del maíz [3] y en algún lugar de Meso-América el algodón. Son las tres civilizaciones que en forma original y sin comunicación entre ellas inventan la agricultura, esencial para el establecimiento del ser humano a lo largo de todo el planeta.
Figura 2. Los productores primarios al servicio de la especie humana. Mural de las ruinas de Cacaxtla, Tlaxcala. La planta del maíz a la izquierda, con mazorcas humanas y planta del cacao. Con el Dios del maíz al centro, abajo izquierda espigas de trigo y al centro abajo planta de arroz. La invención de la agricultura tuvo tres sitios primarios: En Sumeria, en el valle del Tigris y el Eufrates, cuna del trigo; En China en el valle del río Yangtse, cuna del arroz y en el valle del Balsas, cuna del maíz (Piperno DR et al. 2009 Starch grain and phytolith evidence for early ninth millenium B.P. maize from the Central Balsas River Valley, Mexico PNAS 106:5019-24).
Gómez Lojero C y Gutiérrez Cirlos Madrid EM
287
La fotosíntesis oxigénica en cianobacterias En la fotosíntesis oxigénica encontramos dos tipos de reacciones, las
luminosas y las oscuras (Figura 3). Las reacciones luminosas tienen como sustratos químicos al agua (donador de electrones) y al NADP+ (aceptor de electrones) al ADP y al Pi (esenciales para la transferencia de energía) e impulsados en su transformación a productos por la energía de 8-10 cuantos de luz. Los productos son el oxígeno proveniente de la oxidación del agua, el NADPH que se redujo con electrones activados en el proceso y el ATP sintetizado por la fuerza protomotriz. Las enzimas que llevan a cabo las reacciones luminosas se localizan en la membrana tilacoidal (que son pequeños sacos intracelulares).
2H2O + 2NADP+ + 2.5ADP + 2.5Pi + 8hν NADPH + 2H+ + 2.5ATP + 2.5H2O + O2
Las reacciones obscuras utilizan los productos de la fotosíntesis luminosa
para fijar y reducir al bióxido de carbono y transformarlo en carbohidrato.
CO2 + 2NADPH + 2H+ + 3ATP + 2H2O CH2O + 3ADP + 3Pi + 2NADP+
Las enzimas del Ciclo de Calvin que llevan a cabo la fase obscura de la
fotosíntesis se encuentran en el citoplasma. La enzima Rubisco, fijadora del bióxido de carbono, se encuentra organizada en múltiples copias en una subestructura llamada Carboxisoma.
Figura 3. Las reacciones de la fotosíntesis oxigénica se separan temporal y espacialmente en reacciones luminosas y reacciones obscuras. Los sustratos de la fase luminosa son: El agua (H2O), el nicotín adenín dinucleótido fosfato (NADP+), el difosfato
MENSAJE BIOQUÍMICO, VOL. XL (2016)
288
de adenosina (ADP), el fosfato inorgánico (Pi) y los fotones de luz. Con excepción de la luz, estos reactivos son productos de las reacciones obscuras. Los productos de las reacciones luminosas, con excepción del oxígeno, son los sustratos de las reacciones obscuras. NADP+ reducido (NADPH), adenosin trifosfato (ATP), bióxido de carbono (CO2) y oxígeno (O2). Las reacciones obscuras incluyen el ciclo de Calvin o de fijación de bióxido de carbono. El producto orgánico que almacena la energía absorbida en el proceso representa cerca de la sexta parte de la molécula de glucosa (C6H12O6/6).
El esquema zeta de las reacciones luminosas
Las reacciones luminosas de la fotosíntesis las llevan a cabo dos
fotosistemas (FS, de aquí en adelante) conectados por una cadena de transporte
de electrones y una ATP sintasa impulsada por un corriente de protones. El
gradiente de protones es generado por los fotosistemas y el complejo b6f,
transportador de electrones. La Figura 4 muestra el llamado esquema Z de la
fotosíntesis oxigénica. Del lado izquierdo del esquema aparece el FSII que genera
un oxidante poderoso cuyo potencial redox es mayor al del agua, lo cual le
permitirá tomar los electrones de la misma. Los electrones enriquecidos por la
energía del fotón, serán llevados al complejo de citocromos b6f, por la
plastoquinona (PQ), acarreador de hidrógenos en el interior de la membrana. El
complejo b6f, transfiere electrones a la plastocianinina (PC) que cederá los
electrones al FSI. El FSI, en el lado derecho del esquema, genera un reductor
poderoso que a través de una cadena de centros fierro azufre (FeS) hará llegar los
electrones al NADP+ que los distribuirá en el citoplasma para las reacciones de
biosíntesis que requieren de poder reductor [4].
Figura 4. El llamado esquema Z (al girarlo 90 grados resultó una N). Muestra dos fotosistemas en serie conectados por una cadena de transporte de electrones, una plastoquinona (PQ), un complejo de citocromos b6f y la plastocianina (PC). El fotosistema
Gómez Lojero C y Gutiérrez Cirlos Madrid EM
289
II (FSII), a la izquierda, genera un oxidante poderoso que eventualmente jala los electrones del agua. El asterisco (*) significa un electrón excitado del par especializado del FSII. El fotosistema I, derecha (FSI) genera un reductor poderoso que recibirá la ferredoxina (Fd) y que se estabilizará al pasar por intermedio de la ferredoxin NADP+ reductasa (FNR) al NADPH.
Los cuatro complejos de las reacciones luminosas y su ubicación en la
membrana tilacoidal
La Figura 5 muestra un esquema que contiene los cuatro complejos que
llevan a cabo las reacciones de la fotosíntesis luminosa incorporados en una
caricatura del tilacoide de cianobacteria. El FSII muestra en la parte externa del
tilacoide al ficobilisoma (PBS), la antena cosechadora de luz, en la mayoría de las
especies de cianobacterias. En el interior del tilacoide (lado p ó +), se liberan los
protones provenientes de la oxidación del agua por el FSII, en el lado externo
(lado n o -), se toman protones por la PQ al ser reducida en el FSII. La oxidación
del plastoquinol en el lado “p” del tilacoide por dos aceptores de electrones el
citocromo b6 y la proteína fierro-azufre, libera protones nuevamente en lado “p” del
tilacoide. En el lado “n” hay una reducción de la quinona como parte del ciclo Q y
la concomitante captura de protones para regenerar una molécula de quinol. La
toma de protones del lado “n” y su depósito del lado”p” contribuyen a generar el
gradiente de protones que impulsa la síntesis de ATP [5].
Figura 5. Representación esquemática en una porción del tilacoide de los cuatro complejos de, que llevan a cabo las reacciones luminosas de la fotosíntesis oxigénica en cianobacteria. Se incluye al FSII a la antena cosechadora de luz al ficobilisoma en la
MENSAJE BIOQUÍMICO, VOL. XL (2016)
290
superficie del tilacoide adyacente. Fotones (h), ficobilisomas (PBS), fotositema II (FSII), lado n (-) donde se toman los protones y lado p (+) donde se depositan los protones que generan el gradiente protomotriz, complejo de citocromos b6 y f (b6f), citocromo c soluble (Cit c6), fotosistema I (FSI), ATP sintasa (sint).
El fotosistema II, generador de oxidante poderoso
El FSII ha sido estudiado por difracción de rayos X a partir de cristales de
dos diferentes cianobacterias [6,7]. El FSII cristaliza como un dímero, está
representado en la Figura 6. La reacción catalizada por el FSII en la membrana
tilacoidal es la siguiente:
2H2O + 2PQ + 4H+N + 4hν 2PQH2 + 4H+
P + O2
Cuatro fotones en forma sucesiva y pausada excitan un electrón del par
especializado de clorofila a, los electrones desprendidos del par especializado
fluyen a través de la feofitina a una plastoquinona fija para formar una
semiquinona (PQ.-) de esta molécula, a través del Fe pasa a la otra plastoquinona
(PQ) que recibe en forma sucesiva dos electrones y toma del lado n de la
membrana dos protones para formar plastoquinol (PQH2). Dos plastoquinoles son
los productos del FSII provenientes de la oxidación de dos moléculas de agua. La
primera plastoquinona solo se reduce con un electrón y está fija en la proteína, la
segunda se reduce con dos hidrógenos y se disocia de su sitio activo para llevar el
poder reductor al complejo de citocromos b6f. La reposición de los electrones
desprendidos del par especializado se hace a través de la tirosina y provienen del
sistema oxidante del agua. El sistema oxidante del agua tiene entre sus
componentes 4 manganesos y un calcio y forman un centro que puede acumular
cuatro equivalentes de oxidación, pero no de carga ya que disocia sucesivamente
cuatro protones del lado p del tilacoide. Una vez acumulados esos cuatro
equivalentes de oxidación, en un evento único y concertado, se rompen dos
moléculas de agua restituyendo los electrones y protones y liberando una
molécula de oxígeno que fluye como gas que es. El que el producto de la
oxidación del donador de electrones sea un gas constituye otra ventaja de la
fotosíntesis oxigénica sobre la fotosíntesis anoxigénica en la que se acumula el
producto de la oxidación ya sea azufre elemental o sulfatos [8].
Gómez Lojero C y Gutiérrez Cirlos Madrid EM
291
Figura 6. Representación molecular del FSII (Pymol A-E, Rasmac F), PDB id del dímero 1IZL y del monómero 3BZ1. A. Representación de superficie del dímero de FSII. B. Representación en cilindros de las subunidades del monómero del FSII y por esferas de los grupos prostéticos del corazón del FSII. C. Representación en cilindros de las dos subunidades que forman el corazón del FSII. D. Representación de las subunidades del corazón y de las dos subunidades que conforman la antena proximal del FSII. Vista desde el citoplasma a la membrana tilacoidal. E. Representación, vista desde el citoplasma, de los componentes del corazón (esferas, barras y bolas) y las clorofilas de la antena proximal (barras) del FSII. F. Componentes del Centro de Reacción del FSII. De abajo hacia arriba: esferas, el sistema liberador de oxígeno, en barras la tirosina y el dímero especializado de clorofila a, en bolas y barras clorofilas, en esferas feofitinas y en la parte superior de izquierda a derecha plastoquinona (barras) Fe (esfera) y plastoquinona esferas y barras.
En el complejo de citocromos b6f, la diferencia en la energía de óxido-
reducción entre plastoquinol y citocromo c6 o plastocianina se emplea para
generar gradiente de h+, mediante el ciclo q.
Los hidrógenos acarreados por el plastoquinol que disoció del FSII son
recibidos por el complejo b6f [9] en forma muy peculiar. El PQH2 es oxidado por la
proteína fierro azufre (FeS) de Rieske en el sitio PQP, tomando de la molécula un
solo electrón y transformándola en semiquinona PQ.-, el sitio donde se lleva a cabo
esta reacción esta en la interfase p de la membrana tilacoidal por lo que los
protones provenientes del plastoquinol son depositados de ese lado de la
membrana. La semiquinona es oxidada por el hemo bL y se disocia la
plastoquinona (PQ) del sitio PQP. La FeS proteína que tiene movilidad, lleva el
electrón al citocromo f el cual lo cederá a la plastocianina o al citocromo c6 (ver
MENSAJE BIOQUÍMICO, VOL. XL (2016)
292
distancia entre FeS y hemo f en la Figura 8). El electrón cedido al bL pasa de este
al bH y probablemente a través de hemo x llegue a la PQN generando una
semiquinona. El proceso se repite nuevamente, entra el segundo PQPH2, sus
electrones se bifurcan hacia el citocromo f y hacia el bL mediando la PQ.- y los H+
son depositados hacia el lado P de la membrana. Es fundamental señalar que los
potenciales parciales de PQH2/PQ son de valores muy diferentes, para PQ.-/PQH2
es de +200 mV y para PQ/PQ.- es de -200 mV [10]. El potencial de la proteína
FeS es mayor por lo que no hay problema en su reducción, sin embargo, el
potencial del bL es negativo pero el potencial de la semiquinona generada es aún
menor. Esta bifurcación de los dos electrones del plastoquinol que son
aprovechados para reducir a sus vecinos y distribuir a los protones en ambos
lados de la membrana es una característica del llamado ciclo Q de los complejos
tipo bc [11]. Es fundamental que el complejo de citocromos b6f esté como dímero
para ser activo ya que la proteína FeS de cada monómero está orientada hacia el
monómero que se encuentra frente a ella y no ve hacia el monómero al que esta
estructuralmente unido (ver Figura 7B). La reacción que cataliza el complejo de
citocromos b6f que incluye al ciclo Q, es la siguiente:
2PQPH2 + 2PCox + PQn + 2H+N 2PQp + 2PCred + PQnH2 + 4H+
p
el nombre de la enzima es plastoquinol:plastocianina óxidoreductasa
Figura 7. Representación molecular del complejo de citocromos b6f (Pymol) PDB ID 2E76. A. Representación en superficie del dímero. B. Representación de superficie del monómero, señalando las cuatro subunidades proteícas mayores del complejo: citocromo b (Cit b6) arriba e izquierda, Subunidad IV (S. IV) lado derecho, citocromo f (Cit f) parte inferior y hacia dentro la fierro azufre proteína de Rieske (FeS). Del lado izquierdo del
Gómez Lojero C y Gutiérrez Cirlos Madrid EM
293
dímero en esferas y barras los grupos protéticos del complejo. C. Grupos prostéticos del dímero representados en esferas.
Figura 8. Los grupos prostéticos del b6f.: Se muestran dos sitios de PQ uno a cada lado de la membrana. El sitio PQP con afinidad para plastoquinol (PQH2) está cercano al hemo bL, el sitio PQN está cercano al hemo bH y tiene una mayor afinidad por la plastoquinona (PQ). Algo que resultó una sorpresa, cuando se tuvo la estructura del b6f, fue la presencia de un hemo de tipo c entre el hemo bh y el sitio PQN ya que no se encuentra en el análogo mitocondrial (bc1). El grupo prostético de la proteína de Rieske es el centro fierro azufre
Fe2S2) en la Figura FeS. Proteína móvil unida al complejo por una sola hélice. En la parte inferior se observa al hemo f, aceptor final de los electrones en el complejo. Además
se observan una clorofila a (Clor) y -caroteno (Car) que al parecer solo juegan un papel estructural. En la parte inferior queda de manifiesto la función del complejo b6f de transferir electrones del PQH2 al citocromo c o a la plastocianina (PC) y de depositar H+ del lado p y tomar protones del lado n.
El fotosistema I, generador de un reductor poderoso
Los dos polipéptidos que forman el andamiaje del CR del FSI [12] son muy
grandes de alrededor de 730 aminoácidos. Cada polipéptido tiene 11 cruces trans-
membrana representados por cilindros perpendiculares a la superficie de la
membrana. Uno de los polipéptidos tiene los colores ciano y rojo y el otro azul y
verde. El dominio del carboxilo terminal tiene los cinco cruces transmembranales
que son homólogos a los andamios del FSII, están de color rojo y azul, las
restantes seis hélices de cada polipéptido corresponden a los cruces
transmembranales homólogos a el de las antenas proximales del FSII (Figura 9D).
Sin embargo, el número de clorofilas a que se observan a los lados del CR del FSI
son 50 clorofilas a de cada lado (Figura 9E) a diferencia de las subunidades del
MENSAJE BIOQUÍMICO, VOL. XL (2016)
294
FSII que cada una tiene alrededor de 13 clorofilas a (Figura 6E). El centro de
reacción del FSI se muestra en la Figura 9F. En la estructura de los centros de
reacción, el donador inicial de electrones también cuenta con un par especializado
(en barras azul y rojo) pero de un epímero de clorofila a, que se muestra en la
Figura en la base de la misma en representación de espacio lleno. Los
componentes que van en el camino del electrón son dos clorofilas del par
especializado, en esferas y barras verdes que ceden el electrón a la filoquinona
(naftoquinona). Los componentes anaranjados y amarillos son núcleos Fe4S4 fijos
en las proteínas por medio de enlaces con el azufre de cisteínas. Estos son los
aceptores finales del electrón del FSI.
La reacción catalizada por el FSI es la siguiente:
PCred (o Cit c6red) + Fdox+ + hν PCox + Fdred
El sitio donde se encuentra la plastocianina es el espacio intratilacoidal, o
lado P y del lado N de la membrana o espacio del citoplasma de la cianobacteria
se encuentran los centros FeS que reducen a la Fd. El nombre enzimático del FSI
es plastocianina:ferredoxina óxido-reductasa impulsada por la luz. El poder
reductor generado por los dos fotosistemas en tandem se estabiliza en forma de
NADPH mediante la reacción catalizada por la FNR [13] y puede ser distribuido en
el citoplasma para las reacciones de biosíntesis.
Figura 9. Representación molecular del FSI (en Pymol y Rasmac PDB id 1JBO). A. Trímero del FSI, es la forma más frecuente que se encuentra en cianobacteria. En cloroplastos se encuentra como monómero. Vista desde el lado citoplásmico de la membrana tilacoidal. B. Representación en superficie de Pymol, el monómero de FSI,
Gómez Lojero C y Gutiérrez Cirlos Madrid EM
295
vista lateral. C. Representación (también en vista lateral) del monómero de FS1, en
cilindros, las hélices y en esferas atómicas los grupos prostéticos del CR del FS1. D. Representación en cilindros de las subunidades que integran el centro de reacción, subunidades A1 y A2, en esferas, los grupos prostéticos del CR. Los cilindros más obscuros tienen homología, al menos estructural con las subunidades que sirven de andamio a los grupos prostéticos del CR del FSII. E. Vista desde el citoplasma de los grupos protéticos del CR, en esferas y las clorofilas a (en barras) que forman la antena y están integradas a las mismas subunidades A1 y A2. F. Centro reacción del FSI: De abajo hacia arriba el par especial de un isómero de clorofila a, representado en barras, le siguen dos pares de clorofila a, la primera representada en esferas y la segunda en barras, más arriba dos filoquinonas fijas (en esferas) y rematando hacia arriba tres cubos de FeS del tipo Fe4S4 representados en esferas.
La ATP sintasa, un motor molecular impulsado por la corriente de protones,
transforma al gradiente electroquímico de protones en ATP.
La ATP sintasa tiene dos componentes (Figura 10 A), un componente
intrínseco de membrana, el F0, constituido por la subunidad a, la subunidad b y el
anillo formado por subunidades c (14 en el caso de la espinaca) y un componente
extrínseco de la membrana llamado F1 formado por 3 subunidades y tres
subunidades que conforman una dona (lo que se aprecia mejor en la Figura
11A). En su interior se encuentra la subunidad que se extiende hasta el anillo c al
cual se fija mediante la subunidad [14]. La subunidad también de la F1, fija a la
dona a las subunidades b [15]. Los componentes del motor son el rotor y el
estator. El rotor, ilustrado en el formato de superficie de Pymol en la Figura 10B,
está formado por el anillo de las subunidades c, la subunidad y la subunidad . El
estator, parte fija del motor, ilustrado en el formato de cilindros en la misma Figura
10B, lo forman la dona de las seis subunidades y en forma alterna. Por medio
de la subunidad la dona queda fija a las subunidades b que penetran al interior
de la membrana e interaccionan con la subunidad a. La circulación de protones se
inicia al ingresar estos por el lado P a un canal ciego que los conduce a la parte
media de la membrana donde está el carboxilato del ácido glutámico que se
encuentra en la parte media de la subunidad c (Figura 10C). Esto permite a este
residuo que tenía carga negativa moverse al interior de la membrana. Uno a uno
van entrando los protones que neutralizan la carga negativa del glutamato y hacen
girar al anillo de subunidades c. En el caso de espinaca cuyo anillo lo constituyen
14 subunidades c, se requerirá ese mismo número de protones para completar el
giro del rotor en la membrana. La subunidad unida al anillo, como flecha,
transmite la acción a las subunidades donde se encuentra el sitio activo que
lleva a cabo la síntesis y liberación del ATP. Finalmente, el protón abandona la
subunidad c en el canal que está abierto en el lado N. Tres ATPs se forman por
MENSAJE BIOQUÍMICO, VOL. XL (2016)
296
vuelta completa del rotor, o sea que los tres sitios activos van a estar ocupados
sucesivamente por ADP, ATP y uno vacío al disociar el ATP y volver a iniciar el
ciclo, ver Figura 11C. Las subunidades tienen permanentemente ATP como se
puede apreciar en la misma Figura [16].
Figura 10. Representación molecular de la ATP sintasa de Paracoccus denitrificans. PDB id. 5DN6. A. La Fo y F1 de P. denitrificans en representación de superficie de Pymol. B. Componentes del motor molecular que es la ATP sintasa. En este modelo se resalta al inmovilizador en cilindros el estator y en representación de superficie al rotor. Además se
muestra un inhibidor (inh) en representación de superficie unido a la subunidad de la F1. C. Subunidad c componente unitario del anillo del rotor, en liston y en esferas el glutámico clave para la corriente de H+.
Figura 11. A. Vista de la F1 de bovino del lado de la matriz de la mitocondria,
representada en cilindros, PDB id. 1BMF. Se aprecia la alternancia de las subunidades
y siendo estas últimas donde se encuentran los sitios catalíticos. B. Se muestran en
Gómez Lojero C y Gutiérrez Cirlos Madrid EM
297
esferas los nucleótidos trifosforilados en las tres subunidades y en una , la otra
subunidad contiene ADP y la última no está ocupada. La estructura apoya el mecanismo catalítico en el cual las tres subunidades catalíticas están en diferente estado del ciclo catalítico en cada momento. C. PDB id. 4YXW. Se muestra en esferas la ocupación de los
sitios catalíticos (subunidades ) por ATP, ADP y tiofosfato lo que demuestra del mecanismo secuencial en la síntesis de ATP.
Digresión acerca del tecuitlatl y la espirulina
Para seguir con el reloj biogeológico, hace cerca de 40 años, empezamos
nuestro estudio de la fotosíntesis con una cianobacteria autóctona y famosa desde
tiempos prehispánicos. En aquel entonces se le conocía como espirulina y su
nombre taxonónomico era Spirulina maxima y para los aztecas era el Tecuitlatl.
Alrededor de los años noventa se le cambió el nombre al de Arthrospira maxima.
En la época moderna quien trajo a la luz de los científicos la identidad del tecuitlatl
con la espirulina fue Dr W.V.Farrar [17] con su artículo Tecuitlatl: a glimpse of
aztec food technology, en la revista Nature. Su primera fuente fue "La historia
antigua de México" de Francisco Javier Clavijero, en el párrafo 64 [18], “Alimentos
de los mexicanos” señala que: “porque habiendo vivido por tantos años aislados
en el lago los obligó su miseria a alimentarse de cuanto se criaba en aquellas
aguas….Comían no solo de las cosas vivientes, sino aún de cierta sustancia
limosa que sobrenadaba en el lago, la cual recogían, secaban un poco al sol y
hacían de ellas unas tortas que volvían a secar y guardaban para que les sirviese
de queso cuyo sabor remeda. Daban a esta sustancia el nombre de tecuitlatl
(excremento de piedra)”. De allí, el Dr. Farrar cita a los cronistas de la conquista
de la gran Tenochtitlan, transcribe los párrafos referentes en español y su
traducción al inglés: El franciscano fray Toribio Benavente “Motolinía” en sus
Memoriales (1541-1546) comenta: “críanse sobre el agua de la laguna de Méjico
unos como limos muy molidos, y a cierto tiempo del año que están más cuajados,
cógenlos los indios con unos rejoncillos de malla muy menuda, hasta que hinchen
los acales o barcos de ellos, y en la ribera hacen sobre la tierra o sobre arena
unas eras muy llanas con su borde de dos o tres en largo y poco menos de ancho,
y échanlos allí a secar; echan hasta que se hace una torta de gordor de dos dedos
y en pocos días de secar hasta quedar en gordor de un ducado escaso; cortada
aquella torta como ladrillos anchos, cómenlo mucho los indios y tiénese por
buenos anda esta mercaduría por todos los mercaderes de la tierra, como entre
nosotros los que son de la salsa de los indios es bien sabroso, tiene un saborcillo
de sal” [17].
Francisco Hernández (1550-1560), médico naturista enviado por el Consejo
de las Indias para reportar acerca de la flora y minerales de la nueva España y su
MENSAJE BIOQUÍMICO, VOL. XL (2016)
298
posible explotación económica. En el capítulo XIV de “minerales” refiere: “brota el
tecuitlatl, que es muy parecido al limo en algunos sitios del vaso del lago mejicano
y gana al punto la superficie de las aguas de donde se saca o barre con redes o
se apila con palas. Una vez extraído y secado un poco al sol, le dan los indios
forma de pequeñas tortas; se pone otra vez y sobre yerbas frescas hasta que se
seca perfectamente, y se guarda luego como queso por solo un año. Se come
cuando es necesario con maíz tostado con las comunes tortillas de los indios.
Cada venero de este limo tiene su dueño particular, a quien rinde a veces una
ganancia de mil escudos de oro anuales. Tienen sabor de queso y así le llaman
los españoles, pero menos agradable, pero con cierto sabor a cieno; cuando
reciente es de color azul o verde; ya viejo es de color de limo verde tirando a
negro, comestible solo en muy pequeña cantidad, y resto en vez de sal o
condimento de maíz. En cuanto a las tortas que hacen de él, son alimento malo y
rústico, de lo cual es buena prueba el hecho de los españoles, de que nada
desaprovechan de lo que sirve al regalo del paladar, sobre todo en estas tierras,
jamás han llegado a comerlas”.
Francisco López de Gómora en su obra “Historia general de todas las Indias
con todo el descubrimiento y cosas notables que han acaecido desde que se
ganaron hasta el año 1551” y aún tierra: porque con redes de malla menuda
abarren en cierto tiempo del año una cosa molida que se cría sobre el agua de las
lagunas de Méjico, y se cuaja, que ni es yerba ni tierra, sino como cieno. Hay dello
mucho y cogen mucho; y en eras como quien hace la sal, lo vacían y allí se cuaja
y seca. Hácenlo tortas como ladrillos, y no solo las venden en el mercado, mas
llévanlas también a otros fuera de la ciudad y lejos. Comen esto como nosotros el
queso y así tiene un saborcillo de sal, que con chilmolli es sabroso. Y dicen que
este cebo viene tantas aves a la laguna, que muchas veces por invierno la cubren
por algunas partes [17].
Bernal Díaz del Castillo terminó en 1568 su “Historia verdadera de la
conquista de la Nueva España”, refiere al hablar del mercado de “Tlaltelulco” “y
otros vendían unos panecillos que hacen de una como lama que cogen de aquella
gran laguna, que se cuaja y hacen panes de ello que tienen un sabor a manera de
queso” [17].
En la relación de Juan Bautista de Pomar Tezcoco 1582 “ya se había dicho
en el cap. XII de esta relación que entre esta ciudad y la de Mejico esta una
laguna, de lo cual lo hay que decir es que de su propiedad y naturaleza y es muy
amarga y muy peor, sin comparación que la de la mar. y con ser grande su hondo,
Gómez Lojero C y Gutiérrez Cirlos Madrid EM
299
a respecto de las grandes y muchos ríos de agua dulce que en ella entran, no se
mejora ni se convierte en la dulzura de ella, antes de esta y permanece siempre su
amargura natural y lo otro aunque entran en ella ríos y que alguna vez crece por
muchas aguas, no sobrepuja de su ordinario arriba de una vara de medir (87cm).
Y sigue en la relación de Juan Bautista de Pomar Tezcoco 1582 •252. “y un
género de comida que llaman tecuitlal”, que hacen de unas lamas verdes que cría.
Lo cual hecho tortas y cocido queda con un color verde oscuro que llaman los
españoles “queso de la tierra” [17].
Fray Bernardino de Sahagún (1558-1585), autor de las cosas de la Nueva
España hablando de las sabandijas que comían los indios dice: “hay unas urronas
que se crían sobre el agua que se llaman tecuitate, son de color azul claro,
después de que está bien espeso y grueso: cógenlo tiéndenlo en el suelo sobre
ceniza y después se hacen unas tortas de ello y tostadas las comen” [17].
Sin lugar a dudas la espirulina crecía en el lago de Texcoco y recientemente
se le encontraba en el El Caracol, evaporador solar de Sosa Texcoco (parestatal
extinguida por Salinas de Gortari). En El Caracol se concentraba por evaporación
al carbonato y bicarbonato extraído del sedimento del que había sido el lago de
Texcoco. El agua era alcalina y la espirulina tolera la alcalinidad hasta de pH 11,
esto le permite crecer como especie casi única ya que no hay muchos seres vivos
a esta condición y crece por lo tanto a cielo abierto. La espirulina puede hacer
vacuolas de aire que le permiten flotar y bañarse de la luz solar. La espirulina tiene
como pigmentos accesorios a la ficocianina y la aloficocianina ambos de color azul
por lo que los colores a los que se refieren arriba del tecuitlatl coinciden con estos
pigmentos y el otro pigmento abundante es la clorofila a que primero es verde y al
secarse u oxidarse se ennegrece.
Diversificación de la antena cosechadora de luz en las cianobacterias.
A. máxima es una cianobacteria filamentosa (Figura 12 A) que crece de
preferencia en medios alcalinos, sintetiza vacuolas de aire que le permiten flotar,
tiene como antena cosechadora de luz al ficobilisoma (FBS, Figura 12 B-E),
estructura macromolecular hemidiscoidal de peso molecular cercano a los
4,500,000 daltones, contiene ficociania (FC) y aloficocianina (AFC) como sus
proteínas pigmentadas y también tiene polipéptidos de unión que le permiten
ensamblar su estructura (19-21). El FBS, de acuerdo a las micrografías
electrónicas, (Figura12B) está formado por un corazón tricilíndrico (la forma se
puede apreciar en los modelos de las Figuras 5 y 12C vista lateral y 12D vista
desde abajo). Cada cilindro tiene cuatro trímeros de aloficocianina (Fig. 12A y B),
MENSAJE BIOQUÍMICO, VOL. XL (2016)
300
los trímeros centrales en forma asimétrica tienen en su composición al aceptor
final de energía del FBS (marcados como LCM Fig. 12D) y cada uno interacciona
con un monómero de FSII, destino final de la energía absorbida por el FBS. En los
extremos de los cilindros basales, los trímeros marcados como B también están
en forma asimétrica y donan la energía al FSI. Irradia del corazón o núcleo del
FBS seis brazos, cada uno de ellos formado por dos hexámeros de ficocianina
(Fig. 13A). El total de pigmentos que contiene un FBS de A. maxima son 288 (216
en los brazos de FC y 72 en el corazón de AFC). Cada protómero de AFC [22]
contiene dos ficocianobilinas (en cada subunidad proteíca). En la FC encontramos
tres ficocianobilinas una en la subunidad y dos en la subunidad . Cada
ficocianobilina está unida a su subunidad protéica por medio de una cisteína [23].
Los aminoácidos que rodean a cada cromóforo son los responsables de modificar
sus propiedades espectroscópicas de tal forma que la energía entre todos ellos
fluya para desembocar al aceptor final encargado de transferir la energía a las
clorofilas a de los fotosistemas. La característica de estos pigmentos es la de tener
gran capacidad de absorción y gran eficiencia en la transferencia de la energía. La
luz que aprovecha los FBSs de A. maxima es del anaranjado al rojo, que
encuentra en la superficie de su hábitat.
El hábitat de las cianobacterias está definido entre otras cosas por la
cantidad y calidad de luz que les llega y han diversificado sus pigmentos para
poder sobrevivir en esos ambientes. Por ejemplo, Gloeobacter violaceus [24-26]
habita en las paredes húmedas de cuevas o en aguas turbias donde llega poca luz
y tienen pigmentos capaces de absorber un espectro amplio del llamado visible. A
otras cianobacterias se les puede variar la calidad de luz de acuerdo a la variación
de los mares y la columna de agua actuar como filtro para determinados tipos de a
luz y han desarrollado una capacidad de aclimatación complementaria, como en
los lagos Fremyella diplosiphon y Tolypotrix [27] y en el mar, en la costa
Synechococcus 7335 [28,29] o en mayores profundidades Synechococcus
marinus. A mayores profundidades en las que solo penetra la luz azul, en el límite
de la zona fótica, la antena que han desarrollado las cianobacterias, no es con
pigmentos presentes en el FBS sino con divinil clorofila b como en la cianobacteria
más abundante Prochlorococcus marinus [30,31]. De esta adaptación a la calidad
de la luz que han desarrollado a través de la evolución, hablaremos en nuestra
charla.
Gómez Lojero C y Gutiérrez Cirlos Madrid EM
301
Figura 12. El Ficobilisoma, la antena cosechadora de luz de la cianobacteria Artrospira (Spirulina) maxima. La microscopía electrónica y la preparación de muestras para su observación fueron realizadas por el Dr. Alfonso Cárabez-Trejo en el Instituto de Fisiología Celular de la UNAM. A. Microfotografía electrónica de barrido de A. maxima. B. Micrografia electrónica con tinción negativa de una preparación de ficobilisomas de A. maxima. C Modelo de ficobilisoma de A. maxima, vista lateral. En el centro tres cilindros que forma el “core” o corazón del ficobilisoma. Cada cilindro está formado por 4 trímeros de aloficocianina. Irradiando del core hay seis brazos cada uno con dos hexámeros de ficocianina. Las Figuras geométricas representan los péptidos de unión (linkers) que permiten el ensamblaje de esta superestructura de 4 millones de daltones. En los dos extremos de los brazos basales se encuentra la enzima asociada al ficobilisoma, la FNR, descrita anteriormente. D. Vista desde abajo o sea desde la superficie de la membrana tilacoidal. Se aprecian los cuatro trímeros de cada cilindro del core, se señalan los dos
aceptores finales de energía del ficobilisoma con APC y LCM. E. Esquema que ilustra cómo podrían estar asociados los fotosistemas al ficobilioma. El FSII por medio del aceptor final
LCM y el FSI al otro aceptor final APC. Las flechas indican como la ferredoxina (Fd) acarrea electrones del FSI a la FNR en esta modelo tripartita.
Referencias 1. Des Marais DJ et al. (2008) NASA Astrobiology Roadmap. Astrobiology
8:715-730. 2. Margulis L. (1985) Cinco Reinos. Editorial Labor, S.A. 3. Ranere AJ, (2009) The cultural and chronological context of early Holoceno
maize and squash domestication in the Central Balsas River Valley, Mexico. PNAS (USA) 106:5014-5018.
MENSAJE BIOQUÍMICO, VOL. XL (2016)
302
4. González-Halphen D y Gómez-Lojero C (1982) Transducción distribución de Energía en las membranas fotosintéticas. BEB 2:4-19
5. Kramer D. M. et al. (2007) Dinamic flexibilityin the light reactions of photosynthesis governed by both electron and proton transfer reactions. Trends Plant Sci. 9:349-357
6. Kamiya N., Shen J.R. (2003) Crystal structure of oxygen-evolving photosystem II from Thermosynechococcus vulcanus at 3.7-A resolution Proc. Natl. Acad. Sci. 100:98-103
7. Guskov A. et al. (2009) Cyanobacterial phosystem II at 2.9-A resolution and the role of quinones, lipids, channels and chloride Nat. Struct. Mol.Biol 16:334-342
8. Gómez-Lojero C. (1984) Fotosíntesis: Desarrollo de Conceptos (Historia) En: Mensaje Bioquímico Saldaña de Delgadillo Y., Álvarez Llera G y Zentella de Piña M. vol. VII pp 267-302 Ed. Gómez-Lojero C. (1998) La Fotosíntesis, complejos de membrana. En: Mensaje Bioquímico Pardo Vázquez J.P., Juárez Oropeza. M.A., Morales López S. Y Martínez Montes F. Eds. vol. XXII:259-288
9. Yamashita E. Zhang, H Cramer W.A. (2007) Structure of the cytochrome b(6)f Complex: Quinone analogue inhibitors as ligands of Heme c(n). J.Mol.Biol. 370:39-52
10. Cramer W.A. et al. (2011) The Q cycle of citochrome bc complexes: a structure perspective BBA 1807:788-802
11. Palsdottir H. et al. (2003) Structure of the yeast cytochrome bc1 complex with a hydroxyquinone Anion Qo site inhibitor bound. The Journal of Biological Chemistry 278:31303-31311.
12. Jordan P. et al. (2001) Three-dimensional structure of cyanobacterial Photosystem I at 2.5 A resolution. Nature 411:909-917. Brunger A.T. et al. (2012) Improving the accuracy of macromolecular structure refinement at 7 A resolution. Structure 20:957-966
13. Gómez-Lojero C. et al. (2003) Interaction of Ferredoxin:NADP+ oxidoreductase with phycobilisomes and phycobilisome substructures of the cyanobacterium Synechococcus sp. PCC 7002. Biochemistry 47:13800-13811
14. Abrahams J.P. et al. (1994) Structure at 2.8 A resolution of F1-ATPase from bovine heart mitochondria. Nature 370:621-628
15. Morales-Rios, E et al. (2015) Structure of ATP synthase from Paracoccus denitrificans determined by X-ray crystalography at 4.0 angstrom resolution. Proc.Natl.Acad.Sci. 112:13231-13236.
16. Bason J. V. et al. (2015) How release of phosphate from mamalian F1-ATPase generates a rotatory substep. Proc.Natl.Acad.Sci. 112:6009-6014.
17. Farrar W.V. (1966) Tecuitlatl; A glimpse of Aztec food technology. Nature 211:341-342.
18. Francisco Javier Clavijero (Bolonia 13 de junio de 1780) Historia del México Antiguo. Editorial Porrua. Sepan Cuantos.
Gómez Lojero C y Gutiérrez Cirlos Madrid EM
303
19. Prado-Flores G. (1980) Ficobilisomas en Spirulina maxima. Tesis de Maestria en Ciencias (Bioquímica) Cinvestav-IPN
20. Gómez-Lojero C. et al. (1997) The phycobilisomes of the cyanobacterium Arthrospira (Spirulina) maxima. Int.J.Biochem.Cell.Biol. 29:1191-1205
21. Gómez-Lojero C. et al. (1997) The tricylindrical core of the phycobilisome of the cyanobacterium Arthrospira (Spirulina) maxima Int.J. Biochem.&. Cell.Biol. 29:959-970.
22. Reuter W. et al. (1999) Structural analysis at 2.2 A of orthorhombic crystals presents the asymetry of the allophycocyanin-linker complex, AP.LC7.8 from phycobilisomes of Mastigocladus laminosus Proc.Natl.Acad.Sci. 96:1363-1368.
23. Nield J. et al. (2003) The 1.45A three-dimensional structure of C-phycocyanin from the thermophilic cyanobacterium Synechococcus elongatus. J. Struct Biol. 141:149-155.
24. Gutiérrez-Cirlos E.B. et al. (2006) The phycocyanin-associated rod linker proteins of the phycobilisome of Gloeobacter violaceus PCC7421 contains unusually located rod-capping domains. Biochimica et Biophysica Acta 1754:130-134.
25. Krogmann D.W. et al. (2007) The presence of multidomain linkers determines the bundle-shape structure of the phycobilisome of the cyanobacterium Gloeobacter violaceus PCC 7421. Photosynth Res 93:27-43.
26. Mendoza-Hernández G. (2010) Interactions of linker proteins with the phycobiliproteins in the phycobilisome substructures of Gloeobacter violaceus Photosynth Res 106:247-261.
27. Pérez-Gómez B. et al. (2012) A proteomic aproach to the analysis of the components of the phycobilisomes from two cyanobacteria with complementary chromatic adaptation: Fremyella diplosiphon UTEX B590 and Tolypothrix PCC 7601. Photsynth Res 114:43-58.
28. Herrera-Salgado P. (2013) Caracterización inicial de Synechococcus PCC 7335, una singular cianobacteria diazotrópica con adaptación cromática complementaria. Tesis de Maestria en Ciencias (Bioquímica) Cinvestav-IPN.
29. Herrera-Salgado P. et al. (2016) Complementary Chromatic Acclimation in the cyanobacteria Synechcoccus PCC 7335. Abstract 12th Workshop on cyanobacteria Arizona State University.
30. Barrera-Rojas J. (2013) Supercomplejos y complejos de la fotosisntesis oxigénica en la cianobacteria Prochlorococcus marinus MIT 9313. Tesis de Maestria (Bioquímica) Cinvestav-IPN
31. Barrera-Rojas J. et al. (2016) Characterization of photosynthetic membrane complexes from Prochlorococcus marinus MIT 9313. Abstract 12th Workshop on cyanobacteria Arizona State University.
.
MENSAJE BIOQUÍMICO, VOL. XL (2016)
304
Semblanza del Dr. Carlos Gómez Lojero
Es Investigador del
Departamento de Bioquímica del
Cinvestav. Pertenece al Sistema
Nacional de Investigadores 1984-a la
fecha SNI 2. Estudios profesionales
1961-1966 Facultad de Medicina
UNAM Médico Cirujano. Estudios de
Postgrado 1966-1970 Facultad de
Química UNAM Dr. en Ciencias
Químicas. Postdoctoral
Departamento de Bioquímica
Cinvestav IPN 1971. Postdoctoral
Department of Physiology UCLA
1972-1973. Puestos Académicos:
Instructor alumno, Departamento de
Bioquímica, Facultad de Medicina
1963, Ayudante de Profesor
Departamento de Bioquímica,
Facultad de Medicina, 1964-1970,
Profesor de Asignatura Departamento de Bioquímica Facultad de Medicina 1974-
2006. Profesor adjunto Departamento de Bioquímica Cinvestav IPN 1974-1980.
Profesor visitante: Department of Biochemistry, Purdue University 1987,
Department of Biochemistry and Molecular Biology, Pennsylvania State University
1999, Department of Biochemistry, Dartmouth College 2002. Socio numerario
Sociedad Mexicana de Bioquímica A.C. (SMB). Socio Académico Academia
Mexicana de Ciencias. Secretario de SMB 1981-1983. Presidente de SMB 1985-
1987. Organización de Congresos 1979 y 1981 Rama de Bioenergética y
Biomembranas SMB. Y Congresos Nacionales SMB 1982 y 1986. 30 artículos con
comité editorial internacional.