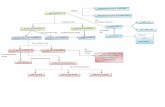
La materia. propiedades eléctricas
Transcript of La materia. propiedades eléctricas
FENÓMENOS ELÉCTRICOS
Desde la antigüedad, (Civilización griega), se
conocían los fenómenos de electrización, en
los que por frotamiento del ámbar con una
piel de gato se atraían trozos de pluma
Alguna vez frotando un bolígrafo con un
jersey has atraído pequeños trozos de papel
BENJAMÍN FRANKLIN
Consideró que la electricidad era un fluido que pasaba de
unos cuerpos a otros cuando eran frotados
Explicó además que existen dos tipos de electricidad que
llamó positiva y negativa
Cuando se acercan dos cuerpos con electricidad del mismo
signo, se repelen, si los cuerpos son de distinto signo se
atraen
EXPERIENCIA DE J.J. THOMSON
En 1897, Thomsonrealizandoexperiencias en tubosde descargas, en losque había gasesencerrados a bajapresión, descubrió queen los átomos existenunas partículas concarga eléctricanegativa, que fueronllamadas electrones
MODELO ATÓMICO DE THOMSON
Cómo la materia solamente presenta sus propiedades eléctricas en determinadas condiciones, debemos considerar que es neutra, y como la masa de los electrones es mucho menor que la de los átomos, el átomo debe ser como una gran masa positiva e incrustada en ella debían estar los electrones, en una cantidad tal, que compensaba la carga positiva
EXPERIMENTO DE RUTHERFORD
Bombardeando una
lámina muy delgada
de oro con partículas
alfa (α), procedentes
de la desintegración
del uranio, comprobó:
1. que la mayoría de las
partículas alfa atravesaban
la lámina como si estuviera
vacía.
2. Pocas partículas alfa eran
desviadas de la trayectoria
rectilínea
3. y menos aún eran rebotadas
EXPLICACIÓN DEL RESULTADO DEL
EXPERIMENTO DE RUTHERFORD
Como la mayoría de las partículas alfa,
positivas, atravesaban la lámina sin
desviarse, y solamente algunas eran
desviadas y muy pocas rebotaban,
Rutherford pensó que la causa de todo
estaba en que toda la carga positiva del
átomo se concentraba en una parte muy
pequeña del mismo
MODELO ATÓMICO DE RUTHERFORD
El átomo está formado porun una zona muypequeña, (núcleo), queconcentra toda la cargapositiva y casi toda lamasa del átomo
Los electrones se encuentran girando alrededor del núcleo describiendo órbitas circulares y en número tal, que compensan la carga positiva del núcleo
PARTÍCULAS FUNDAMENTALES QUE
CONSTITUYEN LOS ÁTOMOS
PROTONES. Partícula que tiene la mismacarga que el electrón, pero positiva, mientrasque su masa es unas 2000 mayor que la delelectrón. Se halla en el núcleo atómico
NEUTRONES. Partícula sin carga, con una masa similar a la del protón. Se halla en el núcleo atómico.
ELECTRÓN. Partícula con carga eléctrica negativa. Se encuentra en la corteza atómica, girando en órbitas.
NÚMEROS QUE CARACTERIZAN AL ÁTOMO
Número atómico, Z, indica el número de
protones que hay en el núcleo. (todos los
átomos del mismo elemento tienen el mismo
número de protones, mismo Z)
Número másico, A, es la suma de los protones
y de los neutrones que hay en un núcleo.
Cualquier elemento químico se representa de la
forma AzX, donde X es el símbolo del elemento
ISÓTOPOS
Se llaman isótopos a los átomos del mismo elemento
que poseen diferente número de neutrones. Por
tanto, tienen el mismo número de protones (mismo Z)
y diferente número de neutrones (diferente A)
126C y
146C, son isótopos, son dos átomos de C (con
6 protones), pero uno tiene 6 neutrones y el otro
tiene 8
146C y
147N, son dos átomos de elementos
diferentes, uno tiene 6 protones y el otro tiene 7
protones, aunque los dos tengan el mismo A
IONES
Es frecuente que, dos átomos de distintos
elementos se combinan para formar un
compuesto, lo hacen ganando o perdiendo
electrones
Cuando un átomo pierde electrones, adquiere
carga positiva y se convierte en un ión positivo
o catión
Cuando un átomo gana electrones, adquiere
carga negativa y se convierte en un ión
negativo o anión
RADIACTIVIDAD
Los núcleos de los átomos no cambian aunque los átomos estén implicados en reacciones químicas o transformaciones físicas
Sin embargo, los núcleos de algunos isótopos son inestables, y por ello pueden ganar o perder algunas partículas mediante un fenómeno que se conoce como radiactividad
También puede tener lugar la rotura de un núcleo en otros más pequeños en un fenómeno conocido como fisión nuclear
La unión de dos núcleos pequeños para formar un núcleo mayor, se conoce como fusión nuclear
En todos los casos antes expuestos, los núcleos de partida y los finales pertenecen a elementos diferentes
NATURALEZA DE LA RADIACIÓN EMITIDA
Cuando un núcleo emite radiación puede ser:
Radiación alfa (α). Son partículas que contienen 2 protones y dos neutrones. Tiene poco poder de penetración
Radiación beta (β). Formada por electrones. Tiene carga negativa. Tiene mayor poder de penetración que las partículas alfa
Radiación gamma (γ). No está formada por partículas, es parecida a los rayos X, pero contiene más energía que estos. Tiene gran poder de penetración
FISIÓN NUCLEAR
Algunos núcleos de isótopos radiactivos, de elementos que
tienen átomos con núcleos muy grandes, como el uranio o
el plutonio, se rompen dando lugar a núcleos de átomos
más pequeños
El proceso se inicia bombardeando el núcleo radiactivo con
partículas, (como los neutrones), además de los núcleos
más pequeños en la fisión se liberan otros neutrones que
rompen núcleos grandes, produciendo una reacción en
cadena y generando una gran cantidad de energía que se
puede aprovechar para generar electricidad en las centrales
nucleares o para fabricar bombas atómicas
FISIÓN NUCLEAR
La imagen representa la reacción en cadena de la fisión de un núcleo de uranio.
Durante la fisión, además de los neutrones emitidos y de los nuevos núcleos formados se desprende una cantidad enorme de energía que es utilizada en las centrales nucleares para producir electricidad
FUSIÓN NUCLEAR
Es el proceso por el que dos núcleos pequeños se unen para formar un núcleo mayor.
Este proceso produce menos residuos radiactivos
Tiene el inconveniente que se requieren cantidades elevadas de energía para que se produzcan (los átomos deben alcanzar millones de grados y eso solamente se obtiene en el Sol y las estrellas)
Por tanto, es el mecanismo de producción de energía de las estrellas
APLICACIONES DE LOS ISÓTOPOS RADIACTIVOS
Como fuentes de energía. En las centrales nucleares para producir electricidad. También en pilas de larga duración con plutonio 238, usadas en sondas espaciales o estaciones de difícil acceso
Aplicación en investigación. Para determinar la antigüedad de los materiales (p.e. C-14). Como rastreadores en reacciones químicas.
Aplicación médica. En métodos diagnósticos, se inyecta algún preparado al paciente con isótopos de baja energía y se observa su evolución. En métodos terapéuticos se utiliza la radiación del cobalto -60 para tratar distintos tipos de cánceres quemando y eliminando las células cancerosas
LOS RESIDUOS RADIACTIVOS
Todas las actividades en que se manejan isótopos radiactivos generan residuos (restos de material radiactivo así como todo los materiales que han estado en contacto con ellos). Los residuos requieren ser almacenados en instalaciones que no permitan la emisión al ambiente de radiaciones (cementerios nucleares)
Los residuos radiactivos son muy peligrosos y tienen una actividad duradera
Los residuos radiactivos son de baja y media actividad cuando la radiactividad que emiten deja de ser peligrosa para la salud pasados 300 años
Los residuos de alta actividad proceden de combustibles de las centrales nucleares y tardarán miles de años en dejar de ser peligrosos para la salud