Informe de Cromatografia
Transcript of Informe de Cromatografia

Universidad de Costa Rica
Escuela de Química
Laboratorio de Química Orgánica I QU-0213
I Ciclo Lectivo 2012
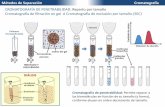
Cromatografía de tiza, capa fina y de columna
Esteban José Mejías Vargas B14047
Ana Laura
Tipo de Reporte: II
Profesor: Godofredo Solano
Asistente: Jorge Chaves
Introducción
La cromatografía es una técnica de separación que se basa una fase estacionaria y
una móvil (Harris, 2003). Con el fin de que los diversos componentes de una mezcla se
separen a través de la fase móvil, la cromatografía logra la separación de diversos
compuestos en diferentes estados de agregación, ya sea sólido-líquido, gaseoso-gaseoso
entre otros. La cromatografía es de suma importancia debido a su gran uso tanto en la
industria como en el campo de la salud y la biología, por lo que se busca con esta práctica
enseñar algunos tipos de cromatografía (como la de capa fina y columna).
En la práctica se lograron separar los pigmentos de extracto de espinaca y tomate,
además de comprobar la afinidad de algunos analgésicos en diferentes disolventes para la
cromatografía de capa fina, además de la cromatografía de tiza. El objetivo principal de la

práctica fue la separación e identificación de los principales compuestos de una mezcla
mediante la cromatografía.
Resultados
Cuadro I. Rf obtenido para cada sustancia diluida en 95% acetato de etilo – 5% ácido
acético. Prueba Incógnita 1 y 2. (Grupo Ana Laura).
Muestra Distancia (cm) Rf
Incógnita 1 3,5 1,2069
Incógnita 2 3,0 1,0344
Cafeína 3,3 1,1379
Aspirina 3,2 1,1034
Acetaminofén 2,0 0,6896
Ibuprofeno 2,1 0,7241
La distancia desde el punto de inicio hasta el frente de disolvente es de 2,9cm.
Cuadro II. Rf obtenido para cada sustancia diluida en 95% formato de etilo – 5% ácido
fórmico. Prueba Incógnita 1 y 2. (Grupo Ana Laura).
Muestra Distancia (cm) Rf
Incógnita 1 3,2 1,0667
Incógnita 2 3,7 1,2333
Cafeína 4,0 1,3333
Aspirina 3,7 1,2333
Acetaminofén 2,2 0,7333
Ibuprofeno ----- -----
La distancia desde el punto de inicio hasta el frente de disolvente es de 3,0cm.

Cuadro III. Rf obtenido para cada sustancia diluida en 95% acetato de etilo – 5% ácido
acético. Prueba Incógnita 1 y 2. (Grupo Esteban).
Muestra Distancia (cm) Rf
Incógnita 1 2,30 0,5897
Incógnita 2 3,90 1,0000
Cafeína 3,10 0,7949
Aspirina 3,30 0,8462
Acetaminofén 3,60 0,9231
Ibuprofeno 3,80 0,9744
La distancia desde el punto de inicio hasta el frente de disolvente es de 3,9cm
Cuadro II. Rf obtenido para cada sustancia diluida en 95% formato de etilo – 5% ácido
fórmico. Prueba Incógnita 1 y 2. (Grupo Esteban)
Muestra Distancia (cm) Rf
Incógnita 1 3,05 0,7820
Incógnita 2 3,80 0,9744
Cafeína 3,10 0,7949
Aspirina 3,80 0,9744
Acetaminofén 4,00 1,0256
Ibuprofeno 4,00 1,0256
La distancia desde el punto de inicio hasta el frente de disolvente es de 3,9cm
Cálculo Rf: d1
dd
=R f ,
donde d1 es la distancia de arrastre del compuesto y dd es la distancia entre la línea trazada
inferior y el frente de disolvente:
3,5 cm2,9 cm
=1,2069

Cuadro V. Resultados de cromatografía de tiza. Grupo Ana.
Disolventes Estructura Observaciones
Agua
No se da un arrastre notorio
de la tinta
Acetona
La tinta se desplaza más, sin
embargo no es tan
perceptible
Etanol
Se da un eficiente
desplazamiento de la tinta a
través de la tiza
Figura 1. Fotografía de la cromatografía de columna para el extracto de espinacas.

Cuadro VI. Cromatografía de tiza para cuatro marcadores de colores. (Grupo de Esteban)
Disolvente dd
(±0,5cm)
Color del marcador Distancia recorrida
(±0,5cm)
Rf
(1)
Agua 6,00
Azul 0,20 0,03
Verde 3,80 0,63
Rojo 5,00 0,83
Anaranjado 0,50 0,08
Acetona 6,20
Azul 5,60 0,90
Verde 5,50 0,89
Rojo 0,90 0,15
Anaranjado 5,30 0,86
Etanol 6,30
Azul 5,10 0,81
Verde 5,00 0,79
Rojo 4,30 0,68
Anaranjado 5,00 0,79
Discusión
Se procede a realizar la prueba de cromatografía de capa fina. La cromatografía de capa
fina consiste en la separación de los componentes de una mezcla a través de la migración
diferencial sobra cada capa fina de absorbente, retenida sobre una superficie plana
(Sharapin, 2000). Este tipo de cromatografía tiene aplicaciones similares a las de
cromatografía de líquidos. Se aplica para desarrollar las condiciones para las separaciones
en cromatografía de líquidos en alta resolución. La cromatografía tiene amplio uso en
laboratorios clínicos e industriales (Skoog, James & Crouch, 2008)
En este método de cromatografía hay dos tipos de fases, una móvil, que es el disolvente que
se colca en la cámara; y otra estacionaria que es donde se agregan las muestras. La
separación se logra porque algunas sustancias son más fuertemente retenidas por la fase
estacionaria, mientras que otras se desplazan mejor en la fase móvil (Bolaños, Herrera &
Luts, 2003).

Se toma una placa de cromatografía y se marca con un lápiz la línea base del nivel
de disolventes a 1cm del extremo inferior y luego otra a 1cm del extremo superior, que va a
ser la línea de frente de disolvente. En la línea de abajo se agrega una pequeña muestra de
cada sustancia en el siguiente orden (indicando en la placa):
1. Incógnita 1
2. Incógnita 2
3. Cafeína
4. Aspirina
5. Acetaminofén
6. Ibuprofeno
Luego se coloca la placa en una cámara de desarrollo con 15mL de 95% acetato de etilo –
5% ácido acético. Además, previo a colocar la placa se coloca un papel filtro que va a
generar una atmósfera controlada con el disolvente que se adicionó. Se deja la placa dentro
de la cámara hasta que el disolvente se desplace hasta el frente de disolvente. Luego se pasa
por una luz ultravioleta y por la cámara de yodo. Las láminas de yodo son sensibles a los
compuestos orgánicos que están en la placa y dan productos oscuros. En cuanto a la luz
fluorescente, los componentes de la muestra amortiguan la fluorescencia del material de tal
forma que toda la placa exhibe fluorescencia, excepto los lugares donde se encuentran los
componentes de la muestra (Skoog, James & Crouch, 2008). Se debe indicar dónde está la
máxima altura que llegó a alcanzar la sustancia aplicada al arrastrarse con el disolvente.
Luego se averigua el Rf y se comparan los resultados obtenidos. Esto se repite usando ahora
95% formato de etilo – 5% ácido fórmico.

(a) (b)
Figura 2. (a) Revelado con luz ultravioleta, (b) revelado con cámara de yodo.
Según lo que se aprecia en los cuadros de resultados, la incógnita 1 es cafeína pues
los valores de Rf de estos son los más similares en el disolvente que contiene acetato de
etilo, sin embargo con el formato de etilo la diferencia es mayor. En cuanto a la segunda
incógnita, el valor Rf al que más se acerca en ambos disolventes es al de la aspirina, donde
en uno difiere por 0,069 (en el acetato de etilo grupo Ana), mientras que en el otro
disolvente (el formato de etilo grupo Ana) no presenta ninguna diferencia pues ambos
alcanzan la misma altura. Sin embargo, los valores las incógnitas 1 y 2 en el formato de
etilo del grupo Esteban son más cercanos a sus identidades (aspirina e incógnita 2 son
iguales, mientras que la incógnita 1 y la cafeína presentan los valores más similares). En
cuanto a los valores obtenidos para el acetato de etilo del grupo Esteban, sucede lo mismo
que en los del grupo Ana donde se presentan leves diferencias. Sin embargo con la
incógnita 2 si se da una diferencia mucho mayor que en los otros cuadros.
Con este tipo de cromatografía, aunque posee diversas ventajas como la simplicidad
del equipo, el bajo costo y la rapidez; también se presentan ciertos problemas que conllevan
a errores y a valores muy variados entre sustancias similares como el hecho de que el
disolvente no migre de manera regular, o el tiempo que transcurre entre el revelado y la
lectura de la placa. La presencia de manchas puede deberse a la aplicación de sustancias en
baja concentración que necesitan de la aplicación de un volumen mayor de la solución que
se va a analizar (Sharapin, 2000). Todo esto puede afectar la eficiencia de esta técnica y por
esa razón los valores obtenidos difieren un poco entre sí.

En cuanto al uso de disolventes, deben buscarse aquellos más volátiles para que se
evaporen antes de ingresar las placas a la cámara de yodo y así evitar manchas que generen
incertidumbre sobre donde está la marca de la muestra. Además, se debe tomar en cuenta la
polaridad de este y la acidez o basicidad (Walton & Reyes, 1983).
(a) (b)
Figura 3. Estructuras disolvente A. (a) Acetato de etilo, (b) ácido acético (Wolfram Alpha,
2012).
(a) (b)
Figura 4. Estructuras disolvente B. (a) Formato de etilo, (b) ácido fórmico. (Wolfram
Alpha, 2012).
Las estructuras demuestran que el formato de etilo – ácido fórmico posee puntos de
ebullición menores debido al metilo menos que posee en comparación con Acetato de etilo
– ácido acético, lo que además, lo vuelve más volátil y por ende mejor disolvente.
Con la cromatografía de columna se basó en la utilización de diversos filtros para la
separación de los diversos pigmentos pertenecientes a la hoja de espinaca y extracto de
tomate. Se utilizó el gel de sílice ya que la filtración por gel produce una serie de poros de
diferentes tamaños, por lo que las moléculas más pequeñas pueden atravesar los diversos
poros y recorrer mucha mayor longitud dentro del tubo que las moléculas más grandes
(Watson, 2005). Para la espinaca se observó (ver Figura 1) que la molécula que realizó el
mayor recorrido es el pigmento amarillo, seguido de diversas tonalidades de verde. Como
describe Oñate (2010) las hojas de espinaca poseen 4 pigmentos básicos, las xantofilas
(pigmento amarillo), carotenos (pigmento naranja) y las clorofila A y B (pigmentos verdes,

la B es más oscura que la A). Por lo que encontramos en el fondo de la columna, el
pigmento amarillo son xantofilas mientras las diversas tonalidades de verde son mezclas
entre las clorofilas A y B, esto último es producto de la distribución uniforme de los poros
del gel. Las xantofilas son moléculas de menor tamaño en comparación con la clorofila (ver
Figuras 6 y 7), por lo que se les facilita atravesar los poros y llegar a la parte más baja de la
columna, cabe destacar que como se observa en la Figura 5 las xantofilas se componen
únicamente de cadenas de carbonos por lo que no poseen polaridad ya que carecen de un
compuesto más electronegativo que atraiga los electrones. Debido que silanol (SiOH),
presente en la superficie de gel de sílice, posee polaridad (Climent, 2004), las xantofilas
como son no polares no poseen interacción con el gel lo que les permite localizarse en la
zona más baja de la columna. Para el caso de las clorofilas se basan en el grupo funcional
que diferencia la clorofila A de la B, la clorofila A posee un metilo en una posición donde
la clorofila B posee un aldehído (Orozco, 2012). Este grupo funcional posee una gran
variante ante la interacción el gel de sílice ya que el aldehído posee polaridad debido al
oxígeno que posee (Bruice, 2007) además de que el hidrógeno forma puentes de hidrógeno
con el oxígeno del silanol, lo que permite mayor interacción con el gel causando que este se
localizara en zonas superiores a la clorofila A (ver Figura 6), a diferencia de la clorofila B,
la A por el metilo no interactúa con el gel debido a que posee un grupo metilo que no
interacciona con el silanol. Debido a la irregularidad de los poros del gel no se da una
distribución exacta entre los pigmentos, sino que se encuentran diferentes capas de colores,
podemos observar en la Figura 1 hay xantofilas tanto en el fondo de la columna como en
una zona superior de la columna.
Figura 5. Estructura de una xantofila (Sigma-Aldrich, 2010).

Figura 6. Estructura de la clorofila A (Sigma-Aldrich, 2010).
Figura 7. Estructura de la clorofila B extraído de espinaca (Sigma-Aldrich, 2010).
Para el caso del tomate, este posee un pigmento característico que es el licopeno que
le otorga la tonalidad rojiza característico de los tomates (Nuez, 2001). Además del
licopeno el tomate posee otros carotenoides en menor cantidad que poseen una tonalidad
diferente. En la Figura 10 (Anexos) observamos como en la parte superior de la columna se
nota la presencia de un pigmento rojizo, el licopeno. Pero a través de la columna se
descomponen otros pigmentos amarillos, otros carotenos (Murray et al., 2004) encontrados
en las células del tomate, que debido a su tamaño si pudieron atravesar los poros del gel
mientras que el licopeno se almaceno en la parte superior de la columna.
Figura 8. Estructura del licopeno, pigmento que otorga color al tomate (Sigma-Aldrich, 2010).

Se realiza la práctica de cromatografía de tiza donde se marca la tiza con un punto
en cada lado con marcadores permanentes. Luego se coloca sobre un disolvente específico
y se espera hasta que la elusión termine. Luego se analiza que tan bueno es el disolvente
según la distancia a la que se desplace la sustancia coloreada del marcador.
La tiza se utiliza como medio poroso, para que realice una función similar a la del papel
filtro, trabajando como fase estacionaria (Villa, 2007). El primer científico en usar la tiza
como fase estacionaria para realizar las pruebas de cromatografía fue Mikhail Tswett, quien
observo cómo se separaban los colores de los diferentes pigmentos al pasarlos por un tubo
con polvo de tiza (Valpuesta, 2008). De hecho, si la tiza fuese muy compacta la prueba de
cromatografía no se puede realizar pues los compuestos muy compactos, como los
productos de cerámica compactos, son impermeables (CEAC, 2007).
El alcohol resulta ser mejor eluyente debido a que producen generalmente una disminución
de la hidrofobicidad de la fase estacionaria y de la polaridad de la fase móvil, y en
consecuencia, una disminución en los factores de retención de los compuestos (Morell &
Candela, 1998). Y por esta misma razón el agua no funciona, pues promueve la retención
de la tinta.
(a) (b)
Figura 9. Cromatografía de tiza, (a) disolvente alcohol, (b) disolvente agua.
El problema con la acetona es la velocidad con que este se volatiliza, pues esto impide un
desarrollo normal de la cromatografía, al mover la tinta pero levemente (Mallol, 2008).

Figura 10. Cromatografía de tiza con acetona como disolvente.
Conclusiones:
La aplicación de la cromatografía de capa fina es un buen método para averiguar
una incógnita siempre que se tenga un modelo para comparar los resultados.
Es importante la utilización de un buen disolvente como fase móvil, en este caso fue
el 95% formato de etilo – 5% ácido fórmico, que generaron mejores resultados.
Las tizas empleadas al no ser compactas facilitaron el arrastre de las tintas. Eso sí,
empleando un alcohol como fase móvil.
El sustrato utilizado en la columna, como el gel de silica, puede intervenir la
separación de pigmentos según la polaridad de los mismos.
El tamaño de las moléculas por separar es un factor importante en la cromatografía
de columna por el tamaño de los poros del sustrato utilizado en la columna.

Referencias:
1. Bruice, P. (2007). Química Orgánica (5ta. Edición). México: Pearson Educación.
2. CEAC, (2007). Materiales de Construcción. Ediciones CEAC, Barcelona, España.
Pp.125.
3. Climent, J. (2005). Experimentación en química : química orgánica, ingenieria
química. Valencia: Univerisidad Politécnica de Valencia.
4. Harris, D. (2003). Ánalisis Químico Cuantitativo (6ta edición). Barcelona: Editorial
Reverté.
5. Herrera, C.; Bolaños, N.; Lutz, G. (2003) Química de Alimentos: Manual de
Laboratorio. Editoria Universidad de Costa Rica, 1ª edición, San José, Costa Rica,
Pp4.
6. Mallol, J. (2008). Manual de Radiofarmacia. Ediciones Díaz de Santos, España,
Pp71.
7. Morell, I.; Candela, L. (1998). Plaguicidas: aspectos ambientales, analíticos y
toxicológicos. 3º edición, Universidad de Jaume, España, Pp171.
8. Murray, M., Birdsall, T., Pizzorno, J., & Reilly, P. (2004). La curación del cáncer :
metodos naturales. Barcelona: RobinBook.
9. Nuez, F. (2001). El cultivo del tomate. Barcelona: Editorial Aedos.
10. Oñate, L. (2010). Biología. México: Cengage Learning.
11. Orozco, M. (2012). Los pigmentos fotosinteticos. Recuperado el 13 de junio de
2012, de Universidad Nacional de Colombia:
http://www.virtual.unal.edu.co/cursos/ciencias/2000051/lecciones/cap02/02_04.htm
12. Sharapin, N. (2000). Fundamentos de Tecnología de Productos Fisoterapéuticos.
Área de Ciencia y Tecnología del Convenio Andrés Bello & Red Iberoamericana de
Productos Fito farmacéuticos. Editado por Roberto Pinzón, 1ª edición, Colombia,
año Pp161-164.

13. Sigma-Aldrich. (2011). Sigma-Aldrich. Recuperado el 24 de mayo de 2012, de
Sigma-Aldrich: http://www.sigmaaldrich.com/us-export.html
14. Skoog, D.; James, F.; Crouch, S. (2008) Principios de Análisis Instrumental.
Editorial Cengage Learning S.A., 6º edición, México, Pp848-849.
15. Valpuesta, J. (2008). A la búsqueda del secreto de la vida. Una breve historia de la
biología molecular. Editorial Hélice, España, Pp62.
16. Villa, M. (2007). Manual de prácticas de química general. 2º edición, Universidad
de Medellín, Colombia, Pp98.
17. Walton, H.; Reyes, J. (1983). Análisis Químico e Instrumental Moderno. Editorial
Reverté, edición en español, España, Pp332-333.
18. Watson, J. (2005). Biología molecular del gen. Madrid: Editorial Médica
Panamericana, D.L.
19. Wolfram Alpha. (2012). Wolfram Alpha. Recuperado el 14 de junio de 2012, de
Wolfram Alpha: http://www.wolframalpha.com
Anexos
Figura 10. Cromatografía de columna para el extracto de tomate.