Herramientas bioquímicas para la taxonomía integrativa de Meloidogyne spp. XVI Congreso...
-
Upload
maria-antonia-correa-fernandez -
Category
Documents
-
view
215 -
download
0
Transcript of Herramientas bioquímicas para la taxonomía integrativa de Meloidogyne spp. XVI Congreso...

Herramientas bioquímicas para la taxonomía
integrativa de Meloidogyne spp.
XVI Congreso Internacional y XLI Congreso Nacional de
Fitopatología
María Gabriela Medina Canales
México, D.F, a 20 de julio de 2014

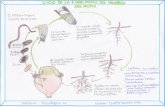
Identificación
MÉTODOS
Morfológico y morfométrico
Hospedantes diferenciales
Caracterización molecular
Caracterización enzimática
•Patrones perineales•Estiletes de machos , hembras y J2•Cabeza de los machos y J2
•Algodón “Deltapine 61”•Tabaco ”NC 95”•Pimienta “California Wonder”•Sandía “Charleston Gray”•Cacahuate “Florunner” •Tomate “Rutgers”
•Amplificación por PCR y RFLP de los ITS •Amplificación de los IGS de DNAr
Eisenback, 1991; Karssen y Moens,2006


Identificación
MÉTODOS
Morfológico y morfométrico
Hospedantes diferenciales
Caracterización molecular
Caracterización enzimática
•Patrones perineales•Estiletes de machos , hembras y J2•Cabeza de los machos y J2
•Algodón “Deltapine 61”•Tabaco ”NC 95”•Pimienta “California Wonder”•Sandía “Charleston Gray”•Cacahuate “Florunner” •Tomate “Rutgers”
•Amplificación por PCR y RFLP de los ITS •Amplificación de los IGS de DNAr
Eisenback, 1991; Karssen y Moens,2006

Caracterización enzimática
Sensible Estabilidad Esterasa
mayor valor diagnóstico
Fenotipos isoenzimáticos, de malato deshidrogenasa y esterasa, de diferentes especies de Meloidogyne.
Karssen y Moens,2006; Brito et al., 2010

Antecedentes
1985
2001
2003
1994
Uso de fenotipos enzimáticos para la identificación de
especies de Meloidogyne. Esbenshade y Triantaphyllou.
Polimorfismo de isoenzimas de esterasa en zimogramas de
poblaciones de Meloidogyne detectadas por el Phastsystem.
Molinari
Variabilidad isoenzimática de poblaciones de Meloidogyne spp.
provenientes de regiones brasileñas productoras de soya. Da
Cunha
Meloidogyne javanica parasito de cacahuate. Tomaszewski et al.

Antecedentes
2004
2011
2010
2005
2013
Caracterización de especies de Meloidogyne de China usando fenotipos
isoenzimáticos y RFLP de DNA mitocondrial amplificado. Jianhua et al.
Patrones isoenzimáticos de poblaciones venezolanas de Meloidogyne spp.
Crozzoli et al.
Plantas ornamentales infectadas con Meloidogyne spp. en Florida. Brito et al.
Diversidad de Meloidogyne spp. parasitando en plantas de la Isla de
Martinica. Quénéhervé et al.
Caracterización morfológica, enzimática y molecular de M. arenaria de Anubias
barteri var. caladiitolia en China. Huang et al.

MuestreoMuestreo
Extracción
Extracción
Electroforesis
Electroforesis
TinciónTinción
A B C
Metodología
Esbenshade y Triantaphyllou, 1985

Extracción de proteínas
1 Hembra + 10mL de regulador de
extracción
1 Hembra + 10mL de regulador de
extracción
Esterasa. 20 g de sacarosa o glicerol + 2 mL de tritón X-100.
Mdh y Sod. 20 g de sacarosa o glicerol + 0.1 g de TRIS + 0.1 g de ascorbato + 0.1 g cisteína. Ajustar pH a 8.0 con
HCl Esbenshade y Triantaphyllou, 1985

Electroforesis
Gel concentrador• 0.5 mL de sol. B• 1 mL sol. D• 0.5 mL sol. E• 2 mL sol. FGel
separador• 4 mL de sol. G• 1 mL agua• 2 mL sol. C• 1 mL sol. A o A2
Buffer• TRIS 6 g• Glicina 28 g• Agua 1 L• pH=8.3• Diluir 1:9
Corrimiento 30 min 80 volts + 70 min 250 volts
Esbenshade y Triantaphyllou, 1985

Revelado
Solución para teñir Esterasa•100 mL regulador fosfatos•30 mg EDTA•60 mg fast blue RR•40 mg a-naftilacetato/2 mL acetona
Solución para teñir Mdh / Sod
•10 mL sol. A•15 mL sol B•50 mg NAD•30 mg NBT•50 mL agua
•2 mg PMS en 26 mL agua
Incubar 1 hora a 37ºC
-Sol. A10.6 g Na2CO3 + 13.4 g malato
-Sol. B
6.06 g TRIS pH = 7.1
Esbenshade y Triantaphyllou, 1985

Interpretación de resultados
ab
Rm = Migración de la banda proteica (a) longitud total recorrida del gel (b)
x100
a
Banda
1
Banda
2
Rm banda 1= 3.8 x 100 = 46.3
8.2
Rm banda 2= 3.2 x 100 = 39
8.2
Fenotipo de esterasa H1 correspondiente a M. hapla.
Fenotipo de esterasa S1 correspondiente a M.chitwodii.
Esbenshade y Triantaphyllou, 1985; Alquicira-Jímenez, 2014

Ejemplos de fenotipos de EST
Fenotipo de esterasa y patron perineal de Meloidogyne incognita. Se observa el fenotipo I1 que presenta un Rm = 43,0
Fenotipo de esterasa para Meloidogyne sp. Se observa el fenotipo que presenta un Rm = 10,1 y 52. 9
Alquicira-Jímenez, 2014

Resultados
Representación esquemática de los fenotipos isoenzimáticos de esterasa observados en Meloidogyne spp. J2a = M. javanica, S1 = M. chitwoodi, H1 = M. hapla, Sp 1 = Especie no identificada, G1 = M. graminis, M2 = M. enterolobii, I1 = M. incognita, A1 , A2a, A3= M. arenaria.
; Alquicira-Jímenez, 2014

Fenotipos de esterasa observado en 291 poblaciones en estudio de 16 especies de Meloidogyne. Cada fenotipo es designado por letras que sugieren la especie a la que pertenece (A = arenaria, H = hapla, I = incognita, J =javanica) o por la velocidad de migración (VS = muy lento, S = lento, M = medio, F = rápido, VF = muy rápido) y el número indica el número de bandas presentes (Esbenshade y Triantaphyllou, 1985).
VS1 = M. graminicola, VS1-S1a = M. carolinensis, VS1-M2 = Meloidogyne sp. S1= M. chitwoodi, S1-M1 = M. arenaria, S2-M1 = M. hispanica, M1 = M. microtyla, M3 = Meloidogyne sp. M3a = M. cruciana, M3F1= M. arenaria, F1 = M. querciana, VF1 = M. naasi
(Esbenshade y Triantaphyllou, 1985)

Fenotipo de esterasa identificado de hembras observadas en geles de poliacrilamida. Se muestras tres bandas de actividad enzimática características de M. javanica y dos bandas de actividad enzimática características de M. arenaria (flecha) (Tomaszewsk et al., 1994).

Fenotipos de esterasa (EST) y malato deshidrogenasa (MDH) observados en 96 poblaciones de Meloidogyne spp. de platano (Musa sp.) (Cofcewicz et al., 2005).

Representación esquemática de los fenotipos de esterase de Meloidogyne spp. que infectan a ornamentales en Florida. A2 = M. arenaria, Mf3 = M. floridensis, Mg1 = M. graminis, I1 and I2 = M. incognita, J3 and J2 = M. javanica, VS1-S1 = M. mayaguensis, Ep2 = M. sp.1, Mc1 = M. sp.2, Vo1 = M. sp.3, Vo2 = M. sp.4, Gj2 = M. sp.5 y Cv2 = M. sp. 6. Rm = Movilidad relativa (Brito et al., 2010).

Fenotipos de esterasa (EST) y malato deshidrogenasa (MDH) obtenidos por electroforesis de 96 raíces y suelo de varias plantas en Martinica (Quénéhervé et al., 2011).

Fenotipos isoenzimáticos de esterasa y malato deshidrogenasa de M. arenaria proveniente de Anubias barteri var. caladiitolia. Líneas 1 y 3: M. javanica; Línea 2: M. arenaria de Anubias barteri var. caladiitolia (Huang et al., 2013).

Caso de estudio
M. enterolobii M. mayaguensis
Xu et al., 2004 se dan cuenta de que son los mismos ya que tienen el mismo fenotipo de EST
(VS1-S1) y lo corroboraron con métodos moleculares.
Xu et al., 2004 se dan cuenta de que son los mismos ya que tienen el mismo fenotipo de EST
(VS1-S1) y lo corroboraron con métodos moleculares.
Yang y Eisenback, 1983 Rammah y Hirschmann, 1988
Fenotipo EST = VS1-S1
Fenotipo EST = VS1-S1

GRACIAS