H 2 O (l) H 2 O (g) H = 44 kJ.mol -1
description
Transcript of H 2 O (l) H 2 O (g) H = 44 kJ.mol -1

H2 O (l) H2O(g) H = 44 kJ.mol-1
1.-Calcula a entalpía de formación da auga gas a 298K, se a esta temperatura a entalpía de formación da auga líquida é -286kJ.mol-1 e a entalpía molar de vaporización da auga é 44 kJ.mol-1.
H2 (g) + ½ O2 (g) H2O(l) H =-286 kJ.mol-1
H2 (g)+ ½ O2 (g) H2O(g) H =-242 kJ.mol-1
Form. da auga líquida
Vaporización da auga
Formación da auga gas

2.-Calcula a enerxía do enlace C-H no metano. A entalpía de formación do metano é -72 kJ.mol-1. A entalpía de vaporización do carbono grafito é 719 kJ.mol-1 e a entalpía de disociación do H2(g) é 494´8 kJ.mol-1 .
A Formación do metano C (s) + 2 H2 (g) CH4 HA = -72 kJ.mol-1
B Vaporización do carbono C (s) C(g) HB = 719 kJ.mol-1
C Disociación do Hidróxeno H 2 (g) 2 H (g) HC = 494´8 kJ.mol-1
A enerxía do enlace, que é a que se require para romper un enlace, neste caso C-H, será a cuarta parte da enerxía necesaria para a seguinte reaccíón:
CH4 (g) C(g) + 4 H(g) H = - HA + HB + 2 HC
A enerxía de enlace será : 1.1́4454
6´17808́494271972
4
1 molkJ

3.-Ao queimar, a presión constante, 25 g de butano despréndense 1240kJ en forma de calor. Con esta dato e os da táboa, calcula a entalpía de formación do butano.
Táboa: ΔHf(CO2 (g)) =-39313´kJ.mol-1; Δ Hf(H2O (g)) = -241´6kJ.mol-1
C4H10(g) + 13/2 O2(g) 4 CO2(g) + 5 H2O(g) ΔHA = -2876´8 kJ.mol-1
C(s) + O2(g) CO2(g) ΔHB = -393´13 kJ.mol-1
H2(g)+ ½ O2(g) H 2O (g) Δ HC = -241´6 kJ.mol-1
4 C(s) + 5H2(g) C4 H10(g) ΔH = ?
mol
kJ
mol
g
g
kJ HC
HC
8,28761
58
25
1240104
104
ΔH = -ΔHA + 4ΔHB + 5ΔHC ΔH = 96´28 kJ.mol-1

4.-Calcula a variación de enerxía interna de combustión do propano gas a 298 K .
Datos da táboa: Δ Hf(CO2 (g)) = -393´13 kJ.mol-1;
Δ Hf(H2O (g)) = -241´6kJ.mol-1 , Δ Hf(C3H 8 (g)) = -103´9 kJ.mol-1
C3H8(g) + 5 O2(g) 3 CO2(g) + 4 H2O(g) Δ H = -ΔHA + 3ΔHB + 4ΔHc .
ΔHcombustión = -2041´89 kJ.mol-1
C(s) + O2(g) CO2(g) Δ HB = -393´13 kJ.mol-1
H2(g)+ ½ O2(g) H 2O (g) Δ HC = -241´6 kJ.mol-1
3 C(s) + 4H2(g) C3 H8(g) ΔHA =-103´9 kJ.mol-1
Con as entalpías de formación das tres substancias que interveñen, xa que a do osíxeno é nula, calculamos:
ΔE =Δ H - Δ (PV) = Δ H – RTΔn =Δ H - RT xa que Δ n = 7 – 6 = 1
ΔE = - 2041´89 kJ.mol-1 – 8´3.10-3kJ.mol-1.K-1 . 298 K = -2044´3 kJ.mol-1

5.-Calcula a entalpía de formación do trióxido de xofre gas a partir das entalpías de reacción dos procesos
S(s)+ 3/2 O2(g) SO3(g) Δ H = ΔHA - ΔHB - ΔHc .
ΔHoxidación = -394´7 kJ.mol-1
PbO(s) + H2SO4 .5H2O PbSO4(s)+ 6 H2O(l) Δ HB = -116´9 kJ.mol-1
SO3(g)+ 6 H2O(l) H2SO4. 5H2O (l) Δ HC = -188´1 kJ.mol-1
PbO(s) + S(s) + 3/2 O2(g) PbSO4(s) ΔHA =-699´7 kJ.mol-1

6-Dos datos seguintes, calcúlese a calor de formación do pentacloruro de fósforo sólido
1/4 P4(s) + 5/2 Cl2(g) PCl5(s) Δ H = ¼ ΔHA + ΔHB
ΔHformación = -108´8 kcal.mol-1
PCl3(l) + Cl2(g) PCl5(s) Δ HB = -32´8 kcal
P4(s) + 6 Cl2(g) 4 PCl3(l) ΔHA =-304´0 kcal

7-Considera a reacción 2 Ag2O(s) 4 Ag(s) + O2(g). Calcula a calor desprendida ou absorbida cando reaccionan 4´62 g de Ag2O a 25ºC. entalpía estandar de formación do Ag2O(s) = - 30´6 kJ.mol-1
OAgmolmolg
OAgg2
22 .10.2/7´231
.624́
2 Ag(s) + ½ O2(g) Ag2O(s) ΔH = - 30´6 kJ.mol-1
É a calor absorbida ao reaccionar 4´62g ou 0´02 moles de Ag2O
2 Ag2O(s) 4 Ag(s) + O2(g) ΔH = - 2( - 30´6 kJ) = 61´2 kJ
Ag2O(s) 2 Ag(s) +1/2 O2(g) ΔH = 30´6 kJ.mol-1
2.10-2 mol de Ag2O . 30´6 kJ.mol-1 = 0´61kJ

8-Calcular a variación de entalpía e a de enerxía interna da seguinte reacción: CH4(g) + 2O2(g) CO2(g) + 2 H2O(l) Datos : As entalpía de formación do metano, dióxido de carbono e auga son respectivamente -74´8; -393´5 ; e -258´8 kJ.mol-1.
ΔH = ΔHf (CO2) + 2ΔHf (H2 O) - ΔHf (CH4) = - 836´3 kJ.mol-1
ΔE =Δ H - Δ (PV) = Δ H – RTΔn =Δ H + 2 RT xa que Δn = 1 – 3 = -2
ΔE = - 836´3kJ.mol-1 + 2 . 8´3 .10-3kJ.mol-1 K-1 . 298 K
ΔE = - 831´3kJ.mol-1

9-Escribe a ecuación de combustión do butano, e razoa se, á mesma temperatura, a calor desprendida a volume constante é maior, igual ou menor que a desprendida a presión constante.
qp = qv+RTΔn onde R >0
T >0
Δn = 9 – (1 + 13/2) >0
resultando qp > qv
C4H10(g) + 13/2 O2(g) 4 CO2(g) + 5 H2O(g)

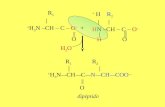
10-Calcular o valor aproximado da entalpía de reacción do proceso CH3-CH2-COH + ½ O2 CH3-CH2-COOHDatos das enerxías de enlace en kJ,mol-1: C-H = 414, C-O = 355 , O=O = 497 , O-H = 464
O O
R – C + ½ O O R - C
H O -H
resultando Δ H = 414+ ½ 497 - (355+464) = -156kJ.mol-1
Fórmanse un enlace C-O e outro O-H e rómpense un enlace C-H e medio enlace O=O
Onde a variación de entalpía da reacción é a variación de entalpía dos enlaces rotos menos a dos enlaces formados.

11.-A reacción 2 H 2 (g)+ O2 (g) 2 H2O (g) transcorre espontaneamente a pesar de que hai un aumento da orde do sistema. ¿Como pode ser esto?
Δ G = ΔH – T ΔS
Se é espontánea Δ G é negativo,
así que ΔH – T ΔS é negativo
polo tanto ΔH é menor que T ΔS
A enerxía que se desprende por ser exotérmica é máis ( son cantidades negativas) que a que se precisa para aumentar a orde do sistema

12.-¿Cal é o aumento de entropía dun sistema que absorbe 1kJ de calor ás seguintes temperaturas?
a) 5K
1.2500
1
KJK
kJ
T
QSb) 500K
c) 5000K1.20́
5000
1
KJK
kJ
T
QS
11 .200.20́5
1
KJKkJK
kJ
T
QS
A menor temperatura máis aumenta a desorde

13.-Deduce o signo de Δ S en cada unha das seguintes reaccións.
a) Ca(s) + ½ O 2(g) CaO (s)
En ambas reaccións aumenta o orde, por desaparecer gases.
Nos dous casos o incremento de entropía é negativo.
b) N2(g) + 2 O 2(g) 2 NO 2(g)

14.-Calcula cuantitativamente os valores de Δ S das reaccións anteriores. Busca os valores nunha táboa.
a) Ca(s) + ½ O 2(g) CaO (s)
Necesitamos os datos de ∆So para productos e reactivos, e a lei de Hess ou ben os de T, ∆G e ∆H para aplicar a fórmula ∆G = ∆H -T ∆S
b) N2 (g) + 2O2 (g) → 2NO2 (g)
∆Go = -603´5 kJ.mol-1 ∆Ho = -635´1 kJ.mol-1
111100
0 ..070́298
.´6035.´6351
KmolkJK
molkJmolkJ
T
GHS

15.-Calcula o valor de Δ G0 das reaccións
a) CaCO 3(s) CaO (s) + CO 2(g)
∆Go = ∆Gof (CO2(g)) + 4 ∆Go
f (H2(g)) - ∆Gof (CH4(g)) - 2 ∆Go
f (H 2O(g))
∆Go = - 394.4 kJ.mol-1 + 4 . 0 – (-50.8 kJ.mol-1 ) - 2. (-228.6 kJ.mol-1)
∆Go = 113´6 kJ.mol-1
b) CH4 (g) + 2H2O (g) → 4H2 (g) + CO2 (g)
∆Go = ∆Gof (CO2(g)) + ∆Go
f (CaO(s)) - ∆Gof (CaCO3(s))
∆Go = -394.4 kJ.mol-1 – 603.5 kJ.mol-1 - (-1128.8 kJ.mol-1) =130.9 kJ.mol-1

15.- Se fixeramos este exercicio utilizando datos de entalpía e de entropía, sería:a) CaCO 3(s) CaO (s) + CO 2(g)
∆So = So(CO2 (g)) + 4. So(H2 (g)) - So (CH4 (g)) - 2. So (H2O (g))
∆So =213,8J.mol-1K-1 + 4 .130,70 J.mol-1K-1 - 186,0 J.mol-1 K-1 - 2. (188,7 J.mol-1K-1)
∆So = 173,2 J.mol-1 K-1
∆Ho = ∆Hof (CO2(g)) + 4. ∆Ho
f (H2(g)) - ∆Hof (CH4(g)) - 2. ∆Ho
f (H2O(g))
∆Ho = -393,5 kJ.mol-1 + 4 . 0 kJ.mol-1 – (-74,9 kJ.mol-1 ) - 2. (-241,8 kJ.mol-1)
∆Ho = 165 kJ.mol-1
∆Go = ∆Ho - T ∆So
∆Go = 165 kJ.mol-1 - 298 K . 173,2 . 10-3kJ.mol-1 K-1 = 114,1 kJmol-1
b) CH4 (g) + 2H2O (g) → 4H2 (g) + CO2 (g)
∆So = So (CO2(g)) + So(CaO(s)) - So (CaCO3(s)) ∆So = 213.8 J.mol-1K-1 + 39.7 J.mol-1K-1 - (92.9 J.mol-1K-1) =160.6 J.mol-1 K-1
∆Ho = ∆Ho
f (CO2(g)) + ∆Hof (CaO(s)) - ∆Ho
f (CaCO3(s)) ∆Ho = -393.5 kJ.mol-1 – 635.1 kJ.mol-1 - (-1206.7 kJ.mol-1) = 178.1 kJ.mol-1 ∆Go = ∆Ho - T ∆So ∆Go = 178,1 kJ.mol-1 - 298 K . 160,6 . 10-3k J.mol-1 K-1 = 130,24 kJmol-1

16.-Determina se as reaccións do exercicio anterior son espontáneas á temperatura de 298K e se non o son, calcula a que temperatura o serán. Supoñemos que os valores de ∆H e ∆ S non varían apreciablemente coa T.
a) CaCO3 (s) → CaO (s) + CO2 (g)
∆Go = 114,1 kJmol-1 positiva, a reacción non é espontánea a esta T
b) CH4 (g) + 2H2O (g) → 4H2 (g) + CO2 (g)
∆Go = 130,24 kJmol-1 positiva, a reacción non é espontánea a esta T Para ser espontánea ∆Ho - T ∆So < 0 , por tanto ∆Ho < T ∆So
TS
H
0
0
TKkJmol
kJmol
.106.160
1.178113
1
TK 9.1108
TS
H
0
0
TKkJmol
kJmol
.102,173
165113
1
TK 7,953

17.- Para a reacción química C (grafito) + 2H2 (g) → CH4 (g) dispós dos seguintes datos a 298 K. A partir destes datos, determina ∆Ho, ∆So, ∆Go para esta reacción. ¿Que che suxire o valor obtido para esta última magnitude?
∆Ho = -74,8 kJ/mol-1 - 2 . 0 kJ/mol-1 - 0 kJ/mol-1 = - 74,8 kJ/mol-1
∆So = 186,9Jmol-1 K-1- 2 .130,7Jmol-1 K-1 - 5,74Jmol-1 K-1 = - 80,24Jmol-1 K-1
Por ser negativo o valor da entalpía libre de Gibbs, sabemos que o grafito en contacto con hidróxeno gas, a 25ºC, forma gas metano espontaneamente.
∆Go = ∆Ho - T ∆So
∆Go = -74,8 kJ.mol-1 - 298 K . ( – 80,24) . 10-3k J.mol-1 K-1 = - 50,9 kJmol-1
C (grafito) H2 (g) CH4 (g)
∆Hof (kJ/mol) 0 0 -74´8
S0 (J/mol ºK) 5´74 130´7 186´9

A combustión do acetileno (C2H2(g)) produce dióxido de carbono e auga. (a) Escriba a ecuación química correspondente ao proceso. (b) Calcule a calor molar de combustión do acetileno e a calor producida ao queimar 1,00kg de acetileno.Datos: ∆Hf
o = (C2H2(g))=+223,75kJ/mol; ∆Hfo = (CO2(g)) =-393,5kJ/mol
∆Hfo = (H2O (g))=-241,8kJ/mol
C2H2(g) + O2(g) 2CO2(g) + H2O(g)
2C(s) + H2(g) C2H2(g) ∆Ho = 223´75kJ/mol
C(s) + O2(g) CO2(g) ∆Ho =-393,5kJ/mol
½ O(s) + H2(g) H2O(g) ∆Ho =-241,8kJ/mol
∆Ho = -241,8kJ/mol-1+ 2 .(-393,5 kJ/mol-1) -223,75 kJ/mol-1= - 1252,5 kJ/mol-1
Ao queimar 1,00kg de acetileno estanse a queimar 38,46 moles de acetileno e a calor producida será:
38,46mol . 1252,5kJ/mol = 48173kJ.

A entalpía de combustión do propano gas é -546,3Kcal. Sabendo que ∆Hf
o = (CO2(g))=-94,03kcal/mol e ∆Hfo = (H2O (l))=-68,30kcal/mol. Calcular:
(a) Entalpía de formación do propano. (b) Os quilogramos de carbón que será preciso queimar ( cun rendemento do 80%) para producir a mesma cantidade de enerxía ca obtida na combustión de 1kg de propanoDato: Entalpía de combustión do carbón 5Kcal/g
C3H8 + O2 3CO2 + 4H2O ∆Ho = -546,3 kcal/mol
C(s) + O2(g) CO2(g) ∆Hfo =-94,3kcal/mol
½ O(s) + H2(g) H2O(l) ∆Hfo =-68,3kcal/mol
3 C(s) + 4 H2(g) C3H8 ∆Hfo =??
Entendendo que a auga formada na combustión está en fase líquida:
∆Ho =546,3Kcal.mol-1 -3 .94,3Kcal.mol-1-4 .68,3Kcal.mol-1= -9,8Kcalmol-1
Un kg de propano son 22,7 mol polo tanto desprende 22,7 . 546,3= 12417,39 Kcal o que equivalería a queimar 2483,1g de carbón nunha combustión ao 100%, e 3103,9 g, se o rendemento é do 80%, como aquí se plantea.

Na reacción 4Ag(s) + O2(g) 2Ag2O(s) a variación de entalpía e a variación de entropía a 25ºC e 1 atm valen -61,1kJ e ´-132,1J/K respectivamente. Supoñendo que estes valores son independentes da temperatura, determinar, previo cálculo: (a) En que sentido é espontánea a reacción nestas condicións.(b)O sentido no que a reacción é espontánea a 500ºC. (c) A temperatura á que se acada o equilibrio químico
∆Ho = -61,1 kJ ∆So = -132,1 J/K T= 298K P= 1 atm
Un kg de propano son 22,7 mol polo tanto desprende 22,7 . 546,3= 12417,39 Kcal o que equivalería a queimar 2483,1kg de carbón nunha combustión ao 100%, e 3103,9kg, se o rendemento é do 80%, como aquí se plantea.
∆Go = ∆Ho - T ∆So
∆Go = -61,1 kJ - 298 K . ( – 132,1) . 10-3k J K-1 = - 21,7kJ
![hE/s Z^/ hdMEKD /h :h Z ] ] v ' v o ^ À ] ] } u ] } v } o ... · hE/s Z^/ hdMEKD /h :h Z ] ] v ' v o ^ À ] ] } u ] } hE/s Z^/ hdMEKD /h :h Z ] ] v ' v o ^ À ] ] } u ] }](https://static.fdocuments.ec/doc/165x107/5f9ec38346b74938413f8ab7/hes-z-hdmekd-h-h-z-v-v-o-u-v-o-hes-z-hdmekd-h.jpg)


![Titulación de complejos [Cu(H 2 O) 4 ] 3+ + H 3 N [Cu(H 2 O) 3 H 3 N] 2+ + H 2 O k 1 = 10 4,1 [Cu(H 2 O) 3 (H 3 N)] 2+ + H 3 N [Cu(H 2 O) 2 (H 3 N) 2 ]](https://static.fdocuments.ec/doc/165x107/5665b4721a28abb57c918b47/titulacion-de-complejos-cuh-2-o-4-3-h-3-n-cuh-2-o-3-h-3-n-2-.jpg)