Fisiopatología de la coagulación. Hemostasia secundaria
-
Upload
yanina-munoz -
Category
Health & Medicine
-
view
23 -
download
2
Transcript of Fisiopatología de la coagulación. Hemostasia secundaria

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 1 de 18
FISIOPATOLOGÍA DE LA COAGULACIÓN
HEMOSTASIA II
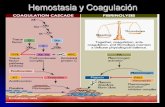
FASE PLASMÁTICA
Es la formación de la fibrina y estabilización de la fibrina.
Cuando hay lesión se liberan sustancias tromboplásticas que activan al fVII. El fVIIa activa
al fX y al fV y forma el Complejo Protrombinasa para generar una pequeña cantidad de
Trombina. La Trombina activa el fVIII, f V, f XI, plaquetas y f XIII. Se forma el Complejo
TENASA (activación del fX a través del fVIII y f IX). El fXa activa al fV y Calcio para formar
el Complejo Protrombinasa quien convierte Protrombina en Trombina, y esta cantidad de
35 ± 10 s
13 ± 2 s
15 ± 2 s

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 2 de 18
Trombina gener mayor cantidad para convertir el Fibrinógeno en Fibrina. La Fibrina es el
producto final de la hemostasia, pero necesita estabilizarse a través de la activación del fXIII.
MODELO CELULAR DE LA HEMOSTASIA: se involucra a las células.
- Fase de Iniciación: Factor tisular activa fVII y fIX, luego activa al fX (forma complejo
Protombinasa) generando pequeñas cantidades de Trombina. En esta fase el tejido
tisular es el tejido dañado o los monocitos.
- Fase de Amplificación: la Trombina activa al fV, fVIII y participan las plaquetas, y
forman el Complejo Tenasa* que es la activación del Factor X.
* "ten" (diez en inglés), y sufijo "-asa" que denomina a las enzimas= enzima que trabajan
sobre el factor diez. FVIIIa es el cofactor del FIXa
- Fase de Propagación: mayor cantidad de Trombina convirtiendo la mayor
cantidad de Fibrinógeno en Fibrina.
MODELO TRADICIONAL DE LA HEMOSTASIA

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 3 de 18
Vía Intrínseca
Están involucrados los factores de contacto y la Precalicreína, la Calicreína y la proteína
de bajo y alto peso molecular que activan el fXII y fXI (factores de contacto). Este factor
de contacto activa al fVIII y el fIX generando un Complejo Tenasa que activa el fX, que activa
el fV. El fVa activa el Complejo Protrombinasa generando Trombrina a partir de Protrombina.
Efecto de la Trombina. Activa:
o Factores: fVIII, fXIII, fV, fXI
o Plaquetas
o Trombomodulina del endotelio vascular para la parte inhibitoria
o Fibrinógeno en fibrina
o Trombomodulina
La trombomodulina es una proteína endotelial que
activa la Proteína C a través de la Proteína S
(catalizador). La Proteína C activada inhibe el fVIII
y el fV y activa parte de la fibrinólisis.
Vía Extrínseca
El Factor Tisular activa al fVII. El fVIIa activa el fX y se genera la vía común. Luego se forma
el Complejo Protrombinasa que activa Trombina, que a su vez activa el fibrinógeno y
finalmente se forma la Fibrina. Cuando se forma la Fibrina, generalmente son monómeros
de fibrina los cuales son solubles, por lo tanto esta fibrina es inestable. A través del fXIII se
forma una fibrina insoluble. Luego de esto viene la fase de fibrinólisis.
En un paciente con trombosis se ha pasado por todas las fases de la coagulación (activación,
iniciación, amplificación, propagación, conversión de fibrinógeno en fibrina y estabilización
de la fibrina).
PRUEBAS DE LABORATORIO
Tiempo Parcial de Tromboplastina Parcial Activada (TTPa): valora la vía
intrínseca. El valor normal es 35 ± 10 s. Si está prolongado, preguntarse si hay un
déficit de factores de la vía intrínseca o hay inhibidores de factores de la vía intrínseca.
Sirve en algunos casos para monitorizar la infusión de anticoagulación con Heparina.
Tiempo de Protrombina (TP): valora la vía extrínseca. El valor normal es 13 ± 2 s.
Si está prolongado puede haber una deficiencia o un inhibidor del fVII. Sirve para

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 4 de 18
monitorizar la anticoagulación con Warfarina
Tiempo de Trombina (TT): valora la conversión del fibrinógeno en fibrina. El valor
normal es 15 ± 2 s.
Si TP y TTPa están prolongados, existe una alteración de deficiencia o inhibidor en la vía
común (fX y fV). Se puede tener TP, el TTPa y TT normal y tener una alteración de la fase
plasmática de la coagulación, la conversión del fibrinógeno en fibrina está bien, pero ocurre
esa fibrina es inestable, por lo tanto se debe hacer una Prueba de Estabilidad del Coágulo.
Prueba de la estabilidad del coágulo en UREA: valora la estabilidad del fXIII. El
coágulo normal permanece insoluble en urea 24 horas. Cuando hay deficiencia o
disfunción del fXIII se disuelve en 10 min. Esta patología es poco frecuente .
Factorización: Si el TTPa está prolongado y se hace una mezcla de 50% de plasma
del paciente en la muestra de laboratorio y se le añade 50% de plasma normal, y se
repite el TTPa y se corrige, ese plasma tiene alguna deficiencia de alguno de los
factores de la vía intrínseca. Se debe tener la capacidad de determinar qué factores
son los deficientes en el plasma problema.
Inhibidor Lúpico: Si en una mezcla de 50% de plasma problema y 50% de plasma
normal se repite el TTPa y no corrige, en ese plasma problema hay anticuerpo lúpico
(inhibidor).
Activación de la Proteína C: mide la capacidad del fV de ser inhibido por la activación
de la Proteína C. Cuando el Factor V tiene resistencia a esa inhibición se llama Factor
V de Leiden (es una trombofilia congénita), una mutación que predispone a trombosis.
Ejercicios de práctica
Caso #1
Paciente que sangra, y con TP, TTPa, plaquetas con valores normales= trastorno en el
fXIII, tiene todo normal pero está sangrando.
Caso #2
Paciente con TP prolongado. Los demás tiempos está normales= alteración del fVII (Vía
extrínseca).
Caso #3
Paciente con TTPa prolongado. Los demás tiempos está normales= alteración del fXII y/o
fXI y/o fIX y/o fVIII y/o precalicreína y/o HMWK (Vía intrínseca)
Caso #4
Paciente con TP y TTPa prolongados y TT normal= alteración del fX y/o fV y/o FII (Vía
común)

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 5 de 18
Caso #5
Paciente con TP, TTPa, TT prolongados= fibrinógeno disminuido o anómalo, Heparina,
aumento de PDF o defecto adquirido múltiple (CID, hepatopatía, déficit de vitamina K).
Caso #6
Paciente con alteraciones en el tiempo de sangría, TPT y TP normal, plaquetas
normales= Pensar en Enfermedad de von Willebrand (ver resultado alterado con
Ristocetina), Tromboastenia de Glanzmann (ver resultados alterados con ADP, colágeno
y epinefrina pero con Ristocetina).
MECANISMOS LIMITANTES DE LA COAGULACIÓN
La sangre es líquida y normalmente no se coagula por la presencia de mecanismos limitantes de
la coagulación:
1. Flujo sanguíneo: tiene efecto de dilución y lavado, reduce el grado de interacción entre
los factores.
2. Función hepática y renal: metabolizan y eliminan los factores activados.
3. Compartimentación de las reacciones: son necesarios para la formación óptima del
coágulo de finbrina final, pues deben estar en un espacio físico limitado
(“compartimientos”). Sin la superficie fosfolipídica, el Ca2+, los cofaactores, otros, las
reacciones ocurrirían muy lentamente o no ocurrirían.
4. Retroalimentación negativa (feed-back)
5. Anticoagulantes naturales
o Antitrombina
o Inhibidor de la vía del factor tisular (TFPI)
o Sistema proteína C/ proteínas S
6. Sistema fibrinolótico
TROMBOFILIAS
La sangre tiene un factor pro-coagulante que frente a un estímulo de la coagulación o un
factor de riesgo de trombosis, responde en forma exagerada a trombosis.
Ejemplos de formación de trombosis:
1. Si una dama posee una trombofilia y toma anticonceptivos.
2. Si el paciente tiene una trombofilia, y realiza un viaje de 9 h.
Las trombofilias son deficiencias de:
Antitrombina III
Proteína C

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 6 de 18
Deficiencia del catalizador de la formación de proteína C (proteína S)
Inhibidor de la vía del factor tisular.
Disolución del coágulo
Ocurre después que se estabiliza el coágulo. La plasmina, que proviene plasminógeno, lisa
el coágulo (PDF-Productos de degradación de fibrina). Se activa a través de:
- Activador intrínseco: fXII, la prekalicreína, el kininogeno de alto peso molecular y la
protrombinasa.
- Activadores extrínsecos: activador tisular del plasminógeno (tPA- activador
fisiológico), la uroquinasa y la estreptoquinasa (medicamentos).
Inhibidores fisiológicos de la fibrinólisis:
- α-2- antiplasmina: inhibe directamente la plasmina.
- Inhibidores del activador tisular del plasminógeno, PAI-1 y PAI-2: inhibe
indirectamente la plasmina.
Si la plasmina actúa sobre:
- Fibrina soluble o no estable: generalmente no hay Dímero-D.
- Fibrinógeno: hay fibrinogenólisis y no hay Dímero-D.
- Un trombo o un coágulo: se llama fibrinólisis, y el producto es el Dímero-D.
Los puentes de Dímeros-D indican que hubo acción de la plasmina sobre la fibrina. Es un
marcador de trombosis.
TRASTORNOS PLASMÁTICOS DE LA COAGULACIÓN
Hemofilia
En la historia, está descrita desde el Talmud. Los rabinos decían que si una madre tenía un
hijo que hubiera muerto o hubiera tenido complicaciones después de la circuncisión, los
siguientes hijos estaban exentos de esa norma religiosa. Es considerada una enfermedad
de la realeza europea por matrimonios consanguíneos.

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 7 de 18
17 de abril, Día mundial de la Hemofilia
Es una enfermedad ligada al cromosoma X, cromosoma que sintetiza el fVIII y f IX.
- Imagen 1. Hombre hemofílico y mujer sana: el hombre hemofílico transmitirá el
cromosoma X a todas sus hijas mujeres, entonces todas sus hijas serán
portadoras. Si el padre hemofílico tiene hijos varones, se corta la hemofilia porque
él es quien da el gen “Y” que es sano.
- Imagen 2. Hombre sano y mujer portadora: probabilidad de 25% de un hijo
hemofílico y un 25% de que tenga una hija portadora.
- Imagen 3. Hombre hemofílico y mujer portadora: probabilidad de 25% de un hijo
sano, 25% de una mujer enferma, 25% de un hijo enfermo, 25% de una mujer
portadora.
Puede existir una hemofilia espontánea, es decir, hubo una mutación espontánea en esa
generación.
Si llega un hay un paciente, que se sospechaba es hemofílico, se debe preguntar si su
abuelo es hemofílico. Si por ejemplo, el paciente refiere que su abuelo murió desangrado
cuando se cayó de un caballo se puede tener la sospecha de Hemofilia. El interrogatorio se
vertical (hacia arriba y hacia abajo), mientras que en las enfermedades somáticas se hace
horizontal (se pregunta a los lados, es decir, hermanos, primos).
Fenómeno de Lyon (lionilización): ocurre cuando una mujer portadora sangra. Esto
puede ocurrir porque se expresa el gen de la hemofilia y el otro no, o que la mujer tenga un
solo cromosoma X, como ocurre en el Síndrome de Turner.
MANIFESTACIONES DE LA HEMOFILIA (CUADRO CLÍNICO)
Hemartrosis: sangrado repetido destruye la sinovia, se produce una sinovitis
crónica. Luego la articulación no sirve y el paciente no podrá caminar. Puede ocurrir
en el codo, en el tobillo y en cualquier parte de la cadera.
Imagen 1 Imagen 3 Imagen 2

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 8 de 18
Hemorragia intracraneal: complicación del hemofílico grave, en niños y en el canal
de parto.
Hemorragia por traumas mínimos: no pueden realizar deportes de contacto (ni
boxeo, basquetbol o futbol) porque sangran.
Hemorragias por procedimientos quirúrgicos: como en el dentista.
Sangrados por traumas graves
Hematoma: puede ser en el bíceps tríceps. En el psoas que puede acumular gran
cantidad de sangre en el retroperitoneo y el paciente puede llegar con esta
hemorragia y nadie se da cuenta y el paciente puede fallecer.
Hematuria
Equimosis
Laceraciones bucales
Sangrado gastrointestinal
Las manifestaciones de la hemofilia dependerán del grado de severidad de la deficiencia
del factor.
Hemartrosis: en hemofílicos graves (<1%) pueden tener hemorragia en las articulaciones
sobre todo en las que son bisagra (muñeca, codo, tobillo, rodilla).
Prevalencia de hemofilia
• Hemofilia A VIII 1:10,000
• Hemofilia B IX 1:50,000
• Deficiencia de XI 1:100,000
• Deficiencia de VII 1:500,000
• Deficiencia de X 1:1,000,000
• Deficiencia de V 1:1,000,000
• Deficiencia de protrombina 1:1,000,000
• Deficiencia de fibrinógeno 1:1,500,000
• Deficiencia de XIII 1:2,000,000
Para detectar una hemofilia se debe hacer una buena historia clínica. Los que van al doctor
son los que tienen desordenes hemorrágicos severos, porque los que tienen desordenes
hemorrágicos leves no van al doctor. Muchas personas piensas que sangrar mucho en la
menstruación es normal o sangrar a veces por la nariz es normal o tener un hematoma que
no resuelve es normal.
Severidad de la hemofilia
Severa: <1% Moderada: 1-5% Leve: 5-40%

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 9 de 18
El hemofílico grave es el que mayormente sangra, el hemofílico moderado también sangra
pero depende de la actividad que realice.
Complicación: pseudotumor
Si un paciente hemofílico hace un hematoma
muscular y éste no se resuelve, el músculo sangra
dentro de la cavidad y se forma una cavidad quística
que crece y destruye todo a su alrededor, como los
huesos. Es una causa de mortalidad.
NOTA: por eso recordar que si llega un paciente con
un dolor (a lo que normalmente le administran una
inyección IM) y si no hay cuidad en saber si el
paciente es hemofílico, el paciente puede regresar
al al cuarto de urgencias con un hematoma.
La mayoría de las hemorragias intramusculares
ocurren por inyecciones, pero también por traumas.
El hemofílico puede tener una vida normal, siempre que se conozca su enfermedad y sus
niveles de factores para poder tratarlos.
Tratamiento
- Hemofílico leve: solo se trata con Desmopresina cuando tiene evento hemorrágico,
porque ésta libera fVIII del endotelio.
- Hemofílico severo: se deben prevenir las hemorragias. Para ello se les da profilaxis
desde que nacen hasta que alcance su desarrollo músculo-esquelético normal, sin
artropatías. El tratamiento no es efectivo para la artropatía pues ellos quedan con secuelas.
Puede tratarse si tienen que hacerse una cirugía, reemplazando con factores. La profilaxis
disminuye los riesgos de complicaciones (hemartrosis, hemorragias). Se hace 3 veces por
semana, y se aplica de 20 a 40 U/ Kg de fVIII. Esto se estima en aproximadamente 20 mil
dólares anuales, pero cuesta más tratarlo que no tratarlo.
Es muy importante que estos pacientes carguen un brazalete, carnet o identificación pues si
ocurre un accidente se puede tratar inmediatamente.
Historia del tratamiento
- Antes de 1930: sólo se inmovilizaba, se aplicaba hielo y analgésico, pero igual los
pacientes presentaban deformidades.
- 1940: se infundía plasma, pero no había plasma fraccionada y a veces se ponía sangre
completa cuando había hemorragia, todo esto no resolvía los problemas de artropatía.
- 1960: los concentrados de factor se pudieron separar del crioprecipitado, pero
demostraron falta de seguridad en sus preparaciones.
- 1980: hubo pacientes afectados por el VHB, VHC y VIH. El 70% de los hemofílicos del
mundo fallecieron por eso, y aún existe un porcentaje que tiene secuelas.

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 10 de 18
Se debe tener factores recombinates y factores de origen plasmático con la suficiente
seguridad para tratar al paciente.
Para que el fVIII sea seguro se cumple lo siguiente:
- Fraccionar el plasma
- Evaluar de donantes (screening para VHB, por ejemplo)
- Tratar al calor y con afinidad para eliminar e inactivar los probables virus.
Cuando se infunde fVIII se puede sensibilizar o producir anticuerpos contra el factor, y aunque
se infunda el factor, éste será inhibido y no se resolverá la hemorragia. Se debe determinar
las Unidades Betesda (BU, las cuales determinan el % de inactivación que tiene el fVIII por la
presencia del inhibidor.
- Si es >5 BU: alta respuesta y no van a responder a dosis de fVIII
- Si es < 5 BU: pueden responder a más dosis (pero es más costoso). Se debe hacer
es una inmunotolerancia para disminuir los títulos del factor.
Cuando los pacientes presentan sangrados, se debe utilizar productos que generen
trombina directamente (productos puente):
- fVII recombinante
- Complejo protrombinico
No se reemplaza el factor, se administran inhibidores y productos que generen trombina. Los
pacientes hemofílicos deben ser autosuficientes (saber infundirse, sus dosis, hacer terapia
casera, cuando ponerse cada factor y los días de aplicación).
Si el paciente tiene:
Hemiartrosis: reposo y hielo
Cuando tenga el aura, aplicar el fVIII, no esperar el edema rotuliano.
Si el paciente tiene hemorragia en algún área que comprometa su vida, hay que elevar el
factor al 100%. Por ejemplo:
- Niño que estuvo jugando en la escuela, se cae y se rompe la cabeza.
- Hematoma de cuello que obstruirá la vía respiratoria
- Trauma ocular
- Hematoma de retroperitoneo
- Cuando hay signos de hipovolemia
En el caso de Hemorragia dental, se puede controlar de manera local, y se eleva el factor al
60-80%.

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 11 de 18
Diagnóstico Diferencial
La Hemofilia A y B, desde el punto de vista clínico, son idénticas. Ambas ocurren por una
alteración del cromosoma X. La Hemofilia A ocurre por deficiencia de fVIII y la Hemofilia B
por la deficiencia del fIX, por lo tanto el tratamiento para la Hemolifia A es dar fVIII y para la
Hemofilia B es infundir fIX.
Diagnóstico: TPT (TTPa) Prolongado. En la enfermedad de von Willebrand el TTPa también
está prolongado, y se parece a la Hemofilia porque tiene deficiencia de fVIII, pero el
tratamiento es distinto (en la enfermedad de von Willebrand tengo se da fvW). Además la
Enfermedad de Von Willebrand es un trastorno autosómico dominante, y las hemofilias son
ligadas al cromosoma X.
DESORDENES ADQUIRIDOS DE LA COAGULACIÓN
Pacientes con accidentes, intervenciones quirúrgicas, pérdida masiva de sangre, pueden
tener alteración de la coagulación, pero si se detecta a tiempo se puede detener el sangrado.
HIPOCOAGULABILIDAD ADQUIRIDA
Déficit de Vitamina K
La vitamina K se obtiene de los vegetales, de la carne y derivados de animales, y de las
bacterias de la flora intestinal. Se produce su déficit en las siguientes situaciones:
- Dieta inadecuada
- Administración de antibióticos que alteren la microbiota intestinal

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 12 de 18
- Recién nacido prematuro: ocurre porque las bacterias aún no han colonizado el tubo
digestivo, y la leche materna tiene poca vitamina K.
- Alteraciones en la absorción: como en resecciones intestinales amplias,
enteropatías crónicas, enfermedades obstructivas de las vías biliares (porque no se
absorben las vitaminas liposolubles-A, D, E, K-), o tratamientos con agentes que
inhiban los ácidos biliares (Colestipol, Colestiramina).
NOTA: predomina la hemorragia (por déficit de fII, fVII, fIX, fX) sobre la trombosis (por déficit
de Proteína C/Proteína S).
Hallazgos clínicos
- Plaquetas, TT, fibrinógeno y tiempo de hemorragia son normales.
- TTPa y TP están prolongados. El primer test que se altera es el TP porque el fVII es
el de vida media más corta (5 h).
Tratamiento
- Corrección de la causa y administración de vitamina K V.O. a las 8-12 h aumenta
la actividad de los factores dependientes de vitamina K. A las 24-48 h, ya está
corregido.
- En alteración de la absorción. Se puede administrar vitamina K I.M. o I.V., y si hay
ictericia obstructiva puede darse junto con sales biliares.
- En operaciones de urgencias, se administran concentrados de complejo
protrombínico (fII, fVII, fIX, fX).
Hepatopatías
Son los trastornos hemostáticos más frecuentes.
Clasificación:
- Hepatopatías agudas fulminantes
- Estadio final de las hepatopatías crónicas (cirrosis): hay daño hepático y produce:
o Hipertensión portal: que genera esplenomegalia, hiperesplenismo,
produciendo trombocitopenia y como consecuencia hay sangrado y várices
esofágicas.
o Déficit de factores dependientes de vitamina K y TP prolongado. Como el
activador tisular del plasminógeno se metaboliza a nivel hepático, éste circula
y activa el sistema fibrinolítico, se destruye el fibrinógeno y se genera
hipofibrinogenesia. La destrucción de fibrinógeno origina PDF que pueden
producir disfunción plaquetaria.
- Enfermedades de las vías biliares

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 13 de 18
Mecanismos de sangrado
- Déficit en la síntesis de factores
- Trombopenia asociada
- CID asociada
- Hiperfibrinólisis asociada
Tratamiento
- Corrección de la causa y administración de plasma fresco congelado (uso poco
frecuente) y vitamina K.
- En cirugías de urgencia o si fallan las medidas anteriores, administración de
concentrados de complejo protrombínico y /o rFVIIa, fibrinógeno purificado (en
presencia de hipofibrinogenemia)
Coagulación Intravascular Diseminada (CID)
Fisiopatología
Se produce por la entrada del factor trombótico al torrente circulatorio, el cual activa la vía
extrínseca de la coagulación, y a su vez sustancias extrañas activan la vía intrínseca,
generándose grandes cantidades de trombina. Existe una dualidad pues se produce
trombosis (por activación) y sangrado (por consumo de factores). Se consume antitrombina
en un intento por neutralizar el exceso de trombina circulante. La gravedad de la CID recae
en la microtrombosis que origina insuficiencia en órganos más que eventos hemorrágicos.
La activación de la coagulación produce:
- Consumo de factores (I, II, V, VII, XIII): por eso todos los test de coagulación
presentan valores prolongados.
- Formación de microcoágulos de fibrina: hay consumo de plaquetas
(trombopenia), y los hemáties se fragmentan (anemia hemolítica
microangiopática).
- Fibrinólisis secundaria:
o Aumento adicional del consumo de factores (fibrinógeno disminuído)
o Aumento de PDF: inhibe la polimerización de la fibrina, agregación plaquetaria
y trombina.
Desencadenantes y enfermedades asociadas
- Sepsis: sobre todo con G- que liberan endotoxinas que activan la vía intrínseca (por
los LPS) y la vía extrínseca (indirectamente por lla destrucción de neutrófilos que
liberan su contenido granular).
- Hemorragias malignas: leucemia promielocítica.
- Tumores sólidos: páncreas, estómago, ovario, próstata (liberan factores trombóticos
y son tejidos ricos en tPA).
- Hepatopatías

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 14 de 18
- Complicaciones obstétricas: desprendimiento precoz de placenta, placenta previa,
embolia de líquido amniótico, eclamsia, etc, pues liberan FT (factores trombóticos).
- Picaduras de insectos y venenos de serpientes
- Accidentes transfusionales y enfermedades autoinmunes graves: los complejos
Ag-Ab dañan el endotelio y activan la coagulación.
- Otros: trauma, abortos, aneurisma de la aorta abdominal, hemangiomas gigantes,
gangrena, cáncer, golpe de calor.
Hallazgos clínicos:
- Hemorrágias múltiples (púrpura progresimente confluyente, grandes hematomas,
gingivorragias, epitaxis, hemorrágias gastrointestinales y genitourinarias, etc)
- Manifestaciones trombóticas
- Fiebre
- Acrocianosis
- Shock: por activación de citosinas y proteínas vasoactivas. La hipovolemia por sangrado
es una contribución mínima al shock.
Hallazgos de laboratorio:
1. Frotis Periférico: Anemia Hemolítica Microangiopatica, esquistocitos,
normoblastos, trombocitopenia.
2. Hemograma: recuentro plaquetario bajo, hemáties disminuídos.
3. Pruebas de Coagulacion: Dímeros D presenten (estarán aumentados). Todos los
test presentan valores prolongados*. El fibrinógeno disminuido
*Recordar que el la PTT, TP y TTPa presentan valores normales.
Tabla 130-4. Disfunción orgánica asociada con CID severa
Órgano Manifestación
Piel Púrpura, sangrado en los sitios de injuria, bulla hemorrágica, necrosis focal, gangrena sacra
Cardiovascular Shock, acidosis, infarto miocárdico, eventos cerebrovasculares, tromboembolismos de todos los tipos y calibres de vasos
Renal Insuficiencia renal aguda (necrosis tubular aguda), oliguria, hematuria, necrosis cortical renal
Hígado Falla heática, ictericia
Pulmones Síndrome de distrés respiratorio en adulto, hipoxemia, edema, hemorrágia
Gastrointestinal Sangría, ulceración y necrosis de mucosas, isquemia intestinal
SNC Coma, convulsiones, lesiones focales, sangría
Adrenales Insuficiencia adrenal (necrosis hemorrágica)
Tratamiento
Tratar la causa porque la CID siempre es secundaria a otra patología.
Puede controlarse con la administración de plasma fresco congelado,
crioprecipitados (pues contiene los factores que se están consumiendo), y
concentrados de plaquetas.

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 15 de 18
Actualmente se aplican inhibidores naturales de la trombina (los cuales también son
consumidos en CID) como antitrombina, proteína C activada e inhibidor de la vía
del factor tisular todos estos para inhibir la tendencia pro-coagulante.
Si existe predominio de hiperfibrinólisis, considerar el uso cuidadoso de
antifibrinolíticos. El uso de Heparina está en debate.
Terapia de soporte: concentrado de hematíes, antibioticoterapia de amplio espectro,
fármacos vasoactivos (por ejemplo, Dopamina), oxigenoterapia, corrección de la
acidosis metabólica, todas estas medidas deben ser aplicadas cuando sea necesario.
DIÁTESIS TROMBÓTICAS
Trombo: masa sólida o semisólida en el interior del sistema vascular.
Triada de Virchow
El origen de las patogenias de los estados trombóticos se da por una o por la combinación de
las mismas:
- Anomalías en la pared del vaso
- Trastornos del flujo sanguíneo: estasis (favorecen trombosis venosa) o
turbulencias (favorecen trombosis arterial).
- Alteración de los componentes de la sangre
Trombosis producidas por alteraciones del sistema de la coagulación
- Déficit de anticoagulantes naturales (AT, Sistema Proteína C/Proteína S, TFPI –
Inhibidor de la vía del factor tisular-)
- Factor V de Leiden o resistencia a la proteína C
- Mutación G20210A del gen de protrombina
- Síndrome antifosfolipídico
- Hiperhomocisteinemia
- Déficit del sistema fibrinolítico
Trombofilia Congénitas
Las trombosis pueden ser adquiridas o congénitas. Se sospechan de trombosis congénitas
en personas:
- Jóvenes (20-40 años)
- Con episodios de trombosis venosas recurrentes en localizaciones poco frecuentes
(por ejemplo: venas mesentéricas, hepáticas, esplénica).
- Suele haber historia familiar

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 16 de 18
Trombofilias Adquiridas
Déficit de AT-III (Antitrombina III). Puede ocurrir en:
1. Déficit en la producción: por hepatopatías (AT III se sintetiza en el hígado), administración
de anticonceptivos o L-Asparginasa (medicamento usado en las leucemias. Éste afecta
la producción de proteínas y afecta a la anti trombina AT-III).
2. Aumento en la eliminación: Síndrome nefrótico (la AT-III es una proteína de bajo
peso molecular→ se filtra por el riñón), enteropatías proteinorrágicas.
3. Consumo excesivo: CID (complejos Trombina-AT)
Síndrome de anticuerpo anti fosfolípido
Ocurre cuando un anticuerpo antifosfolipídico se asocia a trombosis arterial o venosa,
trombocitopenia y/o abortos a repetición (característico de este síndrome). Se dificulta la
coagulación porque los fosfolípidos son el soporte donde se realizan todas las reacciones
entre los distintos factores. E
El TTPa está prolongado porque la membrana fosfolipídica de las plaquetas es una de las
superficies que activa la vía intrínseca (las otras superficies son el colágeno y el subendotelio
dañado). Las recurrencias trombóticas (que son frecuentes) se pueden prevenir con
anticoagulación oral. En embarazadas, se puede tratar con AAS a dosis bajas (con o sin
Heparina). En algunos casos el síndrome puede desaparecer espontáneamente.
Mutación G20210A de la Protrombina
Se cambia la guanina por la adenina en el nucléotido 20210 del gen de la protrombina, por lo tanto
se favorece una mayor actividad de la protrombina en el plasma. El riesgo trombótico
aumenta entre 2-3 veces respecto a la población normal.
Hiperhomocisteinemia (Relacionado a trombosis)
La homocisteína se metaboliza a cisteína (con el cofactor vitamina B6) o metionina (con el cofactor
vitamina B12). Sus niveles en sangre pueden aumentar por:
- Déficits genéticos de alguna enzima que intervenga en este proceso: tipo Cistationina
sintetasa, pero la causa más común de esta enfermedad se debe a la mutación puntual en
el gen de la Metilén tetrahidrofolato reductasa, produciendo que la enzima sea termolábil y
reduciendo al 50% su actividad.
- Déficits nutricionales: de ácido fólico, vitamina B12 o vitamina B6.
La hiperhocisteinemia induce daño endotelial y se asocia a:
- Aumento del factor tisular y de la actividad del fV y fXII
- Descenso de proteína C
El riesgo de trombosis arterial y venosa aumenta 3,5 veces más. Y, en personas con factor de
Leiden, el riesgo aumenta hasta 20 veces más.

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 17 de 18
Tratamiento: ácido fólico, vitamina B6, Vitamina B12.
Laboratorios utilizados en trombofilias
Congénitas Adquiridas
Homocistinemia
- Homocistína por HPLC
- PCR
Síndrome antifosfolipídico
- Anticuerpo anticardiolipina (IgG,
IgA, IgM)
- Anticoagulante lúpico (PTT, RVVT,
KCT)
Disfibrinigenemia
- Análisis de fibrinógeno Claus
- Tiempo de Trombina
- DNA
- PCR
Trombocitopenia inducida por Heparina
- HIT
Mutación G20210A de la Protrombina
- PCR
En resumen…Si el paciente llega a urgencia con:
- Trombocitopenia→ transfundir plaquetas
- Déficit de factores→ transfundir plasma fresco congelado
- Fibrinólisis→ agente antifibrinolítico
FÁRMACOS QUE INTERVIENEN EN LA COAGULACIÓN
Warfarina (Coumadin): medicamento utilizado para:
- Prevenir trombosis en pacientes con fibrilación auricular, porque puede provocar ECV embólica (puede producir la muerte o dejar secuelas como hemiparesia, afasia y ceguera).
- Pacientes con Trombosis venosa profunda, después de la fase aguda, porque requieren tratamiento antitrombótico crónicamente.
- Pacientes con válvulas cardiacas protésicas. La Warfarina tiene muchas interacciones. Por ejemplo:
- Alimentos con vitamina K
- Si el paciente no defeca, aumenta la concentración de vitamina K producida por las
bacterias intestinales y puede desarrollarse un trastorno de la coagulación.
Inhibe todos los factores vitamina K dependientes (II, VII, IX, X, Proteína C y S). Si a un

HEMATOLOGÍA. Fisiopatología de la Coagulación. Hemostasia II Latrodectus mactans
Página 18 de 18
paciente con deficiencia de proteína C o S y se le administra Warfarina, se acentúa la deficiencia. La Warfarina se tiene que monitorizar y se hace a través del TP. La OMS solicitó que se estandarizara el reporte de TP (para evitar la variabilidad en los resultados). El reporte de TP se hace a través de una fórmula matemática que se llama INR (índice normalizado internacional). El INR es el TP del paciente entre el TP de una población normal elevada al ISI (sensibilidad del reactivo usado en determinar factores Vitamina K dependiente). Por ejemplo: si el TP del paciente es 25 y el tiempo promedio es 15, dará una razón que se eleva al índice del reactivo. Si el reactivo tiene un índice de reactividad= 1,5, eso da un número del que se obtiene un antilogaritmo que será el INR. El INR tiene valores terapéuticos para cada caso:
- Fibrilación auricular: > 2 a 3 - Válvulas cardiacas: 2,5 a 3,5 - Riesgo hemorrágico: > 3 o 3,5 - Riesgo de trombosis: < 2
Anticoagulantes que inhiben el factor X o directamente la trombina: Rivaloxaban y
Dabigatran, no requiere monitorización pero son productos muy nuevos.
Heparina: actúa sobre la AT-III, inhibiendo el efecto de la Trombina. El monitoreo se hace por
el TTPa. Si se compara el uso de Heparina I.V. y Heparina de bajo peso molecular, ésta
última no requiere monitoreo y es más cómoda que el tratamiento con Heparina I.V.,
permitiendo el tratamiento extra-hospitalario, ya sea profilaxis o pacientes con trombosis.
NOTA: Si el paciente tiene TTPa prolongado puede ser por Heparina, anticoagulante lúpico, déficit de factor de la vía intrínseca.
13 de octubre Día Mundial de la trombosis por el natalicio de Virchow
“Él da fuerzas al cansado, y al débil le aumenta su vigor. Hasta los jóvenes pueden cansarse y fatigarse, hasta
los más fuertes llegan a caer, pero los que confían en el Señor tendrán siempre nuevas fuerzas y podrán volar
como las águilas; podrán correr sin cansarse y caminar sin fatigarse”.
Isaías 40: 29-31