El átomo y estructuras cristalinas
-
Upload
josegonzalezsalazar -
Category
Education
-
view
89 -
download
2
Transcript of El átomo y estructuras cristalinas

REPÚBLICA BOLIVARIANA DE VENEZUELAINSTITUTO UNIVERSITARIO POLITÉCNICO
“Santiago Mariño”EXTENSIÓN PORLAMAR
ESCUELA DE INGENIERÍA MECANICA
ATOMO Y ESTRUCTURAS CRISTALINAS
ELABORADO POR:
José Ángel González SalazarC.I. 16.035.386
Porlamar, Octubre de 2013

El átomo
El átomo se define como; “un constituyente de la materia ordinaria, con propiedades químicas bien definidas, formado a su vez por constituyentes más elementales sin propiedades químicas bien definidas. Cada elemento químico está formado por átomos del mismo tipo (con la misma estructura electrónica básica), y que no es posible dividir mediante procesos químicos”. http://es.wikipedia.org/wiki/Atomo

Estructura del átomo
El átomo se constituye de la siguiente forma:
- Una zona central o NÚCLEO donde se encuentra la carga total positiva (la de los protones) y la mayor parte de la masa del átomo, aportada por los protones y los neutrones.
- Una zona externa o CORTEZA donde se hallan los electrones, que giran alrededor del núcleo.
Hay los mismos electrones en la corteza que protones en el núcleo, por lo que el conjunto del átomo es eléctricamente neutro.

Teoría atómica de la materia
El primero en utilizar este término fue Demócrito (filósofo griego, del año 500 a.de C.), porque creía que todos los elementos estaban formados por pequeñas partículas indivisibles. átomo, en griego, significa indivisible.
Jonh Dalton, utilizó los dos leyes fundamentales: la "Ley de conservación de la masa y la "Ley de composición constante“ como base de una teoría atómica. La teoría atómica de Dalton condujo a la "Ley de las proporciones múltiples“.
Los experimentos de Thomson sobre los rayos catódicos en campos magnéticos y eléctricos dieron pie al descubrimiento del electrón he hizo posible medir la relación entre su carga y su masa.
Las leyes de Newton, junto con las ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de 10−10 s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo.13

Isótopos, número atómico y número másico
Los átomos se identifican por el número de protones que contiene su núcleo, ya que éste es fijo para los átomos de un mismo elemento
Número atómico: Es el número de protones de un átomo. Se representa con la letra Z y se escribe como subíndice a la izquierda del símbolo del elemento: ZX.
Número másico: Es la suma del número de protones y del número de neutrones de un átomo. Se representa con la letra A y se escribe como superíndice a la izquierda del símbolo del elemento: AX.
Los isótopos son átomos de un mismo elemento que tienen igual número atómico, pero distintos números másicos. Es decir, tienen el mismo número de protones pero distinto número de neutrones.

Masa atómica
“La masa atómica relativa de un elemento, es la masa en gramos de 6.02 x1023 átomos (número de Avogadro, NA) de ese elemento, la masa relativa de los elementos de la tabla periódica desde el 1 hasta el 105 esta situada en la parte inferior de los símbolos de dichos elementos. El átomo de carbono, con 6 protones y 6 neutrones, es el átomo de carbono 12 y es la masa de referencia para las masas atómicas. Una unidad de masa atómica, se define exactamente como 1/12 de la masa de un átomo de carbono que tiene una masa 12. una masa atómica relativa molar de carbono 12 tiene una masa de 12 g en esta escala. Un mol gramo (abreviado, mol) de un elemento se define como el numero en gramos de ese elemento igual al número que expresa su masa relativa molar” http://saia.uft.edu.ve/psm/file.php/2429/estructura_atomica.pdf .

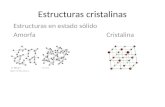
Estructura cristalina
Se define como la forma sólida de cómo se ordenan y empaquetan los átomos, moléculas, o iones. Estos son empaquetados de manera ordenada y con patrones de repetición que se extienden en las tres dimensiones del espacio.

Estructura cristalina ordenada
En la estructura cristalina de los materiales inorgánicos, los elementos que se repiten son átomos o iones enlazados entre sí, de manera que generalmente no se distinguen unidades aisladas; estos enlaces proporcionan la estabilidad y dureza del material. En los materiales orgánicos se distinguen claramente unidades moleculares aisladas, caracterizadas por uniones atómicas muy débiles, dentro del cristal. Son materiales más blandos e inestables que los inorgánicos.

Aplicaciones del átomo
Los átomos se aplican en la industria para producir electricidad como fuente de energía.
Ésta ha probado su gran importancia en la medicina, en la agricultura, en los transportes, en la minería y en todas y cada una de las demás actividades humanas.

Aplicaciones del átomo La radiación atómica se emplea
para diagnosticar y descubrir algunas enfermedades y curar otras. Los motores nucleares impulsan a los barcos y, dentro de poco tiempo, harán lo mismo con los aeroplanos.
El átomo podrá proporcionar calor a ciudades enteras, generar fuerza para las naves espaciales, derribar montañas, abrir canales y descubrir nuevos yacimientos de minerales. Quizá aun pueda utilizarse para mejorar las condiciones climáticas de la Tierra.

Gracias.