Corrosión en Agua Dulce
-
Upload
omar-morteo -
Category
Documents
-
view
72 -
download
18
description
Transcript of Corrosión en Agua Dulce
Corrosión en agua dulce
Materia: Corrosión en ambientes naturales
Presenta: Jessy Marlen Durán Olvera Ángel Omar Morteo Flores
INSTITUTO DE INGENIERÍA
MAESTRÍA EN INGENIERÍA DE CORROSIÓN
Introducción
Las aguas dulces se caracterizan por su bajo contenido salino notablemente inferior al del agua de mar. De acuerdo con su procedencia, la composición de este tipo de aguas varia ampliamente conteniendo en mayor o menor cuantía sales y gases disueltos. Este tipo de aguas puede provenir de cualquier fuente superficial de la tierra, y generalmente contiene menos del 1% de cloruro de sodio.
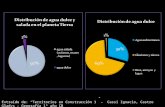
Las aguas de esta naturaleza pueden ser duras o suaves, ricas en calcio y sales de magnesio. Esto depende de los minerales que contenga disueltos. Considerando que, entre los principales constituyentes minerales disueltos en el agua dulce se encuentran los aniones bicarbonato, cloruro y sulfatos, y cationes de sodio, calcio y magnesio. Estos dos últimos, por su tendencia a la formación de compuestos de bajo producto de solubilidad, tienden a precipitar carbonatos e hidróxidos en las áreas catódicas. Los carbonatos, en agua dura, al ser depositados en la superficie del metal lo protegen, sin embargo puede ocurrir corrosión por hendidura si la esta capa protectora no se forma de manera completa. En cuanto al agua suave se considera que esta es mas corrosiva debido a que no forma depósitos protectores. Aquí reside la explicación de la menor corrosividad que presentan las aguas duras respecto a las blandas. grados de dureza que pueden ser estimados a través de los índices de Langelier o Ryznar o puede ser determinado con precisión por titulación con soluciones de agentes quelantes estandarizados.
2
El factor controlante del proceso de corrosión metalica por aguas dulces dependerá de la facilidad o dificultad con la que se llevan a cabo las reacciones anódica y catódica, y de la resistencia óhmica de la pila de la corrosión.
Cabe inferir, respecto al punto anterior, que la baja conductividad del electrolito (10.000-20.000 ohm.cm frente a los 30-50 ohm.cm de agua de mar), motivada por su exiguo contenido salino, puede oponerse al funcionamiento de las pilas de corrosión, la cuales quedaran bajo control de resistencia. No obstante, en el grado de corrosividad, si no también de los solidos y gases disueltos, así como del pH de la solución.
Tomando como referencia que la corrosión por el agua de mar, el oxigeno disuelto en el agua, elemento necesario para que se verifique el proceso catódico, tiene una importancia capital en el progreso de la corrosión en soluciones acuosas. Corrientemente, las aguas aireadas son mas corrosivas que las poco oxigenadas. En otros casos, a pesar de existir en solución moléculas de oxigeno, el proceso catódico de reducción puede estar dificultando a causa de la precipitación de compuestos de corrosión bajo producto de solubilidad en las zonas catódicas, donde, como es sabido, ocurre una alcalinización del electrolito.
En ocasiones, esta formación de capas protectoras, que limita el acceso de oxigeno a la superficie metalica, puede ser motivada por la acción de otros factores, por ejemplo, por el efecto de la temperatura sobre las paredes de los calentadores de agua.
Estas condiciones expuestas responden a la aceptación de que el proceso catódico predominante sea el de reducción de las moléculas de oxigeno , por otro lado, normal en este tipo de soluciones que tiene un pH comprendido entre 6 y 8 unidades. No sucede así en aguas dulces que contienen cantidades considerables de ácidos (aguas de mina) o sales metálicas oxidantes (sulfato férrico, sulfato de cobre) ,donde otras reacciones catódicas pueden adquirir un mayor relieve.
Por lo que la corrosividad en agua dulce depende del contenido de oxígeno, dureza, contenido de cloruros, contenidos de azufre y muchos otros factores. Por ejemplo, un tanque de acero de agua caliente en un inicio puede durar por 20 años en un área pero solo un año o dos en otras áreas. El contenido de carbono puede variar de unas cuantas partes por millón (ppm) a varios cientos de un país a otro. Los componentes de sulfuro en algunas localidades pueden causar la rápida corrosión del acero. Por esta razón es difícil realizar una recomendación general debido a que se trata de un problema local.
3
Los materiales mas ampliamente usados para el manejo de agua dulce son hierro fundido, acero y el acero galvanizado. El cobre el latón, aluminio y algunos aceros inoxidables, monel y cuproníquel también son usados cuando los factores son la temperatura, contaminación y duración.
De manera general la corrosión de los materiales metálicos que se encuentran en contacto con agua se lleva a cabo bajo el siguiente mecanismo:
Reacción anódica: Me↔Men+¿+ en−¿¿ ¿
Reacción catódica: O2+2H 2O+4 e−¿↔4OH−¿¿ ¿
Como se mencionó anteriormente, debido a que se requiere del oxígeno para realizar este mecanismo electroquímico, generalmente existe una relación proporcional entre la velocidad de corrosión y la concentración del oxígeno presente en el electrolíto. Auque en algunos casos en los que al existir alta concentranción de O2 se produce la pasivación, la velocidad de corrosión se verá disminuida notablemente.
Factores que influyen en el nivel de agresividad del agua dulce
Contenido en gases de O2 y CO2
La presencia de otros gases disueltos como el CO2, además del O2, y el contenido en sales de agua, que influye notablemente en su conductividad, son otros factores que determinan la agresividad del agua. También se requiere considerar aspectos como temperatura y velocidad de desplazamiento del agua sobre la superficie metálica para estimar el comportamiento a la corrosión de los metales en su contacto.
(completar con lo del libro)
En cuanto al O2, en general su solubilidad en agua es escasa y es difícil su transporte hasta la superficie catódica, por lo que, habitualmente estos procesos de corrosión aparecen bajo control catódico debido a la aparición de fenómenos de polarización de difusión.
En el caso del acero la velocidad de corrosión promedio en contacto con el agua está comprendida entre 15 y 25 mdd (miligramos/ decímetro cuadrado/día) aumentando a medida que aumenta la velocidad de desplazamiento del fluido como consecuencia del efecto de despolarización catódica. El efecto es más
4
marcado por encima de ciertos valores críticos de velocidad a partir de los cuales se inician fenómenos de corrosión-erosión. Para concentraciones altas de oxígeno, por encima de 12-15 mlO2/litro, se produce la pasivación que son del orden de 8 mdd.
Son habituales las pilas de aireación diferencial con ataque y formación de picaduras en regiones de resquicio o de sedimentos mal aireadas. Estas pilas de aireación diferencial pueden degenerar en pilas activas-pasivas para contenidos de oxígeno en el límite entre el estado activo y pasivo de la aleación que pueden provocar ataques especialmente graves, en las regiones desaireadas, lo que impide, en la práctica, el empleo de presiones de oxígeno relativamente elevadas como procedimiento para producir la velocidad de corrosión del acero.
En sistemas cerrados de circulación de agua, como las instalaciones de calefacción, la corrosión puede llegar a ser prácticamente nula al consumirse, durante las primeras etapas, el oxígeno por reacción catódica, de manera que a partir de un cierto tiempo, la falta de reactivo catódico evita el fenómeno electroquímicode la corrosión.
La influencia del CO2 es, en general, mínima en el nivel de agresividad del agua respecto del acero. Sólo en casos extremos cuando la concentración es alta se producir una ligera acidificación del agua, por la formación de ácido carbónico, lo que puede influir en la cinética de corrosión. Cuando se trata de cinc (fundamentalmente acero galvanizado) la presencia de CO2 puede cambiar los producto de corrosión de hidróxicos a carbonatos básicos de cinc, de menor poder protector, aumentando las velocidades de corrosión del metal. También aumenta el CO2 la agresividad del agua respecto al cobre, modificando la composición de las capas protectoras, lo que se traduce en aumentos de la velocidad de corrosión. Por otra parte el CO2 facilita el ataque por picadura en el cobre en contacto con el agua.
El CO2 regula el equilibrio carbonato-bicarbonato.
CO2Ca+H2O+CO2↔¿
Como se mencionó anteriormente, las aguas duras son menos corrosivas que las blandas o suves debido a la facilidad para precipitar carbonatos insolubles de Ca y Mg sobre las regiones catódicas al aumentar, en su vecindad, el pH por formación de OH- como consecuencia de la reducción de O2. La precipitación de estos carbonatos e hidróxidos polariza la reacción catódica reduciéndose la velocidad de corrosión. La abundancia de CO2 desplaza el equilibrio hacia la formación de
5
bicarbonatos parcialmente solubles, lo que facilita aumentos en la velocidad de corrosión.
Con el fin de clasificar un agua en función de su agresividad es habitual manejar el concepto de “índice de saturación” IS, que se define como:
IS=pH real−pH s
Siendo,pH real :el pHmedido del agua
pH s : pCa+ pAlc+ pK2+pK s
pCa=log 1
ConcentracióndeCa2+¿ en ppm¿
pAlc=log 1ConcentracióndeCa3Caen ppm
pK2=log1
Concentraciónendisolución delCO3H−¿ ¿
pK s=log1
productode solubilidad delCaCO3
Un IS positivo denota que el agua está sobre saturada de CaCO3 y habrá tendencia a la formación de capas protectoras; un índice de saturación del 0.5 se considera satisfactorio. Si IS es negativo el CaCO3 tenderá a disolverse formando bicarbonatos y el agua será agresiva. El razonamiento sólo es aplicable para pHs comprendidos entre 6.5 y 9.5, situación habitual en la mayoría de las aguas dulces.
Por lo que respecta a la temperatura, su aumento, dentro de ciertos márgenes, produce aumentos en la velocidad de corrosión al facilitarse el transporte difusional de O2, de manera que, en el caso del acero, la velocidad de corrosión aproximadamente se duplica por cada 30ºC de aumento de temperatura. Si el material metálico aparece cubierto de agua y está en contacto con la atmósfera, a partir de los 80ºC se observa una disminución de la velocidad de corrosión al eliminarse la mayor parte del O2 disuelto por “arrastre de vapor”. En un sistema cerrado en el que el O2 no puede escapar, la velocidad de corrosión aumenta linealmente con la temperatura.
6
En el caso del cinc, es preciso recordar que por encima de temperaturas del orden de los 60ºC los productos de corrosión pasan de Zn(OH)2 a ZnO, lo que propicia la inversión de la polaridad del cinc con respecto al hierro y se puede generar ataque por picadura en el caso de empreo de tubería galvanizada. La temperatura de inversión disminuye al aumentar la concentración de nitratos y/o carbonatos y aumenta al aumentar la concentración de cloruros y/o sulfatos disueltos.
Para pHs comprendidos entre 4 y 10, la situación habitual en el agua dulce, el pH no influye prácticamente en la velocidad de corrosión del acero. A pH<4 se disuelve la película constituidos por productos oxidados del hierro, la superficie queda libre de capas protectoras y además la reacción catódica para a ser al menos en parte la reducción de protones, con lo que la velocidad de corrosión aumenta de manera relevante.
En caso de medios fuertemente alcalinos la velocidad de corrosión disminuye como consecuencia de alcanzarse la pasivación del acero. Sin embargo, en ausencia de oxígeno disuelto y a alta temperatura (caso del agua en calderas en centrales térmicas de producción de energía en presencia de captadores de oxígeno), a pH por encima de 11 aproximadamente, la capa de magnetita se disuelve con formación de hidrógeno a través de reacciones como la que se indica a continuación, lo que puede propiciar fenómenos de agrietamiento por fragilización por hidrógeno en calderas, recalentadores evaporadores, etc., circunstancia que debe evitarse.
Fe3O4+2H 2O ( pH>11)↔3 FeO2−¿+2 H2¿
Mientras la reacción catódica sea reducción de O2 las características microestructurales del acero al carbono no influyen sobre la cinética de corrosión en contacto con el agua. Sin embargo, en situaciones en que participe la reacción de reducción de protones la velocidad de corrosión es mayor a medida que aumenta el contenido en carbono del acero y, en consecuencia, la proporción de cementita que forma parte de las colonias perlíticas debido a que el Fe3C es una fase que presenta baja sobretensión para la descarga de hidrógeno. Cuando el acero aparce agrio (laminado en frío, por ejemplo, o, en general , deformado en frío) las áreas deformadas presentan también baja sobretensión para la descarga de hidrógeno y, por tanto, la velocidad de corrosión ácida es mayor que en un acero recocido.
Por lo que respecta al cinc, su empleo queda restringido a pHs comprendidos entre 6 y 12 , pues en medios ácidos o de alta alcalinidad la velocidad de corrosión crece exponencialmente por tratarse de un metal anfótero. En medios ácidos el cinc se disuelve como Zn2+ en las regiones anódicas con reacción catódica de
7
formación de hidrógeno en las catódicas y, en medios fuertemente alcalinos, la disolución se produce por formación de anión cincato (ZnO2
2-).
La resistividad del agua es otra variable de importancia relevante en cuanto a los fenómenos de corrosión que se den en metales en su contacto, fundamentalmente por lo que respecta a la existencia de un mayor o menor control de resistencia y a su influencia en procesos de corrosión galvánica. La extensión de la pila bimetálica es tanto mayor cuanto menor es la resistividad del agua; por el contrario, en aguas resistivas el ataque sobre el metal de comportamiento anódico se localiza sobre una superficie restringida próxima a la unión.
Efecto de la temperatura
Normalmente la velocidad de corrosión, como la de otras muchas reacciones, aumenta con la temperatura. En el caso de metales en contacto con l agua, la aceleración del proceso de corrosión con la temperatura se debe, en otras razones, al aumento de la velocidad de difusión del oxigeno hacia las áreas catódicas de la superficie metalica, el aumento de la movilidad iónica ( y con ella de la conductividad) y a la tendencia a formar películas no protectoras.
Bajo las condiciones de control catódico normalmente impuestas por la llegada de oxigeno a la superficie metalica, la velocidad de corrosión para una concentración constante de O2, se duplica, aproximadamente, por cada 30º C que aumente la
8
temperatura. En un recipiente abierto que permita escapar el oxigeno disuelto, la velocidad de corrosión aumenta con la temperatura hasta cerca de los 80 ºC comenzando entonces a disminuir hasta alcanzar valores muy bajos en el punto de ebullición (Fig. 1). La disminución de la corrosión que tiene lugar en el caso de sobrepasar los 80º C , esta asociada con el marcad descenso de la solubilidad del O2, en el agua a medida que aumenta la temperatura, efecto que, al superar los 80º C predomina desde la acción aceleradora propia del aumento de temperatura.
Fig. 1. Variación de la corrosión respecto a la temperatura
En los sistemas de agua caliente de consumo domestico, la velocidad de corrosión aumenta de manera constante al crecer la temperatura. El máximo de la curva de corrosión- temperatura esta desplazado hacia las temperaturas mas altas como resultado de los mayores niveles de solubilidad del oxigeno en sistemas presurizados. Muy distinto es el caso de los circuitos cerrados, como los de la calefacción, en los que prácticamente no hay renovación de agua ni aporte de oxigeno, y en las que una vez agotado el O2, que inicialmente contenía disuelto el agua del circuito, la corrosión queda detenida.
Prescindiendo de los circuitos cerrados de calefacción, en los que emplean conducciones de acero desnudo, el material mas utilizado todavía para la
9
conducción de agua caliente de consumo domestico es, seguramente, el acero galvanizado. En condiciones normales, el Zn es anódico respecto al Fe, por que primero confiere protección catódica al segundo en las zonas pequeñas desnudas que en mayor o menor proporción pueden encontrarse en el acero galvanizado. La corrosión en el cinc en medio acuoso, a temperatura ambiente, origina Zn(OH)2 , floculento, poco adherente y de escasa conductividad, que no altera el proceso anódico, pero por encima de los 60º C tiende a formarse sobre el cinc una película de ZnO, compacta, eléctricamente conductora y catódica respecto al Fe. Esta inversión de polaridad haría que el acero desnudo existente en el fondo de los poros y arañazos del recubrimiento actuase o actuara como ánodo respecto a una superficie catódica, por lo que la corrosión en e acero podría ser muy severa tendiendo a ser una corrosión de tipo local, pudiendo llegar a perforación del tubo sin que el galvanizado sufriera ataque alguno. Para que la inversión de la polaridad tenga lugar parece que, además de una temperatura superior de 60º C , es necesaria cierta concentración de O2 disuelto, la presencia de nitratos y sobretodo de bicarbonatos, viéndose impedida o dificultándose la existencia de iones Cl- y SO4
-, incluso en concentraciones muy bajas como 10 ppm, por lo que afortunadamente, es poco probable que se produzca en las redes de distribución de agua potable. No obstante, es bien conocida la recomendación de no sobrepasar en el gua caliente los 60º C, temperatura mas que suficiente a efectos prácticos para consumo domestico, por encima de la cual se aceleran los procesos de corrosión, favoreciéndose la formación de tubérculos voluminosos y se disminuye o se anula la acción protectora de diversos inhibidores.
10
Recomendaciones para reducir el riesgo de corrosión de materiales metálicos en contacto con agua dulce.
De acuerdo con lo anteriormente planteado es posible establecer las siguientes recomendaciones:
a) Evitar la introducción de aire (oxígeno) en el circuito, por ejemplo por el empleo de bombas.
b) Evitar la formación de pares galvánicos o introducir un aislamiento eficaz entre los metales disimilares cuando sea necesaria su introducción en el circuito.
c) En conductores de acero galvanizado la temperatura del agua no deberá superar los 60ºC.
d) En los casos en que sea posible, tratar el agua mediante el empleo de inhibidores que disminuyan el contenido de oxígeno disuelto (sulfitos, hidracina, etc.).
e) Aplicar las recomendaciones que puedan tomarse con respecto al tipo de corrosión por erosión.
11