Clasificacion y Propiedades De La Materia
-
Upload
javier-cifuentes -
Category
Documents
-
view
213 -
download
0
description
Transcript of Clasificacion y Propiedades De La Materia

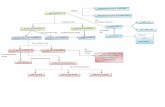
Clasificación y Propiedades De La Materia
Las sustancias: Un cuerpo no es más que una porción de materia, y la clase particular de materia que lo forma se llama sustancia. Por ejemplo, una mesa, una puntilla y una nube son cuerpos. A su vez, el cuerpo "mesa" puede estar hecho de madera, de hierro o de plástico. La madera, el hierro y el plástico son ejemplos de sustancias. Sustancias puras: Al analizar una muestra pura de sal común siempre encontramos los mismos valores para propiedades tales como, la solubilidad (36 g/100cm3 a 20°C), la densidad (2,16 g/cm3) y el punto de fusión (801°C). Los valores de las propiedades específicas de las sustancias puras siempre son los mismos. Una sustancia pura, es cualquier clase de materia que tiene composición fija y presenta propiedades definidas y reconocibles. Elementos y compuestos químicos: Según la composición química, las sustancias puras se clasifican en, sustancias simples o elementos químicos, y sustancias compuestas o compuestos químicos. Un elemento químico, es una sustancia que no puede descomponerse en otras sustancias diferentes de ella, por ejemplo, el hierro (Fe) es un elemento químico ya que del hierro no se pueden obtener otras sustancias diferentes de él. Un compuesto químico, es una sustancia formada por la combinación de dos o más elementos químicos, y que, por tanto, puede descomponerse en otras sustancias simples; la sal común (NaCI) es un compuesto químico ya que se puede descomponer en sus elementos: Cloro (Cl) y Sodio (Na). Mezclas: Una mezcla es la reunión de dos o más sustancias. Las mezclas pueden ser homogéneas o heterogéneas. Son mezclas homogéneas: aquellas en las que sus componentes no pueden distinguirse a simple vista. El aire es una mezcla homogénea compuesta principalmente por oxígeno, nitrógeno y gas carbónico. Son mezclas heterogéneas: aquellas en las que sus componentes sí pueden distinguirse a simple vista. El granito es una mezcla heterogénea compuesta por cuarzo, feldespato y mica. Propiedades de las sustancias: Si tomamos en nuestras manos una piña y la probamos, de ella podremos reconocer, entre otras, las siguientes propiedades: color, olor, sabor, tamaño, peso y volumen. Pero no todas estas propiedades sirven para diferenciar una sustancia de otra. De las propiedades anteriormente mencionadas, sólo el color, el olor y el sabor nos permiten diferenciar una naranja de una piña. Las propiedades que permiten identificar clases de sustancias reciben el nombre de propiedades características o propiedades específicas. Por el contrario, propiedades como el peso y el volumen no sirven para identificar clases de sustancias. Si nos dicen que una fruta tiene un

volumen de 200 cm3, con este dato no podemos saber qué clase de fruta es. Las propiedades que no permiten identificar clases de materia reciben el nombre de propiedades generales. Masa: de un cuerpo es la cantidad de materia que dicho cuerpo posee. Aunque todos los cuerpos están formados por materia, no todos los cuerpos tienen la misma cantidad de materia. Para calcular la masa o cantidad de materia que un cuerpo tiene, se utiliza la balanza. En el Sistema Internacional de Unidades, la masa de los cuerpos se mide en 22

Kilogramos (kg), aunque para, medir la masa de los cuerpos pequeños se utiliza, el gramo (g). Si a una cierta altura del suelo soltamos un cuerpo; éste cae, esto nos indica que existe una fuerza que actúa sobre él, es la fuerza de la gravedad que la Tierra ejerce sobre todos los cuerpos, atrayéndolos hacia su centro, esta fuerza es conocida con el nombre de peso; cuanto mayor sea la masa de un cuerpo mayor será su peso o la fuerza con que la Tierra lo atrae. El instrumento que permite medir el peso de los cuerpos se llama dinamómetro, el dinamómetro consiste en un tubo cilíndrico en cuyo interior hay un resorte de acero, uno de los extremos de este resorte está sujeto a otro tubo que sale al exterior, cuando a este extremo se le cuelga un peso, el muelle se estira y un indicador marca el valor del peso, por ser el peso de los cuerpos una fuerza, se mide en newton(N). El volumen: de un cuerpo es la cantidad de espacio que dicho cuerpo ocupa. En el Sistema Internacional de Unidades, el volumen de los cuerpos se mide en metros cúbicos (m3); pero, por ser esta unidad muy grande, es más cómodo usar el litro (I) o el centímetro cúbico (cm3). Para medir el volumen de un cuerpo se debe tener en cuenta si éste es sólido, líquido o gaseoso. Si.es sólido y tiene forma geométrica definida, el volumen se calcula mediante la aplicación de fórmulas. Por ejemplo, el volumen de un ladrillo se obtiene aplicando la fórmula v = l x h x a, en donde v es volumen, l es el largo, h es el alto y a es el ancho. Si el sólido tiene forma irregular, como por ejemplo una llave, lo más sencillo es utilizar el método de la medida por diferencia, sumergiéndolo en una probeta con agua. La probeta es un tubo cilíndrico de vidrio, que lleva grabada en su exterior una escala graduada en centímetros cúbicos. El volumen del cuerpo se obtiene restando, del valor que marca el nivel del agua después de introducir el cuerpo, el valor que marcaba el nivel del agua antes de introducir el cuerpo. Propiedades características: Las propiedades características de las sustancias no dependen de la cantidad de materia. Una lámina de cobre y un tubo de cobre, siempre tienen el mismo color y brillo, sin importar su tamaño, así como también un terrón de azúcar tiene el mismo sabor que unos pocos granos de azúcar. Por lo tanto, color, brillo y sabor son propiedades características. Estas tres propiedades indicadas anteriormente no son suficientes para identificar la gran variedad de sustancias que hay en la naturaleza. Para conseguirlo, es necesario recurrir a otras propiedades, como densidad, punto de ebullición, punto de fusión, solubilidad y dilatación térmica. Clases de propiedades características: Las propiedades características pueden ser físicas y químicas. Las propiedades físicas, son las que se pueden determinar sin que los cuerpos alteren o varíen su naturaleza, por ejemplo, la densidad y los puntos de fusión y de ebullición. Si cortamos una vajilla de aluminio en fragmentos de 1 cm3, encontraremos que todos tienen la misma masa: 2,7 g, no importa de qué parte de la varilla tomemos la muestra. Si tomamos diferentes muestras de agua de 1 cm3 encontramos que cada centímetro cúbico de agua tiene también la misma masa, 1 g. Esto quiere decir que la masa de 1 cm3 de una sustancia

es la misma para cualquier muestra del mismo volumen, pero es diferente para otras clases de sustancias. Por lo tanto, la masa de un centímetro cúbico es una propiedad característica que sirve para diferenciar clases de sustancias. Esta característica se conoce con el nombre de densidad. Densidad es la masa en gramos que tiene un centímetro cúbico de sustancia; se puede calcular la densidad de cualquier muestra, dividiendo el valor de la masa por el valor de su volumen. Esta operación matemática se representa así: Donde d, es densidad, m, es masa y v, es volumen. Por ejemplo, si tenemos un trozo de hierro y encontramos que tiene una masa de 78 g y un volumen de 10 cm3, su densidad será: Es decir, que 1 cm3 de hierro tiene una masa de 7,8 g. La unidad más usual de densidad es el gramo dividido por centímetro cúbico (g/cm3). Muchas veces habrás oído decir que el hierro es más pesado que la madera; esto es incorrecto. En realidad, lo que ocurre es que el hierro es más denso que la madera. Por otra parte, es importante anotar que los sólidos menos densos que el agua flotan en ella y los más densos se hunden. Si a un recipiente con agua le agregamos hielo, y éste permanece en la mezcla, la temperatura del líquido será de 0°C. Si le suministramos calor, moderadamente, el hielo se fundirá poco a poco y la temperatura permanecerá constante, 0°C, durante el tiempo que tarde el hielo en fundirse. Este mismo proceso se puede observar con muchas sustancias, comprobándose que mientras las sustancias se funden, la temperatura permanece constante (aunque su valor es diferente para cada una de ellas). Al valor de temperatura a la cual una sustancia se funde, se le conoce con el nombre de punto de fusión. 23

El punto de fusión, es una propiedad característica de la sustancia porque permite su identificación. Si calentamos un recipiente con agua, la temperatura de ésta aumentará de manera continua, hasta que comience a hervir. En ese momento el termómetro marcará 100°C, si estamos al nivel del mar. Esta temperatura se mantendrá constante durante el tiempo que dure la ebullición. Si realizamos la experiencia con alcohol, podremos observar que éste hierve a 78,4°C y que la temperatura permanecerá constante durante el cambio de estado. A la temperatura a la cual un líquido hierve se le conoce con el nombre de punto de ebullición. El punto de ebullición también es una propiedad característica de las sustancias. Cada líquido tiene su propio punto de ebullición. Si el hielo se funde a 0°C y el agua hierve a 100°C, el agua se mantiene líquida entre este intervalo de temperaturas. Para cada sustancia el intervalo de temperaturas comprendidas entre el punto de fusión y el punto de ebullición es constante y único. Este intervalo recibe el nombre de zona líquida y es también una propiedad característica de las sustancias. Cuándo mezclamos dos o más sustancias, de tal manera que al cabo de cierto tiempo sea imposible distinguir unas de otras, decimos que se ha formado una disolución. Una disolución, es una mezcla homogénea, es decir, una mezcla en la cual no se pueden distinguir visualmente los componentes. Obtenemos disoluciones cuando mezclamos agua y sal, agua y alcohol, agua y azúcar. Pero en todas las disoluciones hay dos componentes, el disolvente y el soluto. El disolvente es la sustancia que se encuentra en mayor proporción. El soluto es la sustancia que se encuentra en menor proporción. Al disolver una cucharada de sal en un vaso con agua, el disolvente es el agua, y el soluto es la sal. La solubilidad de una sustancia es la capacidad qué tiene dicha sustancia para, a una determinada temperatura, disolverse en otras, por lo general, la solubilidad de una sustancia sólida o líquida aumenta a medida que aumenta la temperatura. Por otra parte, la solubilidad como propiedad característica se observa en el hecho de que no todas las sustancias se disuelven en un mismo disolvente. Por ejemplo, en el agua se disuelve el alcohol y la sal pero no el aceite ni la gasolina. Las propiedades químicas, son las que determinan el comportamiento de las
sustancias cuando se ponen en contacto con otras. Cuando determinamos una
propiedad química, las sustancias cambian su naturaleza. La oxidación es una
propiedad química.