Ciencias Biológicas 1 Lic. José Pinela Castro. Atomos, Moléculas y Vida.
-
Upload
aurora-sevilla-torregrosa -
Category
Documents
-
view
228 -
download
0
Transcript of Ciencias Biológicas 1 Lic. José Pinela Castro. Atomos, Moléculas y Vida.

Ciencias Biológicas 1
Lic. José Pinela Castro

Atomos, Moléculas
y Vida

CONTENIDO DEL CAPÍTULO 2
2.1 ¿ Qué son los átomos?
2.2 ¿ Cómo interactúan los átomos para formar moléculas?
2.3 ¿ Por qué el agua es tan importante para la vida?

CONTENIDO DE LA SECCIÓN 2.1
• Los átomos son las unidades estructurales Los átomos son las unidades estructurales fundamentales de la materia y se componen fundamentales de la materia y se componen de tres tipos de partículas.de tres tipos de partículas.
• En el En el núcleo central hay protones, que núcleo central hay protones, que tienen carga positiva, y neutrones, que no tienen carga positiva, y neutrones, que no tienen carga.tienen carga.
• Los Los electrones giran electrones giran alrededoralrededor del núcleo del núcleo atómico y son partículas con carga atómico y son partículas con carga negativa.negativa.

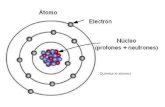
Tres Partículas Subatómicas
Protón:Protón:
Neutrón:Neutrón:
Electrón:Electrón:
• PesadoPesado• PositivoPositivo
• PesadoPesado• NeutroNeutro
• LivianoLiviano• NegativoNegativo

Los átomos difieren en elnúmero de protones
Los elementos pueden variar en electrones y neutrones, pero no en protones
El elemento carbono está formado por átomos con 6 protones
• Número Atómico = 6• Todos los átomos con 6 protones = carbono• Todos los átomos de carbono tienen 6 protones
Variación en el nº de electrones: ionesVariación en el nº de neutrones: isótopos

CAPAS DE ELECTRONESCAPAS DE ELECTRONES
• Los átomos más Los átomos más grandes pueden dar grandes pueden dar cabida cabida a a muchos electrones.muchos electrones.
• Los Los electrones se mueven dentro del electrones se mueven dentro del núcleo de un átomo en capas de núcleo de un átomo en capas de electrones.electrones.• La primera La primera capa o nivel de energía contiene capa o nivel de energía contiene
2 electrones.2 electrones.• La La segunda capa contiene hasta ocho segunda capa contiene hasta ocho
electrones.electrones.
Chapter 2 7

1.1. Modelos AtómicosModelos Atómicos
Hidrógeno (H)Hidrógeno (H) Helio (He)Helio (He)NúcleosNúcleos
Capa
Electrónica

Diferentes Diferentes Tipos de Atomos de Atomos
Helio
Max 2eMax 2e--Max 2eMax 2e--
Carbono
+7p+7p++
+4p+4p++
+2p+2p++
capa electrónica más interna
+4e+4e--
+4n+4n±±
+2n+2n±±
+2e+2e--
Oxígeno Max 8eMax 8e--Max 8eMax 8e--
+7e+7e--
+8n+8n±±
Fósforo
+5p+5p++
+5e+5e--
+4n+4n±±
Calcio
22ee--
22nn 22pp++6e6e--
66nn 6p 6p++
8e8e--
88nn 8p 8p++15e15e--
1616nn 15p 15p++20e20e--
2020nn 20p 20p++

CAPTAR Y LIBERAR ENERGÍACAPTAR Y LIBERAR ENERGÍAChapter 2 10
• La vida depende de la capacidad de los electrones La vida depende de la capacidad de los electrones para captar y liberar energía.para captar y liberar energía.
• Las capas de electrones corresponden a niveles de Las capas de electrones corresponden a niveles de energía.energía.
• Cuando un átomo se excita usando energía provoca Cuando un átomo se excita usando energía provoca que los electrones salten de una capa de electrones que los electrones salten de una capa de electrones de menor energía a otra de mayor energía.de menor energía a otra de mayor energía.
• Poco después, el electrón regresa espontáneamente a Poco después, el electrón regresa espontáneamente a su capa de electrones original, liberando la energía. su capa de electrones original, liberando la energía.

LA ENERGÍA SE CAPTA Y SE LA ENERGÍA SE CAPTA Y SE LIBERA LIBERA
Chapter 2
FIGURA 2-3 La energía se capta y se libera
Un electrón absorbe energía
energía
El electrón regresa a la capa
de menor nivel de energía
y libera la energía en forma
de luz
Luz
La energía impulsa al electrón
hacia un nivel de energía superior

CONTENIDO DE LA SECCIÓN 2.2
.¿Cómo interactúan los átomos para formar moléculas?
.Enlace iónico
.Enlace Covalente
.Puentes de hidrógeno

Enlace Covalente — electrones compartidos
• Compartición no equitativa — polar• Compartición equitativa — no polar
Enlace Iónico — transferencia total de electrones
• Ambos átomos están ionizados• Pueden disociarse en agua
Enlaces Químicos

Los enlaces involucran a electronesLos enlaces involucran a electrones
Se requiere un par de electrones por enlace.
Los electrones periféricos forman enlaces.
Se comportan según “ley del octeto”
Si se acercan a 8 en la capa más externa• Atraen más electrones
Si son menos de 4 en la capa externa• Atraen a menos electrones

Enlaces covalentes
(a) En el gas hidrógeno, se comparte un electrón de cada átomo de hidrógeno, para formar un enlace covalente sencillo. La molécula de hidrógeno resultante se representa como H–H ó H2.
(a) En el gas hidrógeno, se comparte un electrón de cada átomo de hidrógeno, para formar un enlace covalente sencillo. La molécula de hidrógeno resultante se representa como H–H ó H2.
(b) En el gas oxígeno, dos átomos de oxígeno comparten cuatro electrones, para formar un doble enlace.(O=O u O2).
(b) En el gas oxígeno, dos átomos de oxígeno comparten cuatro electrones, para formar un doble enlace.(O=O u O2).

Formación de la molécula de oxígenoFormación de la molécula de oxígeno
Átomo de OxígenoÁtomo de Oxígeno Átomo de OxígenoÁtomo de Oxígeno
Molécula de Oxígeno Molécula de Oxígeno (O2)

Enlace Iónico en NaCl
(b) El Sodio pierde un electrón; el cloro gana un electrón. El Sodio se convierte en ión positivo; el cloro en ión negativo.
(a) El Sodio tiene sólo un electrón en su última capa; el cloro tiene 7.
(a) El Sodio tiene sólo un electrón en su última capa; el cloro tiene 7.

±±++
––
±±++±±++±±++ ±±++±±++±±
++±±++
––
––
–– ––––
––
±±++
––
––
––
±±++
––
±±++±±++±±++ ±±++±±++±±
++±±++
––
––
–– ––––
––
±±++
––
––
––––
––
––
––
––––
––
Enlace Iónico en NaCl
±±++
––
±±++±±++±±++ ±±++±±++±±
++±±++
––
––
–– ––––
––
±±++
––
––
––
––
SodioSodio#e=2+8+1=#p
±±++
––
±±++±±++±±++ ±±++±±++±±
++±±++
––
––
–– ––––
––
±±++
––
––
––––
––
––
––
––––
––Cloro#e=2+8+7=#p
––
––
Ión sodio #e=#p-1
Cloruroion #e=#p+1
––
Electróntotalmente transferido
Carganegativa
Cargapositiva

Enlace Iónico en NaCl
ClCl-- ClCl-- ClCl-- ClCl--
ClCl-- ClCl-- ClCl-- ClCl--
ClCl-- ClCl-- ClCl-- ClCl--
ClCl-- ClCl-- ClCl-- ClCl--
NaNa++ NaNa++ NaNa++
NaNa++ NaNa++ NaNa++
NaNa++ NaNa++ NaNa++
NaNa++
NaNa++
NaNa++
NaNa++ NaNa++ NaNa++ NaNa++
Dado que las partículas con carga positiva se atraen mutuamente, los iones Na y Cl resultantes se acomodan íntimamente en un cristal de sal, NaCl (prefectamen-te cúbicos).
ClCl-- ClCl-- ClCl-- ClCl--
ClCl-- ClCl-- ClCl-- ClCl--
ClCl-- ClCl-- ClCl-- ClCl--
ClCl-- ClCl-- ClCl-- ClCl--
NaNa++ NaNa++ NaNa++
NaNa++ NaNa++ NaNa++
NaNa++ NaNa++ NaNa++
NaNa++
NaNa++
NaNa++
NaNa++ NaNa++ NaNa++ NaNa++

El agua es CovalenteEl agua es Covalente
Un par de electrones forman enlace covalente
Pasan un tiempo conuno, luego con el
otro átomo.
Menos tiempo con H, más tiempo con el O
Causa la polaridad de la molécula de H2O

Molécula de agua HMolécula de agua H22OO
H HO
OxígenoOxígeno
HidrógenosHidrógenos

Enlace Polar v/s No polar
Distribución de carga en la molécula
Polar — superficie cargada Prefiere otras moléculas con carga Solubles en agua
No polar — sin carga residual Prefiere moléculas sin carga Solubles en aceites

Patrones de enlacesde átomos comunes
AzufreAzufre
FósforoFósforo
OxígenoOxígeno
NitrógenoNitrógeno
CarbonoCarbono
HidrógenoHidrógeno

Enlace Puente de Hidrógeno Enlace Puente de Hidrógeno
OO
OO
HH
HH
HHHH++
++
++
––
––
++
++
Puentes de Hidrógeno
Los puentes de hidrógeno son atracciones electricas entre moléculas que tienen enlaces polares.
Los puentes de hidrógeno son atracciones electricas entre moléculas que tienen enlaces polares.
El enlace de hidrógeno se forma entre el O de una molécula y el H de otra.
El enlace de hidrógeno se forma entre el O de una molécula y el H de otra.

CONTENIDO DE LA SECCIÓN 2.3CONTENIDO DE LA SECCIÓN 2.3
• ¿ Por que el agua es tan importante para la ¿ Por que el agua es tan importante para la vida?vida?
-interviene en muchas reacciones químicas-interviene en muchas reacciones químicas que ocurren en las células vivas.que ocurren en las células vivas. -es considerado el disolvente universal-es considerado el disolvente universal -las soluciones en agua pueden ser ácidas -las soluciones en agua pueden ser ácidas neutras y básicas.neutras y básicas.
Chapter 2 25

Disolución de NaCl por AguaDisolución de NaCl por Agua
NaCl se une por enlace iónico
NaCl se une por enlace iónico
El agua es polar y cargada
El agua es polar y cargada
O se pega al Na+
O se pega al Na+
H se pega al Cl-
H se pega al Cl-

DisociaciónDisociación
++
AguaAgua
––
iónHidroxilo
iónHidroxilo
++
iónHidrógeno
iónHidrógeno
El agua disuelve muchas moléculas biológicas
El agua disuelve muchas moléculas biológicas
• El ión hidroxilo esnegativo y básico
• El ión hidroxilo esnegativo y básico
• El ión hidrógeno espositivo y ácido
• El ión hidrógeno espositivo y ácido
Hacen del agua un buensolvente
Hacen del agua un buensolvente
HH22OO Puente de HidrógenoPuente de Hidrógeno
Glucosa
HH22OO
HH22OOHH22OOHH22OO

Cohesiónentre Moléculas de Agua

La Escala de pH La Escala de pH
NeutralNeutralpHpH++ = pOH = pOH––
Acidez crecientepH+ > pOH–
Basicidad crecientepH+ < pOH–
0000 1111 2222 3333 4444 5555 6666 7777 8888 9999 10101010 11111111 12121212 13131313 14141414
Jugo deJugo delimón agriolimón agrio
jugo jugo gástricogástrico
Ácido clorhídrico
CervezaCerveza CaféCafé
OrinaOrina
AguaAgua
SangreSangre
Agua Agua de marde mar
BicarbonatoBicarbonatode Sodiode Sodio
Leche de Leche de magnesiamagnesia
AmoníacoAmoníaco
LimpiadorLimpiadorde hornosde hornos

Fin