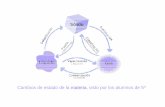
Cambios de estado de la materia
-
Upload
alejandro-cortez -
Category
Education
-
view
146 -
download
0
Transcript of Cambios de estado de la materia
UNIVERSIDAD DE GUADALAJARA - CUCEI
Cambios de estado de la materia
Alejandro Cortez SanchezProf.: Juan Carlos Ibarra Torres
3 de Octubre de 2013
1. Descripcion
Se observaron cambios de estado de la materia, los cuales se ilustraran y se explicarana continuacion
2. Objetivo
Conocer y describir los cambios de estado de la materia: Solido, Lıquido y Gaseoso;Cuando es sublimacon progresiva y cuando regresiva.
3. Desarrollo
Se enlistan, ilustran y describiran a continuacon los cambios de estado de la materia:
3.1. Solido a vapor - Vapor a solido
El cambio de estado de solido a vapor sin pasar por el estado lıquido se le llamasublimacion. Un ejemplo de esto es el hielo seco a temperatura ambiente.
Figura 1: Sublimacion de hielo seco.
1
El proceso inverso a este, es decir, el cambio de estado de vapor a solido, de igualmanera sin pasar por el estado lıqudo, se le llama deposicion. un ejemplo es el naftaleno,que cuando se producen vapores al calentarse y se pone sobre ellos un objeto que est muyfro, los vapores se transformarn nuevamente en cristales de naftalina.
Figura 2: Deposicion de naftalina.
Tambien se les llama ”Sublimacion progresiva” al cambio de solido a vapor, y ”Subli-macion regresiva” al cambio de vapor a solido. [1]
3.2. Evaporacion y ebullicion
Tanto la evaporacion como la ebullicion son cambios de estado lıquido a vapor. Laevaporacion consiste en el paso lento y gradual de un estado lıquido hacia un estadogaseoso, tras haber adquirido suficiente energıa para vencer la tension superficial. Se puedeproducir a cualquier temperatura, siendo mas rpido cuanto mas elevada y no es necesarioque toda la masa alcance el punto de ebullicion.
Figura 3: Ebullicion de agua.
2
Cuando existe un espacio libre encima de un lıquido, una parte de sus moleculas esta enforma gaseosa, al equilibrase, la cantidad de materia gaseosa define la presion de vaporsaturante, la cual no depende del volumen, pero varıa segn la naturaleza del lıquido y latemperatura. Si la cantidad de gas es inferior a la presion de vapor saturante, una partede las moleculas pasan de la fase lıquida a la gaseosa.
Cuando la presion de vapor iguala a la atmosferica, se produce la ebullicion. Esta serealiza cuando la temperatura de la totalidad del lıquido iguala al punto de ebulliciondel lıquido a esa presion. Si se contina calentando el lıquido, este absorbe el calor, perosin aumentar la temperatura: el calor se emplea en la conversion de la materia en estadolıquido al estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En esemomento es posible aumentar la temperatura de la materia, ya como gas. [1]
3.3. Lıquido a solido - Solido a lıquido
El cambio de solido a lıquido por accion de la temperatura se llama fusion. Cuandose calienta un solido, se transfiere calor a los tomos, los cuales vibran con mas rapidez amedida que ganan energıa. El proceso de fusion de la materia es el mismo que el de fundi-cion, pero este ultimo termino se aplica generalmente a sustancias como los metales, quese licuan a altas temperaturas, y a solidos cristalinos. Cuando una sustancia se encuentraa su temperatura de fusion, el calor que se suministra es absorbido por la sustancia du-rante su transformacion, y no produce variacion de su temperatura. Este calor adicionalse conoce como calor de fusion.
Figura 4: Fusion de hielo.
La solidificacion consiste en el cambio de estado de la materia de lıquido a solidoproducido por una disminucion en la temperatura o por una compresion de este material.Es el proceso inverso a la fusion, y sucede a la misma temperatura. [1]
3
3.4. Vapor a lıquido - Lıquido a vapor
Se denomina condensacion al cambio de fase de la materia que se encuentra en formagaseosa y pasa a forma lquida. Es el proceso inverso a la evaporacion.
Figura 5: Condensacion de vapor de agua.
Licuefaccion o licuacion de los gases es el cambio de estado que ocurre cuando una sus-tancia pasa del estado gaseoso al lıquido, por disminucion de la temperatura y el aumentode presion, llegando a una sobrepresion elevada, hecho que diferencia a la licuefaccion dela condensacion. Un ejemplo de esto es el gas domestico, su nombre comercial es Gas LP,lo cual significa ”Licuado de petroleo”, pues es la manera en la que se obtiene. [1]
3.5. Plasma
Se denomina plasma al cuarto estado de agregacion de la materia, un estado fluıdosimilar al estado gaseoso pero en el que determinada proporcion de sus partıculas estancargadas electricamente.
El plasma no tiene una forma definida o un volumen definido, a no ser que este ence-rrado en un contenedor; pero a diferencia del gas en el que no existen efectos colectivosimportantes, el plasma bajo la influencia de un campo magnetico puede formar estructurascomo filamentos, rayos y capas dobles. Los atomos de este estado se mueven libremente;cuanto mas alta es la temperatura mas rpido se mueven los atomos en el gas, y en elmomento de colisionar la velocidad es tan alta que se produce un desprendimiento deelectrones.
4
Calentar un gas puede ionizar sus moleculas o atomos reduciendo o incrementado sunumero de electrones para formar iones, convirtindolo en un plasma. La ionizacion tambinpuede ser inducida por otros medios, como la aplicacion de un fuerte campo electromagneti-co mediante un laser o un generador de microondas, y es acompaado por la disociacion delos enlaces covalentes, si estan presentes. [1]
Figura 6: Plasma en el interior de una lampara fluorescente.
4. Conclusiones
Los estados de la materia y los cambios entre estos, dependen de factores como latemperatura, la presion y las caracterısticas de la materia en cuestion, como sus respectivospuntos de fusion y ebullicion. Y en el caso especıfico del plasma, de la ionizacion.
Referencias
[1] http://es.wikipedia.org/wiki/Cambio de estado
5