Aula isomeria prevupe reta final
-
Upload
jesrayne-nascimento -
Category
Documents
-
view
2.019 -
download
0
description
Transcript of Aula isomeria prevupe reta final

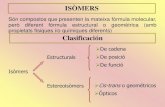
ISOMERIA
Prof. Bruno Ramos

carbonos hidrogênios oxigênio
C2H6O C2H6O
C C
H H
H H
H O H C C
H H
H H
H O H

Os compostos
H3C – CH2 – OH e H3C – O – CH3
são ISÔMEROS
ISÔMEROS
são compostos diferentes
que possuem a mesma fórmula molecular
A este fenômeno damos o nome de
ISOMERIA
Prof. Bruno Ramos

ISOMERIA
pode ser
Plana ou Constitucional Espacial ou estereoisomeria
Isomeria de cadeia.
Isomeria de posição.
Isomeria de compensação.
Isomeria de função.
Isomeria de tautomeria
Geométrica.
Espacial.
Prof. Bruno Ramos

ISOMERIA DE CADEIA OU NÚCLEO
É quando os isômeros pertencem à mesma função química,
mas possuem cadeias carbônicas diferentes.
H3C CH2 CH2 CH3H3C CH CH3
CH3
Ambos são hidrocarbonetos e possuem
cadeias carbônicas diferentes
H3C CH CH CH3
H2C CH2
H2C CH2
Prof. Bruno Ramos

ISOMERIA DE POSIÇÃO
É quando os isômeros pertencem à mesma função química,
mas diferem na posição de um
substituinte ou insaturação
Ambos são hidrocarbonetos e diferem na posição da dupla ligação
H2C CH CH2 CH3 H3C CH CH CH3
H3C CH CH2 CH3
OH
H2C CH2 CH2 CH3
OH
Ambos são alcoóis e diferem na posição da oxidrila
Prof. Bruno Ramos

ISOMERIA DE COMPENSAÇÃO OU METAMERIA
É quando os isômeros pertencem à mesma função química,
mas diferem na posição de um heteroátomo
Ambos são éteres e diferem na posição do heteroátomo (oxigênio)
H3C CH2 O CH2 CH3
H3C O CH2 CH2 CH3
H3C CH2 CO
O CH3
H3C CO
O CH2 CH3
Ambos são ésteres e diferem na posição do heteroátomo (oxigênio)
Prof. Bruno Ramos

ISOMERIA DE FUNÇÃO OU FUNCIONAL
É quando os isômeros pertencem à funções química diferentes
H3C CH CH2 CH3
OH
H3C CH2 O CH2 CH3
éter álcool
ácido carboxílico
H3C CH2 CO
OHH3C C
O
O CH3
éster
Prof. Bruno Ramos

ISOMERIA DE TAUTOMERIA
É quando os isômeros coexistem em equilíbrio químico dinâmico
ceto - enol
H2C C CH3
OH O
H3C C CH3
enol cetona
aldo - enol
H3C CH CH
OH
enol
H3C CH2 CO
Haldeído

01) Um isômero do éter CH3OCH3 é o:
a) ácido acético.
b) éter dietílico.
c) propanol.
d) etanol.
e) etano.
Fórmula molecular do éter
C2H6O
ácido acético
H3C – CO
OH
Fórmula molecular
C2H4O2
éter dietílico
H3C – CH2 – O – CH2 – CH3
Fórmula molecular
C4H10O
propanol
H3C – CH2 – CH2 – OH
Fórmula molecular
C3H8O
etanol
H3C – CH2 – OH
Fórmula molecular
C2H6O
Prof. Bruno Ramos

02) Indique, dentre as alternativas a seguir, a que apresenta um hidrocarboneto isômero do 2, 2, 4 – trimetil – pentano.a) octano.
b) pentano.c) propano.d) butano.e) nonano.
2, 2, 4 – trimetil – pentano
H3C – C – CH2 – CH – CH3
CH3
Fórmula molecularC8H18
CH3
CH3
H3C – CH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3
octano
Fórmula molecularC8H18

03) Os compostos etanol e éter dimetílico demonstram que caso
de
isomeria?a) Cadeia.
b) Posição.
c) Compensação.
d) Função.
e) Tautomeria.
Por pertencerem à funções
químicas diferentes
são
ISÔMEROS DE FUNÇÃO
Prof. Bruno Ramos

04) Os compostos etóxi – propano e metóxi – butano apresentam:
a) isomeria de cadeia.
b) isomeria de posição.
c) isomeria de compensação.
d) isomeria funcional.
e) tautomeria.
H3C – CH2 – O – CH2 – CH2 – CH3 etóxi – propano
diferem na posição do
HETEROÁTOMO
metóxi – butano H3C – O – CH2 – CH2 – CH2 – CH3
Prof. Bruno Ramos

05) A, B e C têm a mesma fórmula molecular: C3H8O. “A” tem
um
hidrogênio em carbono secundário e é isômero de posição de
“B”.
Tanto “A” como “B” são isômeros de função de “C”.
Escreva
as fórmulas estruturais e os nomes de A, B e C.Os compostos “A” e “B” são alcoóis
O isômero de função do álcool é um ÉTER
1 – propanol2 – propanol
metoxi – etano
H3C – CH – CH3
OH
H3C – CH2 – CH2
OH
H3C – O – CH2 – CH3

06) O propeno e o ciclopropano são representados,
respectivamente,
pelas fórmulas:
Pela análise dessas substâncias, pode-se afirmar que:
a) são polares.
b) são isômeros de cadeia.
c) apresentam diferentes massas moleculares.
d) apresentam mesma classificação de átomos de carbono.
e) apresentam diferentes tipos de ligação entre os átomos.
CH2 = CH – CH3
CH2
CH2
H2C
Prof. Bruno Ramos

07) (PUC-MG) “ A 4 – metil – 2 – pentanona é usada como solvente na produção de tintas, ataca o sistema nervoso central, irrita os olhos e provoca dor de cabeça”.O composto citado é isômero funcional de:
a) 1 – hexanol.
b) hexanal.
c) 4 – metil – butanal.
d) 4 – metil – 1 – pentanol.
e) pentanona.
4 – metil – 2 – pentanona
H3C – CH – CH2 – C – CH3
CH3 O
Fórmula molecular
C6H12O
1 – hexanol H3C – CH2 – CH2 – CH2 – CH2 – CH2 – OH
Fórmula molecular
C6H14O
hexanal
Fórmula molecular
C6H12O
OH3C – CH2 – CH2 – CH2 – CH2 – C =
H
Prof. Bruno Ramos

08) Entre os compostos abaixo ocorre isomeria:
a) de posição.
b) de cadeia.
c) cis – trans.
d) tautomeria.
e) óptica
e
O
H3C – C – CH3
OH
H2C = C – CH3=
Prof. Bruno Ramos

09) (UPE – 2007 – Q1) Analise o equilíbrio representado pela equação química abaixo:
Em relação ao conceito de isomeria, é verdadeiro afirmar que o equilíbrio:a) não exemplifica caso de isomeria.b) exemplifica um caso de isomeria de cadeia entre alcenos.c) apenas evidencia a mudança da fórmula estrutural do etanal para a cetona.d) evidencia um caso particular de isomeria funcional conhecido com o nome de tautomeria.e) evidencia tão somente o efeito ressonante entre alcoóis insaturados.
H2C CH
OH
H3C CO
H
Prof. Agamenon Roberto

Prof. Bruno Ramos

É quando os isômeros apresentam
as ligações entre seus átomos
dispostas de maneira diferente no espaço
Existem dois tipos de isomeria espacial
Isomeria geométrica ou cis-trans.
Isomeria óptica.
Prof. Bruno Ramos

Pode ocorrer em dois casos principais:
Em compostos com duplas ligações.
Em compostos cíclicos.
Prof. Bruno Ramos

Nos compostos com duplas ligações
deveremos ter a seguinte estrutura:
C = CR2
R1
R4
R3
R1 R2 R3 R4e
Prof. Bruno Ramos

H
H3C
H
CH3
A estrutura que apresentar
os átomos de hidrogênio
no mesmo lado do plano é
a forma CIS
A estrutura que apresentar
os átomos de hidrogênio em
lados opostos do plano é a
forma TRANS
CIS TRANS
C = C
HH3C
H CH3
C = C
Prof. Bruno Ramos

Nos compostos cíclicos a isomeria cis – trans é
observada quando aparecerem
grupos ligantes diferentes em dois carbonos do ciclo
H CH3
HH3C
TRANS
H
CH3
H
H3C
CIS
Prof. Bruno ramos

C
O composto que apresentar, do mesmo lado
do plano imaginário, os ligantes do carbono
com os maiores números atômicos (Z),
será denominado “Z”
o outro será o “E”
Cl
CH3CH3C
H
Z = 6 Z = 6
Z = 17 Z = 1 CCl
CH3C
H3C
H
CCl CH3
CH3C H
Z-2-clorobut-2-eno
E-2-clorobut-2-eno
Prof. Bruno Ramos

01) Dados os seguintes compostos orgânicos:
I. (CH3)2C = CCl2
II. (CH3)2C = CClCH3
III. CH3ClC = CClCH3
IV. CH3FC = CClCH3
Assinale a opção correta:
a) Os compostos I e III são isômeros geométricos.
b) Os compostos II e III são isômeros geométricos.
c) O composto II é o único que apresenta isomeria geométrica.
d) Os compostos III e IV são os únicos que apresentam
isomeria geométrica.e) Todos os compostos apresentam isomeria geométrica.
Prof. Bruno Ramos

02) (UESC) Admite isomeria geométrica, o alceno:
a) 2, 3 – dimetil – 2 – hexeno
b) 1 – penteno
c) 3 – metil – 3 – hexeno
d) eteno.
e) 4 – etil – 3 – metil – 3 – hexeno
2, 3 – dimetil – 2 – hexeno
H3C – C = C – CH2 – CH2 – CH3
CH3 CH3 ligantes iguaisligantes iguais
1 – penteno
H – C = C – CH2 – CH2 – CH3
H H
H3C – CH2 – C = C – CH2 – CH3
CH3
3 – metil – 3 – hexeno
Hligantes diferentes ligantes diferentes
Prof. Bruno Ramos

03) Apresenta isomeria cis - trans:
a) 1 – buteno.
b) 2 – metil – 2 – buteno.
c) 2 , 3 – dimetil – 2 – buteno.
d) 1 , 1 – dimetil – ciclobutano.
e) 1 , 2 – dimetil – ciclobutano.
1 – buteno
H C
H
CH3CH2
H
C
2 – metil – 2 – buteno
C
CH3
CH3
H
CH3C
2, 3 – dimetil – 2 – buteno
C
CH3
CH3
CH3
CH3C
1, 1 – dimetil – ciclobutano
C
C
CH3
C
H2H3C
CH2
H2
1, 2 – dimetil – ciclobutano C
C
CH3
C
H2
H
CH2
CH3
H
Prof. Bruno Ramos

04)(UESC) Admite isomeria geométrica, o alceno:
a) 2, 3 – dimetil – 2 – penteno.
b) 1 – penteno.
c) 3 – metil – 3 – hexeno.
d) eteno.
e) 4 – etil – 3 – metil – 3 – hexeno.
CH3
2, 3 – dimetil – 2 – penteno
H3C CH2C C
CH3
CH3
H
1 – penteno
H CH2C C
H
CH2 CH3
CH3
3 – metil – 3 – hexeno
H3C CCH2 C
H
CH2 CH3
Prof. Bruno Ramos

05) (U . DE UBERABA – MG) As balas e as gomas de mascar com sabor de canela contêm o composto cinamaldeído (ou aldeído cinâmico) que apresenta a fórmula estrutural abaixo.
H
H
H O
O nome oficial deste composto orgânico é:
a) trans – 3 – fenil propenal.
b) trans – 1 – fenil propenal.
c) trans – 3 – fenil propanal.
d) trans – 3 – benzil propenal.
e) cis – 3 – fenil propenal.
trans - 3 - fenil propenal
1
2
3
Prof. Bruno Ramos

CH
CH
CH
CH
CH
CH
CHCH
CH
CH
CH
CH
2
2
2
2
2
2
22
3
3
3
3
( )
( )
( )
( )
( )
( )
( )
16
7
7
4
7
7
7
COOH
COOH
COOH
COOH
(1)
H
H
HH
H
H
HH
(2)
(3)
(4)
06) ( Covest – 2006 ) O óleo de soja, comumente utilizado na cozinha, contém diversos triglicerídeos (gorduras), provenientes de diversos ácidos graxos, dentre os quais temos os mostrados abaixo. Sobre esses compostos, podemos afirmar que:a) o composto 4 é um ácido carboxílico
de cadeia aberta contendo duas duplas ligações conjugadas entre si.
b) os compostos 2 e 3 são isômeros cis-trans.
c) o composto 1 é um ácido carboxílico de cadeia insaturada.
d) o composto 2 é um ácido graxo de cadeia aberta contendo uma dupla ligação (cis).
e) o composto 3 é um ácido graxo de cadeia fechada contendo uma insaturação (cis).
É um ácido carboxílico decadeia aberta com duas
duplas ligaçõesALTERNADAS
FALSO
VERDADEIRO

As substâncias assimétricas
possuem atividade óptica
A estrutura orgânica que tem
CARBONO ASSIMÉTRICO
possuirá atividade óptica
(opticamente ativa)
Prof. Bruno Ramos

Carbono assimétrico ou quiral
É o átomo de carbono que possui quatro ligantes diferentes entre si
CCH H
ClH
H OH
como o composto tem carbono assimétrico, ele apresenta
ATIVIDADE ÓPTICA
Prof. Bruno Ramos

01) Na estrutura abaixo, quando se substitui “ R ” por
alguns
radicais, o composto adquire atividade óptica.
Qual dos itens indica corretamente esses radicais?
a) metil e etil.b) metil e propil.c) etil e propil.d) dois radicais metil.e) dois radicais etil.
CH3C
R
COOH
R
CH2 CH3
CH2 CH3CH2
Prof. Bruno Ramos

02) (FAFI – MG) Em relação ao ácido lático, cujas fórmulas espaciais estão representadas abaixo, estão corretas as opções, exceto:
a) Possui átomo de carbono assimétrico.
b) Possui atividade óptica.
c) Apresenta carboxila e oxidrila (hidroxila).
d) Possui isomeria cis-trans.
e) As suas estruturas não são superponíveis.
OHH
COOH
CH3
HHO
COOH
CH3
HO H
COOH
CH3
OHH
COOH
CH3
espelhoespelho
ácido lático – ácido – 2 – hidroxipropanóico
( I ) ( II )
Prof. Bruno Ramos

03) (UPE-2007 – Q2) Analise as estruturas I, II, III e IV, abaixo.
CH2OH
(I)
CH3
H OH
CH2OH
(II)
CH3
HOH
CH2OH
(III)
H OH
CH2OH
(IV)
HOH
CH2OH CH2OH
É correto afirmar que
a) somente as estruturas I e II apresentam isomeria ótica.
b) somente as estruturas I e III apresentam atividade ótica.
c) somente as estruturas III e IV apresentam atividade ótica.
d) somente as estruturas I e IV apresentam isomeria ótica.
e) todas apresentam atividade ótica.
Prof. Bruno Ramos

04) (Covest – 2005) Diversos compostos orgânicos são responsáveis pelo odor de vários alimentos. Dentre eles, podemos citar:
A partir das estruturas acima pode-se afirmar que:
0 0 A nomenclatura do composto orgânico responsável pelo aroma da canela, é 3 – fenilpropanal.
1 1 A cicloexilamina possui um centro estereogênico (quiral).
2 2 O acetato de octila, responsável pelo aroma da laranja, apresenta
uma função éter. 3 3 O composto responsável pelo aroma da baunilha, apresenta as funções fenol, aldeído e éter. 4 4 O composto responsável pelo aroma da canela, pode
apresentar isomeria cis - trans.

Para uma substância orgânica,
com carbono assimétrico,
o número de isômeros ativos e inativos
é dado pelas expressões:
2n
2 n – 1
número de isômeros ativos
número de isômeros inativos
“n” é o número de carbonos assimétricos
Prof. Bruno Ramos

tem um carbono assimétricos n = 1.
2n1
= 2 isômeros ativos
2 = 21 – 1
=n – 1
20
= 1 isômero inativo
CCH H
ClH
H OH

CH3C –
HI
–– C NH2
ICl
ICl
HI
Este composto possui dois átomos de carbono assimétricos diferentes,
portanto n = 2
2n
= 22
= 4 isômeros ativos
2 = 22 – 1
=n – 1
21
= 2 isômero inativo
01) O número total de isômeros (ativos e inativos) da molécula abaixo é:
a) 2.
b) 4.
c) 6.
d) 8.
e) 10.
total de isômeros: 4 ativos 2 inativos+ = 6 isômeros
Prof. Bruno Ramos

02) (FESP-PE) Considere o composto:
ácido 2, 3 – dicloro – 3 – fenilpropanóico
Ele apresenta:
a) 4 isômeros sem atividade óptica.
b) um total de 6 isômeros, sendo 2 sem atividade óptica.
c) um total de 4 isômeros, sendo 2 sem atividade óptica.
d) não apresenta isomeria óptica.
e) só 2 isômeros ativos e um meso composto.
Tem dois carbonos assimétricos n = 2
2n2
= 4 isômeros ativos
2 = 22 – 1
=n – 1
21
= 2 isômeros inativos
Total de isômeros = 4 + 2 = 6 isõmeros

03) O ácido cloromático
apresenta:
a) 4 isômeros ativos e 2 racêmicos.
b) 2 isômeros ativos e 1 racêmico.
c) 8 isômeros ativos e 4 racêmicos.
d) 6 isômeros ativos e 3 racêmicos.
e) 16 isômeros ativos e 8 racêmicos.
HOOC – CHCl – CHOH – COOHC
H
O
HOCC
H
COH
OCl OH
Tem dois carbonos assimétricos diferentes, portanto n = 2
2n2
= 4 isômeros ativos 2 = 2 isômeros racêmicos12n – 1