APOLIPOPROTEÍNA E
Transcript of APOLIPOPROTEÍNA E

CURSO DE FORMACIÓN CONTINUADA A
DISTANCIA 2010-2011
TALLER DEL LABORATORIO CLÍNICO
Nº 7
APOLIPOPROTEÍNA E

I.S.S.N.- 1988-7469
Título: Taller del Laboratorio Clínico
Editor: Asociación Española de Biopatología Médica
Maquetación: AEBM
Fecha de Distribución: mayo 2011

533
Apolipoproteína E
Yolanda García Benítez.-Residente (QIR-3) Análisis Clínicos.
Ana Cristina Muñoz Boyero.-Residente (QIR-1) Análisis Clínicos.
Iván Herrera-Peco.- Servicio de Neurocirugía, Unidad de Cirugía de la Epilepsia. Concepción Alonso Cerezo.-Facultativo especialista de Área. Hospital Universitario De La Princesa. Madrid
1. LIPOPROTEÍNAS Y APOLIPOPROTEÍNAS
Las lipoproteínas son partículas esféricas de tamaño subcelular compuestas de
lípidos y proteínas que se mantienen unidas por fuerzas no covalentes. Su
estructura general consiste en un centro hidrofóbico de ésteres de colesterol
y triglicéridos rodeado por una monocapa superficial de fosfolípidos, colesterol
no esterificado y proteínas. Su función principal es transportar lípidos y
materiales liposolubles a través del organismo.
Aunque la estructura básica es similar en las diferentes clases de lipoproteínas, estas
difieren en su proporción relativa de lípidos, en la relación proteínas/lípidos y en las
proteínas presentes, lo que supone diferencias de tamaño, densidad y movilidad
electroforética. Inicialmente las lipoproteínas se clasificaron según su movilidad
electroforética y actualmente también se clasifican por su densidad (de mayor a
menor densidad, va disminuyendo la relación proteínas/lípidos): High Density

534
Lipoprotein (HDL), Intermediate Density Lipoprotein (IDL), Low Density Lipoprotein
(LDL), Very Low Density Lipoprotein (VLDL) y Quilomicrones (QM).
Las proteínas asociadas a las lipoproteínas se denominan apolipoproteínas. Las
apolipoproteínas son anfipáticas, es decir, poseen una región hidrofóbica y otra
hidrofílica, por lo tanto pueden relacionarse con el componente lipídico de las
lipoproteínas y con el entorno acuoso. Dada la naturaleza de las regiones anfipáticas,
la mayoría de las apolipoproteínas desempeñan un papel fundamental para
determinar y estabilizar el tamaño y estructura de las partículas de las lipoproteínas.
Igualmente, actúan en los ligandos para los receptores celulares, o como cofactores
para las enzimas implicadas en el metabolismo de las lipoproteínas (1).
2. APOLIPOPROTEÍNA E
Forma parte constituyente de los quilomicrones (QM) y de las lipoproteínas de alta
(HDL), intermedia (IDL) y muy baja densidad (VLDL).
La apolipoproteína E (Apo E), fue identificada en humanos por primera vez por
Shore y Shore en 1973 como una lipoproteína constituyente de las VLDL (2).
La secuencia de aminoácidos de Apo E, obtenida en 1981, mostró que se trata de
una glucoproteína constituida por 299 aminoácidos, de carácter relativamente básico
dado su abundancia en restos de arginina y un peso molecular de 34 kDa.
La producción de la Apo E plasmática se centra en el hígado y en los macrófagos,
mientras que la Apo E presente en el sistema nervioso central se sintetiza de forma
local en el cerebro (3). En concreto, ésta es sintetizada principalmente por los

535
astrocitos y la microglía, aunque algunos autores han encontrado que algunas
neuronas también sintetizan Apo E. Existen evidencias de que no existe un
intercambio entre la Apo E plasmática y la Apo E cerebral, debido a la presencia de la
barrera hemato-encefálica (4).
Su principal función es ser el ligando de los receptores celulares que participan en el
catabolismo de las lipoproteínas:
• Receptor de VLDL que reconoce a VLDL, IDL y β-VLDL y que se encuentra en las
paredes arteriales, músculo esquelético, corazón, riñón y cerebro.
• Receptor de LDL (LDLR o receptor apo B100/E) que se encuentra en el hígado y
los tejidos periféricos reconociendo LDL residuales.
• Proteína relacionada con el receptor de LDL (LRP) localizada en el hígado, la
placenta y la pared arterial.
• Receptor Apo E2 de cerebro y placenta (5).
Parece que la Apo E cerebral juega un papel importante en la redistribución de
lípidos y colesterol durante los procesos de reparación de las membranas
plasmáticas, durante la plasticidad sináptica, mantenimiento de la mielina y
transporte de lipoproteínas a través del líquido cefalorraquídeo. Así mismo, la Apo E
parece estar relacionada con la capacidad cognitiva del individuo y también en
procesos de aprendizaje y memoria (6).

536
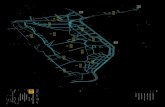
3. ESTRUCTURA
La estructura secundaria de la Apo E consta de un 62 % de hélices , 9 % de hojas
, 11 % de giros y un 18 % de estructuras aleatorias. Posee además hélices -
anfipáticas (una cara con residuos polares y otra con residuos apolares),
característica estructural de todas las apolipoproteínas y que es fundamental para la
unión a los lípidos.
La Apo E tiene dos dominios estructurales independientes, uno amino-terminal de 22
kDa entre los aminoácidos 1 y 191 y un dominio carboxi-terminal entre los
aminoácidos 216 y 299, de 10 KDa. Estos dominios se unen por una región bisagra,
ubicada entre los residuos 165 y 215.
El dominio amino-terminal contiene el sitio de unión a receptores de lipoproteínas
(residuos 136-150), mientras que el carboxi-terminal contiene las regiones de unión
a lípidos. Mediante cristalografía de rayos X se determinó que el dominio amino-
terminal es un empaquetamiento de cuatro hélices . La estructura del carboxilo-
terminal no se conoce con certeza, aunque se ha determinado por espectroscopia de
dicroismo circular que es altamente helicoidal y menos estable que el extremo
amino-terminal.
La Figura 1 muestra el esquema básico de los dominios de la Apo E (7).

537
4. POLIMORFISMO
La naturaleza polimórfica de la Apo E fue establecida por Utermann (8) mediante la
técnica de isoelectroenfoque en una dimensión y posteriormente clarificada por
Zannis y Breslow por medio de electroforesis en dos dimensiones (9).
El gen que codifica la Apo E está localizado en el cromosoma 19 (19q13.2) y
contiene cuatro exones y tres intrones, con una extensión de 3.597 nucleótidos.
El locus del gen estructural es polimórfico. Los tres alelos más comunes, que se
denominan ε2, ε3 y ε4, producen tres isoformas que se diferencian entre sí por 1 o 2
aminoácidos. Los cambios responsables de los polimorfismos se encuentran en el
cuarto exón del gen, y consisten en la diferencia de un único aminoácido en las
Figura 1. Estructura de la Apo E

538
posiciones 112 y/o 158 originados por la presencia del codón CGC (Arg) o TGC (Cys).
Estas tres isoformas son:
• Apo E2: constituye el 8-11%. Los aminoácidos 112 y 158 son dos cisteínas. Tiene
una afinidad reducida por el receptor de LDL, menor del 2%.
• Apo E3: es la variante más común (77%). Los aminoácidos 112 y 158 son cisteína
y arginina, respectivamente. Tiene gran afinidad por el receptor de LDL.
• Apo E4: constituye el 12-15%. Los aminoácidos 112 y 158 son dos argininas. Tiene
una afinidad similar a la anterior para los receptores de LDL (10).
Los tres alelos de la Apo E son heredados en forma codominante, dando como
resultado que en la población general podamos encontrar seis fenotipos distintos:
E2/E2, E2/E3, E3/E3, E3/E4, E2/E4, E4/E4.
El fenotipo más común en la población es el E3/E3, seguido del E3/E4 y el E2/E3; en
concreto, en la población española se estima que la frecuencia de estos fenotipos es
alrededor del 70%, 17% y 11% respectivamente.
Existen evidencias que muestran que los portadores del fenotipo E4/4 tienen
mayores probabilidades de sufrir enfermedades cardiovasculares y enfermedades
neurológicas como enfermedad de Alzheimer, enfermedad de Parkinson, esclerosis
múltiple o epilepsia (11).

539
5. EFECTOS DEL POLIMORFISMO EN LA AFINIDAD POR LOS RECEPTORES
DE LDL
Se han realizado numerosos estudios sobre los efectos del polimorfismo de la Apo E
en los niveles lipídicos. Éstos han mostrado que los individuos con al menos un alelo
E2 tienden a presentar niveles de colesterol total en plasma más bajos que los
sujetos con al menos un alelo E4. El diferente efecto que tienen los alelos E2 y E4
sobre los niveles de lípidos viene dado por la distinta afinidad de las isoformas por
los receptores LDL.
La presencia de una cisteína en la posición 158 de la apo E2, en lugar de una
arginina, afecta a la capacidad de enlace con el receptor, debido a la eliminación de
un puente salino entre la Arg158 y el Asp154 y a la formación de un nuevo puente
salino entre Arg150 y Asp154. Este nuevo enlace modifica la conformación de la
Arg150 con respecto a otros residuos básicos en la región de unión a los receptores
(residuos 136-150), disminuyendo la capacidad de la apo E2 para unirse con el
receptor de la LDL. Por este motivo la isoforma E2 tiene una afinidad del orden de
50-100 veces menor por el receptor de las LDL que las isoformas E3 y E4 (7).
La isoforma E4 tiene alta afinidad con las lipoproteínas ricas en triglicéridos e induce
una captación más rápida de estas partículas por el hígado. Como consecuencia, el
colesterol contenido en los hepatocitos aumenta y el número de receptores de LDL
es regulado negativamente, disminuyendo su número. Esto conduce a una
disminución del catabolismo de las LDL plasmáticas y al incremento de los niveles de
colesterol unido a LDL. Esta relación se ha encontrado en individuos caucásicos
homocigotos (E4/E4) y heterocigóticos (E4/E3) para este alelo, y se asocia con
elevados niveles de colesterol total y LDL, comparado con los niveles obtenidos con
el alelo más común ε3.
El alelo ε2 tiene el efecto metabólico opuesto al descrito para el alelo ε4. Como la
afinidad de la isoforma E2 hacia los receptores es reducida, disminuye la captación
por parte del hígado de quilomicrones y VLDL, provocando una menor concentración
intracelular de colesterol en el hepatocito; esto lleva a una mayor expresión por parte

540
del hepatocito de receptores de las LDL, aumentando su catabolismo y disminuyendo
el colesterol plasmático unido a LDL (10).
En la Figura 2 se representa la diferente captación por parte de los receptores del
hepatocito para las tres variantes alélicas de la Apo E (12).
Además del efecto de los distintos alelos sobre el metabolismo lipídico, la Apo E2 se
asociada con la hiperlipoproteinemia tipo III (disbetalipoproteinemia).
6. DISBETALIPOPROTEINEMIA (HIPERLIPOPROTEINEMIA TIPO III)
La disbetalipoproteinemia es un tipo de hiperlipemia mixta que se caracteriza por una
elevación del colesterol y de los triglicéridos plasmáticos como consecuencia del
aumento de las -VLDL. Estas lipoproteínas son partículas remanentes que proceden
Figura 2. Mecanismos por los que los diferentes
alelos de la Apo E influyen en el metabolismo lipídico. La Apo E2 tiene escasa afinidad por el receptor de la Apo E, se acumula en los remanentes de quilomicrones y disminuye el colesterol intracelular. La célula responde con un aumento de la síntesis de colesterol y expresa un mayor número de receptores de las LDL, con lo que aumenta su aclaramiento del plasma. Por el contrario, la Apo E4 se une normalmente con los receptores, pero tiene una mayor afinidad por las VLDL y los quilomicrones que la Apo E3, con lo que aumenta su captación hepática. Al incrementarse el colesterol intracelular disminuye la síntesis de colesterol y la expresión de los receptores de las LDL, disminuyendo su aclaramiento. Por último, los portadores de la Apo E3 (superior) se comportarían de una forma intermedia.

541
de los quilomicrones de origen intestinal y del catabolismo periférico de las VLDL de
origen hepático.
La acumulación de estas partículas residuales suele asociarse con la presencia de la
isoforma Apo E2 que no es reconocible por sus receptores específicos, LDLR y LRP, lo
que provoca la disminución del catabolismo de las lipoproteínas de las que esta Apo
E es parte constituyente, con la consiguiente acumulación plasmática.
Se conoce que existe una asociación entre la variante alélica Apo E2 y el riesgo de
padecer disbetalipoproteinemia de forma hereditaria recesiva. La mayoría de los
pacientes que presentan disbetalipoproteinemia son homocigotos para la Apo E2 (se
calcula que lo son el 0,5 % de la población, aunque aproximadamente un 8 % es
portadora de una copia de Apo E2), y sólo en raras ocasiones se da con el fenotipo
E2/E3 y E2/E4 (5).
También existen otras variantes de la Apo E, mucho menos comunes que la Apo E2,
que pueden predisponer a la enfermedad incluso de forma dominante en
heterocigotos porque en ellas se producen ciertas sustituciones puntuales de
aminoácidos que provocan que la unión a los receptores sea deficiente. Se han
descrito cerca de 30 variantes de Apo E, de las cuales 14 se asocian con
disbetalipoproteinemia y otras 7 con diversas dislipemias. En la mayoría de los casos
que presentan alguna de estas variantes asociadas a disbetalipoproteinemia se
expresa la enfermedad, teniendo además manifestaciones clínicas más graves y
presentándose a edades más tempranas, en comparación con la forma recesiva de
disbetalipoproteinemia asociada con los pacientes homocigotos para la Apo E2. Por
tanto, en estos individuos la herencia es autosómica dominante con un alto grado de

542
penetrancia. En un estudio realizado en España se han identificado varias familias
con una variante rara, Apo E Arg136Ser, asociada con disbetalipoproteinemia (13).
La mayoría de los pacientes homocigotos para la Apo E2 no presentan
disbetalipoproteinemia hiperlipémica; para desarrollarla es necesario otro factor
desencadenante como puede ser una alteración metabólica (diabetes mellitus tipo II,
obesidad, hipotiroidismo, déficit de estrógenos), aspectos ambientales (fármacos,
alcoholismo) o la presencia de otros genes hiperlipémicos.
La disbetalipoproteinemia hiperlipémica suele detectarse después de los 20 años de
edad, generalmente a partir de los 40, edad en la que puede ya asociarse a síndrome
coronario agudo. Es más común y más precoz en hombres que en mujeres, en
quienes es relativamente rara antes de la menopausia. Presenta un riesgo
aterogénico elevado, ya que hasta el 50% de los individuos son sintomáticos de
alguna lesión aterosclerótica, ya sea de los territorios vasculares coronarios como
cerebrovascular. Los signos clínicos son arco corneal prematuro, xantelasmas,
xantomas cutáneos eruptivos o tuberosos, que aparecen en codos, rodillas y
tendones de Aquiles, y sobre todo xantomas palmares estriados o xantomata striata
palmaris (en el 80% de los pacientes con dislipemia grave no tratados) en palmas y
pliegues interdigitales. Este signo clínico es patognomónico de la
disbetalipoproteinemia, pero sólo se presenta en formas hiperlipémicas (5).
7. ATEROSCLEROSIS
Dado el impacto de la variación alélica del locus de la Apo E sobre las
concentraciones lipídicas, se ha hipotetizado que el polimorfismo de la Apo E pudiera
desempeñar un importante papel determinando la susceptibilidad a la aterosclerosis.

543
Se calcula que el genotipo de la Apo E podría ser responsable de hasta un 14% de la
variación de las concentraciones de colesterol total y de colesterol LDL. Existen datos
epidemiológicos que apoyan esta afirmación. Así, la frecuencia del alelo ε4 es alta en
los países del norte de Europa y baja en el sur de Europa y en Japón, siguiendo el
mismo patrón que la prevalencia de cardiopatía isquémica (CI). En nuestro país, la
prevalencia del alelo ε4 es del 7,6 %. En segundo lugar, existen numerosos estudios,
en pacientes con CI, en los que se observa de forma mayoritaria la mayor frecuencia
relativa del alelo ε4 en los pacientes con CI que en los grupos de control. El infarto
agudo de miocardio (IAM) ocurre una media de 4,6 años antes en los portadores del
fenotipo E4/E3 que en los E3/E2 (14). En tercer lugar, en estudios autópsicos en
varones menores de 34 años con muerte accidental en quienes se estudiaron el
grado y la extensión de la arteriosclerosis en la aorta se observó que aquellos con el
genotipo E4/E3 tenían más avanzadas y extensas las lesiones que los E3/E3 y estos,
a su vez, más que los E3/E2 (15). Cuando ajustaban estos resultados con las
concentraciones de colesterol plasmáticas no había cambios apreciables. Los autores
concluyeron que el efecto del genotipo de la Apo E sobre la pared arterial no estaba
mediado enteramente por los cambios en las concentraciones de colesterol.
Por último, existen varios estudios prospectivos que han evaluado el papel del
polimorfismo de la Apo E y el riesgo de CI. En el primero (16), en pacientes
procedentes del Multiple Risk Factor Intervention Trial (MRFIT), se observó que la
presencia de E4 estaba asociada con un incremento del riesgo de CI, incluso después
de ajustar con otros factores de riesgo, incluido el colesterol LDL. De la misma
manera, en los sujetos del Framingham Offspring Study se encontró que la
prevalencia de CI se asociaba con la presencia del alelo ε4 y dicha relación persistía

544
después de ajustar con otros factores de riesgo, incluyendo colesterol HDL y LDL.
Aproximadamente un 15% de la prevalencia de CI es atribuible al alelo ε4 (17).
Además, existe una relación entre la presencia del alelo ε4 y la mortalidad total,
siendo dicho alelo más frecuente en jóvenes que en ancianos (18).
Numerosos estudios han demostrado que las LDL son las lipoproteínas con mayor y
más evidente poder aterogénico; éstas son más susceptibles a la oxidación y a
producir daño arterial. Es bien conocido que el efecto de niveles altos de colesterol
en el plasma, especialmente los que se asocia a lipoproteínas de baja densidad o
LDL, se asocian con deterioro de la función endotelial de la íntima arterial. En la
búsqueda de una asociación entre el grado de la obstrucción coronaria y el
polimorfismo de la Apo E, se concluye que el alelo E2 se relaciona con bajos niveles
de obstrucción, así como baja prevalencia de enfermedad coronaria. Más aún, el
genotipo E2/E2 se ha asociado con la no presencia de obstrucción. Comparados con
los individuos con genotipo E3/E3, los portadores del alelo E2 tendrían un 20%
menos de riesgo de enfermedad coronaria, mientras que los portadores del alelo E4
tendrían un ligero aumento de riesgo.
Por lo tanto, parece claro que existe una relación entre los genotipos de la Apo E y el
riesgo de padecer CI y que dicho efecto no sólo está mediado por las variaciones
producidas en el perfil lipídico por los diferentes alelos. Otros factores sobre el
metabolismo lipoproteico, los factores hemostáticos, así como otros factores de
riesgo (obesidad, diabetes, hipertensión,…) median dicho efecto.

545
8. ENFERMEDADES NEUROLÓGICAS
8.1. Enfermedad de Alzheimer
Es un trastorno neurodegenerativo que clínicamente se caracteriza por un deterioro
cognitivo progresivo, que llevará a los pacientes a una demencia con afectación de
distintas funciones superiores: memoria, lenguaje, capacidad de reconocimiento y
orientación, capacidad de realizar acciones aprendidas, etc. La prevalencia de esta
enfermedad depende del grupo de edad, de tal modo que entre 65 y 69 años esta
enfermedad la sufre un 1% de la población mundial, mientras que el porcentaje
aumenta hasta el 30% para el rango de 95 años (19).
Por lo general en la práctica clínica habitual hacemos el diagnóstico de demencia tipo
Alzheimer a pacientes que cumplen los criterios clínicos, tras descartar otras causas
de demencia. No obstante, para confirmar el diagnóstico es preciso el estudio
neuropatológico; en este, los marcadores principales son:
Acumulación extracelular de péptido β amiloide (19).
Presencia de ovillos neurofibrilares compuestos por proteína Tau
hiperfosforilada (19).
Disminución del número de neuronas colinérgicas en el cerebro.
Existen numerosas evidencias que confirman la relación existente entre la
enfermedad de Alzheimer y el gen de la Apo E. Estudios en poblaciones de origen
caucásico han proporcionado datos que muestran que los individuos que portan los
fenotipos ε2/4 o ε3/4 poseen el doble de probabilidades de padecer la enfermedad
de Alzheimer que el resto de individuos. Otros estudios realizados en poblaciones

546
europeas y americanas de origen europeo, muestran que el riesgo de padecer la
enfermedad de Alzheimer es 8 veces superior en individuos con el fenotipo ε4/4 que
para aquellos con el fenotipo ε3/3. El alelo de la Apo E ε4, está relacionado con la
aparición de la enfermedad de Alzheimer temprana, antes de los 65 años de edad
(19). El mecanismo por el cual la Apo E influye sobre la aparición de la enfermedad
de Alzheimer, no está del todo claro existiendo dos hipótesis para explicarlo:
la acción de la propia Apo E
la acción mediada a través de receptores neuronales de la Apo E
Por un lado encontramos la posibilidad de que la Apo E module la acumulación y
maduración del péptido β amiloide (3,20,21). En modelos animales se han
encontrado evidencias de la necesidad de que la Apo E esté presente en el proceso
de maduración de la forma soluble del péptido β amiloide. En modelos murinos que
expresan Apo E (las 3 isoformas; E2, E3 y E4) de origen humano, se observa la
existencia de diferencias en cuanto a la cantidad del péptido β amiloide acumulado y
la isoforma presente, de tal modo que la cantidad acumulada de péptido β amiloide
sigue la relación: E4>E3>E2 (20).
Se considera que existen diferencias en cuanto a la capacidad de unión de los alelos
3 y 4 de la Apo E, con el péptido β amiloide, favoreciendo la agregación de éste
(4).
Esto concuerda con los datos obtenidos en humanos, donde se observa la
acumulación del péptido β amiloide en pacientes diagnosticados de la enfermedad de
Alzheimer que expresan el alelo 4, con respecto a pacientes con el alelo 3, en los

547
que no se observa esa acumulación (20). De hecho, en estudios post-mortem se ha
observado que los depósitos del péptido β amiloide son mayores en aquellos
individuos que portan el alelo 4, tanto si la enfermedad de Alzheimer tenía un
origen genético como esporádico (4).
Los receptores neuronales relacionados con la Apo E son los receptores VLDL
(VLDLR), receptores LDL (LDLR) y los LRP1. VLDLR y LDLR se encuentran ubicados
en la membrana plasmática de astrocitos y microglia y LRP1 se encuentra
principalmente en la membrana plasmática de neuronas (22). Además, están
relacionados con distintas funciones como por ejemplo: i) el tráfico y el procesado de
la proteína precursora amiloide (APP, del inglés Amyloid Precursor Protein) (3,21), ii)
regulación de la dinámica de los microtúbulos (21), iii) regulación de la plasticidad
sináptica (21), iv) aclaramiento del péptido β amiloide, entre otras funciones.
Los receptores de Apo E pueden alterar la producción de la APP, lo cual conllevará a
una alteración en la producción del péptido β amiloide que puede provocar su
acumulación. Además se debe tener en cuenta que el complejo formado por la Apo
E3-lipoproteína se une al péptido β amiloide con mayor afinidad que el complejo Apo
E4-lipoproteína, con lo que Apoe E3 aclarará de modo más eficiente el péptido β
amiloide que Apo E4. El complejo formado por la Apo E4-lipoproteína y péptido β
amiloide aclara a una velocidad baja, mientras que los complejos de péptido β
amiloide con Apo E2 y Apo E3 se aclaran vía VLDLR y LRP1 a una velocidad mucho
mayor. Esto desemboca en una acumulación del péptido β amiloide (20).
Esa alteración puede provocar, a su vez, que los receptores LDL del tipo1 de la Apo
E, que se encuentran ubicados en la membrana plasmática de astrocitos, microglia o

548
neuronas, no puedan realizar la función de aclaramiento al no poder unirse al
péptido β amiloide y sacarlo a través de la barrera hemato-encefálica (20).
En numerosos estudios se ha comprobado la existencia de una concordancia entre la
presencia de la isoforma E4 del gen de la Apo E en pacientes diagnosticados de la
enfermedad de Alzheimer, y los siguientes elementos:
Alteración en la fosforilación de la proteína Tau y existencia de ovillos
neurofibrilares de esta proteína (3). La Apo E suele expresarse en astrocitos y
microglia pero puede comenzar a expresarse en neuronas después de una
lesión. Es posible que en enfermos de Alzheimer se produzca una expresión
anormal de Apo E en neuronas que induzca la hiperfosforilación de tau (22).
Aumento de la muerte neuronal por apoptosis, de neuronas colinérgicas (3).
Estos datos sugieren una relación entre la aparición de algunos marcadores
patológicos de la enfermedad de Alzheimer, como la acumulación del péptido β
amiloide, y el gen de la Apo E.
8.2. Enfermedad de Parkinson
Es, en frecuencia, la segunda enfermedad degenerativa del sistema nervioso tras la
enfermedad de Alzheimer. A su vez, es el trastorno extrapiramidal más frecuente. La
prevalencia de esta enfermedad es de aproximadamente 0.5-1% en individuos entre
65-69 años y aumenta hasta el 3% en individuos de 85 años (19).
Se caracteriza por la existencia de una degeneración neuronal debida a la
acumulación de proteínas anómalas como la α-sinucleína. Se afectan de forma
preferente (pero no exclusiva) las neuronas dopaminérgicas de la pars compacta de

549
la sustancia negra, lo que supondrá desajustes funcionales en la actividad tanto de
los ganglios de la base como de la corteza y del tronco cerebral, que justifican la
abundante sintomatología esperable en estos pacientes. Los síntomas cardinales
serán motores (extrapiramidales): rigidez, bradicinesia (lentitud de movimientos) y
temblor de reposo.
Los datos obtenidos en los distintos estudios sugieren la existencia de una relación
entre el gen de la Apo E y la enfermedad de Parkinson, mucho más débil que la
existente entre este gen y la enfermedad de Alzheimer (23). Estudios recientes
muestran la existencia de una relación entre la acumulación de α-sinucleína y la
presencia de APP y del péptido β amiloide, lo que hace suponer que el gen de la Apo
E tenga una influencia directa en estos acúmulos de proteínas y por tanto en la
enfermedad de Parkinson (23).
Se han realizado numerosos estudios con el objetivo de evaluar la posible relación
entre el gen de la Apo E y la enfermedad de Parkinson, obteniéndose resultados en
los que se observa una asociación positiva entre la presencia del alelo 4 del gen Apo
E y la enfermedad de Parkinson. Otros estudios realizados muestran una asociación
positiva entre el alelo 2 del gen ApoE y la enfermedad de Parkinson (23,24),
mientras que el alelo 4 no mostraba esa asociación positiva.
Algo que se debe tener en cuenta al hablar de la enfermedad de Parkinson es la
demencia asociada a esta enfermedad, que afecta alrededor del 30% de los
individuos con Parkinson. En cuanto a la relación del gen de la Apo E con la
demencia en la enfermedad de Parkinson, debe decirse que es controvertida puesto
que se encuentran numerosos estudios que señalan al alelo 4 del gen de la Apo E

550
como un factor de riesgo en la demencia (25). Por otro lado, numerosos estudios con
poblaciones de pacientes arrojan otro tipo de resultado, esto es, que no existe una
relación entre el alelo 4 y la demencia en la enfermedad de Parkinson.
8.3. Epilepsia
La epilepsia es uno de los desórdenes neurológicos más frecuentes; afecta a
alrededor del 0.5-2% de la población mundial. Para su diagnóstico, es precisa la
presencia de crisis epilépticas repetitivas (una crisis aislada no es suficiente en
principio para hacer el diagnóstico) y espontáneas (pues todos estamos expuestos a
padecer crisis epilépticas ante un estímulo suficiente). Una crisis epiléptica es el
resultado clínico de una descarga brusca, anormal por su intensidad e hipersincronía,
de un agregado neuronal del cerebro. De forma global, las crisis pueden clasificarse
como:
Generalizadas: no podemos definir una región cerebral causante de las
mismas con los datos clínicos y los estudios neurofisiológicos
Parciales: podemos localizar una región cerebral responsable del inicio de las
crisis. Son estas las más frecuentes y de entre ellas la más prevalente es la
denominada epilepsia del lóbulo temporal (ELT); se trata de un síndrome
adquirido multifactorial, que aparece como síntoma provocado por diferentes
lesiones, como la esclerosis mesial. Los avances realizados en biología
molecular han facilitado la detección de numerosas alteraciones en genética
molecular que pueden tener un efecto patógeno en las ELT. Recientemente
numerosos autores muestran evidencias de la existencia de relación entre
factores genéticos y epilepsias de tipo idiopático (11).

551
Existen estudios en diversas poblaciones, que sugieren la existencia de una
asociación entre la aparición de la ELT y la presencia del alelo 4 del gen Apo E. Se
han obtenido resultados que muestran una relación positiva entre la presencia del
alelo 4 y la aparición de crisis. Dicho efecto podría estar asociado a la capacidad del
alelo 4 de la Apo E de promover la acumulación intracerebral del péptido amiloide
(20). Sin embargo existen estudios recientes en los se han obtenido resultados
donde no se observa una relación positiva entre el alelo 4 del gen Apo E y la
aparición de epilepsia.
8.4. Esclerosis Múltiple
Exceptuando a los traumatismos, ésta es la causa más frecuente de discapacidad
neurológica en adultos jóvenes. Es la enfermedad por alteración de la mielina más
frecuente en el sistema nervioso central (S.N.C.). Se produce una destrucción
selectiva de la mielina del cerebro y la médula espinal, que suele presentarse en
brotes de actividad inflamatoria que dará lugar a las llamadas placas de
desmielinización (detectables con estudios radiológicos y neuropatológicos),
responsables de la variada sintomatología que presentarán los pacientes (en función
del territorio cerebral afectado por la desmielinización). Aunque la etiología es
desconocida, se asocia su inicio con la aparición de un agente infeccioso, vírico, que
induciría una respuesta inmune, que conllevaría la destrucción de los
oligodendrocitos. Se considera que la pérdida de funciones cognitivas puede
presentarse pronto en la historia natural de la enfermedad, y avanza en intensidad
con esta. El 40-60% de los pacientes diagnosticados de esclerosis múltiple
desarrollarán deterioro cognitivo (25). Aunque no se conoce con exactitud cuál es la

552
patofisiología responsable de la pérdida de funciones cognitivas, existen datos que
sugieren la existencia de una relación positiva entre esta pérdida y el alelo 4 del gen
de la Apo E (25). Pero existen numerosos trabajos y resultados controvertidos, lo que
sugiere que el alelo 4 se considere como que su presencia sólo indicaría un efecto
desfavorable en el curso de la esclerosis múltiple (26). Sin embargo cabe destacar el
hecho de que existe una distribución muy heterogénea entre las distintas
poblaciones humanas estudiadas del gen de la Apo E. De hecho, en algunos estudios
se han encontrado relaciones estadísticamente significativas entre la esclerosis
múltiple y la presencia del alelo 2 del gen de la Apo E (27), relacionándose este
alelo con las fases medias de la enfermedad, así como con el sexo, y existiendo una
relación significativa entre el alelo 2 y el sexo femenino (26).
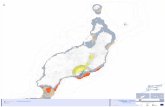
9. DETERMINACIÓN DEL GENOTIPO DE LA APOLIPOPROTEÍNA E
Inicialmente, la determinación del fenotipo de la Apo E, basada en la diferente carga
eléctrica de las isoformas, se realizó mediante isoelectroenfoque de las VLDL aisladas
del plasma con posterior tinción con azul de Coomassie (28) o mediante
inmunoblotting directamente del plasma (29). Posteriormente, se han descrito
técnicas para la determinación del genotipo, mediante la amplificación del segmento
de ADN que contiene ambos residuos (112 y 118), su corte mediante una enzima de
restricción y la posterior separación electroforética en un gel de agarosa o
poliacrilamida. La Figura 3 muestra cómo aparecerían las bandas tras la digestión con
la enzima de restricción Hha I (30).

553
En los últimos años, se han utilizado numerosos métodos para determinar los
genotipos mayoritarios de la Apo E. Tradicionalmente, el más frecuente ha sido PCR-
RFLP (PCR- Restriction Fragment Length Polymorphism) (31). Sin embargo, es un
método laborioso que puede dar lugar a errores debido a la posible digestión
incompleta por las enzimas de restricción.
La electroforesis capilar para la detección de fragmentos de DNA obtenidos tras la
amplificación del gen de la Apo E ofrece mayor resolución y sensibilidad para
detectar fragmentos de DNA en el rango de 20-100 pares de bases (32). Esta
técnica realiza una mejor discriminación entre los genotipos Apo E2/E2 y Apo E3/E3
que las técnicas convencionales, lo cual aporta un gran valor clínico en el diagnóstico
de la disbetalipoproteinemia familiar.
La PCR a tiempo real con determinación fluorescente mediante curvas de “Tmelting”
es un método rápido y sencillo, aunque la formación de dímeros de primers puede
complicar la interpretación de las curvas de temperatura.
Figura 3. Efecto del corte de la enzima de restricción Hha I sobre un segmento del gen de la Apo E, variando el tamaño de los fragmentos según las diferentes isoformas. Inferior: determinación de los diferentes genotipos mediante la separación de los fragmentos por electroforesis.

554
Métodos como la secuenciación PCR plus o la espectrometría de masas son efectivos,
aunque requieren altos costes de instrumentación.
Recientemente se ha desarrollado un método rápido y específico, PCR-FRET
(Fluorescent Resonance Energy Transfer) (33), que incluye tres etapas: (1)
extracción de DNA; (2) amplificación de los fragmentos APOE mediante una primera
secuencia de PCR; (3) análisis de las curvas de temperatura (Tmelting) mediante la
técnica FRET. Las sondas fluorescentes son añadidas en una segunda secuencia de
PCR. Esta técnica permitió determinar la presencia de un nuevo polimorfismo en la
tercera posición del codón 158 (-AAGCGT-), a saber, dos nucleótidos en dirección 5´
respecto del polimorfismo conocido. Al comparar el análisis FRET con los obtenidos
por RFLP y secuenciación, la presencia de este nuevo polimorfismo fue confirmado
solamente por secuenciación, lo cual sugiere que el análisis de los fragmentos de
restricción no siempre es factible para el genotipado.
BIBLIOGRAFÍA
(1) Moreno A. et al. Apolipoproteína E y enfermedad cardiovascular. Rev Fac Med
Univ Nac Colomb 2006;54(1):54-65.
(2) Shore VG, Shore B. Heterogeneity of human plasma very low density lipoproteins:
Separation of species differing in protein components. Biochem 1973;12:502-7.
(3) Posse de Chaves E, Narayanaswami V. Apolipoprotein E and cholesterol in aging
and diseases in the brain. Future Lipidol 2008;3(5):505-30.

555
(4) Cedazo-Mínguez A. Apolipoprotein E and Alzheimer´s disease: molecular
mechanisms and therapeutic opportunities. J Cell Mol Med 2007;11:1227-38.
(5) Gómez JA, Fenollar M. Sociedad Española de Bioquímica Clínica y Patología
Molecular. Comisión de Lípidos y Lipoproteínas. Recomendaciones para el diagnóstico
de la disbetalipoproteinemia. Quim Clin 2006;25(2):94-6.
(6) Giray Ö, Ülgenalp A, Bora E, Uran N, Yilmaz E, Ünalp A, Erçal D. Role of
Apolipoprotein E in febrile convulsion. Paediatric Neurology 2008;39(4):241-4.
(7) Danny M. Hatters, Clare A. Peters-Libeu and Karl H. Weisgraber. Apolipoprotein E
structure: insights into function. Trends in Biochemical Sciences 2006;
31(8):445-54
(8) Utermann G, Hees M, Steinmetz A. Polymorphism of apolipoprotein E and
occurrence of dysbetalipoproteinaemia in man. Nature 1977; Oct 13, 269
(5629):604-7.
(9) Zannis VI, Breslow JL. Human very low density lipoprotein apolipoprotein E
isoprotein polymorphism is explained by genetic variation and postranslational
modification. Biochem 1981;20:1033-41.
(10) García AM. La apolipoproteína E: el polimorfismo genético y su relación con los
cambios metabólicos, los hábitos alimenticios y el origen étnico. Rev Col Cardiol.
2003;10:189-93
(11) Herrera-Peco I, Fernández-Millares V, Pastor J, Hernando-Requejo V, Sola RG,
Alonso-Cerezo C. Factores genéticos asociados a la epilepsia del lóbulo temporal. Rev
Neurol 2009;49(10):541-6.

556
(12) Lahoz C, Ordovás JM. Apo E: lípidos plasmáticos, cardiopatía isquémica y
enfermedad de Alzheimer. Med Clin 1997;109:31-6
(13) García AL, Cenarro A, Civeira F, Gañán A, Recalde D, Puzo J et al.
Apolipoproteína E Arg136Ser: una variante de apolipoproteína E asociada a
hiperlipoproteinemia tipo III con herencia autosómica dominante incompleta. Clin.
Invest. Arteriosclerosis 2001;13(1):9-18
(14) Lenzen HJ, Assmann G, Buchwalsky R, Schulte H. Association of apolipoprotein
E polymorphism, low density lipoprotein cholesterol and coronary artery disease. Clin
Chem 1986;32:778-81
(15) Hixson JE and the Pathobiological Determinants of Atherosclesosis in Youth
(PDAY) Research Group. Apolipoprotein E polymorphism affect atherosclerosis in
young males. Arterioscler Thromp 1991;11:1237-44
(16) Eichner JE, Kuller LH, Orchard TJ, Grandits GA, McCallum L, Ferrell RE et al.
Relation of a apolipoprotrein E phenotype to myocardial infarction and mortality from
coronary heart disease. Am J Cardiol 1993;71:160-5
(17) Wilson PWF, Myers RH, Larson MG, Ordovas JM, Wolf PA, Schaefer EJ.
Apolipoprotein E alleles, dyslipemia and coronary heart disease. The Framingham
Offspring Study. JAMA 1994;272:1666-71
(18) Eggrsten G, Tegelman R, Ericcson S, Angelin B, Berglund L. Apolipoprotein-E
polymorphism in a healthy Swedish population: variation of allele frecuency with age
and relation to serum lipid concentrations. Clin Chem 1993;39:2125-9

557
(19) Pardo LM, van Duijn CM. In search of genes envolved in neurodegenerative
disorders. Mutation Res 2005;592:89-101.
(20) Hirsch-Reinshagen V, Wellington CL. Cholesterol metabolism, apolipoprotein E,
adenosine triphosphate-binding cassette trasnporters, and Alzheimer´s disease. Curr
Opin Lipidol 2007;18:325-32.
(21) Herz J. Apolipoprotein E receptors in the nervous system. Curr Opin Lipidol
2009;20:190-6.
(22) Bu G. Apolipoprotein E and its receptors in Alzheimer's disease: pathways,
pathogenesis and therapy. Nat Rev Neurosci 2009;10(5):333-44.
(23) Buchanan DD, Silburn PA, Prince JA, Mellick GD. Association of APOE with
Parkinson disease age-at-onset in women. Neurosci Letters 2007;411:185-8.
(24) Williams-Gary CH, Goris A, Saiki M, Foltynie T, Compston DAS, Sawcer SJ,
Barker RA. Apolipoprotein E genotype as a risk factor for susceptibility to dementia in
Parkinson´s disease J Neurol 2009;256:493-8.
(25) Tu JL, Zhao CB, Vollmer T, Coons S, Lin HJ, Marsh S, Treiman DM, Shi J. APOE 4
polymorphism results in early cognitive deficits in an EAE model. Biochem Biophys
Res Commun 2009;384(4):466-70.
(26) Guerrera AL, Laherrán E, Gutiérrez F, Martín-Polo J, Iglesias F, Alcázar C, Peralta
J, Rostami P. Apolipoprotein E genotype does not associate with disease severity
measured by multiple sclerosis severity score. Acta Neurol Scand 2008;117:21-5.
(27) Fazekas F, Enzinger C, Ropele S, Schmidt H, Schmidt R, Strasser-Fuchs S. The
impact of our gene: Consequences of the apolipoprotein E polymorphism in
Alzheimer disease and multiple sclerosis. J Neurol Sci 2006;245:35-9.

558
(28) Eto M, Watanabe k, Ishii K. A rapid isoelectro focusing method for the
determination of apolipoprotein E phenotypes and its applications. Clin Chim Acta
1985;149:21-8
(29) Menzel HJ, Utermann G. Apolipoprotein E phenotyping from serum by Western
Blotting. Electroforesis 1986;7:492-6
(30) Walden CC, Hegele RA. Apolipoprotein E in hyperlipidemia. Ann Intern Med
1994;120:1026-36
(31) Zivelin A, Rosenberg N, Peretz H, Amit Y, Kornbrot N, Seligsohn U. Improved
method for genotyping apolipoprotein E polymorphisms by a PCR-based assay
simultaneously utilizing two distinct restriction enzymes. Clin Chem 1997;43:1657-9
(32) Bekers O, op den Buijsch RA, de Vries JE, Wijnen PA, van Dieijen-Visser MP.
Electrophoresis 2002;23(12):1878-81
(33) Rihn BH, Berahmoune S, Jouma M, Chamaa S, Marcocci L, Le Faou A. APOE
genotyping: comparison of three methods. Clin Exp Med 2009;9(1):61-5