anteras, haploides
-
Upload
juan-fernando-diaz-salazar -
Category
Documents
-
view
262 -
download
9
Transcript of anteras, haploides

Mejoramiento genético: Obtención de planta haploides a través
del cultivo de granos de polen.Díaz, Juan Fernando; González, Andrea.
Laboratorio de Cultivo de Tejidos Vegetales in vitro, Ingeniería en Biotecnología,
Departamento de Ciencias de la Vida, Escuela Politécnica del Ejército.
18 de enero de 2012
Resumen:
La obtención de individuos haploides estériles mediante anteras es una de las técnicas de
cultivo de tejidos in vitro que está ganando auge, en especial cuando se trata de hacer
fitomejoramiento. El objetivo de la práctica fue sembrar y cultivar anteras de las flores
empleadas por nosotros, lirios (Lilium candidum), siguiendo la metodología adecuadamente en
cuanto a desinfección y sembrado del material se refiere. Tras el lavado y desinfección de las
flores, las anteras se cultivaron completas en medio Murashige y Skoog enriquecido con
2.5mg/L de 2,4-D, 40g/L de azúcar y 7.5g/L de agar, y pH ajustado a 5.7-5.8. Se controló
contaminación durante la segunda y tercera semana luego de la siembra, durante la
incubación, consiguiendo un 0% de frascos contaminados. De los cuatro frascos sembrados,
dos de ellos empezaron el proceso de necrosis del tejido de la antera, que cubre al polen, lo
que antecede normalmente a la generación de callo a partir de los granos polínicos. Además se
discutió de los posibles resultados obtenidos tras más semanas de incubación, y de los factores
que afectan la androgénesis.
Introducción:
Los organismos haploides han tenido una enorme importancia desde que se los descubrió
naturalmente en algunas especies vegetales, las cuales los producían espontáneamente, pero
con una frecuencia muy baja (7).
Existen algunas formas de considerar a los organismos haploides, esto respecto a si provienen
de otros seres diploides o poliploides. Independientemente de ello, para este caso se
considerará como individuos haploides a aquellos que tengan una constitución cromosómica
igual a la mitad del número cromosómico normal de la especie, en células somáticas (7).
La demanda mundial actual no puede ser satisfecha con las técnicas tradicionales de
mejoramiento vegetal, es por ello que con los avances en biotecnología y biología molecular se
ha implementado el desarrollo de los haploides y los doble haploides (7).
Para originar este tipo de organismos, la ciencia se ha valido de la hibridación interespecífica o
intergenérica, y el cultivo de esporas masculinas y femeninas. Estas metodologías de
fitomejoramiento han permitido fijar sistemas genéticos de gametos individuales, fáciles de
evaluar en cualquier momento del mejoramiento; además se puede conseguir líneas
homocigóticas sin usar la endogamia normal (6, 8).
El obtener líneas puras (homocigotas) suele requerir de una cantidad importante de
autofecundaciones, mientras que con el uso de los haploides y doble haploides se puede llegar

a tener homocigotas en apenas una sola generación, lo cual implica reducir costos de
producción y tiempo utilizado. Por otra parte esta tecnología tiene su aplicación en estudios
genómicos y citogenéticos, construcción de mapas genéticos y evaluación de diversidad
genética (7, 10).
El uso de anteras para generar organismos haploides, a partir del polen contenido en ellas, fue
descubierto por Guha y Maheshwari en 1966, al cultivar anteras de Datura innoxia Mill. (7).
Este proceso se llama androgénesis (8), y ha demostrado su utilidad en la familia de las
solanáceas, crucíferas, gramíneas y ranunculáceas (7, 8, 10). Sin embargo, no se ha conseguido
el mismo éxito con especias arbustivas y arbóreas (7).
Se debe tener claro que las plantas originadas por esta técnica de cultivo de tejidos, no se
originan de la antera en sí, sino del grano de polen, ya que es éste el que tiene la carga
genética haploide, mientras que la antera es tejido diploide (4, 7).
El objetivo de esta práctica fue el de sembrar y cultivar anteras en medio MS enriquecido, para
mediante los granos de polen, obtener plantas haploides estériles.
Materiales y Métodos:
Material vegetal
Se empleó cuatro flores cerradas de Lirio (Lilium candidum) (1). Todas ellas estaban ya en un
estado alto de maduración, ya que el color de los tépalos era de un rosa junto a verde. Se
seleccionó esta especie ya que posee flores grandes, donde las anteras son igualmente
grandes y facilita su manipulación.
Desinfección
Se lavó las flores con agua corriente durante algunos minutos. Posteriormente, se sumergieron
los botones en 500ml de solución de detergente al 3% más tres gotas de Tween, y se mantuvo
en agitación por 10 minutos.
Pasado el tiempo, se enjuagó las flores con agua destilada un par de veces y una tercera con
agua estéril, para luego sumergir las muestras en una solución de cloro al 4% más tres gotas de
Tween 20, durante 10 minutos en constante agitación.
Finalmente, dentro de la cámara de siembra, se realizaron 3 lavados con agua destilada estéril.
Siembra del material
El procedimiento normal para la siembra del material vegetal, indica que se sobre un pedazo
de papel autoclavado, se debe rociar las flores con alcohol al 90% y luego flamearlas sobre el
mechero hasta que la llama se extinga por sí sola1. Sin embargo, solo se flameó las flores sobre
el mechero, cuidando que no se cocine el tejido vegetal.
A continuación, se cortó la flor longitudinalmente, sacudiendo las anteras para que los granos
de polen ya desarrollados caigan al medio Murashige y Skoog (MS) enriquecido con 2.5mg/L de
2,4-D, 40g/L de azúcar y 7.5g/L de agar (pH ajustado a 5.7-5.8). También se cortó las anteras y
se las colocó en el medio ya descrito.
Se flameó la boca del frasco y se lo tapó con papel plástico. Todo este procedimiento se
efectuó con los dos lirios.
1 Protocolo entregado por la Msc. Mónica Jadán.

Los frascos se incubaron a oscuridad, y la contaminación se evaluó una semana más tarde.

Resultados y Discusión:
Los resultados obtenidos hasta la fecha han sido satisfactorios, ya que ninguno de los cuatro
medios sembrados se ha contaminado, indicando que los métodos de desinfección utilizados
(8) son eficaces, incluso a pesar de que no se asperjó las flores con alcohol al 90% por ciento
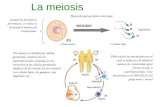
para luego flamearlas, el uso solo de fuego fue eficiente (Imagen 1).
Imagen 1. Anteras, una semana tras la siembra.El medio de cultivo junto a las anteras no presenta ningún tipo de contaminación, una semana después de la siembra.
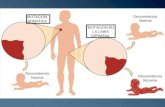
Imagen 2. Proceso de necrosis.Las anteras muestran zonas oscuras, las que corresponden a la necrosis que ha dado inicio dos semanas después de la siembra. Además no hay contaminación alguna.
Por otra parte, el proceso de necrosis en las anteras inició, en las dos semanas posteriores a la
siembra del tejido, en dos de los cuatro frascos (Imagen 2). Esto se puede observar en el
aspecto del material vegetal colocado sobre el medio MS, ya que los bordes de las anteras se
han oscurecido y han forma irregular (3).
Si se quiere ir más allá, según Vélez et al. (2010), los mejores resultados al obtener callo se
obtienen con anteras completas, sin que ellas hayan sufrido algún tipo de corte o incisión con
el objetivo de generar una abertura por la cual los granos de polen tengan un contacto más
directo con el medio enriquecido. Esto ocurre porque el tejido diploide de las anteras (4) actúa
como amortiguador fisiológico, almacenando granos de almidón, lo que a su vez le permite al
grano de polen germinar (7).
Los dos resultados posibles para el cultivo de anteras son: la formación de callos u
organogénesis, donde se puede obtener tejido haploide (proveniente de granos de polen) o
tejido diploide (proveniente del tejido propio de la antera); el segundo resultado es la
embriogénesis, donde se obtienen células conocidas como poliembriones (2, 4, 7).
La formación directa de embriones somáticos en lugar de callos, ayuda a reducir la variación
somaclonal posible (10).
Otro aspecto importante a tener en cuenta, es que el genotipo del material de origen (o de la
planta madre), ya que la forma en que las anteras respondan al cultivo dependerá en gran
parte de este factor. En especial porque se ha detectado que la formación de callo y la
regeneración de las plántulas es heredable, lo que significaría una ganancia en cuanto al
fitomejoramiento (5, 8). Además, el genotipo también afecta la habilidad del callo para
regenerar vástagos y establecer la corona (5).

Relacionado al origen del material vegetal y el genotipo, está saber si el tejido proviene de una
planta monocotiledónea o dicotiledónea. En este punto se puede ver algo que discutir, ya que
según Roca et al. (1991), se ha hecho más androgénesis en plantas monocotiledóneas como el
arroz, la cebada y el maíz (8), mientras que Polci et al. (Sin año), afirma que hay más facilidad
de conseguir androgénesis en especies dicotiledóneas (7). Esto debe ser un ámbito de
investigación, para determinar porque en ciertas especies es más fácil obtener organismos
haploides, antes que en otras.
Por otra parte, identificar correctamente la etapa más sensible a la inducción androgénica en
la microgametogénesis ayudaría a obtener mejores resultados en la obtención de callos y
regeneración de plantas. Por ejemplo, en un estudio efectuado sobre tomate Solanum
lycopersicon, se encontró que la mayor producción de callos ocurre cuando el meiocito está
entre metafase I y telofase II. La determinación de esta etapa incluso influirá en la consecución
de haploides o dobles haploides (9). Roca et al. (1991) menciona que las mejores respuestas se
han conseguido cuando las anteras se cultivaron en un desarrollo del polen entre la
microespora tardía y el polen temprano (8), sin embargo es posible que este factor cambie
entre especies (7).
El pretratamiento de las anteras puede ayudar a la androgénesis, cambiando la expresión de
genes relacionados a la generación del esporofito. Hasta ahora las bajas temperaturas se han
considerado como el mejor tratamiento (7, 8), sin embargo existen muchos tratamientos más,
así se tiene: al calor, el choque osmótico, la centrifugación de anteras, realizar incisiones en la
parte superior de las anteras, aunque como se vio más arriba no necesariamente funciona bien
(10). Otros pretratamientos probados son: la poda, la pulverización con etrel, la irradiación, la
reducción de la presión atmosférica, la anaerobiosis, una atmósfera saturada de agua o la
aplicación de gametocidas (7).
El usar bajas temperaturas estimula la embriogénesis, la división mitótica simétrica de las
microesporas (7, 8).
La composición del medio de cultivo es de igual manera un aspecto a considerar para cada
especie cultivada. Así se ha visto que un medio solidificado con agar y carbón activado da una
mejor respuesta que al solo emplear agar (7).
El medio de cultivo también debe poseer carbohidratos que le servirán como nutrientes al
tejido. Respecto a los reguladores de crecimiento, los más usados son las citoquininas y las
auxinas, como el 2,4-D usado para esta práctica. La presencia de estos reguladores exógenos
es requerida principalmente por especies cereales de plantas (7), a pesar de ello, se ha
reconocido que la respuesta del cultivo depende mucho más de los niveles endógenos de los
mismos reguladores (7, 10). Este factor es más influyente en la generación de embriones
somáticos, por ello, probar varios medios con distintas combinaciones de fitorreguladores y de
sus concentraciones, ayudaría a seleccionar los mejores tratamientos para obtener buenos
resultados, y no solo eso, sino de igual forma conseguir callos o embriones según se desee
(10).

Finalmente, el fotoperiodo, la intensidad de luz, la temperatura y la nutrición e incluso la
posición de la antera sobre el medio, son factores que se controlan al momento de originar
androgénesis, ya que pueden afectar los resultados alcanzados en algunas especies (7, 8, 10).
En un caso particular, uno de los medios se volvió totalmente líquido, a pesar de ello las
anteras de este frasco presentaban un aspecto parecido a las de los otros tres.
Conclusiones:
Los métodos de esterilización y desinfección tanto del lugar de trabajo como del
material vegetal fueron 100% efectivos, ya que no existió un solo frasco contaminado.
La formación de callo o de embrión dependerá de los factores externos o de estrés a los
que esté sometido un explante, de esta forma, la respuesta conseguida, en un tiempo
determinado y con características específicas dependerá del ambiente y el medio de
cultivo que se les dé a las anteras.
Seleccionar un buen genotipo, mediante elección de las características favorables para
lo que busca el investigador, es muy importante. Aquí estará presente la influencia del
pretratamiento dado al material de origen, ya que al inducir la expresión de genes que
se observan durante la embriogénesis, también se estará influenciando sobre la
presencia y cantidad de fitorreguladores endógenos, lo que es más importante que la
presencia exógena de los mismos.
El establecer en qué estadío se hallan las anteras, o en qué etapa es más conveniente
utilizarlas es primordial, ya que se está descubriendo que este factor sí cambia el tipo de
respuesta obtenida en un callo o un embrión.
El porqué la androgénesis no puede ser inducida en todas las especies
monocotiledóneas y dicotiledóneas de interés, es un área que necesita desarrollarse e
investigarse, para ver qué factores, seguramente propios de cada especie, interfieren
con este proceso in vitro.
Bibliografía:
1. Foro creativo. 2009. Azucena, Lirio de San Antonio.
http://www.foro-creativo.com/viewtopic.php?f=55&t=6666
2. Infojardín. 2011. Cultivo in vitro de árboles frutales. Multiplicación o reproducción de
frutal in vitro. http://articulos.infojardin.com/Frutales/cultivo-in-vitro-reproduccion.htm
3. Jauch, C. 1979. Necrosis. Patología Vegetal. Ed. El Ateneo, Buenos Aires.
4. Lentini, Z.; Roca, W.; Martínez, Z. 1997. Cultivo de anteras de arroz en el desarrollo de
germoplasma. Centro Internacional de Agricultura Tropical. Cali, Colombia. pp. 2-8
5. Muñoz, S.; Espósito, M.; Cravero, V.; García, S.; López, F.; Cointry, E. 2006. OBTENCIÓN
DE PLANTAS A PARTIR DE ANTERAS DE ESPÁRRAGO (Asparagus officinalis L.). Revista de
Investigaciones de la Facultad de Ciencias Agrarias. Núm. 9.
6. Polci, P.; Conti, V.; Aldao, G.; Miranda, R.; Echenique, V. 2005. Obtención de Plantas
haploides de Cultivares Argentinos de Trigo Pan (Triticum aestivum L.) por Cultivo de

Anteras y Cruzamientos con Maíz. Revista de Investigaciones Agropecuarias. Vol. 34,
Núm. 3, pp. 151-176
7. Polci, P.; Conti, V.; Miranda, R.; Gear, N. Sin año. Obtención de Plantas Doblehaploides.
Métodos para acelerar programas de mejoramiento e identificación varietal.
Biotecnología y mejoramiento vegetal. pp. 19-36,295-350
8. Roca, W.; Mroginski, L. 1991. Cultivo de tejidos en la agricultura. Fundamentos y
aplicaciones. Centro Internacional de Agricultura Tropical. Cali, Colombia. pp. 272-290
9. Seguí, J.; Nuez, F. Sin año. Obtención de plantas doble haploides androgénicas mediante
cultivo in vitro de anteras de tomate. Instituto de Conservación y Mejora de la
Agrodiversidad Valenciana (COMAV). Universidad Politécnica de Valencia.
10. Vélez, M.; Robledo, A.; Corona, T.; Heber, V.; Ramírez, P.; Suárez, J. 2010. OBTENCIÓN
DE PLANTAS HAPLOIDES EN CHILE MIAHUATECO (Capsicum annuum L.). Revista
Mexicana de Ciencias Agrícolas Vol.1, Núm.2, pp. 189-201