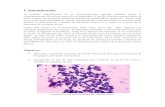
ANEXOS ANEXO 1. COLORACIÓNES COLORACIÓN DE GRAM
Transcript of ANEXOS ANEXO 1. COLORACIÓNES COLORACIÓN DE GRAM

ANEXOS
ANEXO 1. COLORACIÓNES
COLORACIÓN DE GRAM Técnica de la coloración de Gram
1. Aplicar sobre el frotis seco y fijo, cristal violeta, dejar actuar por un
minuto (colorante primario). Lavar con agua.
2. Aplicar lugol, dejar actuar por un minuto (fijador). Lavar con agua.
3. Aplicar alcohol acetona, dejar actuar por treinta segundos
(decolorante). Lavar con agua.
4. Aplicar fucsina básica, dejar actuar por un minuto (colorante de
contraste). Lavar con agua.
Control de Calidad de la Coloración de Gram
Gram positivas: Staphylococcus spp. (cocos gram positivos)
Gram negativas: Escherichia coli. (bacilo gram negativo).
Colorantes para la tinción de Gram 1. Cristal Violeta
Cristal Violeta 2g
Alcohol Metílico 100ml
2. Lugol
Cristal de Yodo 1g
Yoduro de Potasio 2g
Agua destilada 300ml

3. Alcohol Acetona Acetona 40ml
Alcohol etílico 120ml
4. Fucsina Básica Fucsina básica 1g
Alcohol etílico 95% 20ml.
COLORACIÓN DE WAYSON
Técnica de la coloración de Wayson:
1. Aplicar sobre el frotis seco y fijo el colorante de Wayson, dejar actuar
por 30 segundos.
2. Lavar con agua.
Colorantes para la Tinción de Wayson:
Consta de tres Soluciones:
1. Solución 1ª Rojo congo 2 g
Agua destilada 100 ml
Solución 1B Suero 10 ml
Agua destilada 100 ml
• Mezclar las dos soluciones, filtrar y mantenerlas en nevera

2. Solución 2 Ácido clorhidrico 1,0 ml
Agua destilada 100 ml
3. Solución 3 Azul de metileno 130 ml Este se prepara a partir de: Azul de metileno 0.3 g
Alcohol etílico 30 ml
Hidróxido de potasio 0,01%
Agua destilada 100 ml
Disolver el azul de metileno en alcohol, el hidróxido de potasio en agua y
mezclar las dos soluciones.

AGRADECIMIENTOS
Expresamos un especial agradecimiento a la Dra. Alba Alicia Trespalacios,
por sus enseñanzas y su apoyo constante.
A la Dra. Marcela Mercado quien contribuyó con el análisis estadístico de
este estudio.
A la Dependencia de Monitoría de la Facultad de Ciencias porque con sus
instalaciones y equipos hicieron posible el desarrollo de este trabajo.

DETERMINACIÓN DE LA CONCENTRACIÓN IDEAL DE ESPORAS DE
Bacillus stearothermophilus COMO INDICADOR BIOLOGICO PARA EL
CONTROL DE PROCESOS DE ESTERILIZACIÓN
LILIANA ELISA ROSERO TORRES
ANGELA MARIA ZARAMA ORTIZ
Directora Dra. Alba Alicia Trespalacios Rangel
TRABAJO DE GRADO
Presentado como requisito parcial para optar al título de:
BACTERIOLOGA
PONTIFICIA UNIVERSIDAD JAVERIANA
FACULTAD DE CIENCIAS
CARRERA DE BACTERIOLOGÍA
BOGOTÁ D.C.
2006

NOTA DE ADVERTENCIA “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia”. Artículo 23 de la Resolución No 13 de Julio de 1946.

DETERMINACION DE LA CONCENTRACIÓN IDEAL DE ESPORAS DE
Bacillus stearothermophilus COMO INDICADOR BIOLOGICO PARA EL
CONTROL DE PROCESOS DE ESTERILIZACIÓN
LILIANA ELISA ROSERO TORRES
ANGELA MARIA ZARAMA ORTIZ
APROBADO
____________________________
Dra. Alba Alicia Trespalacios Rangel
____________________________ ____________________________
Dr. DIDIER FRENANDEZ RIOS Dr. HUGO DIEZ Docente PUJ Docente PUJ JURADO JURADO

Dedicamos este triunfo a Dios, por permitirnos culminar una etapa más en
nuestras vidas, a nuestros padres quienes nos han apoyado
incondicionalmente, y nos han dado la formación necesaria para ser
personas íntegras y a nuestros familiares y amigos que nos acompañaron
durante todo este proceso, gracias por estar siempre cuando los
necesitamos.
“No es por buena suerte o por pura inspiración que sobresales,
es por emplear tus dones con gran dedicación.
El éxito es el fruto de la perseverancia,
de la fe en uno mismo,
en Dios y en los otros”.
Gonzalo Gallo Gonzalez

RESUMEN
Bacillus stearothermophilus es considerado un microorganismo ideal para
monitorear los procesos de esterilización, por carecer de patogenicidad,
pirogenicidad, toxicidad y además ser resistente a altas temperaturas.
Teniendo en cuenta lo anterior, nuestro proyecto determinó una
concentración ideal de esporas de este bacilo como indicador biológico para
el control de procesos de esterilización como calor a vapor, calor seco y
desinfección con hipoclorito de sodio a diferentes concentraciones. Para
desarrollarlo se hicieron varios ensayos con tiras de papel filtro impregnadas
con esporas de la bacteria a diferentes concentraciones de acuerdo con el
patrón de Mac Farland. Se encontró que la concentración apropiada de
esporas para monitorear los procesos de esterilización fue de 11. 3 x 108
UFC/ml. Este trabajo es un paso muy importante para proyectos posteriores
que continúen con el proceso de validación de este indicador biológico en el
control de procesos de esterilización y desinfección en la Facultad de
ciencias de la Pontificia Universidad Javeriana.

ABSTRACT
Bacillus stearothermophilus is considered an ideal microorganism to monitor
sterilization process. This is because it lacks pathogenicity, pirogenicity,
toxicity and it is resistant to hight temperatures. According to this premises
our project determined the ideal concentration of spores from this species as
a biologic indicator in several sterilization process such as steam heat, dry
heat and disinfection with sodium hypochlorite. This project was developed
using filter paper strips impregnated with spores at different concentrations
according to the Mac Farland patterns. Using this technique, the appropriate
concentration of spores to monitor sterilization process was found to be 11.3
x 108 UFC/ml this work constitutes an important step towards further projects
seeking to validate this biological indicator in the sterilization and disinfection
processes carried out in the School of Sciences in the Pontificia Universidad
Javeriana.

TABLA DE CONTENIDO Pág. 1. INTRODUCCIÓN 1
2. OBJETIVOS 2
2.1 Objetivo General 2
2.2 Objetivos Específicos 2
3. PLANTEAMIENTO Y JUSTIFICACIÓN 3
3.1 FORMULACIÓN DEL PROBLEMA 3
3.1.1Preguntas de investigación 3
3.2 IMPACTO ESPERADO 4
4. MARCO TEÓRICO 5
4.1 Desinfección 5
4.2 Esterilización 7
4.2.1 Preparacion de los Intrumentos para su esterilización 7
4.2.1.1 Limpieza de los intrumentos 7
4.2.1.2 Empaquetado del instrumental 8
4.2.2 Esterilización a vapor 9
4.2.2.1 Requisitos para la esterilización a vapor 9
4.2.2.2 Proceso de esterilización a vapor 10
4.2.2.3 Fallas en el proceso de esterilización a vapor 11
4.2.2.4 Ventajas del calor húmedo 11
4.2.2.5 Desventajas del calor húmedo 11
4.2.3 Esterilización por calor seco 12
4.2.3.1 Requisitos para la esterilización por calor seco 12
4.2.3.2 Proceso de esterilización por calor seco 13
4.2.3.3 Fallas en el proceso de esterilización 13
4.2.3.4 Ventajas del calor seco 14
4.2.3.5 Desventajas del calor seco 14
4.2.4 Controles de los Procesos de Esterilización 14
4.2.4.1 Control Mecánico 14
4.2.4.2 Control Químico 14

4.2.4.3 Control Biológico 14
4.2.5 Generalidades del Género Bacillus 16
4.2.5.1 Características de las Endosporas 16
4.2.5.2 Germinación de las Endosporas 18
4.2.5.3 Bacillus stearothermophilus 19
4.2.5.3.1 Requerimientos nutricionales 20
4.2.5.3.2 Colonia y morfología celular 22
5. MATERIALES Y MÉTODOS 23
5.1 Recuperación de la cepa Bacillus stearothermophilus ATCC 7953 23
5.2 Identificación bioquímica y coloración de Gram 23
5.3 Obtención de esporas 23
5.4 Realización del Patrón de Mac Farland 24
5.5 Elaboración del indicador biológico 24
5.6 Determinación y verificación del número de esporas presentes en
las tiras de papel filtro y controles de viabilidad 24
5.7 Ensayos con el indicador biológico en el Autoclave 25
5.8 Ensayos con el indicador biológico en el Horno 25
5.9 Ensayos con el indicador biológico para la desinfección con
hipoclorito de sodio 26
5.10 Recuento de colonias 26
5.11 Análisis estadístico 26
6. RESULTADOS 29
6.1 Recuperación de la cepa de Bacillus stearothermophilus ATCC 7953 29
6.2 Identificación bioquímica y coloración de Gram 29
6.3 Obtención de esporas 30
6.4 Patrón de Mac Farland 31
6.5 Indicador biológico 32
6.6 Determinación y verificación del número de esporas presentes en
las tiras de papel filtro y controles de viabilidad 32
6.7 Ensayos con el indicador biológico en el Autoclave 35

6.8 Ensayos con el indicador biológico en el Horno 37
6.9 Ensayos con el indicador biológico con hipoclorito de sodio 39
6.10 Estadística de los resultados para horno 41
6.11 Estadística de los resultados para el Autoclave 42
7. DISCUSION DE RESULTADOS 43
8. CONCLUSIONES 46
BIBLIOGRAFÍA 47
RECOMENDACIONES 50

INDICE DE FIGURAS Pág.
FIGURA 1. Liberación de la Endospora. 19
FIGURA 2. Esquema de Metodología. 28
FIGURA 3 y 4. Aislamiento de Bacillus stearothermophilus ATCC 7953. 29
FIGURA 5 y 6. Identificación Bioquímica de Bacillus stearothermophilus
ATCC 7953. 30
FIGURA 7. Obtención de esporas. 31
FIGURA 8. Indicador Biológico. 32
FIGURA 9. Controles de Viabilidad. 34
FIGURA 10. Ensayos en el Autoclave. 36
FIGURA 11. Ensayos en el Horno. 38
FIGURA 12. Ensayos con Hipoclorito de sodio. 40

INDICE DE TABLAS Pág.
TABLA 1. Identificación Bioquímica de Bacillus stearothermophilus. 21
TABLA 2. Porcentaje de esporas. 30
TABLA 3. Patrón de Mac Farland y las absorbancias obtenidas. 31
TABLA 4. Número de esporas presentes en las tiras de papel
filtro y Controles de Viabilidad. 33
TABLA 5. Ensayos en el Autoclave con ciclo para material limpio. 35
TABLA 6. Ensayos en el Autoclave con ciclo para material sucio. 36
TABLA 7. Ensayos en el Horno. 37
TABLA 8. Ensayos con Hipoclorito de sodio. 39
TABLA 9. Estadística para ensayos en el Horno. 41
TABLA 10. Estadística para los ensayos realizados en el Autoclave. 42

1
1. INTRODUCCIÓN
La función clave de los diferentes métodos de esterilización como el calor
seco, calor a vapor y la desinfección por productos químicos con hipoclorito
de sodio, es la destrucción o inactivación de microorganismos en todo
material y es fundamental que esta tarea se realice correctamente y sea
evaluada por medio de controles mecánicos, químicos o biológicos.
Con el fin de disminuir los riesgos de contaminación a nivel de los
laboratorios en general, dar una mayor confiabilidad a los procesos de
esterilización y mejorar la calidad del trabajo que se realiza dentro de la
facultad de ciencias, nuestro proyecto pretende determinar una
concentración ideal de esporas de Bacillus stearothermophilus ATCC 7953
como indicador biológico, para el control de los diferentes métodos de
esterilización y desinfección mencionados anteriormente.
Para desarrollarlo, se envejeció el cultivo del microorganismo hasta obtener
una buena producción de esporas, luego se impregnaron en papel filtro a
diferentes concentraciones de acuerdo al patrón de Mac Farland y se
sometieron a los procesos de esterilización y desinfección. A los resultados
obtenidos se les aplicó el análisis estadístico con el fin de dar respuesta a
los objetivos planteados.
De esta manera consideramos que este trabajo será un aporte para mejorar
el seguimiento de estos procesos llevados a cabo en la dependencia de
monitoría de la Facultad de Ciencias de la Pontificia Universidad Javeriana.

2
2. OBJETIVOS
2.1 Objetivo General
Determinar la concentración ideal de esporas de Bacillus
stearothermophilus como indicador biológico para el control de procesos de
esterilización.
2.2 Objetivo Específicos
Determinar el tiempo requerido para la producción del 80% de esporas de
Bacillus stearothermophilus.
Estandarizar la concentración apropiada de esoras de Bacillus
stearothermophilus para evaluar los procesos de esterilización a vapor, calor
seco y desinfección con hipoclorito de sodio.

3
3. PLANTEAMIENTO DEL PROBLEMA Y JUSTIFICACION
3.1 FORMULACIÓN DEL PROBLEMA
Debido a que es muy frecuente la contaminación de medios de cultivo y
áreas de trabajo con microorganismos ambientales, el trabajo en el
laboratorio de microbiología debe controlar las diferentes fuentes de
contaminación para evitar errores en los resultados de los diferentes análisis
que se realizan en él, por ello es necesario asegurar la completa eliminación
de todas las formas de vida microbiana mediante un buen control de calidad
llevado a cabo en los procesos de esterilización. Para este fin evaluaremos
los procesos de esterilización por calor seco, calor a vapor y la desinfección
con hipoclorito de sodio a diferentes concentraciones, llevados a cabo en la
dependencia de monitoría de la facultad de ciencias de la Pontificia
Universidad Javeriana y estableceremos una concentración ideal de
esporas de Bacillus stearothermophilus ATCC 7953 para lograr monitorear la
ausencia total del crecimiento de este microorganismo (utilizado como
indicador biológico en este proyecto) después de someterlo a los procesos
de esterilización y desinfección anteriormente mencionados. De esta
manera podemos aportar en el cumplimiento de normas asépticas que son
exigidas en laboratorios clínicos y microbiológicos.
3.1.1 Preguntas de investigación
¿Las esporas de Bacillus stearothermophilus son buenas indicadoras de
procesos de esterilización y desinfección?
¿Las concentraciones de esporas utilizadas en el proyecto son las
necesarias para determinar una concentración adecuada que evalúe los
métodos de esterilización y desinfección?

4
3.2 IMPACTO ESPERADO
Gracias al desarrollo de este proyecto, se logró estandarizar la concentración
óptima de esporas de Bacillus stearothermophilus que podrán ser utilizadas
como control de los procesos de esterilización por calor seco, calor a vapor y
desinfección con hipoclorito de sodio en la dependencia de monitoría de la
Facultad de Ciencias de la Pontificia Universidad Javeriana.
El indicador biológico desarrollado permitirá a esta dependencia controlar de
manera más efectiva los procesos de esterilización, ya que en la actualidad
estos son controlados por medio de cintas reveladoras de esterilidad. Dado
los altos costos de los indicadores biológicos comerciales, el indicador
desarrollado permitirá evaluar el sistema de esterilización pero a un bajo
costo.

5
4. MARCO TEORICO
En la historia de las prácticas sociales vinculadas a la salud, siempre se ha
tenido conciencia de un mundo microbiano causante de procesos biológicos
y de enfermedades. A modo de ejemplo, recordemos que ya en la
antigüedad, los romanos tomaban la precaución de hervir el agua cuando
salían en largas campañas para prevenir la contaminación de la misma (1).
Sin embargo, la comprobación de un mundo no perceptible a simple vista se
dió a partir de la invención del microscopio. Así fue como mediante diferentes
observaciones de los microorganismos se avanzó en la percepción de un
mundo microscópico. Sucesivos avances científicos permitieron constatar
que algunos microorganismos son beneficiosos y vitales para nuestra vida y
otros en cambio, transmiten infecciones y enfermedades (1).
Durante el último siglo, en los ámbitos de la Salud Pública, la industria
farmacéutica y la fabricación de dispositivos médicos ha intensificado la
preocupación por controlar y/o eliminar microorganismos dentro de los
diferentes procesos y sobre todo en su producción final. Se ha pretendido
con ésta práctica cuidar a las personas que realizan éstos procesos, a los
usuarios en general, en especial a los pacientes. Los primeros pasos de la
esterilización han estado dados por la necesidad que emergió en relación a
la problemática de higiene, desinfección y asepsia (1).
4.1 Desinfección
Las actividades de desinfección son consideradas como los mecanismos
principales para la destrucción de microorganismos mediante agentes de
naturaleza química (desinfectantes), con el fin de disminuir el número de
formas vegetativas a niveles mínimos (18).
La desinfección de instrumentos y superficies de los puestos de trabajo,
básicamente en el laboratorio donde se manipulan muestras biológicas,
constituye la forma más adecuada de evitar el posible contagio. Esto se
consigue con una correcta utilización de desinfectantes (15).

6
Para el empleo de éstos productos es necesario conocer los riesgos ligados
a su utilización y los consejos de prudencia que deben estar indicados en la
etiqueta y en la ficha de datos de seguridad. En general, el producto debe
poder aplicarse de tal manera que no presente ningún riesgo de toxicidad
aguda o crónica para los animales y el hombre. Debe tenerse en cuenta que,
por su propia función, destrucción de microorganismos, la mayoría de
desinfectantes tienen unas características de toxicidad importantes como
irritación de las mucosas y efecto carcinogénico (15).
La primera acción preventiva en cuanto a su uso es comprobar que estén
adecuadamente etiquetados y preparados tanto si se han adquirido
comercialmente, como si se han preparado en el propio laboratorio. Al
adquirir productos químicos debe exigirse siempre con la primera entrega la
ficha datos de seguridad correspondiente (15).
El cloro es el desinfectante universal, activo sobre todas las bacterias,
incluyendo esporas, y además es efectivo en un amplio rango de
temperaturas (18).
La actividad bactericida del hipoclorito de sodio se debe al ácido hipocloroso
(HClO) y al cloro gaseoso (Cl2) que se forman cuando el hipoclorito es diluido
en agua. La actividad germicida del ion hipocloroso es muy reducida debido
a que por su carga no puede penetrar fácilmente en la célula a través de la
membrana citoplasmática. En cambio, el ácido hipocloroso es neutro y
penetra fácilmente en la célula, mientras que el Cl2 ingresa como gas (18).
Dentro de los desinfectantes liberadores de cloro, los más usados son los
hipocloritos en forma líquida o sólida, los cuales despliegan buena actividad
contra bacterias, virus, hongos y en especial contra el bacilo tuberculoso.
Para su correcta utilización es necesario usar previamente la validación de lo
siguiente: calidad de los productos, concentración y dilución adecuada, la
carga microbiana del sitio que se va a desinfectar, el tiempo de exposición
del desinfectante, la concentración de la materia orgánica y factores que
alteren directamente la actividad (ejemplo: luz, calor). A concentraciones

7
altas, temperaturas adecuadas, y tiempo prolongado pueden tener acción
esporicida (7).
Existe controversia entre los autores sobre la mejor concentración del
hipoclorito de sodio. A mayor dilución, menor poder desinfectante pero
también menor irritación por lo que se ha recomendado diluir al 2.5%, o al
1% (18).
4.2 Esterilización
Se define como la completa eliminación y destrucción de todas las formas de
vida microbiana que contiene un objeto o sustancia. La FDA (Food & Drug
Administration) considera que un producto es estéril cuando la probabilidad
de supervivencia de los microorganismos en él es menor que una en un
millón (1 en 1 x 106) (11).
El material puede esterilizarse a través de varios procesos según su
estructura: metal, silicona, plástico, algodón, gasas, compresas de tela,
gomas, sondas, cables, vidrios, lentes, etc. Los objetos a esterilizar deben
ser sometidos previamente a una descontaminación y limpieza profunda,
para reducir los residuos de material orgánico y la carga bacteriana (4).
4.2.1 Preparación de los instrumentos para su esterilización
4.2.1.1 Limpieza de los instrumentos
Todo instrumento u otro objeto que vaya a ser esterilizado o desinfectado se
debe preparar mediante una cuidadosa limpieza, irrigación y secado antes de
ser sometido al proceso químico o térmico que destruirá los microorganismos
que aloja. La presencia de sangre, saliva, películas de jabón, y otros detritos
orgánicos no solo hacen aumentar el número de microorganismos que deben
ser eliminados, sino que también le protege del ambiente destructivo. Las
condiciones de esterilización y desinfección recomendadas (tiempo,
concentración y temperatura) dependen del contacto estrecho del agente
químico o térmico con el microorganismo. Los instrumentos deben lavarse lo

8
antes posible después de utilizados para acelerar la eliminación de sangre y
detritos antes que se sequen. Si no es posible los instrumentos se deben
introducir en una solución desinfectante o detergente fría. Es preferible
utilizar limpieza con ultrasonido, porque el limpiador ultrasónico puede
desalojar material contaminado de surcos, juntas y otras superficies que no
se alcanzan fácilmente con un cepillo (4).
Cuando no se dispone de un limpiador ultrasónico, es necesario cepillar los
instrumentos. Se requiere un detergente (no jabón) para desalojar sangre y
detritos de las superficies de instrumentos y para reducir la tensión de
superficie. Todas las partes removibles se deben desmontar y los
instrumentos tipo bisagra como tijeras se abren para asegurar que todo el
detergente residual sea eliminado completamente. Los elementos se secan
con una toalla antes de esterilizarse por cualquier método. El exceso de
humedad puede diluir el efecto de los agentes químicos (23).
4.2.1.2 Empaquetado del instrumental
Se debe empacar o envolver en un material que sea compatible con el
método de esterilización que se emplee. Las bolsas de esterilización se
fabrican de manera que una vez sellada mantienen la esterilidad de su
contenido. La rotura de las bolsas de esterilización se puede prevenir
envolviendo los instrumentos punzantes en toalla de papel. Los instrumentos
que se pueden dañar con el contacto con otros instrumentos, se deben
envolver separadamente para que queden protegidos. El tipo más habitual
de bolsa de esterilización es de papel y desechable.
Los instrumentos que se utilicen con poca frecuencia se deben empaquetar
individualmente, cada bolsa se debe etiquetar de forma que los instrumentos
se puedan identificar fácilmente (23).
Cuando los instrumentos y material empaquetado se insertan en la bolsa
etiquetada, el extremo abierto de la bolsa debe cerrarse con un doble
pliegue y sellarse con un fragmento de cinta de esterilización especialmente

9
diseñada. Las bolsas de plástico también se pueden sellar con calor. Los
paquetes de plástico y de papel sellados con cinta se deben esterilizar cada
4 meses. Los paquetes de plástico de sellado térmico pueden durar hasta
seis meses antes de precisar reesterilización (23).
4.2.2 Esterilización a vapor
El vapor es el método de esterilización más antiguo, seguro y con mejor
costo-efectividad. Cuando el vapor es colocado bajo presión y se eleva la
temperatura, el vapor húmedo produce cambios en las proteínas de las
células, haciéndolas inofensivas en un período determinado de tiempo. La
relación entre temperatura, presión y tiempo de exposición es el factor crítico
en la destrucción de microorganismos (13).
4.2.2.1 Requisitos para la esterilización a vapor
Todas las áreas de esterilización necesitan un procedimiento mediante el
cual se garantice y mejore la eficacia del proceso de esterilización. Este
proceso no sólo depende del buen funcionamiento del esterilizador sino que
también es importante:
• La limpieza adecuada de los productos.
• La cantidad y calidad del agente esterilizante.
• La humedad apropiada en el esterilizador y en el área de proceso.
• El tipo y método de empaque.
• La carga del esterilizador.
• Los parámetros apropiados para la carga procesada.
Solo se esterilizará el material que sea resistente al calor.
Los equipos de esterilización deben contar con:
• Manual de instrucciones.
• Calificación de las instalaciones
• Calificación de la operación
• Calificación del proceso y validación

10
• Mantenimiento preventivo, programas, calibración, registradores,
(termómetros de reloj).
• Equipos para efectuar las calibraciones.
• Historia de vida en cada equipo.
• Calificación del personal que realiza el mantenimiento, reparación y
calibraciones.
• Ficha de registro (Contenido de la carga, temperatura durante la fase
de esterilización, identificación de la persona que la esta operando,
resultado del control biológico, registro del tiempo del autoclave).
El escape de aire es absolutamente esencial para permitir el llenado del
vapor, por lo tanto el proceso de esterilización depende de la presión del
vapor, la temperatura y el tiempo.
Los empaques deben impedir el ingreso de microorganismos al interior y ser
permisible al método, quedando completamente sellado para evitar
contaminación del artículo una vez terminado el proceso. Además debe
soportar la tracción y manipulación habitual para el material sin sufrir
deterioros (6).
4.2.2.2 Proceso de esterilización a vapor
Para comenzar con el proceso de esterilización se deben colocar los
paquetes marcados con cinta adhesiva (indicador químico), con abertura
hacia arriba y ordenarlos de modo que haya una mínima resistencia a la
circulación de vapor. No colocar en el esterilizador una cantidad de objetos
mayor a la adecuada para evitar que los objetos toquen los costados o el
piso de la cámara. Luego se cierra la puerta, el aire que es evacuado añade
vapor caliente a alta presión, este penetra en el material y destruye los
microorganismos (19).
Para los autoclaves a vapor se manejan los siguientes parámetros tanto para
objetos de laboratorio como para medios bacterianos y fúngicos: la
temperatura debe estar entre 120 y 140ºC, se usa un tiempo de
precalentamiento de 7 minutos, la fase de esterilización oscila entre 10 a 15

11
minutos y se puede tener un tiempo de secado de 7 a 10 minutos, la presión
debe estar entre 20 y 23 libras (8).
Al terminarse el proceso de esterilización se permite la entrada de aire a la
cámara, en este momento los artículos deben estar secos (8).
4.2.2.3 Fallas en el proceso de esterilización
Mecánicas:
• Inadecuada remoción del aire de la cámara o escapes de aire dentro
de la cámara.
• Mala exposición a tiempo y temperatura.
• Pobre calidad del vapor afectando el tiempo requerido para esterilizar.
• El sobrecalentamiento produce vapor demasiado seco por presión del
vapor, por tanto baja la temperatura de la cámara (10).
Humanas:
• Preparar paquetes muy grandes o muy apretados.
• Envolver el material impermeable al vapor.
• Sobrecarga o incorrecta carga del esterilizador.
• Escogencia inapropiada del ciclo del material a esterilizar.
• Falla en la limpieza de los artículos (10).
4.2.2.4 Ventajas del calor húmedo:
• Rápido calentamiento y penetración
• Destrucción de bacterias y esporas en corto tiempo
• No deja residuos tóxicos
• Hay un bajo deterioro del material expuesto
• Bajo costo (9).
4.2.2.5 Desventajas del calor húmedo:
• No permite esterilizar soluciones que formen emulsiones con el agua
• Es corrosivo sobre ciertos instrumentos metálicos (9).

12
4.2.3 Esterilización por calor seco
La esterilización por calor seco produce la destrucción de los
microorganismos por oxidación de sus componentes celulares. Es un
proceso menos eficiente que la esterilización por calor húmedo porque los
microorganismos mueren con mayor rapidez cuando se encuentran en
presencia de agua, por esta razón para lograr la esterilización empleando el
calor seco se debe aplicar temperaturas más altas durante mayor tiempo.
Como el calor que se usa para destruir los microorganismos es seco, no hay
peligro de corrosión de los instrumentos. Los artículos de hule o los objetos
de tela o papel pueden ser destruidos a las temperaturas extremas del
método de calor seco (3).
4.2.3.1 Requisitos para esterilización por calor seco
Antes del proceso de esterilización se deben tener en cuenta los siguientes
parámetros:
• La limpieza adecuada de los productos.
• La cantidad y calidad del agente esterilizante.
• La carga del esterilizador.
• No se requiere cubierta de aceite para los instrumentos cuando se usa
el método de calor seco.
Solo se debe esterilizar el material que sea resistente a altas temperaturas
como material de vidrio, instrumentos quirúrgicos, agujas de metal,
materiales no miscibles con el agua.
Los equipos de esterilización deben tener:
• Manual de instrucciones.
• Calificación de las instalaciones
• Calificación de la operación
• Calificación del proceso y validación
• Mantenimiento preventivo, programas, calibración, registradores como
cronómetros y termostatos integrados para controlar la temperatura.

13
• Calificación del personal que realiza el mantenimiento, reparación y
calibraciones.
• Ficha de registro (Contenido de la carga, duración y temperatura,
identificación de la persona que la esta operando, resultado del control
biológico) (5).
4.2.3.2 Proceso de esterilización por calor seco
El horno debe encenderse 30 minutos antes de comenzar el proceso de
esterilización, el material debe colocarse correctamente dentro del horno, ya
que la forma como este se ubica puede interferir con la distribución del calor,
e influir directamente en la eficacia del proceso de esterilización; el material
debe estar marcado con cinta adhesiva (indicador químico). Se registra la
temperatura del horno (5).
Posteriormente se cierra el horno y se comienza a contar el tiempo del
proceso de esterilización. La temperatura varía entre 120° y 180°C,
requiriéndose distintos tiempos de exposición. A 140°C se necesitan por lo
menos 5 horas de exposición, mientras que a 160°C se requieren al menos 2
horas de exposición (21).
4.2.3.3 Fallas en el proceso de esterilización
Mecánicas:
• Escapes de aire dentro del horno.
• Inadecuada exposición a tiempo y temperatura.
• Pobre calidad del calor afectando el tiempo requerido para esterilizar
(10).
Humanas:
• Preparar paquetes muy grandes o muy apretados.
• Sobrecarga o incorrecta carga del esterilizador.
• Falla en la limpieza de los artículos (10).

14
4.2.3.4 Ventajas del calor seco:
• No es corrosivo para metales e instrumentos.
• Permite la esterilización de sustancias en polvo y no acuosas, y de
sustancias viscosas no volátiles (18).
4.2.3.5 Desventajas del calor seco:
• Requiere mayor tiempo de esterilización, respecto al calor húmedo,
debido a la baja penetración del calor (18).
4.2.4 Controles de los procesos de esterilización
Los controles se usan para comprobar la eficiencia de los procesos de
esterilización, estos pueden ser mecánicos, químicos o biológicos (10).
4.2.4.1 Control Mecánico
Se registran en el esterilizador las condiciones del ciclo como tiempo, presión
y temperatura de los manómetros (10).
4.2.4.2 Control Químico
Son sustancias químicas que cambian de color al cumplir condiciones de
temperatura, tiempo de exposición en el interior de la cámara.
Son de dos clases: Internos y externos. Los internos monitorizan si las
condiciones físicas de la esterilización se logran en el interior del paquete.
Los externos se hacen por cinta testigo y al terminar el proceso debe estar
coloreada en forma homogénea (10).
4.2.4.3 Control Biológico
Son microorganismos no patógenos en forma de esporas bacterianas vivas
que ofrecen gran resistencia a los agentes esterilizantes y garantizan
eficacia y especificidad al proceso de esterilización (10).
El uso de los controles biológicos para monitorear procesos de esterilización
es recomendado por la Association for the Advancement of Medical

15
Instrumentation (AAMI). La frecuencia del uso va de acuerdo con el empleo
del esterilizador, los estándares de la AAMI indican que los esterilizadores
deben evaluarse por lo menos semanalmente (10).
Existen dos presentaciones de los controles biológicos: El primero es el de la
tira de papel filtro impregnadas con esporas como las del Bacillus
stearothermophilus, el segundo es una ampolla que contiene caldo nutritivo
con esporas de esta bacteria (10).
El control biológico se coloca en el área del esterilizador menos favorable
para la esterilización, esta área es llamada punto frío y corresponde a la
parte anterior e inferior del equipo. Debe marcarse con la fecha y el lugar
dentro de la cámara. Después de exponerse el control biológico al ciclo de
esterilización, se saca del esterilizador y se incuba de acuerdo a las
instrucciones del fabricante (10).
Si el control biológico no crece después de la incubación, el proceso de
esterilización ha sido satisfactorio. Si por el contrario crece se deben tomar
las siguientes acciones:
• Recuperar todo el material que ha sido procesado, ya que se
considera como no estéril.
• Recopilar un registro escrito de las actividades llevadas a cabo. Este
informe debe incluir el tiempo y la fecha del ciclo de esterilización
fallido, una descripción del esterilizador, el número de carga, un
resultado del indicador químico y si el esterilizador tiene un monitor
mecánico supervisar también los dispositivos de información.
• Si se determina que el esterilizador funcionó mal debe repararse y
debe obtenerse un resultado negativo de una prueba biológica antes
de que se use de nuevo (10).

16
4.2.5 Generalidades del Género Bacillus
El genero Bacillus es una colección diversa de bacilos aerobios y anaerobios
facultativos, gram positivos, formadores de esporas. El género incluye
bacterias termofílicas, sicrofílicas, acidofílicas, alcalofílicas, y bacterias
halofílicas que utilizan un amplio rango de suministro de carbono para
crecimiento heterotrófico o autotrófico. Análisis de secuencias genéticas
rRNA 16S han revelado una alta heterogeneidad filogenético en el género
Bacillus (16).
La mayor parte de estos bacilos son quimiheterótrofos versátiles capaces de
utilizar una amplia gama de compuestos orgánicos simples (azúcares,
aminoácidos, ácidos orgánicos) como substratos respiratorios, y en algunos
casos capaces también de fermentar carbohidratos. La mayoría son
mesófilos, con temperaturas óptimas en el margen de 30-45ºC; sin embargo,
el género contiene también un cierto número de representantes termófilos
que crecen a temperaturas de hasta 65ºC (14).
Un grupo fisiológico especial dentro de los productores de esporas aeróbicos
es el de los termófilos extremos, que son capaces de crecer a temperaturas
tan elevadas, como 65ºC y que no logran generalmente crecer a
temperaturas por debajo de los 45ºC (20).
Este grupo comparte la capacidad de formar un tipo peculiar de célula en
reposo denominada endospora. Las endosporas pueden reconocerse por su
lugar intracelular de formación, su extremada refringencia y su resistencia a
la tinción por colorantes básicos de anilina que tiñen fácilmente las células
vegetativas (20).
4.2.5.1 Características de las endosporas
Son formas de resistencia que desarrollan ciertos bacilos y cocos gram
positivos. Entre los bacilos formadores de endosporas se encuentran las
especies de Bacillus (aerobios), Sporolactobacillus (microaerófílos),
Clostridium (anaerobios), Desulfotomaculum (anaeróbico reductor de sulfato),
Sporohalobacter (anaeróbico halófilo) y Anaerobacter (anaeróbico fijador de

17
nitrógeno), mientras que los cocos son de la especie Sporosarcina
(aeróbicos) (21).
Las esporas bacterianas comienzan a formarse durante la fase estacionaria
de crecimiento cuando se han agotado uno o más nutrientes del medio,
pueden sobrevivir en ambientes adversos durante meses o años y una vez
que las condiciones de crecimiento sean apropiadas pueden germinar y
desarrollarse para formar células vegetativas (21).
Las endosporas se caracterizan por un bajo contenido de agua, no tienen un
metabolismo detectable y carecen de compuestos de alta energía como ATP,
y otros nucleósidos trifosfatos (20).
Además son altamente resistentes a la desecación, congelación, radiación y
a la acción de ciertas sustancias químicas (21).
Normalmente, el DNA de una célula procariote sufre lesiones espontáneas,
debido a la depurinización, desaminación, alquilación y oxidación de los
nucleótidos o al efecto de la radiación UV. Sin embargo, en las células
vegetativas estos daños son rápidamente reparados por efectivos sistemas
enzimáticos (20).
En cambio las esporas bacterianas no presentan actividad enzimática pero
han desarrollado distintas estrategias que evitan la acumulación de daños
potencialmente letales en su DNA durante el estado de latencia tales como:
• Bajo contenido de agua que retarda o altera las reacciones
químicas que afectan al DNA. Este menor contenido de agua
disminuye la tasa de depurinización, la fotoquímica de DNA frente
al UV respecto a las de una célula vegetativa. La radiación UV no
genera dímeros de timina en el DNA de una espora sino un
compuesto similar a una iminil-timina.
• El DNA de la espora se encuentra unido a unas proteínas
denominadas α/α- SASP (small acid – soluble proteins) que
disminuyen el daño térmico del DNA evitando la depurinización y
cambian la reactividad fotoquímica del DNA frente al UV formando

18
los SP. Estas proteínas se hallan altamente conservadas en los
géneros Bacillus y Clostridium y son sintetizadas durante la
esporulación y degradadas durante la germinación.
• El DNA alterado durante la latencia es reparado en los primeros
momentos de la germinación.
• Las esporas presentan una elevada concentración de ácido
dipicolínico que permite acumular grandes cantidades de calcio
iónico. El ácido dipicolínico es una sustancia característica de la
espora pero no se encuentra en la célula vegetativa (20).
4.2.5.2 Germinación de las Endosporas
La germinación de una espora que lleva a la formación de una célula
vegetativa consiste en 3 fases secuenciales:
Inicia con un proceso reversible que condiciona a la espora para germinar en
un ambiente adecuado la cual involucra la desnaturalización reversible de
algunas proteínas. Continúa con la germinación, que es un proceso
irreversible en el que participan enzimas que contiene la espora, en esta
etapa hay actividad metabólica, y se pierden las características de la espora
como refractariedad y resistencia a agentes físicos y químicos. Por último se
presenta la fase de crecimiento en la cual hay una alta actividad biosintética
con síntesis de proteínas, RNA mensajero y componentes estructurales
como en una célula vegetativa. Se desarrolla la pared celular y se forma la
célula vegetativa (2). Ver Figura 1.

19
FIGURA 1. LIBERACIÓN DE LA ENDOSPORA
4.2.5.3 Bacillus stearothermophilus
Es considerado un microorganismo ideal para monitorear los procesos de
esterilización, porque carece de patogenicidad, pirogenicidad, toxicidad y
además es resistente a altas temperaturas (24).
De acuerdo a la Farmacopea de los Estados Unidos Mexicanos (FEUM), se
establece que los indicadores biológicos deben cumplir con las
características morfológicas, de cultivo y bioquímicas de la cepa Bacillus
stearothermophilus ATCC 7953 para los ciclos de esterilización mediante
vapor a presión (17).

20
4.2.5.3.1 Requerimientos Nutricionales
Es un microorganismo termófilo que se desarrolla a 65ºC, se ha encontrado
en la naturaleza en lugares donde existen formaciones de agua y
yacimientos petroleros como Russia, Kazakhastan y China. Se puede
desarrollar en medios sintéticos y no requiere factores de crecimiento,
vitaminas, NaCl o KCl. Se ha observado buen crecimiento sobre agar de
papa, agar nutritivo y agar Infusión Cerebro Corazon (BHI). Es capaz de
utilizar aeróbicamente una amplia variedad de azucares tales como glucosa,
sacarosa, maltosa y lactosa (11-89%), pero no producen ácido a partir de
xilosa y manitol Reducen nitratos a nitritos (16).
Frente a la catalasa presenta una reacción positiva y posee la capacidad de
hidrolizar la esculina y el almidón. En el medio Acido Sulfídrico, Indol
Motilidad (SIM) posee motilidad positiva, no produce indol ni ácido sulfúrico
(H2S). No deamina la fenilalanina. En el medio Triple Sugar Iron (TSI) utiliza
los tres azúcares con formación de ácido, no produce gas ni ácido sulfúrico
(H2S). No produce hidroxiacetona. En el agar Urea de Christensen se puede
presentar una reacción positiva en un 11 a 89%. La reacción lecitinasa en
yema de huevo y Voges-Proskauer dan negativas (12,16). Ver tabla 1.

21
TABLA 1. IDENTIFICACIÓN BIOQUÍMICA DE Bacillus
stearothermophilus
IDENTIFICACION BIOQUIMICA
CARACTERISTICAS B. stearothermophilus Ancho de la célula (µm) 0,6 - 1
Longitud (µm) 2 - 3,5
Morfología Esporas * O, S
Localización Esporas * ST, T
Coloración Gram Positiva
Catalasa Positiva
Crecimiento:
Rango de Ph 6,0 - 8,0
Temperatura 65ºC
Producción de ácido a partir de: Glucosa Positiva
Xilosa Negativa
Manitol Negativa
Lactosa V *
Sacarosa Positiva
Maltosa Positiva
Hidrólisis de:
Esculina Positiva
Almidón Positiva
Medio TSI:
Utilización de azucares A/A
H2S Negativo
Gas Negativo
Medio SIM:
Motilidad Positiva
Indol Negativo
H2S Negativo
Urea de Christensen V *
Reducción de Nitratos Positivo
Fenilalanina Negativo
Lecitinasa Negativo
Voges-Proskauer Negativo
Rojo de Metilo Positivo
Morfología Esporas *: O, ovales o cilíndricas; S, las esporas deforman el soma bacteriano. Localización Esporas *: ST, subterminal; T, Terminal. V*: 11 – 89% positivos.

22
4.2.5.3.2. Colonia y morfología celular
Sobre agar nutritivo, se forman colonias redondas, mucosas, pequeñas,
incoloras, con un diámetro de aproximadamente 1mm a 5 mm. Al observar
en microscopia electrónica muestra una célula gram positiva con envoltura
característica. La membrana citoplasmática es rodeada por una capa
delgada de peptidoglicano. Posee esporas ovales o cilíndricas subterminales
o terminales que deforman el soma bacteriano. La división celular es
frecuentemente asimétrica (12, 16).

23
5. MATERIALES Y MÉTODOS
Para determinar la concentración ideal de esporas de Bacillus
stearothermophilus que deben utilizarse como indicador biológico para el
control de procesos de esterilización, se siguió la siguiente metodología:
5.1 Recuperación de la cepa Bacillus stearothermophilus ATCC 7953
Se obtuvo una cepa certificada de Bacillus stearothermophilus ATCC 7953
REMEL INC ®. De acuerdo a las recomendaciones del fabricante, se
recuperó en un tubo con 3 mililitros de Caldo Brain Hearth Infusión (BHI)
Merck 10493 ® y se incubó por 48 horas a una temperatura de 65ºC.
5.2 Identificación bioquímica y Coloración de Gram
Se realizó un repique de la cepa recuperada en una caja de petri con Agar
BHI, y se montaron las siguientes pruebas bioquímicas para su posterior
identificación: Catalasa, Citrato, TSI, LIA, SIM, Fenilalanina, Hidrólisis de la
esculina, Urea de Christensen, Voges-Proskauer, Rojo de Metilo y Azucares
como Glucosa, Lactosa, Sacarosa y Maltosa. Se realizó también la
coloración de Gram.
5.3 Obtención de Esporas
Luego de su identificación, se realizaron resiembras a 15 cajas de petri con
Agar BHI y se incubaron a 65ºC para el envejecimiento del cultivo y la
obtención de esporas. Se realizó diariamente un conteo de esporas por
medio de la coloración de Wayson (Ver anexo 1) las cuales se observaron
como cuerpos esféricos libres antes encontrados dentro del bacilo. El conteo
se realizó hasta obtener un porcentaje mayor al 80%. De acuerdo a Beaman
et al (1988).

24
5.4 Realización del Patrón de Mac Farland
Una vez obtenidas las esporas se prepararon 11 patrones de Mac Farland
desde 0.5 a 10, utilizando para la lectura el espectrofotómetro Spectronic
21D ® a una longitud de onda de 540 nanómetros. Para esto se tomaron
colonias de cada una de las 15 cajas, se suspendieron en tubos con agua
destilada estéril y se leyeron las absorbancias hasta verificar que cada uno
de los patrones se encontraran dentro del rango establecido para cada
patrón y de esta forma se determinó la concentración de células por mililitro.
5.5 Elaboración del Indicador Biológico
Se cortaron 340 tiras de papel filtro de 0.5 centímetros de ancho por 3
centímetros de largo y se esterilizaron. Luego se impregnaron con 50
microlitros (volumen necesario para impregnar toda la tira) de la suspensión
de esporas de cada patrón y se llevaron a incubar a 37ºC durante tres horas
aproximadamente hasta que el papel estuviera seco y las esporas quedaran
fijadas a este.
5.6 Determinación y verificación del número de esporas presentes en
las tiras de papel filtro y Controles de Viabilidad
Los controles de viabilidad se prepararon resuspendiendo la tira en 100 µl de
caldo BHI y a partir de este tubo se hicieron seis diluciones seriadas con un
volumen final de 10 µl. De cada dilución se tomó 1 µl y se sembró en cajas
de petri con agar BHI, se incubaron a 65ºC durante 48 horas para su
recuento. Luego se obtuvieron las UFC/ml para poder comparar las
concentraciones con el patrón de Mac Farland y de esta forma establecer a
que patrón realmente equivalía cada indicador biológico. Simultáneamente
se hizo el muestreo de cada patrón para la esterilización en horno, autoclave
y desinfección con hipoclorito de sodio.

25
5.7 Ensayos con el Indicador Biológico en el Autoclave
Para la esterilización a vapor se utilizó el autoclave marca Sterilof ®. En este
autoclave se evaluaron 5 puntos diferentes: parte superior derecha, parte
superior izquierda, centro, parte inferior derecha y parte inferior izquierda.
Para cada una de estas partes se colocaron las tiras impregnadas de los
once patrones por duplicado y se llevó a esterilizar junto con el material
limpio de la dependencia de monitoría. El ciclo de esterilización se llevó a
cabo de la siguiente manera: 30 minutos de precalentamiento, 20 minutos de
esterilización a 20 libras de presión y 121ºC de temperatura. Después de la
esterilización se sacaron las tiras de papel filtro, se suspendieron en 100 µl
de caldo BHI y se sembraron 50 µl en agar BHI. Por último se incubaron a
65ºC durante 48 horas para su recuento.
Después de obtener los resultados del recuento de colonias de las cajas que
presentaron crecimiento luego de la esterilización con el anterior ciclo, se
repitió el proceso de esterilización a vapor pero con el ciclo de material sucio
el cual se llevó a cabo de la siguiente manera: 30 minutos de
precalentamiento, 15 minutos de esterilización a 35 Libras de presión y
135ºC de temperatura. Se sacaron las tiras de papel filtro, se suspendieron
en 100 µl de caldo BHI y se sembraron 50 µl en agar BHI. Se incubaron a
65ºC durante 48 horas para su recuento.
5.8 Ensayos con el Indicador Biológico en el Horno
La esterilización por calor seco se hizo en el horno marca Binder ®. De igual
forma se evaluaron los 5 puntos empleados en el autoclave con la misma
cantidad de tiras impregnadas por duplicado. El ciclo de esterilización del
horno se realizó de la siguiente manera: 30 minutos de precalentamiento y
dos horas de esterilización a una temperatura de 220ºC. Después de la
esterilización se sacaron las tiras de papel filtro, se suspendieron en 100 µl

26
de caldo BHI y se sembraron 50 µl en agar BHI. Luego se incubaron a 65ºC
durante 48 horas para su recuento.
5.9 Ensayos con el Indicador Biológico para la desinfección con
Hipoclorito de Sodio
La desinfección se llevó a cabo utilizando tubos con 3 ml de hipoclorito de
sodio en dos concentraciones, la primera a una concentración de 0.52% y la
segunda al 2.5% las cuales son empleadas por la dependencia de monitoría
de la Facultad de Ciencias. Se hicieron cuatro ensayos con las tiras de papel
filtro de cada patrón sumergiéndolas durante 1 minuto y sacándolas para
resuspender en 100 µl de caldo BHI. Por último se tomaron 50 µl de ésta
suspensión y se sembraron en cajas de petri con agar BHI. Se incubaron a
65ºC por 48 horas para su posterior recuento.
5.10 Recuento de Colonias
Pasadas las 48 horas de incubación, se realizó el recuento de colonias en
todas las cajas que presentaron crecimiento. Las cajas de los controles de
viabilidad, se leyeron de acuerdo al método de contaje en placa por siembra
en superficie, en las cajas que contenían entre 30 y 300 colonias las cuales
correspondían a la última dilución. A las cajas del muestreo que tuvieron
crecimiento se les hizo el recuento de colonias para establecer las UFC/ml.
5.11 Análisis Estadístico
Los resultados correspondientes a los procesos de esterilización tanto para
horno como para autoclave con ciclo de material limpio, se analizaron con el
programa Statistix utilizando la prueba para la proporción.
En esta prueba se planteó la siguiente hipótesis:

27
La proporción de pruebas de esterilidad con ausencia total de crecimiento de
Bacillus stearothermophilus ATCC 7953 es del 95%.
Hipótesis nula (Ho): P=0.95
Hipótesis alterna (Hi): P≠0.95
Para el rechazo o no de esta hipótesis se determinó el valor de p para los
resultados obtenidos en cada concentración del indicador biológico
empleada en este estudio.
Si p<0.05 se rechaza la hipótesis nula.
Si p>0.05 no se rechaza la hipótesis nula.
Los resultados obtenidos en la desinfección con hipoclorito de sodio y la
esterilización en autoclave con material sucio se analizaron de forma
apreciativa debido a que el número de pruebas evaluadas en estos procesos
no era suficiente para analizarlo estadísticamente, ya que para material sucio
se evaluó solo las dos últimas concentraciones que correspondieron a las
cajas en que hubo crecimiento después de la esterilización con material
limpio. Para la desinfección con hipoclorito de sodio se realizaron 4
repeticiones de igual forma no aptas para el análisis estadístico.

28
FIGURA 2. ESQUEMA DE METODOLOGÍA
Se realizaron los 11 patrones de Mac
Farland
Se cortaron tiras de papel filtro de 3cm de
largo x 0.5 cm de ancho
. Se impregnaron con cada patrón de Mac Farland
Para los controles de viabilidad de hicieron
seis diluciones seriadas
Se realizaron los
ensayos
Esterilización con calor seco a 220ºC
por 2 horas
Esterilización a vapor 121ºC 20 Lb, 20 min y a 135ºC, 35 Lb, 15
min
Desinfección con hipoclorito de sodio
0.52% y 2.5%
Se sembraron en agar BHI y se realizó el conteo de UFC/mL
a las 48 horas.
Recuperación en caldo BHI cepa Bacillus stearothermophilus
ATCC 7953.
Realizar un repique Agar BHI
Realizar batería bioquímica y coloración de gram para su
confirmación.
Sembrar en 15 cajas de Agar BHI
Envejecer cultivo, hasta obtención de esporas.
Realizar recuento de esporas diariamente hasta que el 80 % de cultivo este en fase esporulada.
Se realizaron los 11
patrones de Mac Farland
Se cortaron tiras de papel filtro de 3cm de
largo x 0.5 cm de ancho
. Se impregnaron con cada patrón de Mac Farland
Para los controles de viabilidad de hicieron
seis diluciones seriadas
Se realizaron los
ensayos
Esterilización con calor seco a 220ºC
por 2 horas
Esterilización a vapor 121ºC 20 Lb, 20 min y a 135ºC, 35 Lb, 15
min
Desinfección con hipoclorito de sodio
0.52% y 2.5%
Se sembraron en agar BHI y se realizó el conteo de UFC/mL
a las 48 horas.
Recuperación en caldo BHI cepa Bacillus stearothermophilus
ATCC 7953.
Repique Agar BHI a partir de Caldo BHI
Se realizó prueba bioquímica y coloración de gram para su
confirmación.
Se sembró en 15 cajas de Agar
BHI
Se envejeció cultivo, hasta
obtención de esporas.
Se realizó recuento de esporas diariamente hasta que el 80 % de
cultivo estuviera en fase esporulada.

29
6. RESULTADOS
6.1 Recuperación de la cepa de Bacilllus stearothermophilus ATCC 7953
Para desarrollar este estudio se recuperó la cepa de Bacilllus
stearothermophilus ATCC 7953 en el agar BHI a una temperatura de 65ºC, la
cual mostró colonias redondas, mucosas, pequeñas, blanquecinas, con un
diámetro de aproximadamente 1mm a 5 mm, como se muestran en la figura
3 y 4.
FIGURA 3 y 4. Aislamiento de Bacillus stearothermophilus ATCC 7953. 6.2 Identificación Bioquímica y Coloración de Gram
Frente a la catalasa presentó una reacción positiva e hidrolizó la esculina.
En el medio SIM presentó motilidad positiva, indol negativo y ácido sulfúrico
negativo (H2S). La fenilalanina no fue deaminada. En el medio TSI se dió una
reacción A/A sin producción de gas ni ácido sulfúrico (H2S). En el Agar Urea
de Christensen se obtuvo una reacción positiva. El Voges-Proskauer fue
negativo y el Rojo de Metilo positivo. Fermentó los siguientes azucares:
glucosa, lactosa, sacarosa y maltosa. Ver figura 5. En cuanto a la Coloración
de Gram se observaron bacilos gram positivos esporulados, como se
observa en la Figura 6.

30
FIGURA 5 y 6. Identificación Bioquímica y Coloración de Gram de Bacillus stearothermophilus ATCC 7953.
6.3 Obtención de Esporas
Empleando la coloración de Wayson se realizó un conteo de esporas
diariamente sobre un total de 500 bacilos, como se muestra en la tabla 2.
TABLA 2. Porcentaje de Esporas.
DIA
No DE ESPORAS EN 500 BACILOS OBSERVADOS
PORCENTAJE DE
ESPORAS 1 155 31% 2 260 52% 3 435 87%
Se obtuvo un recuento de 31% de esporas en el primer día, 52% de esporas
en el segundo día y 87% de esporas al tercer día, como se muestra en la
figura 7.

31
0
20
40
60
80
100
PORCENTAJE
1 2 3
DIAS
PRODUCCIÓN DE ESPORAS
Esporas
FIGURA 7. Obtención de esporas. 6.4 Patrón de Mac Farland
Se preparó el patrón de Mac Farland con el fin de obtener un amplio rango
de concentraciones para impregnar las esporas en el papel filtro y realizar los
ensayos en el horno, autoclave y con hipoclorito. En la Tabla 3 se indican las
absorbancias de cada Patrón de Mac Farland y la concentración
correspondiente para cada uno y se añaden las absorbancias obtenidas en
nuestro estudio, leídas a una longitud de onda de 540 nm.
TABLA 3. Patrón de Mac Farland y las absorbancias obtenidas.
No PATRÓN DE MAC FARLAND
ABSORBANCIAS PATRÓN
CONCENTRACIÓN PATRÓN cel/ml
ABSORBANCIA OBTENIDA
0.5
0.05
1.5 x 10
8
0.052
1
0.1
3 x 10
8
0.170
2
0.2
6 x 10
8
0.245
3
0.3
9 x 10
8
0.383
4
0.4
12 x 10
8
0.469
5
0.5
15 x 10
8
0.556
6
0.6
18 x 10
8
0.683
7
0.7
21 x 10
8
0.778
8
0.8
24 x 10
8
0.868
9
0.9
27 x 10
8
0.960
10
1.0
30 x 10
8
1.160

32
6.5 Indicador Biológico
Se realizó a partir de tiras de papel filtro de 0.5 centímetros de ancho por 3
centímetros de largo, impregnadas con 50 microlitros (volumen necesario
para impregnar toda la tira) de la suspensión de esporas de Bacillus
stearothermphilus ATCC 7953 de cada patrón. Ver figura 8.
FIGURA 8. Indicador Biológico.
6.6 Determinación y verificación del número de esporas presentes en
las tiras de papel filtro y Controles de Viabilidad
En la tabla 4 se indica el número de esporas impregnadas en la tira para
cada patrón y se muestra el número de unidades formadoras de colonias por
mililitro recuperadas a partir de la última dilución seriada. Estos datos se
compararon con el rango de concentración del patrón de Mac Farland y se
obtuvo una equivalencia que da como resultado una recuperación del 50%
de esporas presentes en la tira de papel filtro. En la figura 9 se muestran las
UFC recuperadas para cada patrón a partir de la última dilución.

33
TABLA 4. Número de esporas presentes en las tiras de papel filtro y
Controles de Viabilidad
No PATRÓN
No ESPORAS POR TIRA
UFC/ml RECUPERADAS
RANGO DE CONCENTRACIÓN
PATRON
EQUIVALENCIA AL PATRÓN Mac
Farland
0.5
7.5 x 106
0.6 x 10
8
0.75 x 108 - 2.25 x 10
8
Aprox. 0.5
1
15 x 10
6
1.2 x 108
0.75 x 10
8 - 2.25 x 10
8
Patrón 0.5
2
30 x 10
6
2.6 x 108
2.26 x 10
8 - 4.5 x 10
8
Patrón 1
3
45 x 10
6
4.0 x 108
2.26 x 10
8 - 4.5 x 10
8
Patrón 1
4
60 x 10
6
5.3 x 108
4.6 x 10
8 - 7.5 x 10
8
Patrón 2
5
75 x 10
6
6.5 x 108
4.6 x 10
8 - 7.5 x 10
8
Patrón 2
6
90 x 10
6
8.0 x 108
7.6 x 10
8 - 10.5 x 10
8
Patrón 3
7
105 x 10
6
8.8 x 108
7.6 x 10
8 - 10.5 x 10
8
Patrón 3
8
120 x 10
6
11.3 x 108
10.6 x 10
8 - 13.5 x 10
8
Patrón 4
9
135 x 10
6
12.9 x 108
10.6 x 10
8 - 13.5 x 10
8
Patrón 4
10
150 x 10
6
14.3 x 108
13.6 x 10
8 - 16.5 x 10
8
Patrón 5

34
FIGURA 9. CONTROLES DE VIABILIDAD
A. B. C.
D. E. F.
G. H. I.
J. K.
FIGURA 9. Controles de Viabilidad: A. Patrón 0.5: 6 colonias recuperadas. B. patrón 1: 12 colonias recuperadas. C. Patrón 2: 26 colonias recuperadas. D. Patrón 3: 40 colonias recuperadas. E. Patrón 4: 53 colonias recuperadas. F. Patrón 5: 65 colonias recuperadas. G. Patrón 6: 80 colonias recuperadas. H. Patrón 7: 88 colonias recuperadas. I. Patrón 8: 113 colonias recuperadas. J. Patrón 9: 129 colonias recuperadas. K. Patrón 10: 143 colonias recuperadas.

35
6.7 Ensayos con el Indicador Biológico en el Autoclave Para el autoclave con el ciclo de 15 min, 20 Lb y 121ºC, se evaluaron 5
puntos diferentes con el indicador biológico: parte superior derecha, parte
superior izquierda, centro, parte inferior derecha y parte inferior izquierda.
Como se muestra en la tabla 5, desde la concentración 0.6 x 108 hasta la
11.3 x 108 no hubo crecimiento de Bacillus stearothermophilus ATCC 7953
después del proceso de esterilización. Mientras que para las concentraciones
12.9 x 108 y 14.3 x 108 hubo crecimiento del indicador biológico ubicado en
la parte inferior derecha y en la parte inferior izquierda.
TABLA 5. Ensayos en el Autoclave con ciclo para material limpio.
Concentración AUTOCLAVE UFC/ml (15 min, 20 Lb, 121ºC)
Cel/ml Sup. Der Sup. Izq Centro Inf. Der Inf. Izq
0.6 x 108
0 0 0 0 0 0 0 0 0 0
1.2 x 108
0 0 0 0 0 0 0 0 0 0
2.6 x 10
8 0 0 0 0 0 0 0 0 0 0
4.0 x 10
8 0 0 0 0 0 0 0 0 0 0
5.3 x 10
8 0 0 0 0 0 0 0 0 0 0
6.5 x 10
8 0 0 0 0 0 0 0 0 0 0
8.0 x 10
8 0 0 0 0 0 0 0 0 0 0
8.8 x 10
8 0 0 0 0 0 0 0 0 0 0
11.3 x 10
8 0 0 0 0 0 0 0 0 0 0
12.9 x 10
8 0 0 0 0 0 0 10 0 0 0
14.3 x 10
8 0 0 0 0 0 0 50 30 40 0
Con el fin de observar si estos resultados afectarían a la esterilización de
productos contaminados, se probó el ciclo de esterilización utilizado para
material sucio (15 minutos, 35 Libras de presión a 135ºC), se evaluaron las
mismos cinco partes para las últimas concentraciones (12.9 x 108 y 14.3 x
108) sin obtener crecimiento. Ver tabla 6.

36
TABLA 6. Ensayos en el Autoclave con ciclo para material sucio.
Concentración AUTOCLAVE UFC/ml (15 min, 35 Lb, 135ºC)
Cel/ml Sup. Der Sup. Izq Centro Inf. Der Inf. Izq
12.9 x 108
0 0 0 0 0 0 0 0 0 0
14.3 x 108
0 0 0 0 0 0 0 0 0 0
A continuación se muestra en la Figura 10 las cajas donde hubo crecimiento
después de la esterilización en cada una de las partes del autoclave
evaluadas con el ciclo de material limpio.
A. B.
C. D.
Figura 10. Ensayos en el Autoclave: A una concentración de 12.9 x 108 UFC/ml después de esterilizar se observó crecimiento en: A. Autoclave Inferior Derecho: 1 colonia. A la concentración de 14.3 x 108 UFC/ml se observó crecimiento en B. Autoclave Inferior Izquierdo: 4 colonias. C y D. Autoclave Inferior Derecho: 3 y 5 colonias respectivamente.

37
6.8 Ensayos con el Indicador Biológico en el Horno
Se evaluaron 5 puntos diferentes con el indicador biológico: parte superior
derecha, parte superior izquierda, centro, parte inferior derecha y parte
inferior izquierda. En la tabla 7 se observó que desde la concentración 0.6 x
108 hasta la 11.3 x 108 no hubo crecimiento de Bacillus stearothermophilus
ATCC 7953 después del proceso de esterilización. Mientras que para las
concentraciones 12.9 x 108 y 14.3 x 108 hubo crecimiento del indicador
biológico ubicado en la parte central, en la parte inferior derecha y en la parte
inferior izquierda.
TABLA 7. Ensayos en el Horno.
Concentración HORNO UFC/ml
UFC/ml Sup. Der Sup. Izq Centro Inf. Der Inf. Izq
0.6 x 108
0 0 0 0 0 0 0 0 0 0
1.2 x 108
0 0 0 0 0 0 0 0 0 0
2.6 x 10
8 0 0 0 0 0 0 0 0 0 0
4.0 x 10
8 0 0 0 0 0 0 0 0 0 0
5.3 x 10
8 0 0 0 0 0 0 0 0 0 0
6.5 x 10
8 0 0 0 0 0 0 0 0 0 0
8.0 x 10
8 0 0 0 0 0 0 0 0 0 0
8.8 x 10
8 0 0 0 0 0 0 0 0 0 0
11.3 x 10
8 0 0 0 0 0 0 0 0 0 0
12.9 x 10
8 0 0 0 0 30 0 20 0 0 0
14.3 x 10
8 0 0 0 0 20 0 60 20 40 0
En la figura 11 se muestran las cajas que presentaron crecimiento del bacilo
en las cinco partes del horno evaluadas, después de la esterilización. Este
crecimiento correspondió a las concentraciones más altas.

38
A. B.
C. D.
E. F.
FIGURA 11. Ensayos en el horno: A una concentración de 12.9 x 108 UFC/ml después de esterilizar se observó crecimiento en: A. Horno Inferior Derecho: 2 colonias. B. Horno Centro: 3 colonias. A la concentración de 14.3 x 108 UFC/ml se observó crecimiento en C. Horno Centro: 2 colonias. D y F. Horno Inferior Derecho: 2 y 6 colonias respectivamente. E. Horno Inferior Izquierdo: 4 colonias.

39
6.9 Ensayos con el Indicador Biológico con Hipoclorito de sodio
Se realizaron 4 ensayos con Hipoclorito de sodio al 0.52% y al 2.5%. En la
tabla 8 se puede ver que desde la concentración 0.6 x 108 hasta la 11.3 x
108 no hubo crecimiento de Bacillus stearothermophilus ATCC 7953 después
del proceso de desinfección con hipoclorito de sodio al 0.52% y 2.5%.
Mientras que para las concentraciones 12.9 x 108 y 14.3 x 108 hubo
crecimiento del indicador biológico después de la desinfección con hipoclorito
al 0.52%.
TABLA 8. Ensayos con hipoclorito de sodio.
Concentración UFC/ml
Hipoclorito 0.52% UFC/ml
Hipoclorito 2.5 % UFC/ml
0.6 x 10
8 0 0 0 0 0 0 0 0
1.2 x 10
8 0 0 0 0 0 0 0 0
2.6 x 10
8 0 0 0 0 0 0 0 0
4.0 x 10
8 0 0 0 0 0 0 0 0
5.3 x 10
8 0 0 0 0 0 0 0 0
6.5 x 10
8 0 0 0 0 0 0 0 0
8.0 x 10
8 0 0 0 0 0 0 0 0
8.8 x 10
8 0 0 0 0 0 0 0 0
11.3 x 10
8 0 0 0 0 0 0 0 0
12.9 x 10
8 20 10 30 0 0 0 0 0
14.3 x 10
8 50 0 30 20 0 0 0 0
En la figura 12 se muestra las cajas en las que hubo crecimiento del bacilo
después de la desinfección con hipoclorito de sodio al 0.52%.

40
A. B.
C. D.
E. F.
Figura 12. Ensayos con Hipoclorito de sodio: Después de realizar el proceso de desinfección se observó crecimiento a una concentración de 12.9 x 108 UFC/ml en: A, B y C. Hipoclorito de sodio 0.52%: 1, 2 y 3 colonias respectivamente. Con la concentración de 14.3 x 108 UFC/ml se observó crecimiento en: D, E y F. Hipoclorito de sodio 0.52%: 3, 2 y 1 colonia respectivamente.

41
6.10 Estadística de los resultados para el Horno
Según los datos arrojados por el programa statistix, en la tabla 9 se indica el
valor de p para cada concentración del indicador biológico el cual se emplea
para rechazar o no la prueba, se muestra también el número de repeticiones
realizadas y el número de cajas en las que no hubo crecimiento de Bacillus
stearothermophilus ATCC 7953 después de realizada la esterilización en el
horno. Con color azul se señalan las pruebas rechazadas y con color verde
se señalan las pruebas no rechazadas.
TABLA 9. Estadística para Ensayos en el Horno.
Concentración HORNO UFC/ml
UFC/ml No Repeticiones Sin Crecimiento Valor de P
0.6 x 108
10 10 0.468
1.2 x 108
10 10 0.468
2.6 x 10
8 10 10 0.468
4.0 x 10
8 10 10 0.468
5.3 x 10
8 10 10 0.468
6.5 x 10
8 10 10 0.468
8.0 x 10
8 10 10 0.468
8.8 x 10
8 10 10 0.468
11.3 x 10
8 10 10 0.468
12.9 x 10
8 10 8 0.029
14.3 x 10
8 10 6 0.0002

42
6.11 Estadística de los resultados para el Autoclave
Según los datos arrojados por el programa statistix, en la tabla 10 se indica
el valor de p para cada concentración del indicador biológico el cual se
emplea para rechazar o no la prueba, se muestra también el número de
repeticiones realizadas y el número de cajas en las que no hubo crecimiento
de Bacillus stearothermophilus ATCC 7953 después de realizada la
esterilización en el autoclave para material limpio. Con color azul se señalan
las pruebas rechazadas y con color verde se señalan las pruebas no
rechazadas.
TABLA 10. Estadística para los Ensayos realizados en el Autoclave.
Concentración AUTOCLAVE UFC/ml (15 min, 20 Lb, 121ºC)
UFC/ml No Repeticiones Sin Crecimiento Valor de P
0.6 x 108
10 10 0.468
1.2 x 10
8 10 10 0.468
2.6 x 10
8 10 10 0.468
4.0 x 10
8 10 10 0.468
5.3 x 10
8 10 10 0.468
6.5 x 10
8 10 10 0.468
8.0 x 10
8 10 10 0.468
8.8 x 10
8 10 10 0.468
11.3 x 10
8 10 10 0.468
12.9 x 10
8 10 9 0.468
14.3 x 10
8 10 7 0.0037

43
7. DISCUSIÓN DE RESULTADOS
Bacillus stearothermophilus es considerado un indicador biológico ideal para
el monitoreo de los procesos de esterilización porque carece de
patogenicidad, pirogenicidad, toxicidad y sus esporas son altamente
resistentes al calor. Publicaciones como las del World Health Organization
(2003), Fallis (1998), Parra et al. (1999) se han basado en el
comportamiento de estas esporas a diferentes condiciones de tiempo y
temperatura, los resultados de la muerte de estas esporas nos llevan a
pensar que al ser verificada la eliminación de estas esporas, se puede
pensar también en la muerte de formas bacterianas menos resistentes,
garantizando un proceso de esterilización altamente eficiente. Por esto
nuestro estudio utilizó Bacillus stearothermophilus ATCC 7953, para obtener
una concentración ideal de esporas en el control de los procesos de
esterilización.
De acuerdo con los resultados obtenidos en la producción de esporas, se
obtuvo el 87% del cultivo en fase esporulada a los tres días. Este resultado
no era el esperado por nosotras ya que en estudios como los de Zmidzinska
et al. (2004) y Kralovic (2000), los cultivos de Bacillus stearothermophilus a
55ºC duraban alrededor de siete días en producir un porcentaje mayor al
80%, esto pudo deberse al medio empleado, ya que se presentó una mayor
desecación del medio con la consecuente disminución de nutrientes,
aportando un ambiente desfavorable que pudo acelerar de alguna manera
el proceso de esporulación.
Teniendo en cuenta que hay dos presentaciones de indicadores biológicos
disponibles como lo menciona Fallis (1998), uno con esporas impregnadas
en papel filtro y otro a manera de ampollas que contienen las esporas en un
caldo nutritivo; nosotras desarrollamos nuestro propio indicador biológico a
manera de esporas de Bacillus stearothermophilus ATCC 7953 impregnadas
en papel filtro, el cual fue sometido a los diferentes ensayos de esterilización
y desinfección y de acuerdo a los resultados obtenidos se obtuvo que en los
controles de viabilidad hubo una recuperación del 50% de esporas presentes

44
en la tira de papel filtro, lo cual pudo deberse a que no se empleó un
tratamiento con lisozimas, centrifugación y lavados repetidos para permitir la
liberación de todas las endosporas desde el esporangio y la lisis de algunas
células no esporuladas presentes en la solución, como lo explica el estudio
de Zmidzinska et al. (2004). Otro aspecto importante que puede explicar la
disminución en la recuperación total de esporas dada en nuestro estudio, se
basa en que según Beaman et al. (1988) menos del 10% del número total de
esporas sin un tratamiento previo al calor germinan y forman colonias. Sin
embargo la población de esporas recuperadas en nuestro estudio fue apta,
suficiente y superior al compararla con indicadores comerciales como el
Sterikon Plus Bioindicador de Merck ® en donde la concentración de
esporas (5 x 105 – 1 x 107 por unidad) es similar a la empleada en nuestro
estudio.
En cuanto a los resultados de los ensayos de esterilización a vapor y calor
seco se puede ver que la concentración ideal de esporas para el control de
estos procesos es la de 11.3 x 108 UFC/ml p(0.468), porque fue la última
concentración en la que presentó ausencia total del crecimiento de Bacillus
stearothermophilus ATCC 7953 en un 95% de acuerdo a la prueba para la
proporción realizada en este estudio. Aunque hay carencia de información
acerca de los efectos de la temperatura sobre la resistencia de esporas
según Beaman et al. (1988), al comparar con el estudio de Zmidzinska et al.
(2004) en donde se analizaron los efectos de diferentes concentraciones de
esporas al calor, se encontró que diferentes niveles de inóculos afectan la
resistencia de las esporas, esto puede explicar porque en nuestro estudio a
concentraciones mayores a 11.3 x 108 UFC/ml, hubo un crecimiento gradual
del bacilo. En la publicación también se mostró que las esporas a
concentraciones bajas procesadas a temperaturas de 105ºC y 130ºC
requirieron 65.9 minutos y 23.5 minutos respectivamente para destruir el 90%
de la población. Este porcentaje de destrucción con esporas de inóculos más
altos tratados con las mismas temperaturas no pudo ser calculado aun
después de 80 minutos de procesamiento. Las esporas tratadas a

45
temperaturas altas (145, 160, 175ºC) fueron eliminadas mas rápidamente
para el caso de los inóculos de mayor concentración. Esto se puede
comparar con nuestro estudio en donde se evaluó las mayores
concentraciones de esporas en el autoclave para material sucio el cual
trabaja con un ciclo de mayor temperatura y mayor presión (135ºC 35 Lb de
presión) que el autoclave para material limpio y se encontró una eliminación
total de esporas a estas concentraciones.
Si se comparan los dos procesos de esterilización se puede decir que la
concentración ideal de esporas requirió una menor temperatura y tiempo en
el autoclave que en el horno para eliminar el 95% de esporas, esto puede
deberse a que según lo afirmado por Spicher y Peters (1997) las moléculas
de agua son capaces de desplazar a los puentes de hidrógeno rompiéndose
más fácilmente que con el calor seco, por el contrario, la esterilización con
calor seco necesita recurrir a mayores temperaturas ya que al no existir
moléculas de agua la rotura de puentes de hidrogeno y la desnaturalización
de proteínas así como la fusión de membranas se efectúa a mayores
energías.
De los resultados de los ensayos de desinfección desarrollados con
Hipoclorito de sodio, de manera descriptiva se puede decir que fueron los
esperados por nosotras ya que de acuerdo con el Manual de Limpieza,
Desinfección y Esterilización de la Universidad Autónoma de Barcelona
(2004), éste desinfectante tiene un extenso espectro de actividad
(bactericida, virucida y esporicida) según la concentración de uso. A una
mayor concentración de desinfectante se elimina mayor carga microbiana.
Por último, a partir de los resultados obtenidos en este estudio nosotras
queremos aportar un buen punto de referencia para proyectos posteriores
que continúen con el proceso de validación de este control biológico y así
establecer calidad en los procesos de esterilización.

46
8. CONCLUSIONES
• La concentración ideal de esporas de Bacillus stearothermophilus
ATCC 7953, establecida en este estudio para el control de los
procesos de esterilización como calor seco y calor a vapor fue de 11.3
x 108 UFC/ml.
• Se obtuvo el 87% del cultivo de Bacillus stearothermophilus ATCC
7953 en fase esporulada a los tres días después de recuperada la
cepa.
• Las esporas de Bacilllus stearothermophilus ATCC 7953, son buenas
indicadoras de los procesos de esterilización porque cumplen con las
características de termoresistencia y no patogenicidad para el ser
humano.
• Si se comparan los dos procesos de esterilización se puede decir que
la concentración ideal de esporas requirió una menor temperatura y
tiempo en el autoclave que en el horno para eliminar el 95% de
esporas.
• Se observó que la concentración de hipoclorito de sodio al 2.5% fue
más efectiva que la de 0.52% por eliminar una mayor carga
microbiana.

47
BIBLIOGRAFÍA
1. Asociación Argentina de Técnicos en Esterilización y Comisión Interministerial. 2004. Perfil Profesional y bases para la organización curricular de la carrera técnica superior en esterilización. Ministerio de Educación, Ciencia y Tecnología y Ministerio de Salud. República de Argentina. 57 p.
2. Beaman, T; Stuart, H and Philipp, G. 1988. Heat Shock Affects
Permeability and Resistance of Bacillus stearothermophilus Spores. Applied and Environmental Microbiology. 54 (10): 2515-2520
3. Black, J. 1999. Microbiology Principles and Exploration. Fourth Edition. Jhon Wiley and Son Inc. Pg 43-46
4. Centers for Disease Control and prevention Recommended Infection
Control Practices for Dentistry. 1993. MMWR. 41 (RR-8) 1-12
5. Clavell, L; Pedrique de Aulacio, M. 1992. Microbiología. Manual de Métodos Generales (segunda edición). Facultad de Farmacia. Universidad Central de Venezuela. 62 p.
6. Devore, C. 1995. Involved in Academic Sterilization Monitoring
Services. Ohio State University. College of Dentistry. Ohio Compendium. 15 (12): 3555.
7. Dr. Hugo Nano. Conceptos de Limpieza, Antisepsia y Esterilización [online]<http://www.clinano.com.ar/publicaciones/normas_ap9.htm>[12 Febrero.2006]
8. Escobar de Rico, M. 2002. Fundamentos de Microbiología. Editorial
CEJA. Bogotá, Colombia. Pg 68-73
9. Esterilizacióngeneralidades.[online]<http://www.qb.fcen.microinmuno/seminarioesterilizacion.htm>[ 6 Diciembre.2005]

48
10. Fallis, P. 1998. Biological Testing of your Sterilization Process. Cope National. 5 (1): 332-333
11. Kenneth, T. The Genus Bacillus. In: Important Groups of Procaryotes [online] Todar`s Online Textbook of Bacteriology. 2005. University of Wisconsin-Madison Department of Bacteriology. <http://www.textbookofbacteriology.net> [22 Febrero.2006]
12. Koneman, E;Allen, S; Janda, W; Schreckenberger, P and Winn, W. 1999. Diagnóstico Microbiológico. Quinta Edición. Editorial Médica Panamericana SA. Buenos Aires. Pg 640-645
13. Kralovic Raymond. 2000. Use of Biological Indicators Designed for
Steam or Ethylene Oxide to Monitor a Liquid Chemical Sterilization Process. Infection Control and Hospital Epidemiology. 14 (PT2): 313-15.
14. Madigan, M; Martinko, J; Parker, J and Brock, T. Biología de los
Microorganismos. Octava Edición. Editorial Prentice Hall. Madrid. Pg 626-630.
15. Marti, M y Espadalé, R. 2003. NTP 429 Desinfectantes: Características y usos más corrientes. Ministerio de Trabajo y Asuntos Sociales. Instituto Nacional de Seguridad e Higiene en el trabajo. España. 10 p.
16. Nazina TN, Tourova TP, Poltaraus AB, Novikova EV, Grigoryan AA, Ivanova AE, Lysenko AM, Petrunyaka W, Osipov GA, Belyaev SS, Ivanov MV. 2001. Taxonomic study of aerobic thermophilic bacilli: descriptions of Geobacillus subterraneus gen. nov., sp. Nov. and Geobacillus uzenensis sp. Nov. from petroleum reservoirs and transfer of Bacillus stearothermophilus, Bacillus thermocatenulatus, Bacillus thermoleovorans, Bacillus kaustophilus, Bacillus thermodenitrificans to Geobacillus as the new combinations G. stearothermophilus, G. th. International Journal of Systematic and Evolutionary Microbiology. 51 (PT2): 433-46.
17. Parra, L y Acosta, E. 1999. Análisis de algunos indicadores biológicos disponibles comercialmente en Mexico. ADM. 56 (4): 151-154

49
18. Sandra Riveros C. Historia de los indicadores biológicos
[online]<http://www.enfermeraspabellonyesterilizacion.cl/trabajos/biologicos.pdf> [10 Diciembre.2005]
19. Spicher G, Peters J. 1997. Suitability of Bacillus subtilis and Bacillus stearothermophilus spores as test organism bioindicators for detecting superheating of steam. 199 (PT2): 462-74.
20. Stainer, R and Ingraham, J. 1989. Microbiología. Segunda Edición. Editorial Reverté. España. Pg 125-128
21. Tortora, GJ. 2001. Microbiology an Introduction. Seventh edition. The Benjamin/Cummings Company Inc. Pg 102-108
22. Universidad Autónoma de Barcelona. 2004. Unidad de docencia de la salud del Instituto de Catalá. Manual de Limpieza, Desinfección y Esterilización. Antisépticos y Desinfectantes. 20p.
23. World Health Organization Aids in Africa. 1992. A Manual for physcians. First Edition. 122-125.
24. World Health Organization Aids in India. 2003. Quality Control in Sterilization. Quality Assurance in Bacteriology and Inmunology. 28. 161-162.
25. Zmidzinska D, Cenkowski S and Blank G. 2004. Superheated Steam Treatment of Bacillus stearothermophilus Spores. ASAE. MBO4 - 208-218

50
RECOMENDACIONES
Como en este trabajo se estandarizó la concentración de esporas nosotras
recomendamos continuar el estudio con un proceso de validación frente a un
indicador biológico comercial. De igual manera se recomendamos el uso de
tratamientos con lisozimas, centrifugación y lavados con buffer salino con el
fin de optimizar el proceso de recuperación de esporas.
Es importante que se continúe con la realización de pruebas suficientes que
confirmen estadísticamente la eficiencia del proceso de desinfección con
hipoclorito de sodio frente a la concentración determinada en este estudio

DETERMINACIÓN DE LA CONCENTRACIÓN IDEAL DE ESPORAS DE Bacillus stearothermophilus
COMO INDICADOR BIOLÓGICO PARA EL CONTROL DE LOS PROCESOS DE
ESTERILIZACIÓN
ANGELA MARÍA ZARAMA ORTÍZLILIANA ELISA ROSERO TORRES
DRA. ALBA ALICIA TRESPALACIOS RANGELDirectora

Determinar el tiempo requerido para la producción del 80% de Determinar el tiempo requerido para la producción del 80% de esporas de esporas de Bacillus stearothermophilus.Bacillus stearothermophilus.
Estandarizar la concentración adecuada de esporas de Estandarizar la concentración adecuada de esporas de Bacillus Bacillus stearothermophilusstearothermophilus para evaluar los procesos de esterilización a para evaluar los procesos de esterilización a vapor, calor seco y desinfección con hipoclorito de sodio.vapor, calor seco y desinfección con hipoclorito de sodio.
Determinar la concentración ideal de esporas de Bacillus stearothermophilus como indicador biológico para el control de procesos de esterilización.

Frecuente contaminación de medios de cultivo y áreas Frecuente contaminación de medios de cultivo y áreas de trabajo con microorganismos ambientales.de trabajo con microorganismos ambientales.
Asegurar la completa eliminación de todas las formas Asegurar la completa eliminación de todas las formas de vida microbiana.de vida microbiana.

El indicador biológico desarrollado permitirá a la El indicador biológico desarrollado permitirá a la dependencia de monitoría controlar de manera más dependencia de monitoría controlar de manera más efectiva los procesos de esterilización.efectiva los procesos de esterilización.
Dado los altos costos de los indicadores biológicos Dado los altos costos de los indicadores biológicos comerciales, el indicador desarrollado permitirá evaluar comerciales, el indicador desarrollado permitirá evaluar el sistema de esterilización pero a un bajo costo.el sistema de esterilización pero a un bajo costo.

Mecanismo para la destrucción de microorganismos Mecanismo para la destrucción de microorganismos mediante agentes de naturaleza química mediante agentes de naturaleza química (desinfectantes).(desinfectantes).
El hipoclorito de sodio actúa sobre todas las bacterias El hipoclorito de sodio actúa sobre todas las bacterias incluyendo el bacilo tuberculoso, virus, hongos y incluyendo el bacilo tuberculoso, virus, hongos y esporas.esporas.

Completa destrucción de todas las formas de vida Completa destrucción de todas las formas de vida microbiana, contenidas en un objeto o sustancia.microbiana, contenidas en un objeto o sustancia.
Entre los procesos más empleados están el calor a vapor y Entre los procesos más empleados están el calor a vapor y calor secocalor seco

CONTROL MECÁNICO CONTROL QUIMICO
CONTROL BIOLOGICO

Bacilo Gram positivoBacilo Gram positivo Formador de esporas Formador de esporas TermorresistenteTermorresistente Habita en lugares donde existe formación de agua y Habita en lugares donde existe formación de agua y
yacimientos petrolerosyacimientos petroleros Carece de patogenicidad, pirogenicidad y toxicidadCarece de patogenicidad, pirogenicidad y toxicidad Empleado para monitorear los procesos de esterilizaciónEmpleado para monitorear los procesos de esterilización

Reconstituir 48 h-65 C Repique a agar BHI
Coloración de Gram
Catalasa
RECUPERACIÓN DE LA CEPA
COLORACIÓN DE GRAM E IDENTIFICACIÓN BIOQUIMICA

SIM TSI Fen Urea RM VP Glu Lac Sac Mal
PRODUCCIÓN DE ESPORAS
Coloración de Wayson
Repique a 15 cajas agar BHI

PREPARACIÓN PATRÓN DE MAC FARLAND
FABRICACIÓN DEL INDICADOR BIOLÓGICO
0.5 cm x 3 cm
37ºC0.5-10
0.5 1 2 3 4 5 6 7 8 9 10

CONTROLES DE VIABILIDAD
1 µl
10-1 10-2 10-3 10-4 10-5 10-6
65ºC por 48 h 30-300 colonias
Stock

ENSAYOS EN AUTOCLAVE
Ciclo material limpio20 Lb 121ºC 20 min
Ciclo material sucio35 Lb 135ºC 15 min
65ºC por 48 h BHI

ENSAYOS EN HORNO
220ºC por 2 horas
65ºC por 48 h BHI

ENSAYOS CON HIPOCLORITO DE SODIO
0.52% 1 min
2.5% 1 min
BHI 65ºC por 48 h

ANÁLISIS ESTADÍSTICO
La proporción de pruebas de esterilidad con ausencia total de crecimiento de Bacillus stearothermophilus ATCC 7953 es del 95%.
Hipótesis nula (Ho): P=0.95Hipótesis alterna (Hi): P≠0.95
Si p<0.05 se rechaza la hipótesis nula.Si p>0.05 no se rechaza la hipótesis nula.

Recuperación de la cepa Bacillus stearothermophilus ATCC 7953
Coloración de Gram

Mot: pos A/A Negativa Positiva Positivo Negativo Positiva Positiva Positiva PositivaIndol: neg H2S: negH2S: neg Gas: neg
SIM TSI Fenilalalnina Urea RM VP Glucosa Lactosa Sacarosa Maltosa
Identificación Bioquímica

Producción de esporas
020406080
100
PORCENTAJE
1 2 3
DIAS
PRODUCCIÓN DE ESPORAS
Esporas

Patrón de Mac Farland
1.160
30 x 108
1.0
10
0.960
27 x 108
0.9
9
0.868
24 x 108
0.8
8
0.778
21 x 108
0.7
7
0.683
18 x 108
0.6
6
0.556
15 x 108
0.5
5
0.469
12 x 108
0.4
4
0.383
9 x 108
0.3
3
0.245
6 x 108
0.2
2
0.170
3 x 108
0.1
1
0.052
1.5 x 108
0.05
0.5
ABSORBANCIAOBTENIDA
CONCENTRACIÓNPATRÓN cel/ml
ABSORBANCIAPATRÓN
No PATRÓN DE Mac Farland

Indicador Biológico

Verificación del número de esporas presentes en las tiras del papel filtro
Patrón 5
13.6 x 108 - 16.5 x 108
14.3 x 108
150 x 106
10
Patrón 4
10.6 x 108 - 13.5 x 108
12.9 x 108
135 x 106
9
Patrón 4
10.6 x 108 - 13.5 x 108
11.3 x 108
120 x 106
8
Patrón 3
7.6 x 108 - 10.5 x 108
8.8 x 108
105 x 106
7
Patrón 3
7.6 x 108 - 10.5 x 108
8.0 x 108
90 x 106
6
Patrón 2
4.6 x 108 - 7.5 x 108
6.5 x 108
75 x 106
5
Patrón 2
4.6 x 108 - 7.5 x 108
5.3 x 108
60 x 106
4
Patrón 1
2.26 x 108 - 4.5 x 108
4.0 x 108
45 x 106
3
Patrón 1
2.26 x 108 - 4.5 x 108
2.6 x 108
30 x 106
2
Patrón 0.5
0.75 x 108 - 2.25 x 108
1.2 x 108
15 x 106
1
Aprox. 0.5
0.75 x 108 - 2.25 x 108
0.6 x 108
7.5 x 106
0.5
EQUIVALENCIA AL PATRÓN Mac
Farland
RANGO DECONCENTRACIÓN
PATRÓN
UFC/ml RECUPERADAS
No ESPORAS POR
TIRA
No PATRÓN

Controles de Viabilidad

Ensayos con el Indicador Biológico en el Autoclave
40 050 300 00 00 0 14.3 x 108
0 010 00 00 00 0 12.9 x 108
0 00 00 00 00 0 11.3 x 108
0 00 00 00 00 0 8.8 x 108
0 00 00 00 00 0
8.0 x 108
0 00 00 00 00 0 6.5 x 108
0 00 00 00 00 0 5.3 x 108
0 00 00 00 00 0 4.0 x 108
0 00 00 00 00 0 2.6 x 108
0 00 00 00 00 0 1.2 x 108
0 00 00 00 00 0 0.6 x 108
Inf. IzqInf. DerCentroSup. IzqSup. DerCel/ml
AUTOCLAVE UFC/ml (15 min, 20 Lb, 121ºC) Concentración

Ensayos con el Indicador Biológico en el Autoclave (15 min, 35 Lb a 135ºC)
0 00 00 00 00 0 14.3 x 108
0 00 00 00 00 0 12.9 x 108
Inf. IzqInf. DerCentroSup. IzqSup. DerCel/ml
AUTOCLAVE UFC/ml (15 min, 35 Lb, 135ºC)Concentración

AUTOCLAVE

Ensayos con el Indicador Biológico en Horno
40 060 20 20 00 00 014.3 x 108
0 020 0 30 00 00 0 12.9 x 108
0 00 00 00 00 0 11.3 x 108
0 00 00 00 00 0
8.8 x 108
0 00 00 00 00 0
8.0 x 108
0 00 00 00 00 0
6.5 x 108
0 00 00 00 00 0 5.3 x 108
0 00 00 00 00 0 4.0 x 108
0 00 00 00 00 0 2.6 x 108
0 00 00 00 00 0 1.2 x 108
0 00 00 00 00 0
0.6 x 108
Inf. IzqInf. DerCentroSup. IzqSup. DerUFC/ml
HORNO UFC/mlConcentración

HORNO

Ensayos con el Indicador Biológico con Hipoclorito de Sodio
0 0 0 050 0 30 20 14.3 x 108
0 0 0 020 10 30 0 12.9 x 108
0 0 0 00 0 0 0 11.3 x 108
0 0 0 00 0 0 0
8.8 x 108
0 0 0 00 0 0 0
8.0 x 108
0 0 0 00 0 0 0
6.5 x 108
0 0 0 00 0 0 0 5.3 x 108
0 0 0 00 0 0 0 4.0 x 108
0 0 0 00 0 0 0 2.6 x 108
0 0 0 00 0 0 0 1.2 x 108
0 0 0 00 0 0 0 0.6 x 108
Hipoclorito 2.5 % UFC/ml
Hipoclorito 0.52% UFC/ml
ConcentraciónUFC/ml

HIPOCLORITO DE SODIO

0.00376100.0002710
14.3 x 108
0.4688100.029910 12.9 x 108
0.46810100.4681010 11.3 x 108
0.46810100.4681010
8.8 x 108
0.46810100.4681010
8.0 x 108
0.46810100.4681010 6.5 x 108
0.46810100.4681010
5.3 x 108
0.46810100.4681010 4.0 x 108
0.46810100.4681010 2.6 x 108
0.46810100.4681010 1.2 x 108
0.46810100.4681010 0.6 x 108
Valor de pSin
CrecimientoNo
RepeticionesValor de pSin
CrecimientoNo
RepeticionesUFC/ml
AUTOCLAVE UFC/ml (15 min, 20 Lb, 121ºC)HORNO UFC/mlConcentración

Bacillus stearothermophilus Bacillus stearothermophilus es considerado un indicador es considerado un indicador
biológico ideal para el monitoreo de los procesos de biológico ideal para el monitoreo de los procesos de esterilización.esterilización. World Health Organization (2003), Fallis World Health Organization (2003), Fallis (1998), Parra et al. (1999). (1998), Parra et al. (1999).
Se obtuvo el 87% del cultivo en fase esporulada a los tres Se obtuvo el 87% del cultivo en fase esporulada a los tres días. Otrosdías. Otros cultivos duraban alrededor de siete días en cultivos duraban alrededor de siete días en producir un porcentaje mayor al 80%. Zmidzinska et al. producir un porcentaje mayor al 80%. Zmidzinska et al. (2004) y Kralovic (2000). (2004) y Kralovic (2000).
En los controles de viabilidad hubo una recuperación del 50% En los controles de viabilidad hubo una recuperación del 50% de esporas presentes en la tira de papel filtro ya que node esporas presentes en la tira de papel filtro ya que no se se empleó un tratamiento con lisozimas, centrifugación y empleó un tratamiento con lisozimas, centrifugación y lavados repetidos. Zmidzinska et al. (2004).lavados repetidos. Zmidzinska et al. (2004).

La concentración ideal de esporas para el control de la La concentración ideal de esporas para el control de la esterilización a vapor y calor seco es de 11.3x10esterilización a vapor y calor seco es de 11.3x1088 UFC/ml. UFC/ml. DDiferentes niveles de inóculos afectan la resistencia de las iferentes niveles de inóculos afectan la resistencia de las esporas. Zmidzinska et al. (2004).esporas. Zmidzinska et al. (2004).
La concentración ideal de esporas requirió una menor La concentración ideal de esporas requirió una menor
temperatura y tiempo en el autoclave que en el horno para temperatura y tiempo en el autoclave que en el horno para eliminar un 95% de esporas. Leliminar un 95% de esporas. Las moléculas de agua son as moléculas de agua son capaces de desplazar a los puentes de hidrógeno rompiéndose capaces de desplazar a los puentes de hidrógeno rompiéndose más fácilmente que con el calor seco. Spicher y Peters más fácilmente que con el calor seco. Spicher y Peters (1997). (1997).
El desinfectante tiene un extenso espectro de actividad El desinfectante tiene un extenso espectro de actividad (bactericida, virucida, esporicida) según la concentración de (bactericida, virucida, esporicida) según la concentración de uso. uso. Manual de Limpieza, Desinfección y Esterilización de la Universidad Autónoma de Barcelona (2004).

La concentración ideal de esporas de La concentración ideal de esporas de B. stearothermophilusB. stearothermophilusATCC 7953 establecida en este estudio para el control de ATCC 7953 establecida en este estudio para el control de los procesos de esterilización como calor seco y calor a vapor los procesos de esterilización como calor seco y calor a vapor fue de 11.3x10fue de 11.3x1088 UFC/ml. UFC/ml.
Se obtuvo el 87% del cultivo de Se obtuvo el 87% del cultivo de B. stearothermophilusB. stearothermophilus en en fase esporulada a los tres días después de recuperada la fase esporulada a los tres días después de recuperada la cepa.cepa.
Las esporas de Las esporas de B. stearothermophilusB. stearothermophilus son buenas indicadoras son buenas indicadoras de los procesos de esterilización porque cumplen con las de los procesos de esterilización porque cumplen con las características de termoresistencia y no patogenicidad para características de termoresistencia y no patogenicidad para el ser humano.el ser humano.

La concentración ideal de esporas requirió una menor La concentración ideal de esporas requirió una menor temperatura y tiempo en el autoclave que en el horno para temperatura y tiempo en el autoclave que en el horno para eliminar el 95% de esporas.eliminar el 95% de esporas.
Se observó que la concentración de Hipoclorito de sodio al Se observó que la concentración de Hipoclorito de sodio al 2.5% fue más efectiva que la de 0.52% por eliminar una 2.5% fue más efectiva que la de 0.52% por eliminar una mayor carga microbiana.mayor carga microbiana.

Se recomienda continuar el estudio para un proceso de Se recomienda continuar el estudio para un proceso de validación frente a un indicador biológico comercial.validación frente a un indicador biológico comercial.
Se recomienda el uso de tratamiento con lisozimas, Se recomienda el uso de tratamiento con lisozimas, centrifugación y lavados con buffer salino con el fin de centrifugación y lavados con buffer salino con el fin de optimizar el proceso de recuperación de esporas.optimizar el proceso de recuperación de esporas.
Es importante continuar con la realización de pruebas Es importante continuar con la realización de pruebas suficientes que confirmen estadísticamente la eficiencia del suficientes que confirmen estadísticamente la eficiencia del proceso de desinfección con Hipoclorito de sodio frente a la proceso de desinfección con Hipoclorito de sodio frente a la concentración determinada en este estudio.concentración determinada en este estudio.
Es necesario aumentar la concentración de Hipoclorito de Es necesario aumentar la concentración de Hipoclorito de sodio cuando hayan accidentes de trabajo en el laboratorio.sodio cuando hayan accidentes de trabajo en el laboratorio.

Un agradecimiento especial a la Dra Alba Alicia Trespalacios, Dra Marcela Mercado, Dra Ofelia
Díez y a la Dependencia de Monitoría de la Facultad de Ciencias de la Pontificia Universidad
Javeriana.